Časná integrace paliativní péče v onkologii
Early integration of palliative care in oncology
Palliative care has evolved in the last half a century from a philosophy of care aiming at care of dying patients to specific/standalone medical specialization caring of patients with incurable diseases. Patients with advanced cancer suffer from physical and psychical symptoms, existential and social distress and have limited prognosis. Today we have strong clinical data about feasibility and usefulness of early integration of palliative care in oncology in terms of better quality of life, symptom control and survival. The question is not if, but when, whom and how is the best way to integrate palliative care into modern oncology. This article reviews data from clinical trials, presents models of cooperation for early integration and raises questions remained to be solved in a future.
Keywords:
oncology, palliative care, early palliative care, symptoms, quality of life
Authors:
Marek Sochor
Authors‘ workplace:
Komplexní onkologické centrum, Krajská nemocnice Liberec, a. s.
Published in:
Čas. Lék. čes. 2018; 157: 13-18
Category:
Review Article
Overview
Paliativní péče se v posledním půlstoletí posunula od filozofie péče o umírající k samostatnému oboru, který pečuje o pacienty s nevyléčitelnými chorobami. Pacienti s pokročilými nádory trpí řadou fyzických a psychických symptomů, existenciálním a sociálním distresem a mají omezenou prognózu. V současnosti existují přesvědčivá klinická data o aplikovatelnosti a užitečnosti časné integrace paliativní péče v onkologii zlepšením kvality života, kontrolou symptomů a přežitím. Dnes není otázkou zda, ale kdy, kým a jak nejlépe integrovat paliativní péči do moderní onkologie. Následující přehledový článek uvádí klinická data ze studií, modely spolupráce pro časnou integraci a otázky, které musíme vyřešit v budoucnosti.
Klíčová slova:
onkologie, paliativní péče, časná paliativní péče, symptomy, kvalita života
ÚVOD
Nádorová onemocnění představují spolu s kardiovaskulárními nejčastější příčiny nemocnosti a úmrtnosti u dospělých pacientů. Pacienti s pokročilými nádorovými chorobami trpí řadou obtěžujících fyzických a psychických symptomů, mají významné sociální a existenciální komplikace s přímým dopadem na celkovou kvalitu života, léčbu a přežití (1). Tyto problémy se přenášejí i na rodiny a blízké pacientů.
Paliativní péče (PC – palliative care) je definována jako „přístup ke zlepšení kvality života pacientů a jejich rodin čelících problémům spojeným s život ohrožujícími chorobami cestou prevence a úlevy od utrpení pomocí časné identifikace a precizního zhodnocení léčby bolesti a dalších symptomů – fyzických, psychosociálních a spirituálních“ (2). Pro lepší porozumění je vhodné definovat i péči podpůrnou. Jedná se o „poskytování nezbytné péče pacientům s nádory k naplnění jejich informačních, emočních, spirituálních, sociálních a fyzických potřeb během diagnostiky, léčby a sledování, zahrnující podporu zdraví, prevenci, péči o přežívající, paliativní péči a péči o truchlící“. Z této definice vyplývá, že paliativní péče v onkologii je podskupina podpůrné péče u pacientů s pokročilými nádory (3). Paliativní péče tvoří nezbytnou součást onkologie a její co nejčasnější zařazení do celkové péče je velmi doporučované (4). Za posledních 10–15 let byla nashromážděna přesvědčivá data, která prokázala zlepšení kvality života, kontroly symptomů, snížení zátěže pečujících a prodloužení celkového přežití při aplikaci časné paliativní péče (EPC – early palliative care) v onkologii (4–6).
Pacienti s nádorovými chorobami mohou profitovat z časné paliativní péče bez ohledu na prognózu a pokročilost stavu (7). Paliativní péče byla v onkologii poskytována v minulých desetiletích zpravidla v poslední fázi onemocnění po ukončení protinádorové léčby. Byla vnímána jako péče na konci života, podobně jako péče hospicová. Tím pádem neměla řada pacientů přístup k dobře vedené paliativní péči, případně u nich byla zahájena pozdě, bez možnosti mít z ní prospěch. Diskuse o cílech léčby, pacientových preferencích, plánování pokročilé péče a péče na konci života tak byla vedena pozdě nebo vůbec. Důsledkem je častá aplikace chemoterapie v posledních 30 dnech života, velká část onkologických pacientů umírá v nemocnicích, včetně jednotek intenzivní péče, jejich léčba není vedena podle preferencí a představ pacientů a nízká a pozdní je reference do hospicové péče.
Pro moderní onkologii dnes není otázkou, zda do svého kontinua paliativní péči zařadit, ale kdy a kým má být vedena, jaké pacienty referovat, jaké komponenty přinášejí maximální benefit, kde ji realizovat a jaké modely spolupráce paliativních specialistů a onkologů jsou pro pacienta optimální (8–10).
KLINICKÁ DATA PODPORUJÍCÍ EPC
V posledních letech byla provedena řada randomizovaných studií, které podporují časnou aplikaci paliativní péče spolu s onkologickou léčbou v domácím prostředí, za hospitalizace i v ambulantním provozu (11–18).
Studie vedené u hospitalizovaných pacientů vedly zpravidla ke zkrácení a zlevnění hospitalizace, nemocní měli častěji vedené rozhovory o péči na konci života a plánování pokročilé péče, nelišila se celková kvalita života a doba přežití. To vyvolává otázku, zda paliativní péče zahájená u takto pokročilých pacientů má potenciál zlepšit symptomy (19).
Význam domácího multidisciplinárního paliativního týmu na celkovou spokojenost a kontrolu symptomů zkoumali Brumley et al. (20). Do studie zařadili celkem 298 pacientů s předpokládanou prognózou života kratší než 1 rok a recentní hospitalizací nebo vyšetřením na pohotovosti. Pacienti vedení paliativním týmem vykazovali méně hospitalizací, návštěv pohotovostí, častěji umírali doma a byli celkově více spokojeni s péčí. Pozitivní výsledek vedl k zařazení komplexní a specializované domácí paliativní péče do běžné praxe (21, 22).
Ambulance paliativní péče představují spojovací článek mezi nemocnicemi akutní péče a domácí specializovanou paliativní péčí. Jejich roli zkoumaly projekty ENABLE (11, 17). Projekt ENABLE II zahrnoval vstupní edukaci pacientů, měsíční návštěvy v paliativní ambulanci a strukturované telefonické rozhovory vedené sestrami specialistkami paliativní péče. U intervenční skupiny byla významně lepší kvalita života, méně depresivity a symptomové zátěže a delší přežití (14 vs. 8,5 měsíce) (11). Projekt ENABLE III zkoumal optimální načasování paliativní péče po stanovení onkologické diagnózy a jeho výsledky silně podpořily co nejvčasnější zahájení. Jedna skupina pacientů byla do PC zařazena ihned, druhá 3 měsíce od diagnózy. Včasná skupina měla medián přežití 18,3 a pozdní 11,8 měsíce (p = 0,003) (17).
Nejvíce citovanou je studie Temelové et al. (18) vedená u pacientů s nemalobuněčným karcinomem plic. Autoři randomizovali pacienty s metastatickým nemalobuněčným karcinomem k běžné péči a běžné péči s časnou specializovanou PC. Do studie bylo zařazeno 151 pacientů. Po 12 týdnech měli nemocní s EPC signifikantně lepší kvalitu života (p = 0,03), byli méně depresivní a měli lepší náladu (p = 0,01). Pacienti v EPC skupině lépe porozuměli prognóze a méně často volili chemoterapii na konci života (9 vs. 50 %, p = 0,02), což může být faktor odpovědný za delší přežití. I přes menší agresivitu péče (p = 0,05) bylo přežití v intervenční skupině delší (11,6 vs. 8,9 měsíce, p = 0,02). Tato studie prokázala významný přínos EPC, kdy i přes nižší agresivitu léčby měli pacienti delší přežití při zachování vyšší kvality života a lepší nálady.
Předchozí data ukazují na to, že kvalita života a depresivita jsou nezávislé prediktory přežití u pacientů s NSCLC (23). Zajímavé bylo porovnání záznamů paliativních specialistů a onkologů s důrazem na coping a kvalitu života. Z nich vyplynula potřeba dalšího prohlubování paliativních dovedností onkologů pro správné vedení paliativní péče (24).
Zajímavá studie byla vedena v Kanadě Zimmermannovou et al. se zařazením paliativních intervencí u onkologických pacientů hospitalizovaných, ambulantních a v domácím prostředí (14). Po 3 měsících byla u intervenční skupiny významně lepší kvalita života a spokojenost s péčí, po 4 měsících přibyla významně lepší kontrola symptomů.
Bohatá klinická data jednoznačně podporují integraci paliativní péče do onkologické léčby pacientů s pokročilými nádory. Panuje shoda, že by to mělo být co nejdříve, optimální doba načasování je zpravidla do 8 týdnů od zjištění diagnózy, ale liší se podle symptomové zátěže jednotlivých pacientů. V budoucnosti je třeba definovat komponenty paliativní péče přinášející prospěch u konkrétních skupin pacientů. Ze studií je patrné, že nejlépe vycházel týmový multidisciplinární přístup. Dalším podstatným krokem je nastavení spolupráce mezi onkology a paliatry, jejich komunikace, zodpovědnost za pacienty, vedení péče a léčby. V neposlední řadě je otázkou dostupnost specializované PC. Studie prokázaly, že i v onkologických centrech s kvalitně integrovanou PC pouze přibližně 50 % pacientů obdrží specializovanou PC během své léčby (25). Další studie prokázaly limitovanou dostupnost a pozdní referenci k paliativní péči (26). Bariéry jsou na straně onkologů, paliatrů, pacientů a v celkové systémové organizaci a k jejich překonání bylo navrženo několik druhů modelů spolupráce, které se dají aplikovat na různých úrovních péče.
MODELY SPOLUPRÁCE
Na modely paliativní péče v onkologii můžeme nahlížet z hlediska konceptuálního a klinického. Konceptuální modely lze dělit podle časové osy, úrovně PC, spolupráce mezi jednotlivými odbornostmi a systémové organizace.
Model načasování paliativní péče v onkologii se v posledních letech významně změnil. Původní zahájení PC po ukončení protinádorové léčby ustoupilo modelu s postupným prolínáním obou specializací. S tím, jak se snižují možnosti protinádorové léčby, roste význam PC. V komplexním modelu je zahrnuta i hospicová péče a péče o pozůstalé (obr. 1) (27).

Dělení podle úrovně rozlišuje PC primární, sekundární a terciární (28). Primární je realizována základními odbornostmi, u kterých se klade důraz na zvládnutí základních fyzických a psychických symptomů. Onkologové hrají zásadní roli v kontrole symptomů v časných fázích léčby nádorového onemocnění. Je však nerealistické očekávat plné zohlednění pacientových obtíží s progresí onemocnění a symptomů z důvodů časových, dostupnosti psychosociální podpory, zkušeností a zájmu o PC. Navíc podle studií pacienti preferují, aby jejich onkolog byl více optimistický, věnoval se léčbě nádoru a fyzickým obtížím a méně řešil psychické a existenciální otázky, včetně péče na konci života (29, 30). Sekundární PC je realizována specialisty paliativní péče a je určena pacientům s potřebou komplexní multidisciplinární PC. Specialisté PC v tomto modelu fungují jako konzultanti, a to jak v případě lůžkové, tak ambulantní péče. Terciární PC je pak nejčastěji realizována ve formě paliativních jednotek pro pacienty s vysokou mírou symptomové zátěže a komplexním utrpením (31). Hierarchie úrovně PC vznáší otázky, které se týkají toho, jak široce má být primární PC realizována onkologem, jaká by měla být dostupnost sekundární a terciární PC a jak ji zajistit.
Model dělení podle spolupráce jednotlivých specializací zohledňuje většinu paliativních a podpůrných situací v každodenní onkologické praxi (9). V tomto modelu lze definovat několik podskupin podle řešení pacientových obtíží.
- V sólo modelu je onkolog zodpovědný za onkologickou i paliativní problematiku. V začátcích se jedná o ideální přístup, protože pro pacienta nezvyšuje nároky na kontroly jinými specialisty. S přibývajícími obtížemi nemusejí být komplexní obtíže pacienta zohledněny z důvodu času, znalostí a zkušeností a je nutná komplexní PP, která je optimálně realizována multidisciplinárním specializovaným týmem.
- V kongresovém modelu (congress approach) funguje onkolog jako „dispečer“, odesílá pacienta k jednotlivým specialistům podle jeho obtíží. Tento model klade na pacienta velké nároky, omezuje jeho volný čas a může často vést k jeho zmatení z důvodu různých a někdy si navzájem odporujících doporučení. Tento model obecně pro onkologické pacienty není vhodný a doporučovaný.
- Jako optimální se jeví integrovaný model, kdy onkolog odesílá pacienta do specializované PC časně po zjištění pokročilého nádoru. Onkolog tak kromě vedení protinádorové léčby řeší základní podpůrné a paliativní problémy a má jistotu okamžité spolupráce specialisty PC. Tím pádem se nároky na onkologa nezvyšují a zároveň je tento postup šetrnější pro pacienta, který nemusí být referován dalším specialistům.
Z hlediska systémového řešení jsou dva možné modely (32). Ten první je v současnosti převládající a je závislý na osobě onkologa, který dle své edukace, zaměření a zkušeností rozhoduje o tom, jaký bude další postup. Může být postupováno v sólo, kongresovém i integrovaném modelu, s jejich výhodami a nevýhodami. Druhý model využívá předem definovaná kritéria pro reference do PC, bez ovlivnění osobou lékaře. Bylo publikováno několik různých kritérií pro včasné zahájení PC (33, 34). Modely systémového řešení jsou komplementární k modelu spolupráce specializací, zvýrazňují komplexní zhodnocení a paliativní péči vedenou paliativním týmem a ukazují na to, jak standardizace procesu integrace PC do onkologie zlepšuje její dostupnost.
Výše uvedené konceptuální modely slouží k nastavení komunikace a spolupráce mezi onkology a paliatry z hlediska načasování a role jednotlivých specialistů a rozvoje skutečné integrace PC v onkologii (35). Klinická aplikace zohledňuje jejich principy a může být realizována v ambulantním provozu nebo za hospitalizace. V každém prostředí lze nalézt výhody, nevýhody, bariéry, ale také odlišné klinické výsledky integrace.
Jak již bylo řečeno, paliativní péče se postupně vyvinula z predominantně hospicové péče realizované na konci života přes konzultace a symptomové ovlivnění vysoce nemocných hospitalizovaných pacientů až po v současnosti samostatný obor realizovaný převážně ambulantně v časných fázích nevyléčitelných chorob. Vznik paliativních ambulancí (samostatných nebo navázaných na lůžková zařízení) umožňuje dosáhnout více pacientům v časnějších fázích nemoci na komplexní PC. Onkologie je v současnosti obor, který se o většinu pacientů stará ambulantně, propojení s ambulantní PC je tak zcela logické.
Uvedené klinické studie prokázaly realizovatelnost a významný prospěch ve zlepšení symptomové kontroly, snížení depresivity, zlepšení nálady, kvality života a spokojenosti s léčbou nejenom pro pacienty, ale i rodinné příslušníky. Spolu s tím se významně zlepšila informovanost o prognóze, komunikace o cílech léčby, péče na konci života, snížily se zbytné hospitalizace na akutních lůžkách včetně JIP a návštěv pohotovostí (36). Rozvoj ambulantní PC je dán změnou vnímání paliativní péče, výhodami při jejím včasném zařazení a je patrný ve všech zemích s propracovanou PC (37).
Paliativní péče za hospitalizace je dalším klinickým modelem aplikace PC. Její hlavní výhodou je možnost užší spolupráce, komunikace a koordinace péče mezi onkology a členy paliativního týmu. Dále přináší možnosti pravidelných setkání nad jednotlivými pacienty, časnější přístup k PC a ušetření času onkologa v řešení podpůrné a paliativní problematiky. Mezi hlavní výzvy patří prostorové řešení a možnost umístit členy paliativního týmu do stávajících prostor. Dále, i přes blízkost paliativního týmu, může být pacient na další konzultaci unaven, případně se mu to nehodí z časových důvodů. Mezi nejdůležitější úkoly v tomto modelu se jeví hledání a nastavení optimálního způsobu spolupráce, komunikace, předávání a vedení pacientů.
Pro specialisty paliativní péče a onkology může být zajímavé a přínosné vzdělání i ve druhém oboru, hovoříme tak o paliativní onkologii. Znalost obou specializací, jejich specifik, uvažování a možností je velkou výhodou při rozvíjení integrované paliativní péče v onkologii. Začlenění paliativního onkologa do každého komplexního onkologického centra může podpořit komunikaci, spolupráci a určitou vzájemnou „nakaženost“ obory na cestě k prohloubení a koordinaci správné a komplexní paliativní péče v onkologii (38).
Kombinované paliativně-onkologické multidisciplinární týmy přinášejí další příležitost k integraci PC v onkologii. Jejich role by měla být v komplexním zhodnocení pacienta z hlediska diagnózy, stadia nemoci, potenciálních léčebných možností, ale též předpokládané prognózy, funkčního stavu, symptomové zátěže a jeho preferencí. Takto koncipované multidiscplinární týmy přinášejí možnost lepší komunikace o pacientech, rozšiřují diskusi o adekvátní péči, spouštějí včasnou paliativní péči, podporují pacientův rozhodovací proces a obecně otevírají možnosti pro rozšíření pacientského managementu (39).
BARIÉRY A VÝZVY V INTEGRACI PALIATIVNÍ PÉČE DO ONKOLOGIE A CESTY JEJICH PŘEKONÁNÍ
Všechny výše uvedené studie prokázaly realizovatelnost a benefit současné aplikace časné paliativní péče spolu s onkologickou léčbou u pacientů hospitalizovaných, ambulantních a v domácím prostředí. Dále prokázaly, že benefit je tím větší, čím dříve jsou intervence zahájené a pokud jsou realizované multidisciplinárně. Ve studiích nedošlo u skupiny s EPC ke zhoršení jakéhokoliv parametru. Pro úspěšné zařazení efektivní EPC do klinické praxe je nutné pojmenovat a překonat některé bariéry a omezení, jež s sebou tento zcela nepochybně prospěšný koncept přináší (tab. 1) (40).

Z hlediska onkologů je hlavní bariérou vnímání paliativní péče jako přístupu, který je realizován až po ukončení onkologické léčby, a dále znalost skutečných možností multidisciplinární PC (41). Tyto překážky lze překonat dobře vedeným pre - i postgraduálním vzděláváním s důrazem na možnosti paliativní péče (42). Další možnou bariérou může být obava z významného navýšení doby nutné ke zvládnutí všech povinností. Tento fakt je důležitý, současná onkologie klade vysoké nároky na znalosti protinádorové léčby, podpůrné terapie a managementu nežádoucích účinků.
Při dobře vedeném a strukturovaném rozhovoru s pacientem lze kvalitně a efektivně vyřešit většinu stesků v relativně krátkém čase. Vhodné je následné sledování v odstupu několika dnů až jednotek týdnů ve formě krátké telefonické konzultace, vedené případně i sestrou-specialistkou paliativní péče. Předpokladem je dobrá úroveň znalosti základního ovlivnění hlavních symptomů pokročilých nádorů, zde je to opět otázka vzdělání a praxe (43–45).
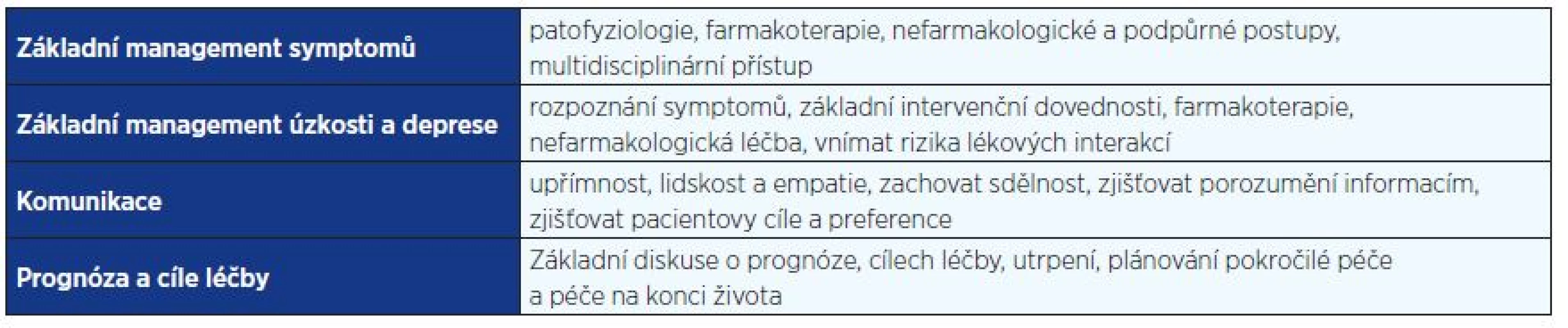
Obecná paliativní péče má své limity, po jejichž dosažení je nutné zařadit do spolupráce specializovanou multidisciplinární PC. Základní paliativní dovednosti, které by měl ovládat každý onkolog, jsou uvedeny v tab. 2.
Hlavním nástrojem lékaře pro zvládnutí všech pacientových obtíží v každodenní praxi je efektivní komunikace, v onkologii pokročilých nádorů zvlášť (46). Onkologové se v komunikaci zaměřují primárně na protinádorové léčebné možnosti a jejich nežádoucí účinky. Méně je s pacientem řešena předpokládaná prognóza a možnosti paliativní péče, resp. cíle péče a léčby. Přitom u pacientů s prognózou v jednotkách měsíců u nádorů obtížně léčebně ovlivnitelných (karcinom pankreatu, žaludku, žlučových cest, plic) je přínos chemoterapie nízký nebo vůbec žádný při vysokém riziku komplikací.
Dobrá znalost reálné prognózy a ovlivnitelnosti choroby může pacientovi změnit jeho preference (47). Komunikace o prognóze, cílech léčby, možnostech terapie a paliativní péče není jednorázový krok, jedná se o proces, který je s pacientem veden po celou dobu léčby. Na jeho začátku musí být hlavní informace řečené v jasné a srozumitelné podobě, poskytneme tak pacientovi a jeho rodině delší čas na vyrovnání se s nastalou životní situací a předejdeme těžkým zklamáním s utrpení v dalším průběhu. Existuje řada důkazů o tom, že komunikace o prognóze u pacientů nezhoršuje naději a adherenci k léčbě (48, 49).
Významná bariéra na straně specializované paliativní péče je v nedostatku specialistů. Vzrůstající potřeba a konzultace specializované PC tento nedostatek dále zvyšuje. Již několik let je paliativní medicína v ČR samostatný nástavbový atestační obor, který každým rokem produkuje několik specialistů. Jejich místa působení jsou rozličná: primární péče, nemocnice, ambulantní péče, hospice. Budoucnost je v pokračování oboru paliativní medicíny jakožto samostatného nástavbového oboru.
Nezanedbatelným faktorem pro realizaci včasné paliativní péče je její celkové vnímání společností. Pacienti, jejich rodiny, pečující a laická veřejnost nerozumí tomu, co je skutečná paliativní péče. Většina laiků tento výraz nezná, a pokud ano, tak dává jej na stejnou úroveň jako hospice a péči na konci života. Zároveň vnímá konotace ukončení onkologické léčby a urychlení smrti. Opak je přitom pravdou – většina přehledů a studií jednoznačně dokumentovala, že u pacientů v paliativní a hospicové péči nedochází ke zkrácení života a jeho kvality (50, 51). Podaří-li se zlepšit porozumění tomu, co skutečně je PC, v čem spočívá její hlavní přínos a jaké jsou její reálné možnosti (lepší kvalita života a delší přežití), je to důležitý krok k EPC (10).
SHRNUTÍ A ZÁVĚR
V posledním půlstoletí se paliativní péče rozvinula od filozofie péče o pacienty v závěru života po samostatný klinický obor pomáhající pacientům s nevyléčitelnými chorobami. V minulých letech bylo podáno mnoho důkazů o tom, že časná paliativní péče v onkologii může zlepšit celkovou péči, kvalitu života, kontrolu symptomů a psychický stav a prodloužit přežití u pacientů s pokročilými nádory. Otázka dnes není, zda má být paliativní péče součástí moderní onkologie, ale kdy, kým a jak má být realizována. Základ tvoří rutinní screening symptomů a definovaná kritéria předání do paliativní péče s multidisciplinární péčí o každého pacienta (paliativně-onkologický multidisciplinární tým).
Bylo navrženo několik modelů pro realizaci EPC v nemocnicích, ambulantní a domácí péči, které prokazují přínos od stanovení diagnózy po konec života. Všechny modely vykazují omezení a bariéry ze strany onkologů, paliativních specialistů, společnosti a koncepce zdravotní péče. Do budoucna je nutné tyto bariéry překonávat pomocí propracovaného systému vzdělávání, obecné osvěty o paliativní péči a pokračujícího sbírání dat o jednotlivých parametrech EPC. Jedině tak lze očekávat skutečnou integraci kvalitní paliativní péče v onkologii.
Adresa pro korespondenci:
MUDr. Marek Sochor
Komplexní onkologické centrum
Krajská nemocnice Liberec, a. s.
Husova 357/10
460 63 Liberec
Tel.: 485 312 226
e-mail: marek.sochor@nemlib.cz
Sources
1. Davis MP, Bruera E, Morganstern D. Early integration of palliative and supportive care in the cancer continuum. Am Soc Clin Oncol Educ Book 2013; 144–150.
2. World Health Organization. WHO Definition of Palliative Care. Dostupné na: www.who.int/cancer/palliative/definition/en/
3. Hui D. Definition of supportive care: does the semantic matter? Curr Opin Oncol 2014; 26 : 372–379.
4. Ferrell BR, Temel JS, Temin S et al. Integration of palliative care into standard oncology care: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2016; 35 : 96–112.
5. Smith TJ, Temin S, Alesi ER et al. American Society of Clinical Oncology provisional clinical opinion: the integration of palliative care into standard oncology care. J Clin Oncol 2012; 30 : 880–887.
6. Cherny N, Catane R, Schrijvers D et al. European Society for Medical Oncology (ESMO) program for the integration of oncology and palliative care: a 5-year review of the Designated Centers’ incentive program. Ann Oncol 2010; 21 : 362–369.
7. Von Roenn JH. Optimal cancer care: Concurrent oncology and palliative care. J Natl Compr Canc Netw 2013; 11(Suppl1): S1–S2.
8. Quill TE, Abernethy AP. Generalist plus specialist palliative care-creating a more sustainable model. N Engl J Med 2013; 368 : 1173–1175.
9. Bruera E, Hui D. Integrating supportive and palliative care in the trajectory of cancer: establishing goals and models of care. J Clin Oncol 2010; 28 : 4013–4017.
10. Parikh RB, Kirch RA, Smith TJ et al. Early specialty palliative care: translating data in oncology into practice. N Engl J Med 2013; 369 : 2347–2351.
11. Bakitas M, Lyons KD, Hegel MT et al. Effects of a palliative care intervention on clinical outcomes in patients with advanced cancer: the Project ENABLE II randomized controlled trial. JAMA 2009; 302 : 741–749.
12. Higginson IJ, Bausewein C, Reilly CC et al. An integrated palliative and respiratory care service for patients with advanced disease and refractory breathlessness: a randomized controlled trial. Lancet Respir Med 2014; 2 : 979–987.
13. Grudzen CR, Richardson LD, Johnson PM et al. Emergency department-initiated palliative care in advanced cancer: a randomized clinical trial. JAMA Oncol 2016; 2 : 591–598.
14. Zimmermann C, Swami N, Krzyzanowska M et al. Early palliative care for patients with advanced cancer: A cluster-randomised controlled trial. Lancet 2014; 383 : 1721–1730.
15. Back AL, Park ER, Greer JR et al. Clinician roles in early integrated palliative care for patients with advanced cancer: A qualitative study. J Palliat Med 2014; 17 : 1244–1248.
16. Greer JA, Pirl WF, Jackson VA et al. Effect of early palliative care on chemotherapy use and end-of-life care in patients with metastatic non-small-cell lung cancer. J Clin Oncol 2012; 30 : 394–400.
17. Bakitas MA, Tosteson TD, Li Z et al. Early versus delayed initiation of concurrent palliative oncology care: patient outcomes in the ENABLE III randomized controlled trial. J Clin Oncol 2015; 33 : 1438–1445.
18. Temel JS, Greer JA, Muzikansky A et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010; 363 : 733–742.
19. Gade G, Venohr I, Conner D et al. Impact of an inpatient palliative care team: a randomized control trial. J Palliat Med 2008; 11 : 180–190.
20. Brumley R, Enguidanos S, Jamison P et al. Increased satisfaction with care and lower costs. Results of a randomized trial of in-home palliative care. J Am Geriatr Soc 2007; 55 : 993–1000.
21. Jang RW, Burman D, Swami N et al. Impact of an oncology palliative care clinic on access to home care services. Am J Hosp Palliat Care 2013; 30 : 425–431.
22. Porzio G, Aielli F, Verna L et al. Integrating oncology and palliative home care in Italy: the experience of the "L’Aquila per la Vita" Home Care Unit. Tumori 2013; 99 : 225–228.
23. Maione P, Perrone F, Gallo C et al. Pretreatment quality of life and functional status assessment significantly predict survival in elderly patients with advanced non-small-cell lung cancer receiving chemotherapy: a prognostic analysis of the Multicenter Italian Lung Cancer in the Elderly study. J Clin Oncol 2005; 23 : 6865–6872.
24. Yoong J, Park ER, Greer JA et al. Early palliative care in advanced lung cancer: a qualitative study. JAMA Intern Med 2013; 173 : 283–290.
25. Hui D. Access to palliative care among patients treated at a comprehensive cancer center. Oncologist 2012; 17 : 1574–1580.
26. Beccaro M, Constantini M, Merlo DF et al. Inequity in the provision of and access to palliative care for cancer patients: Results from the Italian survey of the dying of cancer (ISDOC). BMC Public Health 2007; 7 : 66.
27. Hui D, Bruera E. Models of integration of oncology and palliative care. Ann Palliat Med 2015; 4(3): 89–98.
28. Weissman DE, Meier DE. Identifying patients in need of a palliative care assessment in the hospital setting: a consensus report from the Center to Advance Palliative Care. J Palliat Med 2011; 14 : 17–23.
29. Tanco K et al. Patient perception of physician compassion after a more optimistic vs a less optimistic message: A randomized clinical trial. JAMA 2015; 1 : 176–183.
30. Dow LA et al. Paradoxes in advance care planning: the complex relationship of oncology patients, their physicians, and advanced medical directives. J Clin Oncol 2010; 28 : 299–304.
31. Payne R. The integration of palliative care and oncology: the evidence. Oncology (Williston Park) 2011; 25 : 126.
32. Bruera E, Hui D. Conceptual models for integrating palliative care at cancer centers. J Palliat Med 2012; 15 : 1261–1269.
33. Levy MH, Adolph MD, Back A et al. Palliative care. J Natl Compr Canc Netw 2012; 10 : 1284–1309.
34. Gaertner J, Wolf J, Hallek M et al. Standardizing integration of palliative care into comprehensive cancer therapy – a disease specific approach. Support Care Cancer 2011; 19 : 1037–1043.
35. Hui D, Kim Yj, Park JC et al. Integration of oncology and palliative care: a systematic review. Oncologist 2015; 20 : 77–83.
36. Hui D, Kim SH, Roquemore J et al. Impact of timing and setting of palliative care referral on quality of end-of-life care in cancer patients. Cancer 2014; 120 : 1743–1749.
37. Davis MP, Strasser F, Cherny N et al. MASCC/ESMO/EAPC survey of palliative programs. Support Care Cancer 2015; 23 : 1951–1968.
38. Hui D, Finlay E, Buss MK et al. Palliative oncologists: Specialists in the Science an Art of Patient Care. J Clin Oncol 2015; 33 : 2314–2317.
39. Vergo MT, Cullinan AM. Joining together to improve outcomes: Integrating specialty palliative care into the care of patients with cancer. J Natl Compr Cancer Netw 2013; 11: S38–S46.
40. Von Roenn JH, Voltz R, Serrie A. Barriers and approaches to the successful integration of palliative care and oncology practice. J Natl Compr Cancer Netw 2013; 11(Suppl. 1): S11–S16.
41. Schenker Y, Crowley-Matoka M, Dohan D et al. Oncologist factors that influence referrals to subspecialty palliative care clinics. J Oncol Practice 2014; 10: e37–44.
42. Ross DD, Shpritz D, Alexander CS et al. Development of required postgraduate palliative care training for internal medicine residents and medical oncology fellows. J Cancer Educ 2004; 19 : 81–87.
43. Rangachari D, Smith TJ. Integrating palliative care in oncology. The oncologist as a primary palliative care provider. Cancer J 2013; 19(5): 373–378.
44. Gaertner J, Weingartner V, Wolf J, Voltz R. Early palliative care for patients with advanced cancer: how to make it work? Curr Opin Oncol 2013; 25 : 342–352.
45. Quill TE, Abernethy AP. Generalist plus specialist palliative care-creating a more sustainable model. N Engl J Med 2013; 368 : 1173–1175.
46. Gilligan T, Coyle N, Frankel RM, Berry DL et al. Patient-clinician communication: American Society of Clinical Oncology consensus guideline. J Clin Oncol 2017; 35 : 3618–3632.
47. Johnson LA, Gorman C, Morse R et al. Does communication skills training make a difference to patients’ experiences of consultations in oncology and palliative care services? Eur J Cancer Care 2013; 22 : 202–209.
48. Mack J, Wolfe J, Cook EF. Hope and prognostic disclosure. J Clin Oncol 2007; 25 : 5636–5642.
49. Wright AA, Zhang B, Ray A et al. Associations between end-of-life discussions: Patient mental health, medical care near death, and caregiver bereavement adjustments. JAMA 2008; 300(14): 1665–1673.
50. Connor SR, Pyenson B, Fitch K et al. Comparing hospice and nonhospice patient survival among patients who die within a three-year window. J Pain Symptom Manage 2007; 33(3): 238–246.
51. El-Jawahri A, Green JA, Temel JS. Does palliative care improve outcomes for patients with incurable illness? A review of the evidence. J Support Oncol 2011; 9 : 87–94.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Výrobci cigaret a jejich opravné prohlášení – corrective statement
- Hospic – pokračující péče během života pacienta
- Péče o nevyléčitelně nemocné a umírající v domácím prostředí
- Časná integrace paliativní péče v onkologii
- Paliativní péče v kardiologii
- Paliativní péče v nefrologii
- Perioperační paliativní péče: role mezioborového konziliárního týmu v perioperačním období a v prostředí intenzivní péče
- Geriatrická paliativní péče
- Dětská paliativní péče
- Přehled dotazníků a škál hodnotících pacienty s amyotrofickou laterární sklerózou
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Paliativní péče v nefrologii
- Péče o nevyléčitelně nemocné a umírající v domácím prostředí
- Přehled dotazníků a škál hodnotících pacienty s amyotrofickou laterární sklerózou
- Dětská paliativní péče
