Karcinom plic
Lung cancer
Lung cancer is one of the most common cancers worldwide. Approximately 85 % of lung cancers are non-small cell lung cancers while 15 % are small cell lung cancers. Histologically, following subtypes of non-small cell cancer are distinguished: adenocarcinoma (38.5 % of all lung cancers), squamous cell carcinoma (20 %) and large cell carcinoma (3 %). Over recent years, the incidence of adenocarcinoma has been increasing. Squamous cell carcinoma is more commonly associated with smoking while adenocarcinoma is the most common histological type in non-smokers.
The treatment of non-small cell lung cancer is decided according to clinical stage, morphological diagnosis, and the performance status of the patient. Early-stage patients are typically indicated for surgery. In some cases, adjuvant therapy is indicated. In locally advanced and metastatic stages, chemotherapy, biological treatment, and, recently, immunotherapy is indicated. Radiotherapy should also be considered for locally advanced disease. In small-cell lung cancer, the combination of etoposide and cisplatin or etoposide and carboplatin is still considered standard chemotherapy. Radiotherapy is an integral part of treatment of either type of lung cancer.
Keywords:
lung cancer, non-small cell lung cancer, small cell lung cancer, chemotherapy, biological therapy, radiotherapy, immunotherapy
:
Jana Skřičková; Bohdan Kadlec; Ondřej Venclíček; Zdeněk Merta
:
Klinika nemocí plicních a TBC LF MU a FN Brno
:
Čas. Lék. čes. 2018; 157: 226-236
:
Review Article
Bronchogenní karcinom patří k nejčastěji se vyskytujícím karcinomům na světě. Zhruba v 85 % případů se jedná o nemalobuněčný karcinom a v 15 % o malobuněčný karcinom. Histologicky rozlišujeme u nemalobuněčného karcinomu adenokarcinom (38,5 % ze všech plicních karcinomů), skvamózní karcinom (20 %) a velkobuněčný karcinom (3 %). V posledních letech vzrůstá zejména incidence adenokarcinomu. V souvislosti s kouřením se častěji vyskytuje skvamózní typ karcinomu, adenokarcinom je nejčastějším histologickým typem u nekuřáků.
O léčbě nemalobuněčného karcinomu plic se rozhoduje na základě klinického stadia, morfologické diagnózy a výkonnostního stavu nemocných. U nízkých klinických stadií je indikované chirurgické řešení. V některých případech je indikovaná adjuvantní léčba. U místně pokročilých a metastatických stadií máme k dispozici chemoterapii, biologickou léčbu a v poslední době se uplatňuje rovněž imunoterapie. V případě lokálně pokročilých onemocnění by měla být zvažována také radioterapie. U malobuněčného karcinomu je za standardní chemoterapeutický režim stále považována kombinace etoposidu a cisplatiny nebo etoposidu a karboplatiny. Nedílnou součástí léčby obou typů karcinomu plic je radioterapie.
Klíčová slova:
karcinom plic, nemalobuněčný karcinom plic, malobuněčný karcinom plic, chemoterapie, biologická léčba, radioterapie, imunoterapie
ÚVOD
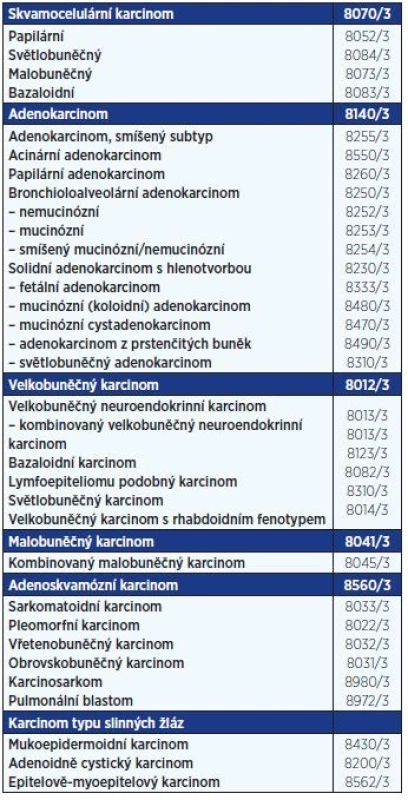
Z pohledu biologických vlastností lze bronchogenní karcinom rozdělit na dvě základní skupiny: malobuněčný bronchogenní karcinom (SCLC) a nemalobuněčný bronchogenní karcinom (NSCLC). SCLC představuje asi 15 % a NSCLC 80 % ze všech nemocných s plicními nádory (1). NSCLC zahrnuje všechny histologické typy uvedené v tab. 1 mimo malobuněčný karcinom. Plicní nádor však může obsahovat komponentu SCLC a současně buňky jiného histologického typu. Takový nádor se označuje jako kombinovaný karcinom (2). Pro rozhodování o léčbě mají zásadní význam klinické stadium, morfologická diagnóza a výkonnostní stav nemocných (PS).
KLINICKÁ STUDIA NEMALOBUNĚČNÉHO KARCINOMU PLIC
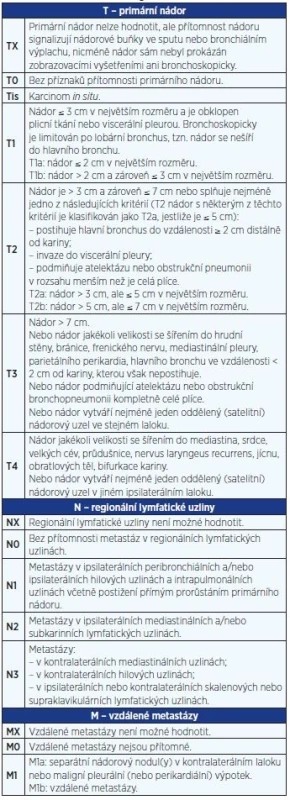
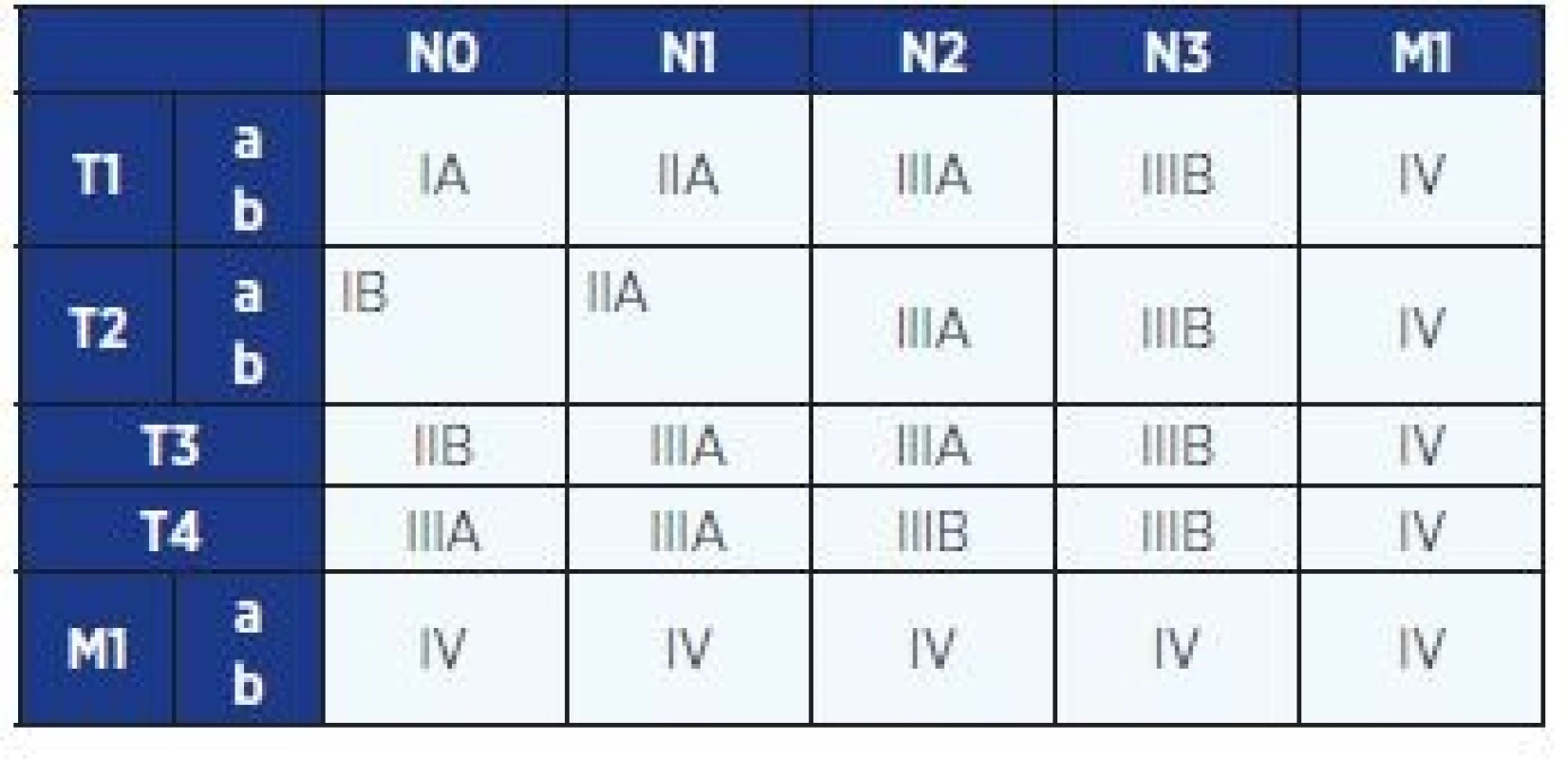
Rozsah nádorového onemocnění se hodnotí podle mezinárodně platného systému (klasifikace TNM = tumor – lymph node – metastasis) a z něj odvozených klinických stadií. Určení klinického stadia je rozhodující pro stanovení léčebného postupu. V roce 2009 byla schválena nová klasifikace (3), která je v České republice platná od 1. 1. 2011 (tab. 2 a 3). Tato klasifikace je platná doposud, i když v roce 2016 byla publikována klasifikace nová.
LÉČBA NEMALOBUNĚČNÉHO KARCINOMU PLIC PODLE KLINICKÝCH STADIÍ
Klinické stadium IA, IB
Chirurgický resekční zákrok je považován za dostatečně radikální a není zde indikovaná žádná další léčba. 5leté přežívání u nemocných je udáváno až 70 %. Kde není možné radikální chirurgické řešení, je indikovaná radioterapie, především stereotaktická. Ve stadiu IB, pokud je nádor větší než 4 cm, by měla být zvažována adjuvantní léčba (4,5).
Klinická stadia IIA, IIB, IIIA
V případě klinického stadia IIA je indikovaná chirurgická a následně adjuvantní léčba (kombinace platinového derivátu s vinorelbinem či paklitaxelem). Pokud nemocný není schopen chirurgického zákroku, je indikovaná souběžná nebo sekvenční chemoradioterapie. Při kontraindikaci chemoterapie je indikovaná radioterapie.
V případě stadia IIIA, které je po posouzení multidisciplinárním týmem operabilní, je indikovaná chirurgická léčba a adjuvantní chemoterapie. Při postižení mediastinálních uzlin (N2) je indikovaná pooperační radioterapie. Předoperační souběžná chemoradioterapie by měla být zvažována zejména u Pancoastova nádoru. 5leté přežívání nemocných v tomto stadiu je po chirurgické léčbě udáváno až 50 % (4, 5).
Klinické stadium IIIB
Jde o neoperabilní stadium, naděje na úplné vyléčení je velmi malá. Systémovou chemoterapií se souběžnou nebo následnou zevní radioterapií hrudníku lze dosáhnout zmenšení nádoru, lepší lokální kontroly a prodloužení přežívání nemocných. Souběžná chemoterapie s radioterapií by měla být zvažována především u nemocných s dobrým stavem výkonnosti (PS – performance status 0–1). Tam, kde je kontraindikovaná chemoterapie, je doporučována radioterapie (6).
Klinické stadium IV
Metastazující bronchogenní karcinom je léčen systémovou chemoterapií s paliativním záměrem. Dále je u nemocných, kteří jsou nosiči aktivačních mutací genu EGFR, nebo u nemocných s pozitivním průkazem mutací EML4-ALK a ROS indikovaná biologická léčba. Radioterapie se využívá k zmírnění symptomů způsobených samotným nádorem, ale i metastázami (5, 6).
CHEMOTERAPIE NEMALOBUNĚČNÉHO KARCINOMU PLIC
Chemoterapie znamená podávání léků, které jsou produkty chemické syntézy. Chemoterapeutika se používají jak k léčbě onkologických onemocnění, tak i jiných (bakteriálních, virových, plísňových, parazitárních) chorob. V onkologii se pod pojmem chemoterapie rozumí podávání léků s cytotoxickým účinkem, ať už jsou původu syntetického nebo jde o deriváty látek získaných z rostlin či plísní (6, 7).
Ke kombinované chemoterapii jsou indikovaní nemocní s PS 0–1, zcela ojediněle s PS 2. Rozsáhlými klinickými studiemi bylo prokázáno zlepšení kvality života a prodloužení přežití řádově o několik měsíců. Za vhodný chemoterapeutický režim se považuje dvojkombinace platinového derivátu (cisplatiny či karboplatiny) s jedním z následujících cytostatik: docetaxel, gemcitabin, paklitaxel, vinorelbin. Účinnost jednotlivých režimů s cisplatinou nebo karboplatinou byla studována v různých randomizovaných studiích fáze III. Jejich účinnost je vzájemně srovnatelná. Monoterapii je vhodné zvažovat u pacientů s kontraindikacemi k podání karboplatiny či cisplatiny a také u starších nemocných (70–75 let věku). V monoterapii se používají stejná cytostatika jako v kombinaci s platinovými deriváty (6–8).
Na základě výsledků randomizované studie fáze III je indikované podání pemetrexedu v kombinaci s cisplatinou v 1. linii léčby NSCLC, pokud je morfologická diagnóza adenokarcinom nebo velkobuněčný karcinom (6).
Při paliativní chemoterapii podáváme 2–6 cyklů. Po 2. cyklu provedeme zhodnocení léčby, a pokud je dokumentována léčebná odpověď nebo dojde ke stabilizaci nádoru (ani odpověď, ani progrese), pokračujeme dalšími 2 cykly pouze tehdy, jestliže předchozí léčba nebyla provázena závažnou toxicitou. Po 4 cyklech provedeme opět zhodnocení efektu léčby a podle výsledku se rozhodujeme o pokračování nebo ukončení chemoterapie. Více než 6 cyklů chemoterapie se doporučuje zcela ojediněle, pouze tam, kde je příznivá odpověď a nedochází k ohrožení toxicitou (6).
Pro některé starší a polymorbidní nemocné může být výše uvedená léčba příliš toxická. V těchto případech představuje monoterapie v režimu v režimu metronomické léčby vhodnou alternativu. Pojem metronomická chemoterapie označuje trvalé podávání nízkých dávek konvenčních protinádorových léků. Důvodem pro metronomickou chemoterapii je překonání rezistence nádoru k léku díky kontinuálnímu podávání a omezení toxicity v důsledku podávání nízkých dávek. Dalším mechanismem účinku je trvalá inhibice proliferace endotelových buněk, což vede k útlumu angiogeneze. Výsledky doposud proběhlých studií ukazují slibné výsledky co do účinnosti a velmi příznivý bezpečnostní profil. Výsledky velkých studií fáze IIII však chybí. Jako vhodný se pro metronomickou léčbu jeví perorální vinorelbin (8, 9).
NSCLC – chemoterapie 2. linie
Pro 2. linii chemoterapie u pokročilého NSCLC (při další progresi nádorového onemocnění) se rozhodujeme tam, kde klinický stav nemocného je dobrý, PS je 0–1 a kde nebyla předchozí významná toxicita chemoterapie. I tady je podstatný funkční stav (stav výkonnosti, PS) a ne věk nemocných. Na základě randomizovaných studií s placebem se pro léčbu ve 2. linii doporučuje docetaxel a pro nemocné s neskvamózním karcinomem pemetrexed (6).
RADIOTERAPIE NEMALOBUNĚČENÉHO KARCINOMU PLIC
Radioterapie se uplatňuje jako potenciálně kurativní nebo paliativní metoda u všech stadií NSCLC. Samotná radioterapie může být alternativou chirurgické resekce u neoperabilních nemocných se stadiem I či II nebo u nemocných, kteří tuto léčbu odmítli. U NSCLC se radioterapie uplatňuje v kombinaci s chemoterapií především u stadia IIIA či IIIB. U stadia IIIA lze také aplikovat i neoadjuvantní chemoterapii s radioterapií (4).
Nové léčebné systémy dávají stále více prostoru pro kurativní léčbu. Optimalizace léčby probíhá systémem obrazem řízené radioterapie (IGRT), která má stále své rezervy v konfrontaci plánovacího CT a 3D zobrazení při ozařování. Stereotaktická radioterapie (SRT) umožňuje dodat dávku s vyšší prostorovou přesností a minimálním postižením zdravých tkání. Lze toho dosáhnout pomocí přesného zajištění polohy těla během plánování, simulace i samotné léčby. Množství symptomatických poradiačních pneumonitid se snížilo pod 5 %, i nadále je však třeba opatrnosti v blízkosti hrudní stěny (osteonekróza žeber), v oblasti velkých cév, jícnu nebo míchy (4).
Rizikovější jsou nemocní po pneumonektomii. U stadií T2N0M0 je po SRT uváděna lokální kontrola nádoru v 85–95 % a přežívání 3 let u 80 % nemocných. Ještě přesnější je 4D radioterapie, která zohledňuje dýchací pohyby během léčby. Při respiratory gating radioterapii je pacient ozařován jen v určité fázi dýchacího cyklu. Zobrazování pomocí PET/CT má určité výhody v odlišení oblasti tumoru, atelektázy a zánětu. I nadále trvá obecné doporučení léčebné dávky (64–66 Gy) (4)
Brachyterapie je endobronchiální postup záření s použitím 192Ir. Metodu lze kombinovat se zevní radioterapií nebo použít samostatně, případně kombinovat s jinou endobronchiální metodou (laser, stent) (4).
CÍLENÁ BIOLOGICKÁ LÉČBA NEMALOBUNĚČNÉHO KARCINOMU PLIC
Biologické preparáty působí na nádorové buňky jiným mechanismem než standardní chemoterapie. Ukazuje se totiž, že v chemoterapii již bylo dosaženo maxima a žádná nová cytostatika ani nové kombinace již nepřispějí k významnému zlepšení léčebného efektu a přežívání nemocných. Cílená biologická léčba se někdy také nazývá cílená molekulární terapie, což lépe vyjadřuje skutečnost, že zasahuje selektivněji do intracelulárních pochodů v nádorové buňce.
Většinou jde o nízkomolekulární látky, které vazbou např. na receptor pro epidermální růstový faktor (EGFR), jenž je ve velkém počtu exprimován na povrchu nádorových buněk, blokují signální dráhy do buněčného jádra. Ty ve svém důsledku ovlivňují vlastnosti buňky, které ji činí maligní, jako jsou:
- inhibice apoptózy (u nádorové buňky nedochází ke kontrolované buněčné smrti tak jako u fyziologické buňky);
- schopnost novotvorby cév a vlastního zásobování nádoru živinami;
- nekontrolovaná proliferace nádorové buňky;
- schopnost nádorové buňky metastazovat.
V léčbě pokročilého NSCLC byly z této skupiny zkoušeny nejdříve inhibitory tyrosinkinázy (TKI) – erlotinib a gefitinib. Oba jsou v současnosti indikované v 1. linii léčby NSCLC u nemocných, u kterých byly prokázány aktivační mutace genu EGFR. Jako první byl v Evropské unii a také v České republice v této indikaci k dispozici gefitinib. Na základě úspěšné studie z roku 2009 byl prokázán delší čas do progrese při lepší toleranci ve srovnání se standardní chemoterapií (10)
Na základě výsledku randomizované studie s placebem byl jako první lék této skupiny v naší republice kategorizován pro 2. a 3. linii léčby NSCLC erlotinib. Je indikovaný u nemocných v dobrém klinickém stavu (PS 0–1) s pokročilým nemalobuněčným bronchogenním karcinomem po selhání 1. či 2. linie chemoterapie (11). Výsledky dalších studií potvrdily možnost podávání také erlotinibu v 1. linii léčby pokročilého NSCLC s prokázanou aktivační mutací EGFR. U těchto nemocných ve srovnání se standardní chemoterapií erlotinib prokázal signifikantní prodloužení přežití do progrese. Léčba erlotinibem byla pacienty lépe tolerována (12).
V roce 2012 byly na konferenci ASCO publikovány výsledky léčby s TKI 2. generace afatinibem ve studii LUX-Lung 3, která prokázala, že tento lék významně prodlužuje dobu do progrese v porovnání s nejlepší standardní chemoterapií. Afatinib působí odlišným způsobem než erlotinib a gefitinib. Mechanismus účinku spočívá v ireverzibilní blokádě rodiny receptorů ERBB. Afatinib blokuje EGFR (ERBB1) stejně jako další receptory náležející k rodině receptorů ERBB, jež jsou součástí signální dráhy umožňující nádorové buňce růst, metabolizovat a migrovat (13).
LUX-Lung 3 je velká randomizovaná otevřená registrační studie fáze III, která porovnává účinky afatinibu s účinky léčby pemetrexedem s cisplatinou v 1. linii léčby pacientů s pokročilým nemalobuněčným plicním karcinomem ve stadiu IIIB nebo IV, u kterých je přítomná mutace EGFR. Studie se účastnilo celkem 345 pacientů s nemalobuněčným plicním karcinomem s mutací EGFR (13). Výsledky prokázaly, že nemocní s nemalobuněčným karcinomem plic, kteří v 1. linii léčby užívali ireverzibilní blokátor receptorů rodiny ERBB, žili téměř rok bez progrese nádoru (doba do progrese činila 11,1 měsíce). U pacientů léčených standardní chemoterapií (pemetrexed/cisplatina) činila doba do progrese zhruba polovinu roku (6,9 měsíce). Velmi významné je, že u pacientů s nejčastější mutací EGFR (Del19 a L858R; 90 % všech mutací) prodloužil afatinib dobu do progrese až na 13,6 měsíce. U těchto pacientů se standardní chemoterapií byla doba do progrese 6,9 měsíce (13).
Mutace T790M je nejčastější příčinou (až v 60 %) získané rezistence k TK inhibitorům EGFR. Tato mutace se nachází na exonu 20 genu EGFR a vede k záměně threoninu za methionin na pozici 790 kinázové domény receptoru. Vzniká tak překážka, která brání vazbě EGFR-TKI. Mutace navíc zvyšuje vazebnou afinitu EGFR k ATP a výsledkem je opět snížení efektu TKI (14).
Pro překonání získané rezistence byl vyvinut osimertinib. Před indikací osimertinibu k léčbě lokálně pokročilého nebo metastazujícího NSCLC je nutné stanovit přítomnost mutace T790M genu EGFR. Validovaný test má být proveden s použitím DNA získané ze vzorku nádorové tkáně nebo cirkulující nádorové DNA (ctDNA) získané ze vzorku plazmy. Osimertinib je perorální ireverzibilní TK inhibitor receptoru epidermálního růstového faktoru (EGFR) s aktivačními mutacemi (EGFRm) a s rezistentní mutací T790M. Je indikovaný k léčbě dospělých pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic (NSCLC) s prokázanou mutací T790M EGFR (14)
Bezpečnost a účinnost osimertinibu byla zkoumána v klinickém programu AURA. Ten se skládá se ze tří studií, jež probíhaly u pacientů s pokročilým nebo metastatickým nemalobuněčným karcinomem plic (NSCLC) s přítomností aktivačních mutací genu EGFR, kteří progredovali na léčbě inhibitory tyrosinkinázy (EGFR-TKI) a u kterých byla prokázána mutace T790M (14). V prosinci 2016 byly na kongresu WCLC prezentovány výsledky studie fáze III AURA3. Jedná se o konfirmační randomizovanou otevřenou studii porovnávající TKI 3. generace osimertinib s chemoterapií založenou na platině u pacientů s lokálně pokročilým nebo metastatickým NSCLC s prokázanou mutací T790M, u kterých došlo k progresi při léčbě 1. linie TKI. Primárním cílovým parametrem účinnosti bylo přežití bez progrese (PFS – progression free survival) podle posouzení zkoušejícího. Dalšími parametry účinnosti byly míra objektivní odpovědi (ORR – objective response rate), délka trvání odpovědi (DoR – duration of response) a celkové přežití (OS – overal survival) dle posouzení zkoušejícího (14). Medián PFS byl statisticky signifikantně vyšší u skupiny pacientů léčených osimertinibem oproti chemoterapii: 10,1 vs. 4,4 měsíce (HR 0,30; 95% CI 0,23–0,41; p < 0,001) (obr. 1).
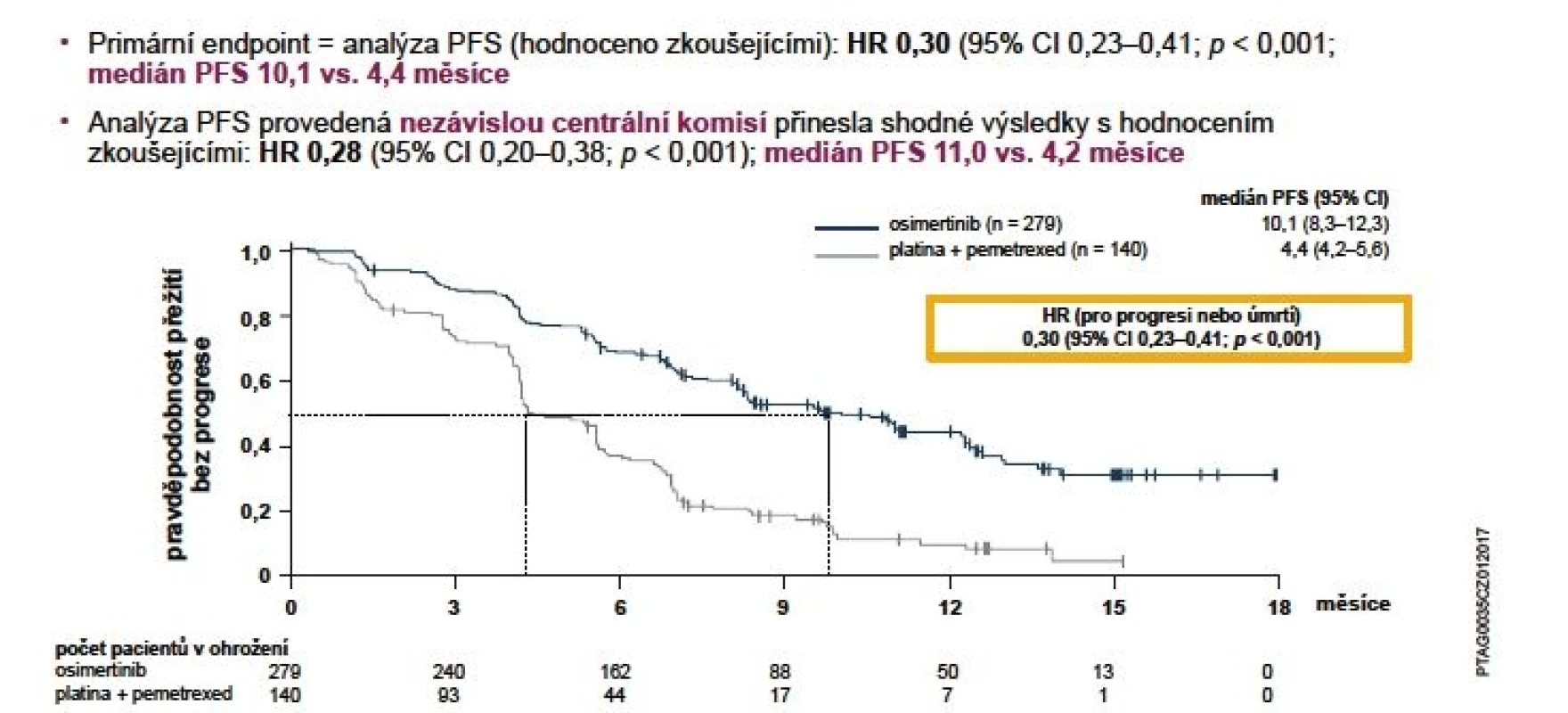
Datum ukončení sběru dat bylo 15. dubna 2016. Populace: ITT (všichni randomizovaní pacienti).
Přežití bez progrese bylo definováno jako doba od randomizace do data objektivní progrese onemocnění. Progrese zahrnovala i úmrtí při nepřítomnosti progrese podle kritérií RECIST. Svislé čárky na křivkách přežití označují
pacienty s cenzorovanými údaji.
Analýza provedená zaslepeným nezávislým centrálním hodnocením (BICR) potvrdila medián PFS 11,0 vs. 4,2 měsíce ve prospěch osimertinibu (HR 0,28; 95% CI 0,20-0,38; p < 0,001). Významného zlepšení PFS s poměry rizik (HR) < 0,50 ve prospěch pacientů užívajících osimertinib v porovnání s těmi, kteří byli léčeni chemoterapií, bylo dosaženo ve všech předem definovaných podskupinách, včetně etnického původu, věku, pohlaví, anamnézy kouření a typu mutace EGFR (14).
Míra objektivní odpovědi (ORR) byla signifikantně vyšší u pacientů léčených osimertinibem oproti pemetrexedu s karboplatinou nebo cisplatinou: 71 vs. 31 % (OR 5,39; 95% CI 3,47–8,48; p < 0,001). Délka trvání odpovědi (DoR) na základě posouzení zkoušejícího prokázala délku 9,7 měsíce (95% CI 8,3–11,6) ve skupině s osimertinibem a 4,1 měsíce (95% CI 3,0–5,6) u kombinace platina + pemetrexed. Do studie AURA3 mohli být zařazeni také pacienti s asymptomatickými metastázami v CNS nevyžadujícími léčbu steroidy po dobu alespoň 4 týdnů před zahájením studijní léčby. Rovněž u této skupiny byl medián doby přežití bez progrese signifikantně vyšší ve skupině léčené osimertinibem: 8,5 vs. 4,2 měsíce (HR 0,32; 95% CI 0,21–0,49; p < 0,001) (obr. 2) (12).
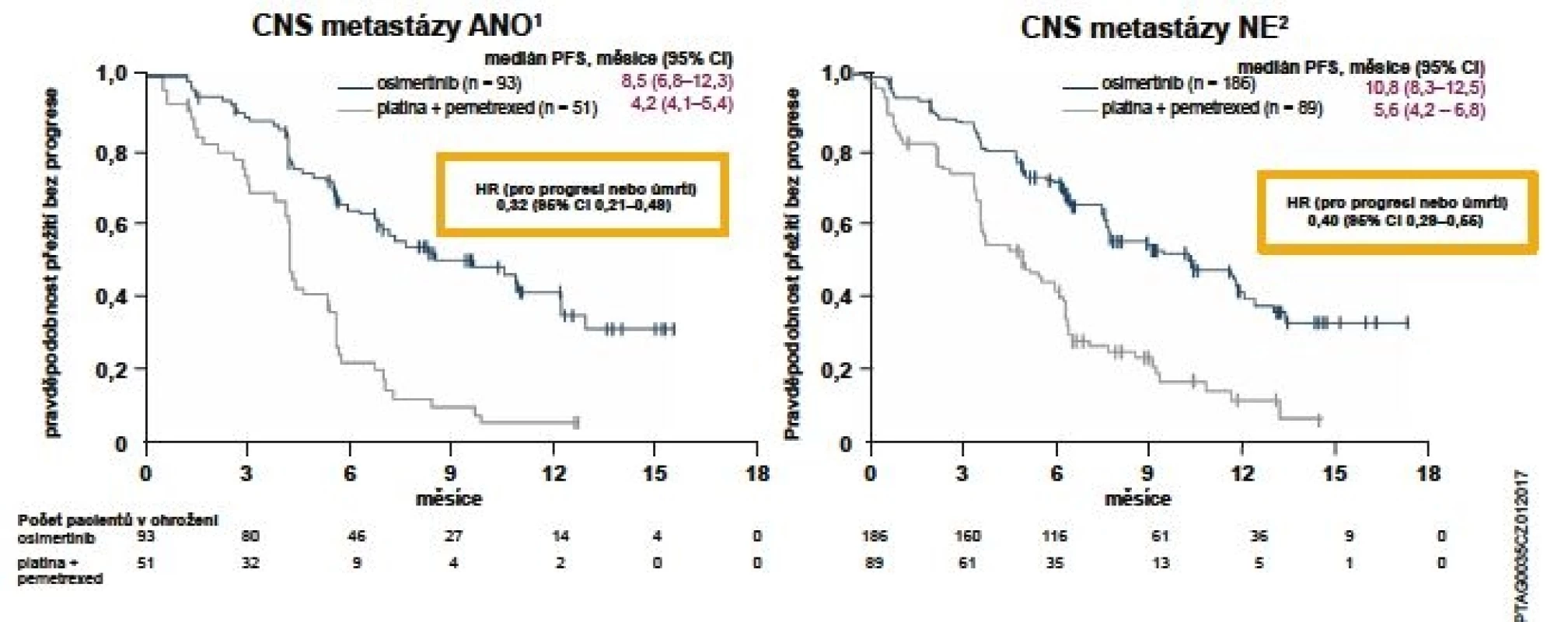
Datum ukončení sběru dat bylo 15. dubna 2016. Populace: ITT (všichni randomizovaní pacienti).
Přežití bez progrese bylo definováno jako doba od randomizace do data objektivní progrese onemocnění. Progrese zahrnovala i úmrtí při nepřítomnosti progrese podle kritérií RECIST. Svislé čárky na křivkách přežití
označují pacienty s cenzorovanými údaji. Metastázy v CNS a jejich lokalizace byly určeny na základě vstupního vyšetření CNS, zdravotní anamnézy a záznamů o chirurgickém výkonu nebo radioterapii.
1. Mok TS et al. N Engl J Med 2017; 376(7): 629–640. 2. Supplementary appendix for: Mok TS et al. N Engl J Med 2017.
Dalším preparátem biologické léčby NSCLC je bevacizumab – protilátka, která blokuje receptor vaskulárního endoteliálního růstového faktoru (VEGFR). Zvýšená exprese VEGFR je negativním prognostickým faktorem, jenž zhoršuje přežívání nemocných s NSCLC. V klinických studiích byla prokázána účinnost v kombinaci s chemoterapií u nemocných s pokročilým nedlaždicobuněčným NSCLC již v 1. linii v kombinaci s konvenční chemoterapií. V České republice je tento preparát k dispozici pro nemocné s neskvamózním karcinomem. Podává se po ukončení chemoterapie, a to do progrese onemocnění nebo do nezvládnutelné toxicity (15).
Jedním z novějších preparátů ovlivňujících angiogenezi je nintedanib. Jedná se o inhibitor angiogeneze, působící na několik cílů, jež hrají roli v regulaci angiogeneze. Blokuje tři receptory pro růstový faktor: receptory pro vaskulární endotelový faktor (VEGFR1–3), receptory pro růstový faktor odvozený od trombocytů (PDGFR-α a β) a receptory pro fibroblastový růstový faktor (FGFR1–3). Nintedanib v kombinaci s chemoterapií byl srovnáván se standardní chemoterapií v kombinaci s placebem ve studiích LUME-Lung 1 a LUME-Lung 2 u nemocných s pokročilým nemalobuněčným plicním karcinomem ve druhé linii léčby. Studie potvrdily, že nintedanib prodlužuje čas do progrese ve srovnání jak s docetaxelem (ve studii LUME-Lung 1), tak s pemetrexedem. Lepšího výsledku dosáhli pacienti s adenokarcinomy: OS 12,6 měsíce (placebo s docetaxelem 10,3 měsíce) (16, 17). V České republice v dubnu 2018 nebyla pro tuto indikaci stanovena úhrada.
Dalším preparátem s působením na angiogenezi je ramucirumab. Jedná se o plně humánní monoklonální protilátku typu IgG1 s vysokou afinitou k extracelulární vazebné doméně receptoru typu 2 pro vaskulární endotelový růstový faktor (VEGFR2). Patří tedy mezi potenciální inhibitory angiogeneze, mechanismem účinku je však odlišný od bevacizumabu. Ramucirumab neblokuje solubilní ligand (VEGF-A) jako bevacizumab, ale přímo extracelulární vazebnou doménu receptoru (VEGFR2), čímž znemožňuje receptorovou vazbu a aktivaci signální dráhy VEGFR2 nejen působením ligandu VEGF-A, ale i působením jiných aktivujících ligandů, jež mohou kromě VEGF-A receptor VEGFR2 aktivovat a signální dráhu spouštět. Výsledky mezinárodní randomizované studie fáze III (REVEL) testující pacienty s pokročilým/metastazujícím NSCLC všech histologických typů (tedy včetně dlaždicobuněčného histologického typu) prokázaly účinnost a bezpečnost ramucirumabu přidaného do kombinace k docetaxelu ve 2. linii léčby oproti monoterapii docetaxelem (18). Léčba s ramucirumabem se také jeví jako jedna z možností pro 2. linii léčby nemocných s NSCLC. V České republice není pro tuto indikaci stanovena úhrada.
Dalším z preparátů biologické léčby je krizotinib, selektivní inhibitor ALK (anaplastické lymfomové kinázy) a jejích onkogenních variant (fúze a vybrané mutace ALK). Specifický onkogen EML4-ALK (fúzní mutace) je přítomen přibližně u 5 % nemocných s NSCLC. Krizotinib prokázal klinickou aktivitu u EML4-ALK-pozitivních pacientů s NSCLC. V České republice je stanovena úhrada pro léčbu po selhání chemoterapie. Průkaz mutace EML4-ALK je nezbytný pro podání krizotinibu u nemocných s NSCLC (19).
Také během podávání krizotinibu se vyvíjí rezistence. Preparátem účinným u nemocných s přestavbou genu ALK, u kterých se vyvinula rezistence, je ceritinib. Jedná se o další inhibitor ALK, který se ukázal jako vysoce aktivní u pacientů s pokročilým NSCLC s přestavbou genu ALK, včetně těch, u kterých došlo k progresi onemocnění choroby v průběhu léčby krizotinibem, bez ohledu na přítomnost rezistenčních mutací. Ceritinib se podává perorálně do progrese nebo do nezvládnutelné toxicity. V České republice byl dostupný v rámci časného přístupu pro nemocné, u kterých došlo k progresi při léčbě krizotinibem (20).
Preparátem, který lze užít u nemocných s progresí při léčbě krizotinibem je také alektinib. Alektinib a krizotinib mají dle studií velmi dobré výsledky i v léčbě po stanovení diagnózy. Krizotinib, alektinib a ceritinib jsou vhodné nejen pro léčbu nemocných s NSCLC s přestavbou genu anaplastické lymfomové kinázy ale také ROS1 a fúzí RET, amplifikací genu MET a amplifikací genu kódujícího HER2. V České republice nemají pro 1. linii léčby stanovenu úhradu.
Biologicky cílená léčba NSCLC je zásadním trendem a je vyvíjeno velké množství dalších nadějných léků.
UDRŽOVACÍ (MAINTENANCE) LÉČBA NEMALOBUĚČNÉHO KARCINOMU PLIC
Tento způsob léčby byl ověřován již delší dobu. První prodloužení času do progrese bylo prokázáno při použití chemoterapie (docetaxel, gemcitabin, vinorelbin) nebo biologicky cílené terapie (erlotinib, bevacizumab). Zlepšení času do progrese i celkového přežití bylo zjištěno v několika studiích se switch maintenance, což znamená změnu preparátu pro léčbu po 1. linii, kterou představují 4 cykly chemoterapie s platinovým dubletem. Byly to studie s erlotinibem a kombinací bevacizumabu s erlotinibem nebo pemetrexedem.
Pro současnou praxi měla největší význam studie PARAMOUNT, jež u pacientů s pokročilým/metastazujícím nemalobuněčným karcinomem plic (NSCLC) jiné než převážně dlaždicobuněčné histologie prokázala zlepšení přežití po podání pemetrexedu v režimu udržovací pokračovací léčby (continuation maintenance). Pemetrexed byl podáván u nemocných nevykazujících známky progrese onemocnění bezprostředně po ukončení 4 cyklů léčby 1. linie kombinací cisplatina/pemetrexed. Jeho podávání znamenalo zlepšení přežití při dobré kvalitě života ve srovnání s přístupem watch and wait za současné aplikace nejlepší podpůrné péče (21). Tento koncept léčby je již dostupný pro pacienty v České republice
Udržovací pokračovací léčbu (continuation maintenance) představuje i léčba bevacizumabem do progrese nebo nezvladatelné toxicity. V monoterapii bevacizumabem se pokračuje v případě, že po 4 cyklech kombinované léčby s chemoterapií na bázi platinového derivátu bylo dosaženo remise nebo stabilizace onemocnění. Tato léčba je indikovaná u neskvamózních NSCLC (15).
IMUNOTERAPIE NEMALOBUNĚČNÉHO KARCINOMU PLIC
Léčebné zásahy do imunitního systému nebyly v minulosti v léčbě plicní rakoviny příliš úspěšné. Pokrok v pochopení imunitní odpovědi organismu při setkání s nádorovými buňkami vedl k vývoji nových imunoterapeutických léků, které užívají dvou hlavních přístupů. Prvním z nich je imunoterapie vakcínami (např. vakcína MAGE-A3 u resekovaných pacientů s lokalizovaným stadiem nemalobuněčného plicního karcinomu). Druhý pak představuje specifická imunoterapie zahrnující monoklonální protilátky, jež modulují interakci mezi antigen prezentujícími buňkami, T lymfocyty a nádorovými buňkami (například protilátky proti CTLA-4, proti receptoru PD-1 nebo jeho ligandu PD-L1) (22)
Imunoterapie modulující aktivitu T lymfocytů nabízí alternativní léčebný přístup, který by mohl přispět ke zlepšení léčebných výsledků (obr. 3). Zlepšení v celkovém přežití v randomizovaných klinických studiích fáze III vedlo ke schválení ipilimumabu pro melanom a obnovilo zájem o imunoterapii solidních nádorů včetně karcinomu plic (22).
Pozn. red.: Za objevy spojené s odblokováním tlumícího účinku proteinů CTLA-4 a PD-1 v protinádorové imunitní odpovědi byla letošní Nobelova cena za fyziologii a medicínu udělena Jamesi P. Allisonovi z USA a Tasuku Hondžóovi z Japonska.
Principy imunoterapie
To, že nádory exprimují antigeny, které mohou být rozpoznány imunitním systémem, nebylo v minulosti zcela jasné, ale předpokládalo se, že imunitní systém je schopen rozpoznat maligní buňky jako cizí a je schopen je eliminovat. Normální protinádorová imunitní odpověď začíná rozpoznáním nádorových antigenů pomocí antigen prezentujících buněk (APC), zejména buněk dendritických. Tyto antigeny jsou těmito buňkami „internalizovány“ a zpracovány do malých peptidových sekvencí a následně se objevují na buněčném povrchu.
Nádory mají různé mechanismy jak se vyhnout imunitnímu systému, což vede k navození imunotolerance. Nádorové buňky mohou například redukovat antigeny a snížit expresi molekul třídy I MHC a kostimulačních molekul, což má za následek poruchu rozpoznávání a aktivaci T lymfocytů. Kromě toho sekrece řady cytokinů zasahuje do dozrávání dendritických buněk a vytváří tak imunosupresivní prostředí. Receptor PD-1 může interagovat s ligandem PD-L1, což vede ke snížení působení aktivovaných T lymfocytů v nádoru. A konečně se také nádorové buňky mohou stát rezistentními vůči účinkům cytotoxických T lymfocytů tím, že aktivují apoptózu (22).
Imunoterapie využívá imunitní systém ke kontrole a případné eliminaci nádoru. Starší imunoterapeutické léky, např. interleukin 2, interferon a vakcíny první generace, měly v praxi pouze omezený úspěch. Průlom nastal až zlepšením celkového přežití díky novějším imunoterapeutickým lékům u pacientů s melanomem a karcinomem prostaty. Zásadní obrat přišel s poznatky, že je možné cíleně ovlivnit kontrolní body (checkpointy) imunitní odpovědi, což je poměrně složitá síť molekul a drah zajišťujících homeostázu imunitního systému (23).
Prvním lékem, který dokázal reprodukovatelně navodit dlouhotrvající odpověď u nemocných s metastatickým melanomem, byl ipilimumab – monoklonální protilátka proti CTLA‑4 receptorům, jejíž účinnost se podobá účinnosti interleukinu 2. Rozdíl ovšem spočívá v navození dlouhotrvající odpovědi, a to u 20–25 % pacientů. Určitým problémem této léčby se staly její nežádoucí účinky (24).
Příznivější poměr mezi účinností a bezpečností nacházíme u další generace monoklonálních protilátek, cílících na imunitní checkpointy PD‑1. I když rakovina plic dříve nebyla považována za imunitně ovlivnitelnou chorobu, stále více důkazů naznačuje, že imunitní systém zde hraje důležitou úlohu. Retrospektivní analýzy nádorových vzorků od pacientů s rakovinou plic, ukázaly, že buněčná imunitní odpověď je spojena s příznivější prognózou. Zvýšená infiltrace nádorového stromatu CD4+/CD8+ T lymfocyty se projevila jako nezávislý prognostický indikátor jak u pacientů s časným stadiem NSCLC, tak i v případě metastazujícího onemocnění. Přítomnost vyššího počtu makrofágů a CD8+ T lymfocytů v nádoru je spojena s příznivější prognózou. Vysoká exprese tumor infiltrujících regulačních T lymfocytů na druhé straně snižuje protinádorovou imunitu a je spojena s recidivou onemocnění. Tyto skutečnosti podpořily hypotézu, že lze využít protinádorové vlastnosti imunitního systému k léčbě nádorů plic (25, 26).
Průlomovou modalitu v imunoterapii tedy představují léky založené na monoklonálních protilátkách proti kontrolním bodům imunitní reakce. Výsledky s protilátkou anti-CTLA-4 (cytotoxický T lymfocytový antigen 4) ipilimumabem (25) znamenaly revoluci a byly impulzem pro vývoj nových protilátek zaměřených na další kontrolní molekuly (tab. 4). Z nich je nutné zmínit zejména protilátky proti receptoru programované buněčné smrti (PD-1) – nivolumab, pembrolizumab – a proti jeho ligandu (PD-L1) – atezolizumab a durvalumab. Výhodou těchto léků je kromě jejich účinnosti také univerzální potenciál z hlediska využití u řady maligních nádorů. Princip účinku těchto inhibitorů spočívá v blokádě inhibičních receptorů na buňkách imunitního systému nebo nádoru a tím prolomení tolerance imunitního systému vůči nádoru.
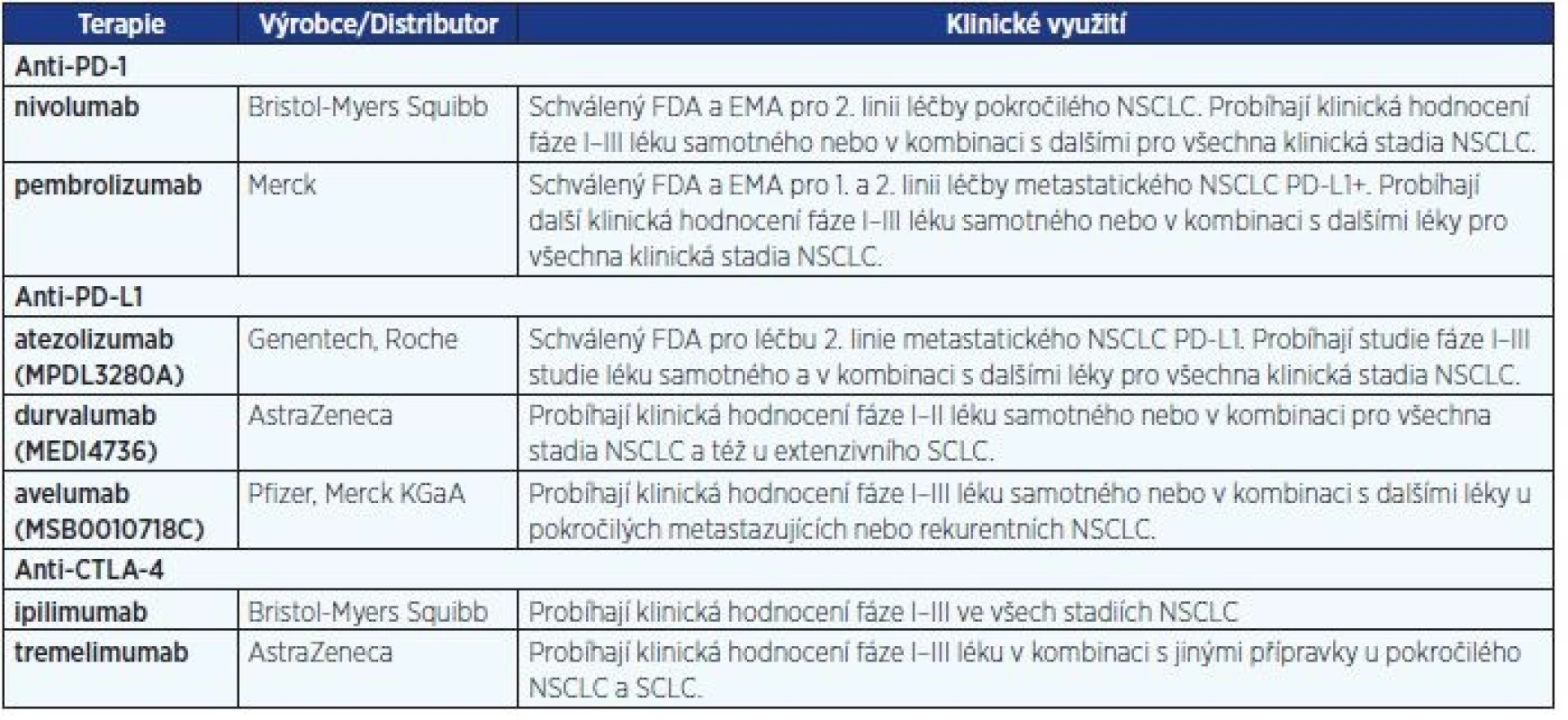
Anti PD-1/PD-L1 protilátky
Nivolumab je plně humánní protilátka IgG4, která selektivně blokuje interakci mezi PD-1 a PD-L1/PD-L2 a obnovuje imunitní reakci proti nádorovým buňkám. V březnu 2015 jej americký Úřad pro kontrolu léků a potravin (FDA) schválil pro léčbu pokročilého skvamózního NSCLC po předchozím selhání chemoterapie, a to na základě výsledků klinické studie fáze III CheckMate-017. V této randomizované otevřené studii byl porovnán účinek nivolumabu s docetaxelem ve 2. linii (28). V celkovém přežití dosáhl medián OS u nivolumabu 9,2 měsíce proti 6,0 měsícům u docetaxelu (HR 0,59; 95% CI 0,44–0,79; p = 0,00025). Riziko úmrtí bylo u pacientů s nivolumabem sníženo o 41 %. Jednoletého OS dosáhlo s nivolumabem 42 % pacientů proti 24 % s docetaxelem. Celkový počet objektivních odpovědí byl 20 % u pacientů léčených s nivolumabem proti 9 % (12/137) s docetaxelem (p = 0,0083). Stanovená hladina exprese PD-L1 neprokázala prediktivní ani prognostický význam. Bezpečnostní profil nivolumabu se ukázal lepší než u docetaxelu (28).
V říjnu 2015 FDA rozšířil svůj souhlas i o neskvamózní NSCLC, a to na základě studie fáze III CheckMate-057. Do ní byli zařazeni pacienti, kteří byli v 1. linii předléčeni chemoterapií s platinovými deriváty nebo tyrosinkinázovým inhibitorem. OS bylo výrazně prodlouženo u pacientů s nivolumabem, medián činil 12,2 měsíce proti 9,4 měsíce u docetaxelu (HR 0,73; 96% CI 0,59–0,89; p = 0,00155). Ročního OS dosáhlo 50,5 % pacientů léčených nivolumabem a 39,0 % s docetaxelem. Také bylo dosaženo zlepšení celkového počtu objektivních odpovědí (19,2 vs. 12,4 %; p = 0,0235). Riziko úmrtí a progrese se u pacientů s nivolumabem snížilo o 27 %. V této studii byla exprese PD-L1 spojena s lepšími výsledky léčby nivolumabem a účinnost terapie byla prokázána napříč všemi hodnotami hladiny receptorů PD-L1 (1, 5 a 10 %) (29).
Pembrolizumab je plně humanizovaná IgG4 monoklonální protilátka cílená proti PD-1. V dubnu 2015 byly publikovány výsledky studie fáze I KEYNOTE-001, v níž dostávali pembrolizumab pacienti dříve léčení nebo bez předchozí léčby. ORR činila 19,4 %, medián OS 12 měsíců. Při expresi PD-L1 alespoň 50 % nádorových buněk dosáhla ORR 45,2 %, medián OS nebyl dosažen. V říjnu 2015 byl pembrolizumab schválen FDA pro léčbu metastatického nemalobuněčného karcinomu plic s expresí PD-L1 progredujícího po předchozí léčbě. V prosinci 2015 byly publikovány výsledky studie fáze II/III KEYNOTE-010, porovnávající pemrolizumab s docetaxelem u předléčených pacientů s NSCLC s prokázanou pozitivitou PD-L1. Medián OS byl signifikantně delší v rameni s pembrolizumabem než v rameni s docetaxelem u pacientů s pozitivitou PD-L1 ≥ 50 % (14,9 a 17,3 měsíce vs. 8,2 měsíce), ale také s pozitivitou PD-L1 ≥ 1 % (10,4 a 12,7 měsíce vs. 8,5 měsíce). Obě dávky pembrolizumabu prodloužily PFS v porovnání s docetaxelem, ale rozdíl byl signifikantní pouze u pacientů s PD-L1 ≥ 50 % (5,0 a 5,2 měsíce vs. 4,1 měsíce). ORR byl signifikantně vyšší v rameni s pembrolizumabem, a to jak u pacientů s pozitivitou PD-L1 ≥ 50 % (30 a 29 % vs. 8 %), tak také v sledované celé populaci (18 a 18 % vs. 9 %) (30).
Pro 1. linii léčby NSCLC byl pembrolizumab schválen FDA na základě dat z randomizované otevřené klinické studie fáze III (KEYNOTE-024), která jej hodnotila ve srovnání s chemoterapií obsahující platinu u pacientů se skvamózním (18 %) i neskvamózním (82 %) metastatickým NSCLC. Studie zahrnovala nepředléčené pacienty s metastatickým onemocněním, jejichž nádory vykazovaly vysokou expresi PD-L1 (TPS ≥ 50 %) a zároveň u nich nebyly přítomné řídicí mutace ALK či EGFR. Studie randomizovala 305 pacientů, kteří dostávali pembrolizumab v dávce 200 mg každé 3 týdny nebo chemoterapii na bázi platiny. Medián přežití bez progrese onemocnění činil 10,3 měsíce (95% CI 6,7 – nedosaženo) ve skupině s pembrolizumabem proti 6,0 měsícům (95% CI 4,2–6,2) u chemoterapie, riziko progrese onemocnění/úmrtí bylo 0,50 (95% CI 0,37–0,68; p < 0,001). Míra odpovědi byla vyšší u skupiny s pembrolizumabem než ve skupině s chemoterapií (44,8 vs. 27,8 %), medián trvání odpovědi byl delší (nebyl dosažen [rozmezí 1,9 + 14,5 měsíce] oproti 6,3 měsíce). Nežádoucí účinky související s léčbou v jakémkoliv stupni byly méně časté (vyskytly se u 73,4 oproti 90,0 % pacientů), stejně jako u 3., 4. nebo 5. stupně nežádoucích účinků souvisejících s léčbou (26,6 vs. 53,3 %). U pacientů s vysokou expresí PD-L1 (> 50 % nádorových buněk) byl pembrolizumab spojen s významně delším přežitím bez progrese a celkovým přežitím při menším množství nežádoucích příhod než s chemoterapií na bázi platiny (30). Plánovány jsou i další studie s pembrolizumabem v kombinaci s bevacizumabem, inhibitory tyrosinkinázy, ipilimumabem či chemoterapií.
Atezolizumab je protilátkou namířenou proti PD-L1 a představuje volbu ve 2. linii léčby pro pacienty s nemalobuněčným karcinomem plic bez ohledu na stav PD-L1 exprese v nádoru. Na základě dat z klinické studie OAK bylo pozorováno zlepšení celkového přežití o 27 % u nemocných užívajících atezolizumab ve srovnání s pacienty léčenými docetaxelem (p = 0,0003) bez ohledu na hladiny exprese PD-L1, a to včetně pacientů s expresí < 1 %. Pokud byli probandi členěni podle úrovně exprese PD-L1, bylo celkové přežití v rameni s atezolizumabem u pacientů s nejvyšší mírou exprese PD-L1 dokonce o 59 % vyšší než ve srovnání se stejnou skupinou léčenou docetaxelem. Nicméně i u nemocných léčených atezolizumabem, kteří nevykazovali expresi PD-L1, došlo k významnému zlepšení celkového přežití o 25 % ve srovnání s těmi léčenými docetaxelem. Zlepšení celkového přežití bylo podobné u pacientů se skvamózním i neskvamózním karcinomem. Skutečnost, že studie ukázala zlepšení celkového přežití dokonce i u pacientů bez exprese PD-L1, je důležitým argumentem pro nevylučování „PD-L1-negativních“ z léčby, než se zcela objasní úloha ligandu v léčebné predikci a standardizuje se jeho stanovení. Probíhají další výzkumy včetně studií v 1. linii léčby u pacientů s PD-L1-pozitivním lokálně pokročilým nebo metastazujícím NSCLC porovnávající atezolizumab s chemoterapií, dále pak v kombinaci s bevacizumabem či chemoterapií (32).
Nežádoucí účinky imunoterapie
Prolomení imunitní tolerance vůči nádoru vede k nežádoucím vedlejším efektům, které se svým charakterem podobají autoimunitním onemocněním – jde o tzv. imunitně podmíněné vedlejší příhody (Ir-AEs – immune-related adverse events). Nežádoucí účinky při podání imunoterapie jsou časté a mohou být život ohrožující. K nejčastějším patří kožní toxicita (exantém, pruritus), gastrointestinální toxicita (průjem, kolitida), endokrinní toxicita (hypopituitarismus, hypofyzitida, hypotyreóza, insuficience nadledvin), jaterní toxicita (elevace transamináz, hepatitida) a u anti-PD-1 protilátek navíc pneumonitida (33, 34).
MALOBUNĚČNÝ KARCINOM PLIC (SCLC)
Malobuněčný karcinom plic ve srovnání s nemalobuněčným roste rychleji, brzy metastazuje a je více citlivý k chemoterapii a radioterapii. Pro malobuněčný karcinom plic se nadále v klinické praxi používá zjednodušená klasifikace, i když i zde princip TNM zůstává stejný. Malobuněčný karcinom je dělen do dvou skupin podle VALG (Veterans Administration Lung Cancer Study Group). Limitované stadium (LD – limited disease) je definováno jako onemocnění ohraničené na jedno plicní křídlo (s postižením ipsilaterálních či kontralaterálních uzlin mediastinálních nebo supraklavikulárních nebo bez tohoto postižení a se stejnostranným pleurálním výpotkem nebo bez něj), které může být ozářeno v rámci jednoho ozařovacího pole. Extenzivní stadium (ED – extensive disease) zahrnuje všechny ostatní formy onemocnění (35).
Limitované onemocnění
Limitované onemocnění je diagnostikováno cca u 30 % pacientů s malobuněčným karcinomem. Je obvykle senzitivní na chemoterapii i radioterapii. U nemocných v dobrém klinickém stavu (PS), obvykle ve věku do 65–70 let, je indikovaná souběžná (konkomitantní) chemoterapie s radioterapií (chemoradioterapie). Radioterapie by měla být zahájena současně s 1. či 2. cyklem chemoterapie. Za standardní chemoterapeutický režim při souběžné chemoradioterapii je považována kombinace cisplatiny a etoposidu. Kombinace karboplatiny a etoposidu je též přípustná, nicméně pro vyšší výskyt myelotoxicity a slizniční toxicity je při konkomitanci méně vhodná. Hlavním typem toxicity je ezofagitida (pokud probíhá spolu s chemoterapií radioterapie) a hematologická toxicita (41–43). U nemocných vyššího věku nebo tam, kde lze předpokládat sníženou toleranci léčby, je bezpečnější následné (sekvenční) zařazení radioterapie (až po ukončení chemoterapie). Pokud bylo dosaženo odpovědi na léčbu, je indikované preventivní ozáření neurokrania. Odpověď na systémovou chemoterapii a radioterapii se předpokládá u 70–90 % pacientů v limitovaném stadiu. Medián přežití se pohybuje mezi 14 a 20 měsíci a 2letého přežití je dosaženo u < 40 % pacientů (36–39).
Resekce primárního malobuněčného karcinomu je zcela výjimečně indikovaná u primárních nádorů v rozsahu T1–2N0M0. Po radikální resekci primárního nádoru je vždy indikovaná chemoterapie – i za předpokladu, že v resekátu nebyly histologicky prokázány metastázy v N1 či N2 uzlinách. Při pozitivním průkazu diseminace v N1 či N2 uzlinách by měla být podána konkomitantní chemoradioterapie stejným způsobem jako u limitovaného onemocnění bez operace. Adjuvantní léčbu lze doplnit o profylaktické ozáření neurokrania (4, 38).
Extenzivní stadium
Kombinovaná chemoterapie také významně prodlužuje přežití nemocných s extenzivním stadiem malobuněčného karcinomu. Užívají se stejná kombinovaná schémata jako v léčbě limitované formy. Délka 1. linie chemoterapie by neměla přesáhnout 6 sérií. Za standardní režim lze v současnosti považovat kombinaci etoposidu a cisplatiny nebo etoposidu a karboplatiny. Záměna cisplatiny za karboplatinu je u extenzívního stadia více akceptovaná. Lokální ozáření hrudníku u nemocných s extenzivním onemocněním nezlepšuje přežití a není v případě ED indikované. Radioterapie je vhodná v rámci léčby syndromu horní duté žíly nebo v jiné paliativní indikaci (např. symptomatická léčba kostních metastáz nebo radioterapie mozkových metastáz) (38).
Podle reakce na chemoterapie můžeme SCLC dělit na chemosenzitivní, chemorezistentní a chemorefrakterní. U chemosenzitivního typu v průběhu chemoterapie dojde ke kompletní či parciální remisi nádoru, která trvá nejméně 90 dní po skončení chemoterapie. V případě relapsu chemosenzitivního typu nádoru je obvykle zachována citlivost k platinovým cytostatikům. Pravděpodobnost dosažení další remise onemocnění při použití původní léčebné kombinace přesahuje 50 %. U chemorezistentního typu v průběhu chemoterapie nastane kompletní či k parciální remise nádoru, k progresi nádoru však dojde do 90 dní po skončení chemoterapie. Při relapsu chemorezistentního nádoru je třeba počítat s rezistencí nádoru k platinovým derivátům. Jako léčebné schéma 2. linie se doporučuje podání topotekanu 1.–5. den, a to perorální nebo intravenózní cestou. U chemorefrakterního typu SCLC nedochází v průběhu chemoterapie k remisi nádorového onemocnění. V léčbě tohoto typu nádoru se naděje na úspěch při podání chemoterapie 2. linie pohybuje kolem 10 %. Prognóza tohoto typu onemocnění je krajně nepříznivá (38, 41).
Mozek je častým místem vzniku metastáz malobuněčného karcinomu plic, již v době stanovení diagnózy jsou nalezeny u 10–15 % pacientů a v dalším průběhu nemoci se objeví u dalších 20–30 % pacientů. Již v roce 1999 metaanalýza 7 randomizovaných studií s 987 pacienty prokázala snížení rizika úmrtí a vzestup počtu nemocných přežívajících déle než 3 roky o 5,4 % (z 15,3 na 20,7 %), pokud po absolvování indukční léčby podstoupili ještě profylaktické ozáření mozku. Tato léčebná modalita rovněž vedla ke 25% snížení incidence mozkových metastáz v průběhu 3 let od zahájení léčby. Také u nemocných s extenzivním stadiem SCLC s příznivou odpovědí na indukční chemoterapii vede profylaktické ozáření mozku jak k redukci rizika vzniku mozkových metastáz, tak k významně prodlouženému dlouhodobému přežití (42, 43).
Na rozdíl od NSCLC je poznání řídicích mutací a mechanismů u malobuněčných karcinomů plic dosud omezené. Cílená léčba tyrosinkinázovými inhibitory zatím nevedla k prokazatelně prodlouženému přežití nemocných se SCLC. Určitou naději představuje pro tuto diagnózu imunoterapie.
PALIATIVNÍ LÉČBA KARCINOMU PLIC
Na možnost paliativní léčby bychom měli myslet u nemocných s rakovinou plic již při stanovení diagnózy. Paliativní léčbu indikujeme především pro obtíže spojené se syndromem horní duté žíly, maligním pleurálním výpotkem a bronchiální obstrukcí.
Syndrom horní duté žíly
V případě syndromu horní duté žíly je u NSCLC indikována především radioterapie. Ještě před zahájením výše uvedené léčby lze zmírnit obtíže nemocného antiedematózní léčbou vysokými dávkami dexamethasonu (24–40 mg/d) a podáváním diuretik. V některých případech indikujeme aplikaci stentu do horní duté žíly (prováděno intervenčním radiologem), a to zvláště u nemocných s již vyčerpanou možností radioterapie (4).
Tvorba pleurálního výpotku
Tvorbu pleurálního výpotku lze zpomalit či zastavit aplikací cytostatik do pleurální dutiny. Nejčastěji se podává bleomycin. Dalším řešením je sklerotizace pohrudniční dutiny po chemickém zánětu navozeném intrapleurální aplikací některých látek (pleurodéza). K navození chemické pleuritidy se používaly tetracykliny, koncentrovaná glukóza a nyní především talek. Se stejným cílem se dříve podávala vakcína Corynebacterium parvum (4).
Podstatou úspěchu je podání sklerotizující látky do prázdné (dobře vydrénované) pleurální dutiny a její dobrá distribuce v celém prostoru, aby chemický zánět proběhl v celém rozsahu pleury a způsobil její srůst. Uměle vyvolaná pleuritida může být provázena bolestí. Pokud se výpotek i navzdory intrapleurální léčbě doplňuje, zvažujeme trvalé zavedení drénu. Jde-li o nemocné s předpokládanou dobou života dnů až týdnů, je vhodnější provádět opakované pleurální punkce než časově náročné sklerotizace pleury (4).
Obstrukce dýchacích cest
V případě obstrukce dýchacích cest endobronchiálně rostoucím nádorem můžeme kvalitu života zlepšit rekanalizací pomocí laseru, elektrokauteru nebo kryoterapie. K rekanalizaci s dlouhodobějším efektem lze použít také brachyterapii – zavedení zářiče přímo do bronchiálního stromu. Ta je indikovaná především v případech, kdy je zúžení bronchu způsobeno extramurálním tlakem. Další možností řešení extramurálních stenóz je zavedení stentu.
Některé uvedené metody patří mezi intervenční bronchologické výkony, pro jejichž provedení je třeba zkušeného bronchologa a také odpovídající technické vybavení. Většinu lze provádět i flexibilními přístroji, ale pro zachování bezpečnosti a okamžitou možnost řešení komplikací je obvykle vhodnější rigidní bronchoskopie (4).
Adresa pro korespondenci:
prof. MUDr. Jana Skřičková, CSc.
Klinika nemocí plicních a TBC LF MU a FN Brno
Jihlavská 20, 635 00 Brno
e-mail: skrickova.jana@fnbrno.cz
Sources
- Dušek L, Malúšková D, Mužík J et al. Epidemiologie zhoubných nádorů plic, průdušnice a průdušek v České republice. Onkologická Revue 2016; 8, Speciál (Současné trendy v léčbě karcinomu plic): 7–1
- Moulis M. Morfologická diagnostika karcinomu plic. In: Skřičková J. Kolek V. a kol. Základy moderní pneumoonkologie ( vyd.). Maxdorf, Praha, 2017.
- Giroux DJ, Rami-Porta R, Chansky K et al. The IASLC Lung Cancer Staging Project: data elements for the prospective project. J Thorac Oncol 2009; 4 : 679–68
- Skřičková J, Kolek V a kol. Základy moderní pneumoonkologie (2. vyd.). Maxdorf, Praha, 2017.
- Skřičková J, Venclíček O, Kadlec B a kol. Nemalobuněčný karcinom plic. Postgraduální medicína 2016; 18, Příloha 1 (Pneumoonkologie): 21–27.
- Sculier JP, Moro-Sibilot D. First-and second-line therapy for advanced nonsmall cell lung cancer. Eur Respir J 2009; 33(4): 915–930.
- Ginsberg RJ. Lung Cancer. BC Decker Hamilton, London, 2002.
- Pallis AG, Gridelli C, Wedding U et al. Management of elderly patients with NSCLC; updated expert’s opinion paper: EORTC Elderly Task Force, Lung Cancer Group and International Society for Geriatric Oncology. Ann Oncol 2014; 25 : 1270–1283.
- Lien K, Georgsdottir S, Sivanathan L et al. Low-dose metronomic chemotherapy: a systematic literature analysis. Eur J Cancer 2013; 49 : 3387–3395.
- Duffield EL, Watkins CL, Armour AA, Fukuoka M. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361 : 947–957.
- Shepherd FA, Pereira JR, Ciuleanu T et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353 : 123–132.
- Rosell R, Carcereny E, Gervais R et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13 : 239–246.
- Yang JCH, Schuler MH, Yamamoto N et al. LUX-Lung 3: a randomized, open-label, phase III study of afatinib vs cisplatin/pemetrexed as 1st-line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR-activating mutations. J Clin Oncol 2012; 30(18 Suppl.): LBA7500.
- Mok TS, Wu YI, Ahn MJ et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017; 376 : 629–640.
- Reck M, von Pawel J, Zatloukal P et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol 2009; 27 : 1227–1234.
- Reck M. Nintedanib (BIBF 1120) plus docetaxel in NSCLC patients progressing after first-line chemotherapy: LUME Lung 1, a randomized, double-blind phase III trial. ASCO Annual Meeting 2013. J Clin Oncol 2013; 31(Suppl.): abstr. #LBA8011.
- Hanna NH. LUME-Lung 2: a multicentre, randomized, double-blind, phase III study of nintedanib plus pemetrexed vs. placebo plus pemetrexed in patients with advanced non-squamous non-small cell lung cancer (NSCLC) after failure of first-line chemotherapy. American Society of Clinical Oncology, Chicago, 2013 Jun 2. J Clin Oncol 2013; 31(Suppl.): abstr. #8034.
- Perol M, Ciuleanu TE, Arrieta O et al. REVEL: a randomized, double-blind, phase III study of docetaxel (DOC) and ramucirumab (RAM; IMC-1121B) versus DOC and placebo (PL) in the second-line treatment of stage IV non-small cell lung cancer (NSCLC) following disease progression after one prior platinum-based therapy. J Clin Oncol 2014; 32 : 5(suppl.): abstr. #LBA8006.
- Shaw AT, Solomon B. Targeting anaplastic lymphoma kinase in lung cancer. Clin Cancer Res 2011; 17 : 2081–2086.
- Shaw AT, Kim DW, Mehra R et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 2014; 370 : 1189–1197.
- Paz-Ares L, de Marinis F, Dediu M et al. Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non-squamous non-small-cell lung cancer (PARAMOUNT): a double-blind, phase 3, randomised controlled trial. Lancet Oncol 2012; 13 : 247–255.
- Kelly RJ, Gulley JL, Giaccone G. Targeting the immune system in non-small cell lung cancer: bridging the gap between promising concept and therapeutic reality. Clin Lung Cancer 2010; 11 : 228–237.
- Fong L, Small EJ. Anti-cytotoxic T-lymphocyte antigen-4 antibody: the first in an emerging class of immunomodulatory antibodies for cancer treatment. J Clin Oncol 2008; 26 : 5275–5283.
- Maker AV, Attia P, Rosenberg SA. Analysis of the cellular mechanism of antitumor responses and autoimmunity in patients treated with CTLA-4 blockade. J Immunol 2005; 175 : 7746–7754.
- Al-Shibli KI, Donnem T, Al-Saad S et al. Prognostic effect of epithelial and stromal lymphocyte infiltration in non-small cell lung cancer. Clin Cancer Res 2008; 14 : 5220–5227.
- Kawai O, Ishii G, Kubota K et al. Predominant infiltration of macrophages and CD8+ T cells in cancer nests is a significant predictor of survival in stage IV non-small cell lung cancer. Cancer 2008; 113 : 1387–1395.
- Lynch TJ, Bondarenko I, Luft A et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small cell lung cancer: results from a randomized, double-blind, multicenter Phase II study. J Clin Oncol 2012; 30 : 2046–2055.
- Spigel DR, Reckamp KL, Rizvi N et al. A phase III study (CheckMate 017) of nivolumab (NIVO; anti-programmed death-1 [PD-1]) vs docetaxel (DOC) in previously treated advanced or metastatic squamous (SQ) cell non-small cell lung cancer (NSCLC). J Clin Oncol 2015; 33(Suppl.): abstr. 8009.
- Hossein Borghaei H, Paz-Ares L, Horn L et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373 : 1627–1639.
- Reck M, Rodríguez-Abreu D, Robinson AG et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375 : 1823–1833.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012; 12 : 252–264.
- Garassino MC, Rizvi N, Besse B et al. Atezolizumab as 1L therapy for advanced NSCLC in PD-L1-selected patients: updated ORR, PFS and OS data from the BIRCH study. World Conference on Lung Cancer 2016 Dec 5; Abstract OA03.02.
- Schmerling RA. Toxicity of checkpoint inhibitors. Chin Clin Oncol 2014; 3 : 31.
- Lakomý R, Poprach A. Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi. Klinická onkologie 2015; 28(Suppl 4): 4S103–4S114.
- Vallières E, Shepherd FA, Crowley J et al. The IASLC Lung Cancer Staging Project: proposals regarding the relevance of TNM in the pathologic staging of small cell lung cancer in the forthcoming (seventh) edition of the TNM classification for lung cancer. J Thorac Oncol 2009; 4 : 1049–1059.
- Almquist D, Mosalpuria K, Ganti AK. Multimodality therapy for limited-stage small-cell lung cancer. J Clin Oncol 2016; 12 : 111–117.
- Corso ChD, Rutter ChE, Park HS et al. Role of chemoradiotherapy in elderly patients with limited-stage small-cell lung cancer. J Clin Oncol 2015; 33 : 4240–4246.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Small cell lung cancer. Dostupné na: www.nccn.org
- Niho S, Kubota K, Yoh K et al. Clinical outcome of chemoradiation therapy in patients with limited-disease small cell lung cancer with ipsilateral pleural effusion. J Thorac Oncol 2008; 3 : 723–727.
- Hanna N, Bunn PA, Langer C et al. Randomized phase III trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer. J Clin Oncol 2006; 24 : 2038–2043.
- Schneider BJ. Management of recurrent small cell lung cancer. J Natl Compr Canc Netw 2008; 6 : 323–331.
- Patel S, Macdonald OK, Suntharalingam M. Evaluation of the use of prophylactic cranial irradiation in small cell lung cancer. Cancer 2009; 115 : 842–850.
- Nawal L, Islam KMM, Deviany PE et al. Survival trends of small cell lung cancer (SCLC) in the United States: a SEER database analysis. J Thorac Oncol 2015; 10(9, Suppl. 2): S402.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Lung cancer
- Idiopathic pulmonary fibrosis: Does the time for change of diagnostic and therapeutic recommendations come?
- Treatment of tobacco dependence as a standard part of oncology care
- Alcohol as an issue of the public health in the Czech Republic: facts and context
- The origin and development of fat droplet and its role in health and illness
- Aulus Cornelius Celsus and a regimen
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Lung cancer
- The origin and development of fat droplet and its role in health and illness
- Idiopathic pulmonary fibrosis: Does the time for change of diagnostic and therapeutic recommendations come?
- Alcohol as an issue of the public health in the Czech Republic: facts and context
