Tibolon – jediný zástupce skupiny STEAR
Tibolon – the only one member of STEAR’s group
Tibolon is the only therapeutic approach to climacteric symptoms, prevention of osteoporosis and urogenital atrophy with the same efficacy as hormone replacement therapy. Tibolon has more positive effects on sexuality and mood changes in menopausal women. It decreases the mammographic density. Its safety for breast cancer is the same as for only estrogen therapy and better than for estrogen-gestagen therapy. Tibolon is the first choice for postmenopausal women with mood and sexuality disorders, women with mastodynia and high mammographic density.
Keywords:
breast cancer – osteoporosis – tibolon – climacteric syndrome – mammographic density
:
Tomáš Fait
:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha
:
Čas. Lék. čes. 2019; 158: 107-111
:
Review Article
Tibolon je zatím jediná terapeutická modalita plně srovnatelná s hormonální substituční terapií. Lepších výsledků dosahuje v oblasti ovlivnění psychiky a sexuality postmenopauzální ženy. Snižuje mamografickou denzitu. Z hlediska karcinomu prsu je srovnatelně bezpečný s estrogenní terapií a pravděpodobně bezpečnější než estrogen-gestagenní léčba. Tibolon by měl být primárně volen u postmenopauzálních žen s poruchami sexuality a nálady, s mastalgiemi a vysokou prsní denzitou.
Klíčová slova:
karcinom prsu – osteoporóza – tibolon – klimakterium – mamografická denzita
ÚVOD
Tibolon je syntetický progestin původně vyvíjený pro léčbu a prevenci osteoporózy. V klinických zkouškách prokázal srovnatelnou účinnost s hormonální substituční terapií (HRT – hormone replacement therapy) v léčbě akutního klimakterického syndromu i v prevenci osteoporózy při nulové stimulaci endometria. Lze jej tedy užít u postmenopauzálních žen bez ohledu na přítomnost dělohy či anamnézu endometriózy. V klinických studiích nezvyšoval mamografickou denzitu, a v preklinických zkouškách dokonce stimuloval diferenciaci a podporoval apoptózu normálních buněk prsní žlázy, proto byl zkoušen jako vhodná alternativa pro terapii akutního klimakterického syndromu u žen s anamnézou karcinomu prsu. V tomto extrémně rizikovém souboru však předpokládanou neutralitu neprokázal.
STEAR
Vedou se diskuse o tom, zda jsou selektivní regulátory tkáňové estrogenní aktivity (STEAR – selective tissue estrogenic activity regulators) typem HRT, nebo její alternativou zařazenou do samostatné skupiny označované ve starší literatuře jako gonadomimetika či tkáňově specifická HRT.
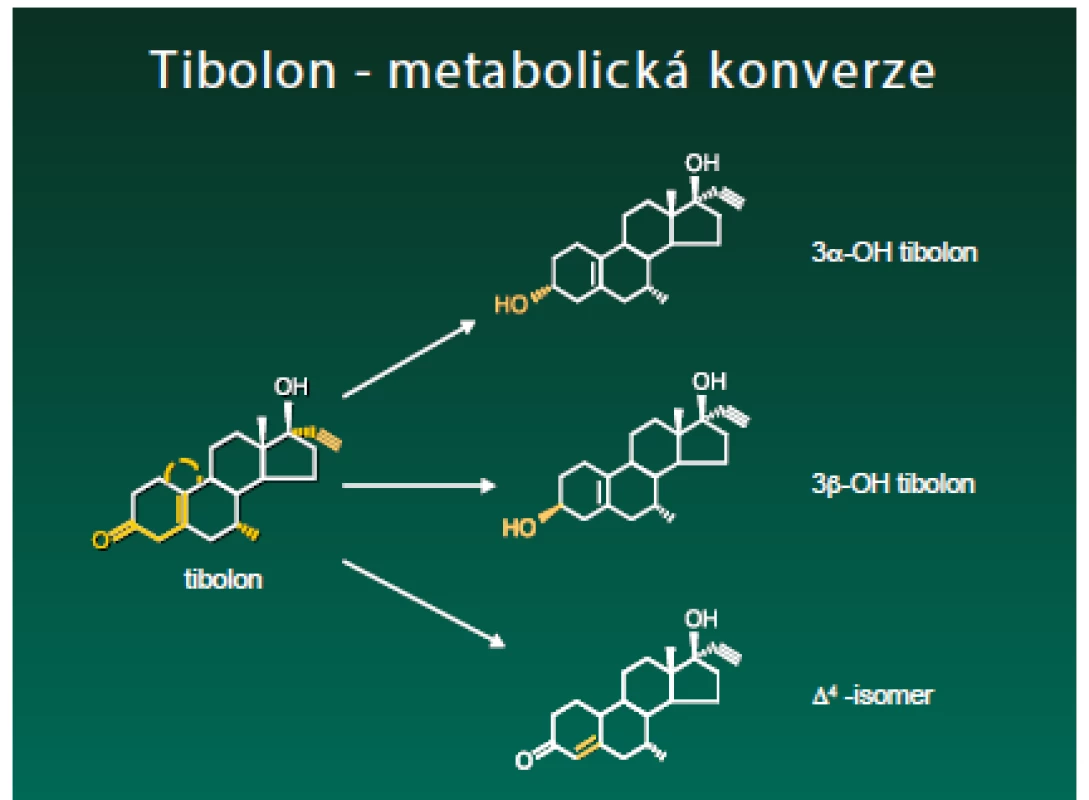
Tibolon je strukturálně příbuzný progestinům odvozeným od 19-nortestosteronu, jež se používají jako perorální antikoncepce. Jeho aktivní metabolity 3α-hydroxytibolon a 3β-hydroxytibolon mají estrogenní účinek, Δ4-isomer má progestagenní a androgenní efekt (obr. 1). Působí přímo na hormonální receptory a ovlivňují aktivitu enzymatických procesů, které v cílových tkáních určují hladiny vlastních aktivních estrogenů.
Tyto procesy jsou selektivní – to znamená, že v každé tkáni je upřednostňována tvorba jiného metabolitu. Také jejich účinek na enzymatické procesy je rozdílný. Inhibice sulfatázy je silná v prsu, střední v endometriu (přispívající k antiestrogennímu účinku) a nulová v kosti (umožňující silný estrogenní vliv). Hydroxymetabolity působí na cévní systém, poševní systém a kost stejně jako estrogen.
TIBOLON A KLIMAKTERICKÝ SYNDROM
Vysokou účinnost tibolonu v dávce 2,5 mg denně v léčbě akutního klimakterického syndromu potvrzuje 30 let klinických zkušeností (v Evropě byl na trh uveden v roce 1987). V prospektivní dvojitě zaslepené randomizované studii 775 pacientek byl pro dávku 2,5 a 5 mg prokázán oproti placebu významný vliv na návaly a pocení již po 4 týdnech, zatímco pro dávku 1,25 mg bylo snížení návalů pozorováno až po 8 týdnech (1).
Srovnávací studie nenalezly rozdíl mezi účinkem tibolonu a HRT, ať již čistě estrogenní s 17β-estradiolem, estradiol valerátem či konjugovanými equinními estrogeny (CEE – conjugated equine estrogens) nebo sekvenčně či kontinuálně gestagenně oponované (EPT – estrogen progesterone/progestin hormone therapy) (2–5). Podkladem psychických změn v klimakteriu je pravděpodobně zjištěný pokles hladin β-endorfinu. Podávání tibolonu ve 30členné skupině vedlo na rozdíl od placeba k návratu premenopauzálních hodnot β-endorfinu (6). V oblasti psychiky se účinnost opírá i o androgenní aktivitu Δ4-isomeru tibolonu.
V rozsáhlejší dvojitě zaslepené prospektivní randomizované studii na 256 postmenopauzálních ženách prokázal tibolon účinnost na náladu hodnocenou ve škále 16 parametrů (7). Tibolon je účinný rovněž v léčbě výpadových jevů způsobených podáváním agonistů gonadoliberinů (8, 9), tedy v pozici add-back terapie při léčbě endometriózy. Podkladem dobré snášenlivosti tibolonu je minimální výskyt nežádoucích účinků. Nejčastější příčinou přerušení HRT je nepravidelné krvácení. Tibolon má ovšem významně nižší výskyt této komplikace.
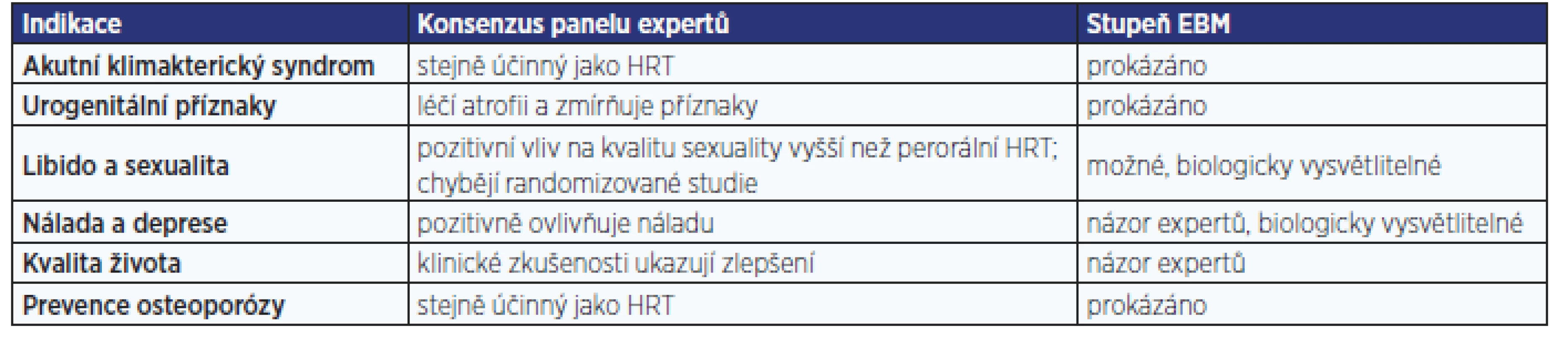
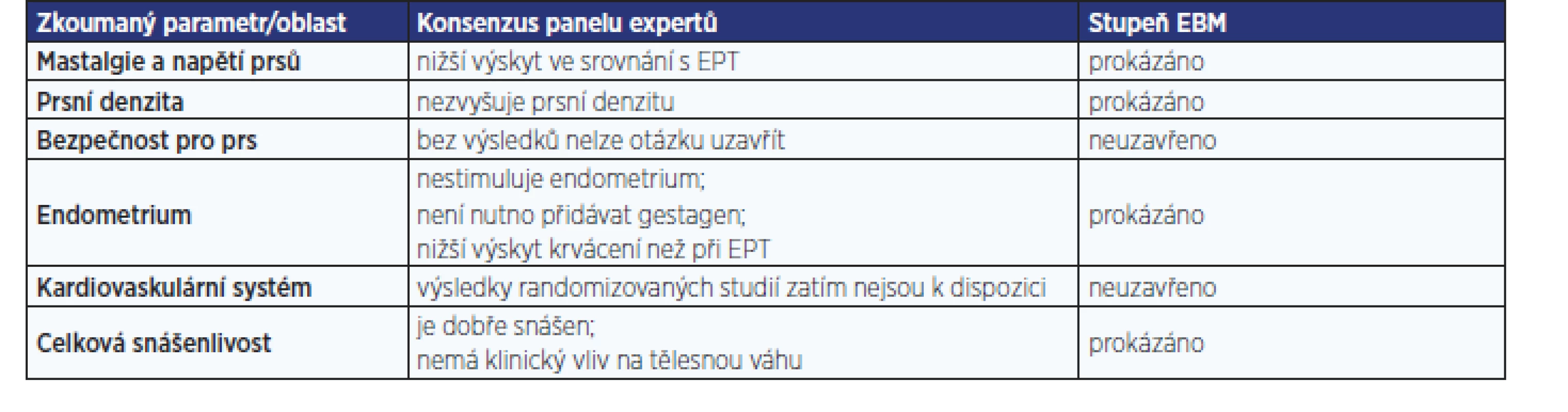
V souboru 1189 žen bylo dosaženo po 4měsíční léčbě tibolonem nejen významného (p < 0,001) snížení příznaků menopauzy z hodnoty 37,5 na 18,3 na škále MRS (menopause rating scale), ale současně i významného (p < 0,001) snížení podílu žen s nepravidelným krvácením z 15,9 na 6,8. Incidence nežádoucích účinků dosáhla pouhých 3,1 %, přičemž v 1,2 % případů se stavy jako např. akné, padání vlasů, zvýšení tlaku krve, otoky nohou či žilní obtíže vyskytovaly již před začátkem léčby (10). Také podle konsenzu panelu expertů (11) je tibolon v léčbě příznaků akutního klimakterického syndromu prokazatelně stejně účinný jako HRT (tab. 1). Díky spojení vysoké účinnosti s bezpečností je jeho podávání spojeno se zlepšením kvality života (tab. 2).
TIBOLON A JEHO VLIV NA PRS
Byly vedeny rozsáhlé diskuse o tom, zda je mamografická denzita rizikovým faktorem pro karcinom prsu, či nikoli. Nicméně oba tábory se shodnou na tom, že získaná mamografická denzita při užívání HRT může snížit záchytnou schopnost mamografie (13).
V prospektivní roční srovnávací studii – na rozdíl od kombinace CEE + medroxyprogesteron acetát (MPA) – tibolon vyvolal snížení mamografické denzity díky redukci proliferace a stimulaci apoptózy. Po roce léčby tibolonem bylo dosaženo významného rozdílu (p = 0,007) v mamografické denzitě i její změně (p = 0,00053), expresi markeru proliferace Ki-67 i apoptózy Bcl-2 (14).
V prospektivní randomizované dvojitě zaslepené placebem kontrolované studii s EPT v kombinaci 2 mg estradiol (E2) + 1 mg norethisteron acetát prokázal tibolon významně (p < 0,001) nižší negativní vliv na mamografickou denzitu, de facto srovnatelný s placebem. Riziko zvýšení mamografické denzity při užívání tibolonu v této studii činilo 0,12 (0,04–0,37) (15).
Průkazem dlouhodobé bezpečnosti tibolonu z pohledu mamografické denzity jsou výsledky 10letého sledování 22 žen užívajících tibolon a 10 žen bez léčby, přičemž nebyl zaznamenán rozdíl v mamografické denzitě mezi skupinami před léčbou a po ní (16).
V roční studii na 260 ženách s fibrocystickou mastopatií (kterým byly podávány placebo, tibolon, CEE, CEE + MPA, E2 transdermální + MPA, E2 transdermální) došlo pouze ve skupině s tibolonem k významné změně, a to ke zmenšení průměrné velikosti cyst ze 7,29 ± 2,48 mm na 2,0 ± 3,68 mm (p < 0,001) (17).
Ve výše citované studii, kterou publikovali Lundström et al. (15) byl prokázán i významně (p < 0,001) nižší výskyt mastodynií po tibolonu (3,6 %) oproti E2 + NETA (33 %). Toto zjištění odpovídá dřívějším nálezům srovnávajícím tibolon s CEE+ MPA, jež publikovali Hammar et al. (18) na souboru 437 žen (20 % vs. 54 %; p < 0,0001), Huber et al. (19) na souboru 501 žen (2,4 % vs. 17,1 %; p < 0,0001) a další.
Jediná významná studie ukazující zvýšení rizika karcinomu prsu u žen užívajících tibolon byla Million Women Study (MWS) (20). V souboru 1 084 110 žen sledovaných po dobu 2,6 roku bylo zachyceno 9364 případů karcinomu prsu, incidence tedy v této studii činila 3,3 případu na 1000 žen a rok. Z údajů pacientek pak vyšlo neobvykle vysoké relativní riziko (RR) pro uživatelky tibolonu 1,44 (95% interval spolehlivosti [CI] 1,25–1,65) při RR pro čistě estrogenní substituci 1,3 a estrogen-gestagenní kombinaci 2,0.
Nicméně jiná – rovněž britská – studie (GPRD) na populaci 500 tisíc žen za 7 let zaznamenala pouze 6347 případů karcinomu prsu, tedy incidenci 1,8 případu na 1000 žen a rok. Obdobná incidence 2,0 byla zaznamenána i ve skupině žen, jež odmítly účast ve studii MWS, která původně oslovila kolem 3 milionů žen. V MWS užívalo HRT 52 % žen, v GPRD jen 32 %.
Zcela nezvyklý a biologicky obtížně vysvětlitelný je také prudký nárůst relativního rizika na 1,45 pro všechny uživatelky HRT v MWS již v prvním roce užívání (95% CI 1,14–1,78). Ve studii bylo jen 6 % žen užívajících tibolon a hodnocení zcela opomíjí fakt, že tibolon byl v té době předepisován právě ženám ve vyšším riziku karcinomu prsu.
VELKÉ RANDOMIZOVANÉ STUDIE
V prvním desetiletí 21. století proběhlo s tibolonem několik rozsáhlých, a tedy i nákladných multicentrických randomizovaných studií (tab. 3). Byly vedeny snahou o rozšíření užívání tibolonu ve Spojených státech amerických a prokázání jeho absolutní bezpečnosti ve vztahu ke karcinomu prsu. Selhání těchto snah a současné ukončení ochrany patentu tibolonu před generickými firmami znamenalo na jistou dobu konec jeho odborné propagace.
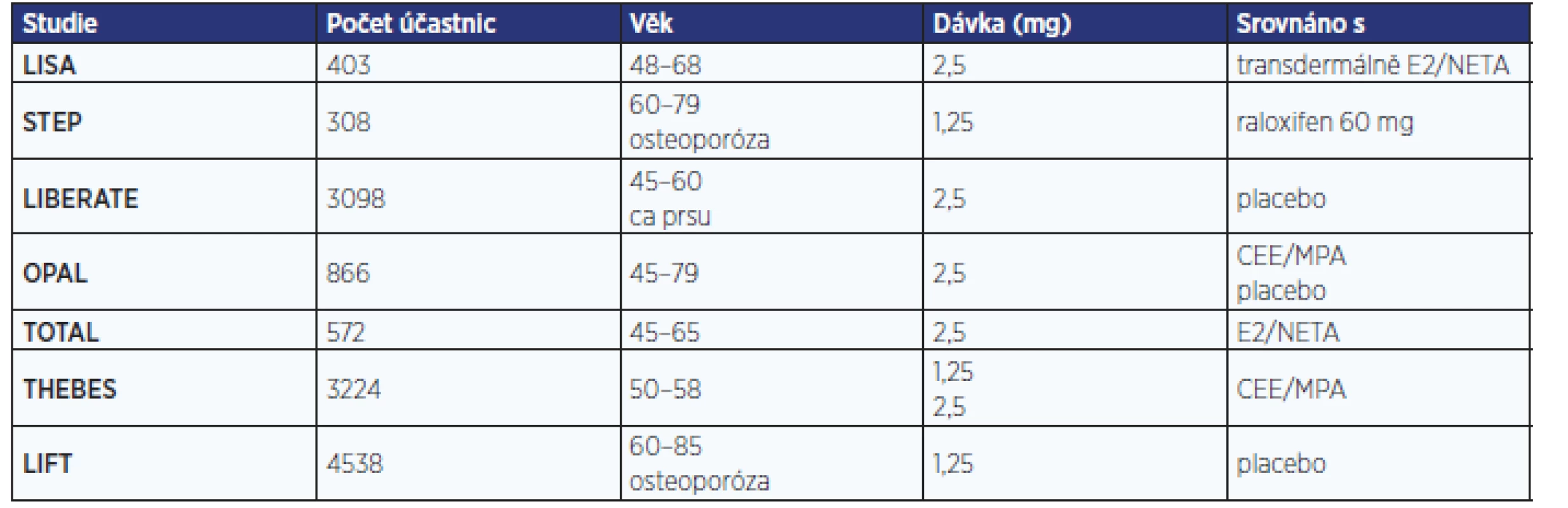
Studie LISA (Livial International study in Sexual Arousal disorders) srovnávala sexualitu, krvácení a mastodynie v souboru 403 žen průměrného věku 56 let randomizovaných na 24 týdnů k užívání 2,5 mg tibolonu nebo transdermální kombinaci 0,05 mg estradiolu + 0,14 mg norethisteron acetátu. Zlepšení sexuality podle Female Sexual Function Index (FSFI) bylo stejné pro obě skupiny ve 12. týdnu, ale významně (p = 0,025) vyšší po 24 týdnech užívání tibolonu. V obou skupinách došlo k významnému poklesu skóre Female Sexual Distress Scale (p < 0,001). V případě tibolonu byla lepší kontrola krvácení (24 % vs. 76 % žen s krvácením; p < 0,001) jak ve formě špinění (v týdnu 1–12 16 % vs. 56 %; p < 0,001, v týdnu 13–24 12 % vs. 51 %; p < 0,001), tak ve formě silnějšího krvácení (0 % vs. 11 %; p < 0,001). Při užívání tibolonu byl rovněž nižší (4 % vs. 11 %; p = 0,015) výskyt bolesti prsů (21, 22).
STEP (Study of Tibolone’s Effect on osteoPenia) je dvojitě zaslepená srovnávací studie s podáváním 1,25 mg tibolonu a 60 mg raloxifenu postmenopauzálním osteopenickým ženám ve věku 60–69 let. V souboru 308 žen oba léky významně zvyšovaly kostní denzitu (BMD – bone mineral density). Tibolon prokázal oproti raloxifenu vyšší zvýšení BMD v bederní páteři (v prvním roce 2,2 % vs. 1,2 %, p < 0,01; ve 2. roce 3,8 % vs. 2,1 %, p < 0,001) i v krčku kosti stehenní (p < 0,005). Snížení hodnot C-telopeptidu, kolagenu I i osteokalcinu bylo významné při obou modalitách (23).
Studie LIFT (Long term Intervention on Fractures with Tibolone) sledovala vznik nových osteoporotických zlomenin u 4538 postmenopauzálních žen ve věku 60–85 let s osteoporózou (T-skóre ≤ –2,5 nebo ≥ –2,0 při současné zlomenině obratle) při podávání 1,25 mg tibolonu nebo placeba současně s vitaminem D a kalciem. 3leté sledování bylo ukončeno v roce 2006 s prodloužením o další 2 roky, které však bylo zastaveno pro nárůst incidence cévních mozkových příhod. Studie LIFT prokázala zlepšení kostní minerální denzity v obou lokalitách (bederní páteři, krčku kosti stehenní), snížení zlomenin obratlů s RR 0,55 (95% CI 0,41–0,74; p < 0,001) a mimoobratlových zlomenin s RR 0,74 (95% CI 0,58–0,93; p = 0,01) s vyšším účinkem u žen s anamnézou zlomeniny. Skupina s tibolonem měla i nižší výskyt karcinomu prsu s RR 0,32 (95% CI 0,13–0,82; p = 0,02) a kolorektálního karcinomu s RR 0,31 (95% CI 0,1–0,96; p = 0,04). Přes neutrální vliv na kardiovaskulární a tromboembolické nemoci došlo k nárůstu cévních mozkových příhod s RR 2,19 (95% CI 1,14–4,23; 1,2 % vs. 0,6 %; p = 0,02) (24).
Studie LIBERATE (Livial Intervention following Breast Cancer Efficacy, Recurrence and Tolerability, Endpoint) byla postavena na 5leté aplikaci 2,5 mg tibolonu nebo placeba u 2600 symptomatických žen s anamnézou karcinomu prsu. V letech 2002–2004 bylo v 245 centrech 31 zemí randomizováno 3148 žen s anamnézou operačního řešení karcinomu prsu ve stadiu T1–3 N0–2 M0 s vazomotorickými příznaky akutního klimakterického syndromu: 1556 žen užívalo tibolon, 1542 placebo, jejich průměrný věk činil 52,7 ± 7,3 roku, odstup od operace 2,1 ± 1,3 roku, 58 % zařazených pacientek mělo při operaci metastázy v uzlinách, 71 % bylo ER-pozitivních, 67 % užívalo tamoxifen a 6,5 % inhibitory aromatáz. Příznaky akutního klimakterického syndromu poklesly o více než 55 % při užívání tibolonu a přibližně o 30 % při užívání placeba. Také kostní minerální denzita byla významně vyšší ve srovnání s placebem. Studie byla předčasně ukončena průměrně po 3,1 roku léčby. V této extrémně rizikové skupině vedl tibolon ke zvýšení RR recidivy karcinomu prsu na 1,4 (95% CI 1,14–1,7; p = 0,001) s 237 (15,2 %) případy po tibolonu a 165 (10,7 %) případy po placebu (25).
THEBES (Tibolone Histology on the Endometrium and Breast Endpoints Study) je multicentrická randomizovaná dvojitě zaslepená studie, která pomocí biopsie endometria hodnotila bezpečnost 2letého podávání tibolonu v dávce 1,25 mg nebo 2,5 mg oproti CEE 0,625 mg/MPA 2,5 mg (v poměru 1 : 1 : 2) v souboru zdravých postmenopauzálních žen. Screening podstoupilo 5185 žen, randomizováno bylo 4446 žen, zařazeny byly pouze ženy s atrofickým (87,29 %) a inaktivním endometriem (0,25 %). Výsledný soubor tedy zahrnoval 3240 žen průměrného věku 54,4 ± 4,4 roku s odstupem od menopauzy 4,5 ± 3,6 roku. Studie potvrdila bezpečnost obou dávek tibolonu pro endometrium (0 případů hyperplazie endometria vs. 2 případy pro CEE/MPA). Amenorea byla referována v 78,7 % případů pro 1,25 mg tibolonu, 71,4 % pro 2,5 mg tibolonu a 44,9 % pro CEE/MPA. Výskyt bolesti prsů byl oproti HRT nižší pro obě dávkování tibolonu (4 % vs. 13 %; p < 0,001) (26, 27).
TOTAL (Trial to Compare the Effects of Tibolone and Continuous Combined Low-Dose Estradiol/Noresterone) je multicentrická studie randomizující 572 symptomatických postmenopauzálních žen ve věku 45–65 let pro 2,5 mg tibolonu, nebo 1 mg estradiolu/0,5 mg norethisteron acetátu. Studie prokázala identické snížení návalů a příznivý účinek na poševní sliznici ve srovnání s HRT při významně lepším profilu vaginálního špinění a krvácení po 3 měsících (18,3 % vs. 33,1 %; p < 0,001) i 9 měsících (11 % vs. 19 %; p < 0,05). Tibolon byl spojen s nižší prevalencí bolestí prsů oproti nízkodávkované HRT (3,2 % vs. 9,8 %; p < 0,001) (28).
Studie OPAL (Osteoporosis Prevention and Arterial effects of tiboLone) sledovala 3 roky soubor 866 žen ve věku 45–79 let randomizovaných k tibolonu 2,5 mg a CEE 0,625 mg/MPA 2,5 mg nebo k placebu s primárními cíli: stavem cévní stěny arteria carotis měřením tloušťky intima-media a kostní denzita bederní páteře a krčku kosti stehenní u zdravých postmenopauzálních žen. Tibolon snížil koncentraci triglyceridů i cholesterolu a obou jeho frakcí, zatímco HRT příznivě zvýšila koncentraci HDL cholesterolu při stejném nárůstu tloušťky komplexu intima-media karotid (TIM). Roční nárůst TIM při užívání tibolonu činil 0,0077 mm (95% CI 0,0051–0,0103), při CEE/MPA 0,0074 mm (95% CI 0,0048–0,0099), v placebové skupině 0,0035 mm (0,0009–0,0061), tedy u obou léčebných skupin významně vyšší než při podávání placeba. Obtížnost interpretace studie ukazuje fakt, že v placebové skupině se v Evropě TIM snižuje a v USA zvyšuje (29, 30).
ZÁVĚR
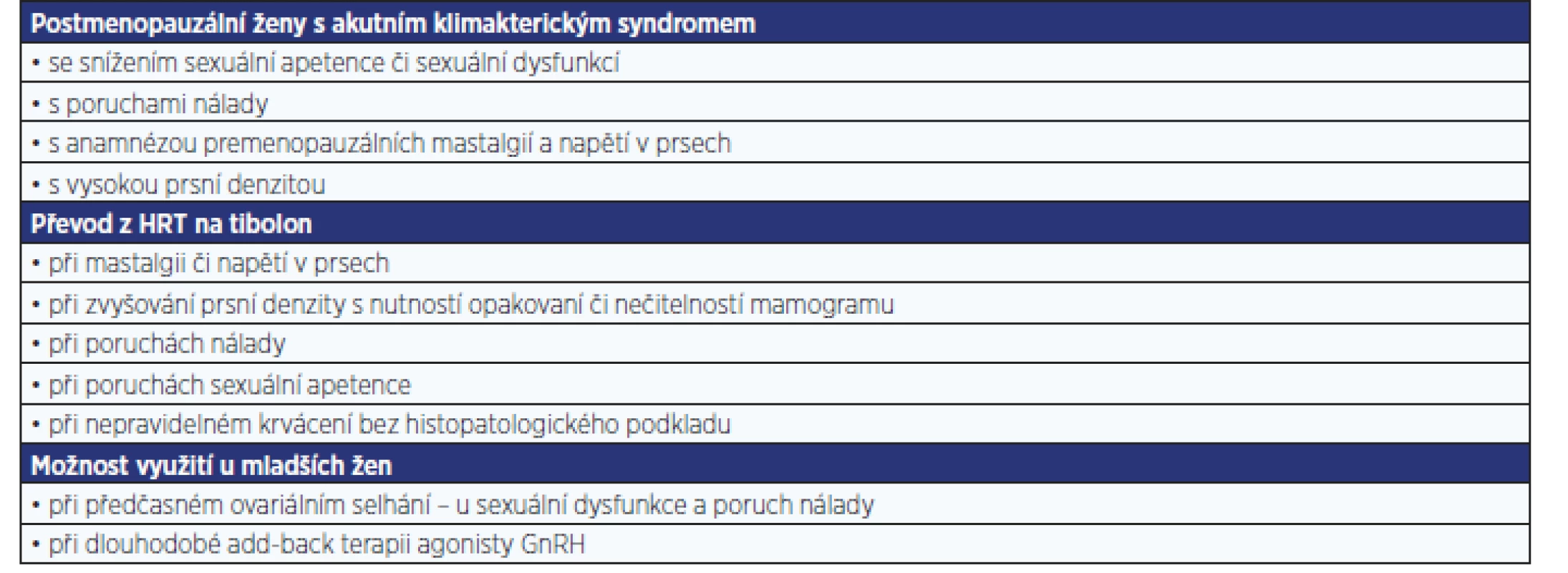
V léčbě akutního klimakterického syndromu je tibolon plně srovnatelný s dostupnými modalitami HRT. Lepších výsledků dosahuje v oblasti ovlivnění psychiky a sexuality postmenopauzálních žen. Z hlediska bezpečnosti je zcela prokázán jeho příznivý vliv na mamografickou denzitu. Tibolon je tak srovnatelně bezpečný s estrogenní terapií a pravděpodobně bezpečnější než estrogen-gestagenní léčba.
Tibolon by měl být primárně volen u postmenopauzálních žen s poruchami sexuality a nálady, s mastalgiemi a vysokou prsní denzitou. Také ženy již užívající HRT se stejnými problémy nebo s nepravidelným krvácením bez histologického podkladu by měly být převedeny z HRT na tibolon.
Adresa pro korespondenci:
doc. MUDr. Tomáš Fait, Ph.D.
Gynekologicko-porodnická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
Tel.: 224 434 258
e-mail: tomas.fait@fnmotol.cz
Sources
-
Landgren MB, Coelingh Bennink HJT, Helmond FA et al. Dose response analysis of effect of tibolone on climacteric symptoms. Br J Obstet Gynaecol 2002; 109 : 1109–1114.
-
Hammar M, Christau S, Nathorst-Boos J et al. A double blind randomised trial comparing the effects of tibolone and continuous combined hormone replacement therapy in postmenopausal symptoms. Br J Obstet Gynaecol 1998; 105 : 904–911.
-
Huber J, Palacios S, Berglund L et al. The effect of tibolone compared with CEE continuously combined with medroxyprogesterone acetate on bleeding rates, quality of life and tolerability in postmenopausal women, Br J Obstet Gynaecol 2002; 109 : 886–893.
-
Mendoza N, Pison JA, Fernandez M et al. Prospective, randomised study with three HRT regimens in postmenopausal women with an intact uterus. Maturitas 2002; 41 : 289–298.
-
Baracat EC, Barbosa IC, Giordano MG et al. A randomized, open-label study of conjugated equine estrogens plus medroxyprogesterone acetate versus tibolone. Climacteric 2002; 5 : 60–69.
-
Davis SR. The effect of tibolone on mood and libido. Menopause 2002; 9 : 162–170.
-
Tax L, Goorissen EM, Kucovic PM. Clinical profile Org OD14. Maturitas 1987 (Suppl 1): 3–13.
-
Lindsay PC, Shaw RW, Coeling Benning HJ et al. The effect of add back treatment with tibolone on patients treated with the GnRH agonist triptorelin. Fertil Steril 1996; 65 : 342–348.
-
Palomba S, Affinito P, Di Carlo C et al. Long-term administration of tibolone plus GnRH agonist for the treatment of uterine leiomyomas. Fertil Steril 1999; 72 : 889–895.
-
Egarter C, Sator M, Berghammer P et al. Efficacy, tolerability, and rare side effects of tibolone treatment in postmenopausal women. Int J Gynecol Obstet 1999; 64 : 281–286.
-
Kenemans P, Speroff L. Tibolone: clinical recommendations and practical guidelines. Maturitas 2005; 51 : 21–28.
-
Meeuwsen IB, Samson MM, Duursma SA et al. The influence of tibolone on quality of life in postmenopausal women. Maturitas 2002; 41 : 35–43.
-
Fait T, Žižka Z. Mammographic density – a risk factor for breast cancer. Prague Medical Report 2007; 108 : 205–214.
-
Valdivia I, Campodónico I, Capia A et al. Effects of tibolone and continuous combined hormone therapy on mammographic breast density and breast histochemical markers in postmenopausal women. Fertil Steril 2004; 81 : 617–623.
-
Lundström E, Christow A, Kersemaekers W et al. Effects of tibolone and continuous combined hormone replacement therapy on mammographic breast density. AJOG 2002; 186 : 717–722.
-
Bruce D, Robinson J, McWilliams S et al. Long‑term effects of tibolone on mammographic density. Fertil Steril 2004; 82 : 1343–1347.
-
Yenen MC, Dede M, Goktolga U et al. Hormone replacement therapy in postmenopausal women with benign fibrocystic mastopathy. Climacteric 2003; 6 : 146–150.
-
Hammar M, Christau S, Nathorst-Boos J et al. A double blind, randomised trial comparing the effects of tibolone and continuous combined hormone replacement therapy in postmenopausal women with menopausal symptoms BJOG 1998; 105 : 904–911.
-
Huber J, Palacios S, Berglund L et al. Effects of tibolone and continuous combined hormone replacement therapy on bleeding rates, quality of life and tolerability in postmenopausal women. BJOG 2002; 109 : 886–893.
-
Speroff L. The Million Women Study and breast cancer. Maturitas 2003; 46 : 1–6.
-
Nijland EA, Nathorst-Boos J, Palacios S et al. Improved bleeding profile and tolerability of tibolone versus transdermal E2/NETA treatment in postmenopausal women with female sexual disfunction. Climacteric 2009; 12 : 114–121.
-
Nijland EA, Weijmar Schultz WC, Nathorst-Boos J et al. Tibolone and E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women. J Sex Med 2008; 5 : 646–656.
-
Delmas PD, Davis SR, Hensen J et al. Effects of tibolone and raloxifene on bone mineral density in osteopenic postmenopausal women. Osteoporos Int 2008; 19 : 1153–1160.
-
Cummings SR, Ettinger B, Delmas PD et al. The effect of tibolone in older postmenopausal women. N Engl J Med 2008; 359 : 697–708.
-
Kenemans P, Bundred NJ, Foidart JM et al. Safety and efficacy of tibolone in breast cancer patients with vasomotor symptoms: a double-blind randomised, non-inferiority trial. Lancet Oncol 2009; 10 : 135–146.
-
Archer DF, Hendrix S, Ferenczy A et al. Tibolone histology of the endometrium and breast endpoints study. Fertil Steril 2007; 88 : 866–878.
-
Archer DF, Hendrix S, Gallagher JC et al. Endometrial effects of tibolone. J Clin Endocrinol Metab 2007; 92 : 911–918.
-
Hammar ML, van de Weijer P, Franke HR et al. Tibolone and low-dose continuous combined hormone treatment: vaginal bleeding pattern, efficacy and tolerability. BJOG 2007; 114 : 1522–1529.
-
Bots ML, Evans GW, Riley W et al. The effect of tibolone and continuous combined CEE plus MPA on progression of CIM thickness. Eur Heart J 2006; 27 : 746–755.
-
Langer RD, Landgren BM, Rymer J, Helmond FA. Effects of tibolone and continuous CEE/MPA on the endometrium and vaginal bleeding. AJOG 2006; 195 : 1320–1327.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

2019 Issue 3-4
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Úvodem
- Editorial
- Vzpomínky aneb honem, než to zapomenu
- Mezinárodní konference o biobankách Dauhá, 25.–27. března 2019
- Michael Stuart Brown (1941–) a Joseph Leonard Goldstein (1940–)
- Odešel jeden z nejznámějších českých lékařů profesor Josef Koutecký
- Profesor Jan Pfeiffer zemřel
- Genitourinary syndrome of menopause: hard to communicate, easy to treat
- Tibolon – the only one member of STEAR’s group
- Sedentary behaviour and adiposity in community-dwelling women aged 55 and older
- Impact of the mother’s age at childbirth on the birth weight of new-born children
- Reproduction ageing in Czechia in the European context
- Postponing parenthood to advanced age and its possible consequences
- Importance of vitamin D in gynecology
- Recommended fluid intake and evidence-based medicine
- Evaluation of the personalized invitation of Czech citizens to screening programs
- How to reduce stigmatization of people with mental illness in medical education: READ intervention
- Přednáškové večery spolku českých lékařů v Praze (ZÁŘÍ 2019)
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Tibolon – the only one member of STEAR’s group
- Genitourinary syndrome of menopause: hard to communicate, easy to treat
- Impact of the mother’s age at childbirth on the birth weight of new-born children
- Recommended fluid intake and evidence-based medicine