Maligní somatostatinom (stručný přehled a kazuistika)
Malignant Somatostatinoma (Brief Overview and a Case Review)
Introduction:
Somatostatinoma is a rare, slowly growing tumor with malignity potential, most commonly located in the pancreas or duodenum. By the time its diagnosis is established, it is usually large and liver metastases are present. Increased concentrations of somatostatin, produced by pancreatic D cells or by intestinal mucosa, inihibit secretion of a number of GIT hormones, endocrine and exocrine pancreatic secretion. The clinical findings include symptoms of diabetes, dyspepsia, diarrhoea, steatorhoea, abdominal pain, hypochlorhydria, anemia. Sometimes, the finding is accidental.
A case review:
The authors present a case of somatostatinoma, detected accidentaly in a 72 - year - old male. The tumor originated from the pancreatic head, partially spreading invasively into surrounding organs (duodenum), invading blood vessels and metastazing into peripancreatic lymphonodes. The tumor was asymptomatic and was detected as an accidental finding on ultrasound and CT abdominal examinations for the patient’s urological disorder (vesicolithiasis)
Pylorus saving hemipancreatoduodenectomy was performed and, on microscopic and subsequent immunohistochemical examination of the resecate, a well - differentiated endocrine, somatostatin - producing pancreatic carcinoma was verified.
Key words:
malignant somatostatinoma – accidental detection of the tumor – hemipancreatoduodenectomy – verification by a pathologist
Authors:
M. Pešková 1; R. Hvižď 1; J. Dušková 2
Authors‘ workplace:
1. chirurgická klinika 1. LF UK a VFN Praha
1; Ústav patologie 1. LF UK a VFN a Katedra patologie IPVZ Praha
2
Published in:
Rozhl. Chir., 2007, roč. 86, č. 12, s. 643-647.
Category:
Monothematic special - Original
Overview
Úvod:
Somatostatinom je vzácný, pomalu rostoucí nádor s maligním potenciálem, nejčastěji se nacházející v pankreatu nebo v duodenu. V době stanovení diagnózy dosahuje už větších rozměrů a v játrech bývají metastázy. Zvýšená hladina somatostatinu produkovaného D buňkami pankreatu nebo sliznicí trávicího ústrojí působí inhibičně na řadu hormonů trávicího ústrojí i vnitřní a zevní sekrece pankreatu. V klinickém obrazu jsou projevy diabetu, dyspepsie, průjmy, steatorea, bolesti břicha, hypochlorhydrie, anémie. Někdy jde o náhodný nález.
Kazuistika:
O takovém náhodném nálezu u 72letého muže referují autoři. Nádor vycházel z oblasti hlavy slinivky břišní s částečným invazivním šířením do okolních orgánů (duodenum) s prorůstáním do cév a s metastázami do peripankreatických lymfatických uzlin. Nádor byl asymptomatický a byl prokázán náhodně při US a CT vyšetření břicha u pacienta s urologickým onemocněním (vezikolitiáza).
U nemocného byla provedena pylorus šetřící hemipankreatoduodenektomie a v resekátu až histopatology verifikován pomocí ikroskopického a následně imunohistochemického vyšetření dobře diferencovaný endokrinní karcinom slinivky s produkcí somatostatinu.
Klíčová slova:
maligní somatostatinom – náhodný záchyt tumoru – hemipankreatoduodenektomie – verifikace patologem
ÚVOD
Somatostatinomy jsou velmi vzácnými nádory trávicího ústrojí. Přibližně 60 % somatostatinomů pochází z horní části GIT, pravděpodobně v souvislosti s přítomností relativně velkého množství D-buněk v této oblasti. Mají tendenci k rozsáhlému růstu, podobně jako glukagonom, na rozdíl od inzulinomu a gastrinomu, které bývají zpravidla malé.
Jsou lokalizované nejčastěji v hlavě pankreatu a v periampulární oblasti duodena, zcela výjimečně v ostatních částech trávicí trubice, nebo i ve žlučových cestách, v plicích a v kostech [1, 2]. V 93,1 % jsou solitární, mohou ale být i součástí mnohočetné endokrinní neoplazie, (MEN I – v 6,9 %), nebo souviset s feochromocytomem a Recklinghausenovou neurofibromatózou v rámci MEN 2 [2].
Jejich velikost je udávána od 2,5 (v duodenu) do 5 cm (v pankreatu), ale jsou popsány i tumory větší 10 cm. Obvykle jsou maligní (65 %) s metastázami v uzlinách a játrech (27,7 %) [2, 6]. Incidence je uváděna počtem 1 na 40 milionů. Nejsou odlišnosti pokud jde o pohlaví a vyskytují se nejčastěji mezi 40–60 roky věku [6].
Poprvé a nezávisle na sobě popsali první případy somatostatinomu Ganda a Larsson v r. 1977, a biochemické, morfologické a klinické charakteristiky pak popsal Krejs v r. 1979 [2, 6].
Somatostatin (SRIF-somatotropin release inhibitory factor,) je tetradecapeptid produkovaný D-buňkami Langerhansových ostrůvků pankreatu a střevní sliznicí, který ovlivňuje řadu endokrinně a exokrinně sekretorických funkcí [8]. Potlačuje uvolnění růstového hormonu a mezi další hormony ovlivňované SRIF patří inzulin, pankreatický polypeptid (PP), glukagon, gastrin, sekretin, žaludeční inhibiční polypeptid (GIP). Kromě inhibice endokrinní sekrece má SRIF přímé účinky i na několik cílových orgánů: je silným inhibitorem bazální a stimulované sekrece žaludeční kyseliny (to má významný vliv na pasáž trávicím ústrojím, střevní motilitu a vstřebávání živin z tenkého střeva), zpomaluje např. resorpci tuků a vápníku, působí jako inhibitor pankreatické sekrece proteolytických enzymů, vody, bikarbonátů. Somatostatin v nadprodukci nebo podaný v infuzi zpomaluje evakuaci žlučníku a může tak zapříčinit vznik cholelitiázy.
Klinicky se tyto nádory mohou manifestovat jednak známkami hypersekrece somatostatinu v podobě inhibičního syndromu (častěji při pankreatické lokalizaci – až v 66 %), jednak velikostí a lokalizací tumoru.
Inhibiční syndrom z nadprodukce somatostatinu zahrnuje diabetes mellitus nebo glukózovou intoleranci, cholecystolitiázu, průjmy se steatoreou nebo bez ní, hypochlorhydrii až achlorhydrii, úbytek hmotnosti. Je daleko častější u pankreatických lokalizací (18,5–66 %), proti 1,2 % u tumorů duodenálních. Velikost a lokalizace tumoru může zapříčinit obstrukční ikterus, stenózu duodena, krvácení do trávicího ústrojí. Onemocnění žlučníku se vyskytuje u 59 % pacientů s pankreatickými nádory a 27 % pacientů se střevními nádory. K úbytku na hmotnosti v rozsahu od 9 do 21 kg během několika měsíců dochází pouze u jedné třetiny pacientů s pankreatickými nádory a jedné pětiny pacientů se střevními nádory [2, 7].
KAZUISTIKA
Pacient, 72 let, byl v listopadu 2005 operován pro benigní hyperplazii prostaty. Pro recidivující urologické obtíže byl v r. 2006 znovu vyšetřen a zjištěna mnohočetná drobná vezikolitiáza. Následně byla plánována lito-trypse, ale pacient konkrementy vymočil a při ultrasonografické (US) kontrole před výkonem nebyly prokázány. Byl pak odeslán ještě ke kontrolnímu CT vyšetření břicha, při němž byl zjištěn nález v oblasti hlavy pankreatu. Pacient byl v té době zcela bez subjektivních obtíží, bolesti břicha neměl, nezhubnul.
Z anamnézy: v mládí vážněji nestonal, prodělal 2 operace menisku levého kolene, 7 let léčen pro tachyfibrilaci síní, prodělal kardioverzi, dále léčen pro arteriální hypertenzi, hyperlipoproteinémii. Před 4 lety prodělal centrální mozkovou příhodu bez reziduální symptomatologie. V rámci předoperačního vyšetření byla u něj zjištěna dosud asymptomatická cholelititáza. Chuť k jídlu měl normální, trávení bez poruch, stolice pravidelná, bez průjmů. Abúzus alkoholu neuváděl. V rodině 3 sestry zemřely na blíže nespecifikovanou malignitu, matka zemřela na TBC, jeden syn zemřel v 18 letech na nádor mozku, druhý syn zdráv.
Vyšetření: Při US břicha byl popsán nejasný nález v oblasti hlavy pankreatu či hilu jater. Na CT skenech se zobrazila objemná ohraničená expanze hlavy pankreatu s převážně hypodenzní složkou i charakteru cystoidů, s těsným vztahem k portě a zcela zaujímající cévy pro pravou ledvinu (Obr. 1). Nález má charakter mucinózního adenomu slinivky, dif. dg. kystadenokarcinom. Doplněna endoskopická ultrasonografie (EUS) pankreatu a popsán objemný cystický tumor (cystický adenom?) hlavy pankreatu, který odtlačuje okolní struktury, obkružuje množství cévních struktur, ale nemá zřetelné známky angioinvaze a nezdá se, že by invazivně prorůstal do okolních orgánů. Dále zjištěn ampulom, velikosti asi 2 cm, ohraničený, neinvazivního charakteru, a regionální lymfadenopatie s maximem v oblasti truncus coeliacus. Odebrána tenkojehlová aspirační biospie tumoru, vzhledem ke spornému nálezu vzorek odeslán ještě na konzultaci do Prahy, se závěrem, že nelze jednoznačně rozhodnout, zda se jedná o afekci benigní, nebo dobře diferencovaný zhoubný nádor. Charakter nádorových buněk a uspořádání, zejména v některých úsecích by mohlo svědčit pro nádorovou afekci s neuroendokrinními rysy.
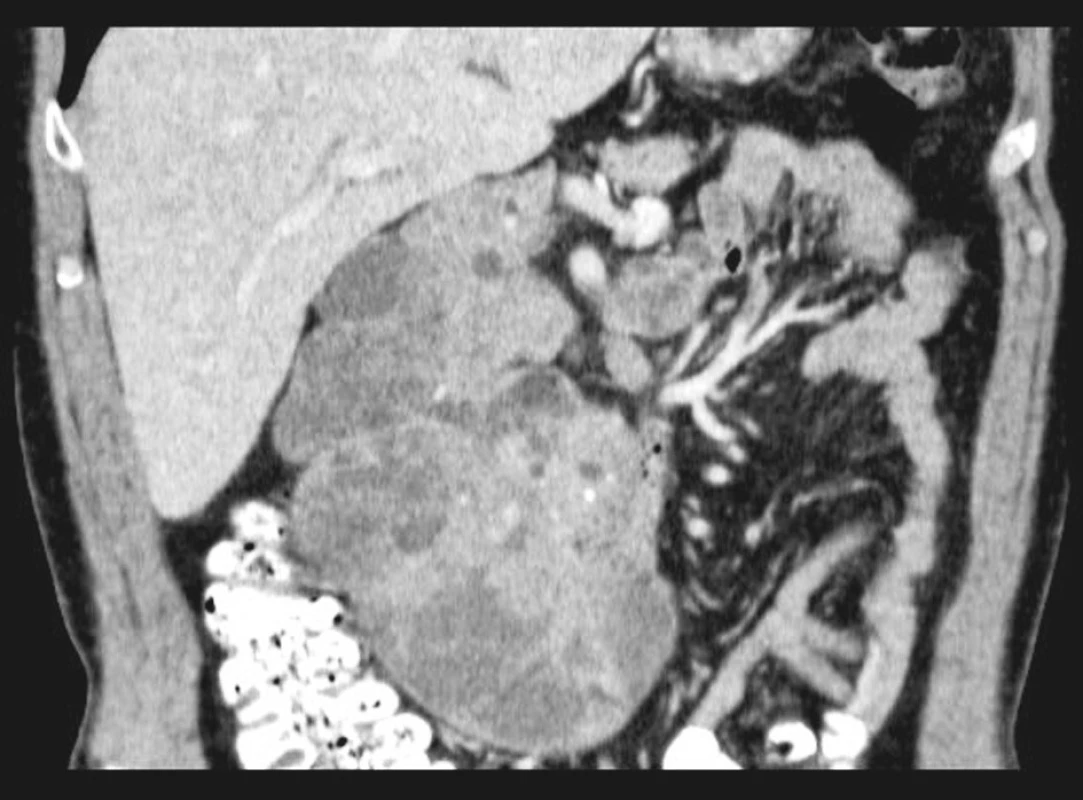
Před plánovanou operací byla provedena základní laboratorní vyšetření, včetně onkomarkerů, a stolice na OK, bez nálezu patologických hodnot. Transtorakální echokardiografie prokázala dobrou funkci levé komory srdeční a známky diastolické dysfunkce.
Operace: Při laparotomii ve shodě s předoperačními vyšetřeními nalezen objemný jakoby polycystický útvar retroduodenálně a paraduodenálně se vyklenující z retroperitonea. Dutinové útvary vyplněné spíše vodnatým než mucinózním obsahem byly velikosti mandarinky až velké pěsti a souvisely jak se stěnou duodena, tak s tkání hlavy slinivky. Část jich zasahovala kaudálně až k dolnímu pólu pravé ledviny, kraniálně až pod portální žílu do ligamenta hepatoduodenálního, a mediálně až za radix mezenteria doleva k duodenojejunálnímu ohbí. Část těchto tenkostěnných útvarů se při manipulaci vyprázdnila. Peroperační nález (Obr. 2). Cholecystolitiáza byla potvrzena a jiné patologické změny v břišní dutině nebyla prokázány. Byla provedena pylorus šetřící hemipakreatduodenektomie s cholecystektomií.
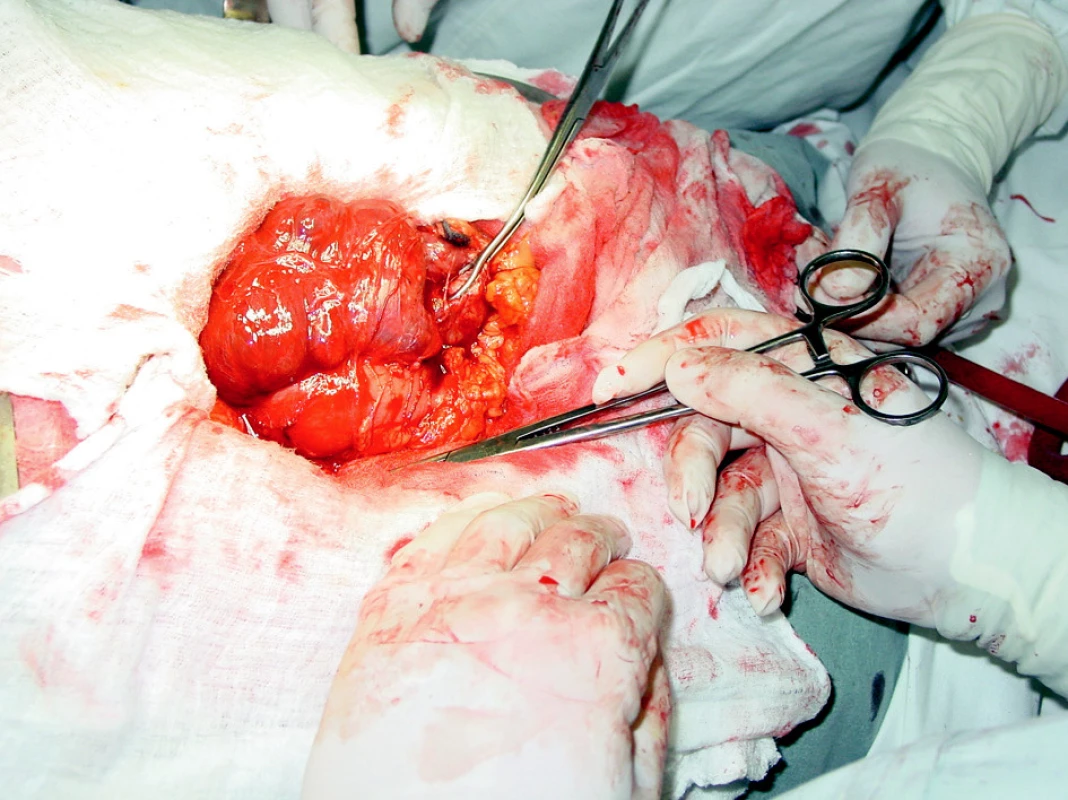
Pooperační bioptické vyšetření: k vyšetření byl zaslán 1. žlučník, 2. tumor slinivky v částech a 3. resekát hlavy slinivky s tumorem a duodenem, s protruzí části nádoru do stěny duodena považovaném z endoskopického pohledu za ampulom (Obr. 3).
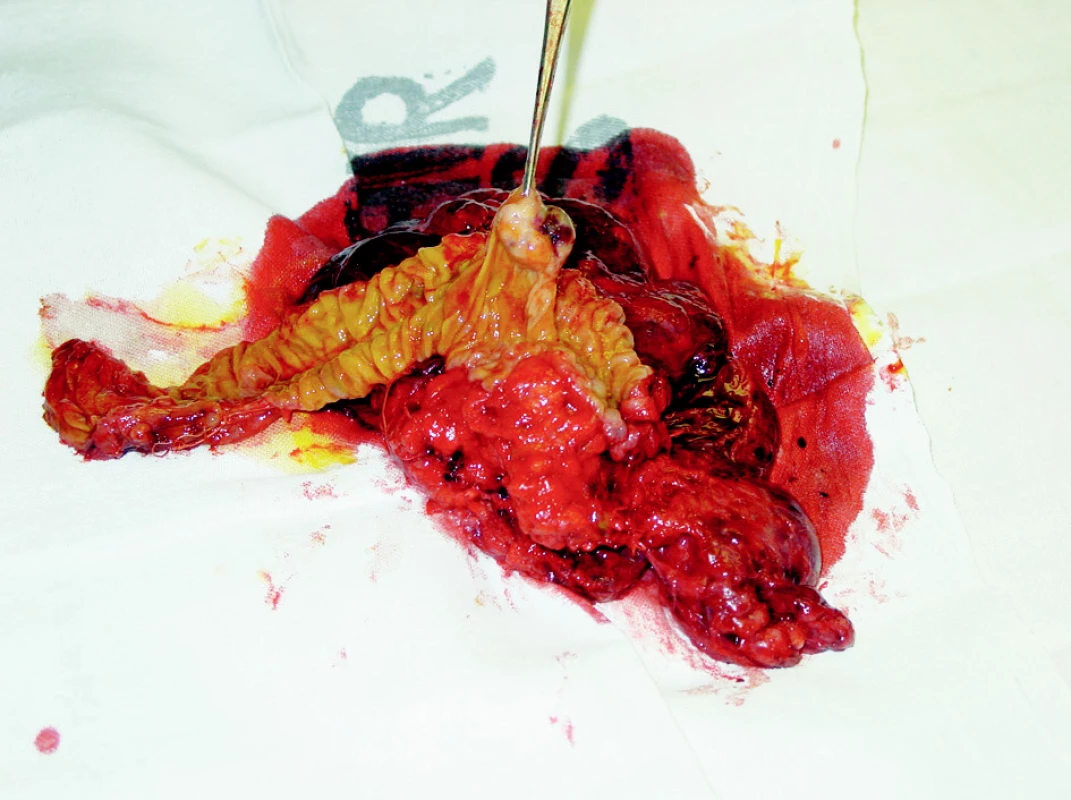
- Rozstřižený žlučník 60x50x2 mm. Histologicky ve dvou excizích se známkami mírné chronické cholecystitidy.
- Celkem 5 částek o velikosti od 15x10x5 mm do 40x20x15 mm, na řezu v částkách patrna bělavá ložiska, v některých zřejmé dutiny. Histologicky v 5 excizích nádorová infiltrace dobře diferencovaným endokrinním karcinomem, ležící zčásti v tukové tkáni a v některých excizích se zřejmými zbytky nádorově nahražených lymfatických uzlin.
- Resekát o celkové velikosti 170x120x55 mm obsahující rozstřižený úsek duodena délky 160 mm, obvod 40 mm, 45 mm od okraje široce přisedlý nádorový uzel 25x20x12 mm bez povrchové ulcerace. K materiálu dále připojen nerozstřižený úsek tenkého střeva délky 110 mm, obvod 40 mm s krvavým obsahem v lumen, bez zřejmých ložiskových změn. Hlava slinivky 80x50x50 mm prokrvácená a prostoupená tumorem. Histologicky z resekátu vyšetřeno celkem 10 excizí, v nichž zachycena stěna duodenální s prominujícím nádorovým uzlem charakteru dobře diferencovaného endokrinního karcinomu, který se v makroskopicky patrném duodenálním tumoru vtlačuje pod sliznici převážně bez destrukce, pouze v jednom úseku v nevelkém rozsahu sliznice zřejmě zvnitřku narušena. Další excize zachycují hlavu slinivky rozsáhle nahraženou dobře diferencovaným endokrinním karcinomem převážně solidně trabekulárně upraveným. Barvení alciánovou modří a metodou PAS negativní. Imunohistochemicky byl nádor negativní v průkazu alfa 1-antitrypsinu, CA19-9, ACTH, inzulinu, glukagonu, gastrinu při dobře vyjádřené pozitivitě nenádorových ostrůvkových buněk téhož řezu. Protilátkou proti VIP nedisponujeme. Pozitivně vyzněl průkaz chromograninu, slabě synaptophysinu, somatostatin v nádorových buňkách se slabou až střední pozitivitou při současné dobře vyjádřené pozitivitě nenádorových ostrůvkových buněk téhož řezu. Průkaz MIB1 pozitivní ojediněle, nepřesahuje 3 %. V okolí nádorových čepů zachycena lymfangioinvaze (Obr. 4).
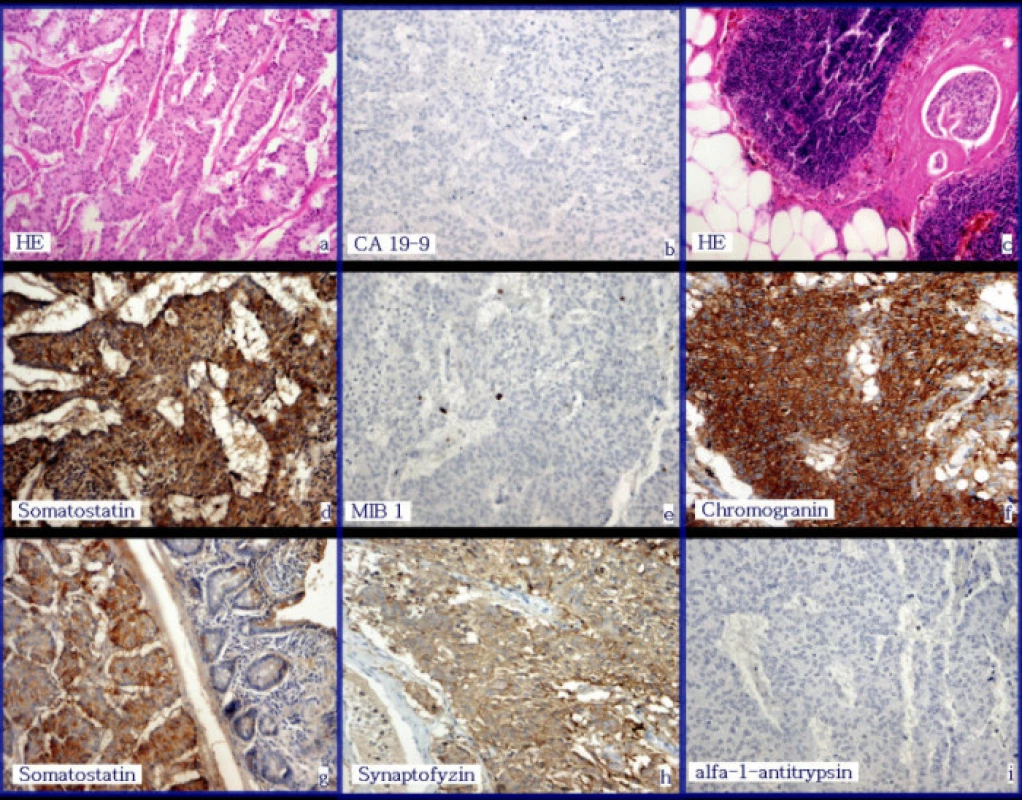
S ohledem na maximum zachycené nádorové infiltrace hodnotíme jako dobře diferencovaný endokrinní karcinom hlavy slinivky s produkcí somatostatinu a metastázami do peripankreatických lymfatických uzlin. T 99 M 81503.
V pooperačním průběhu byla u nemocného přechodná porucha vyprazdňování žaludku, která se upravila během 14 dnů. Při pooperační kontrole po 1 a po 3 měsících od propuštění je pacient bez subjektivních obtíží, přibyl na váze. Námi doporučenou adjuvantní chemoterapii, onkolog v místě bydliště nemocného, zatím neindikoval.
DISKUSE
Diagnóza somatostatinomu může být náhodná při laparotomii, cholecystektomii, nebo při vyšetření zobrazovacími metodami pro různou břišní symptomatologii, ale např. Economopoulos a spol. [2] uvádějí 92,7 % symptomatických somatostatinomů u sebraného souboru 138 pacientů.
Nejčastěji udávaným příznakem, u 40 % nemocných, jsou bolesti břicha, které vedou k vyšetření zobrazovacími metodami a často k víceméně náhodnému nálezu tumoru. Z dalších nejčastějších příznaků jsou úbytek hmotnosti (20–32 %), průjmy (u pankreatických lokalizací až u 60 %), u duodenální lokalizace pak ikterus (38 %). Diabetes mellitus bývá lehký, vyskytuje se u 75 % pacientů s pankreatickými nádory, ale pouze u 11 % pacientů se střevními nádory. Je kompenzovatelný dietou, popřípadě perorálními antidiabetiky, nebo malými dávkami inzulinu.
Tumory v duodenu a v oblasti ampuly se mohou projevit teprve bilární obstrukcí.
Plazmatická koncentrace somatostatinu u pacientů s pankreatickým somatostatinomem může být mnohonásobně, 1–250krát vyšší (15,5 ng/ml, v rozmezí 0,16 – 107 ng/ml) než normální koncentrace u zdravých pacientů, která činí méně než 100 pg/ml), avšak u střevních somatostatinomů mohou být jen mírně zvýšené nebo normální koncentrace [2, 7].
Diagnóza lokalizační, případně průkaz metastáz je pak výsledkem endoskopických vyšetření a vyšetření zobrazovacích, případně laboratorního potvrzení, jestliže se na somatostatinom myslí. Pro definitivní diagnózu somatostatinomu je rozhodující histopatologické a imunohistochemické vyšetření. Úprava odpovídá variantám karcinoidu, určující je průkaz endokrinní diferenciace (pozitivita chromograninu a/nebo synaptofizinu jako obecných markerů a zejména somatostatinu. K vyloučení případné podvojné endo - a exokrinní diferenciace poslouží negativní výsledky průkazu alfa-1-antitrypsinu a CA 19-9.
Chirurgické odstranění tumoru je metodou volby a při maligní variantě adjuvantní chemoterapie. Při nejčastější lokalizaci v hlavě pankreatu a v duodenu je to hemipankreatoduodenektomie, distální pankreatektomie u nádorů v těle a kaudě žlázy, případně i odstranění metastáz. Profylakticky je vhodné provést cholecystektomii.
Protože se tyto nádory vyznačují relativně pomalým růstem, je resekční výkon možný častěji než u duktálního karcinomu pankreatu. Při vzácných střevních lokalizacích je rovněž indikován resekční výkon.
Odstranění (i částečné) velkých metastatických ložisek v játrech může efektivně zmírnit symptomy spojené s nadprodukcí somatostatinu a prodloužit tak dobu přežití. Chemoterapie je používána jako adjuvantní léčba, v případě metastatického postižení a také při recidivě po operaci jako paliace. Klinickou odpověď na chemoterapii u neresekabilních nádorů nebo při metastatickém postižení lze předpokládat asi u 50 % pacientů. Pro paliativní léčbu může být použita jako alternativa i jaterní embolizace. Pacienti s hmotnostními úbytky, anemizací, pankreatickou insuficiencí nebo podvýživou vyžadují symptomatickou léčbu [1, 7].
Prognóza je u maligního somatostatinomu lepší než u karcinomu hlavy slinivky břišní nebo karcinomu žlučových cest. Pětileté přežití může být až v 60 % [2, 6].
ZÁVĚR
Nález somatostatinomu je většinou náhodný, protože identifikovat odstraněný nádor lze až morfologickým vyšetřením, jestliže se předoperačně nevyšetřuje plazmatická hladina somatostatinu, jejíž zvýšení by mohlo na tento vzácný nádor ukazovat. Její stanovení by tedy mohlo být vodítkem v některých případech nevysvětlitelných bolestí břicha, průjmech, postprandiální dyspepsii, biliárních potížích bez prokázané cholelitiázy, nebo u pacientů s diabetem bez rodinné anamnézy. Tyto nálezy tak mohou být časným diagnostickým znamením u somatostatinomu.
Nádor se vyznačuje vysoce maligním potenciálem, a proto je důležité být radikální ve vedení léčby a pokusit se odstranit všechny nádorové tkáně i u benigních variant. U pacientů, u kterých byly nalezeny metastázy již při stanovení diagnózy, je indikováno odstranění nebo alespoň celkové zmenšení (debulking) těchto metastáz, je-li technicky proveditelné. Optimální forma chemoterapie je stanovena onkology (streptozocin, dakarbazin, doxorubicin apod.) a je nejlepší léčbou u neresekabilních nádorů.
Prof. MUDr. M. Pešková, DrSc.
I. chirurgická klinika 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
e-mail: marie.peskova@lf1.cuni.cz
Sources
1. Adam, Z., Vorlíček, J, Vaníček, J., a kol. Neuroendokrinní nádory střeva a pankreatu. In: Diagnostické a léčebné postupy u maligních chorob. Praha: Grada Publishing, s. 127–134.
2. Economopoulos, P., Christopoulos, C. Somatostatinoma syndrome, Annals of Gastroenterology, 2001, 14, 252–260.
3. Ganda, O. P., et al. „Somatostatinoma“ A somatostatin-containing tumor of the endocrine pankreas. N. Engl. J. Med., 1977, 296, 963–967.
4. Krejs, G. J., et al. Somatostatinoma syndrome. Biochemical, Morphologic and Clinical features. N. Engl. J. Med., 1979, 301, 285–292.
5. Larsson, L. I., et al. Pancreatic somatostatinoma. Clinical features and physiological implications. Lancet, 1977, 1, 666–668.
6. Vinik, A. J. Somatostatinoma. Endotext.com, August 2, 2004.
7. Vinik, A. J., Moattari, A. R. Treatment of endocrine tumors of the pancreas. Endokrinol. Metab. Clin. North Am., 1989.
8. Škrha, J., Eliáš, P., Dvořák, M., Fixa, B. Endokrinní nádory trávicího ústrojí. In: Mařatka, Z.: Gastroenterologie. Praha: Karolinum, 1999, s. 473–485.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2007 Issue 12
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Infekce v rekonstrukční cévní chirurgii
- Léčba hepatocelulárního karcinomu a současný stav v České republice
- Maligní somatostatinom (stručný přehled a kazuistika)
- Nejčastěji se vyskytující neuroendokrinní nádor trávicího ústrojí – karcinoid
- ACE operace pro dlouhodobou obstipaci u dospělého
- Hemipelvektomie, konstantní chirurgické dilema
- Současné možnosti ošetření osteoporotických fraktur torakolumbální páteře
- Longova metoda operace hemoroidů a prolapsu sliznice anorekta (PPH) – zkušenosti 8 let
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Longova metoda operace hemoroidů a prolapsu sliznice anorekta (PPH) – zkušenosti 8 let
- Nejčastěji se vyskytující neuroendokrinní nádor trávicího ústrojí – karcinoid
- Maligní somatostatinom (stručný přehled a kazuistika)
- Současné možnosti ošetření osteoporotických fraktur torakolumbální páteře
