Výsledky chirurgické léčby karcinomu žaludku v období 2004–2008
Gastric Carcinoma Surgery Outcomes during 2004–2008
Gastric carcinoma is a malignancy, frequently manifesting itself in late stages, with metastatic spread into lymph nodes. Resection is the only curative therapy. A total of 149 gastric carcinoma patients were operated in the Ist Surgical Clinic during the studied five - year period. The pre-operative disease staging included the PET-CT examination, as a standard. Total gastrectomy (GE) was completed in 109 subjects, while 12 subjects underwent subtotal GE. The both procedures included D2 lymphadenectomy. In selected cases, the surgery included upper polar resection (7 subjects). Paliative resections or explorations were performed in 21 subjects. During the postoperative period, no complications were recorded in 90% of the patients, however, two subjects exited. The postoperative complications recorded included adhesive ileus in a single subject, subphrenic absces in two subjects, esophago-jejuno-anastomosis fistule in 8 subjects and a duodenal stub fistule in one female patient. Total or subtotal gastrectomy with D2 lymphadenectomy are standard procedures in gastric carcinoma patients. Mortality and morbidity rates of radical surgical procedures for gastric carcinoma should correspond with data presented in the literature.
Key words:
gastric carcinoma – surgery – lymphadenectomy
Authors:
R. Vrba; Č. Neoral; R. Aujeský; T. Malý; M. Loveček
Authors‘ workplace:
I. chirurgická klinika FN Olomouc, přednosta: doc. MUDr. Č. Neoral, CSc.
Published in:
Rozhl. Chir., 2009, roč. 88, č. 2, s. 50-54.
Category:
Monothematic special - Original
Overview
Karcinom žaludku je maligní onemocnění, které se často symtomaticky manifestuje v pokročilém stadiu již s přítomností metastatického postižení v lymfatických uzlinách. Jedinou kurativní terapií je chirurgický resekční výkon. Na I. chirurgické klinice bylo za posledních pět let operováno celkem 149 pacientů s karcinomem žaludku. Do předoperačního stagingu onemocnění bylo na našem pracovišti standardně zařazeno PET-CT vyšetření. Totální gastrektomie byla provedena u 109 nemocných, subtotální u 12 pacientů. Součástí obou výkonů byla vždy lymfadenektomie v rozsahu D2. Ve vybraných případech byla operačním řešením horní polární resekce, celkem u 7 nemocných. Paliativní výkon nebo explorace byla provedena u 21 pacientů. Celkem 90 % nemocných bylo v pooperačním období bez komplikací. Ve dvou případech došlo v pooperačním období k exitu nemocného. Z pooperačních komplikací jsme v naší sestavě zaznamenali jedenkrát adhezivní ileus, ve dvou případech subfrenický absces, píštěl v ezofagojejunoanastomóze byla u 8 nemocných, píštěl v pahýlu duodena měla jedna pacientka. Totální nebo subtotální gastrektomie s lymfadenektomií v rozsahu D2 je standardním výkonem u nemocných s karcinomem žaludku. Mortalita a morbidita radikálního chirurgického výkonu pro karcinom žaludku by měla odpovídat výsledkům citovaným v odborné literatuře.
Klíčová slova:
karcinom žaludku – chirurgická terapie – lymfadenektomie
ÚVOD
Karcinom žaludku je závažné zhoubné onemocnění horní etáže trávicího ústrojí. Ve většině případů je onemocnění diagnostikováno v pokročilém období s přítomností metastatického rozsevu v regionálních lymfatických uzlinách. Jedinou možností terapie onemocnění je radikální chirurgický výkon. Prognóza onemocnění záleží na stadiu onemocnění, pětileté přežití po radikálním chirurgickém výkonu se v západních zemích Evropy pohybuje od 8–28 % [1].
MATERIÁL A METODIKA
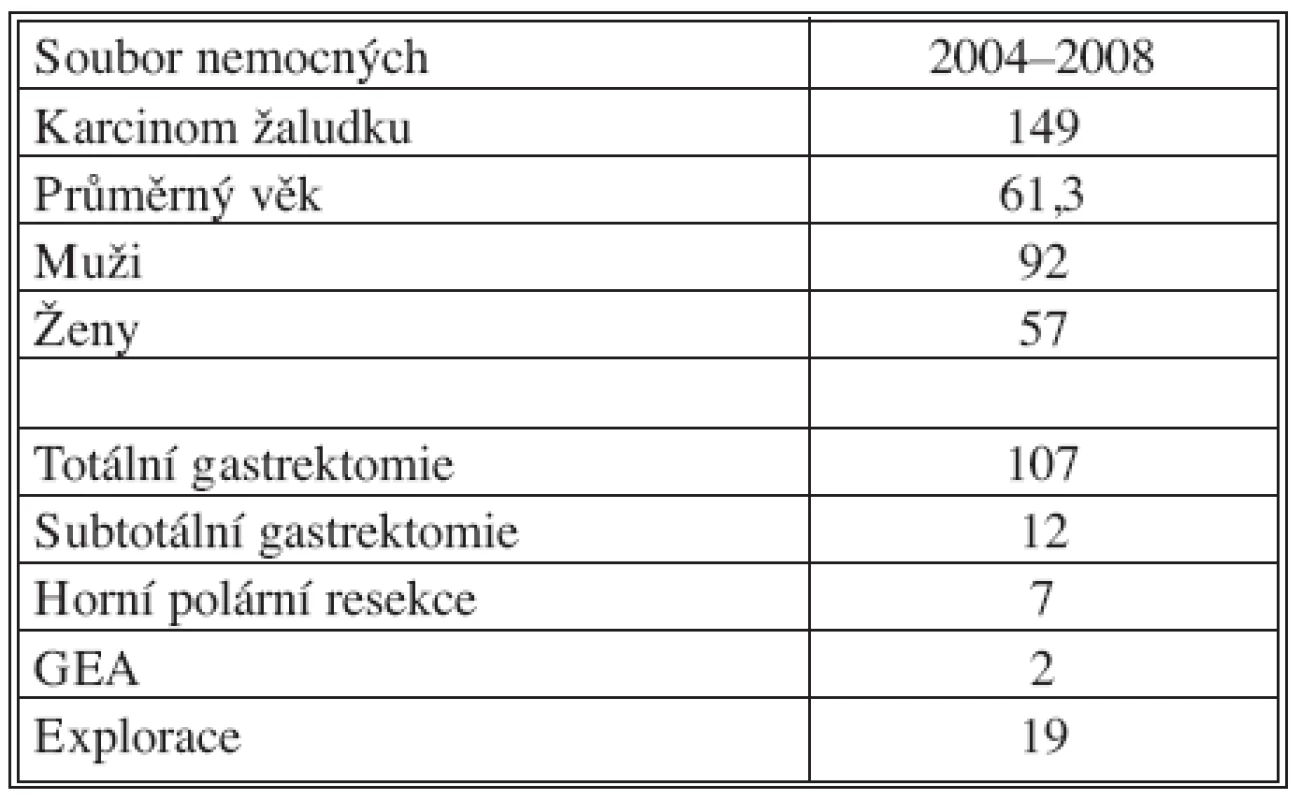
Na I. chirurgické klinice bylo za období 2004–2008 celkově operováno 149 nemocných s diagnózou karcinomu žaludku. V sestavě bylo zastoupeno 92 (62 %) mužů a 57 (38 %) žen s průměrným věkem 61,3 roků.
Diagnóza onemocnění byla potvrzena endoskopickým vyšetřením s biopsií tumoru. Předoperační staging byl stanoven na základě endosonografického a CT vyšetření. Od roku 2006 bylo zařazeno do předoperačního diagnostického algoritmu PET-CT vyšetření (Obr. 1).
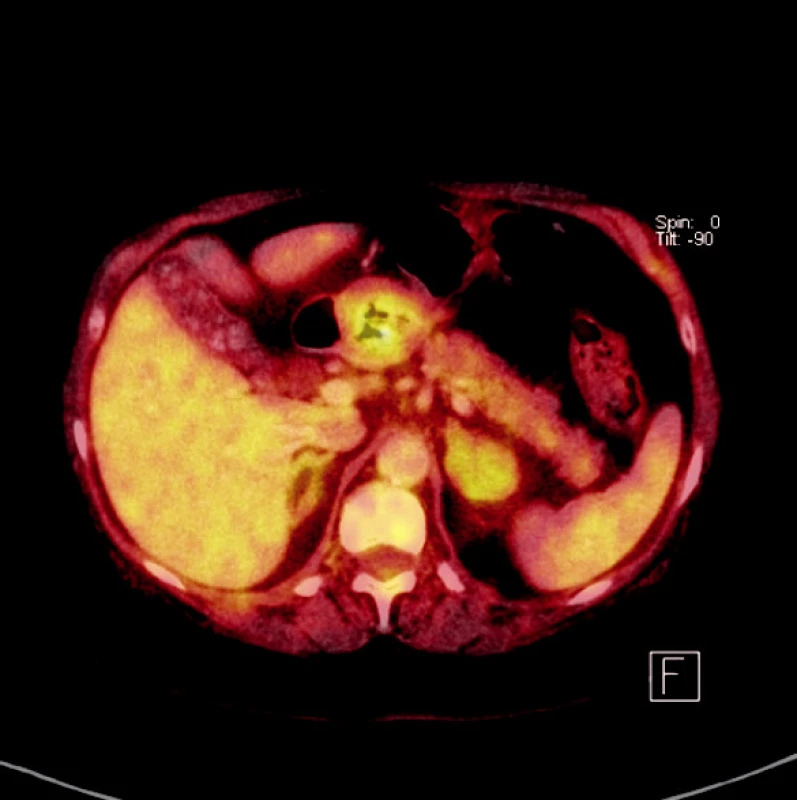
Operační výkon byl vždy zahájen diagnostickou laparoskopií k vyloučení generalizace onemocnění pro možnost miliárního metastatického rozsevu onemocnění v dutině břišní. Přítomnost viabilních nádorových ložisek do velikosti 5 mm je pod rozlišovací schopností PET-CT vyšetření. Kurativním léčebným výkonem byla totální nebo subtotální gastrektomie. U polymorbidních nemocných ve vyšších věkových kategoriích byla ve vybraných případech provedena horní polární resekce žaludku. U pacientů s poruchou pasáže při lokálně inoperabilním nádoru byla zvolena paliativní gastroenteroanastomóza, při generalizaci onemocnění bez poruchy pasáže byla provedena pouze explorativní laparoskopie. Explorativní laparotomie s palpačním ohledáním nálezu byla provedena v případech pokud laparoskopie neprokázala generalizaci onemocnění.
Dominantním chirurgickým výkonem byla totální gastrektomie, která byla provedena u 109 (73 %) nemocných. Přístupem do břišní dutiny byla příčná laparotomie, která byla při postižení orálních partií žaludku individuálně rozšířena kraniálně k mečíku hrudní kosti. Po ohledání operačního nálezu byla provedena resekční fáze, en block byl odstraněn žaludek s omentem a slezinou (Obr. 2, 3). Po odstranění resekátu s tumorem následovala lymfadenektomie v rozsahu D2 podle předepsaných kritérií onkologické radikality výkonu. Při nádorech lokalizovaných v oblasti kardie bylo vždy provedeno vyšetření horní resekční linie na zmrzlo. K obnovení pasáže trávicího ústrojí jsme využili retrokolicky uloženou exkludovanou Rouxovu kličku. Ezofagojejunoanastomóza byla konstruována kruhovým staplerem v rozmezích velikostí 21–29 mm. Ve všech případech byl konstruován rezervoár J-tvaru s využitím staplerů GIA 100mm.
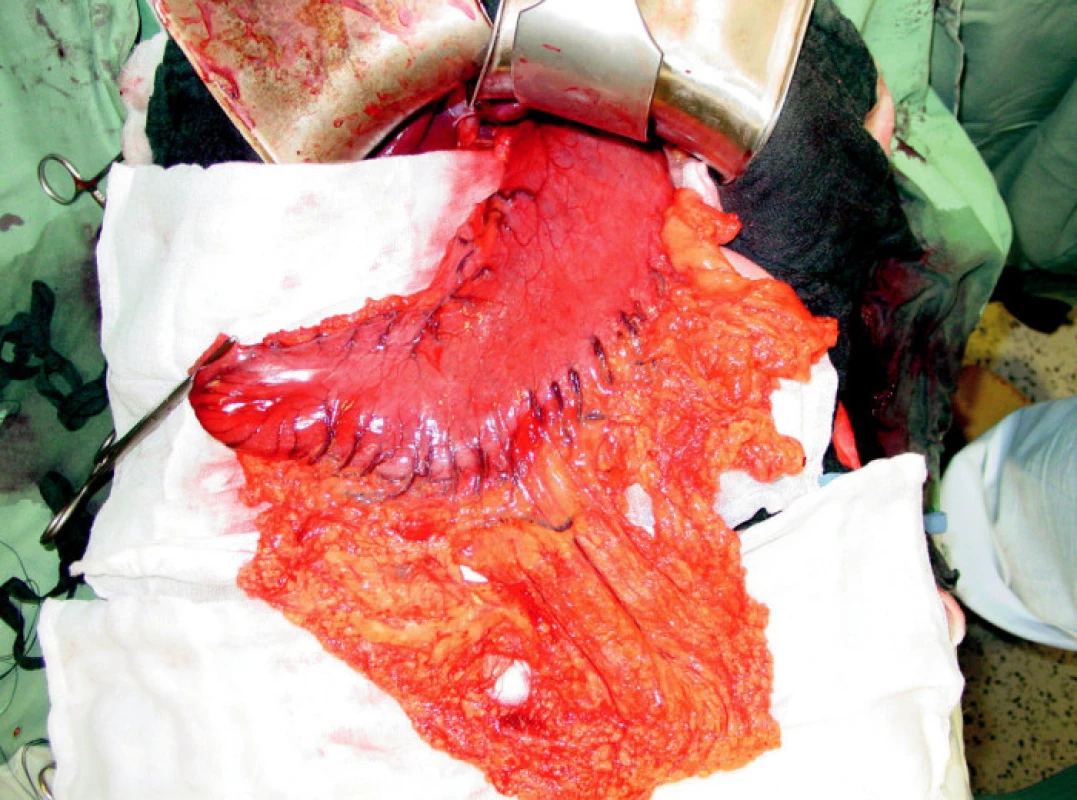
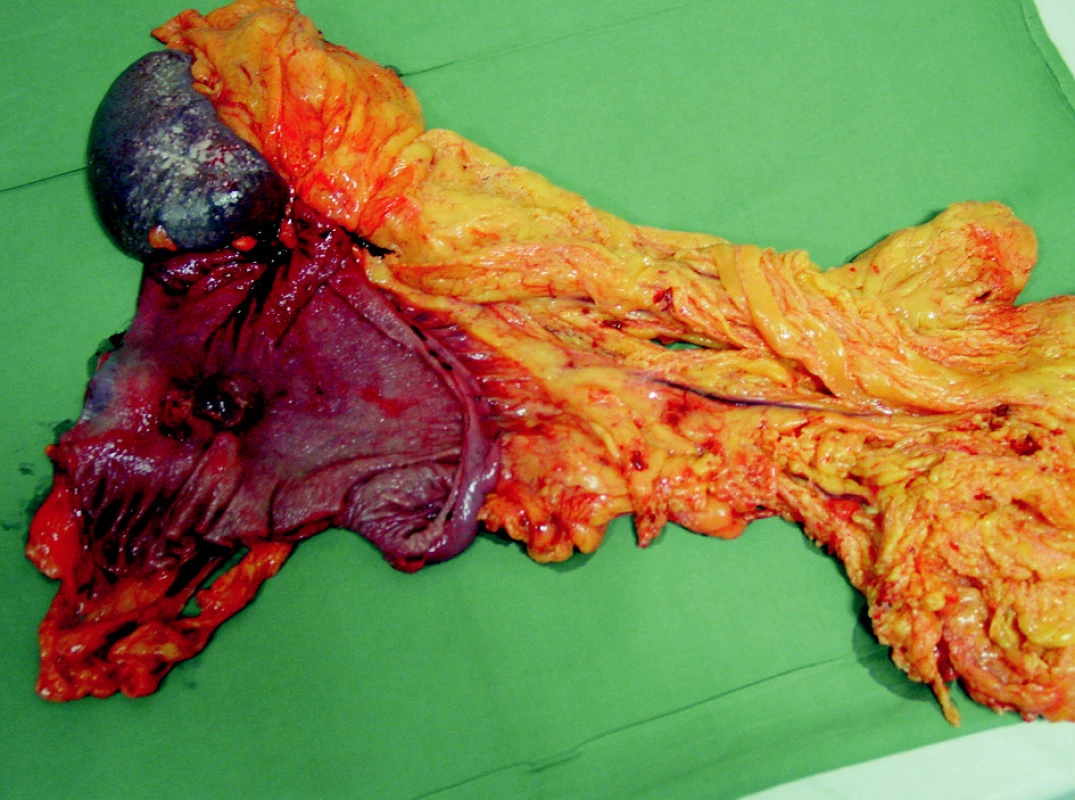
Subtotální gastrektomie byla v našem souboru provedena u 12 (8 %) nemocných. Výkon jsme indikovali při nádorovém postižení distálních partií žaludku s příznivým histologickým nálezem. Součástí výkonu byla vždy lymfadenektomie v rozsahu D2. Splenektomie nebyla standardně součástí výkonu, při jejím provedení jsme postupovali individuálně podle lokalizace tumoru a postižení lymfatických uzlin nádorovým procesem. Po obou typech resekčních výkonů byly do břišní dutiny uloženy dva drény, redonův drén subhepaticky na podtlak a silastikový drén do levého hypochondria na spád.
Horní polární resekce žaludku byla provedena u 7 (4 %) pacientů. Ve všech případech se jednalo o polymorbidní nemocné ve vyšších věkových kategoriích. Tumor byl vždy lokalizovaný v orální partii žaludku a byla zachována onkologická kritéria chirurgického resekčního výkonu.
Paliativní výkon gastroenteroanastomóza byla provedena u 2 (1 %) nemocných pro stenotizující karcinom v prepylorické lokalizaci s metastatickým rozsevem onemocnění v játrech. Explorativní laparoskopie nebo laparotomie pro lokálně inoperabilní nález nebo generalizované onemocnění byla provedena v 19 (12 %) případech.
Doba operačního výkonu nepřesáhla 4 hodiny, výjimkou byly dvě operace s resekcí distální třetiny jícnu z torakotomie.
Součástí radikálního chirurgického výkonu byla lymfadenektomie v rozsahu D2 podle onkologicky stanovených kritérií. Průměrný počet vyšetřených uzlin byl na našem pracovišti 17. Rozmezí počtu resekovaných uzlin se pohybovalo od 6 do 35 lymfatických uzlin. Nejmenší počet resekovaných uzlin byl zaznamenán u nemocné s včasně diagnostikovaným tumorem žaludku ve stadiu IA. Naopak 35 resekovaných uzlin, z toho 33 pozitivních, bylo zaznamenáno u 67letého muže s tumorem ve stadiu T4N3M0. U pacienta tumor infiltroval lienální flexuru, kde již byly známky poruchy pasáže. K totální gastrektomii byla připojena resekce lienální flexury.
V souboru nemocných s karcinomem žaludku byla u celkem 107 nemocných provedena R0 resekce, u 18 nemocných R1 resekce a R2 resekce u 3 nemocných. Explorace nebo paliativní výkon byl proveden u 21 pacientů.
VÝSLEDKY
V naší sestavě pacientů s karcinomem žaludku nebyla perioperačně zaznamenána žádná závažnější komplikace. Ve dvou případech jsme byli nuceni provést resekci distální třetiny jícnu z pravostranné torakotomie pro perioperačně potvrzenou pozitivní resekční linii.
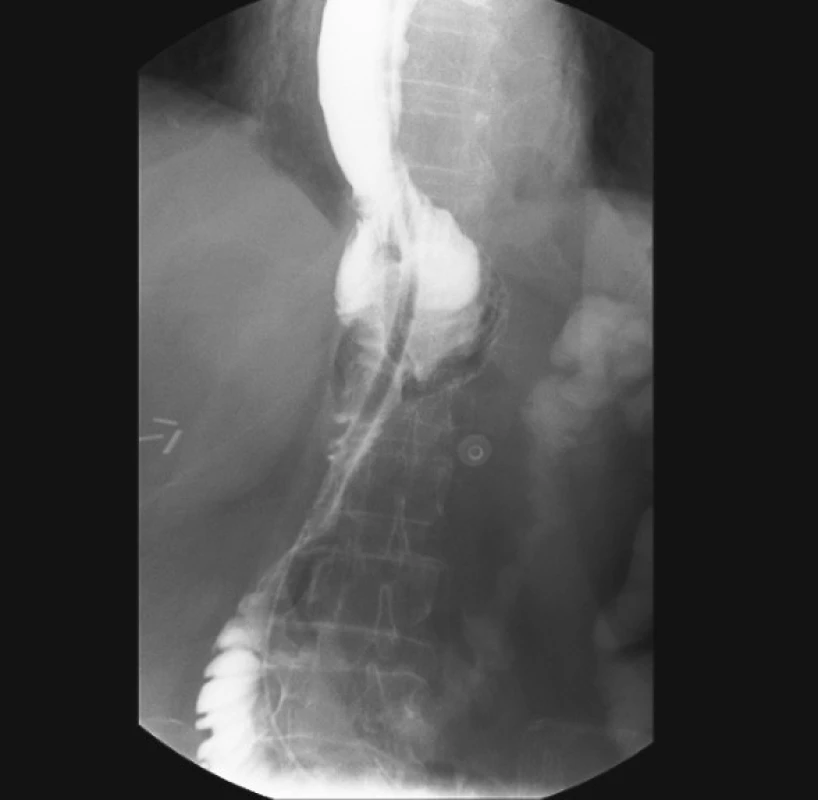
Celkem 135 (90 %) nemocných bylo v bezprostředním pooperačním průběhu bez závažných komplikací. Nutrice pacientů byla zajištěna kombinací parenterální a enterální terapie. Enterální terapie byla podávána biluminální nazojejunální sondou, která byla zavedena do první jejunální kličky během operace po ukončení rekonstrukční fáze výkonu. Sedmý pooperační den bylo standardně provedeno kontrolní RTG vyšetření horní etáže trávicího ústrojí s použitím vodné kontrastní látky k vyloučení píštěle na GIT (Obr. 4). Při příznivém nálezu byli nemocní postupně realimentováni. Průměrná doba propuštění nemocných do péče praktického lékaře byla 15. pooperační den.
Ve dvou případech (1 %) došlo v pooperačním období k exitu nemocného. V prvním případě u nemocného s perioperačně nově diagnostikovanou cirhózou jater došlo k rozvoji hepatorenálního selhání s následným exitem 5. pooperační den. Druhý nemocný exitoval 54. pooperační den pro respiračnímu selhání s ARDS syndromem při dehiscenci anastomózy.
Z dalších bezprostředních pooperačních komplikací, které jsme v našem souboru zaznamenali byla píštěl v ezofagojejunoanastomóze celkem u 8 (5 %) nemocných, u jednoho byla prokázána píštěl v oblasti pahýlu duodena. Konzervativní léčba byla u všech nemocných úspěšná. Subfrenický absces v oblasti lůžka sleziny jsme zaznamenali ve dvou případech (1 %). V jednom případě byla pod CT kontrolou provedena jeho drenáž. U druhého nemocného byla drenáž provedena klasickým operačním způsobem po neúspěšném pokusu pod CT kontrolou. Jedna nemocná byla revidována za měsíc od operace pro adhezivní ileus.
U dvou nemocných byla zaznamenána pozdní komplikace hernie v jizvě. V odstupu od primární operace byla provedena její plastika.


DISKUSE
Karcinom žaludku stále patří mezi často se vyskytující tumory trávicího ústrojí. Jeho incidence se ve světě liší, ve vyspělých zemích světa jakou jsou Evropa a Spojené státy americké byl zaznamenán jeho pokles. Nejvyšší výskyt onemocnění je v Číně, Japonsku, Jižní Americe [2]. V České republice představuje 4 % nádorových onemocnění u mužů (incidence 18,4 na 100 000 a úmrtnost 15 na 100 000 obyvatel) a 2 % u žen (incidence 12,7 na 100 000 a úmrtnost 14 na 100 000 obyvatel za rok) [23, 24].
Karcinom žaludku je onemocnění středního a staršího věku, které se vyskytuje mezi 50. a 70. rokem života [1]. Onemocnění se vyskytuje dvakrát častěji u mužů než žen [2]. Prognóza onemocnění je i při radikální terapii nepříznivá, pětileté přežití nemocných se pohybuje mezi 20–30 %. Mortalita onemocnění vykazuje ve světě významné rozdíly, v západní Evropě se pohybuje do 10 na 100 000 obyvatel, v Číně je okolo 40 na 100 000 obyvatel.
Mezi maligní nádory žaludku patří epiteliální karcinomy, stromální nádory, vřetenobuněčné nádory a lymfomy. Převážnou většinou nádorů jsou karcinomy, nejčastěji ve více než 90 % je zastoupen adenokarcinom. Prognóza onemocnění závisí na makroskopické a mikroskopické klasifikaci onemocnění. Pro stanovení stadia onemocnění karcinomu žaludku se používá TNM klasifikace. Klasifikace WHO rozlišuje pět histologických typů karcinomu (adenoskvamózní G1-G3, dlaždicový epitel G1-G3, malobuněčný G1-G4, nediferencovaný G3-G4, jiné). Mezi další klasifikace patří Laurenova, Stoutova, Borrmannova, Mingova [2].
Klinické symptomy onemocnění v časném stadiu jsou minimální, v pokročilém stadiu dominuje váhový úbytek se ztrátou hmotnosti (62 %), bolesti epigastria (52 %) a nauzea (34 %). Mezi další symptomy onemocnění patří anorexie, meléna, dysfagie, nechutenství a vředová symptomatologie [2].
Karcinom žaludku primárně metastazuje do lymfatických uzlin, následují játra (40 %), plíce (30 %). Dalšími lokalitami metastatického rozsevu jsou dutina peritoneální (15 %) a kosti (10 %) [2].
Diagnóza onemocnění je stanovena endoskopickým vyšetření s biopsií tumoru. Endosonografické vyšetření je nezbytné pro posouzení infiltrace stěny žaludku tumorem T-kategorie, dále posouzení okolní lymfadenopatie N-kategorie. Pro vyloučení vzdálených metastáz a posouzení penetrace tumoru do okolí je stále častěji v diagnostice maligních onemocnění využíváno PET-CT vyšetření. Senzitivita jaterního postižení u PET-CT je popisována 88 % oproti 38 % u CT vyšetření [22].
Jedinou kurativní terapií karcinomu žaludku je chirurgický resekční výkon. Standardním operačním řešením je totální nebo subtotální gastrektomie (4/5 resekce žaludku) [2]. Typ výkonu je volen podle lokalizace a histologického vyšetření tumoru. U histologicky prokázaných difuzních nádorů je indikován rozsáhlejší výkon – totální gastrektomie. U tumorů lokalizovaných v distálních partiích žaludku s histologicky potvrzeným intestinálním typem nádoru ve stadiu T 1,2 bez známek metastazování do lymfatických uzlin lze provést subtotální gastrektomii. Pro zachování onkologické radikality výkonu musí být orální resekční linie od tumoru nejméně 6 cm [2].
Součástí výkonu je vždy lymfadenektomie, v současné době je jednoznačně preferovaná lymfadenektomie v rozsahu D2 [19, 11, 12, 13, 9]. Principem D2 lymfadenektomie je odstranění lymfatických uzlin v I. a II. kompartmentu. Uzliny I. kompartmentu zahrnují perigastrické uzliny podél velké a malé křiviny žaludku, II. kompartment obsahuje uzliny v oblasti truncus coeliacus, levé gastrické tepny, společné hepatické tepny, podél lienální tepny a hilu sleziny. Při radikálně provedené lymfadenektomii by mělo být v definitivním resekátu vyšetřeno 15 uzlin [10]. V posledním období je diskutována otázka radikality lymfadenektomie, v literatuře je popisována lymfadenektomie v rozsahu D 3 spočívající v odstranění uzlin ze III. kompartmentu. Třetí kompartment zahrnuje uzliny v hepatoduodenálním vazu, za hlavou panktreatu, v oblasti radixu mesenteria a paraaortální uzliny. Podle posledních prací publikovaných randomizovaných studií na medline nebyl prokázán benefit D3 versus D2 lymfadenektomie v celkovém přežití nemocných [20, 21].
Názory na provedení splenektomie nejsou jednotné, po jejím provedení je popisován vzestup insuficiencí anastomózy a septických komplikací [5, 14, 15]. Poslední studie doporučují provést splenektomii zejména u pokročilých nádorů a při nádorech lokalizovaných v proximální části žaludku [16, 17].
Obnovení pasáže je možno provést v mnoho modifikacích [18, 8]. Nejčastěji je používána rekonstrukce s využitím Rouxovy kličky [8]. Z dalších používaných modifikací se v hojné míře uplatňuje ezofagojejunoplikace podle Peipera a Siewerta. Pro zlepšení příjmu potravin a zvýšení kvality života je možno vytvořit z tenké kličky rezervoár.
Morbidita chirurgického výkonu se pohybuje okolo 30 %, mortalita by neměla přesáhnout 10 % [3, 4, 5]. Výrazný rozdíl v morbiditě a mortalitě při totální a subtotální gastrektomii není v literatuře udáván [6, 7]. Podle definitivního histopatologického stadia onemocnění je indikována adjuvantní onkologická terapie.
ZÁVĚR
Radikální chirurgický výkon s lymfadenektomií v rozsahu D2 je jedinou možností kurativní terapie u nemocných s karcinomem žaludku. Prognóza onemocnění je závislá na stadiu onemocnění. Na chirurgických pracovištích s rutinně prováděnými resekčními výkony pro karcinom žaludku procento pooperačních komplikací odpovídá výsledkům referovaným v odborné literatuře. Pro zachování onkologické radikality výkonu je na našem pracovišti preferován operační výkon klasickým přístupem v rozsahu totální gastrektomie s D2 lymfadenektomií a splenektomií. Výsledky publikované sestavy nemocných potvrdily bezpečnost rozsáhlého operačního výkonu s morbiditou a mortalitou korelujícími s referovanými literárními odkazy. Naše zkušenosti prokázaly významně zlepšenou kvalitu života po konstrukci rezervoáru. Výraznou změnu v diagnostickém algoritmu v před-operačním stagingu onemocnění přineslo PET-CT vyšetření, které na našem pracovišti indikujeme u všech nemocných s diagnózou karcinomu žaludku.
MUDr. R. Vrba, Ph.D.
I. chirurgická klinika LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: radek.vrba@fnol.cz
Sources
1. Berrino, A., Haas, O., Piard, F., et al. How many nodes must be examined to accurately stage gastric carcinomas? Cancer, 2002, 94, p. 2862–2866.
2. Becker, H. D., Hohenberger, W., Junginger, T., Schlag, P. M. Chirurgická onkologie. Grada, 2005, s. 291–338.
3. Devessa, S. S., Silverman, D. T., Young, J. L., et al. Cancer incidence and mortality trends among whites in the United States, 1947-1984. J. Nat. Cancer Indy., 1987, 79, 701–742.
4. Bonenkamp, J. J., Songun, I., Hermans, J., Sasako, M., Welvaart, et al. Randomised comparison of morbidity after D1 and D2 disection for gastric cancer in 996 Dutch patiens. Lancet, 1995, 345, 745–748.
5. Brady, M. S., Rogatko, A., Dent, L. L., Shiu, M. H. Effect of splenectomy on morbidity and survival followin curative gastrectomy for carcinoma. Ann. Surg., 1991, 126, 359–364.
6. Bozzetti, F., Marubini, E., Bonfani, G., et al. Total versus subtotal gastrectomy. Surgical morbidity and mortality rates a multicenter Italian randomized trial. Ann. Surg., 1997, 226, 613–620.
8. Malý, T., Zonča, P., Neoral, Č., Jurytko, A. Rekonstrukce po gastrektomii. Rozhledy v chirurgii, 2008, 7, 367–375
7. Roder, J. D., Bottcher, K., Siewert, J. R., Busch, R., Hermanek, P., Meyer, H-J. Prognostic factors in gastric carcinoma. Results of the German gastric carcinoma Study 1992. Cancer, 1993, 72, 2089–2097.
9. Gatěk, J., Duben, J., Bakala, J., Miča, T., Dudešek, B., Haša, E., Musil, T., Hnátek, L. Lymfadenektomie u časného karcinomu žaludku. Rozhledy v chirurgii, 2004, 9, 428–438
10. Sobin, L., Wittekind, Ch. UICC TNM Classification of malignant tumours. 1997, 5th ed., 56.
11. Manzoni, G., Verlato, G., Guglielmi, A., Laterza, E., Genna, M., Cordino, C. Prognostic significance of lymph node dissection in gastric cancer. Br. J. Surg., 1996, 83, 1604–1607.
12. Roukos, D. H, Lorenz, M., Enckle, A. Evidence of survival benefits of extended (D2) lymphadenectomy in Western patients with gastric cancer based on new concept: a prospect long-term follow-up study. Surgery, 1998, 123, 573–578.
13. Siewert, J. R., Bottcher, K., Roder, J. D., Busch, R., Hermanek, P., Meyer, H. J. and the German Gastric Carcinoma Study group Prognostic relevance of systematic lymph node dissection in gastric carcinoma. Br. J. Surg., 1993, 80, 1015–1018.
14. Buhl, K., Lehnert, T., Schlag, P., Herfarth, C. Reconstruction after gastrectomy and quality of life. World J. Surg., 1995, 19, 558–564.
15. Griffith, J. P., Sue-ling, H. M., Martin, I., et al. Preservation of the spleen improves survival after radical surgery for gastric cancer. Gut, 1995, 36, 684–690.
16. Okajima, K., Isozaki, H. Splenectomy for treatment of gastric cancer: Japanese experience. World J. Surg., 1995, 19, 537–540.
17. Wanebo, H. J., Kennedy, B. J., Winchester, D. P., Steward, A. K., Fremgen, A. M. Role of splenectomy in gastric cancer surgery: adverse effect of elective splenectomy on longterm surfoval. J. Am. Coll. Surg., 1997, 185, 177–184.
19. Šimša, J., Leffler, J., Hoch, J., Schwarz, J., Bavor, P. Karcinom žaludku a D2 lymfadenektomie – technika, možné komplikace., Rozhledy v chirurgii, 2004, 1, s. 6–10.
20. Yonemura, Y., Wu, C. C., Fukushima, N., Honda, I., Bandou, E., Kawamura, T., Kamata, T., Kim, B. S., Matsuki, N., Sawa, T., Nosh, S. H., East Asia Oncology Group Randomized clinical trial of D2 and extended paraaortic lymphadenectomy in patients with gastric cancer. Int. J. Clin. Oncol., 2008, 13, 132–137.
21. Sasako, M., Sano, T., Yamamoto, S., Kurokawa, Y., Nashimoto, A., et al. D2 lymphadenectomy alone or with paraaortic nodal dissection for gastric cancer. N. Engl. J. Med., 2008, 31, 448–451.
22. Ondrák, M., Šefr, R. Role PET a CT vyšetření v managmentu léčby zhoubného onemocnění tlustého střeva a konečníku – review. Rozhledy v chirurgii, 2007, 9, 461–465.
23. ÚZIS Novotvary 2005.
24. Stefanová, M. Epidemiologie, screening, současná diagnostika a staging karcinomu žaludku. Bulletin HPB, 2008.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2009 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Výsledky chirurgické léčby karcinomu žaludku v období 2004–2008
- Traumatická perforace duodena – kazuistika
- Neurinom zvratného nervu
- Dvojitý průstřel hrudní stěny u afghánského vojenského policisty
- Ischemicko-reperfuzní poškození ledvin transplantovaných z nebijícího dárce (NHBD) – mají antioxidanty nebo protizánětlivé léky význam v jeho prevenci?
- Chirurgická léčba jaterních metastáz kolorektálního karcinomu
- Riziko úmrtí u polytraumatizovaných pacientů s poraněním pánve
- Nové trendy v diagnostice a léčbě karcinomu prsu na přelomu tisíciletí
- Radiodiagnostika zlomenin lopatky
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Radiodiagnostika zlomenin lopatky
- Traumatická perforace duodena – kazuistika
- Dvojitý průstřel hrudní stěny u afghánského vojenského policisty
- Ischemicko-reperfuzní poškození ledvin transplantovaných z nebijícího dárce (NHBD) – mají antioxidanty nebo protizánětlivé léky význam v jeho prevenci?
