Maligní ascites – možnost ovlivnění tvorby pomocí hypertermické peroperační chemoterapie (HIPEC)
Malignant Ascites – Optional Management using Hyperthermic Peroperative Chemotherapy (HIPEC)
146 procedures using hyperthermic intraoperative peritoneal chemotherapy (HIPEC) were performed in 121 patients in the FNB Surgical Clinic, during 2000–2008. During these procedures, ascites was detected in 30 subjects (24.8%) and its volume was 250–11,000 ml. The patients concerned could not undergo radical surgery for their GIT or gynecological tumors. The patient group was divided into two subgroups. Subgroup A (22 subjects) included subjects, in whom at least palliative debulking of the tumors (usually total omentectomy) was feasible, and the procedure was followed by HIPEC. Subgroup B (8 patients) included subjects who could not undergo even the minimum debulking procedure because of extensive tumorous spread in their abdominal cavity, underwent only HIPEC. Out of the total of 22 subjects in Subgroup A, ascites was not postoperatively recorded in 17 patients. In 5 patients, ascites was gradually formed from month 6.3 onwards, however, it only reached subclinical levels. In this subgroup, 7 patients exited (at the mean postoperative month 11.7), the remaining 15 patients were surviving at that time, out of whom 9 patients were surviving for more than 1 year after the procedure, 4 subjects were surviving for over 2 years after the procedure and 2 patients for over 4 years. The geometric mean survival time 16.49 months, standard deviation of 1.57. In Subgroup B (8 patients), no ascites was detected in 3 subjects until their death (37.5%), further 5 subjects presented with ascites at the mean postoperative month 7.25. These patients survived for 2–23 months. The geometric mean survival time was 6.83 months, standard deviation of 2.12. There was a statistically significant difference between the two subgoups in the survival time parametres (p = 0.009), thereas, the difference in ascites relapse rates was statistically insignificant (p = 0.12). In the whole study group, in-hospital morbidity was 16.6% and lethality 3.3%.
Conclusions:
HIPEC with/without debulking is an efficient method for controlling, managing or preventing the development of malignant ascites, it extends the mean survival time of the patients (especially when bulking is feasible) with low morbidity and lethality rates of the procedure.
Key words:
ascites – malignant ascites – hyperthermic intraperitoneal peroperative chemotherapy (HIPEC)
:
F. Antoš; P. Dytrych
; P. Vítek *; O. Ryska; J. Marvan; Z. Šerclová
:
Chirurgická klinika 1. LF UK a IPVZ FN Praha Bulovka, přednosta: prof. MUDr. František Antoš, CSc.
; Ústav radiační onkologie 1. LF a IPVZ FN Praha Bulovka, přednosta: prof. MUDr. Luboš Petruželka
*
:
Rozhl. Chir., 2010, roč. 89, č. 4, s. 237-241.
:
Monothematic special - Original
Na chirurgické klinice FNB bylo v rozmezí let 2000–2008 provedeno u 121 pacientů 146 operací z použitím hypertermické intraoperativní peritoneální chemoterapie (HIPEC). Při těchto operacích byl ascites nalezen u 30 nemocných (24,8 %) a to v množství 250–11 000 ml. Šlo o nemocné u nichž nebylo možno provést radikální operaci nádorů GIT či tumorů gynekologických. Tato skupina pacientů byla rozdělena na podskupinu A (22 pacientů), kde bylo možné provést alespoň paliativní debulking nádorů (většinou jen úplnou omentektomii) a doplnit HIPEC. Ve skupině B (8 pacientů), kde extenzivní nádorové postižení dutiny břišní nedovolilo ani minimální debulking, byl proveden pouze HIPEC. U podskupiny A (22 nemocných) jsme u 17 nemocných po operaci již ascites nezaznamenali. U 5 nemocných se pak ascites postupně vytvářel v průměru od 6,3 měsíce, avšak v subklinické míře.V této podskupině zemřelo 7 nemocných (průměrně za 11,7 měsíců po operaci), zbylých 15 nemocných bylo ke stejnému datu naživu a z toho 9 nemocných žilo po operaci více než 1 rok, 4 nemocní více než 2 roky a 2 nemocní dokonce více než 4 roky. Geometrický průměr přežití činil 16,49 měsíce při směrodatné odchylce 1,57. V podskupině B (8 nemocných) se neobjevil ascites až do smrti pacientů u 3 z nich (37,5 %), u dalších 5 nemocných se ascites prezentoval opětně v průměru po 7,25 měsících. Tito nemocní přežívali 2–23 měsíců . Zde činil geometrický průměr přežití 6,83 měsíce při směrodatné odchylce 2.12. Srovnání výsledků obou skupin v položce délky přežití bylo statisticky signifikantní (p = 0,009), zatímco v recidivě ascitu statisticky nesignifikantní (p = 0,12). V celé sestavě činila in-hospital morbidita 16,6 % a letalita 3,3 %.
Závěry:
HIPEC s/bez debulkingu je účinnou metodou k omezení až zastavení tvorby maligního ascitu, zvyšuje průměrnou dobu přežití pacientů (zvláště je-li debulking možný) a to při nízké morbiditě i letalitě operačního výkonu.
Klíčová slova:
ascites – malignant ascites – hyperthermic intraperitoneal peroperative chemotherapy (HIPEC)
ÚVOD
Ascites lze definovat jako patologickou akumulaci většího množství tekutiny v peritoneální dutině. Tvorba ascitu při malignitách břišní dutiny je jednou ze známek blížícího se konce života nemocných postižených nádorovými procesy různého původu. V průměru tito pacienti žijí ještě 1–8 měsíců, jeden rok přežije jen 0–13 % z nich [1, 2]. Kvalita života těchto nemocných je velmi nízká a s postupujícím narůstáním ascitu se stále snižuje. Maligním ascitem trpí asi 10 % nemocných s nádorovým postižením v břišní dutině a téměř u 20 % maligních ascitů se primární zdroj malignity nezjistí [1, 2, 3]. Nemocní s maligním ascitem mimo jiné trpí bolestmi břicha, poruchou funkce gastrointestinálního traktu a narůstající dušností. Kromě málo účinné diuretické léčby zbývá k ovlivnění přetlaku v břišní dutině jen symptomatická léčba pomocí abdominocentéz či krátkodobě účinných abdominovenózních spojek, se všemi metabolickými a infekčními důsledky. Při řešení problematiky pokročilých po peritoneu diseminovaných nádorů břišní dutiny pomocí cytoredukce a hypertermické intraperitoneální peroperační chemoterapie (HIPEC) jsme ověřili, že tato metoda také zabraňuje tvorbě ascitu, či jeho produkci význačně zmenší, a to často až do konce života nemocného. O této možnosti užití referujeme u skupiny našich 30 nemocných.
MATERIÁL A METODA
Námi použitá metoda hypertermické intraperitoneální chemoterapie je založená na aplikaci koncentrovaného cytostatika do břišní dutiny při operaci s ověřeným předpokladem jeho výrazně limitované absorpce z peritoneální dutiny do systémového oběhu. K těmto účelům používáme Mytomycin C, Bleomycin, Cisplatinu, či nověji i Oxaliplatinu. Všechna tato cytostatika jsou ordinována ve spolupráci s klinickým onkologem, která určuje i jejich dávku poměrovým výpočtem k tělesného povrchu. Intraperitoneálně podaná chemoterapeutika působí proti malignímu ascitu destrukcí tumorózních buněk na povrchu peritonea, či nádorů samotných, s následnou fibrotizací, kteréžto mechanismy pak brání nadměrnému tvoření tekutiny [8]. Účinek těchto cytostatik lze podpořit jejich zahřátím na teplotu 42–43 °C, která zvýší penetraci do tkání [8, 9] a stálým promýváním břišní dutiny s pomocí speciálního perfuzního přístroje (např. SKALA LA-1, Obr. 1), zpravidla po dobu 90 minut. Po odsátí cytostatika z břišní dutiny je výkon ukončen běžným způsobem.

Na chirurgické klinice FNB bylo v rozmezí let 2000–2008 provedeno u 121 pacientů 146 operací z použitím HIPEC, a to z důvodu léčení pseudomyxomu peritonea, mezoteliomu, pokročilého kolorektálního karcinomu či malignit gynekologického původu. Při těchto operacích byl ascites nalezen u 30 nemocných (24,8 %) a to v množství 250–11 000 ml. Šlo o nemocné u nichž nebylo možno provést radikální či kurativní operaci. Tuto skupinu pacientů lze podle provedené operace rozdělit na podskupinu A (22 pacientů), kde bylo možné provést alespoň paliativní debulking nádorů (většinou jen úplnou omentektomii) a doplnit HIPEC. Ve skupině B (8 pacientů), kde extenzivní nádorové postižení dutiny břišní nedovolilo ani minimální debulking, byl proveden pouze HIPEC. Celkem šlo o 12 mužů, průměrného věku 52,6 let (32–72) a 18 žen průměrného věku 58,4 let (26–74). V tabulce 1 jsou uvedeny diagnózy pro které byly operace provedeny. Průměrná doba trvání ascitu před operací byla 5,3 měsíce (2–48).

VÝSLEDKY
U podskupiny A (22 nemocných) jsme u 17 pacientů po operaci již ascites nezaznamenali. U 5 nemocných se pak ascites postupně vytvářel v průměru od 6,3 měsíce, avšak v subklinické míře. V této podskupině do 30. 6. 2009 zemřelo 7 nemocných (průměrně za 11,7 měsíců po operaci), přičemž více než 1 rok z nich žili 4 pacienti. Zbylých 15 nemocných bylo ke stejnému datu naživu a z toho 9 nemocných žilo po operaci více než 1 rok, 4 nemocní více než 2 roky a 2 nemocní dokonce více než 4 roky. Geometrický průměr přežití u této skupiny činil 16,49 měsíce při směrodatné odchylce 1,57.
V podskupině B (8 nemocných) se neobjevil ascites až do smrti pacientů u 3 z nich (37,5 %), u dalších 5 nemocných se ascites prezentoval opětně v průměru po 7,25 měsících, ale pouze u dvou z nich šlo o klinicky manifestní, punkce vyžadující formu. Tito nemocní přežívali 2–23 měsíců. Zde činil geometrický průměr přežití 6,83 měsíce při směrodatné odchylce 2,12.
V celé sestavě byla in-hospital morbidita 16,6 % (infekt rány, bronchopneumonie, uroinfekt) a letalita 3,3 % (1 nemocný zemřel na bronchopneumonii).
DISKUSE
Maligní ascites je vedle ascitu transudativního, chylózního a exudativního zánětlivého další variantou ascitu, který je charakterizován difuzním rozsevem maligních buněk v peritoneální dutině. Asi 10 % nádorů břišní dutiny vytváří ascites, zatímco přibližně u 20 % výskytu maligního ascitu v břišní dutině se nedaří stanovit primární malignitu [1, 2, 3]. Až 50 % nitrobřišních malignit se primárně prezentuje jako ascites [1, 5]. U žen (proti mužům frekventnější – 67 % : 33 %) jde obvykle o nádory ovariální, non Hodgkinský lymfom, karcinom žlučníku, prsu a ostatní nádory. U mužů pak jde z 50 % o gastrointestinální nádory – karcinom kolorektální, žaludku, pankreatu a žlučníku [3, 5].
Vytvoření ascitu je multifaktoriální proces. Na mechanismu vzniku maligního ascitu se hlavně podílí nepoměr mezi tekutinovou nadprodukcí, která je způsobená zvýšenou vaskulární permeabilitou (cytokiny, VEGF, VPF, TNF, IL6, IL10) a jejím sníženým vstřebáváním, které jde na vrub především nádorové obstrukci lymfatické drenáže [1, 3, 5].
Mezi klinické znaky počítáme zvětšující se obvod břicha, břišní bolesti, nauzeu a zvracení. Nejvíce obtěžující je dyspnoe, narůstání hmotnosti a omezená pohyblivost. Ascites lze dobře znázornit abdominálním sonografickým vyšetřením, jinak pak pomocí CT či MRI (Obr. 2).
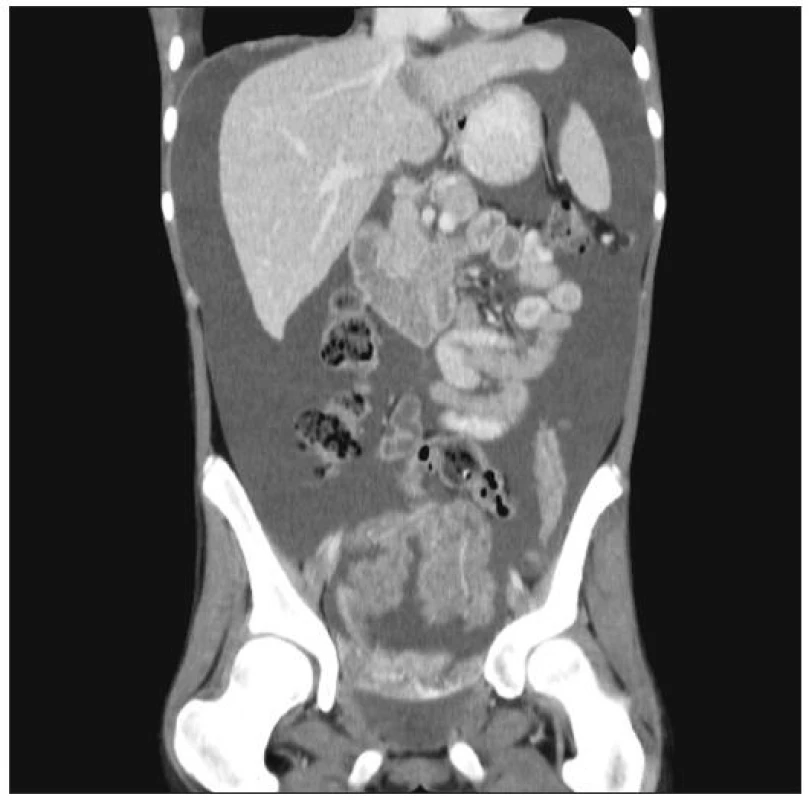
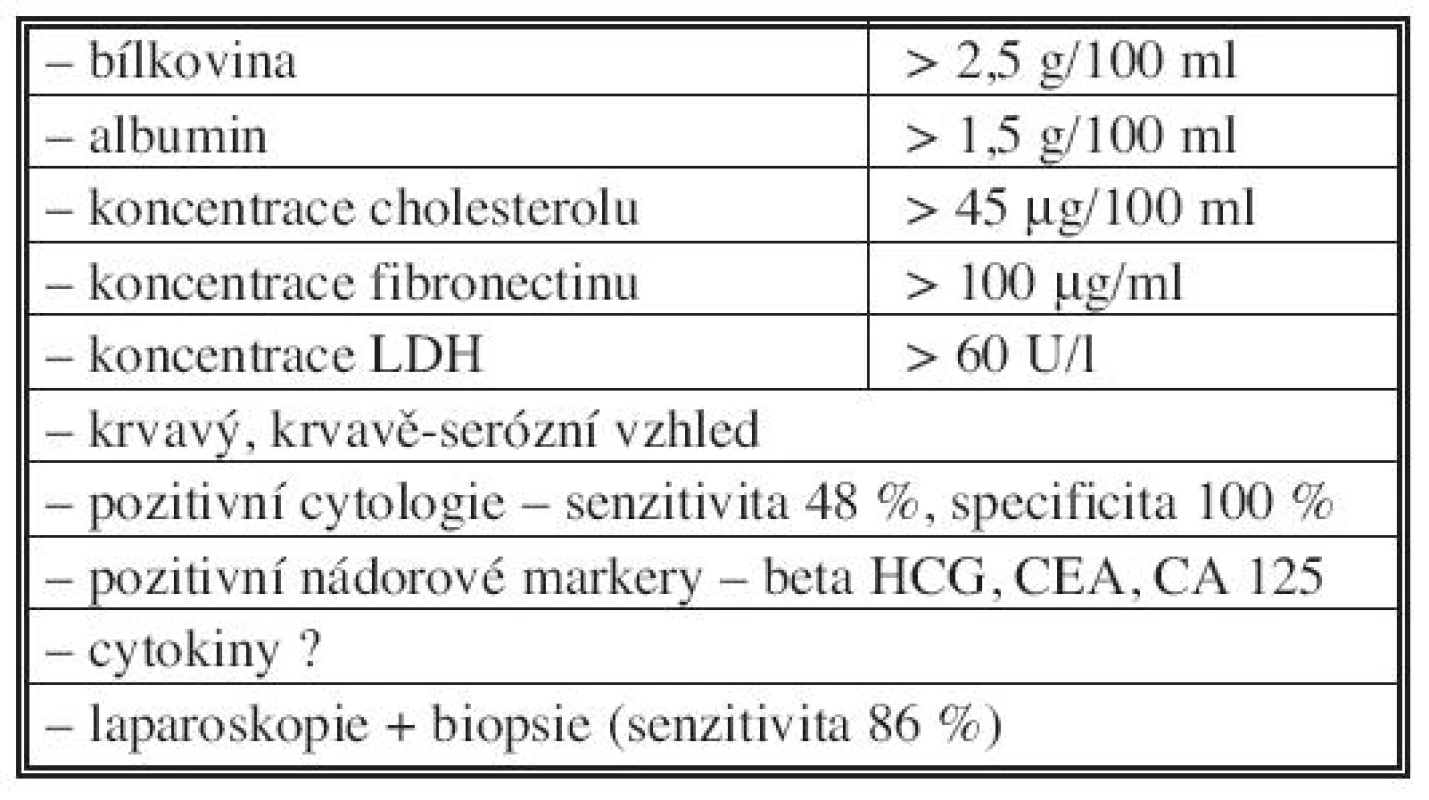
Hlavním problémem vedle léčby zůstává rozlišení maligního ascitu od ostatních typů ascitu. V tabulce 2 [4, 5, 6] jsou uvedena některá diferenčně diagnostická kritéria, která v rozlišení mohou pomoci. Zdálo by se, že vyšetření cytologické je suverénní metodou a bude hrát rozhodující úlohu v diagnostice malignity, avšak podle literárních i našich zkušeností je senzitivita této metody jen kolem 50 % [4, 5]. V ascitické tekutině může být jen velmi málo zjistitelných buněk a mohou být neidentifikovatelné mezi populacemi mezothelových buněk či makrofágy [4]. Ani nejnovější metoda k nalezení nádorových buněk v ascitické či lavážní tekutině, která používá identifikace nádorové RNA, obvykle CEA mRNA, tzv. reverzní transkripce (RT – PCR) nepřináší zatím, podle našich zkušeností, senzitivnější výsledky. Nezbývá proto, než se v diagnostice maligního ascitu spolehnout na minimální chirurgický výkon (laparoskopie + biopsie), který vykazuje asi 86% resp. 93% senzitivitu při sono - nebo CT-navigované biopsii [5].
Prognóza pacientů s maligním ascitem je velmi špatná. Střední doba přežití se udává 1–8 měsíců, 1 rok přežije pouze 0–13 % nemocných [1, 2]. Zatím však neexistuje žádné evidence-based doporučení jak tento stav léčit a i ramdomizovaných studií je jen málo [1, 5]. Není známo, kdy a u kterých malignit se ascites vytvoří, takže ani preventivní opatření nejsou možná. K dispozici je pouze paliativní léčba medikamentózní (redukce příjmu soli a tekutin a podávání diuretik), která má jen malý dlouhodobý efekt. Druhou možností je krátkodobě efektní punkce ascitu, která však má řadu technických a metabolických komplikací. Je účinná v průměru jen 10 dnů [2], pak je třeba ji opakovat. Drenáž ascitu lze provádět drénem vyvedeným navenek, či pomocí peritoneovenózních spojek (Denver, Le Veen), avšak i tyto metody mají mnoho komplikací (40–60 %), jakými jsou infekce, DIC, obstrukce drenáže, hypotenze či diseminace tumoru. Průměrně pak fungují jen 83 dnů a pacienti zmírají po 11–33 týdnech [5]. Novější metody intraperitoneální aplikace (corynebaterium parvum, monoklonální protilátky, interferon alfa, TNF alfa, OK 432, metalloproteinázové inhibitory) či užití anti-VGF léčby, radioimunoterapie nebo Octreotidu jsou ve fázi klinického zkoušení či experimentu na zvířeti [1].
Hypertermická peroperační chemoterapie v kombinaci s agresivní cytoredukcí byla v selektovaných případech prokázána jako velmi účinná metoda léčby. Na př. Verwaal a spol. [17] na skupině 105 nemocných s kolorekálním diseminovaným karcinomem randomizovaných do skupin standardní systémové chemoterapie a agresivní cytoredukce s HIPEC dosáhl střední doby přežití 22,3 vs. 12,6 měsíců ve prospěch HIPEC skupiny (p = 0,032). Při použití agresivní cytoredukce + HIPEC v indikacích maligního ascitu u GIT a gynekologických typů nádorů je referováno o 75–100 % různě dlouhé době účinnosti [10, 11, 12, 13, 14, 15, 16]. Ve studii Loggie a spol. [10] bylo prokázáno, že střední doba přežívání je přímo závislá na úrovni provedeného debulkingu (R0–R2). Při sledování všech pacientů bez ohledu na možnou radikalitu debulkingu bylo zjištěno, že 79 % nemocných žilo až do smrti bez znovuvytvoření ascitu.
V naší sestavě nemocných potvrzujeme, že přežívání nemocných při použití metody HIPEC spolu s paliativním debulkingem tumoru lze význačně prodloužit. Průměrná doba přežívání těchto nemocných byla v naší sestavě více než dvojnásobná proti literárním údajům 1–8 měsíců [1, 2]. Při srovnání s pouhým HIPEC pomocí Log-rank testu pak na vysoké hladině statistické významnosti (p = 0,009), (Graf 1). Rovněž znovuobjevení se ascitu u nemocných je časově příznivější u skupiny HIPEC + debulking, i když nedosahuje statistické významnosti (p = 0,12) (Graf 2). Pro nemocné je však podstatné, že v celé skupině (krom dvou pacientů) buď nedošlo k znovuvytvoření ascitu vůbec, nebo jen v množství, které si nevyžadovalo další léčebná opatření a které podstatněji zlepšilo kvalitu jejich zbylého života. Výsledky naší studie ukazují na to, že i u nemocných s maligním ascitem, kde nelze provést ani minimální debulking má smysl pokusit se alespoň o HIPEC, který umožní kontrolu tvorby ascitu. Poslední literární zprávy [18, 19] to potvrzují a uvádějí možnost laparoskopického přístupu k provedení HIPEC se střední dobou přežívání 98 dní bez letality a s minimální morbiditou. Taktéž v naší skupině byly in-hospital morbidita (16,6 %) a 3,3 % letalita velmi příznivé a podle našeho názoru opravňují k provádění této operační metody, která by si zasloužila většího rozšíření.


ZÁVĚR
U kurativně neoperovatelných nádorů břišní dutiny s vytvořeným ascitem lze potíže nemocných (především dechové a mobilitu) ovlivnit pomocí HIPEC a to s/bez provedení paliativní cytoredukce (debulking). Výrazně lepších výsledků jsme dosáhli při možnosti alespoň částečné cytoredukce a to jak v době přežívání nemocných, tak v ev. recidivě tvorby ascitu. I když u části našich nemocných k znovuvytváření ascitu docházelo, šlo o klinicky nevýznamná množství, která si nevyžadovala další léčbu. Tento paliativní postup (ve shodě s literaturou) význačně zlepšuje kvalitu života těchto onkologických pacientů, a proto by si tato metoda zasloužila většího rozšíření.
Seznam zkratek:
- VEGF – Vascular Endothelial Growth Factor
- VPF – Vascular Permeability Factor
- TNF – Tumor Necrosis Factor
- IL6 – Interleukin 6
- IL10 – Interleukin 10
- CT – Computer Tomography
- MRI – Magnetic Resonance Imaging
- RNA – Ribonucleic Acid
- CEA – Carcinoembryonic antigen
- mRNA – Messenger Ribonucleic Acid
- RT – PCR – Reverse Transcriptase Polymerase Chain Reaction
Prof. MUDr. František Antoš, CSc.
Chirurgická
klinika
Budínova
2
180
81 Praha 8
e-mail:
frantisek.antos@fnb.cz
Sources
1. Saif, M. W., Siddiqui, I. A., Sohail, M. A. Management of ascites due to gastrointestinal malignancy. Ann. Saudi Med., 2009 Sept-Oct; 29(5): 369–377.
2. Becker, G., Galandi, D., Blum, H. E. Malignant ascites: systematic review and guideline for treatment. Eur. J. Cancer, 2006 Mar; 42(5): 589–972.
3. Smith, E. M., Jayson, G. C. The current and future management of malignant ascites. Clin. Oncol. (R. Coll. Radiol.), 2003 Apr; 15(2): 59–72.
4. Lin, O. Challenges in the interpretation of peritoneal cytologic speciments. Arch. Pathol. Lab. Med., 2009 May; 133 (5): 739–742.
5. Chung, M., Kozuch, P. Treatment of malignant ascites. Curr. Treat. Options Oncol., 2008 Jun; 9(2–3): 215–33. Epub 2008 Sep 6.
6. Hu, L., Hofmann, J., Holash, J., et al. Vascular endothelial growth factor trap combined with Paclitaxel strinkingly inhibits tumor and ascites, prolonging survival in a human ovarian cancer model. Clin. Cancer Res., 2005;11(19 ) October 1 : 6966–6971.
7. Los, G., Smals, O. A., van Vugt, M. J., van der Vlist, M., den Engelse, L., McVie, J. G., Pinedo, H. M. A rationale for carboplatin treatment and abdominal hyperthermia in cancers restricted to the peritoneal cavity. Cancer Res., 1992 Mar 1; 52(5): 1252–1258.
8. Adam, R. A., Adam, Y. G. Malignant ascites: past, present, and future. J. Am. Coll. Surg., 2004 Jun; 198(6): 999–1011.
9. Rosenshein, N., Blake, D., McIntyre, P. A., Parmley, T., Natarajan, T. K., Dvornicky, J., Nickoloff, E. The effect of volume on the distribution of substances instilled into the peritoneal cavity. Gynecol. Oncol., 1978 Feb; 6(1): 106–110.
10. Loggie, B. W., Fleming, R. A., McQuellon, R. P., Russell, G. B., Geisinger, K. R. Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for disseminated peritoneal cancer of gastrointestinal origin. Am. Surg., 2000 Jun; 66(6): 561–568.
11. Loggie, B. W., Perini, M., Fleming, R. A., Russell, G. B., Geisinger, K. Treatment and prevention of malignant ascites associated with disseminated intraperitoneal malignancies by aggressive combined-modality therapy. Am. Surg., 1997 Feb; 63(2): 137–143.
12. Loggie, B. W., Fleming, R. A., McQuellon, R. P., Russell, G. B., Geisinger, K. R., Levine, E. A. Prospective trial for the treatment of malignant peritoneal mesothelioma. Am. Surg., 2001 Oct; 67(10): 999–1003.
13. Gilly, F. N., Carry, P. Y., Brachet, A., Sayag, A. C., Panteix, G., Salle, B., Bienvenu, J., Banssillon, V., Burgard, G., Manchon, M., et al. Treatment of malignant peritoneal effusion in digestive and ovarian cancer. Med. Oncol. Tumor Pharmacother., 1992; 9(4): 177–181.
14. Francois, Y., et al. Intraperitoneal chemo-hyperthermia with mitomycin C in cancer of the stomach with peritoneal carcinosis. J. Chir. (paris), 1997; 134 (5–6): 237–242.
15. Garofalo, A., Valle, M., Garcia, J., Sugarbaker, P. H. Laparoscopic intraperitoneal hyperthermic chemotherapy for palliation of debilitating malignant ascites. Eur. J. Surg. Oncol., 2006 Aug; 32(6): 682–685. Epub 2006 Apr 21.
16. Kusano, H., et al. Continuous hyperthermic peritoneal perfusion (CHPP) for prevention or treatment of peritoneal dissemination. Gan To Kagaku Ryoho, 1993; 20 (11): 1622–1625
17. Verwaal, V. J., et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J. Clin. Oncol, 2003; 21(20): 3737–3743.
18. Valle, M., Speeten, V. M., Garofalo, A. Laparoscopic hyperthermic intraperitoneal peroperative chemotherapy ( HIPEC ) in the management of refractory malignit ascites : A muilti-institutional retrospective analysis in 52 patients. Eur. J. Surg. Oncol., 2008 Feb; 34(2): 154–158.
19. Facchiano, E., Scaringi, S., Kianmanesh, R., et al. Laparoscopic hyperthermic intraperitoneal chemotherapy (HIPEC) for the treatment of malignant ascites secondary to unresectable peritoneal carcinomatosis from advanced gastric cancer. Anticancer Res., 2009 Aug; 29(8): 3353–3359.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2010 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Spinal Cord Stab Injury Associated with Modified Brown-Séquard Syndrome Symptoms – A Case Review and Literature Overview
- Reliability of Load-Sharing Classification in Indications for Anterior Vertebral Body Replacement in Thoracolumbar Spine Fractures
- Peroperative Detection of Pulmonary Lesions during Mini-invasive Surgery
- Iatrogenic Injuries of the Pulmonary Artery
- Malignant Ascites – Optional Management using Hyperthermic Peroperative Chemotherapy (HIPEC)
- Mesenteric Ischemia – Late Diagnosis or Managed Disease?
- Perforation of the Intestine – Rare Complication of Choledocholithiasis
- Rare Tumors of the Gallbladder and Bile Ducts. A Case Review
- Surgical Treatment of Liver and Pulmonary Metastases of Colorectal Carcinoma
- Stapler Procedure for Anal Prolapse and Hemorrhoids: Long-term Results
- Improving of Treatment Safety in Emergency Thoracic Surgery
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Malignant Ascites – Optional Management using Hyperthermic Peroperative Chemotherapy (HIPEC)
- Mesenteric Ischemia – Late Diagnosis or Managed Disease?
- Stapler Procedure for Anal Prolapse and Hemorrhoids: Long-term Results
- Rare Tumors of the Gallbladder and Bile Ducts. A Case Review
