Ošetření pankreatické pooperační píštěle gastrofistuloanastomózou – soubor kazuistik
Postoperative pancreatic fistula management by gastrofistuloanastomosis – a set of case reports
High incidence of postoperative pancreatic fistulas after proximal pancreatoduodenectomy has lead surgeons to search for an effective approach to treatement this life-threatening complication. There is still an absence of therapeutic guidelines in this field.
The authors present 3 case reports of pancreatic fistula management with pancreaticojejunal anastomosis disconnection, retrogastric drainage and gastrofistuloanastomosis with good results.
Key words:
proximal duodenopancreatectomy – pancreatic fistula – gastrofistuloanastomosis
:
J. Rudiš; M. Ryska
:
Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta: prof. MUDr. M. Ryska, CSc.
:
Rozhl. Chir., 2012, roč. 91, č. 11, s. 620-624.
:
Case Report
Vysoké procento pooperačních pankreatických píštělí po provedené proximální pankreatoduodenektomii (PDE) vede chirurgy ke hledání postupu, jak tuto život ohrožující komplikaci v časném pooperačním období efektivně řešit. Jednoznačný doporučený postup doposud chybí.
Autoři prezentují na 3 kazuistikách metodu dekonexe pankreatické anatomózy a ošetření pankreatické píštěle fistulogastroanastomózou na založeném retrogastrickém drénu s dobrým výsledkem.
Klíčová slova:
proximální pankreatoduodenektomie – pankreatická píštěl – fistulogastroanastomóza
Úvod
Pankreatická píštěl po PDE (proximální pankreatoduodenektomie) je poměrně častou komplikací i v centrech pankreatické chirurgie. U 90–95 % nemocných je komplikace vyřešena konzervativním postupem [1]. Ve zbylém procentu si pooperační vývoj a zhoršující se celkový stav pacienta, především rozvoj septického stavu, vyžádá chirurgické řešení. I přes významný pokrok v chirurgii pankreatu nebyl dosud popsán nejvhodnější postup řešení.
Na několika případech si dovolujeme čtenáře seznámit s metodou ošetření pooperační pankreatické píštěle u nemocných po PDE tak, jak je v posledním období ošetřujeme na našem pracovišti.
Metodika
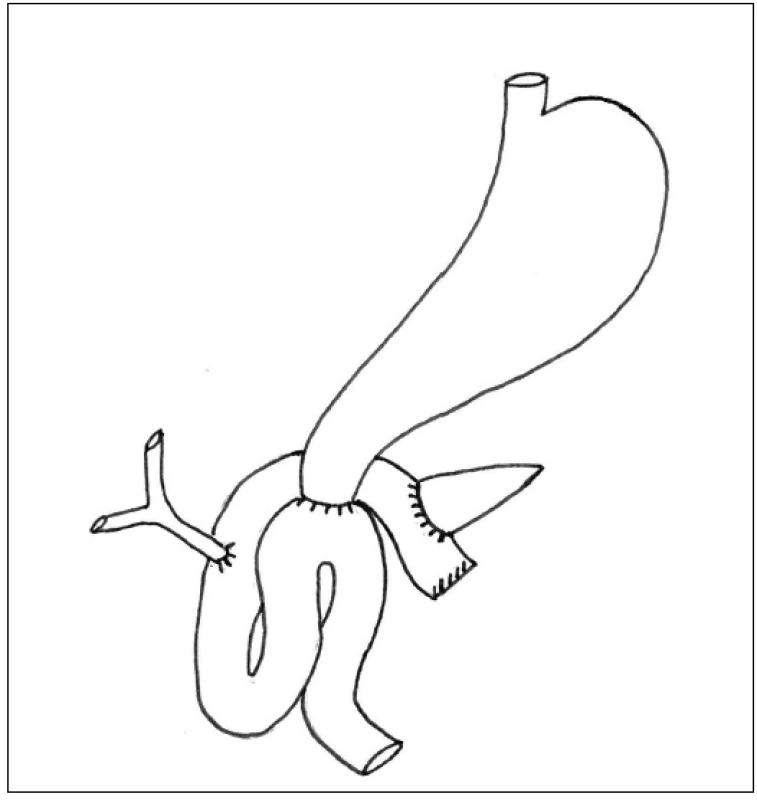
PDE provádíme u naprosté většiny nemocných v modifikaci podle Traverso-Longmire. Při rekonstrukční fázi obnovujeme kontinuitu trávicího traktu standardně tak, že šijeme postupně jednotlivé anastomózy na zaslepenou první jejunální kličku vytaženou dorzálně za radixem mezenteria. Postupujeme od pankreatojejunoanastomózy end-to-side (PJA) přes hepatikojejunoanastomózu end-to-side (HJA) a končíme duodenojejunoanastomózou end-to-side (DJA) – Obr. 1. Všechny anastomózy šijeme vstřebatelným stehem. PJA podle charakteru pankreatické tkáně šijeme obvykle jedno nebo dvouvrstevně s hlubokým zanořením pahýlu pankreatu do lumen jejuna.§
Při operační revizi pro klinicky závažnou dehiscenci anastomózy obvykle nacházíme okrajovou nekrózu pankreatu v místě založených jednotlivých Vicrylových stehů nebo obraz téměř kompletní dehiscence anastomózy v případě pooperační pankreatitidy. V obou případech provádíme dekonexi anastomózy s uzávěrem otvoru v kličce jejuna a zakládáme retrogastricky drenáž resekční plochy pankreatu s otevřeným d. pancreaticus (Obr. 2). Drenáž s použitím měkkého kulatého silikonového drénu o průměru cca 10–12 mm vyvádíme přes omentum v levém mezogastriu navenek.
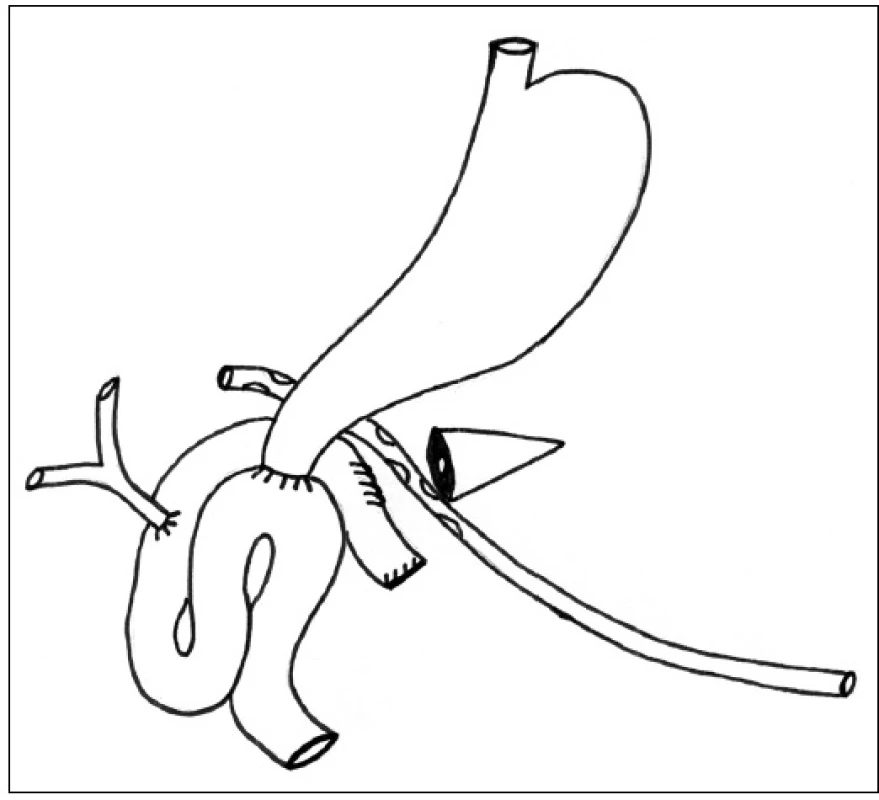
V případě nálezu peripankreatického abscesu s propagací do podjaterní krajiny vkládáme současně do této oblasti měkký kapilární drén, který vyvádíme v pravém mezogastriu. Tímto způsobem zajistíme účinnou drenáž pankreatické šťávy, kterou odvádíme v podobě zevní pankreatické píštěle do sběrného stomického sáčku, a vyčkáváme zhojení pacienta.
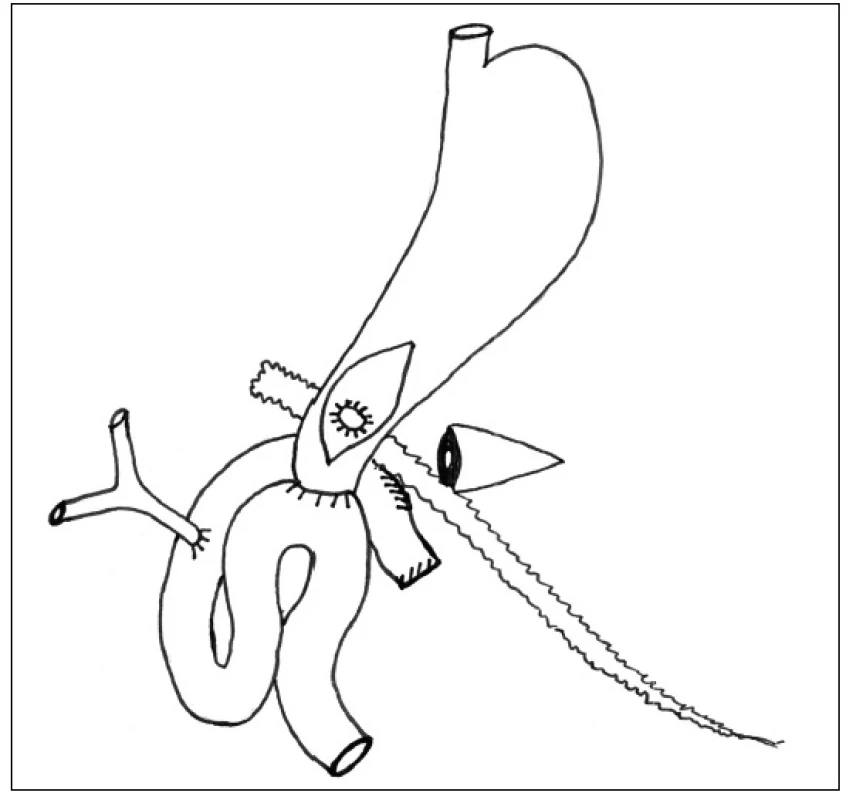
V druhé době v případě přetrvávající pankreatické sekrece po CT kontrolním vyšetřením s ozřejměním polohy drénu, většinou s cca 4–8týdenním odstupem od primárního operačního výkonu v závislosti na celkovém stavu pacienta, provedeme relaparotomii. Přes přední gastrotomii nahmatáme na zadní stěně žaludku výše popsaný kulatý drén, nad kterým provedeme podélnou zadní gastrotomii a principem Juraszovy operace našijeme gastrofistuloanastomózu (Obr. 3). Drén extrahujeme.
Kazuistika 1
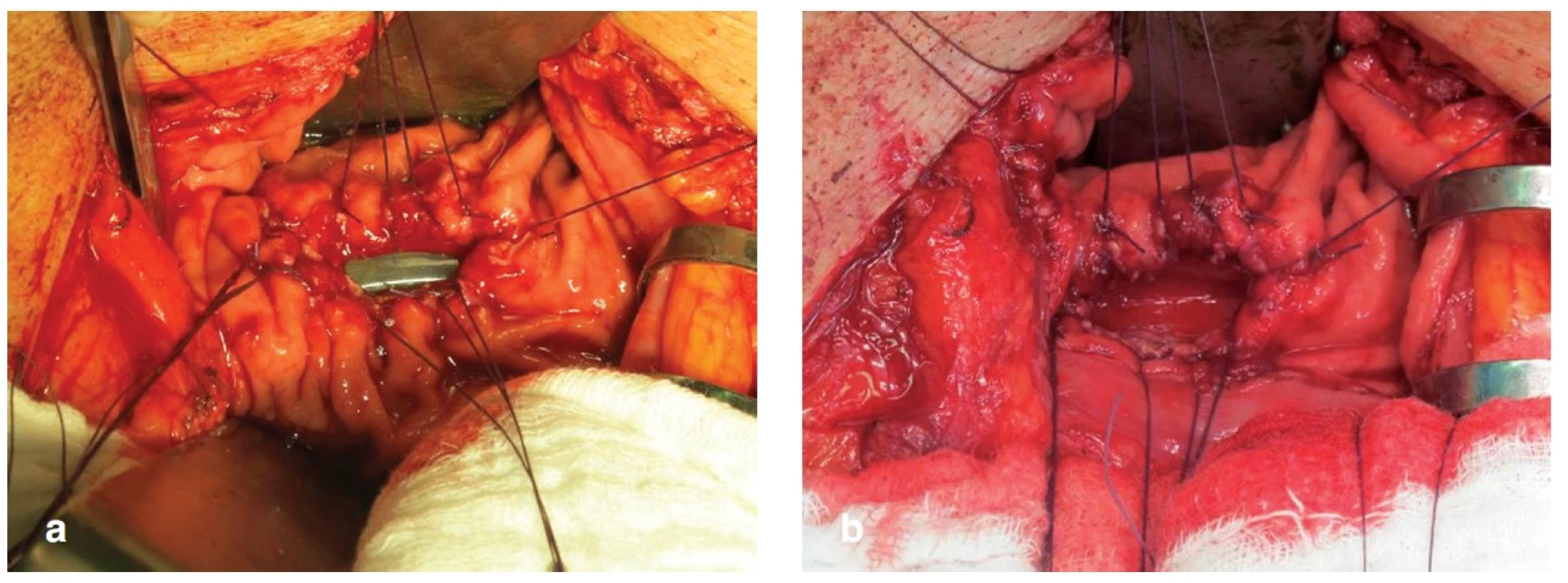
66letého pacienta, ASA II, jsme operovali pro duktální adenokarcinom hlavy pankreatu T3 NX M0. Provedli jsme pylorus šetřící PDE s krevní ztrátou do 1000 ml bez nutnosti peroperačního podání krevního převodu. 1. pooperační den (POD) byl pacient indikován k operační revizi pro známky krvácení do dutiny břišní. Nalezli jsme dysrupci PJA a krvácení z resekční plochy pankreatu. Krvácení jsme zastavili opichem drobné tepny a provedli re-PJA. 3. POD po revizi se objevila masivní enterální sekrece pojistným drénem a operační ranou. Při operační revizi jsme nalezli v podjaterní krajině rozsáhlý infikovaný bilom a po jeho odsátí známky natrávení peripankreatického tuku a zánětlivé infiltrace okolních tkání. Současně jsme objevili dehiscenci PJA ze dvou třetin předního obvodu s okrajovou nekrozou ve zbytku pankreatu. DJA byla intaktní. Celý proces byl ohraničen supramezokolicky. Vzhledem k nálezu jsme se rozhodli k provedení dekonekce PJA a cílené drenáži pankreatu. Po rozpojení PJA jsme pokračujícím stehem uzavřeli původní enterotomii ve vytažené jejunální kličce a z levého podžebří jsme přes ligámentum gastrokolikum zavedli cílenou drenáž k řezné ploše pankreatu. Konec drenu byl umístěn a fixován pod antrum žaludku tak, aby byl při následném výkonu dobře hmatný přes stěnu žaludku a umožnil tak snadné vytvoření FGA. Pooperační průběh byl bez komplikací a 10. POD byl pacient s drénem, který odváděl 400–600 ml čiré pankreatické šťávy, propuštěn do domácího ošetření. Po 3 měsících od založení retrogastrické drenáže byl přijat k plánovanému provedení gastrofistuloanastomózy (GFA). Z malé laparotomie jsme provedli přední gastrotomii v místě hmatného drénu a na zadní stěnu žaludku jsme našili GFA a drén extrahovali (Obr. 4a, b). Pooperační průběh byl nekomplikovaný, v místě stopy po extrahovaném drénu se dále již pankreatická šťáva neobjevila a 10. POD byl pacient propuštěn. Po 5 měsících od posledního výkonu je pacient bez zn. diabetu a nutnosti substituce pankreatickcýh enzymů v dobrém stavu v péči onkologa.
Kazuistika 2
62letý pacient, ASA II – III, byl indikovaný k resekčnímu výkonu pro cystický tumor hlavy pankreatu T3N1M0. Předoperační hladina albuminu byla 35 g/l. Peroperačně byla žláza v místě resekční plochy měkká (tzv. soft tissue) s 3 mm širokým pankreatickým vývodem. Provedli jsme pylorus zachovávající PDE s krevní ztrátou do 200 ml. 7. POD se objevila enterální sekrece v operační ráně. Při CT vyšetření byla vyslovena suspekce na dehiscenci duodenojejunoanastomózy s retencí tekutiny v okolí. Pro narůstající enterální odpady ranou a celkové zhoršení stavu jsme 8. POD indikovali operační revizi s nálezem dehiscence v rozsahu 1/3 obvodu DJA s okrajovými nekrózami. Dále jsme nalezli drobný únik pankreatické šťávy z přední strany PJA. Rozhodli jsme se situaci vyřešit provedením antrektomie s gastroenteroanastomózou (GEA) na okludovanou jejunální kličku podle Rouxe. Současně jsme k PJA a do podjaterní krajiny založili 2 měkké silikonové drény. Výkon proběhl bez komplikací s krevní ztrátou 200 ml. 2. POD se objevila biliární sekrece drénem v pravém mezogastriu. 3. POD jsme pro zvyšující se biliární sekreci a celkové zhoršení stavu pacienta indikovali k operační revizi. Při ní jsme nalezli okrajovou nekrózu pankreatu v rozsahu 2/3 PJA (Obr. 5). Provedli jsme dekonexi PJA a založili retrogastricky 12 mm široký měkký silikonový drén k resekční ploše pankreatu. Drén jsme vyvedli přes omentální burzu v levém hypochondriu. 15. POD jsme pacienta s ponechaným drénem propustili do domácí péče. Po 6 týdnech odpady pankreatické šťávy drénem téměř ustaly. Kontrolní CT neprokázalo retenci tekutiny v dutině břišní. Drén jsme odstranili. V současné době je pacient 5 měsíců v dobrém stavu na substituci exokrinní funkce pankreatu bez klinických zn. pankreatické píštěle. Dle kontrolního CT po 5 měsících od výkonu nezobrazena patologická tekutinová kolekce v dutině břišní.
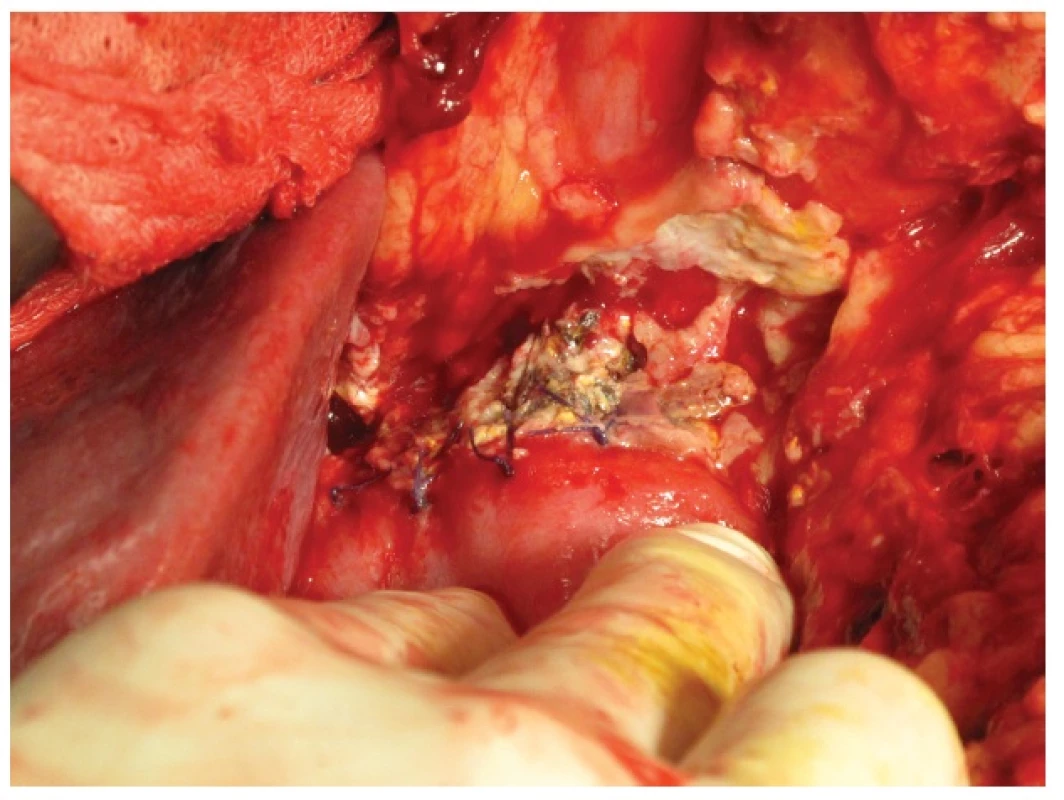
Kazuistika 3
U 66letého muže jsme provedli PDE pro cystický tumor hlavy pankreatu s definitivní klasifikací T3N1M0. Předoperační hodnota albuminu byla 35 g/l. Operační výkon trval 225 min. Operační krevní ztrátu 700 ml, způsobenou krvácením z poranění v. portae pod krčkem pankreatu při preparaci, jsme hradili 2j Ery masy. Průběh anestezie nebyl komplikovaný. 8. POD se objevil postupný vzestup zánětlivých parametrů a známky gastrické parézy. 10. POD jsme indikovali operační revizi pro rozvoj septického stavu a známky enterální píštěle v operační ráně. Při relaparotomii jsme nalezli částečnou dehiscenci DJA a téměř kompletní dehiscenci PJA s abscesem podjaterní krajiny. Po toaletě supramezokolické oblasti a podjaterní krajiny jsme provedli dekonexi PJA a duodenum jsme našili na exkludovanou kličku jejunální podle Rouxe. Současně jsme založili 12 mm silný silikonový drén retrogastricky k resekční ploše pankreatu a vyvedli jej z dutiny břišní přes ligamentum gastrocolicum v levém podžebří. Pooperační průběh s ponechanou drenáží byl nekomplikovaný. Po 3 týdnech od poslední revize byla neinformovaným lékařem při ambulantní kontrole drenáž odstraněna a stopou po drénu postupně docházelo následující dny k poklesu pankreatické sekrece. Nicméně pro klinické známky retence obsahu v dutině břišní jsme indikovali CT vyšetření, při kterém se zobrazila retrogastrická kolekce v místě původně zavedeného drénu (Obr. 6). Pro obavu z rozvoje septického stavu jsme se rozhodli k revizi, při které jsme založili fistulogastroanastomózu na principu Juraszovy operace (Obr. 6). Pooperační období proběhlo bez komplikací a pacient byl 10. POD propuštěn do domácího ošetření.
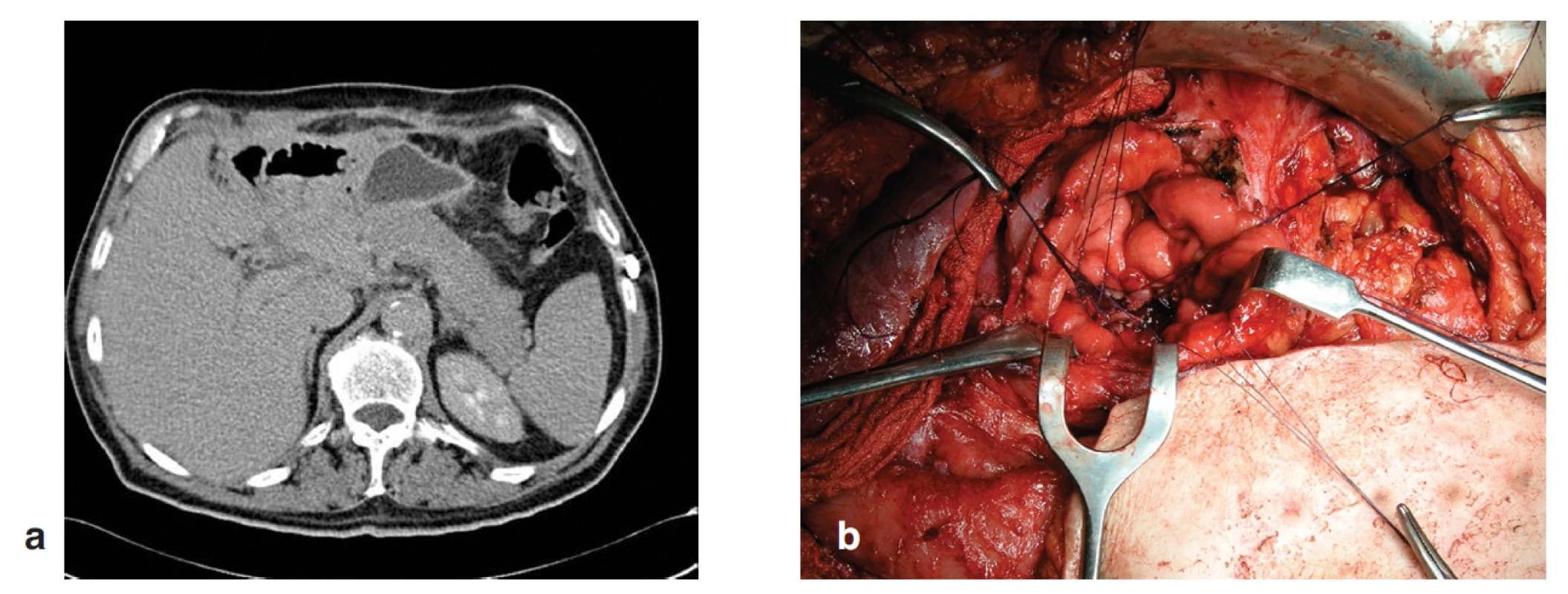
Nyní je 4 roky po operaci, je v dobrém stavu, který nevyžaduje ani substituční enzymatickou léčbu.
Diskuze
Pankreatické píštěle po proximálních resekcích pankreatu jsou v současné době i ve vyspělých světových centrech komplikací, která je pozorována v průměru u každého desátého pacienta. Výskyt je popisován v rozmezí 2–30 % v závislosti na použité klasifikaci [3–10]. Podle mezinárodně uznávané klasifikace ISGPF z roku 2005 (3) jsou úniky – leaky – pankreatické šťávy v současné době děleny do 3 skupin dle klinického dopadu na zdravotní stav a průběh léčby pacienta – Tab. 1.
![Klasifikace pankreatických píštělí po PDE [3]
Tab. 1: Classification of pancreatic fistulas following PDE [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b5d811d80de976362bb29674ffa49e69.png)
Leaky typu A a B jsou řešeny většinou konzervativně radiologicky a významně neovlivňují pooperační průběh onemocnění. Leaky typu C se závažným klinickým dopadem často vyžadují opakované operační revize a dlouhodobý pobyt pacienta na jednotce intenzivní péče (2).
I přes významný pokrok v pankreatické chirurgii v posledních dvou dekádách nebyl nalezen jednotný postup při ošetření takto závažné komplikace. Vedle různých typů chirurgických drenážních výkonů bylo řadou autorů často preferováno „jako život zachraňující výkon“ dokončení operace na totální pankreatektomii se splenektomií [6, 7, 8]. Tento zdánlivě jednoduchý výkon se u pozdně manifestovaných leaků s nutností operační revize v terénu těžkých zánětlivých změn ukazuje často jako velmi obtížný a rizikový. Komplikovaný pooperační průběh lze očekávat i vzhledem k pooperační imunosupresi u splenektomovaných pacientů. Navíc je nutné zvážit i výrazně zhoršenou kvalitu života při nutnosti trvalé inzulinoterapie a substituce pankreatických enzymů.
Pro obecně udávanou vysokou mortalitu u těchto výkonů dosahující 50–90 % již v dnešní době řada autorů od tohoto postupu upustila [4, 9].
Další z uváděných metod ošetření závažného pankreatického leaku je dekonexe PJA a současná konverze PJA na PGA. Bachelier se spoluautory na malé sestavě nemocných prokázali dobré výsledky [11]. Metoda je však limitována příznivým anatomickým umístěním a dobrou mobilizovatelností zbytku pankreatu vzhledem k zadní stěně žaludku. Obecně lze říci, že výše uvedené postupy lze doporučit při vzniku závažné komplikace v časném pooperačním období, kdy je operační terén ještě relativně příznivý a umožňuje preparaci tkání.
Námi uvedený postup jsme použili opakovaně u komplikace v terénu kombinované dehiscence a těžkých zánětlivých a infiltrativních změn tkání. Náš malý soubor pacientů neumožňuje naše výsledky zobecnit. Nicméně lze usuzovat, že metoda umožňuje efektivní technicky nenáročné ošetření jak peroperačně, tak i pooperačně.
Závěr
Pankreatická pooperační píštěl je stále nejzávažnější komplikací resekčního výkonu na pankreatu. Je třeba co nejrychleji komplikaci diagnostikovat a rozhodnout o postupu, který je pro pacienta nejvýhodnější. Metoda dekonexe PJA se založením dlouhodobé drenáže pankreatické šťávy z oblasti resekční plochy pankreatu a následnou FGA se ukazuje jako použitelná u nejzávažnějších komplikací včetně pooperační pankreatitidy. Při operačních revizích pro takto závažné nálezy bude vždy rozhodnutí a konečný výsledek záviset na zkušenostech a odhadu chirurga. Péče o tyto pacienty musí být komplexní a systematická a vyžaduje často dlouhodobou týmovou spolupráci chirurga, intenzivisty a intervenčního radiologa.
Zkratky
PDE – Proximální pankreatduodenktomie
PJA – Pankreatojejunoanastomóza
HJA – Hepatikojejunoanastomóza
GFA – Gastrofistuloanastomóza
MUDr. Jan Rudiš
Chirurgická klinika 2. LF UK a ÚVN, Praha
U vojenské nemocnice 1200
160 00 Praha 6
e-mail: jan.rudis@uvn.cz
Sources
1. Kazanjian KK, Hines OJ, Eibl G et al. Management of pancreatic fistulas after pancreaticoduodenectomy: results in 437 consecutive patients. Arch Surg 2005;140(9):849–855.
2. Dellaportas D, Tympa A, Nastos C et al. An ongoing dispute in the management of severe pancreatic fistula: Pancreatosplenectomy or not? World Journal of Gastrointestinal Surgery 2010;11:381–384.
3. Bassi C, Dervenis C, Fingerhut A et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138:8–13.
4. Cullen JJ, Sarr MG, Iistrup DM. Pancreatic anastomotic leak after pancreaticoduodenectomy: incidence, significance and management. Am J Surg 1994;168:295–298.
5. Farley DR, Schwall G, Trede M. Completion pancreatectomy for surgical complications after pancreaticoduodenectomy. BJS 1996;83:176–179.
6. van Berge Henegouwen ML, De Wit LT, van Gulik TM et al. Incidence, risk factors and treatment of pancreatic leakage after pancreaticoduodenectomy: drainage versus resection of the pancreatic remnant. J Am Coll Surg 1997;185:18–24.
7. Fuks D, Piessen G, Heut E, Tavernier M et al. Life-threatening postoperative pancreatic fistula (grade C) after pancreaticoduodenectomy: incidence, prognosis and risk factors. Am J Surg 2009;197:702–709.
8. De Castro SM, Busch OR, van Gulik TM et al. Incidence and management of pancreatic leakage after pancreatoduodenectomy. BJS 2005;92:1117–1123.
9. Büchler MW, Wagner M, Schmied BM et al. Changes in morbidity after pancreatic resection: toward the end of completion pancreatectomy. Arch Surg 2003;138:1310–1314. Discussion 1315.
10. Haddad LB, Scatton O, Randone B et al. Pancreatic fistula after pancreaticoduodenectomy: the conservative treatment of choice. HPB (Oxford), 2009;11:203–209.
11. Bachellier P, Ousssoultzoglou E, Rosso E et al. Pancreatico gastrostomy as a salvage procedure to treat severe postoperative pancreatic fistula after Pancreaticoduodenectomy. Arch Surg 2008;143(10): 966–970.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2012 Issue 11
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Current Insights into the Antispasmodic and Analgesic Effects of Metamizole on the Gastrointestinal Tract
Most read in this issue
- Repeated surgery for parathyroid carcinoma
- Current microsurgical and neurointerventional therapy of cerebral aneurysms
- Postoperative pancreatic fistula management by gastrofistuloanastomosis – a set of case reports
- The NanoKnife and two successful cases of intracavitary irreversible electroporation of main bronchus tumours
