Totální pelvická exenterace – strategie výkonu
Total pelvic exenteration – strategy of the surgery
Introduction:
Total pelvic exenteration (TPE) has a key role in the complex treatment of advanced T4 tumours of the small pelvis, which cannot be radically removed by a less invasive procedure. The aim of this work is to summarize the strategy of TPE, perioperative care of the patients, complications of the intervention and their management.
Methods:
Overview of the current literature and the authors’ experience, based on our own group of 37 patients after TPE performed during the period 1999–2012.
Conclusion:
This article aims to summarize the strategy of TPE, complications and the authors’ own experience.
Key words:
total pelvic exenteration – strategy of the surgery – complications
Authors:
V. Visokai; L. Lipská; M. Levý; J. Šimša
Authors‘ workplace:
Chirurgická klinika 1. LF UK a Thomayerovy nemocnice, přednosta: Doc. MUDr. J. Šimša, Ph. D.
Published in:
Rozhl. Chir., 2014, roč. 93, č. 1, s. 38-45.
Category:
Various Specialization
Práce vznikla s podporou projektu PRVOUK.
Práce je určena k postgraduálnímu vzdělávání lékařů.
Overview
Úvod:
Totální pelvická exenterace (TPE) je základem komplexní léčby pokročilých T4 nádorů malé pánve, které nelze radikálně odstranit méně rozsáhlým operačním výkonem. Cílem práce je shrnout strategii TPE, perioperační péči o nemocné, komplikace výkonu a možnosti jejich řešení.
Metody:
Práce vychází z přehledu aktuální literatury a zkušeností autorů z vlastního souboru 37 nemocných, u kterých byla v letech 1999–2012 provedena TPE.
Závěr:
Práce shrnuje strategii TPE, komplikace výkonu a vlastní zkušenosti autorů.
Klíčová slova:
totální pelvická exenterace – strategie výkonu – komplikace
ÚVOD
Totální pelvická exenterace, dále jen TPE, je základem komplexní léčby pokročilých T4 nádorů malé pánve, které nelze radikálně odstranit méně rozsáhlým, byť multiviscerálním resekčním výkonem. K pánevní exenteraci jsou indikováni nemocní s lokálně pokročilým, primárním nebo recidivujícím nádorem kolorektálního původu, dále pak nemocní s některými typy nádorů původu gynekologického a urologického. Klasifikace a typy pánevních exenterací, indikace, kontraindikace i předoperační rozvaha u nemocných byly podrobně probrány v předchozím článku tohoto postgraduálního bloku.
Cílem tohoto článku postgraduálního bloku je shrnout přípravu nemocného k operaci s ohledem na specifika mnohahodinového výkonu, a to jak z pohledu chirurgického, tak anesteziologického. Podrobně je popsána vlastní strategie totální pelvické exenterace a jednotlivé kroky během resekční i rekonstrukční fáze výkonu. V neposlední řadě pak jsou uvedena specifika pooperační péče, možné komplikace výkonu a možnosti jejich řešení.
METODY
Příprava pacienta před plánovanou TPE spočívá v ortográdní přípravě střeva, doplněné o výplach rekta s roztokem betadinu (pokud rektum nebylo již dříve odstraněno). U žen vyplachujeme roztokem s betadinou vždy i pochvu. Někteří autoři doporučují navíc i zavedení močového katétru do rekta a jeho napojení na uzavřený drenážní systém s cílem udržet prázdné rektum po celou dobu operace. V rámci optimálního operačního zajištění zavádíme nasogastrickou a nasojejunální sondu, provádí se kanylace centrální žíly, periferní arterie a často i dalších dvou periferních žil. Močový měchýř je derivován standardním močovým katétrem, předoperační sondáž ureterů nevyžadujeme. Pro prevenci tromboembolické choroby aplikujeme nízkomolekulární heparin. Operujeme v chráněném koagulu, profylaktické podání antibiotik znamená na našem pracovišti kombinaci amoxicilin s metronidazolem nebo cefalosporin s metronidazolem. Pacient je uložen na operační stůl s vyhřívanou podložkou, obdobně jako u výkonů na dolním rektu, v poloze na zádech s dolními končetinami uloženými do nožních podpěrek v semiflexi v kyčelních a kolenních kloubech. Důležité je, aby pánev a špička kostrče přesahovaly okraj stolu. Uložení pacienta musí být velmi precizní s vypodložením všech částí tak, aby nedošlo ke vzniku tlakových nekróz kůže v místě nerovností nebo záhybů na podložce (Obr. 1). Důležité je také předcházet zatečení dezinfekčních roztoků, které mohou při přímém styku s kůží během mnohahodinové operace vést k jejímu vážnému poškození.
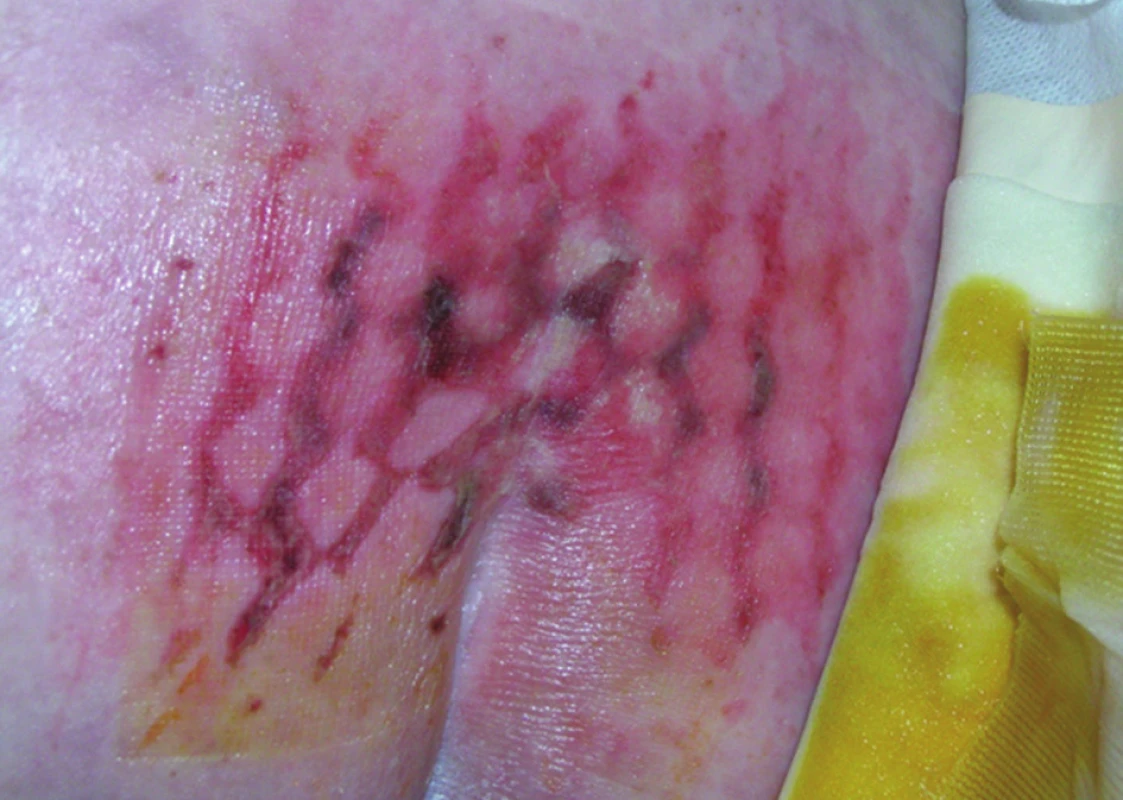
K prevenci dlouhodobé venostázy dolních končetin lze použít přístroje, které masáží lýtek urychlují žilní návrat z končetin. Z pohledu zachování tělesné homeostázy a funkční koagulační kaskády je extrémně důležité zabránit poklesu teploty tělesného jádra. Používáme proto velkoobjemové zařízení na ohřev infuzí, vyhřívanou podložku operačního stolu a některá další technická zařízení (vyhřívané oblečky, vhánění teplého vzduchu pod roušky mimo operační pole na horní polovinu těla). Podchlazení pacienta při dlouhotrvající operaci může vést k rozvoji závažných komplikací jak v průběhu operace, tak v pooperačním období.
Operační postup
Operaci začínáme dlouhou střední laparotomií od symfýzy, s protažením řezu okolo pupku až do epigastria. Je-li pochybnost o operabilitě nádoru nebo je-li podezření na jeho generalizaci, je vhodné výkon zahájit diagnostickou laparoskopií. Je-li v dutině břišní výpotek, odebíráme cca 20 ml tekutiny z malé pánve na rychlé cytologické vyšetření. Pokud vyšetření potvrdí přítomnost volných nádorových buněk, je nutné indikaci k TPE znovu zvážit, zejména s ohledem na kvalitu života nemocného. Zhodnocení resekability nádoru je pro provedení exenterační operace samozřejmě zásadní. Perioperačně prokázaný nádorový rozsev v dutině břišní, lokální neresekabilita nebo nádor rostoucí extrapelvicky znemožňují přibližně u 25–30 % nemocných exenterační výkon provést [1]. Vždy je nutné uvolnit všechny adheze po předchozích operacích, aby byla celá dutina břišní včetně parenchymatózních orgánů přístupná revizi. Dále pokračujeme zhodnocením nálezu v malé pánvi. Zde musíme postupovat extrémně opatrně, aby nedošlo k náhodnému uvolnění k nádoru adherujících kliček tenkého střeva, omenta, céka, vnitřních rodidel atd. K nádoru adherující orgány nikdy neuvolňujeme, ale pečlivě je chráníme zabalením do vlhkých roušek před jejich nechtěným odtržením od tumoru. Revizi celé dutiny břišní a malé pánve vždy věnujeme mimořádnou pozornost, systematicky vyšetřujeme peritoneum i omentum, kde pátráme po implantačních metastázách, vyšetřujeme celé tenké střevo včetně jeho závěsů, palpací obturátorových prostor a bočních pánevních stěn vyhodnocujeme, zda tumor nepřesahuje za musculus psoas. Vyšetřujeme také uzliny podél aorty a dolní duté žíly (VCI). Z pohledu operability je klíčové zhodnocení invaze nádoru do společných ilických cév, které většinou znamená kontraindikaci exenterace. Přesto již dnes lze v literatuře nalézt publikace o kurativních exenteracích pro recidivující karcinom rekta s resekcí ilických tepen a jejich rekonstrukcí [2].
Dalším obligátním krokem na našem pracovišti je prohlédnutí a palpační vyšetření obou laloků jater, na které navazuje perioperační ultrazvukové vyšetření jater. V případě nálezu suspektních ložisek v játrech, která nebyla předoperačně detekována, je nezbytné určit, zda a v jakém rozsahu by byla tato ložiska resekabilní. Podle velikosti, počtu a lokalizace metastáz uvažujeme, zda je možné a vhodné řešit nález synchronně, nebo až v druhé době. Rozhodnutí a nález je vždy nutné přesně popsat v operačním protokolu. Na našem pracovišti se kloníme k názoru, že nález solitární resekabilní jaterní metastázy není absolutní kontraindikací exenterační operace a lze – za příznivých anatomických poměrů – provést i její jednodobou resekci. Při hodnocení operability nádoru v malé pánvi revidujeme jako první stranu, kde tumor naléhá intimněji na stěny pánve. Hodnotíme, zda je nádor volný nebo fixovaný, případně v jakém rozsahu.
Resekční fázi zahajujeme protětím zadního nástěnného peritonea kauterem kolem baze céka a radixu terminálního ilea. Tím je uvolníme od retroperitonea a cékum s částí vzestupného tračníku, radixem terminálního ilea a tenkými kličkami zavineme do vlhkých břišních roušek. Tento „balík“ poté přesuneme pod mezokolon příčného tračníku, kde vše fixujeme středovým autofixačním retraktorem zavedeným do horního pólu laparotomie. Tlak retraktoru a počet roušek musí být přiměřený, aby nedošlo k uvolňování kliček do operačního pole v průběhu operace, nebo naopak tlakem roušek k elevaci bránice a kompresi VCI nebo hepatálních žil. Jejich útlak může značně omezit žilní návrat a způsobit závažnou hypotenzi. Poté zavádíme další retraktory po stranách laparotomie.
Nedílnou a významnou součástí TPE je široká exenterace retroperitonea, při které postupujeme od nejvzdálenějších proximálních i laterálních oblastí kaudálně do malé pánve. Napříč protínáme zadní nástěnné peritoneum v úrovni dolního okraje duodena. Po stranách postupujeme až k oběma ureterům, které obkroužíme a pověsíme na závěs (Obr. 2). Podél ureterů postupujeme kaudálně a protínáme celé zadní nástěnné peritoneum až k promontoriu, resp. k bifurkaci aorty. Odtud pokračuje řez obloukem podél okraje pánve dopředu kolem močového měchýře, kde se obě linie spojí. Tím obnažíme oba ilické svazky až do hlubokých inguinálních prostor. Spojením incizí peritonea vznikne jakýsi obdélníkový půdorys rozsahu exenterace retroperitonea, proximálně od úrovně retroperitoneální porce duodena napříč laterálně od přechodu nástěnného peritonea na mezokolon levého tračníku a zleva podél okraje pánve k symfýze. Při plánované TPE není důvod šetřit vegetativní nervy, exenterujeme proto veškerou tukovou tkáň z retroperitonea v uvedeném rozsahu.
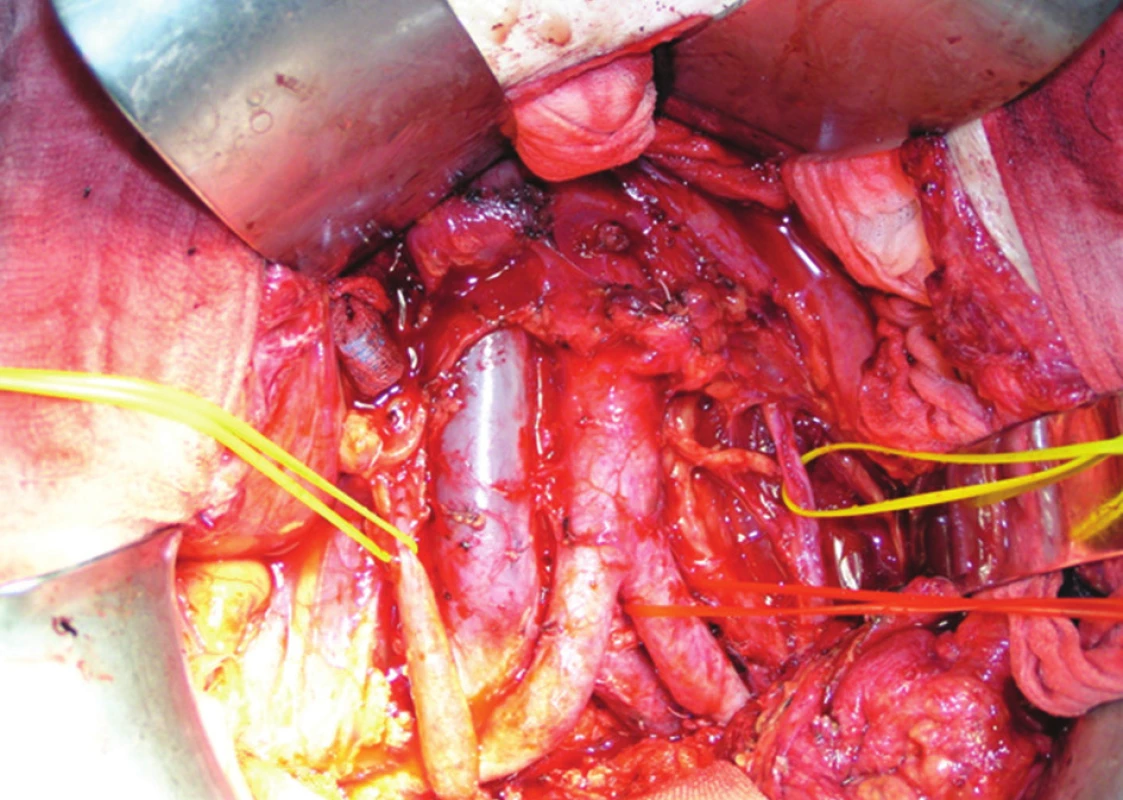
Uvolnění nádoru v malé pánvi začínáme preparací pod bifurkací aorty a junkcí obou společných ilických žil, pozor je potřeba dát zejména na poranění levé ilické žíly, která není z ventrální strany kryta levou ilickou tepnou. Ostře pronikáme presakrálně a uvolňujeme rektum s totální excizí mezorekta (TME), pokud již nebylo odstraněno při předchozích operacích. Uvolnění rekta od přední plochy křížové kosti až pod kostrč provádíme po celou dobu ostře nebo kauterem pod vizuální kontrolou a s extrémní opatrností, aby nedošlo k laceraci jemné fascie kryjící mezorektum. Tkáň mezorekta je místem přímého prorůstání nebo lymfatického šíření nádoru a lacerace jemné fascia propria kryjící je hlavní příčinou vzniku lokální recidivy. V důsledku neadekvátní chirurgické techniky tupou preparací digitálně hrozí iatrogenní diseminace nádoru. Pozitivita nádoru v cirkumferenčním okraji resekční linie (R1) pak dosahuje 20–36 % [3]. Při ostré preparaci TME se naopak absence nádoru v cirkumferenční linii resekce uvádí až v 93 % [4].
Operační strategie u recidivujícího tumoru spočívá v tom, že disekci a mobilizaci začínáme v nejvzdálenějších oblastech a postupujeme od snadné exenterace k obtížnějším, až do oblastí nádorově nebo jizevnatě změněných po předchozích operacích, do kterých mohou být zavzaty důležité struktury, např. ilické svazky, dolní dutá žíla (VCI) nebo aorta. Poranění těchto struktur může vést k život ohrožujícímu krvácení a může značně zkomplikovat až zastavit plánovanou exenterační operaci. Nádorem postižené orgány během výkonu postupně kryjeme uvolněným peritoneem, chirurg by se neměl do přímého kontaktu s nádorem vůbec dostat. Jen tak lze maximálně snížit riziko rozsevu nádorových buněk v průběhu operace. Lymfadenektomii paraaortální a parakavální začínáme kraniálně v úrovni křížení levé renální žíly a aorty, po odklopení hlavy pankreatu. Postupujeme kaudálně a laterálně podél obou ureterů, které musíme mít po celou dobu pod vizuální kontrolou. Vzhledem k tomu, že součástí totální pelvické exenterace je i odstranění močového měchýře, odstraňujeme s veškerou tukovou tkání i nervové tkáně podél aorty a VCI až na jejich bifurkaci, s podvazem a protětím dolní mezenterické arterie (AMI) u jejího odstupu z aorty (vysoká ligatura AMI). Dolní mezenterickou žílu protínáme mezi ligaturami při dolní hraně těla pankreatu. Odstraňujeme uzliny a tukovou tkáň podél aorty a VCI až k bifurkaci aorty na promontoriu. Laterálně tvoří hranici exenterace retroperitonea uretery. Zde je důležité neporušit jejich cévní zásobení. Ischemie močovodu by vyžadovala jejich resekci v delším úseku a mohla by komplikovat konstrukci urostomie. Vyznačíme orální linii resekce tračníku, který prošíváme lineárním staplerem, protínáme mezokolon levého tračníku tak, aby založení terminální kolostomie ve vyznačeném místě bylo bez tahu a s dobrou trofikou. Při plánované supralevátorové exenteraci je nutné zajistit dostatečnou délku i vitalitu tračníku, který umožní konstrukci kolorektální (koloanální) anastomózy. Toho lze nejlépe dosáhnout protětím splenokolického a gastrokolického ligamenta, kdy široce otevřeme omentální burzu a uvolníme radix mezokolon příčného tračníku od dolního okraje těla slinivky až do úrovně středních kolických cév. Po uvolnění lienálního ohbí od nástěnného peritonea a od Gerotovy fascie přesuneme tračník s mezokolon mediokaudálně směrem do pánve. Uvedený postup většinou umožní konstrukci nízké anastomózy s dobrou trofikou a bez napětí.
V následující fázi operace vstupujeme do malé pánve a provádíme laterální disekci. Její rozsah závisí jednak na rozsahu nádorové infiltrace, jednak na vztahu nádoru k laterální stěně pánve. Laterální disekce uzlin začínáme od bifurkace aorty, kde využijeme již dříve provedenou incizi parietální endopelvické fascie mediálně od genitofemorálního nervu, který leží na musculus psoas a který šetříme. Fascie kryje společnou a zevní ilickou tepnu, ty uvolňujeme a obnažujeme, obkroužíme a pověsíme na závěs. V této fázi protínáme mezi ligaturami u mužů testikulární cévy, u žen ovariální cévy a ligamentum teres uteri. Tukovou a lymfatickou tkáň kolem bifurkace a kolem ilických cév odstraňujeme en bloc, obdobně postupujeme dále podél společných a zevních ilických cév až do oblasti hlubokých tříselných uzlin, které též resekujeme. Stejně postupujeme na protilehlé straně. V této fázi také preparujeme odstup vnitřní ilické tepny a žíly oboustranně. Z předchozí incize peritonea již máme otevřený retrorektální a retroprostatický (retrovaginální) prostor, do kterého zavedeme dlouhý retraktor a tahem kaudálně pronikáme pod vizuální kontrolou ze střední čáry ostře laterálně na obou stranách a obnažujeme pelvické nervy. Rektum je fixované k boční stěně pánve nervovými vlákny autonomního nervového plexu ležícího mezi vnitřními ilickými cévami a laterální stěnou rekta. Tah rekta doleva usnadní protětí tohoto spojení a umožní disekci podél vnitřní strany arteria ilica interna a exenteraci uzlin z pravé strany pánevní stěny. Současně se obnaží fascie musculus piriformis. Ostrá preparace v této oblasti musí být extrémně opatrná a pod kontrolou zraku. Obnažíme mediální plochu pravé vnitřní ilické tepny a žíly a ligujeme a protínáme všechny jejich viscerální větve – horní i dolní vezikální, pudendální a střední rektální (Obr. 3).
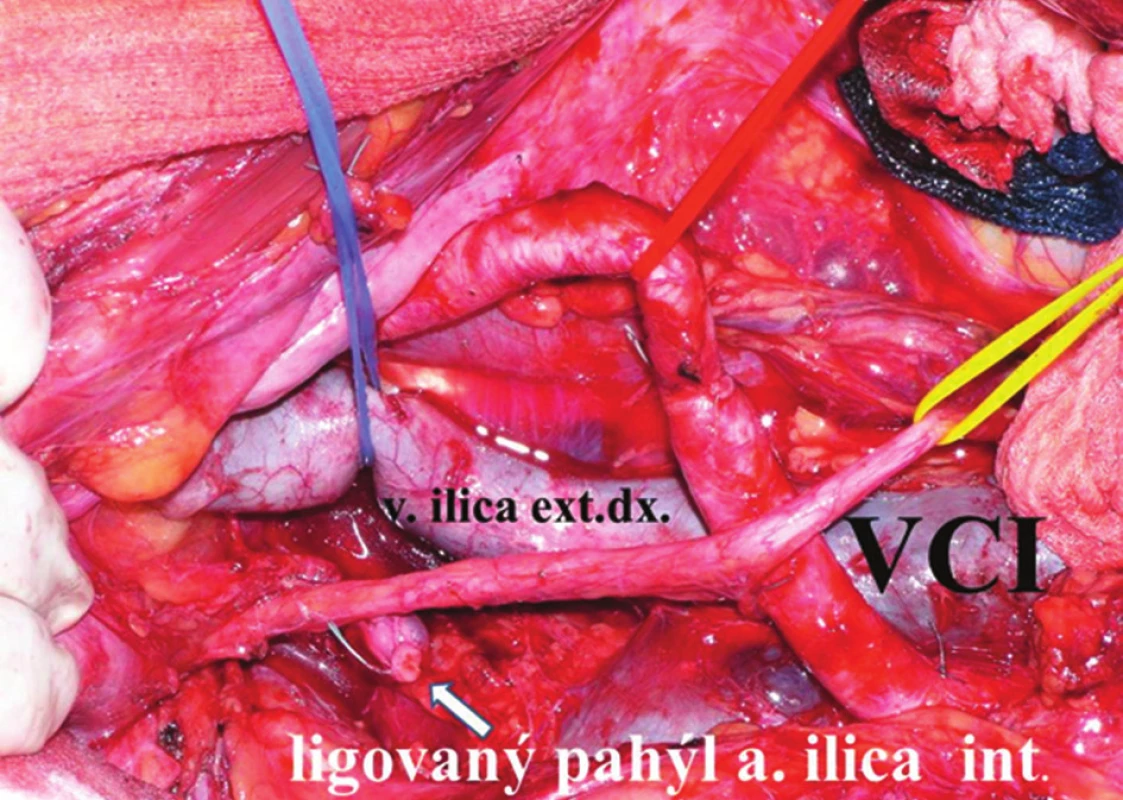
Přístup do pravého obturátorového prostoru získáme odstraněním všech tkání kolem společných a zevních ilických cév. V místě bifurkace zevních a vnitřních ilik otevřeme obturátorový prostor a vypreparujeme v něm probíhající n. obturatorius. Následuje exenterace laterální části obturátorového prostoru, na spodině zůstává m. obturatorius int. Chráníme obturátorový nerv před poraněním a exenterujeme zbytek prostoru až k m. levator ani. Tento sval vzniká jako pokračování fascie m. obturatororius internus. V průběhu exenterace obturátorového prostoru identifikujeme sakrální plexus tvořený kořeny S2–S5, který leží dorzálně a laterálně od n. obturatorius. V této oblasti preparujeme ostře branžemi nůžek s extrémní opatrností pod kontrolou zraku. Krvácení z žilních spojek je velmi závažné v důsledku velkých a rychlých krevních ztrát. Hemostáza je obtížná, provádíme ji pomocí bipolární koagulace nebo tamponády. Exenterace obturátorového prostoru při zachování vnitřních ilických cév a jejich větví je obtížná a může být nekompletní. Při podezření na postižení obturátorových nebo vnitřních ilických uzlin podle CT nebo NMR vyšetření a také při palpačním perioperačním vyšetření bočních stěn pánve indikujeme laterální disekci kombinovanou s resekcí vnitřních ilických cév. Postup je stejný s expozicí společných ilických cév a s obnažením jejich větvení na zevní a vnitřní iliky. Uvolníme vnitřní ilickou tepnu od pod ní probíhající vnitřní ilické žíly. Preparace musí být velmi šetrná, zejména pokud jsou zřejmé sklerotické změny na tepnách. Obkroužíme zevní ilickou tepnu a pověsíme ji na závěs, vnitřní ilickou tepnu dvojmo ligujeme buď v bifurkaci, nebo až po odstupu a. glutealis sup., která je první větví odstupující dorzálně z a. ilica int. Její zachování má význam při použití muskulokutánního laloku ke krytí rozsáhlých defektů po kompozitních exenteracích. Ligatura a. glutealis sup. by v tomto případě ohrozila výživu laloku. Laterální disekci kombinovanou s resekcí vnitřních ilických cév můžeme provést na jedné, nebo na obou stranách, a to zejména podle stavu mízních uzlin. Vnitřní ilickou žílu v této fázi neligujeme a ponecháváme ji na závěsu. Důvodem je lepší žilní drenáž z perivezikálních a periprostatických plexů a snížení krevních ztrát při manipulaci s prostatou. Jakmile přerušíme kontinuitu střeva, močového traktu nebo velké cévy a nervy zásobující pánevní orgány, dostáváme se do nevratné fáze pánevní exenterace. Močovody ligujeme a protínáme těsně u stěny močového měchýře, aby zůstaly dostatečně dlouhé a umožnily konstrukci konduitu. Do ureterů po jejich přerušení zavádíme splinty až do ledvinné pánvičky a moč derivujeme do sběrných sáčků nebo sterilních rukavic. Vždy se snažíme předejít kontaminaci operačního pole močí, obzvláště pak, je-li infikovaná. Sběr moči umožní také sledování diurézy. Preparace pokračuje uvolněním řídké pojivové tkáně v prevezikálním prostoru, adherující k periostu os pubis. Vstup do bohatě vaskularizovaného retropubického prostoru znamená riziko závažného, obtížně stavitelného krvácení. Někteří doporučují provádět tuto fázi operace perineálním přístupem. Moriya doporučuje ke snížení krevních ztrát pokračovat otevřením Retziova prostoru, identifikací endopelvické fascie a pubo-prostatického ligamenta oboustranně, které následně protíná kauterem a obnažuje tak m. levator ani. Dorzální žilní komplex spolu s protnutou endopelvickou fascií poté uchopí do modifikovaných Duvalových kleští a po dvojí ligatuře protíná. Dále postupuje otevřením prostoru od bifurkace aorty přes promontorium na přední plochu sakra k levátorům. Tato fáze patří mezi nejdůležitější a zároveň nejobtížnější části operace, vyžaduje značnou technickou zručnost a často je provázena závažným krvácením. Ztráta jednoho až dvou litrů krve může nastat během krátké chvíle. Je proto důležité, aby anesteziolog byl na takovou situaci připraven. Tuto část výkonu nelze začínat u oběhově nestabilního pacienta.
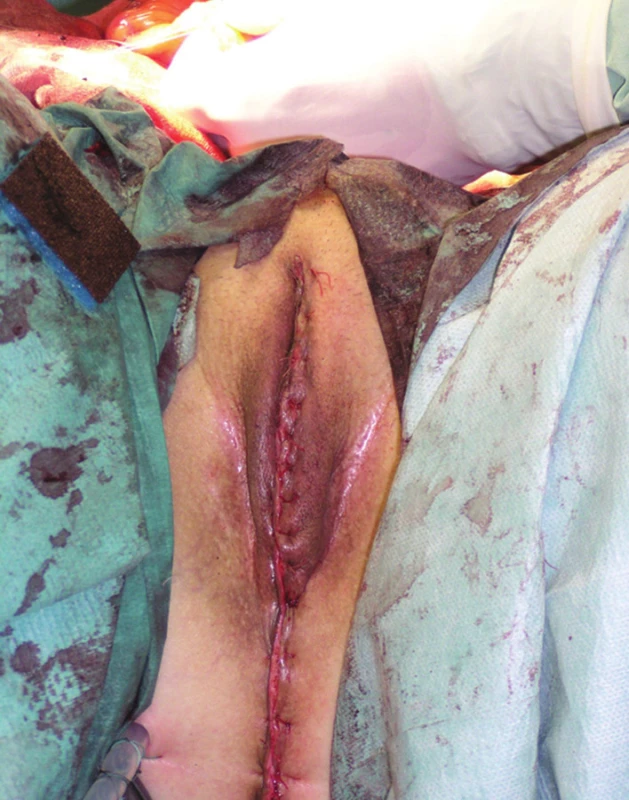
Další fází exenterace je uvolnění močového měchýře s prostatou, i zde hrozí větší krevní ztráta, zejména ze žilních plexů v Retziově prostoru. Po uchopení a odtažení prostaty dvojitě ligujeme a přerušujeme uretru. Následuje ligatura a resekce vnitřních ilických žil a en bloc odstranění rekta, pánevních orgánů a uzlin, zabalených do endopelvické fascie, čímž je TPE dokončena (Obr. 4). Vzdálenost dolního okraje tumoru od linea dentata je rozhodující pro možnost provedení supralevátorové exenterace se zachováním sfinkterů a konstrukcí kolorektální (koloanální) anastomózy, nebo amputace konečníku. U žen je součástí operace hysterektomie s adnexektomií. Jestliže tumor prorůstá ventrálně do vaginy, je nutná dostatečně radikální resekce pochvy. Pokud prorůstá nádor až do poševního introitu, je nutná vulvektomie. Měchýř může být u žen často zachován, v tomto případě hovoříme o zadní pelvické exenteraci. Pokud je indikovaná amputace konečníku, musíme tento uvolnit až ke kostrči a močový měchýř do periuretrální oblasti. V perineální fázi u mužů začíná incize u baze skrota a pokračuje dorzálně ke kostrči, proximální část penilní uretry se obnaží, liguje a protíná. U žen je rozsah excize dán rozsahem nádorového postižení, u pokročilých tumorů je nutná vulvektomie (Obr. 5). Ve většině případů však lze zachovat labia maiora, naopak uretra je u žen většinou součástí en bloc resekce. Finální výsledek po TPE s vulvektomií a po dokončení sutury hráze ukazuje Obr. 6.
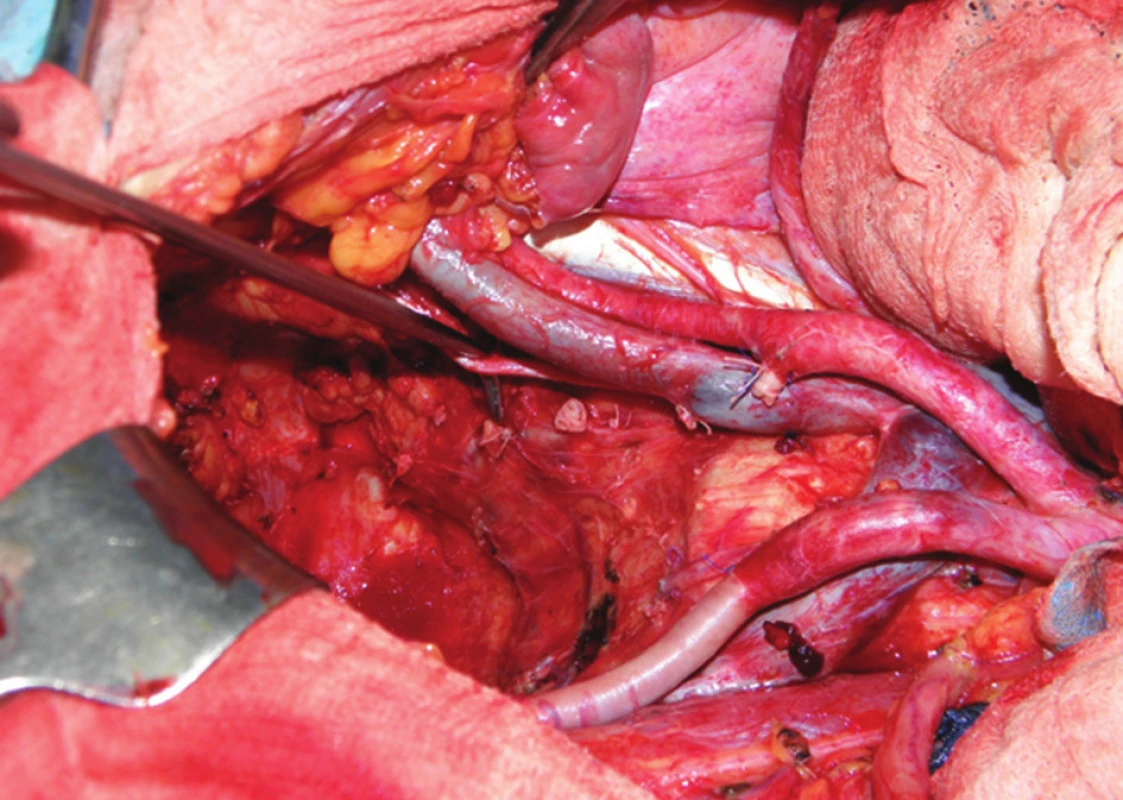
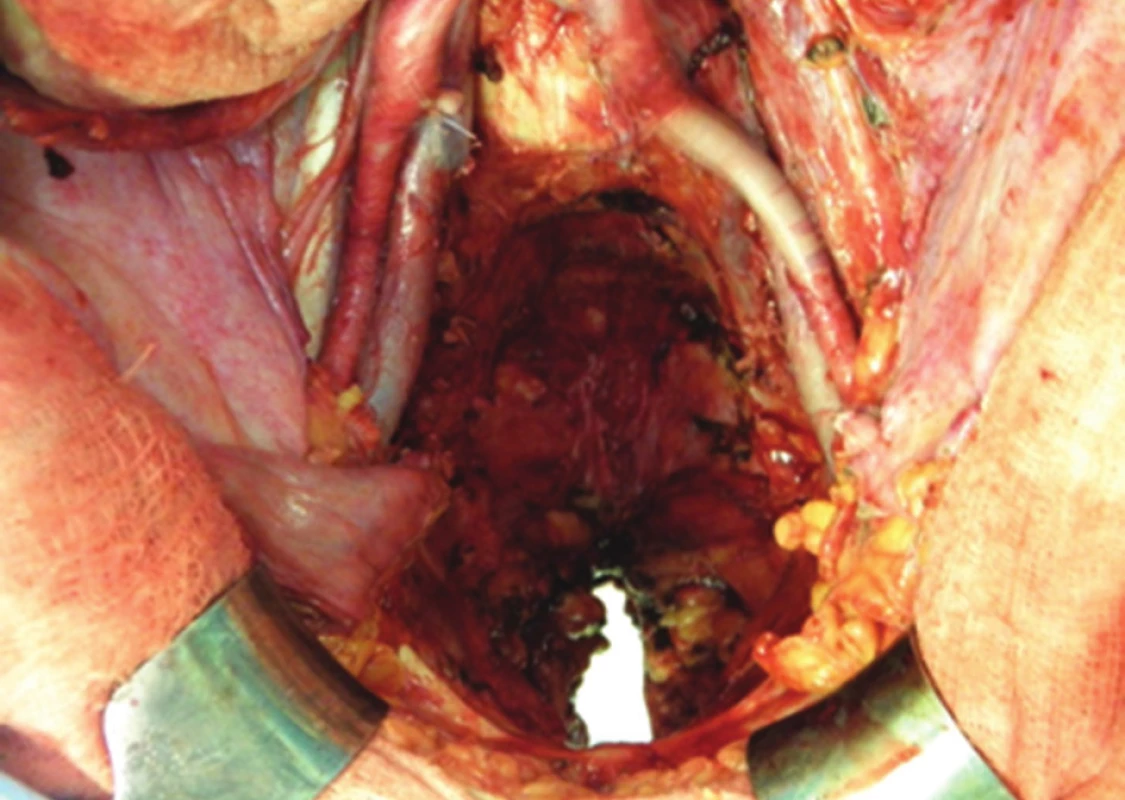
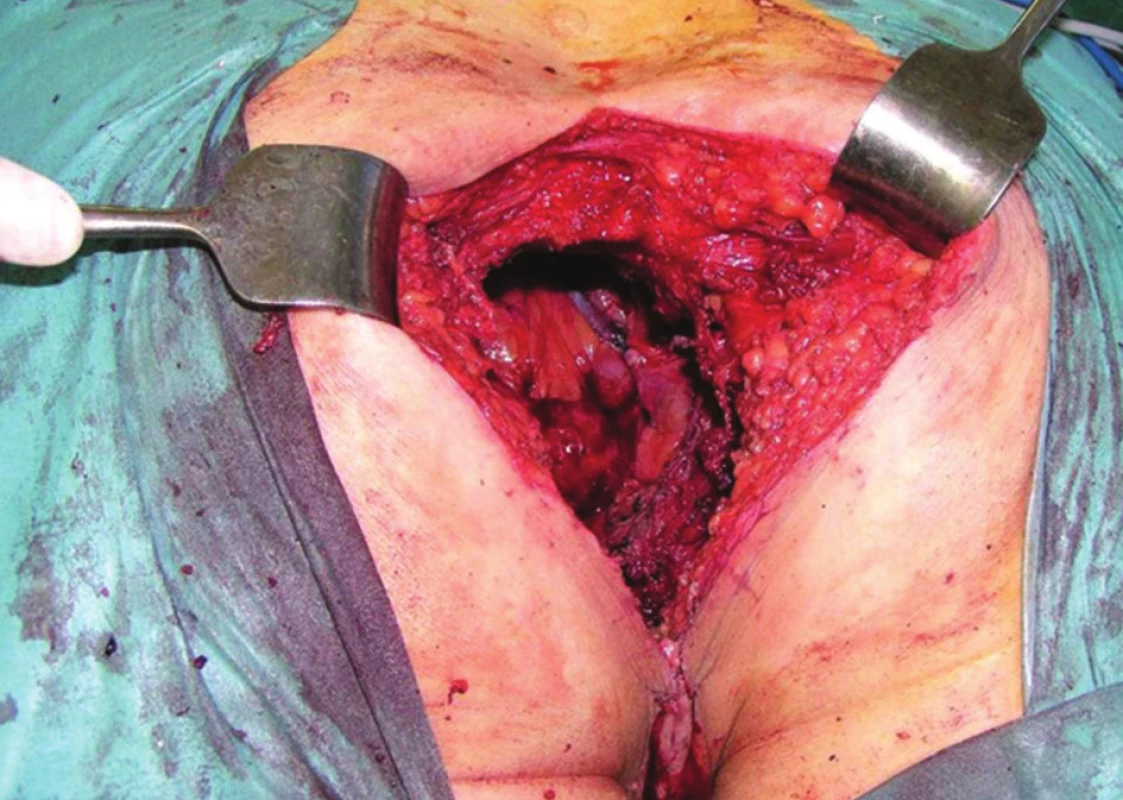
Při invazi nádoru do skeletu pánve je třeba zvážit tzv. kompozitní pelvickou exenteraci, jejíž součástí je en bloc resekce pánevních orgánů s postiženou kostí. Nejčastěji se jedná o kost svatou nebo kostrč. Resekce samotné kostrče nevyžaduje zvláštní přístup. Situace je složitější v případě nutnosti resekce kosti svaté. Os sacrum lze bez nutnosti stabilizace pánevního kruhu resekovat až do úrovně S2/3. Rozhodnutí o operabilitě i provedení vlastní resekce takto pokročilých nádorů vyžaduje velkou zkušenost. Je-li nález zhodnocen jako operabilní, ponechává se resekce kosti jako poslední krok. Důvodem je riziko masivního krvácení. Po dokončení nitrobřišní fáze operace je dutina břišní provizorně uzavřena a pacient přetočen na břicho do pozice „zavíracího nože“. Svatou kost resekujeme navnitř od ischiadických nervů, které musejí být po celou dobu jasně patrné. Výsledný stav po kompozitní TPE ukazuje Obr. 7. Následuje sutura měkkých tkání nad zbývající křížovou kostí a pacient se vrací do polohy na zádech. Po novém otevření dutiny břišní je kompozitní pelvická exenterace dokončena en bloc odstraněním postižených pánevních orgánů s resekovanou kostí.
Následuje rekonstrukční fáze pelvické exenterace. V případě supralevátorové exenterace zvážíme podle stavu nemocného konstrukci nízké anastomózy v jedné době, nebo tento výkon odsouváme do druhé doby. U amputačních výkonů zakládáme terminální kolostomii, nebyla-li již provedena dříve. Rekonstrukční fáze operace je dokončena vyřazením kličky terminálního ilea z pasáže, obnovou kontinuity tenkého střeva end-end anastomózou a konstrukcí ureteroileostomie v pravém podbřišku. Tuto fázi operace podrobně popisuje poslední článek postgraduálního bloku. V důsledku předoperačního ozařování malé pánve i dalších faktorů (infekce, ischemie) se mohou vyskytovat poruchy hojení hráze. Některá pracoviště proto v případě nutnosti širší excize využívají k bezpečnému uzávěru perinea muskulokutánní lalok na cévní stopce z musculus rectus abdominis nebo musculus gluteus maximus [5].
Komplikace
Celková morbidita nemocných po TPE se pohybuje v rozmezí 33–44 %. Téměř u každého druhého operovaného je nutné s více či méně závažnými komplikacemi počítat. Přibližně polovina komplikací si navíc vyžádá další vyšetřovací a léčebné zákroky [6,7,8]. Přehlednou analýzu, shrnující publikované práce o pelvických exenteracích provedených v letech 2000–2012 pro lokálně pokročilý nebo recidivní karcinom rekta, provedl Yang et al. Výskyt komplikací kolísal v analyzovaných souborech v rozmezí 37–100 %, mortalita 0–25 % a frekvence lokálních recidiv nádoru byla uváděna v širokém rozmezí 4,8–61 % [9].
Komplikace pánevních exenterací dělíme na intraoperační, časné a pozdní. Nejzávažnější intraoperační komplikací je masivní krvácení. Jeho zdrojem bývají zejména žilní pánevní plexy a poraněné velké pánevní žíly, méně často tepny. Velmi rychle zde dochází k velké krevní ztrátě, která nemocného bezprostředně ohrožuje na životě. Celkové ztráty během TPE byly popsány až 21 litrů [7]. Ideální je ošetřit krvácející cévu cévním stehem nebo ligaturou. Není-li tento postup úspěšný, je vhodná zejména u masivního žilního krvácení komprese krvácejících míst břišními rouškami a přerušení operace. Dokončení resekční fáze a fáze rekonstrukční následuje po dohrazení ztráty a stabilizaci nemocného. Variantou je i ukončení výkonu a jeho pokračování v druhé době s odstupem 24–48 hodin. Z dalších závažných intraoperačních komplikací hrozí ischemie utererů, znemožňující derivaci moči do konduitu dle Brickera a poranění zažívací trubice.
K nejzávažnějším časným komplikacím po TPE patří pooperační ileus na tenkém střevě, komplikace okolo stomií a enterokutánní píštěle, jejichž zdrojem bývá nejčastěji leak v oblasti anastomózy. Výskyt těchto vážných komplikací se udává okolo 20 %. Roberts et al. uvádí nutnost reoperace po TPE až ve 29 %. Reoperace jsou vždy velmi obtížné, často vedou k dalším komplikacím a reoperacím a samozřejmě významně zvyšují letalitu nemocných. Reoperace pro enterokutánní píštěl nebo pooperační střevní neprůchodnost jsou zatížené letalitou 40–50 % [10]. Z dalších komplikací je nutné zmínit septické stavy různé etiologie, pánevní abscesy, poruchy hojení laparotomie nebo hráze a komplikace urologické. Z nich je nutné uvést zejména urinózní píštěl z oblasti konduitu nebo ureterů [11].
Poslední skupinou jsou komplikace pozdní. Jejich výskyt je sice nižší, nicméně až ve 30 % se jedná o vážné stavy jako enterokutánní píštěl, střevní neprůchodnost, striktura močovodů, renální selhání nebo pyelonefritida. Z dalších komplikací se vyskytují hluboké žilní trombózy, plicní embolizace a samozřejmě opět veškeré komplikace stomií. Je nutné zdůraznit, že většina pacientů má v předchorobí jednu nebo více operací pro kolorektální karcinom nebo pro jinou pánevní malignitu a často také náročnou onkologickou léčbu. U mnoha nemocných s pokročilými nádory také dochází k vytvoření patologické komunikace mezi zažívacím a urogenitálním traktem, často s rozpadem nekrotických tumorózních hmot a rozvojem chronického septického stavu. Pooperační morbidita i letalita je v takovém souboru pacientů i ve velkých centrech významná. Je proto nezbytné, aby tým pečující o tyto nemocné možné komplikace dobře znal, aktivně po nich pátral, dokázal je včas diagnostikovat a řešit. Jen tak lze při významné morbiditě, provázející tyto výkony, snížit letalitu.
Vlastní soubor
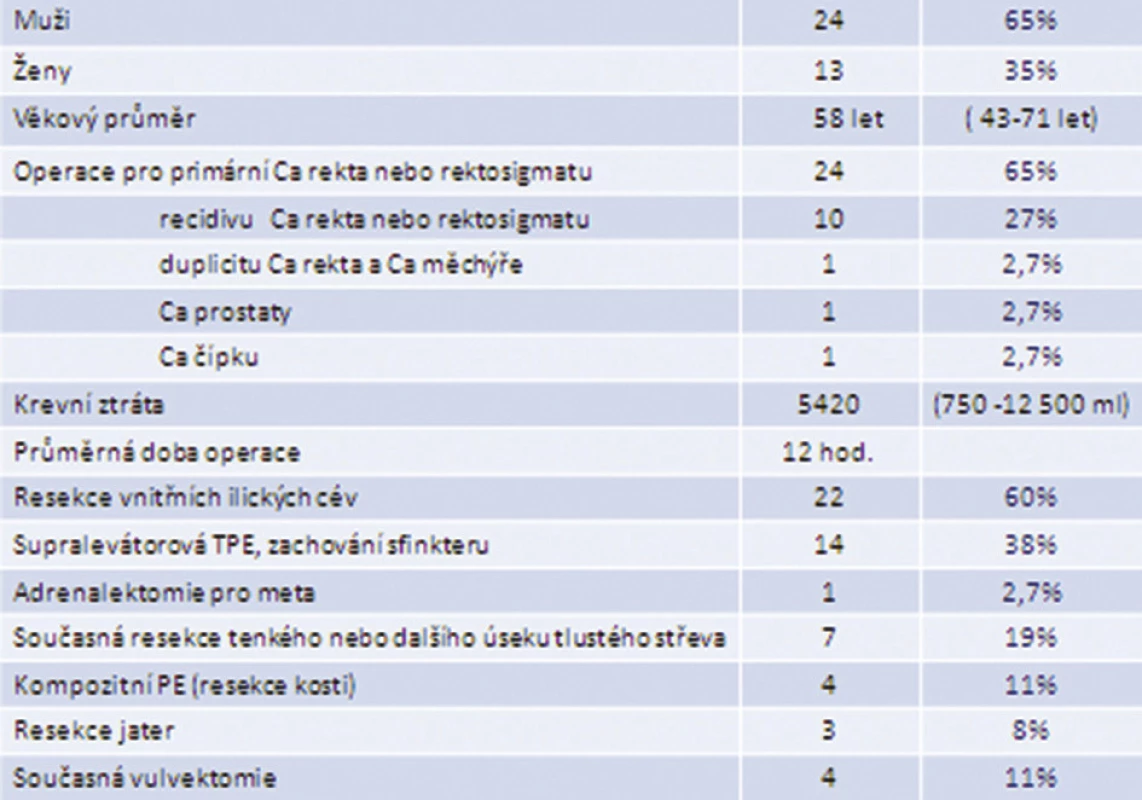
V období let 1999–2012 jsme provedli 37 totálních pelvických exenterací, jednalo se o 13 žen a 24 mužů. Průměrný věk byl 58 let (43–71), průměrná krevní ztráta dosáhla 5420 ml (750–12 500 ml). Průměrný operační čas TPE byl 12 hodin. Resekce vnitřních ilických cév byla provedena 22krát, supralevátorová resekce 14krát, simultánní resekce nadledviny pro metastázu 1krát, TPE s en bloc resekcí tenkého nebo tlustého střeva 7krát, TPE s vulvektomií 4krát, resekce solitární jaterní metastázy 3krát a kompozitní TPE s resekcí kosti 4krát (Tab. 1).
Výsledky
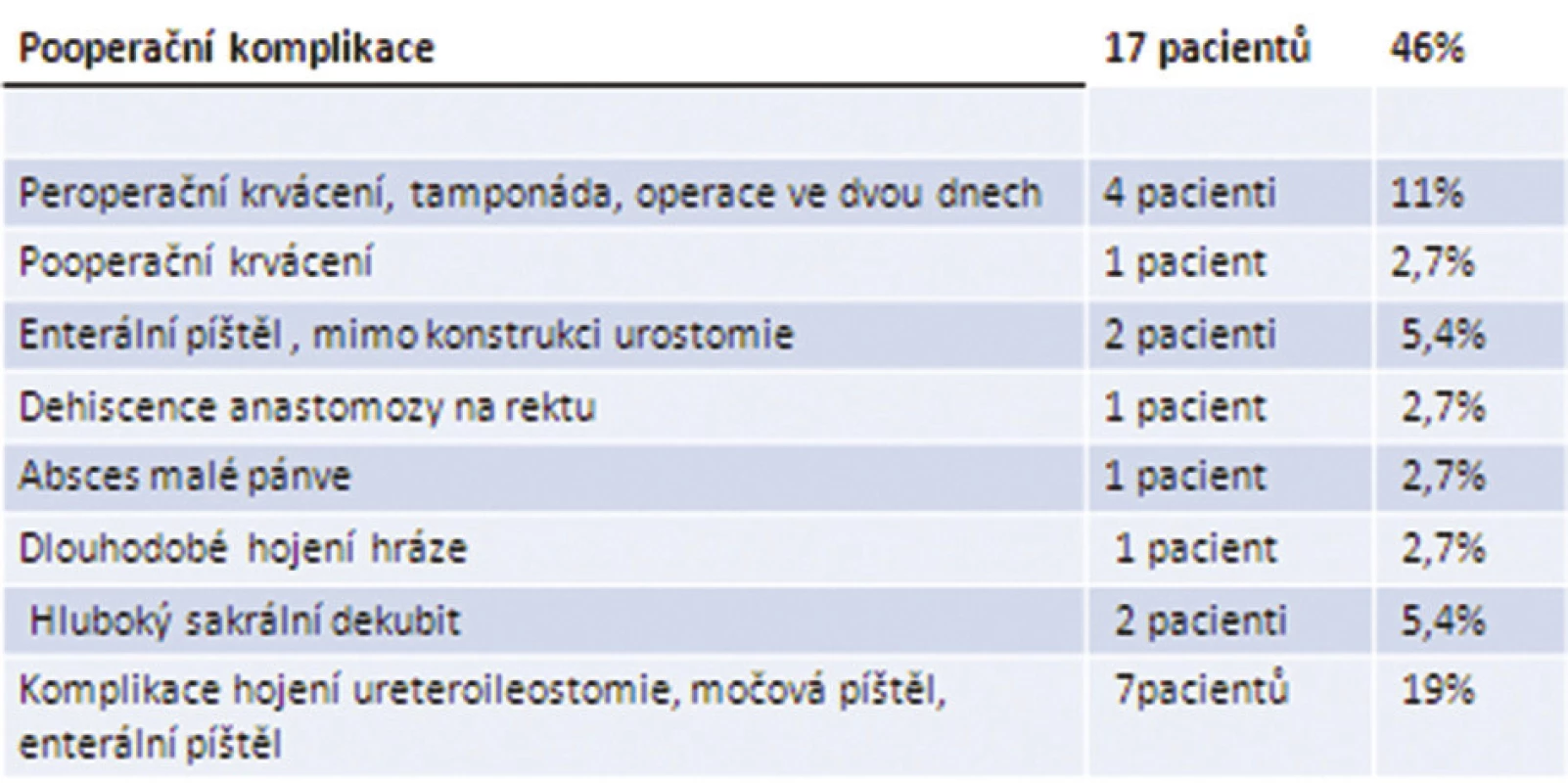
Komplikace se v našem souboru vyskytly celkem u 17 nemocných, morbidita tedy činila 46 %. Do 30 dnů od operace zemřeli dva nemocní, 30denní letalita byla 5,4 %. Celkově během hospitalizace zemřelo 6 pacientů, hospitalizační letalita tak činila 16 %. Pětileté přežívání nemocných v našem souboru je 52 %. Nejzávažnější komplikace spojené s vysokou letalitou byly krvácení a poruchy hojení anastomóz, spojených s derivací moči. Přehled komplikací u nemocných v našem souboru shrnuje Tab. 2.
ZÁVĚR
Závěrem lze shrnout několik zásad, které by měly být dodržovány u pokročilých a recidivujících nádorů kolorekta. V rámci předoperačního vyšetření je nutné provést co nejpřesnější staging. Jen tak lze předejít překvapení z nálezu daleko pokročilejšího nádoru a jeho řešení pod tlakem, často improvizovaně a neadekvátně. Při hodnocení operability nádoru v předoperačním období nebo v průběhu operace je nutné minimalizovat pokusy o objasnění vztahu nádoru k okolí, založit prostou kolostomii (pokud již založena není) a odeslat nemocného na pracoviště, které exenterační operace provádí. Klíčové z pohledu onkologického je také neoddělování orgánů a struktur naléhajících na tumor ve snaze zjednodušit operaci a „ušetřit“ nemocného extenzivního výkonu. Pro nemocné s extrapelvickými metastázami, které jsou potenciálně resekabilní, platí stejné principy jako pro nemocné bez metastatického procesu.
Doc. MUDr. Vladimír Visokai, Ph.D.
Chirurgická klinika 1. LF UK a TN
Vídeňská 800, 140 59, Praha 4 – Krč
e-mail: vladimir.visokai@ftn.cz
Sources
1. Yamamaura T, Matsuzaki H, Suda T, et al. Clinicopathological variables and p53 over–expression as a prognosticator for hematogenic recurrence in colorectal cancer. J Surg Oncol 1999; 70 : 1–5.
2. Ahsant A, Clagett P, Edwards M. Complex venous and arterial reconstruction with deep vein after pelvic exenterative surgery: a case report. Am Surg 2006;72 : 22–24.
3. Birbeck KF, Macklin CP, Tiffin NJ, et al. Rates of circumferential resection margin involvement vary between surgeons and predict outcoms in rectal cancer surgery. Ann Surg 2002;235 : 449–457.
4. Cawthorn SJ, Parums DV, Gibbs NM, et al. Extent of mesorectal spread and involvement of lateral resection margin as prognostic factors after surgery for rectal cancer. Lancet 1990;335 : 1055–1059.
5. Lopez MJ, Luna–Pérez P. Composite pelvic exenteration: is it worthwile? Ann Surg Oncol 2003;11 : 27–33.
6. Morley GW, Hopkins MP, Lindenauer SM, Roberts JA. Pelvic exenteration, University of Michigan: 100 patients at 5 years. Obstet Gynecol 1989;74 : 934–43.
7. Rutledge FN, Smith JP, Wharton JT, O’Quinn AG. Pelvic exenteration: analysis of 296 patients. Am J Obstet Gynecol 1977;129 : 881–92.
8. Goldberg GL, Sukumvanich P, Einstein MH, Smith HO, Anderson PS, et al. Total pelvic exenteration: the Albert Einstein College of Medicine/Montefiore Medical Center Experience (1987 to 2003). Gynecol Oncol 2006;10 : 261–8.
9. Yang TX, Morris DL, Chua TC. Pelvic exenteration for rectal cancer: a systematic review. Dis Colon Rectum 2013;56 : 519–31.
10. Roberts WS, Cavanagh D, Bryson SC, Lyman GH, Hewitt S. Major morbidity after pelvic exenteration: a seven-year experience. Obstet Gynecol 1987;69 : 617–621.
11. Penalver MA, Angioli R, Mirhashemi R, Malik R. Management of early and late complications of ileocolonic continent urinary reservoir (Miami pouch). Gynecol Oncol 1998;69 : 185–91.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2014 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Erektilní dysfunkce jako následek spinálního traumatu
- Laparoskopická cholecystektomie u dětí a adolescentů
- Navigace v páteřní chirurgii založená na intraoperačním CT zobrazení: zkušenost s iniciálními 295 implantáty
-
Je chirurgie štítné žlázy a příštítných tělísek opravdu bezpečná?
Je vhodná pro jednodenní chirurgii? - Biliární stent jako příčina ileózního stavu
- Pánevní exenterace v léčbě pokročilých nádorů malé pánve
- Totální pelvická exenterace – strategie výkonu
- Derivace moči po radikální cystektomii
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Derivace moči po radikální cystektomii
-
Je chirurgie štítné žlázy a příštítných tělísek opravdu bezpečná?
Je vhodná pro jednodenní chirurgii? - Pánevní exenterace v léčbě pokročilých nádorů malé pánve
- Biliární stent jako příčina ileózního stavu
