Resekabilní karcinom pankreatu − 5leté přežití
Surgical therapy of pancreatic cancer – 5 years survival
Introduction:
The purpose was to identify 5-year survivors among a group of radically resected patients with pancreatic cancer and analyse the characteristics and factors associated with their 5-year survival. Single tertiary centre experience.
Method:
A prospectively maintained database of 155 pancreatic resections from January 2006 to June 2010 was scanned to identify patients after curative radical resections for pancreatic ductal adenocarcinoma. The clinical and pathological data was analysed retrospectively. The outcomes of the PDAC group were evaluated using Kaplan-Meier analysis (survival) with the Log-rank test and Cox regression analysis (evaluation of prognostic factors). Characteristics of the survivors were discussed. Significance level of 0.05 was used. Those factors were used as independent variables for Cox regression analysis whose significant effect on survival was shown based on Kaplan-Meier analysis.
Results:
Among 155 patients undergoing a curative pancreatic resection, 73 had a pancreatic ductal adenocarcinoma. Fifteen patients (20.5%) after radical surgery survived over 5 years, 13 of whom are still alive. In the group of the survivors, the mean overall survival was 77.1 months (60−110) and the median survival was 74 months. The mean relapse-free interval in the group of the survivors was 63.3 months (14−110) with the median of 65 months. Factors associated with a longer survival included the absence of lymph node infiltration (p=0.031), uncomplicated postoperative course (p=0.025), absence of vascular invasion (p=0.017), no blood transfusions (p=0.015) and the use of postoperative therapy – predominantly chemotherapy (p=0.009). Significant independent predictors of survival included vascular invasion HR=2.239 (95%CI: 1.093−4.590; p=0.028), postoperative chemotherapy HR=2.587 (95%CI: 1.301−5.145; p=0.007) and blood transfusion HR=2.080 (95%CI: 1.027−4.212; p=0.042). The risk of death was increased 2.2 times in patients with vascular invasion, 2.1 times in patients with transfusions, and finally 2.6 times in those with no chemotherapy.
Conclusion:
Factors associated with an improved overall survival included: the absence of lymph node infiltration, an uncomplicated postoperative course, absence of vascular invasion, no need of blood transfusions, and finally the use of postoperative chemotherapy. Vascular invasion, use of blood transfusions and postoperative adjuvant chemotherapy were significant independent prognostic factors of survival.
Key words:
pancreatic cancer − survival − resection − mortality − morbidity
:
M. Loveček 1; P. Skalický 2
; Dušan Klos 2
; Č. Neoral 2; J. Ehrmann jr. 3; J. Zapletalová 4; H. Švébišová 5; T. Yogeswara 1; M. Ghothim 1; R. Vrba 1; R. Havlík 2
:
I. chirurgická klinika, LF Univerzity Palackého Olomouc
přednosta: prof. MUDr. Č. Neoral, CSc.
1; I. chirurgická klinika, FN Olomouc
přednosta: prof. MUDr. Č. Neoral, CSc.
2; Ústav klinické a molekulární patologie, LF Univerzity Palackého Olomouc
přednosta: prof. MUDr. Z. Kolář, CSc.
3; Ústav lékařské biofyziky, LF Univerzity Palackého Olomouc
přednosta: prof. RNDr. H. Kolářová, CSc.
4; Onkologická klinika, FN Olomouc
přednosta prof. MUDr. B. Melichar, PhD.
5
:
Rozhl. Chir., 2015, roč. 94, č. 11, s. 470-476.
:
Original articles
Úvod:
Cílem práce je identifikovat pacienty operované pro vývodový karcinom pankreatu, kteří přežili více než 5 let a analyzovat jejich charakteristiky a faktory s vlivem na přežití. Zkušenosti a výsledky terciárního centra.
Metoda:
Prospektivně vedená databáze 155 pankreatických resekcí v období leden 2006 až červen 2010 byla prozkoumána se záměrem identifikace pacientů operovaných kurativně pro vývodový karcinom pankreatu. Klinická a patologická data byla analyzována retrospektivně. Kaplan-Meierova analýza byla použita pro hodnocení přežívání, Log-rank test a Coxova regresní analýza pro analýzu faktorů s vlivem na přežití. Testy byly dělány na hladině signifikance 0,05. Jako nezávisle proměnné v Coxově regresní analýze byly vybrány faktory, u nichž byl pomocí Kaplan-Meierovy analýzy prokázán signifikantní vliv na přežívání.
Výsledky:
V sestavě 155 resekcí pankreatu s kurativním záměrem bylo identifikováno 73 nemocných operovaných pro vývodový karcinom pankreatu, u nichž bylo možné hodnotit 5leté přežití. Více než 5 let přežilo 15 nemocných (20,5 %), z nichž 13 dosud žije. Průměrná doba přežití ve skupině přeživších 5 let je 77,1 měsíce (60–110) a medián 74 měsíce, průměrná doba přežití bez nemoci (relaps free survival) je 63,3 měsíce (14−110), medián 62 měsíce. Ze sledovaných faktorů statisticky významný vliv na přežití měly: nepřítomnost infiltrace lymfatických uzlin (p=0,031), nekomplikovaný pooperační průběh (p=0,025), nepřítomnost vaskulární invaze v tumoru (p=0,017), léčba bez nutnosti podání transfuze krve (p=0,015) a pooperační onkologické léčba – převážně chemoterapie (p=0,009). Významnými nezávislými prediktory přežívání jsou: přítomnost angioinvaze HR=2,239 (95%CI: 1,093−4,590; p=0,028), pooperační chemoterapie HR=2,587 (95%CI: 1,301−5,145; p=0,007) a nutnost podání transfuze HR=2,080 (95%CI: 1,027−4,212; p=0,042). Přítomnost angioinvaze zvyšuje riziko úmrtí pacienta 2,2x, podání transfuze zvyšuje riziko úmrtí 2,1x a nepodání chemoterapie zvyšuje riziko úmrtí 2,6x.
Závěr:
Vliv na dlouhodobé přežití u nemocných operovaných pro karcinom hlavy pankreatu byl prokázán u těchto faktorů: nepřítomnost infiltrace lymfatických uzlin, nekomplikovaný pooperační průběh, nepřítomnost vaskulární invaze v tumoru, léčba bez nutnosti podání transfuze krve a pooperační onkologická léčba – chemoterapie. Významnými nezávislými prediktory přežívání jsou: vaskulární invaze, chemoterapie a nutnost podání transfuze.
Klíčová slova:
karcinom pankreatu − přežití − resekce − mortalita − morbidita
Úvod
Karcinom pankreatu je v současnosti považován za celospolečenský zdravotní problém, kterému je věnována velká pozornost i evropskými autoritami na úrovni výzkumu, prevence, časné diagnostiky a léčby. Z důvodu agresivity nádoru, pozdní symptomatologie, mnohdy zdlouhavé diagnostiky a dlouhého časového intervalu mezi stanovením diagnózy a zahájením léčby jak operační, tak onkologické, jsou léčebné výsledky u karcinomu pankreatu velmi neuspokojivé. Na popud evropské komise byla provedena studie, jejíž závěry shrnuje Euro pancreatic cancer index, který byl publikován v roce 2014. [1] V závěrech této studie je konstatováno, že ačkoliv je obecně zdravotní péče v České republice na vysoké úrovni, pozornost věnovaná nemocným s karcinomem pankreatu není dostatečná. Konkrétní závěry hodnotí zdravotní péči o nemocné s karcinomem pankreatu tako:„... nedostupnost registru certifikovaných HPB chirurgů či pracovišť, velmi dlouhá čekací doba mezi stanovením diagnózy a léčbou – jak operační, tak onkologickou, nedostupnost výsledků léčby: 5leté přežití, medián přežití kurativně léčených, in-hospital mortalita po operaci, přežití léčených paliativní chemoterapií, medián přežití u symptomaticky léčených. Zcela samostatně stojí prevence, kde funguje screening rizikových skupin, ale naše populace absolutně převyšuje všechny země ve spotřebě alkoholu a BMI u nemocných nad 20 let. Velmi dobré ukazatele vykazuje farmaceutická léčba – chemoterapie založená na důkazech (evidence based chemotherapy), adjuvantní chemoterapie, přijatelné výsledky jsou dosaženy v aplikaci monoklonálních protilátek, chybějí však data o procentu zamýšlených kurativních resekcí. Selhává systém paliativní péče v praxi…“. Je otázkou, zdali tento závěr skutečně odráží stav péče o nemocné s karcinomem pankreatu v České republice, či jen nebyla dostupná data v době provedení zmíněné studie.
Cílem naší práce je prezentovat výsledky radikální léčby nemocných s karcinomem pankreatu včetně 5letého přežití a analýza faktorů s vlivem na přežití včetně charakteristik jednotlivých přeživších.
Metoda
Hepatopankreatobiliární skupina I. chirurgické kliniky FN a LF UP v Olomouci systematicky vede databázi výkonů na pankreatu od roku 2006 včetně jejich výsledků jak krátkodobých (morbidita, 30denní mortalita, in-hospital mortalita), tak dlouhodobých (5leté přežití).
Výběr pacientů
Část výše uvedené prospektivně vedené databáze od roku 2006 do června 2010 byla využita pro identifikaci nemocných, kteří podstoupili potenciálně radikální výkon na pankreatu pro diagnózu karcinom pankreatu – kód MKN 10 je C25. Časový rámec byl zvolen tak, aby bylo možné vyhodnotit 5leté přežití. Retrospektivně byla využita klasifikace TNM – 7. edice podle UICC (2011) k hodnocení stadia onemocnění, výsledné R2 resekce nebyly ze studie vyřazeny. Všichni nemocní podstoupili zamýšlený radikální výkon v podobě pravostranné pankreatoduodenektomie s lymfadenektomií (PDE), levostranné pankreatektomie se splenektomií a lymfadenektomií (LPE) či totální pankreatektomii s lymfadenektomií (TPE). Pro hodnocení komplikací byly využity definice podle ISGPS pro specifické komplikace pankreatické chirurgie – pankreatická píštěl (PF), postpankreatektomická hemoragie (PPH), opožděná evakuace žaludku (DGE). [2,3,4] Pooperační komplikace byly hodnoceny na základě klasifikace vycházející z Clavien-Dindo (C-D) systému. [5] Analyzovanými faktory byly věk, pohlaví, výskyt pooperačních komplikací a jejich závažnost podle C-D klasifikace, stadium, histopatologický grading, hodnocení perineurální invaze, vaskulární invaze a lymfangioinvaze v resekátu a podání pooperační onkologické léčby, především chemoterapie. Histopatologické nálezy u nemocných, kteří přežili více než 5 let, byly znovu posouzeny tzv. druhým čtením patologem, který se nepodílel na primárním vyšetření. Adjuvantní onkologická léčba byla indikována v souladu s kritérii a v té době platnými doporučeními České onkologické společnosti.
Sledování
Všichni nemocní byli sledováni buď operujícím chirurgem, onkologem, či praktickým lékařem. Data všech nemocných zařazených do studie byla získána: 1. přímým kontaktem s pacientem, 2. telefonním kontaktem pacienta nebo rodiny nebo 3. telefonním kontaktem praktického lékaře či ošetřujícího onkologa. Data pacientů přeživších 5 let byla získána operujícím chirurgem, u něhož jsou nemocní nadále také sledováni.
Statistická analýza
Prospektivně získaná data byla analyzována využitím statistického programu IBM SPSS Statistics version 22 (USA). Přežití bylo hodnoceno použitím Kaplan-Meierovy analýzy, statistická významnost jednotlivých faktorů ovlivňujících přežívání byla analyzována použitím Log-rank testu a Coxovy regresní analýzy. Testy byly dělány na hladině signifikance 0,05.
Výsledky
V sestavě 155 nemocných, kteří podstoupili resekci pankreatu v období leden 2006 až červen 2010, bylo identifikováno 73 nemocných (47 %) s vývodovým karcinomem pankreatu (PDAC). Průměrný věk byl 62,8 ±9 let, žen bylo 32,9 % a mužů 67,1 %. Lokalizace nádoru byla v 66 případech v hlavě pankreatu (90,4 %), v těle či ocase ve 4 případech (5,5 %) a multifokální výskyt byl u 3 (4,1 %). Chirurgické výkony pak byly u 65 nemocných (89 %) PDE, u 4 nemocných (5,5 %) LPE a u 4 nemocných (5,5 %) TPE. Vaskulární resekce (vena portae či vena mesenterica superior) byla provedena u 3 nemocných (4,1 %). Třicetidenní a zároveň in-hospital mortalita byla zaznamenána v jednom případě (1,4 %), rozšířená 60denní zůstala stejná. Medián sledování všech pacientů byl 15 měsíců (2 až 110 měsíců). Průměrná doba přežití všech pacientů byla 33,5 měsíce (95%CI: 25,0−41,9), s mediánem 15,8 měsíce (95%CI: 10,4−21,2). Třicet šest pacientů (49,3 %) nemělo pooperační komplikaci, délka hospitalizace byla průměrně 13,1 dne (10–20 dnů), medián 12 dnů. Méně závažná komplikace (CD I a II) byla u 25 nemocných (34,2 %), jejich délka hospitalizace byla průměrně 18,3 dne (13−28 dnů), medián 17 dnů. Čtyři operovaní (5,5 %) si vyžádali pooperační intervenci bez celkové anestezie (CD IIIa), jejich délka hospitalizace byla průměrně 21,5 dne (10−30 dnů), medián 23 dny. Osm nemocných (11 %) vyžadovalo reoperaci pro závažnou komplikaci (CD IIIb-V) a jeden z nich zemřel (CD V, 1,3 %). Délka hospitalizace nemocných se závažnou komplikací, kteří přežili, byla průměrně 28,1 dne (14−45 dnů), medián 29 dnů. Tab. 1 shrnuje typy pooperačních komplikací podle závažnosti, které vyžadovaly reintervenci (CD IIIa-V).
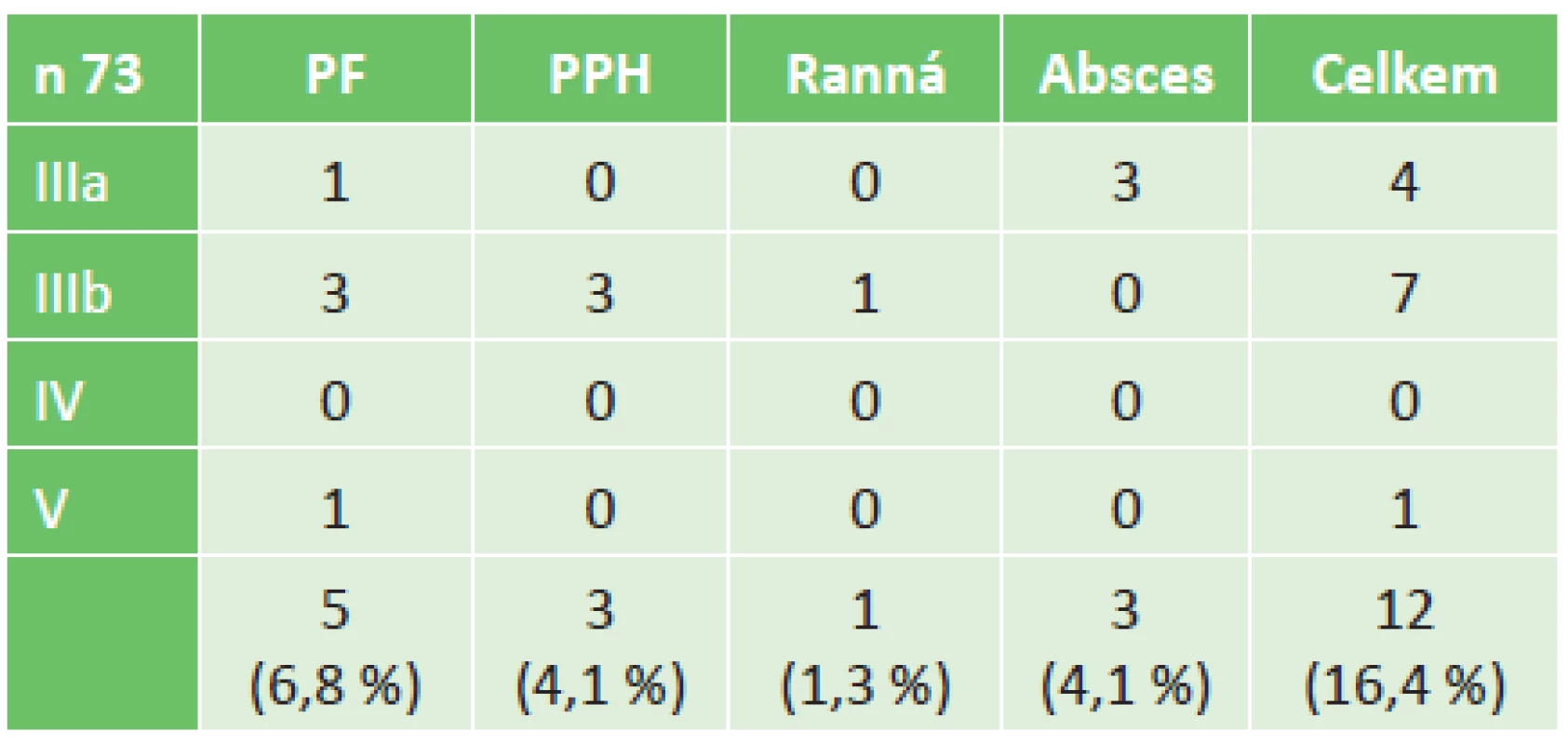
Klinicky relevantní pankreatická píštěl (PF) byla nejčastější závažnou komplikací a vyskytla se u 5 nemocných (6,8 %) (typ B,C). Tyto stavy vyžadovaly reintervenci – drenáž pod CT kontrolou u jednoho nemocného – a dokončující pankreatektomii u 4 nemocných, z nichž 1 zemřel. Další operační reintervence byly nutné u 3 nemocných pro časnou život ohrožující postpankreatektomickou hemoragii PPH typ C (4,1 %), jedenkrát byla nutná resutura dehiscentní laparotomie a u 3 nemocných byla pod CT kontrolou provedena drenáž nitrobřišního abscesu (4,1 %).
Ze sledovaných faktorů na základě Kaplan-Meierovy analýzy neměly vliv na přežití tyto: věk (p=0,256), pohlaví (p=0,461), nutnost reoperace (p=0,451), histopatologický grading (p=0,501), přítomnost perineurální invaze (p=0,127). Statisticky signifikantní vliv pak měly: zcela nekomplikovaný pooperační průběh podle CD klasifikace CD 0 oproti CD I−V, kdy průměrné přežití nekomplikovaných bylo 42 měsíců oproti 23 měsícům u komplikovaných, p=0,025 (Graf 1), nepřítomnost infiltrace lymfatických uzlin, kdy nemocní se stavem N0 měli průměrné přežití 44 měsíců, oproti 24 měsícům u N1, p=0,031 (Graf 2), nepřítomnost vaskulární invaze v tumoru s průměrným přežitím 38 měsíců oproti 16 měsícům u prokázané vaskulární invaze, p=0,017 (Graf 3), léčba bez nutnosti podání transfuze krve s průměrným přežitím 47 měsíců oproti 27 měsícům s transfuzí krve, p=0,015 (Graf 4) a podání pooperační onkologické léčby – chemoterapie, kde přežití ve skupině s pooperační chemoterapií bylo 43 měsíců, oproti 17 měsícům u nemocných bez chemoterapie p=0,009 (Graf 5).





Multivariační metoda – výsledek Coxovy regresní analýzy
Jako nezávisle proměnné v Coxově regresní analýze byly vybrány ty, u nichž byl pomocí Kaplan-Meierovy analýzy prokázán signifikantní vliv na přežívání, tj. chemoterapie, transfuze, stav lymfatických uzlin, vaskulární invaze a nekomplikovaný pooperační průběh a perineurální invaze jako parametr s nižší hladinou signifikance u Kaplan-Meierovy analýzy. Významnými nezávislými prediktory přežívání jsou: přítomnost vaskulární invaze HR=2,239 (95%CI: 1,093−4,590; p=0,028), pooperační chemoterapie HR=2,587 (95%CI: 1,301−5,145; p=0,007) a transfuze HR=2,080 (95%CI: 1,027−4,212; p=0,042). Přítomnost vaskulární invaze zvyšuje riziko úmrtí pacienta 2,2x, transfuze zvyšuje riziko úmrtí 2,1x a nepodání chemoterapie zvyšuje riziko úmrtí 2,6x.
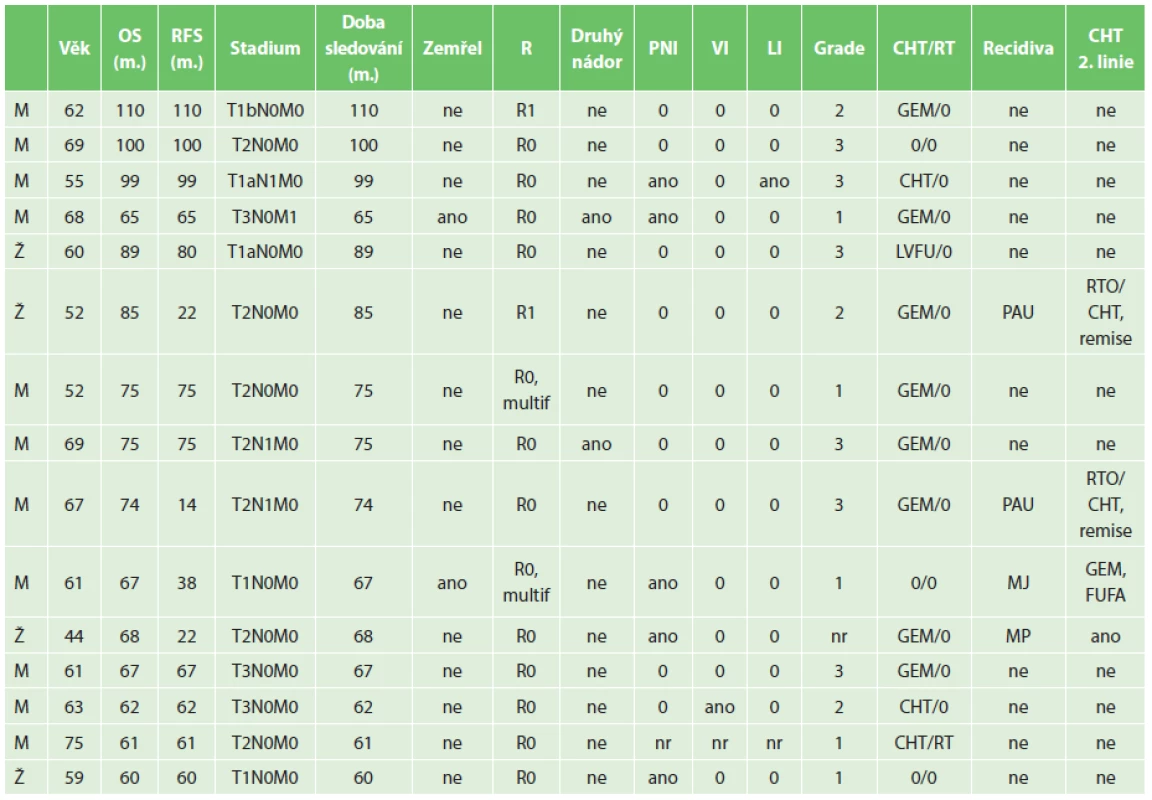
Patnáct operovaných (20,5 %) z celého souboru přežilo více než 5 let (průměrný věk 60,9 roku, rozmezí 44−75, průměrné přežití v této skupině bylo 77,1 měsíce, rozmezí 60−110 měsíců, medián 74 měsíce, doba sledování 60–110 měsíců). Přežití bez nemoci (relaps free survival) bylo v této skupině průměrně 63,3 měsíce (14−110), medián 65 měsíců. Tab. 2 shrnuje jejich charakteristiky. V této skupině jedna nemocná podstoupila neoadjuvantní léčbu (RCHT), poté podstoupila radikální výkon (TPE, lymfadenektomie) a 22 měsíců po operaci byly zaznamenány metastázy v plicích. Pro tyto trvale podstupuje chemoterapii a onemocnění je stabilizováno 68 měsíců od operace. U 2 nemocných se po adjuvantní chemoterapii gemcitabinem objevily 14 a 22 měsíců od operace metastázy v lymfatických uzlinách. Oba podstoupili kombinovanou RCHT a 5 let se dožili v remisi onemocnění a dosud žijí bez známek další rekurence. U jednoho nemocného se objevila metastáza v játrech 38 měsíců po primární operaci, pooperační adjuvantní léčbu neměl (T1N0M0, pooperační komplikace, dlouhá rekonvalescence), zemřel na generalizaci onemocnění 67 měsíců po primární operaci. U dvou nemocných se v pooperačním průběhu po absolvované adjuvantní léčbě objevily druhé nádory: 1. karcinom močového měchýře 18 měsíců po resekci pankreatu (nejprve lokální léčba endoskopicky, nakonec radikální cystektomie 5 let po resekci pankreatu, dosud žije 6,5 roku bez onemocnění), 2. karcinom rekta, cca 5,5 roku po resekci pankreatu, bez prokázané recidivy, zemřel na komplikace po operaci tumoru rekta. Jeden nemocný byl operován pro synchronní nádorovou duplicitu – karcinom žaludku a incidentální karcinom pankreatu. Onkologická léčba byla volena podle pokročilejšího nádoru, tedy karcinom žaludku – jako jediný absolvoval pooperační RCHT. Souhrnně lze říci, že 5 let bez nemoci se dožilo 13 z 15 (přeživších 5 let) ze 73 PDAC nemocných. Pětileté přežití bez nemoci bylo tedy dosaženo u 17,8 % všech radikálně operovaných a 86,6 % u přeživších 5 let. Dva z nich měli rekurenci v uzlinách úspěšně léčenou kombinací RCHT a dva nemocní se dožili druhého nádoru. Dva nemocní se dožili 5 let s rekurencí onemocnění, při onkologické léčbě: 1. stabilní, 2. progredující.
DISKUZE
Výsledky radikální chirurgické léčby v domácí literatuře prezentovali v posledních 10 letech pouze Ryska (3leté přežití 22 %) a zcela stručně bez bližší analýzy Krška (5leté přežití 19 %) [6,7]. Dlouhodobé výsledky chirurgické léčby nejsou uspokojivé. Existuje mnoho faktorů, které mohou mít vliv na přežívání. Je nesporné, že časná diagnóza u karcinomu pankreatu je velmi problematická především z důvodu absence specifických symptomů. To potvrzuje i vysoký počet diagnostikovaných v pokročilém, generalizovaném, a tedy radikálně neléčitelném onemocnění (více než polovina všech). Na druhé straně spektra nemocných, tedy kandidátů radikální resekce (různé zdroje uvádějí 10−20 %), stojí nezanedbatelná skupina nemocných, kteří by mohli být kandidáty radikálního výkonu, ale indikováni k němu z různých důvodů nejsou [8,9]. V americké populaci byla tato skupina odhadnuta na 38 % všech kandidátů radikální resekce v lokalizovaném stadiu [9]. Z praxe a vlastní zkušenosti není důvod se domnívat, že situace v naší populaci je významně odlišná. Nicméně chirurgická resekce je nadále jedinou léčebnou modalitou, která může nabídnout části nemocných s PDAC naději na dlouhodobější přežití. To ovšem jen tehdy, pokud jsme schopni tyto nemocné včas identifikovat a diagnostikovat, v co možná nejkratší době bezpečně odoperovat a co nejrychleji odeslat k následné adjuvantní onkologické léčbě. Faktory s vlivem na přežití u lokalizovaného karcinomu pankreatu je možno považovat za neovlivnitelné a ovlivnitelné. Mezi neovlivnitelné patří biologické vlastnosti nádoru – zde stupeň diferenciace, přítomnost perineurální invaze, vaskulární invaze (angioinvaze) či lymfangioinvaze. Z těchto faktorů jsme v naší studii mohli označit pouze vaskulární invazi jako faktor s vlivem na délku přežití (jak v univariační, tak i v multivariační analýze). V jiných studiích u tohoto faktoru vliv na přežití prokázán nebyl. U skupiny bez a s perineurální invazí byl též zjištěn rozdíl v přežívání, tento ale nebyl statisticky významný (p=0,127). Perineurální invaze však byla prokázána jako významný faktor ve studii Robinsona (2012) a Kimury (2014)[10,11]. Histopatologický grade byl prokázán ve studiích Clearyho (2004), Howarda (2006) a Wentze (2012) [12,13,14]. Naše studie tento faktor neprokázala patrně i na vrub malého počtu hodnocených pacientů. Mezi zřejmě „relativně“ ovlivnitelné lze zařadit stadium onemocnění, zde může záležet jak na době od symptomů do stanovení diagnózy, tak na době od stanovení diagnózy do zahájení léčby jak chirurgické, tak onkologické. Vliv stadia onemocnění (velikost tumoru, stav uzlin…) prokázaly mnohé studie [10,11,12,13,14,15,16,17,18,19,20,21]. Naše studie může potvrdit stav uzlin jako faktor s vlivem na přežívání v univariační analýze. Mezi faktory do jisté míry ovlivnitelné pak patří faktory chirurga či chirurgického výkonu – rozsah neboli radikalita a komplikace. Dosažení R0 či alespoň R1 resekce podle aktuální klasifikace radikality využitím Leedského protokolu (LEEPP) by mělo být cílem resekčního výkonu [22,23]. Hodnocení radikality výkonu podle současných standardů v naší studii nebylo možné, tento byl implementován až v posledním roce (2015). Retrospektivní přehodnocení není možné z důvodu zcela odlišné metodiky zpracování resekátu. Několik studií prokazuje jednoznačně radikalitu, tedy dosažení stavu R0, jako významný faktor s vlivem na délku přežívání [11,13,14,15,18,19,20]. Ve světle LEEPP je významně frekventnější stav R1 než dříve a stává se faktorem nesnadno ovlivnitelným, zejména v resekční linii na straně AMS, přední a zadní strany resekátu. Kritériem je mikroskopická vzdálenost okraje tumoru od stěny pankreatu či resekční linie více než 1 mm. Přežívání však jsou u R0 a R1 podobná. Naopak R2 resekce nemůže ovlivnit průběh onemocnění, a není tedy obecně přínosem pro zlepšení prognózy. Za další faktory, které lze považovat též za ovlivnitelné, považujeme: výskyt komplikací (morbidita), jejich závažnost a nutnost řešení (reoperace, reintervence), nutnost podání krevní transfuze. Tato nepřímo souvisí s peroperačními komplikacemi. Tyto faktory úzce souvisejí s mortalitou, délkou hospitalizace, frekvencí rehospitalizací, náklady na léčbu a v neposlední řadě i s možností operovaného podstoupit pooperační onkologickou léčbu. Mortalita resekčních výkonů pankreatu v centrech dosahuje velmi uspokojivého čísla a pohybuje se pod 5 %, nicméně i zde je prostor pro snahu o její zlepšení. Naše mortalita dosahuje ve skupině PDAC pacientů 1,4 %. Nízká mortalita je předpokladem smysluplné komplexní léčby nemocných s PDAC. Kritériem kvality pak je morbidita. Implementace Clavien-Dindo systému umožní objektivní hodnocení morbidity a tím i hodnocení kvality či hledání případných rezerv v operační technice nebo případných chyb. Přísnost klasifikace způsobuje, že vysoké procento nekomplikovaných, tedy CD 0, je dosažitelné obtížně u tak rozsáhlých výkonů, jako jsou resekce pankreatu. V naší studii jsme docílili CD 0, tedy bez komplikací, bez nutností medikace jiné než analgetik, antipyretik a běžné pooperační léčby u poloviny operovaných. Zároveň jsme prokázali, že nekomplikovaný průběh – CD 0 – je významným faktorem ovlivňujícím dlouhodobé přežití (p=0,025). Tato skupina má i nejkratší dobu hospitalizace – medián 12 dnů. (Je nutné podotknout, že délka hospitalizace v našem systému nebyla v době studie objektivním a racionálním faktorem, stejně jako např. doba pobytu na JIP; vzhledem k ekonomickým a organizačním parametrům – náklady, TISS, délka hospitalizace, obložnost...). I nezávažné komplikace, které splňují kritéria pro CD I (skupina CD 0+I) oproti CD II–V, vykazují statisticky významně delší přežití (p=0,047). Skupina rozšířená o komplikace CD II (CD 0+I+II) ve srovnání se skupinou komplikací vyžadujících reintervenci vykazuje také lepší přežití, rozdíl však již není statisticky významný (p=0,074). Vlivem chirurga a jeho činnosti na dlouhodobé výsledky se dosud z velkých studií zabýval jen Howard, který v multivariační analýze prokázal pooperační komplikace jako faktor s vlivem na přežití, naše studie tyto výsledky potvrzuje jak v univariační (komplikace p=0,025, transfuze p=0,015), tak multivariační analýze (transfuze) [13]. Závažná morbidita, tedy komplikace vyžadující operační reintervenci (CD IIIb–V), byla v naší studii 10,9 %, mortalita pak jen 1,4 %. Ze specifických komplikací dominují závažné pankreatické píštěle stupně B a C, které převážně byly řešeny záchrannou pankreatektomií (4x) s výsledným jedním úmrtím. Postpankreatektomická hemoragie se vyskytla u 3 nemocných a výhradně jako časná, řešená reoperací, s nulovou mortalitou. Pooperační morbidita tak výrazně ovlivňuje nejen délku hospitalizace, ale i náklady na léčbu, zejména pak komplikací. Má však přímý vliv i na dlouhodobé výsledky v souvislosti s nemožností zahájit buď vůbec, nebo včas adjuvantní onkologickou léčbu, pokud je indikována. Ačkoliv je karcinom pankreatu považován za chemorezistentní onemocnění, je chemoterapie obecně doporučována a má větší efekt než pouhé sledování pacienta. Chemoterapie je tak hlavní léčebnou modalitou u pacientů po kompletní resekci [24]. Na základě rozsáhlé domácí multicentrické studie Rysky a spol. z let 2008 až 2011 však bylo zjištěno, že více než dvě třetiny nemocných s PDAC jak po resekci (radikální či paliativní), tak po jiném léčebném výkonu (bypass, explorace, stent) chemoterapii nedostane [25]. V naší sestavě přeživších 5 let jen u 3 nemocných (20 %) nebyla indikována pooperační adjuvantní onkologická léčba (dva nemocní pT1N0M0 a jeden pT2N0M0). Tyto výsledky korespondují s výsledky prospektivní multicentrické randomizované studie CONKO 001, kdy přežití bez známek nemoci (DFS) bylo ve třetím a v pátém roce sledování 23,5 % a 16,5 % u nemocných s pooperační léčbou gemcitabinem oproti 7,5 % a 5,5 % v kontrolní skupině bez léčby [26]. V naší sestavě pouze jedna nemocná podstoupila předoperačně neoadjuvantní léčbu. Kromě nemocného s nádorovou duplicitou žaludku a pankreatu, který podstoupil pooperačně kombinovanou RCHT, všichni ostatní (66 %) podstoupili adjuvantní chemoterapii – téměř všichni gemcitabinem. V sestavě jsou zastoupeni i dva nemocní se závažnou pooperační komplikací, u kterých byla provedena pro insuficienci PJA záchranná pankreatektomie. Zcela bez zajímavosti není fakt, že u těchto dvou nemocných byl v resekátu dokončené pankreatektomie – tělo a kauda – zastižen multifokální vývodový karcinom [27].
Závěr
Jelikož celkové výsledky léčby nemocných s PDAC nejsou uspokojivé, je nezbytné hledat možnosti jejich zlepšení. Pro chirurga, ale i pro jeho pacienty, je klíčové znát vlastní výsledky činnosti, jako je resekční chirurgie pankreatu. Jedná se v současnosti ve velkých centrech o bezpečnou chirurgii s nízkou mortalitou, ale nadále nezanedbatelnou morbiditou, která též ovlivňuje dlouhodobé výsledky skupiny radikálně operovaných. Stratifikovaná morbidita na nezávažnou – CD 0, I, II – a závažnou – CD IIIa, IIIb, IV a V – pak objektivně podá informace o kvalitě chirurgické léčby, společně se spojením faktů o rozsahu výkonů, počtu vaskulárních resekcí atd. Centralizace nemocných, identifikace faktorů negativně ovlivňujících mortalitu, jejich eliminace a snaha o maximální eliminaci komplikací a jejich bezpečné řešení je klíčovým předpokladem pro zlepšení dlouhodobých výsledků z pohledu chirurga. Vliv na dlouhodobé přežití u nemocných operovaných pro karcinom pankreatu v naší sestavě byl prokázán u těchto faktorů: nepřítomnost infiltrace lymfatických uzlin, nekomplikovaný pooperační průběh, nepřítomnost vaskulární invaze v tumoru, léčba bez nutnosti podání transfuze krve a pooperační onkologická léčba – chemoterapie. Významnými nezávislými prediktory přežívání jsou pak vaskulární invaze, chemoterapie a nutnost podání transfuze.
Seznam zkratek
HPB − hepatopankreatobiliární
BMI − body mass index
UICC − Union for International Cancer Control
PDE − pankreatoduodenektomie
LPE − levostranná pankreatektomie
TPE − totální pankreatektomie
ISGPS − international study group for pancreatic surgery
PF − pancreatic fistula
PPH − postpancreatectomy haemorrhage
DGE − delayed gastric emptying
CT − computer tomography
RCHT − radio-chemoterapie
PDAC − pancreatic ductal adenocarcinoma
CD − Clavien-Dindo
Dedikováno ke grantu IGA_LF_2015_002.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Loveček, PhD.
Benýškova 6
779 00 Olomouc
e-mail: mlovecek@seznam.cz
Sources
1. Euro Pancreatic Cancer Index 2014, Dostupný z www: www.healthpowerhouse.com
2. Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138 : 8−13.
3. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH): an International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery 2007;142 : 20−5.
4. Wente MN, Bassi C, Dervenis C, et al. Delayed gastric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2007;142 : 761−8.
5. DeOliveira ML, Winter JM, Schafer M, et al. Assessment of complications after pancreatic surgery: A novel grading system applied to 633 patients undergoing pancreaticoduodenectomy. Ann Surg 2006;244 : 931−7.
6. Ryska M, Strnad R, Belina F, et al. Radical resection in patients with pancreatic head carcinomas. A retrospective survival analysis in a group of 307 subjects. Rozhl Chir 2007;86 : 432−9.
7. Krska Z, Sváb J. Developments in pancreatic surgery at the 1st Surgical Department 1st Faculty of Medicine, Charles University and General University Hospital in Prague. Rozhl Chir 2012;91 : 262−6.
8. Tamburrino D, Partelli S, Crippa S, et al. Selection criteria in resectable pancreatic cancer: a biological and morphological approach. World J Gastroenterol 2014;20 : 11210−5.
9. Bilimoria KY, Bentrem DJ, Ko CY, et al. National failure to operate on early stage pancreatic cancer. Ann Surg 2007;246 : 173−80.
10. Robinson SM, Rahman A, Hauqk B, et al. Metastatic lymph node ratio is an important prognostic factor in pancreatic ductal adenocarcinoma. Eur J Surg Oncol 2012;38 : 333−9.
11. Kimura K, Amano R, Nakata B, et al. Clinical and pathological features of five-year survivors after pancreatectomy for pancreatic adenocarcinoma. World J Surg Oncol 2014;12 : 360.
12. Cleary SP, Gryfe R, Guindi M et al. Prognostic factors in resected pancreatic adenocarcinoma: analysis of actual 5-year survivors. J Am Coll Surg 2004;198 : 722–31.
13. Howard TJ, Krug JE, Yu J et al. A margin-negative R0 resection accomplished with minimal postoperative complications is the surgeon’s contribution to long-term survival in pancreatic cancer. J Gastrointest Surg 2006; 10 : 1338–45.
14. Wentz SC, Zhao ZG, Shyr Y, et al. Lymph node ratio and preoperative CA 19-9 levels predict overall survival and recurrence-free survival in patients with resected pancreatic adenocarcinoma. World J Gastrointest Oncol 2012;4 : 207−15.
15. Han SS, Jang JY, Kim SW, et al. Analysis of long-term survivors after surgical resection for pancreatic cancer. Pancreas 2006;32 : 271–5.
16. Ferrone CR, Brennan MF, Gonen M, et al. Pancreatic adeno-carcinoma: the actual 5-year survivors. J Gastrointest Surg 2008;12 : 701–6.
17. Schnelldorfer T, Ware AL, Sarr MG, et al. Long-term survival after pancreatoduodenectomy for pancreatic adenocarcinoma: is cure possible? Ann Surg 2008;247 : 456−62.
18. Katz MH, Wang H, Fleming JB, et al. Long-term survival after multidisciplinary management of resected pancreatic adenocarcinoma. Ann Surg Oncol 2009;16 : 836−47.
19. Hartwig W, Hackert T, Hinz U, et al. Pancreatic cancer surgery in the new millennium: better prediction of outcome. Ann Surg 2011;254 : 311−9.
20. Yamamoto T, Yagi S, Kinoshita H, et al. Long-term survival after resection of pancreatic cancer: a single-center retrospective analysis. World J Gastroenterol 2015;21 : 262−8.
21. Strobel O, Hinz U, Gluth A, et al. Pancreatic adenocarcinoma: number of positive nodes allows to distinguish several N categories. Ann Surg 2015;261 : 961−9.
22. Verbeke CS, Menon KV. Redefining resection margin status in pancreatic cancer. HPB 2009;11 : 282−9.
23. The Royal College of Pathologists 2010. Standards and datasets for reporting cancers. Dataset for the histopathological reporting of carcinomas of the pancreas, ampulla of Vater and common bile duct. May 2010, Dostupný z www: www.rcpath.org
24. Halámková J, Burkoň P, Tomášek J, et al. Současné možnosti léčby karcinomu slinivky břišní. Remedia 2010;20 : 368–73.
25. Ryska M, Dušek L, Pohnán R, et al. Kvalita života je důležitým faktorem indikační rozvahy u nemocných s pokročilým karcinomem pankreatu - multicentrická prospektivní studie. Rozhl Chir 2012;91 : 207−6
26. Oettle H, Post S, Neuhaus P, et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 2007;297 : 267–7.
27. Havlík R, Loveček M, Klos D, et al. Synchronní invazivní duktální adenokarcinomy pankreatu a jejich klinický význam. Onkologie 2010 : 4;342−3.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2015 Issue 11
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Hepatic pseudolesions adjacent to the falciform ligament
- Management of groin wound infection after arterial surgery using negative-pressure wound therapy
- Our experience with the measurement of transcutaneous oxygen tension for evaluation of blood circulation in peripheral arteries in patients with critical ischemic disease of lower limbs
- Determination of CEA, EGFR and hTERT expression in peritoneal lavage in patients with pancreatic adenocarcinoma using RT – PCR method
- Surgical therapy of pancreatic cancer – 5 years survival
- Vascular dialysis access with transposed superficial femoral vein
- Perigraft seroma as a rare angiosurgical complication
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hepatic pseudolesions adjacent to the falciform ligament
- Our experience with the measurement of transcutaneous oxygen tension for evaluation of blood circulation in peripheral arteries in patients with critical ischemic disease of lower limbs
- Surgical therapy of pancreatic cancer – 5 years survival
- Management of groin wound infection after arterial surgery using negative-pressure wound therapy
