Thorakoskopická epikardiální ablace fibrilace síní systémem COBRA Fusion jako první část hybridního výkonu
Thoracoscopic, epicardial ablation of atrial fibrillation using the COBRA Fusion system as the first part of hybrid ablation
Introduction:
Treatment of persistent and long-standing persistent atrial fibrillation is not successfully managed by methods of catheter ablation or pharmacotherapy. Hybrid ablation (i.e. combination of minimally invasive surgical ablation, followed by electrophysiological assessment and subsequent endocardial catheter ablation to complete the entire intended procedure) presents an ever more used and very promising treatment method.
Method:
Patients underwent thoracoscopic ablation of pulmonary veins and posterior wall of the left atrium (the box-lesion) with use of the COBRA Fusion catheter; thoracoscopic occlusion of the left atrial appendage using the AtriClip system was also done in later patients. After 2−3 months, electrophysiological assessment and catheter ablation followed. In this article we summarize a strategy of the surgical part of the hybrid procedure performed in our centre. We describe the surgery itself (including possible periprocedural complications) and we also present our short-term results, especially with respect to subsequent electrophysiological findings.
Results:
Data of the first 51 patients were analyzed. The first 25 patients underwent unilateral ablation; the mean time of surgery was 102 min. Subsequent 26 patients underwent the bilateral procedure with the mean surgery time of 160 min. Serious complications included 1 stroke, 1 phrenic nerve palsy and 2 surgical re-explorations for bleeding. After 1 month, 65% of patients showed sinus rhythm. The box-lesion was found complete during electrophysiological assessment in 38% of patients and after catheter ablation, 96% of patients were discharged in sinus rhythm.
Conclusion:
The surgical part of the hybrid procedure with use of the minimally invasive approach and the COBRA Fusion catheter is a well-feasible method with a low number of periprocedural complications. For electrophysiologists, it provides a very good basis for successful completion of the hybrid ablation.
Key words:
atrial fibrillation − hybrid ablation – thoracoscopy − catheter ablation − electrophysiology assessment
:
P. Budera 1; P. Osmančík 2; D. Talavera 1; R. Fojt 1; A. Kraupnerová 1; J. Žďárská 2; T. Vaněk 1; Z. Straka 1
:
Kardiocentrum, Kardiochirurgická klinika, 3. lékařská fakulta Univerzity Karlovy a FN Královské Vinohrady, Praha
přednosta: prof. MUDr. Z. Straka, CSc.
1; Kardiocentrum, III. interní-kardiologická klinika, 3. lékařská fakulta Univerzity Karlovy a FN Královské Vinohrady, Praha
přednosta: prof. MUDr. P. Widimský, DrSc., FESC., FACC.
2
:
Rozhl. Chir., 2017, roč. 96, č. 5, s. 203-208.
:
Original articles
Úvod:
Léčba perzistentní a dlouhodobě perzistentní fibrilace síní není uspokojivě vyřešena pomocí katetrizační ablace či farmakoterapie. Nadějnou a stále častěji používanou metodou jsou tzv. hybridní ablace, tedy kombinace miniinvazivní kardiochirurgické ablace s následným elektrofyziologickým vyšetřením a endokardiální katetrizační ablací, která celou ablaci dokončí.
Metoda:
Prováděna byla thorakoskopická ablace plicních žil a zadní stěny levé síně (tzv. box-léze) systémem COBRA Fusion, u pozdějších pacientů doplněná o uzávěr ouška levé síně systémem AtriClip. Po 2−3 měsících pacienti podstoupili elektrofyziologické vyšetření a katetrizační ablaci. V článku shrnujeme strategii chirurgické části hybridní ablace prováděné na našem pracovišti a popisujeme vlastní operaci a krátkodobé výsledky, zejména ve vztahu k následným nálezům elektrofyziologů.
Výsledky:
Analyzována byla data prvních 51 pacientů. Prvních 25 pacientů podstoupilo jen unilaterální ablaci, průměrný čas výkonu byl 102 minut, u následujících 26 pacientů (bilaterální výkon) to bylo 160 minut. Závažnými komplikacemi byl 1 iktus, 1 paréza n. phrenicus a 2 operační revize pro krvácení. Po měsíci mělo 65 % pacientů sinusový rytmus. Box-léze byla při elektrofyziologickém vyšetření kompletní u 38 % pacientů a po katetrizační ablaci odcházelo 96 % pacientů se sinusovým rytmem.
Závěr:
Chirurgická část hybridní ablace pomocí miniinvazivního přístupu s využitím katétru COBRA Fusion je dobře proveditelnou metodou s nízkým počtem perioperačních komplikací a poskytuje elektrofyziologům velmi dobrý základ pro úspěšné dokončení hybridní ablace.
Klíčová slova:
fibrilace síní, hybridní ablace – torakoskopie − katetrizační ablace − elektrofyziologické vyšetření
ÚVOD
Fibrilace síní (FS) je nejčastější setrvalou srdeční arytmií, s prevalencí 1,5−2 % v celkové populaci [1]. Tato prevalence stoupá s věkem pacientů a roste i celkový počet pacientů s FS. Přítomnost FS vede ke dvojnásobnému riziku úmrtí, významnému zvýšení rizika tromboembolických příhod (až 5x vyšší riziko iktu), častým kardiovaskulárním hospitalizacím (zejména pro vznik či zhoršení srdečního selhání) a také k výraznému snížení kvality života [2]. Farmakologická léčba FS má stále významné limitace v poměrně nízké účinnosti zejména u neparoxysmálních forem FS a také četné vedlejší účinky. Intervenční metody léčby FS tak i z tohoto důvodu zažívají v posledních letech významný rozvoj.
Katetrizační, endokardiální ablace FS je v současné době zavedenou a standardně prováděnou metodou a zejména pro léčbu paroxysmální FS má výborné výsledky. U neparoxysmálních forem je však dlouhodobá úspěšnost výrazně nižší [3]. Chirurgická léčba FS je postavena na proceduře představené v roce 1987, tzv. Cox-maze operaci. Tento známý výkon [4], původně prováděný náročnou technikou incize a sutury, byl na přelomu tisíciletí poměrně úspěšně modifikován a zjednodušen, zejména ve smyslu použití alternativních energií pro vytváření ablačních lézí, především kryoenergie a radiofrekvence (RF)[5]. Jako součást jiného kardiochirurgického výkonu je dnes již prováděn standardně u pacientů indikovaných primárně pro jinou diagnózu (nejčastěji chlopenní vadu či koronární nemoc). Pro pacienty s izolovanou FS (tedy bez strukturálního postižení srdce a bez indikace k jinému kardiochirurgickému výkonu) byly vyvíjeny jednodušší varianty maze operace, zejména s cílem provedení epikardiálně, na bijícím srdci a z minimálně invazivního přístupu. Jejich účinnost však není zcela přesvědčivá, jak shrnul například Mack ve svém přehledovém článku, kdy po 6−12 měsících trval SR pouze u 62 % pacientů s předoperační perzistentní či dlouhodobě perzistentní FS [6]. V začátcích byla hlavním problémem nespolehlivost katétrů v provádění kvalitních, transmurálních ablačních lézí. V současné době u spolehlivějších katétrů (především využívajících bipolární RF energii) zůstává problémem nemožnost provedení některých lézí, zásadních pro léčbu zejména neparoxysmálních forem FS (léze např. k mitrálnímu anulu). V posledních zejména 5 letech se bouřlivě rozvíjí koncept tzv. hybridního výkonu, určeného zejména k léčbě izolované perzistentní a dlouhodobě perzistentní FS. Jeho principem je kombinace miniinvazivního kardiochirurgického zákroku a následné katetrizační ablace, kdy se využije předností obou výkonů a eliminují se tak jejich nedostatky při pouze samostatném provedení. Kardiochirurgický zákrok je většinou prováděn thorakoskopicky (unilaterálně či bilaterálně, v závislosti na použitém instrumentáriu a katétru) a spočívá především v izolaci plicních žil (PŽ) a zadní stěny levé síně (koncept tzv. box-léze). Důležitou součástí těchto výkonů, zejména pro prevenci iktu a možnosti vysazení antikoagulační léčby, se stává i uzávěr ouška levé síně (LS), navíc mohou být přidány i další léze. Katetrizační výkon je následně prováděn buď ihned po skončení chirurgického (tzv. one-staged koncept, provádí se na hybridním operačním sále), anebo s odstupem několika dní až měsíců. Spočívá v elektrofyziologickém vyšetření za účelem kontroly kompletnosti box-léze zadní stěny levé síně (tj. izolace všech 4 plicních žil a zadní stěny), v případě její nekompletnosti je dokončena. Následně se provádějí další ablační linie (typicky ke chlopenním annulům), které jsou chirurgicky buď obtížně proveditelné, anebo zcela neproveditelné. Dále mohou být mapovány a ablovány i další event. přítomné (běžící) arytmie, jako např. atypický flutter zpravidla levé síně či fokální síňové tachykardie. Nutno říci, že konkrétní protokoly hybridních ablací se na jednotlivých pracovištích různí a ideální cesta se stále hledá. Review prvních výsledků však ukazují na velmi dobrou úspěšnost v nastolení a udržení SR – u procedur využívajících bipolární RF energii to po roce od výkonu bylo 85,7–92 % [7].
V článku popisujeme chirurgickou část hybridního výkonu pro FS, který se provádí v našem Kardiocentru. Soustřeďujeme se na operační postup a techniku, možné pooperační komplikace, krátkodobou úspěšnost našeho souboru pacientů a shrnujeme základní elektrofyziologické výsledky, zjištěné při katetrizační části procedury.
METODA
Výběr pacientů
Protokol hybridního výkonu byl vytvořen v souladu s aktuálním konsenzem doporučení světových arytmologických společností [8]. Vhodnými kandidáty výkonu jsou pacienti se symptomatickou, perzistentní či dlouhodobě perzistentní FS, u kterých nebyla účinná farmakologická léčba (alespoň 1 antiarytmikum bylo vyzkoušeno). Vylučovacím kritériem je zejména přítomnost strukturálního onemocnění srdce, indikované ke klasické kardiochirurgické operaci. Všichni pacienti jsou komplexně kardiologicky vyšetřeni (echokardiografie, selektivní koronarografie, RTG, spirometrie) zejména k zachycení významných stenóz na koronárních tepnách či významných chlopenních vad. K výkonu nejsou indikováni též pacienti se známou reverzibilní příčinou FS (např. thyreopatie) a pacienti se srůsty v perikardiální či pravé pleurální dutině či po předchozím kardiochirurgickém výkonu. Obecné rizikové faktory (věk, obezita, plicní onemocnění) a rizikové faktory selhání ablace (velikost LS, trvání FS) jsou posuzovány individuálně.
Thorakoskopický výkon
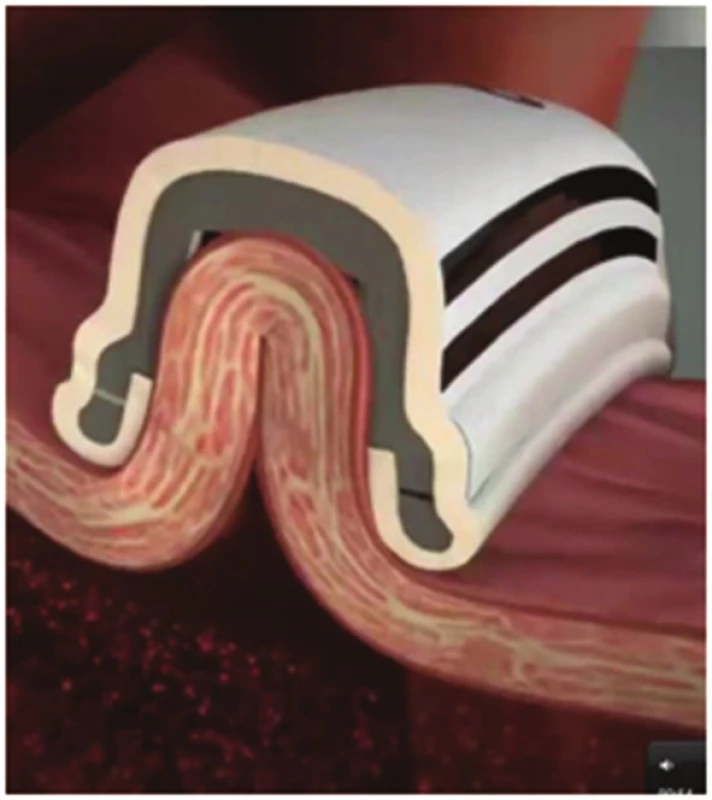
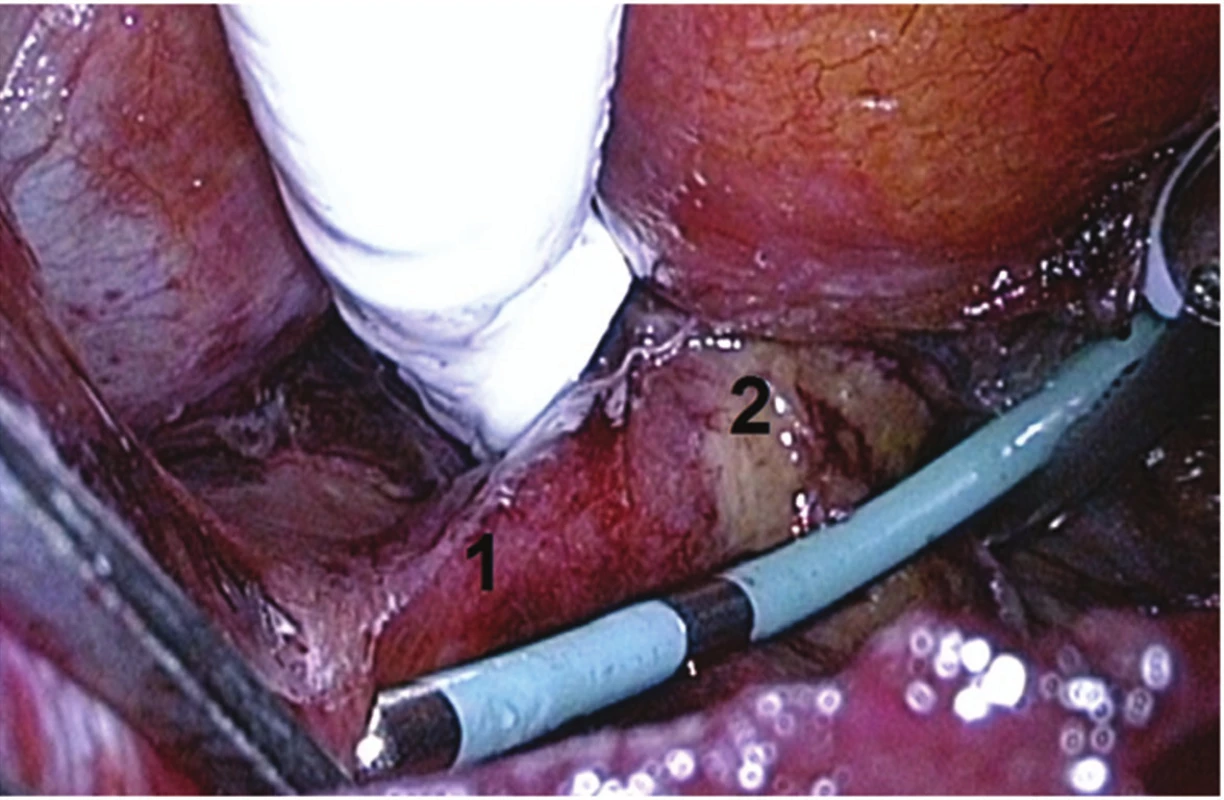
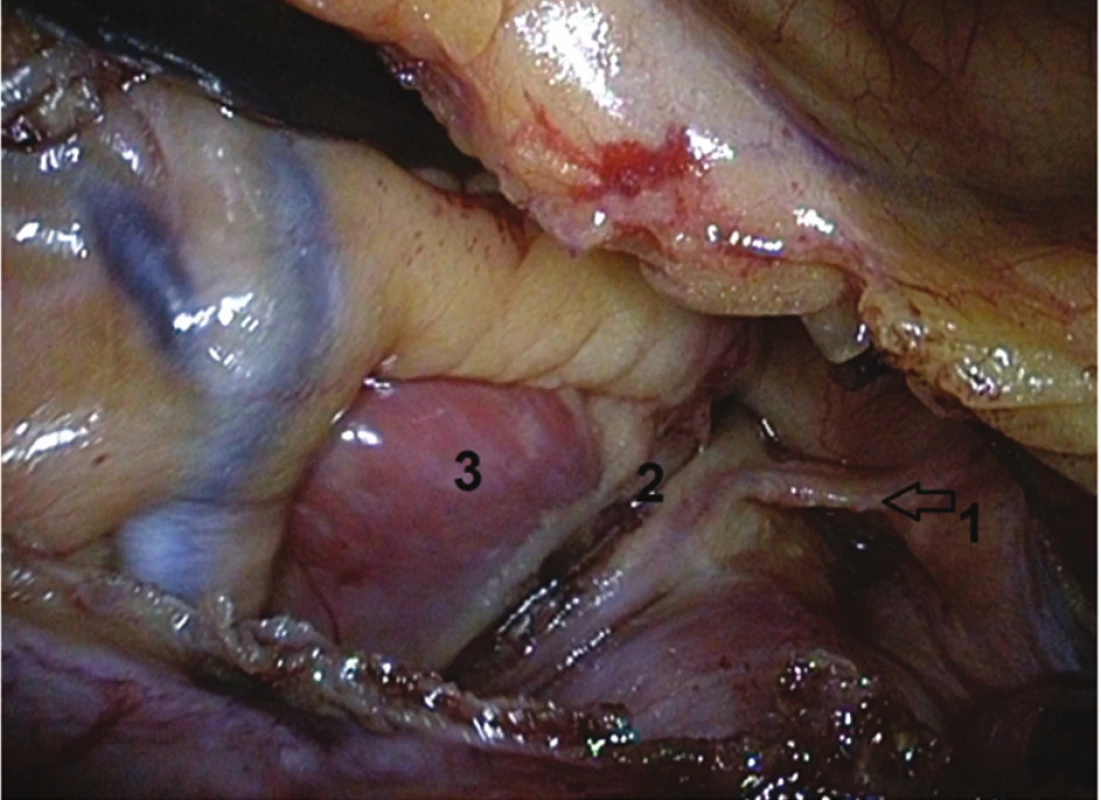
Před výkonem je pacientům vysazena antikoagulační léčba, warfarin 5 dní a nová perorální antikoagulancia (NOAK) 2−3 dny. Na začátku výkonu je provedeno jícnové echokardiografické vyšetření (TEE) k vyloučení intrakardiální trombózy, která představuje absolutní kontraindikaci operace. Pacient je umístěn vleže na zádech, používá se selektivní plicní ventilace. Thorakoskopické porty jsou zavedeny do pravého hemitoraxu, port pro kameru (10mm) mírně pod úrovní přední axilární čáry v 5. mezižebří, je zahájena insuflace CO2. Druhý port (10mm) několik centimetrů nad ní do 5. či 6. mezižebří a třetí (5mm) podobně do 3. či 4. mezižebří tak, že společně tvoří trojúhelník. Následně je široce otevřen perikard několik cm nad průběhem n. phrenicus a zadní část perikardu je odtažena stehy dorzálně, stehy jsou protaženy skrz kůži a fixovány. Pomocí endoskopických nástrojů je následně preparován nejprve transverzální sinus, zároveň je touto preparací rozrušen i epikardiální tuk v oblasti stropu levé síně. Na konci této preparace je ozřejmeno ouško LS. Dále je preparací mezi dolní dutou žilou a pravou dolní plicní žilou uvolněn i vstup do sinus obliqus. Do obou sinů jsou následně zasunuty speciální zavaděče se špičkou opatřenou magnetem, které se spojí za srdcem a výsledkem je tak obkroužení všech plicních žil. Následně se připojí ablační sonda COBRA FusionTM 150 (Estech, an AtriCure® Company, San Ramon, CA, USA) a protáhne se kolem plicních žil (Obr. 1). Zásadní je kontrola správné pozice sondy, prováděná jak vizuálně, tak pomocí TEE, zejména umístění sondy pod ouškem LS (při poloze katétru přes ouško LS hrozí poranění kmene levé koronární tepny a samotného ouška). Kontakt s tkání síně je následně zajištěn aplikací podtlaku (-500 mmHg) – sonda do své dutiny nasaje přilehlou část síně, čímž je též zabráněno ochlazování ablované části myokardu krví proudící v síni (Obr. 2). Před aplikací podtlaku je ještě rozrušen v co největší míře epikardiální tuk (který, jakožto izolační vrstva, zvyšuje riziko selhání ablace), a to zejména v oblasti u mezisíňového septa a nad stropem LS. Vlastní ablace je prováděna vždy jak v bipolárním, tak unipolárním módu, aplikovaná energie se automaticky přizpůsobuje dle cílové teploty, která je nastavena na 70 °C. Provádějí se dvě cirkulární léze a katétr je mezi nimi vždy mírně posunut, aby se zajistila spojitost box-léze, většinou ještě přidáváme třetí lézi na septum. Po poslední aplikaci RF energie se provádí kontrola kompletnosti box-léze, a sice testováním tzv. exit bloku (provádíme standardně od roku 2014), případně i tzv. entrance bloku (provádíme až od roku 2016). Testování exit bloku spočívá ve stimulaci zadní stěny levé síně či pravostranných plicních žil distálně za ablační linií (Obr. 3) a je možno je provádět jen při přítomném SR. Pokud box není kompletní, stimulace zadní stěny či plicní žíly se převede na levou síň a následně na komoru. Při kompletním boxu stimulace zadní stěny levé síně ani vysokou stimulační energií nevede ke stahu síně (vlně P), a tudíž následnému stahu komor (QRS komplexu), box je tedy elektricky „oddělen“ od zbytku levé síně. Složitější testování entrance bloku spočívá v měření přítomnosti signálů na zadní stěně levé síně či na pravostranných žilách přiložením elektrofyziologického katétru (elektrody) distálně od ablační linie. Pokud je box kompletní, žádné signály „za“ ablační linií detekovány nejsou (box je oddělen od zbytku síně). Testování entrance bloku může být prováděno jak při SR, tak při běžící FS. Při nekompletnosti bloku přidáváme ještě další ablační cyklus. Rány jsou následně uzavřeny, ponecháváme jeden hrudní drén.
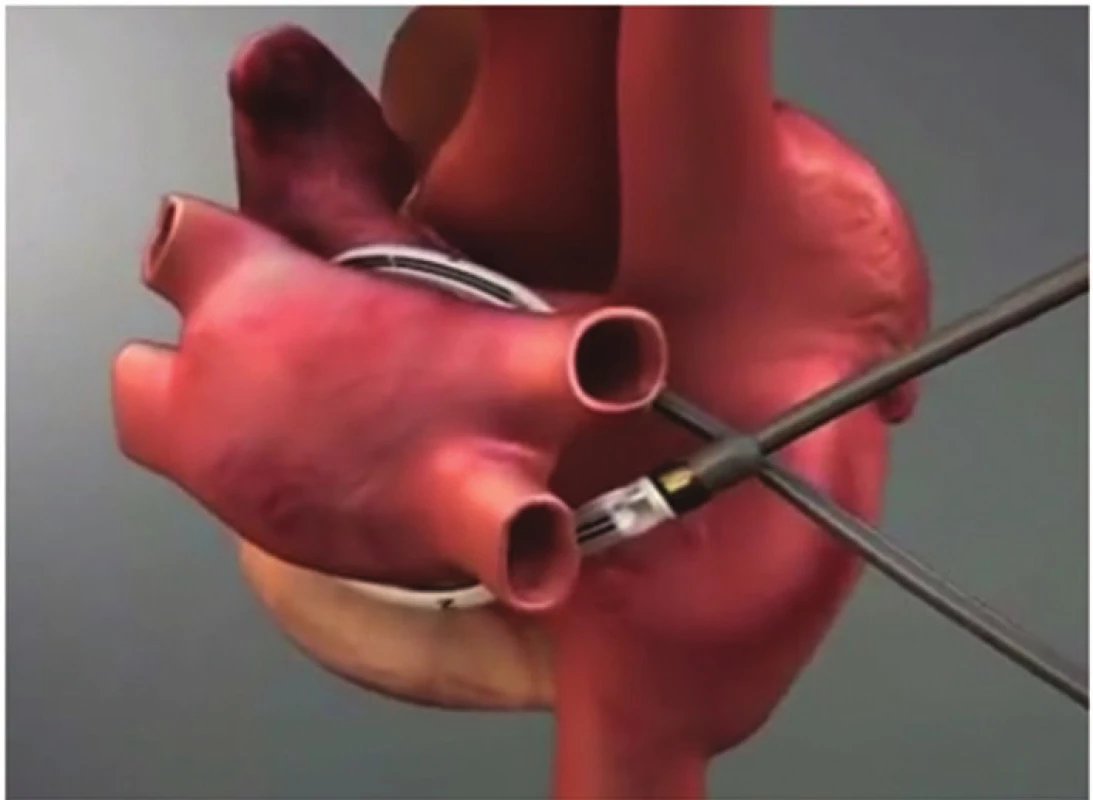
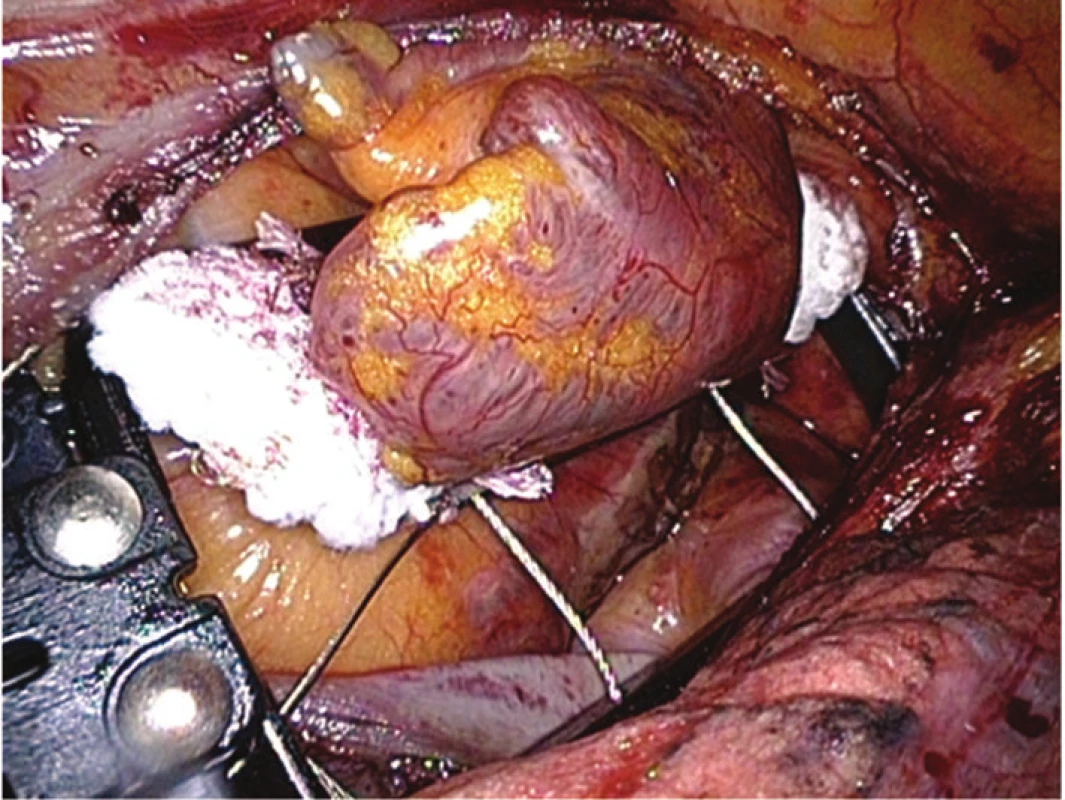
Od března 2015 provádíme jako součást výkonu levostrannou thorakoskopickou okluzi ouška LS. Selektivní intubace je přesunuta na kontralaterální stranu a do levého hemithoraxu jsou zavedeny 3 endoskopické porty (o něco kraniálněji než vpravo). Perikard je široce otevřen pod průběhem n. phrenicus a horní okraj je vytažen stehem ventrálně přes kůži a fixován. Baze ouška LS je změřena pomocí speciálního instrumentária a je vybrána vhodná velikost klipu. Kaudální incize je následně zvětšena na malou torakotomii (kožní řez cca 6 cm), skrz kterou je do hrudníku zasunut speciální klip, systém AtriClip® Pro (AtriCure, Inc, Cincinnati, OH, USA). Ouško LS je prostrčeno otvorem v klipu tak, aby ten doléhal až k jeho bazi, poté je uzavřen (Obr. 4). Pomocí TEE je ihned posouzena kompletnost uzávěru ouška (reziduální pahýl nesmí být větší než 1 cm, měla by být kompletně uzavřena jeho trabekularizovaná část a nesmí být přítomen průnik krve ze síně do ouška) a zkontrolována kinetika boční stěny a průtok ramus circumflexus levé koronární tepny, která leží v těsné blízkosti ouška. Při neúplnosti uzávěru či při vzniku hypokineze a zhoršení průtoku koronární tepnou je možno klip opět otevřít a upravit jeho pozici. Po potvrzení správné pozice je zaváděcí systém klipu uvolněn a odstraněn.
Výhodou rozšíření přístupu i na levou stranu je možnost zkontrolovat zprava nepřístupnou část léze, ověřit elektrický blok i na levostranných plicních žilách a také velmi jednoduše elektrokoagulací přetnout Marshallovo ligamentum, které může hrát důležitou roli v udržování FS (Obr. 5). Není-li blok vlevo přítomen, či je-li vizuálně viditelná mezera (tzv. gap) v ablační lézi, lze k dokončení léze použít ještě kratší variantu katétru, COBRA FusionTM 50 (Estech). Ta pracuje na stejném principu a se stejnou ablační konzolí jako velký katétr 150. Na konci výkonu ponecháváme jeden hrudní drén.
Po výkonu jsou pacienti časně extubováni, nutná je intenzivní plicní rehabilitace. Antikoagulaci jsme dříve během výkonu nepodávali a zahajovali ji první pooperační den (nízkomolekulární heparin). Od roku 2015 podáváme během výkonu nefrakcionovaný heparin tak, aby vlastní ablace byla prováděna při hodnotě Aktivovaného koagulačního testu (ACT) nad 300 sekund. Heparin ponecháváme v nízké dávce (ACT 180-200s) až do prvního pooperačního dne, kdy je nahrazen nízkomolekulárním heparinem [9]. Pacienti jsou po výkonu nasyceni antiarytmiky, domů odcházejí s warfarinem (cílové INR 2–3) či některým z NOAK a antiarytmikem (amiodarone či propafenon). Před propuštěním je prováděno kontrolní TEE k vyloučení intrakardiální trombózy a kontrola pozice AtriClipu. První pooperační kontrola je za měsíc od výkonu. Při této kontrole jsou vysazena antiarytmika a pacient je objednán ke katetrizační části hybridní procedury (za 2−3 měsíce od chirurgické části).
VÝSLEDKY
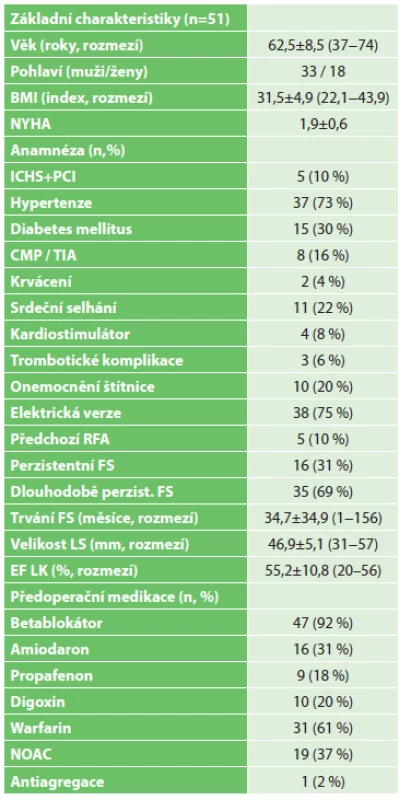
Od září 2013 do září 2016 podstoupilo chirurgickou část hybridního výkonu celkem 51 pacientů. Základní charakteristiky pacientů jsou shrnuty v Tab. 1. Kontraindikace nepředstavoval ani vysoký věk (až 74 let), obezita (BMI až 43,9) či doba trvání FS (i více než 12 let). U 5 pacientů byla předoperačně přítomna těžká posttachykardická dysfunkce LK (s EF 20−30 %).
U prvních 25 pacientů byl proveden pouze unilaterální ablační výkon pravostrannou thorakoskopií. Průměrný čas výkonu byl 102 minut (70−130). Po rozšíření výkonu o uzávěr ouška LS z levostranného přístupu se doba operace prodloužila, v průměru na 160 minut (135−220). U všech pacientů byla kompletně provedena box-léze katétrem COBRA Fusion 150, u 1 pacienta bylo z levé strany provedeno dodatečné doplnění léze katétrem Fusion 50 v místě její nekontinuálnosti u levé horní plicní žíly (viditelné vizuálně a potvrzené testováním bloku). Ouško LS bylo uzavřeno u 25 z 26 posledních pacientů, u jednoho nemohl být uzávěr proveden pro srůsty v levé pleurální dutině. U všech 25 pacientů prokázalo TEE dobrý efekt uzávěru. Ke spontánní verzi na SR došlo během ablace u 8 pacientů, u 7 z nich byl blok přítomen, u 1 nebyl testován. Elektrická kardioverze byla během výkonu provedena u 32 pacientů, u 22 pacientů byla úspěšná, z těchto 22 pacientů byl u 18 úspěšně ověřen blok, u 4 nebyl přítomen ani po opakované ablaci. Ověření exit bloku vedení bylo celkově provedeno u 36 pacientů (u 15 pacientů nebyl ověřován pro trvající FS), u 6 (12 % všech pacientů) nebyl blok vedení přítomen ani po přidání další ablační léze. Testování entrance bloku bylo prováděno až u posledních několika pacientů v roce 2016, výsledky tedy zatím nepřinášejí statisticky validní data. Na začátku výkonu byla u 43 (84 %) pacientů přítomna FS, na konci výkonu mělo FS pouze 14 (27 %) pacientů.
Nedošlo k žádnému perioperačnímu úmrtí ani perioperační konverzi na sternotomii. Ze závažných pooperačních komplikací jsme zaznamenali jeden (2 %) perioperační iktus, který se demaskoval ihned po extubaci (tento pacient byl operován dle původního protokolu, kdy během výkonu nebyl podáván heparin). Přes intenzivní rehabilitaci u pacienta trvá reziduální neurologický deficit. U jednoho (2 %) pacienta byla pooperačně zaznamenána paréza pravostranného n. phrenicus, která se postupně upravila během 9 měsíců při intenzivní rehabilitaci a akupunktuře. U 2 (4 %) pacientů byla pooperačně provedena revize levého hemithoraxu pro krvácení a 2x (4 %) jsme zaznamenali pooperační pneumothorax s nutností drenáže. Pacienti byli průměrně propuštěni domů pátý až šestý pooperační den. V prvních dvou pooperačních měsících měli 2 (4 %) pacienti postperikardiotomický syndrom, který byl vyřešen konzervativně a 2x (4 %) se vyskytla pooperační pleuritida s nasedající pneumonií. Dalším důležitým nálezem byl u části pacientů záchyt trombů v oušku LS na TEE před katetrizační ablací, z tohoto důvodu byla do protokolu výkonu postupně přidána peroperační heparinizace a následně i rozšíření výkonu o uzávěr ouška LS. Tato problematika byla podrobně popsána v jiné publikaci a přesahuje rozsah této práce [9].
Při měsíční kontrole mělo na EKG sinusový rytmus 33 pacientů (65 %). Pacienti byli za další 1–2 měsíce odesláni k EP vyšetření a katetrizační části výkonu. Ta již byla provedena u 45 pacientů, 43 (96 %) z nich bylo následně propuštěno se SR. Elektrofyziologické nálezy první skupiny pacientů byly nedávno publikovány [10]. V aktuálním souboru byla chirurgicky vytvořená box-léze kompletně izolována u 17 (38 %) pacientů. Důležitým zjištěním bylo, že maximum mezer (gapů) v box-lézi bylo přítomno v oblasti stropní linie mezi horními plicními žilami a v oblasti pravostranných plicních žil; v těchto oblastech byla zjištěna i výrazně silnější vrstva epikardiálního tuku než v ostatních částech síně [10].
DISKUZE
Miniinvazivní léčba FS zažívá v současné době velký rozmach. Byla vyvinuta řada ablačních katétrů a postupů a jednotlivá pracoviště dávají přednost různým strategiím léčby. U paroxysmální FS je katetrizační ablace standardně prováděna po selhání antiarytmické léčby, v některých případech na zkušených pracovištích i jako metoda první volby [1]. Většina pracovišť ji standardně provádí i u neparoxysmální FS, tam však dle dostupných studií jsou výsledky ve smyslu trvalého udržení SR podstatně horší [3,11]. Na některých pracovištích je prvoplánově prováděna pouze chirurgická miniinvazivní ablace a elektrofyziologické vyšetření a katetrizační ablace jsou indikovány až v druhé době, při recidivách FS či jiných SV arytmiích. Hybridní koncept vychází z logické úvahy, že chirurgické léze (zejména izolace plicních žil) nemusejí být vždy zcela kompletní a že k co nejvyšší pravděpodobnosti udržení SR je potřeba jak jejich ověření a kompletizace, tak i případné přidání lézí dalších (většinou léze k anulům za účelem prevence nejčastějších typů síňových flutterů, event. jiných přítomných arytmií dle výsledku elektrofyziologického vyšetření). Navíc je známo, že nekompletní léze mohou být pro pacienty spíše proarytmogenní (jsou ideálním substrátem pro makroreentry).
Pro další rozšíření chirurgických výkonů je důležité, aby byla potvrzena jejich dobrá proveditelnost, perioperační bezpečnost, minimální zátěž pro pacienty a aby provedené léze vytvořily pro elektrofyziology co nejlepší pozici pro finalizaci plánovaného setu ablačních lézí. Znalost elektrofyziologických nálezů a zejména poznání „slabých míst“, tedy nejčastějších lokalizací gapů po výkonech s různými chirurgickými ablačními systémy, tak tvoří pro chirurgy důležitou zpětnou vazbu.
V našem souboru pacientů jsme od března 2015 rozšířili výkon o uzávěr ouška LS. Doba výkonu se tím signifikantně prodloužila, ovšem uváděný průměrný čas 160 minut zahrnuje i první výkony, které byly ovlivněny učební křivkou. Dále bylo též u posledních výkonů zpřesněno (a prodlouženo) měření bloku vedení a v neposlední řadě zabere cca 10 až 15 minut samotný přesun endoskopické věže a instrumentária a také úprava selektivní ventilace. Samotný uzávěr ouška LS tak trvá zhruba 20 minut. Rozšíření chirurgického přístupu a také peroperační podávání heparinu může zvýšit riziko krvácivých komplikací.V našem souboru jsme u dvou pacientů byli nucení provést operační revizi, zdrojem bylo krvácení v oblasti levostranné minithorakotomie. Pečlivá hemostáza, zejména u peroperační heparinizace, je zcela nezbytná. Rizika spojená s nutností provedení thorakotomie pro zavedení Atriclipu může v budoucnu vyřešit vylepšená verze tohoto klipu. Na našem pracovišti již byl testován (v rámci pilotní evropské studie) model PRO2, který je možno implantovat plně thorakoskopicky, cestou 13mm portu. Ostatní chirurgické komplikace se vyskytly v našem souboru s nízkou četností, což koresponduje s podobnými soubory pacientů. V přehledových článcích uvádějí Gelsomino [7] a Vroomen [12] četnost významných komplikací 4,1 %, resp. 7 % (zahrnuje úmrtí, iktus, konverzi na sternotomii, revizi, poranění n. phrenicus, tamponádu srdeční, implantaci KS, krvácení).
Sinusový rytmus se po chirurgickém výkonu vyskytoval u více než poloviny pacientů a po kombinaci s následnou katetrizační ablací ho bylo dosaženo v naprosté většině případů (96 %). Zásadní budou samozřejmě dlouhodobé výsledky, které budou tématem navazující publikace. V našem souboru používáme k ablaci bipolární/unipolární RF katetr COBRA Fusion. Jeho výhodou oproti jiným ablačním systémům je jeho jednoduchý design, který však umožňuje vytvoření široké a robustní léze kolem plicních žil. Jiné ablační systémy využívají většinou bipolární RF kleště k izolaci plicních žil v párech, které mívají velmi dobrou účinnost. Například v práci kolegů z Českých Budějovic (RF kleště a izolační pera AtriCure) popisují Bulava a kolektiv výbornou úspěšnost izolace plicních žil po 2 měsících od chirurgického výkonu – 80 % a 94 % pro levostranné, resp. pravostranné žíly [13]. Další léze je však nutno provést jinými a většinou méně účinnými systémy, nejčastěji jsou to unipolární či bipolární ablační pera. Ve výše uvedené práci mají spojovací linie mezi levo - a pravostrannými žilami nižší úspěšnost 34 % (horní linka) a 60 % (dolní), box-léze pak byla kompletní u 30 % pacientů. V našem souboru jsme dospěli k velmi podobným výsledkům, box-léze byla kompletní u 38 % pacientů a vyšší počet gapů (a tedy nižší úspěšnost kompletní léze) byl shodně zaznamenán u stropní linie. Možným důvodem může být i silnější vrstva epikardiálního tuku v této stropní oblasti oproti místu kaudální spojovací linky, jak popisujeme z měření CT zobrazení síní v jiném článku [10]. To jen zdůrazňuje nutnost pečlivé a extenzivní preparace tuku v místech zamýšlených lézí.
Hybridní výkon lze provádět ve dvou základních variantách. V rámci jediného výkonu je prováděn na hybridním sále a po chirurgické části následuje ihned fáze katetrizační. Druhou možností je provést katetrizační zákrok s odstupem několika dní až měsíců, tyto intervaly se na různých pracovištích různí. Při chirurgickém výkonu byl v našem souboru blok vedení (a tedy potenciálně kompletní box-léze) přítomen u 83 % pacientů, v práci Bulavy a spol. to bylo dokonce u 96 % pacientů. Po dvou měsících při elektrofyziologickém vyšetření už byl přítomen však jen u 38 %, resp. 30 %. Tato zjištění podporují spíše variantu výkonu ve dvou krocích, kdy se prodlevou mezi výkony může demaskovat falešně pozitivní akutní blok. Ten je většinou dán nekompletní ablační linií s edémem tkáně, který akutně během ablace vypadá jako blok kompletní, po odeznění otoku (ve dnech) se ovšem vedení tkání obnoví. Tento příklad demonstruje do budoucna nutnost velkých studií či registrů, které by srovnaly tyto různé přístupy k léčbě izolované FS.
ZÁVĚR
Chirurgická část hybridní ablace pomocí bilaterálního, miniinvazivního přístupu s využitím bipolárního/unipolárního RF katétru je dobře proveditelnou metodou s nízkým počtem komplikací. Ke zvýšení úspěšnosti je však chirurgickou ablaci, i při přítomnosti sinusového rytmu, nutno ověřit a doplnit katetrizačním výkonem. Rozsáhlé studie s velkým počtem pacientů budou nutné k nalezení optimálních strategií pro konkrétní pacienty.
Podpořeno grantem AZV No. 16-32478A
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Petr Budera, Ph.D.
Kardiochirurgická klinika 3.LF UK a FNKV
Šrobárova 50
100 34 Praha 10
petr.budera@fnkv.cz
Sources
1. Camm AJ, Lip GY, De Caterina R, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012;33 : 2719−47.
2. Chugh SS, Blackshear JL, Shen WK, et al. Epidemiology and natural history of atrial fibrillation: clinical implications. J Am Coll Cardiol 2001;37 : 371−8.
3. Ganesan AN, Shipp NJ, Brooks AG, et al. Long-term outcomes of catheter ablation of atrial fibrillation: a systematic review and meta-analysis. J Am Heart Assoc. 2013;18,2:e004549.
4. Cox JL, Schuessler RB, Lappas DG, et al. An 8 1/2-year clinical experience with surgery for atrial fibrillation. Ann Surg 1996;224 : 267−73;discussion 273−5.
5. Stulak JM, Suri RM, Burkhart HM, et al. Surgical ablation for atrial fibrillation for two decades: are the results of new techniques equivalent to the Cox maze III procedure? J Thorac Cardiovasc Surg 2014;147 : 1478−86.
6. Mack MJ. Current results of minimally invasive surgical ablation for isolated atrial fibrillation. Heart Rhythm. 2009;6,Suppl:S46−9.
7. Gelsomino S, Van Breugel HN, Pison L, et al. Hybrid thoracoscopic and transvenous catheter ablation of atrial fibrillation. Eur J Cardiothorac Surg 2014;45 : 401−7.
8. Calkins H, Kuck KH, Cappato R, et al. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace 2012;14 : 528−606.
9. Budera P, Osmancik P, Herman D, et al. Risk of intraatrial thrombi after thoracoscopic ablation in absence of heparin and appendage closure. Ann Thorac Surg 2017; in press.
10. Osmancik P, Budera P, Zdarska J, et al. Electrophysiological findings after surgical thoracoscopic atrial fibrillation ablation. Heart Rhythm 2016;13 : 1246−52.
11. Rostock T, Salukhe TV, Steven D, et al. Long-term single - and multiple-procedure outcome and predictors of success after catheter ablation for persistent atrial fibrillation. Heart Rhythm 2011;8 : 1391–7.
12. Vroomen M, Pison L. Hybrid ablation for atrial fibrillation: a systematic review. J Interv Card Electrophysiol 2016;47 : 265−74.
13. Bulava A, Mokracek A, Hanis J, et al. Sequential hybrid procedure for persistent atrial fibrillation. J Am Heart Assoc 2015;25,4:e001754.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2017 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Malignant fibrous histiocytoma as a rare cause of acute limb ischemia
- Thoracoscopic, epicardial ablation of atrial fibrillation using the COBRA Fusion system as the first part of hybrid ablation
- Autologous cranioplasty with a bone flap preserved subcutaneously in the mesogastrium
- Combined treatment of early tracheobronchopleural fistula after right tracheal sleeve pneumonectomy
- Leiomyoma of external iliac vein
- Current possibilities to influence surgical site infection
- Colorectal cancer in senior patients – are we doing it well?
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Autologous cranioplasty with a bone flap preserved subcutaneously in the mesogastrium
- Current possibilities to influence surgical site infection
- Malignant fibrous histiocytoma as a rare cause of acute limb ischemia
- Thoracoscopic, epicardial ablation of atrial fibrillation using the COBRA Fusion system as the first part of hybrid ablation
