Možnosti ošetření durálních defektů v neurochirurgii
Current possibilities of dural reconstruction in neurosurgery
An integral part of intracranial neurosurgery is the opening of the subdural space and its subsequent closure or reconstruction after the surgery. The optimal goal is a primary watertight suture, although that is often unfeasible for various reasons. Cerebrospinal fluid leakage in postoperative care is an undesirable and potentially dangerous complication of most of the surgical interventions. The aim of this article is to present the current possibilities of dural reconstruction in neurosurgery.
Key words:
mater − cerebrospinal fluid leakage − dural defect −craniectomy
Authors:
Z. Večeřa 1,2; Š. Reguli 1,2; M. Houdek 1,2; R. Lipina 1,2
Authors‘ workplace:
Neurochirurgická klinika, Fakultní nemocnice Ostrava
1; Lékařská fakulta Ostravské univerzity
2
Published in:
Rozhl. Chir., 2018, roč. 97, č. 10, s. 455-458.
Category:
Review
Overview
Nedílnou součástí intrakraniálních neurochirurgických operací je otevření mozkových obalů a po ukončení výkonu i jejich následná důsledná rekonstrukce. Optimem je přímá vodotěsná sutura tvrdé pleny, která ale často z různých příčin není možná. Únik mozkomíšního moku v pooperačním období je nežádoucí a riziková komplikace většiny neurochirurgických výkonů. Cílem článku je představit současné možnosti ošetření durálních defektů.
Klíčová slova:
plena − likvorea − durální defekt − zevní dekomprese
Úvod
Základním principem fyziologického intrakraniálního operování v neurochirurgii je ukončení výkonu vodotěsnou suturou tvrdé pleny. V řadě případů ale vzniká defekt, který je nutno překrýt či rekonstruovat. Retrakce okrajů či poranění dury během kraniotomie jsou relativně časté. Někdy provádíme resekci tvrdé pleny plánovaně při nádorovém postižení k dosažení radikálního odstranění nádoru (meningiomy). Naopak existují stavy, kdy je potřeba durální obaly rozšířit, nastavit dekomprese v oblasti zadní jámy (Chiariho malformace), nebo v neurotraumatologii při provedení zevní dekomprese pro otok mozku.
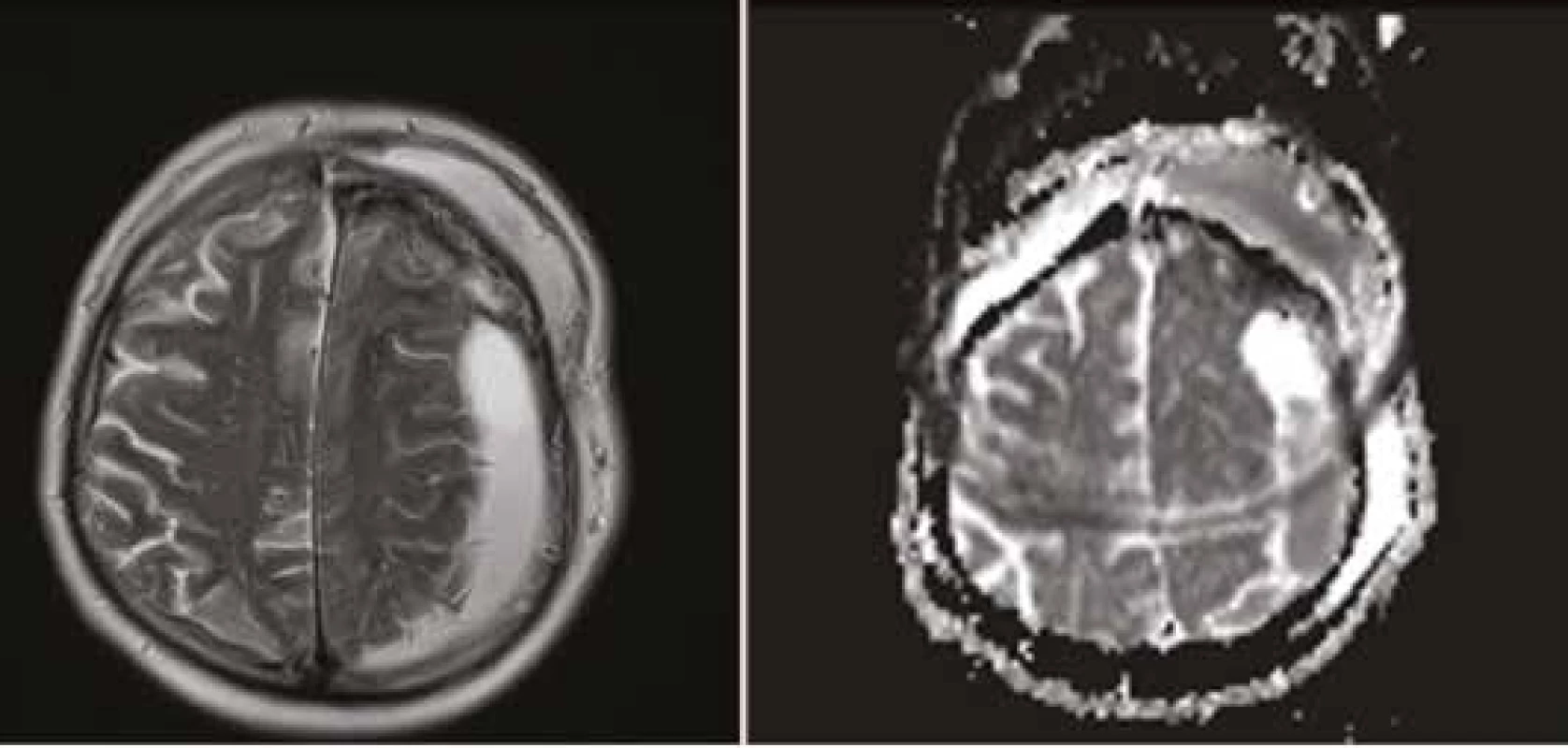
Nedostatečně kvalitní ošetření může vést ke vzniku likvorové pseudocysty nebo likvorové píštěle s prosakováním likvoru z operační rány (viz Obr. 1). Zvýšené riziko pro vznik píštěle představují operace v oblasti zadní jámy, reoperace, rozsáhlé tumory a operace v zánětlivém terénu. Rizika infekčních komplikací mohou znamenat pro pacienta vážné důsledky s možnými trvalými následky, i když primární operace dopadla bez výraznějších potíží. Je možné vzplanutí meningitidy, která je často vyvolána nozokomiálními rezistentními kmeny, nebo vznik abscesu či empyému s odstupem času, s charakterem pozdní komplikace (viz Obr. 2). Prodlužuje se čas hospitalizace, narůstá ekonomická zátěž pacienta způsobená delší antibiotickou terapií, případnou reoperací, event. i zavedením zevní lumbální drenáže [1].
Fig. 1: MR image (T2W) of cerebrospinal fluid pseudocyst
after posterior fossa surgery with expansive behaviour –
two reoperations were needed to achieve successful healing
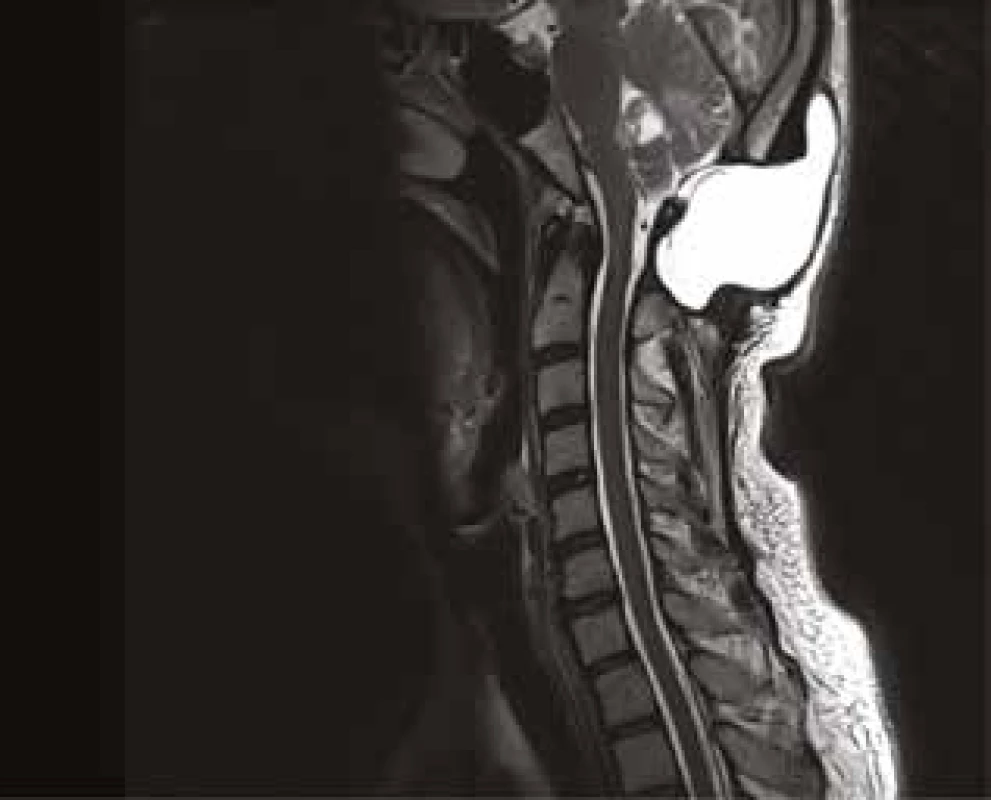
Fig. 2: MR imaging of subdural and subcutaneous empyema after cranial surgery – severe complication
as a result of insufficient dural reconstruction. (A – T2 weighted image, B – apparent
diffusion coefficient, ADC)
Technika ošetření, druhy materiálů
Primární vodotěsná sutura atraumatickým stehem, jednotlivými stehy či pokračující suturou se liší v závislosti na zkušenostech a preferencích jednotlivých pracovišť, případně na typu operace. Drobné defekty v průběhu sutury je možné nastavit svalem či ošetřit položením plátku hemostatického materiálu (např. Tachosil®, Hemopatch®). Vodotěsnost sutury lze pojistit aplikací tkáňového fibrinového lepidla či hydrogelu – snížení incidence likvorey a bezpečnost podání jsou proklamovány řadou prací [2,3,4].
Rozsáhlé defekty či ztrátová poranění je nutné překrýt či přešít durální náhradou. V dnešní době existuje řada možností ošetření. Nejvhodnějším materiálem je autologní štěp. Používáme periost kalvy (perikranium) či fascii skalpu (galea aponeurotica). Při reoperacích nebo velkých defektech je možné odebrat fascii m. tensor fasciae latae (fascia lata). Při operativě zadní jámy lební je možné využít nuchální fascii [5]. Vhodné se jeví i užití autologního tukového štěpu odebraného nejčastěji abdominálně. Tuto techniku poprvé použil Harvey Cushing již v roce 1912 [6,7].
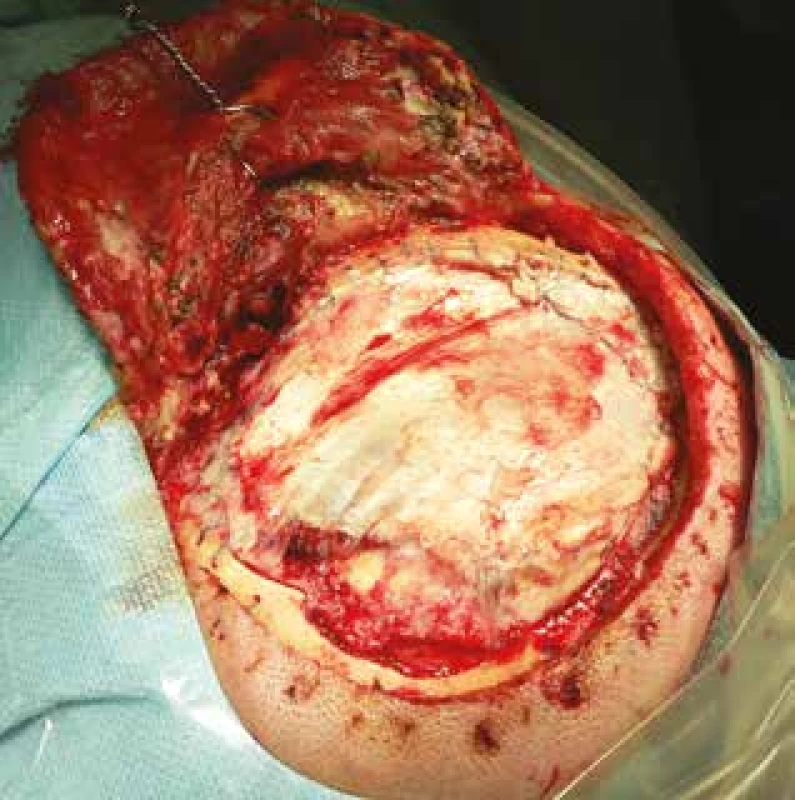
Technika aplikace štěpu se liší dle pracovišť – lalok je možné ponechat na vitální stopce či kompletně všít do defektu (Obr. 3). Nevýhodou použití autologního štěpu je prodloužení operačního času, může narůst krevní ztráta, přibývá další jizva, případně se s odstupem času rozvíjí atrofie svalu v místě odběru, což může být spojeno s negativními estetickými dopady (atrofie m. temporalis) či bolestivými stavy v místě odběru (fascia lata).
Fig. 3: Repeated surgery for CSF leakage. Dural reconstruction
with fascia lata and application of fibrin tissue
glue.
K dispozici máme řadu umělých a biologických materiálů allogenní či xenogenní povahy. První záznamy o plastice tvrdé pleny autologním zdrojem lze dohledat již v roce 1890 [8,9]. V této době započalo experimentování s možnými náhradami od použití gumy, zlaté fólie či vaječné membrány [10,11]. Od 50. let20. století došlo k rozvoji allogenních preparátů – nejčastěji šlo o lyofilizovanou tvrdou plenu z kadaverózních zdrojů [12–14]. Desetiletí užívaná náhrada vykazovala bezproblémové hojení. Poté byla zakázána pro zaznamenaný a prokázaný přenos prionové infekce − iatrogenní formy Creutzfeldt-Jakobovy encefalopatie v souvislosti s jejím užitím u durálních rekonstrukcí. Šlo o preparát Lyodura (B-Braun, Německo). Ve světě, zejména v Japonsku a Austrálii, je do dnešního dne prokázáno přes 120 infikovaných [13,14,15]. V současnosti je z allogenních preparátů k dispozici acelulární lidská dermis (AlloDerm®). Byla s dobrými výsledky používána k rekonstrukci Chiariho malformace u dětí [16,17,18].
Ze zvířecích tkání se využívaly nejčastěji perikard, peritoneum či intestinální mukóza. Materiál se sterilizoval gama zářením a nakládal do alkoholu [19]. Pro rizika přenosu zoonóz a imunitní reakce nejsou tyto náhrady v dnešní době užívány.
Umělé materiály mají největší riziko infekčních komplikací [20]. Příkladem uvádíme polymer na bázi polytetrafluoroetylenu (Gore-tex®), mikroporózní tkanou membránu z polyesteruretanu (Neuro-Patch®, Bard®) [20−23]. Využití v chirurgii našla i biosyntetizovaná celulóza (SYNTECEL®) [24]. Jsou neresorbovatelné, neprohojí se s tkání, většinou je nutná pečlivá sutura do defektu.
Největší a nejpoužívanější skupinou jsou syntetické či xenogenní kolageny dostupné v podobě plošné acelulární matrix zbavené zvířecích antigenů s minimem imunitních a infekčních rizik. Bezpečnost aplikace byla vždy v první době testována v experimentu na zvířecím modelu [25,26], následně ověřena řadou klinických prací [27−30]. Dostupné jsou v různé velikosti a hojně využívány pro rychlost aplikace a zkrácení operačního času. Aplikace se liší dle výrobce, od sutury po prosté položení. Literatura udává minimální nežádoucí účinky i podobnou incidenci pooperační likvorey v porovnání s přímou suturou u nevšívatelných materiálů. Výsledky jsou srovnatelné jak u supratentoriálních operací [31,32], tak i u operací zadní jámy [33]. Nevýhodou je cena preparátů pohybující se v řádu tisíců až desetitisíců korun. Příkladem může být derivát bovinního kolagenu (DuraGen®, DURAFORM®, Duradry®), bovinní dermis (DuraMatrix®), derivát koňského kolagenu (Tissudura®), derivát submukózy tenkého prasečího střeva (Dural graft Biodesing®) či kombinace syntetického a bovinního kolagenu (NeoDura®, ReDura®).
Endoskopické výkony
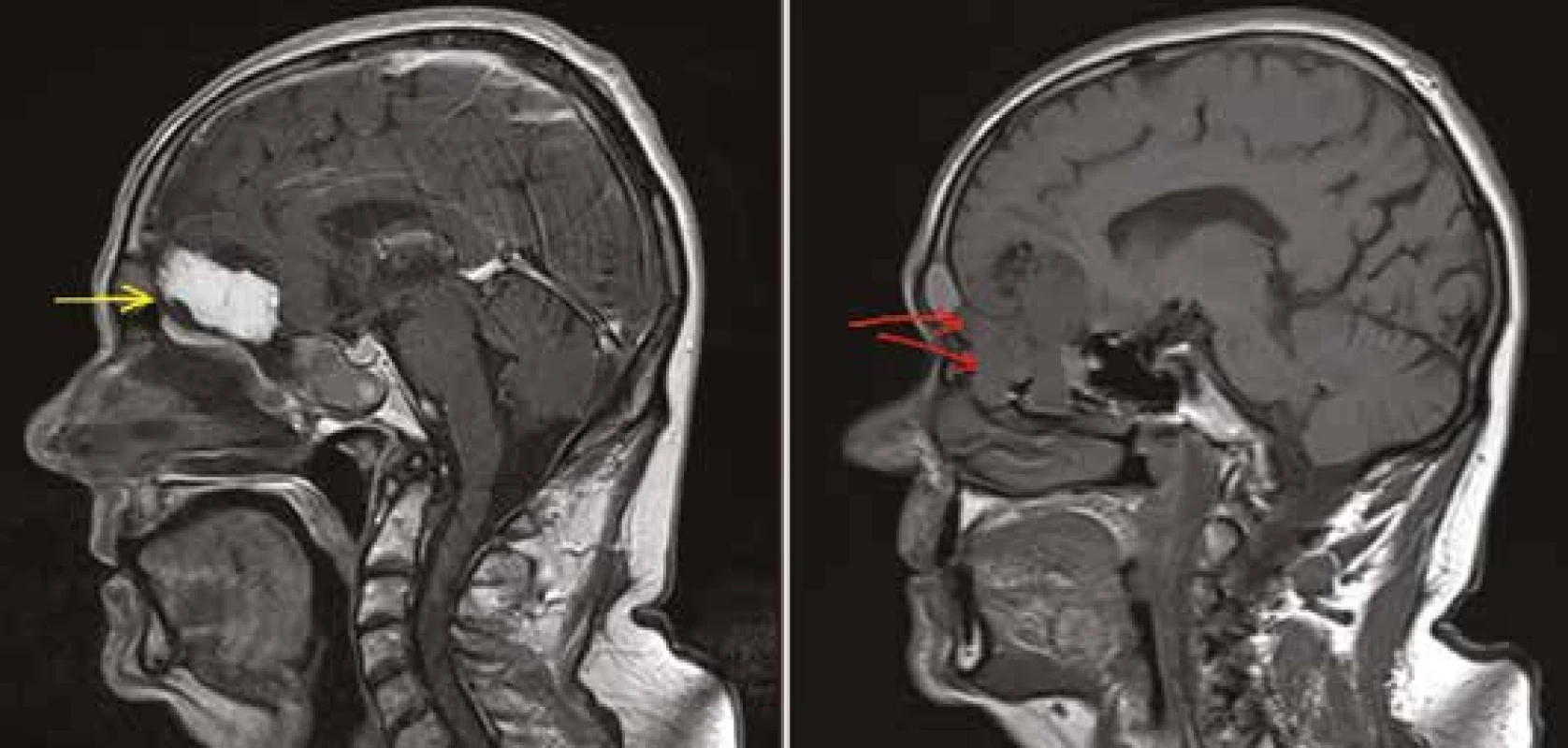
Endoskopické výkony představují speciální podkapitolu neurochirurgie. Defekty tvrdé pleny při transnasální endoskopické chirurgii představují často větší problém než samotná operace. Sutura v této oblasti není možná, defekty se nejčastěji řeší aplikací tukového štěpu do defektu, překrytím kolagenní náhradou a zajištěním nasoseptálním vitálním lalokem (viz Obr. 4). Možná je i aplikace tkáňového lepidla. Zavedení dočasné zevní lumbální drenáže a několikadenní imobilizace na lůžku jsou i tak v některých případech podmínkou úspěšného zahojení.
Fig. 4: Transnasal endoscopic surgery of the anterior cranial base – after removal of the invasive
meningioma we performed dural reconstruction using fat tissue (A – fat graft, B – meningioma
before surgery)
Závěr
Vodotěsná rekonstrukce tvrdé pleny je nezbytnou součástí všech intrakraniálních operací, obnovuje fyziologickou rovnováhu intrakraniálně a poskytuje prevenci nežádoucích komplikací, které mohou výrazně zhoršit výsledek operace, snížit spokojenost pacienta i omezit zjevné ekonomické dopady. Možnosti rekonstrukce jsou v dnešní době rozsáhlé a měly by být optimalizovány dle typu operace, zkušenostmi chirurga i s ohledem na ekonomickou situací oddělení. Nicméně jako zlatý standard by měla vždy platit primární sutura tvrdé pleny tam, kde je to technicky možné.
Podpořeno MZ ČR – RVO – FNOs/2015
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Zdeněk Večeřa
Dolní Sklenov 169
739 46 Hukvaldy
Sources
- Grotenhuis JA. Costs of postoperative cerebrospinal fluid leakage: 1-year, retrospective analysis of 412 consecutive nontrauma cases. Surg Neurol 2005;64 : 490–3.
- Terasaka S, Iwasaki Y, Kuroda S, et al. A novel method of dural repair using polyglycolic acid non-woven fabric and fibrin glue: clinical results of 140 cases. No Shinkei Geka 2006;34 : 1109–17.
- Esposito F, Angileri FF, Kruse P, et al. Fibrin sealants in dura sealing: A systematic literature review. PLoS ONE 2016. Available from: doi:10.1371/journal.pone.0151533.
- Than KD, Baird CJ, Olivi A. Polyethylene glycol hydrogel dural sealant may reduce incisional cerebrospinal fluid leak after posterior fossa surgery. Neurosurgery 2008;63 : 182–7.
- Kosnik EJ. Use of ligamentum nuchae graft for dural closure in posterior fossa surgery. Technical note. J Neurosurg 1998;89 : 155−6.
- Di Vitantonio H, De Paulis D, Del Maestro M, et al. Dural repair using autologous fat: Our experience and review of the literature. Surgical Neurology International. 2016;7(Suppl 16):S463-S468.
- Black P. Cerebrospinal fluid leaks following spinal or posterior fossa surgery: Use of fat grafts for prevention and repair. Neurosurg Focus 2000;9:e4.
- Shridharani SM, Tufaro AP. A systematic review of acelluar dermal matrices in head and neck reconstruction. Plast Reconstr Surg 2012;130 : 35S–43S.
- Bartosz DK, Vasterling MK. Dura mater substitutes in the surgical treatment of meningiomas. J Neurosci Nurs 1994;26 : 140–5.
- Beach HHA. Gold foil in cerebral surgery. Boston Med Surg J 1897;136 : 281−2.
- Abbe R. Rubber tissue for meningeal adhesions. Trans Am Surg Assoc 1895;13 : 490−1.
- Sharkey PC, Usher FC, Robertson RCL. Lyophilized human dura mater as a dural substitute. J Neurosurg 1958;15 : 192−8.
- Preusser M, Ströbel T, Gelpi E, et al. Alzheimer-type in a 28 year old patient with iatrogenic Creutzfeldt-Jakob disease after dural grafting. J Neurol Neurosurg Psychiatry 2006;77 : 413–6.
- Nishida Y, Yamada M, Hara K, et al. Creutzfeldt-Jakob disease after Jannetta‘s operation with cadaveric dura mater graft: initial manifestations related to the grafted site. J Neurol 2002;249 : 480–3.
- Brooke FJ, Boyd A, Klug GM, et al. Lyodura use and the risk of iatrogenic Creutzfeldt-Jakob disease in Australia. Med J Aust 2004;180 : 177–81.
- Parizek J, Mericka P, Husck Z, et al. Detailed evaluation of 2959 allogeneic and xenogeneic dense connective tissue grafts (fascia lata, pericardium and dura mater) used in the course of 20 years for duraplasty in neurosurgery. Acta Neurochir 1997;139 : 827–81.
- Warren WL, Medary MB, Dureza CD, et al. Dural repair using acellular human dermis: experience with 200 cases: technique assessment. Neurosurgery 2000;46 : 1391−6.
- Danish SF, Samdani A, Hanna A, et al. Experience with acellular human dura and bovine collagen matrix for duraplasty after posterior fossa decompression for Chiari malformations. J Neurosurg 2006;104 (1 Suppl):16−20.
- Filippi R, Schwarz M, Voth D, et al. Bovine pericardium for duraplasty: clinical results in 32 patients. Neurosurg Rev 2001;24 : 103−7.
- Malliti M, Page P, Gury C, et al. Comparison of deep wound infection rates using a synthetic dural substitute (neuro-patch) or pericranium graft for dural closure: A clinical review of 1 year. Neurosurgery 2004;54 : 599–603, discussion 603−4.
- Viñas FC, Ferris D, Kupsky WJ, et al. Evaluation of expanded polytetrafluoroethylene (ePTFE) versus polydioxanone (PDS) for the repair of dura mater defects. Neurol Res 1999;21 : 262−8.
- Robertson SC, Menezes AH. Hemorrhagic complications in association with silastic dural substitute : pediatric and adult case reports with a review of the literature. Neurosurgery 1997;40 : 201−5; discussion 205−6.
- Messing-Jünger AM, Ibáñez J, Calbucci F, et al. Effectiveness and handling characteristics of a three-layer polymer dura substitute: a prospective multicenter clinical study. J Neurosurg 2006;105 : 853−8.
- Rosen CL, Steinberg GK, DeMonte F, et al. Results of the prospective, randomized, multicenter clinical trial evaluating a biosynthesized cellulose graft for repair of dural defects. Neurosurgery 2011;69 : 1093−103; discussion 1103−4.
- Cobb MA, Badylak SF, Janas W, et al. Histology after dural grafting with small intestinal submucosa. Surg Neurol 1996;46 : 389–94.
- Cobb MA, Badylak SF, Janas W, et al. Porcine small intestinal submucosa as a dural substitute. Surg Neurol 51 : 99–104, 1999
- Litvack ZN, West GA, Delashaw JB, et al. Dural augmentation: part I-evaluation of collagen matrix allografts for dural defect after craniotomy. Neurosurgery 2009;65 : 890−7;discussion 897.
- Narotam PK, Qiao F, Nathoo N. Collagen matrix duraplasty for posterior fossa surgery: evaluation of surgical technique in 52 adult patients. Clinical article. J Neurosurg 2009;111 : 380−6.
- Narotam PK, Van Dellen JR, Bhoola K, et al. Experimental evaluation of collagen sponge as a dural graft. Br J Neurosurg 1993;7 : 635−41.
- Parlato C, di Nuzzo G, Luongo M, et al. Use of a collagen biomatrix (TissuDura) for dura repair: A long-term neuroradiological and neuropathological evaluation. Acta Neurochir 2011;153 : 142–7.
- Barth M, Tuettenberg J, Thomé C, et al. Watertight dural closure: is it necessary? A prospective randomized trial in patients with supratentorial craniotomies. Neurosurgery 2008;63(4 Suppl 2):352–8, discussion 358.
- Sade B, Oya S, Lee JH. Non-watertight dural reconstruction in meningioma surgery: results in 439 consecutive patients and a review of the literature. Clinical article. J Neurosurg 2011;114 : 714–8.
- Kshettry VR, Lobo B, Lim J, et al. Evaluation of non-watertight dural reconstruction with collagen matrix onlay graft in posterior fossa surgery. Journal of Korean Neurosurgical Society 2016;59 : 52−7.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2018 Issue 10
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Strategie léčby pacientů s kolorektálním karcinomem a synchronními metastázami jater
- Možnosti ošetření durálních defektů v neurochirurgii
- Intraperitoneal onlay mesh − analýza vlastní sestavy nemocných
- Vliv nadváhy a obezity na komplikace v kolorektální chirurgii
- Laparoskopická cholecystektomie u pacientky se situs viscerum inversus totalis a empyémem žlučníku − kazuistika
- Spontánna bilaterálna ruptúra ligamentum patellae
- Akutní embolie truncus brachiocephalicus a arteria pulmonalis
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Spontánna bilaterálna ruptúra ligamentum patellae
- Možnosti ošetření durálních defektů v neurochirurgii
- Intraperitoneal onlay mesh − analýza vlastní sestavy nemocných
- Akutní embolie truncus brachiocephalicus a arteria pulmonalis
