Radikalita proximální resekce žaludku - přehledový článek
Radicality of proximal gastrectomy – a rewiev
Although the incidence of gastric cancer is decreasing worldwide, the number of esophagogastric junction and upper-third gastric carcinomas is gradually growing. This is due to an increasing incidence of reflux esophagitis with Barrett’s metaplasia and successful eradication of Helicobacter pylori infection. Treatment options for these tumors include proximal gastrectomy. The only currently accepted indication for proximal gastrectomy is early gastric cancer with no preoperative evidence of lymph node involvement. In Western countries, however, advanced gastric cancers are treated using this method as well in spite of the above recommendation. Oncological radicality is a widely discussed issue. If R0 resection and at least D1+ lymphadenectomy are achieved in proximal gastrectomy, the overall survival is comparable with total gastrectomy in early gastric cancers. Recurrence rate, nevertheless, remains higher for proximal gastrectomy.
Key words:
proximal gastrectomy − oncological radicality − esophagogastric junction cancer − early gastric cancer
Authors:
P. Lochman; J. Páral
Authors‘ workplace:
Katedra vojenské chirurgie, Fakulta vojenského zdravotnictví Univerzity obrany, Hradec Králové
; Katedra vojenské chirurgie, Fakulta vojenského zdravotnictví Univerzity obrany, Brno
Published in:
Rozhl. Chir., 2018, roč. 97, č. 8, s. 360-367.
Category:
Review
Overview
I přes celosvětově klesající incidenci karcinomu žaludku dochází k nárůstu počtu nádorů ezofagogastrické junkce a proximální třetiny žaludku. Příčinou je na jedné straně rostoucí výskyt refluxní ezofagitidy s Barrettovou metaplazií a na straně druhé úspěšná eradikace infekce Helicobacter pylori. Jednou z možností, jak řešit karcinomy v této oblasti, je i proximální resekce žaludku. Dnes akceptovanou indikací k jejímu provedení je pouze časný karcinom žaludku bez předoperačně prokázaného postižení lymfatických uzlin. V západních zemích je navzdory tomuto doporučení používána i k řešení pokročilých karcinomů. Onkologická radikalita výkonu a její srovnatelnost nejčastěji s totální gastrektomií jsou často diskutovány. Při dosažení R0 resekce a provedení D1+ lymfadenektomie je celkové přežití u časných karcinomů u obou metod srovnatelné, nicméně procento recidiv je u proximální resekce žaludku vyšší.
Klíčová slova:
proximální resekce žaludku − onkologická radikalita − karcinom ezofagogastrické junkce − časný karcinom žaludku
Úvod
Karcinomy žaludku a jícnu, čtvrté, resp. osmé nejčastější maligní onemocnění v celosvětovém měřítku, představují závažný medicínský problém [1]. Podle údajů dostupných z databáze GLOBOCAN byla v roce 2012 celosvětově odhadována incidence karcinomu jícnu na 456 tis. případů a karcinomu žaludku na 952 tis. v absolutních číslech, počet úmrtí na daná onemocnění pak 400 tis., resp. 723 tis. za jeden rok [2]. I když je během posledních čtyř desetiletí zejména u karcinomu žaludku patrný dramatický pokles v incidenci o více než polovinu, což ukazují i pro Českou republiku data Národního onkologického registru (NOR), výsledky léčby hodnocené délkou přežití, resp. mortalitou a letalitou se i přes nové terapeutické možnosti u obou onemocnění příliš nemění [3]. Příčinou je zejména přetrvávající záchyt onemocnění až v pokročilých stadiích.
Co se však mění, je histologický typ a lokalizace nádorů jícnu a žaludku. V současnosti v našich zeměpisných šířkách převažuje adenokarcinom jícnu nad dlaždicobuněčným karcinomem, a to hlavně z důvodu rostoucího výskytu gastroezofageální refluxní nemoci a s ní spojené intestinální (tzv. Barrettovy) metaplazie distálního jícnu, která je považována za jasnou prekancerózu. Ročně pak dochází k nárůstu incidence adenokarcinomu jícnu o 5–10 % [1]. U žaludku naopak přibývá proximálně uložených nádorů [4,5]. Za příčinu tohoto trendu se označuje rostoucí úspěšná eradikace infekce Helicobacter pylori [1]. Každopádně roste výskyt adenokarcinomů v oblasti přechodu jícnu a žaludku, jak ukazují i četné populační studie vycházející z onkologických registrů [6–8]. Tento trend je patrnější zejména v zemích západní Evropy a USA, zatímco ve východoasijských zemích (např. Jižní Korea a Japonsko) stále ještě převládá dlaždicobuněčný karcinom jícnu a karcinomy žaludku postihující spíše jeho distální vývodnou část. Dle posledních publikovaných údajů tvoří adenokarcinomy v oblasti proximální třetiny žaludku v západoevropských zemích přes 30 % všech karcinomů žaludku, ve východoasijských zemích průměrně asi 15 % případů [9]. Dnes uznávaným chirurgickým postupem u karcinomu jícnu včetně jeho distální části je subtotální ezofagektomie z transtorakálního přístupu a nitrohrudní anastomóza nejčastěji tubulizovaného žaludku na jícen, nebo subtotální ezofagektomie z transhiatálního přístupu a našití obdobné anastomózy na krku, oba postupy doplněny o lymfadenektomii v předepsaném rozsahu.
U nádorů proximálního žaludku pak většina chirurgů volí totální či rozšířenou totální gastrektomii s resekcí distálního jícnu z transhiatálního přístupu. Nádory vycházející z oblasti anatomické kardie jsou pak řešeny oběma přístupy a na rozsahu operačního výkonu, resp. na nejvhodnějším typu operace nepanuje všeobecná shoda. Rozsáhlejší resekční výkony ve smyslu ezofagogastrektomie nepřinesly zlepšení výsledků léčby a naopak zvyšují morbiditu [10,11].
Proximální resekce žaludku (proximal gastrectomy, proximální gastrektomie, PG) není v léčbě nádorů ezofagogastrické junkce a proximálního žaludku široce akceptována snad s výjimkou nevelkých nádorů žaludku v časném stadiu, tzv. early gastric cancer (EGC). Odpůrci argumentují její předpokládanou nižší onkologickou radikalitou a zejména špatnými funkčními výsledky, které negativně ovlivňují kvalitu života pacientů po PG. Některé současné práce prokazují srovnatelnost výsledků s totální gastrektomií (total gastrectomy, TG) z hlediska onkologické radikality tohoto výkonu a část z nich dokonce vyvrací názor o neuspokojivých funkčních výsledcích.
Proximální resekce žaludku
Proximální resekce žaludku je typem výkonu, jehož rozsah není zcela přesně definován. Obecně ji lze definovat jako odstranění proximální části žaludku včetně EGJ při zachování pyloru a různě velké části žaludečního těla a antra. Stejně tak není univerzální postup při obnovení kontinuity zažívacího traktu po tomto resekčním výkonu a existuje celá řada modifikací.
Současná indikační kritéria
Japanese Gastric Cancer Association (JGCA) rozděluje ve své 4. anglické verzi doporučení pro léčbu karcinomu žaludku z roku 2014 chirurgické postupy na kurativní a nekurativní. Kurativní chirurgické výkony pak dále dělí na standardní gastrektomie (resekce alespoň 2/3 žaludku s nádorem a D2 lymfadenektomií, tj. odstraněním uzlin č. 1 až 12 dle JGCA) a nestandardní gastrektomie, kde může být rozsah resekce a lymfadenektomie změněn v závislosti na lokalizaci a pokročilosti nádoru. Jedním z uznávaných výkonů v této skupině je i proximální resekce žaludku, která je spolu s pylorus zachovávající resekcí žaludku také někdy označovaná jako modifikovaná gastrektomie [12].
Indikací k jejímu provedení je ale pouze časný karcinom žaludku bez předoperačně prokázaného postižení lymfatických uzlin (cT1N0M0), pokud může být zachována více než polovina žaludku. Za těchto podmínek je akceptabilní provést lymfadenektomii menšího rozsahu než D2, která je standardním krokem při řešení nádorů ve stadiu cT2-4a či cN+.
Proximální resekcí žaludku lze tedy logicky řešit pouze časné karcinomy v oblasti ezofagogastrické junkce (typ III dle Siewerta a výběrově i typ II a I) a karcinomy proximální třetiny žaludku. Proximální resekční okraj u T1 nádorů je doporučován 2 cm. Pokud jsou hranice nádoru nejasné, doporučuje se předoperační endoskopické označení klipem. Distální resekční okraj většinou nebývá problémem. Principiálně pro cT1N0 nádory bývá doporučena D1 (u PG jde o odstranění uzlin č. 1, 2, 3a, 4sa, 4sb a 7) nebo D1+ lymfadenektomie (u PG D1 + uzliny č. 8a, 9, 11p). D1 lymfadenektomie je indikována u T1a nádorů nevhodných k endoskopickému řešení (EMR/ESD) a u cT1bN0, které jsou G1 a G2.
Doporučovanou metodou obnovení kontinuity zažívacího traktu je ezofagogastroanastomóza, interpozice jejuna či tzv. double-tract rekonstrukce (ezofagojejunoanastomóza na exkludovanou kličku dle Rouxe, na kterou je anastomózou připojen i pahýl žaludku). U této poslední metody rekonstrukce tak dochází k pasáži potravy částečně přes žaludeční pahýl a částečně pak přímo do tenkého střeva s vynecháním cesty přes žaludek a duodenum.
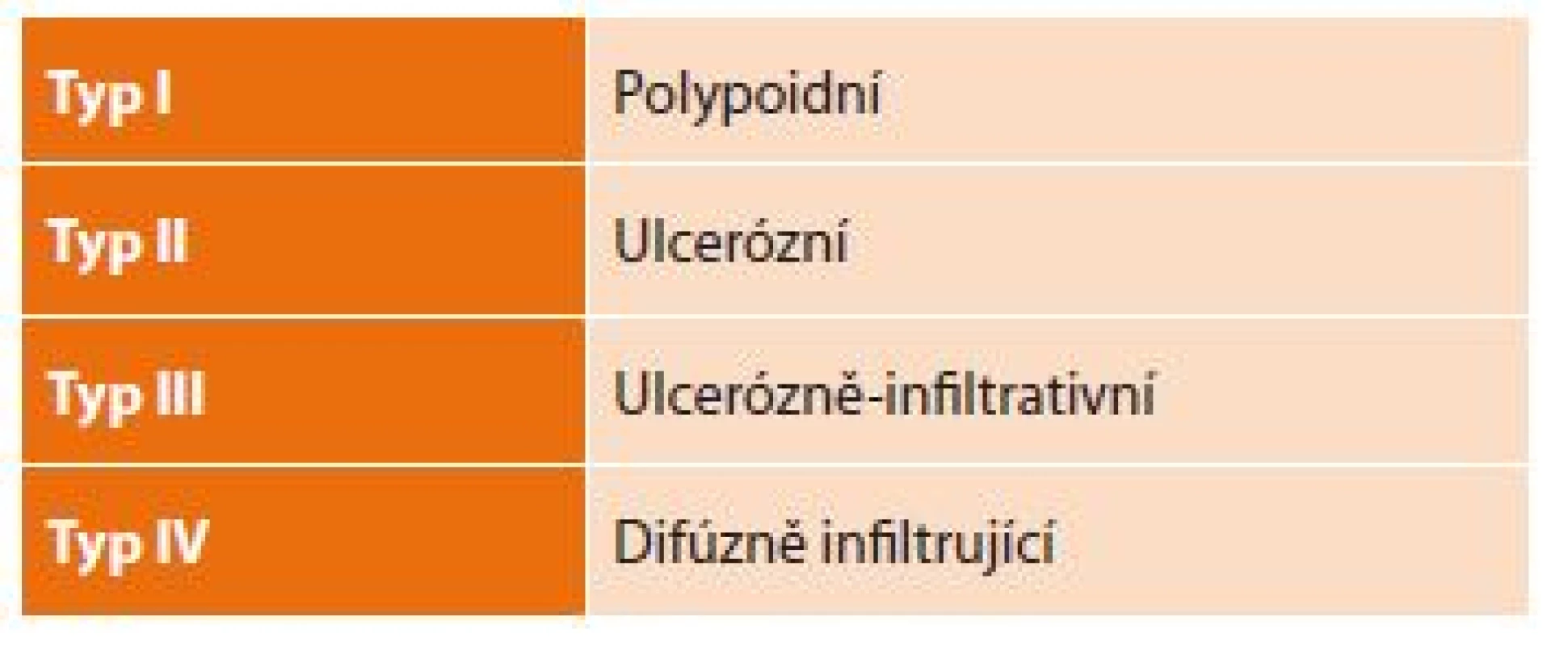
V západních zemích jsou proximální resekcí žaludku řešeny i nádory pokročilejší, u nichž se doporučuje dosažení proximálního resekčního okraje alespoň 3 cm pro T2 a vyšší stadia u makroskopického typu I a II a 5 cm u typu III a IV (Tab. 1). Při postižení distálního jícnu nádorem, kdy nelze dosáhnout 5cm okraje, je doporučeno provést peroperační „zmrazovací“ vyšetření resekčního okraje k zabezpečení R0 resekce [12]. Požadavek na provedení D2 lymfadenektomie nelze ale u PG naplnit, což je hlavní limitující faktor v případě pokročilých stadií (cT2−T4 nebo cN+) podle odpůrců této metody. Zastánci argumentují srovnatelnými výsledky D1+ lymfadenektomie u PG a D2 lymfadenektomie u TG při řešení nádorů EGJ a proximální třetiny žaludku.
Tab. 1: Macroscopic division of advanced tumours according to JGCA
Onkologická radikalita
Předpokladem onkochirurgické radikality je dosažení R0 resekce, tj. kompletní odstranění nádoru bez ponechání rezidua, s odpovídající lymfadenektomií. V případě maligních nádorů zažívací trubice se jedná o resekci či odstranění celého orgánu s nádorem a dostatečnými resekčními okraji. Názory na vzdálenost resekčních okrajů od nádoru a rozsah lymfadenektomie se u karcinomů jícnu a žaludku liší a tyto otázky jsou opakovaně diskutovány na odborných akcích a v celé řadě literárních sdělení.
Resekční okraje
Vezmeme-li v úvahu, že karcinomy jícnu včetně jeho distální části, tj. i karcinomy typu I a II dle Siewerta, jsou řešeny subtotální ezofagektomií, pak dosažení dostatečného proximálního i distálního resekčního okraje nebývá problémem mimo případů typu II šířících se dominantně distálním směrem na žaludek. Pokud ale zvažujeme provedení totální či rozšířené totální gastrektomie z transhiatálního přístupu u nádorů typu II a III nebo proximální třetiny žaludku, pak dostačující proximální resekční okraj může být pro chirurga nemalou výzvou. Stejná situace tedy nastává i v případě PG s event. resekcí distálního jícnu, kdy navíc musíme zvažovat i vzdálenost distálního resekčního okraje. Makroskopická negativita longitudinálních resekčních okrajů (proximální a distální) není dostatečným kritériem radikality v případě nádorů EGJ. Důvodem je jejich schopnost šířit se intramurálně a podrůstat zdravou sliznici buď šířením primárního nádoru, nebo jako metastatická ložiska [13,14]. Délkou resekčních okrajů se zabývalo několik studií, které měřily vzdálenosti in vivo nebo na fixovaných preparátech. Je třeba vzít v úvahu, že jícen se zkracuje bezprostředně po resekci a toto zkrácení dosahuje 10–45 % délky naměřené in vivo [15,16].
V roce 2003 publikoval Mariette studii týkající se nádorů typu I a II dle Siewerta a doporučil vzdálenost proximálního resekčního okraje 8 cm in vivo (s předpokladem 50% zkrácení při fixaci resekátu) [17]. Ito definoval jako bezpečnou vzdálenost 6 cm u nádorů typu II a III [18]. Barbour v roce 2007 prokázal zlepšení přežití u pacientů s proximálním resekčním okrajem in vivo alespoň 5 cm, což odpovídalo 3,8 cm na resekátu [19]. Prodloužené přežití při dodržení 5 cm proximálního okraje se týkalo pacientů se všemi typy nádorů EGJ dle Siewertovy klasifikace. Mine prokázal, že proximální resekční okraj v délce alespoň 20 mm (přibližně 28 mm in vivo) je spojen s lepším přežitím u typu II a III [20]. Dřívější doporučení bezpečného proximálního resekčního okraje 6 cm u intestinálního a dokonce 8 cm u difuzního typu karcinomu žaludku dle Lauréna jsou u nádorů EGJ, resp. typu III těžko splnitelná a z pouhého transhiatálního přístupu prakticky nemožná.
Distální resekční okraj může být problémem u nádorů EGJ typu II dle Siewerta, které se extenzivně šíří distálním směrem. Nutnost použití tubulizovaného žaludku k náhradě jícnu může bránit dosažení bezpečného distálního resekčního okraje. V práci Ita byl negativní okraj dosažen u všech pacientů s minimálním odstupem 4 cm pod nádorem, Casson doporučuje alespoň 5 cm měřeno in vivo [18,21].
Lze tedy konstatovat, že výše uvedená doporučení platná pro proximální resekční okraj se vzhledem k podstatě výkonu neliší u totální gastrektomie a PG. Distální resekční okraj může být v případě rozsáhlých nádorů EGJ obtížně dosažitelný u PG, zvláště pokud se nádor šíří převážně na straně malé křiviny a může si vynutit provedení totální gastrektomie místo PG. Ve většině případů by ale pouhé dosažení odpovídajícího longitudinálního resekčního okraje nemělo být diskriminujícím faktorem PG vůči totální gastrektomii u nádorů EGJ.
V posledních letech se stále více uplatňuje koncept cirkumferentního resekčního okraje. Tento okraj je již v praxi rozšířen při hodnocení radikality resekčního výkonu na rektu, ale obecně jej lze použít u fixovaných tubulárních struktur, mezi něž patří i jícen. Z hlediska nádorů EGJ může být hodnocen u nádorů typu I a II, nikoliv u typu III. Nutno dodat, že smysl má hodnotit pouze nádory ve stadiu pT3, protože pozitivita u nižších stadií znamená neadekvátní resekci a u stadia pT4 je naopak pozitivní vždy. I v případě nádorů pT4 lze ale dosáhnout R0 resekce – u pT4a karcinomů žaludku je postižena pouze seróza, a tudíž pozitivita tohoto okraje v zásadě nevadí, v případě pT4b (u jícnového postižení i při pT4a) pak lze k dosažení radikality provést tzv. multiviscerální resekci. Podobně jako u longitudinálního resekčního okraje i zde nelze z pohledu onkologické radikality stavět totální gastrektomii u vybraných nádorů EGJ nad PG.
Rozsah lymfadenektomie
Rozsah lymfadenektomie u karcinomu jícnu, EGJ a žaludku je ještě kontroverznějším tématem než bezpečná vzdálenost resekčních okrajů. TNM klasifikace založená ve své aktuální verzi na pouhém stanovení počtu odstraněných pozitivních lymfatických uzlin v kategorii N nepřináší zcela validní informaci o radikalitě výkonu. Dosažení doporučeného minimálního počtu odstraněných lymfatických uzlin u jícnu a žaludku (alespoň 6, resp. 16) slouží k zařazení nádoru do odpovídajícího klinického stadia onemocnění, ale bez bližšího určení anatomické lokalizace pozitivních lymfatických uzlin není jeho vypovídající hodnota stran radikality zcela optimální. Jsou-li odstraněné lymfatické uzliny negativní, ale nebylo dosaženo jejich doporučeného počtu, klasifikuje se jako pN0, i když je zde riziko tzv. understagingu. Na druhou stranu je třeba samozřejmě zmínit fakt, že s rostoucím počtem odstraněných uzlin se staging zpřesňuje a že vyšší počet odstraněných uzlin je důležitým nezávislým prognostickým faktorem celkového přežití. Přesnější se zdá být klasifikace JGCA, která rozděluje lymfatické uzliny do anatomicky a číselně jasně označených skupin a podle kompletnosti jejich odstranění určuje rozsah lymfadenektomie.
Jak už bylo zmíněno, nepanuje shoda na rozsahu lymfadenektomie. Zatímco ve východoasijských zemích je D2 lymfadenektomie nepodkročitelným standardem u pokročilých stadií karcinomu žaludku již několik dekád, pak v západních zemích nebyl až do nedávné doby jasně prokázán přínos D2 lymfadenektomie oproti D1. Často citovaná multicentrická randomizovaná studie holandských autorů z 90. let srovnávala výsledky D1 vs. D2 lymfadenektomie [22]. Ve skupině D2 prokázali statisticky významně vyšší frekvenci pooperačních komplikací, vyšší mortalitu a prodlouženou dobu hospitalizace. V roce 2010 pak publikovali dlouhodobé výsledky této studie (15letý follow-up), kde již skupina pacientů po D2 lymfadenektomii vykazovala statisticky významně nižší výskyt lokoregionální recidivy a v podskupině pacientů s D2, kteří nepodstoupili splenektomii, došlo i k významnému zlepšení doby celkového přežití [23]. Na základě těchto výsledků je D2 lymfadenektomie dnes považována za standardní postup i v mnoha vyspělých evropských zemích a je součástí doporučení mezinárodních odborných společností jako European Society for Medical Oncology (ESMO), společné ESMO-ESSO (European Society of Surgical Oncology) − ESTRO (European Society of Radiotherapy and Oncology) a od roku 2013 je zařazena do doporučení NCCN (National Comprehensive Cancer Network) i v USA [24−26].
U výkonů menšího rozsahu než totální gastrektomie je rozsah lymfadenektomie logicky vždy menší, resp. modifikován. Existuje celá řada prací, které se pokoušejí určit nezbytný rozsah lymfadenektomie u nádorů EGJ v závislosti na T stadiu onemocnění, histologickém typu, gradingu nádoru a jeho lokalizaci. V případě PG pak autoři řeší pravděpodobnost nádorového postižení ponechaných lymfatických uzlin podél distální části žaludku (č. 3b, 4d, 5 a 6) a podobně jako u TG i uzlin č. 10 v hilu sleziny a s tím související míru rizika pro pacienta při event. ponechání těchto uzlin.
Většina prací se shoduje v tom, že výskyt uzlinových metastáz u časného karcinomu žaludku je nízký a dosahuje maximálně 10–20 %. Záleží na hloubce postižení stěny (T stadiu), kdy u slizničních nádorů je riziko pozitivních uzlin menší než 5 %, stejně tak při postižení povrchní vrstvy submukózy (sm1). Při hlubší infiltraci stěny nádorem již procento stoupá a tyto případy nelze řešit endoskopicky, protože by měly být doplněny lymfadenektomií. Alternativou endoskopického odstranění je v případě nádorů EGJ a proximální třetiny žaludku i PG. Již v 80. a 90. letech Okamura a Kitamura prokázali, že u časných karcinomů proximální třetiny řešených PG je míra postižení uzlin č. 4d, 5 a 6 velmi nízká či žádná [27−29]. Toto riziko stoupá v případě šíření těchto nádorů do střední třetiny žaludku [30]. Stejně tak se riziko pozitivity zvyšuje s rostoucím T stadiem. Kitamura zaznamenal postižení výše uvedených uzlin až ve stadiu T3 [28]. Kong v roce 2010 ve své práci uvádí, že EGC v proximální lokalizaci metastazuje pouze do uzlin č. 2, 3 a 7 [31]. Son v souboru 64 pacientů s EGC, kteří podstoupili PG, neprokázal žádný případ recidivy nádoru. Také nebyl zjištěn rozdíl v 5letém přežití u pacientů s PG oproti TG, i když počet odstraněných lymfatických uzlin byl nižší [32].
V roce 2000 publikoval Siewert sestavu 1002 pacientů s adenokarcinomem EGJ [33]. Mimo jiné konstatoval, že u nádorů typu II dle jeho klasifikace jsou nejvíce metastaticky postiženy lymfatické uzliny č. 2 (67,8 %), č. 1 (56,9 %), č. 3 (67,8 %), č. 7, 11 a 9 (26,9 %) a dále č. 4 (16,1 %) a uzliny v dolním zadním mediastinu č. 110 (15,6 %). Také prokázal postižení lymfatických uzlin za slinivkou a v oblasti hilu levé ledviny, tedy až ve třetím kompartmentu. Lymfografické studie tento směr lymfatického toku z oblasti EGJ potvrzují [34]. Podobné zjištění učinili i další autoři, kteří konstatovali, že anatomická lokalizace pozitivních lymfatických uzlin je u nádorů typu II a III podobná, ale odlišuje se od typu I [35,36]. V otázce kompletnější lymfadenektomie v případě TG oproti PG je zajímavá práce Kobayashiho, který uvádí, že metastazování nádorů EGJ se děje zejména do uzlin č. 3, 7 a 9, a proto není ve všech případech TG potřebná [37]. Také Sugoor zastává tento názor, neboť v jeho sestavě 75 pacientů činil medián počtu odebraných lymfatických uzlin 14 (1−27) u PG a 15 (2−31) u TG [38]. S větší hloubkou infiltrace stěny nádorem roste i riziko postižení lymfatických uzlin [39]. Tento závěr potvrdil ve své práci Ishikawa v sestavě 127 pacientů s nádorem proximální třetiny žaludku, kteří podstoupili D2 lymfadenektomii se splenektomií [9]. Primárně se zaměřil na uzlinové postižení skupin č. 10 a 4d a vlastní výsledky porovnával s literárními z dalších 14, resp. 9 studií, z nichž některé se věnovaly pouze EGC. V případě pozitivity lymfatických uzlin č. 10 neprokázal postižení u nádorů T1a (0/157 pacientů) a pouze v 0,9 % (2/209 pacientů) případů T1b. Oba tyto případy zahrnovaly nádor větší než 7 cm. U stadia T2 pak bylo uzlinové postižení prokázáno ve 4 % (6/151 pacientů) případů, což již bylo statisticky významné (p=0,047). U uzlin č. 4d naproti tomu neprokázal postižení u T1 (0/261 pacientů) a T2 (0/43 pacientů). U nádorů T3 bylo uzlinové postižení prokázáno v 7,1 % (6/84 pacientů), což je oproti T1 statisticky významné (p<0,001), vůči T2 pak na hranici statistické významnosti (p=0,067). Otázkou je, zda 4 % pozitivních uzlin č. 10 je dostatečně nízká hodnota k rozhodnutí o neprovedení splenektomie u T2, a to i s přihlédnutím k možnostem chemoterapie. A obdobně, zda 7,1% pozitivita uzlin č. 4d u T3 stadia je akceptabilní k provedení pouhé PG. Nabízí se možnost indikovat PG se splenektomií v případech T2, což by rozšířilo indikace k provedení tohoto výkonu i mimo EGC.
K určení potenciální užitečnosti lymfadenektomie jednotlivých skupin uzlin navrhl již v roce 1995 Sasako tzv. index odhadovaného prospěchu disekce lymfatických uzlin (index of estimated benefit of lymph node dissection, IEBLD), někdy označován i jako terapeutický index [40]. Jedná se o součin frekvence pozitivity dané skupiny lymfatických uzlin a 5letého přežití při postižení této skupiny v procentech. Index nabývá hodnot 0–100, přičemž vyšší hodnoty znamenají, že odstranění daných lymfatických uzlin má pro pacienta větší význam z hlediska celkového přežití. Yoshikawa publikoval výsledky multicentrické studie, která porovnávala dopad lymfadenektomie u nádorů EGJ bez rozdílu histologického typu [41]. Zařazeno bylo celkem 431 pacientů, z nichž 381 mělo adenokarcinom typu II a III dle Siewerta a 50 dlaždicobuněčný karcinom. Postižení lymfatických uzlin činilo 64,3 % (245/381) u pacientů s adenokarcinomem a 76 % (38/50) u dlaždicobuněčného karcinomu. Do studie zařadil výsledky lymfadenektomie hodnocené pomocí IEBLD pouze u těch skupin, které byly disekovány minimálně ve 20 případech. U adenokarcinomu byl index nejvyšší ve skupinách č. 3 (19.8), č. 1 (16.2), č. 2 (13.6), č. 7 (11.7) a u dolních mediastinálních uzlin č. 110 (6.0), u dlaždicobuněčného karcinomu pak u č. 1 (17.1), č. 2 (7.4), č. 3 (7.2), č. 7 (4.4) a u dolních mediastinálních uzlin č. 110 (4.2). Z toho lze vyvodit, že nezávisle na histologickém typu je u nádorů EGJ prioritou odstranit lymfatické uzliny č. 1, 2, 3, 7 a 110. Další skupiny uzlin u adenokarcinomu měly index mezi 1–5, ale u dlaždicobuněčného karcinomu 0 kromě č. 9 (2,4) a uzlin č. 10, 11d a 16, které ale nebyly hodnoceny. Profylaktická paraaortální nodální disekce (PAND) není doporučena u pokročilých karcinomů žaludku na základě výsledků fáze III studie provedené v Japonsku (JCOG 9501), nicméně toto doporučení by nemělo být aplikováno u pacientů s nádory EGJ, kteří do ní nebyli zařazeni [42]. Podle výsledků publikovaných Yoshikawou by u nich mělo být zváženo odstranění uzlin č. 16a2, protože u adenokarcinomu EGJ jsou 7. nejčastěji postiženou skupinou [41]. Ke stejnému závěru dospěli i Hasegawa a Nunobe [43,44]. Mimo rozsah abdominální lymfadenektomie je předmětem zájmu i míra postižení lymfatických uzlin v mediastinu, a to zejména u typu II a III (u typu I při subtotální ezofagektomii je mediastinální lymfadenektomie samozřejmostí). Počet postižených mediastinálních uzlin roste se zvyšující se délkou postižení distálního jícnu. Riziko se významně zvyšuje při délce postižení jícnu ≥3 cm [45]. Hosokawa dokonce udává, že riziko pozitivních dolních mediastinálních uzlin je při postižení jícnu ≥2 cm až 21x vyšší [46]. U typu II jsou mediastinální uzliny postiženy ve 30 %, abdominální vždy, ale ve druhém kompartmentu také jen ve 30 %, paraaortální pak v 10–17 % [47−49]. U typu III jsou mediastinální uzliny pozitivní v 10 %, abdominální v prvních dvou kompartmentech prakticky vždy a pozitivita paraaortálních uzlin dosahuje až 30 % [47]. Tato zjištění vedou většinu autorů k názoru, že u typu II by měl být metodou volby výkon spíše ve smyslu ezofagektomie a ne rozšířená totální gastrektomie či PG.
Lymfatické uzliny č. 3 podél malé křiviny jsou nejčastěji postiženou skupinou u nádorů EGJ a proximálního žaludku. To by ovšem znamenalo, že samotná PG by nebyla z důvodu nízké radikality proveditelná. JGCA v roce 2011 rozdělila tuto skupinu na dvě podskupiny, proximální č. 3a a distální č. 3b, neboť se ukázalo, že i v rámci této skupiny jsou některé uzliny postiženy výrazně častěji. Asi největší soubor pacientů (celkem 2400) publikoval Haruta [50]. Zaměřil se na pacienty s nádorem EGJ a proximální třetiny žaludku (385 pacientů), kteří byli řešeni TG s D2 lymfadenektomií, a analyzoval frekvenci metastáz v uzlinách č. 3a a 3b. Vypočtený IEBLD porovnal s pacienty s postižením střední třetiny (1093 pacientů) a distální třetiny (922 pacientů), a to zvlášť pro časné i pokročilé nádory (pozn. část těchto pacientů byla řešena distální resekcí žaludku s D2 lymfadenektomií). Zatímco postižení uzlin č. 3a v případě pokročilých nádorů bylo u proximální třetiny vyšší než u zbylých dvou, tak v případě uzlin č. 3b se mezi skupinami signifikantně nelišilo. IEBLD byl však u proximální třetiny pouze 1.7, ale u dalších dvou 7,1, resp. 7,0. U EGC nebylo uzlinové postižení ve skupině č. 3b ani v jednom případě a u pokročilých stadií pouze u 4 pacientů z 253 (2,2 %) v případě, že nádor byl lokalizován v EGJ a proximální třetině žaludku. Terapeutický index činil 1,1. Všechny tyto nádory (jeden T3 a tři T4) měly minimálně 40 mm v průměru a uzliny č. 3a byly vždy pozitivní (v jednom případě i uzliny č. 5). Autor ze zjištěných výsledků vyvozuje možnost indikace PG nejen u EGC, ale i u pokročilých stadií (minimálně T2) v případě, že nádor nezasahuje do střední třetiny a nepřekračuje 40 mm ve svém největším rozměru.
Dlouhodobé přežití a recidiva
Při dodržení současně doporučovaných indikačních kritérií k provedení PG se většina autorů shoduje, že 5leté přežití se statisticky neliší mezi PG a TG v případě EGC. Jeho hodnoty přesahují 90 % [32,51−56]. Huh zaznamenal recidivu nádoru u 8 pacientů ze 192 u PG, z toho v 6 případech v pahýlu žaludku (3,1 %) [51]. Jung udává, že recidiva nádoru v pahýlu po PG u EGC se vyskytuje v rozmezí 3,6–9,1 %, což je ale vyšší hodnota než u distální resekce [52]. Bylo také publikováno několik metaanalýz, které zahrnovaly i případy, kdy byla PG provedena i u pacientů s pokročilým karcinomem žaludku. Kim ve své práci z roku 2006 porovnával výsledky 43 pacientů s PG a 104 s TG [57]. Celkové 5leté přežití se nelišilo mezi PG a TG (46 % vs. 48,6 %, p=0,972). Při rozdělení na jednotlivá stadia byl ale statisticky významný rozdíl ve prospěch TG u stadia III (38,4 % vs. 17,1 %; p=0,035) a stadia IV (19,6 % vs. 0 %, p=0,026). Procento recidivy se také zvyšovalo s kratším proximálním resekčním okrajem. Wen publikoval výsledky metaanalýzy, do níž bylo zařazeno 8 studií [58]. Celkově porovnával 349 pacientů s PG (z toho 154 s pokročilým nádorem) a 728 pacientů s TG (z toho 288 s pokročilým nádorem). Celkové přežití vyznívalo lépe pro TG (72,3 % vs. 60,7 %), ale rozdíl nebyl statisticky významný (p=0,53). Tři ze studií hodnotily i recidivu nádoru, u kterého již byl signifikantní rozdíl ve prospěch TG (23 % vs. 36,8 %; p=0,004). Pu v roce 2013 došel k obdobným závěrům analýzou 11 studií s celkem 1245 pacienty [59]. Pětileté přežití se statisticky nelišilo mezi PG a TG (60,9 % vs. 64,4 %; p=0,07), procento recidiv však bylo u PG výrazně vyšší (38,67 % vs. 24,38 %; p=0,001).
Diskuze
Celosvětově dochází k nárůstu počtu adenokarcinomů v oblasti EGJ a proximální třetiny žaludku. Nepanuje shoda na optimálním typu operačního výkonu u nádorů v této lokalizaci. Podle JGCA je jedním z možných postupů i proximální resekce žaludku, ale pouze u EGC. Tento resekční výkon zachovávající funkční část žaludku by měl vést ke zlepšení kvality života pacientů po PG. Názory na jeho prospěšnost se ale různí. Řada chirurgů ho odmítá z obavy nižší radikality, která je dána menšími resekčními okraji a méně rozsáhlou lymfadenektomií, vysokým počtem refluxních komplikací s následným vznikem ezofagitidy a stenózy anastomózy a dlouhodobě špatnými funkčními výsledky. Zatímco např. v Japonsku je uznáván jako alternativa TG u EGC, tak v Jižní Koreji, zemi s nejvyšší incidencí karcinomu žaludku na světě, tvořila PG v roce 2009 pouhé 1 % všech operací pro toto onemocnění [60]. V západních zemích je PG indikována i k léčbě pokročilých karcinomů, a to zejména u polymorbidních pacientů jako méně zatěžující výkon nebo jako paliativní řešení hrozící či již nastalé obstrukce v oblasti EGJ. Vzhledem k vysokému záchytu onemocnění až v pokročilých stadiích zde podstupuje většina pacientů neoadjuvantní léčbu, nejčastěji radioterapii s konkomitantní chemoterapií. Po jejím absolvování dochází často k downstagingu a není výjimkou ani kompletní patologická odpověď.
Radikalita PG je nejčastěji srovnávána s TG. Řada prací se zabývá především porovnáním vzdálenosti resekčních okrajů, rozsahem lymfadenektomie a délkou přežití. Většinou se jedná o soubory pacientů s EGC. Stejně jako u kolorektálních karcinomů, i v případě nádorů jícnu a žaludku stále přetrvává premisa tzv. orálního šíření nádoru, proto je proximálnímu resekčnímu okraji věnována větší pozornost. V případě PG a její indikaci u nádorů EGJ a proximální třetiny žaludku je to logické. Při dodržení těchto kritérií nebývá dosažení doporučeného distálního resekčního okraje v délce alespoň 4–5 cm problémem [18,21]. Ten samozřejmě může nastat při šíření rozsáhlého nádoru do střední třetiny žaludku, pak je ale stav řešen TG. Proximální resekční okraj může být při nádorech postihujících EGJ nemalou výzvou, protože konstrukce anastomózy na jícen z transhiatálního přístupu je někdy na hranici technické dosažitelnosti nebo až za ní. Vynuceně je pak třeba přistoupit k pravostranné torakotomii a našít anastomózu z hrudníku. Dvoudutinový výkon samozřejmě prodlužuje operační čas, ale hlavně zvyšuje morbiditu. Jednotné doporučení délky bezpečného proximálního resekčního okraje chybí, většina autorů doporučuje minimálně 5 cm ve stavu in vivo [17−19]. Svou roli na doporučenou vzdálenost sehrává celková velikost nádoru, T stadium, histologický typ či stupeň diferenciace. Pouhá makroskopická negativita okraje není dostačující pro riziko submukózního šíření nádoru [13,14]. Proto by zde vždy mělo být provedeno rychlé „zmrazovací“ histopatologické vyšetření resekčního okraje k vyloučení R1 resekce, které je i součástí doporučení JGCA z roku 2014 v případě, kdy nelze dosáhnout 5cm resekčního okraje na distálním jícnu [12]. Problémem zde však může být kompletnost a spolehlivost tohoto vyšetření, kdy výsledek definitivního hodnocení se může dle našich zkušeností od peroperačního i lišit. Rozsah lymfadenektomie je dalším z diskutovaných kritérií onkologické radikality u PG. Standardně doporučenou D2 lymfadenektomii nelze u tohoto výkonu provést, proto je předmětem zájmu otázka četnosti postižení jednotlivých skupin lymfatických uzlin, zejména v oblasti distálního žaludku a hilu sleziny. Pozitivita lymfatických uzlin u EGC je maximálně 20 % a dominantně jsou postiženy uzliny v bezprostředním okolí nádoru. Riziko postižení uzlin č. 3b, 4d, 5 a 6 je při PG u EGC nulové či velmi nízké, jak prokázala řada autorů na poměrně velkých souborech pacientů [9,27−29,31,49]. V případě uzlin č. 10 spadajících do druhého kompartmentu pak Ishikawa prokázal nulové postižení u pacientů ve stadiu T1a a pouze u 0,9 % pacientů ve stadiu T1b [9]. Riziko se zvyšuje s rostoucím T stadiem a velikostí nádoru. Ve stadiu T2 prokázal 4% postižení uzlin č. 10 a 7,1% postižení uzlin č. 4d až ve stadiu T3. Haruta pak prokázal postižení uzlin č. 3b pouze u 2,2 % pacientů s pokročilým karcinomem EGJ a proximální třetiny žaludku [50]. Dosud nezodpovězenou otázkou tak zůstává, zda nízké procentuální riziko postižení uzlin v okolí distálního žaludku a hilu sleziny (nižší, než je mortalita TG) může znamenat rozšíření indikačních kritérií PG a neprovedení splenektomie i pro pokročilé karcinomy žaludku v proximální lokalizaci, a to i s přihlédnutím k současným možnostem adjuvantní léčby. Celkové přežití pacientů bez rozdělení na jednotlivá stadia vyznívá podle většiny autorů mírně ve prospěch TG, ale rozdíl není signifikantní [57–59]. U časného karcinomu převyšuje 5leté přežití u obou výkonů 90 % [32,51−56]. Významný rozdíl prokázal ve svém souboru Kim až při rozdělení na jednotlivá stadia, a to ve stadiu III a IV [57]. Publikovaná metaanalýza Wena z roku 2012 zahrnovala i výsledky 3 studií hodnotících recidivu nádoru, kde již byl signifikantní rozdíl ve prospěch TG [58]. Pu v roce 2013 došel k obdobným závěrům analýzou 11 studií s celkem 1245 pacienty, procento recidiv bylo u PG výrazně vyšší [59]. Jung udává, že recidiva v samotném pahýlu po PG u EGC se vyskytuje v rozmezí 3,6–9,1 %, což je ale vyšší hodnota než u distální resekce [52]. U pokročilých karcinomů lze předpokládat míru recidivy ještě vyšší. Tato zjištění jen podtrhují důležitost důkladné dispenzarizace pacientů po PG s nutností pravidelných endoskopických kontrol ponechaného pahýlu žaludku. V českých podmínkách publikoval výsledky léčby karcinomu žaludku pomocí proximální gastrektomie pouze kolektiv autorů z olomoucké chirurgické kliniky, kde má tato léčba dlouhou tradici. V roce 2012 zhodnotil výsledky souboru 14 pacientů s PG a v roce 2016 pak rozšířenou sestavu celkem 28 pacientů, kteří byli operováni v období 2007–2015, viz archiv časopisu Rozhledy v chirurgii [61,62].
Závěr
Proximální resekce žaludku je v současnosti uznávanou alternativou totální gastrektomie v chirurgické léčbě časných karcinomů proximální třetiny žaludku a EGJ, zejména typu III a částečně i typu II dle Siewertovy klasifikace. V celé řadě publikovaných prací byla prokázána onkologická radikalita proximální resekce žaludku i celkové přežití srovnatelné s totální gastrektomií. Zůstává otázkou, zda při rostoucích možnostech onkologické léčby dojde k rozšíření indikačních kritérií tohoto výkonu. Neoadjuvantní léčba má nesporný pozitivní vliv na zmenšení vlastního nádoru a rozsah postižení lymfatických uzlin, což ve svém důsledku vede k překlasifikování do nižšího klinického stadia (downstagingu) po jejím absolvování. Do jisté míry tedy může eliminovat nižší rozsah D1+ lymfadenektomie, což je jeden z hlavních důvodů, proč doposud není PG obecně uznána za metodu vhodnou k řešení pokročilých karcinomů, u nichž je dnes D2 lymfadenektomie jen stěží podkročitelným standardem. Proximální resekce žaludku může být také vhodnou alternativou totální gastrektomie či rozsáhlejšího dvoudutinového výkonu u významně polymorbidních nemocných, kteří by tyto rozsáhlé operace nebyli schopni podstoupit. Z těchto důvodů je ovšem nezbytné provádět peroperační „zmrazovací“ vyšetření proximální resekční linie k dosažení R0 resekce.
Práce byla podpořena Dlouhodobým záměrem rozvoje organizace FVZ UO (DZRO Klinické obory 2016−2020)
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. Petr Lochman, Ph.D., FACS
Chirurgická klinika FNHK
Sokolská 581
500 05 Hradec Králové
e-mail: petr.lochman@fnhk.cz
Sources
1. Ectors N, Driessen A, de Hertog G, et al. Is adenocarcinoma of the esophagogastric junction or cardia different from Barrett adenocarcinoma? Arch Pathol Lab Med 2005;128 : 183−5.
2. Available from: http://globocan.iarc.fr/Pages/_fact_sheets_cancer.aspx.
3. Availeble from: www.svod.cz.
4. Craanen ME, Deker W, Blok D, et al. Time trends in gastric cancer; changing patterns of type and location. Am J Gastroenterol 1992;87 : 572−9.
5. Powell J, McConkey CC. Increasing incidence of adenocarcinoma of the gastric cardia and adjacent sites. Brit J Cancer 1990;62 : 440−3.
6. Devesa SS, Blot WJ, Fraumeni JF jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer-Am Cancer Soc 1998;83 : 2049−53.
7. Bollschweiler E, Wolfgarten E, Gutschow C, et al. Demographic variations in the rising incidence of esophageal adenocarcinoma in white males. Cancer-Am Cancer Soc 2001;92 : 549−55.
8. Sharma R, Samantaray S, Shukla NK, et al. Transcriptional gene expression profile of human esophageal squamous cell carcinoma. Genomics 2003;81 : 481−8.
9. Ishikawa S, Shimada S, Miyanari N, et al. Pattern of lymph node involvement in proximal gastric cancer. World J Surg 2009;33 : 1687−92.
10. Sasako M, Sano T, Yamamoto S, et al. Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial. Lancet Oncol 2006;7 : 644−51.
11. Kurokawa Y, Sasako M, Sano T, et al. Ten-year follow-up results of a randomized clinical trial comparing left thoracoabdominal and abdominal transhiatal approaches to total gastrectomy for adenocarcinoma of the esophagogastric junction or gastric cardia. Brit J Surg 2015;102 : 341−8.
12. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver. 4). Gastric Cancer 2017;20 : 1−19.
13. Gao F, Chen J, Wang T, et al. Incidence of microscopically positive proximal margin in adenocarcinoma of the gastroesophageal junction. PloS One 2014;9:e88010.
14. Szántó I, Vörös A, Nagy P, et al. Esophageal intramural metastasis from adenocarcinoma of the gastroesophageal junction. Endoscopy 2002;34 : 418−20.
15. Lam KY, Ma LT, Wong J. Measurement of extent of spread of oesophageal squamous carcinoma by serial sectioning. J Clin Pathol 1996;49 : 124−9.
16. Khoshnevis J, Moradi A, Azargashb E, et al. A study of contractility of proximal surgical margin in esophageal cancer. Iran J Cancer Prev 2013;6 : 26−27.
17. Mariette C, Castel B, Balon JM, et al. Extent of oesophageal resection for adenocarcinoma of the oesophagogastric junction. Eur J Surg Oncol 2003;29 : 588−93.
18. Ito H, Clancy TE, Osteen RT, et al. Adenocarcinoma of the gastric cardia: what is the optimal surgical approach? J Am Coll Surgeons 2004;199 : 880−6.
19. Barbour AP, Rizk NP, Gonen M, et al. Adenocarcinoma of the gastroesophageal junction: influence of esophageal resection margin and operative approach on outcome. Ann Surg 2007;246 : 1−8.
20. Mine S, Sano T, Hiki N, et al. Proximal margin length with transhiatal gastrectomy for Siewert type II and III adenocarcinomas of the oesophagogastric junction. Brit J Surg 2013;100 : 1050−4.
21. Casson AG, Darnton SJ, Subramanian S, et al. What is the optimal distal resection margin for esophageal carcinoma? Ann Thorac Surg 2000;69 : 205−9.
22. Bonenkamp JJ, Songun I, Hermans J, et al. Randomised comparison of morbidity after D1 a D2 dissection for gastric cancer in 996 Dutch patients. Lancet 1995;345 : 745−8.
23. Songun I, Putter H, Kranenbarg EM, et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1/D2 trial. Lancet Oncol 2010;11 : 439−49.
24. Okines A, Vereheij M, Allum W, et al. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010;21 Suppl 5:v50−v54.
25. Waddell T, Verheij M, Allum W, et al. Gastric cancer: ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013;24 Suppl 6:vi57-vi63.
26. Ajani JA, Bentrem DJ, Besh S, et al. Gastric cancer, version 2.2013: featured updates to the NCCN guidelines. J Natl Compr Canc Ne 2013;11 : 531−46.
27. Okamura T, Tsujitani S, Korenaga D, et al. Lymphadenectomy for cure in patients with early gastric cancer and lymph node metastasis. Am J Surg 1988;155 : 476−80.
28. Kitamura K, Yamaguchi T, Nishida S, et al. The operative indications for proximal gastrectomy in patients with gastric cancer in the upper third of the stomach. Surg Today 1997;27 : 993−8.
29. Kitamura K, Nishida S, Yamamoto K, et al. Lymph node metastasis in gastric cancer in the upper third of the stomach: surgical treatment on the basis of the anatomical distribution of positive node. Hepatogastroenterology 1998;45 : 281−5.
30. Kaibara N, Nishimura O, Nishidoi K, et al. Proximal gastrectomy as the surgical procedure of choice for upper gastric carcinoma. J Surg Oncol 1987;36 : 110−2.
31. Kong SH, Kim JW, Lee HJ, et al. Reverse double-stapling end-to-end esophagogastrostomy in proximal gastrectomy. Digest Surg 2010;27 : 170−4.
32. Son MW, Kim YJ, Jeong GA, et al. Long-term outcomes of proximal gastrectomy for upper-third gastric cancer. J Gastric Cancer 2014;14 : 246−51.
33. Siewert JR, Feith M, Werner M, et al. Adenocarcinoma of the esophagogastric junction. Results of surgical therapy based on anatomical/topographic classification in 1,002 consecutive patients. Ann Surg 2000;232 : 353−61.
34. Aikou T, Shimazu H. Difference in main lymphatic pathways from the lower esophagus and gastric cardia. Surg Today 1989;19 : 290−5.
35. Yonemura Y, Tsugawa K, Fonseca L, et al. Lymph node metastasis and surgical management of gastric cancer invading the esophagus. Hepato-Gastroenterology 1995;42 : 37−42.
36. Tachimori Y, Kato H, Watanabe H, et al. Difference between carcinoma of the lower esophagus and the cardia. World J Surg 1996;20 : 507−10.
37. Kobayashi T, Sugimura H, Kimura T. Total gastrectomy is not always neccessary for advanced gastric cancer of the cardia. Digest Surg 2002;19 : 15−21.
38. Sugoor P, Shah S, Dusane R, et al. Proximal gastrectomy versus total gastrectomy for proximal third gastric cancer: total gastrectomy is not always neccessary. Langenbeck Arch Surg 2016;401 : 687−97.
39. Maruyama K, Gunvén P, Okabayashi K, et al. Lymph node metastases of gastric cancer. General pattern in 1931 patients. Ann Surg 1989;210 : 596−602.
40. Sasako M, McCulloch P, Kinoshita T, et al. New method to evaluate the terapeutic value of lymph node dissection for gastric cancer. Brit J Surg 1995;82 : 346−51.
41. Yoshikawa T, Takeuchi H, Hasegawa S, et al. Theoretical therapeutic impact oflymph node dissection on adenocarcinoma and squamous cell carcinoma of the esophagogastric junction. Gastric Cancer 2016;19 : 143−9.
42. Sasako M, Sano T, Yamamoto S, et al. D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. New Engl J Med 2008;359 : 453−62.
43. Hasegawa S, Yoshikawa T, Rino Y, et al. Priority of lymph node dissection for Siewert type II/III adenocarcinoma of the esophagogastric junction. Ann Surg Oncol 2013;20 : 4252−9.
44. Nunobe S, Ohyama S, Sonoo H, et al. Benefit of mediastinal and para-aortic lymph-node dissection for advanced gastric cancer with esophageal invasion. J Surg Oncol 2008;97 : 392−5.
45. Kurokawa Y, Hiki N, Yoshikawa T, et al. Mediastinal lymph node metastasis and recurrence in adenocarcinoma of the esophagogastric junction. Surgery 2015;157 : 551−5.
46. Hosokawa Y, Kinoshita T, Konishi M, et al. Clinicopathological features and prognostic factors of adenocarcinoma of the esophagogastric junction according to Siewert classification: experiences at a single institution in Japan. Ann Surg Oncol 2012;19 : 677−83.
47. Pedrazzani C, de Manzoni G, Marrelli D, et al. Lymph node involvement in advanced gastroesophageal junction adenocarcinoma. J Thorac Cardiov Sur 2007;134 : 378−85.
48. Mine S, Sano T, Hiki N, et al. Proximal margin length with transhiatal gastrectomy for Siewert type II and III adenocarcinomas of the oesophagogastric junction. Brit J Surg 2013;100 : 1050−4.
49. de Manzoni G, Morgagni P, Roviello F, et al. Nodal abdominal spread in adenocarcinoma of the cardia. Results of a multicenter prospective study. Gastric Cancer 1998;1 : 146−51.
50. Haruta S, Shinohara H, Hosogi H, et al. Proximal gastrectomy with exclusion of No. 3b lesser curvature lymph node dissection could be indicated for patients with advanced upper-third gastric cancer. Gastric Cancer 2016. Available from: doi:10.1007/s10120-016-0624-2.
51. Huh YJ, Lee HJ, Oh SY, et al. Clinical outcome of modified laparoscopy-assisted proximal gastrectomy compared to conventional proximal gastrectomy or total gastrectomy for upper-third early gastric cancer with special references to postoperative reflux esophagitis. J Gastric Cancer 2015;15 : 191−200.
52. Jung DH, Ahn SH, Park DJ, et al. Proximal gastrectomy for gastric cancer. J Gastric Cancer 2015;15 : 77−86.
53. Ichikawa D, Komatsu S, Kubota T, et al. Long-term outcomes of patients who underwent limited proximal gastrectomy. Gastric Cancer 2014;17 : 141−5.
54. Nishigori T, Okabe H, Tsunoda S, et al. Superiority of laparoscopic proximal gastrectomy with hand-sewn esophagogastrostomy over total gastrectomy in improving postoperative body weight loss and quality of life. Surg Endosc. Published online 2017. Available from: doi:10.1007/s00464-016-5403-y.
55. Ahn SH, Lee JH, Park DJ, et al. Comparative study of clinical outcomes between laparoscopy-assisted proximal gastrectomy (LAPG) and laparoscopy-assisted total gastrectomy (LATG) for proximal gastric cancer. Gastric Cancer 2013;16 : 282−9.
56. Hayami M, Hiki N, Nunobe S, et al. Clinical outcomes and evaluation of laparoscopic proximal gastrectomy with double-flap technique for early gastric cancer in the upper third of the stomach. Ann Surg Oncol 2017;24 : 1635−42.
57. Kim JH, Park SS, Kim J, Boo YJ, et al. Surgical outcomes for gastric cancer in the upper third of the stomach. World J Surg 2006;30 : 1870−6.
58. Wen L, Chen XZ, Chen XL, et al. Total vs. proximal gastrectomy for proximal gastric cancer: a systematic review and meta-analysis. Hepatogastroenterology 2012. Available from: doi:10.5754/hge11834.
59. Pu YW, Gong W, Wu YY, et al. Proximal gastrectomy versus total gastrectomy for proximal gastric carcinoma. Saudi Med J 2013;34 : 1223−8.
60. Jeong O, Park YK. Clinicopathological features and surgical treatment of gastric cancer in South Korea: the results of 2009 nationwide survey on surgically treated gastric cancer patients. J Gastric Cancer 2011;11 : 69−77.
61. Vrba R, Aujeský R, Neoral Č. Výsledky limitované resekce karcinomu gastroezofageální junkce. Rozhl Chir 2012;91 : 368−72.
62. Vrba R, Aujeský R, Neoral Č, et al. Proximální gastrektomie u selektovaných pacientů s adenokarcinomem gastroezofageální junkce, bezprostřední a dlouhodobé výsledky operační terapie. Rozhl Chir 2016;95 : 439−43.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2018 Issue 8
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Radikalita proximální resekce žaludku - přehledový článek
- Kvalita života po proximální resekci žaludku – přehledový článek
- Může vyšetření lymfatických uzlin metodou One-Step Nucleic Acid Amplification zpřesnit staging plicních nádorů?
- Empyém pleurální dutiny – evaluace výsledků jednoho pracoviště
- Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
- Tuberkulóza pečene − kazuistika
- Invertovaný Meckelův divertikl: raritní příčina ileo-ileální invaginace a krvácení do dolní části zažívacího traktu
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
- Radikalita proximální resekce žaludku - přehledový článek
- Kvalita života po proximální resekci žaludku – přehledový článek
- Tuberkulóza pečene − kazuistika
