Zásady antibiotické léčby
Principles of antibiotic therapy
The paper describes the basic sources and principles of antibiotic therapy in contemporary medicine in which the ability to treat bacterial infections may be lost. The main reason for that is the increasing resistance of bacterial pathogens to antibiotics. A possible solution is to implement a comprehensive program of antibiotic stewardship incorporating adequate consideration of indication and selection of antimicrobial agents including appropriate duration and way of administration. Another important component of the comprehensive approach to bacterial resistance and antibiotic therapy is adequately applied antibiotic prophylaxis in surgery.
Keywords:
bacteria − antibiotics − resistance − therapy
Authors:
M. Kolář
Authors‘ workplace:
Ústav mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc
Published in:
Rozhl. Chir., 2019, roč. 98, č. 4, s. 137-144.
Category:
Review
Overview
V předloženém sdělení jsou formulovány výchozí zdroje a zásady antibiotické léčby v současné medicíně, v níž hrozí ztráta schopnosti léčit bakteriální infekce. Hlavním důvodem tohoto vývoje je rostoucí odolnost bakteriálních patogenů k antibiotikům. Řešení uvedeného nebezpečí spočívá v implementaci komplexního programu „antibiotic stewardship“, který zahrnuje adekvátní zvážení indikace a výběru antibakteriálních přípravků včetně odpovídající délky jejich aplikace a vhodného způsobu podání. Velmi důležitou součástí komplexního přístupu k řešení problematiky bakteriální rezistence a antibioterapie je rovněž správně aplikovaná antibiotická profylaxe v chirurgii.
Klíčová slova:
bakterie − antibiotika − rezistence − léčba
Současná medicína je konfrontována s reálnou hrozbou ztráty účinku antibiotik na bakterie a s tím související schopností léčit bakteriální infekce. Je vhodné zdůraznit prohlášení Valného shromáždění OSN ze září 2016 − „Lze odhadnout, že pokud se bude bakteriální rezistence zvyšovat stejným tempem jako doposud, budou v roce 2050 neléčitelné infekce vyvolané multirezistentními bakteriemi nejčastější příčinou úmrtí.“ Zvyšující se odolnost bakteriálních patogenů k antibakteriálním léčivům, například stoupající výskyt bakterií s produkcí širokospektrých beta-laktamáz (včetně metalo-beta-laktamáz a karbapenemáz) přináší možnost návratu do nové „bezantibiotické éry“, v níž nebudou k dispozici adekvátní antibiotika pro léčbu bakteriálních infekcí s etiologickou rolí multirezistentních bakterií. Z uvedeného jednoznačně vyplývá nutnost praktické realizace „antibiotic stewardship“, přičemž tento termín lze volně definovat jako soubor opatření vedoucích k racionální antibiotické léčbě založené na adekvátním výběru antibakteriálních přípravků, odpovídající délce jejich aplikace a současně vhodnému způsobu podání. Uvedený přístup je velmi komplexní a obsahuje řadu jednotlivých činností, z nichž pro praktickou medicínu jsou nejdůležitější:
- adekvátní identifikace bakteriálních patogenů, resp. správná interpretace mikrobiologických výsledků,
- hodnocení výskytu frekvence bakteriálních původců u jednotlivých infekcí či infekčních komplikací,
- analýza bakteriální rezistence k antibiotikům (včetně jejího vývoje) podle všech nutných kritérií a za definovaných pravidel,
- analýza cest a šíření multirezistentních bakterií za využití moderních molekulárně-genetických metodik,
- tvorba lokálních doporučených postupů pro iniciální antibiotickou léčbu,
- realizace antibiotické léčby na základě klinického stavu pacienta, mikrobiologických výsledků a vývoje příslušných zánětlivých markerů,
- aplikace farmakokinetických/farmakodynamických parametrů a personalizovaného přístupu k pacientovi,
- adekvátní antibiotická profylaxe.
Definice bakteriální rezistence
Je vhodné definovat termín bakteriální rezistence, ke kterému je možné přistupovat ze tří úhlů pohledu, a to z mikrobiologického, klinického a farmakologického. V případě mikrobiologické definice lze rezistenci charakterizovat jako přítomnost genetické informace, která kóduje příslušný mechanismus odolnosti bakterie k danému antibiotiku. Vhodným parametrem je hodnota ECOFF (epidemiological cut of) rozlišující „wild type“ populaci (bez mechanismu rezistence) a populaci s příslušným mechanismem rezistence. Je nutné zdůraznit, že ECOFF není klinickým „breakpointem“ (BP) k určení citlivosti či rezistence testované bakterie, a bakterie s nízkým stupněm rezistence mohou být klasifikovány jako citlivé. Aplikaci tohoto přístupu lze spatřovat v platných kritériích EUCAST [1].
Klinickou definici bakteriální rezistence lze charakterizovat jako absenci nebo neadekvátní klinický účinek antibiotika ve vhodném dávkování a správné indikaci. V této souvislosti lze formulovat následující předpoklady:
- citlivost vyjadřuje vysokou pravděpodobnost účinku léčby daným antibiotikem,
- rezistence vyjadřuje vysokou pravděpodobnost selhání léčby daným antibiotikem.
Pro tuto interpretaci jsou zásadní klinické „BP“, jejichž cílem je odlišení bakteriálních patogenů, u nichž je vysoká pravděpodobnost úspěchu léčby, od izolátů s vysokou pravděpodobností selhání. Hlavním cílem je v tomto pohledu adekvátně léčit, ne identifikovat mechanismus rezistence. Na druhé straně je však vhodné uplatňovat racionální rozvahu. V případě těžké sepse s etiologickou rolí ESBL-pozitivního kmene Klebsiella pneumoniae s minimální inhibiční koncentrací (MIC) cefotaximu 1 mg/l (tedy podle kritérií EUCAST citlivý kmen) je možná vhodnější použít v terapii jiné antibiotikum, například karbapenem.
Z pohledu farmakologického lze rezistenci definovat jako absenci antibakteriálního účinku (farmakodynamického – PD) a následně klinického (farmakokinetického − PK) efektu v souvislosti s koncentrací antibiotika v místě infekce. V tomto případě se uplatňuje vztah mezi PD/PK parametry (Cmax/MIC, T>MIC, plocha pod křivkou) a efektem léčby [2]. Z výše uvedeného vyplývá PD/PK definice rezistence, kterou lze chápat jako komplexní, umožňující zvážení všech parametrů, tedy klinického stavu pacienta, lokalizace infekce, MIC příslušného antibiotika a jeho koncentrace v místě infekce atd. Určení bakteriální citlivosti či rezistence je v tomto případě personalizovanější a umožňuje cílenější zaměření antibiotické léčby včetně dávkování.
Významným problémem je stoupající rezistence bakterií k účinku antibiotické léčby. Aplikace antibakteriálních přípravků, resp. jejich selekční tlak, je důležitým faktorem tohoto nepříznivého účinku a v odborné literatuře je k dispozici řada sdělení dokladujících uvedenou skutečnost [3−6]. Je však nutné poukázat na stoupající rezistenci i v případě snižování spotřeby antibiotik [7]. Vysvětlení tohoto jevu spočívá v šíření mobilních genetických elementů (především plazmidů a transpozonů) v bakteriálních populacích. Více než 75letá éra masivního, v řadě případů nekontrolovaného a zbytečného podávání antibiotik způsobila současnou alarmující situaci, která bezprostředně ohrožuje schopnost léčit bakteriální infekce.
Klinický dopad bakteriální rezistence
Bakteriální rezistence není teoretický mikrobiologický termín, ale skutečnost se závažnými negativními klinickými dopady. K nim patří především vyšší smrtnost a kratší přežívání pacientů s infekcemi způsobenými multirezistentními bakteriemi. Jako konkrétní příklad lze použít například enterobakterie produkující širokospektré beta-laktamázy ESBL, schopné inaktivovat účinek penicilinů a cefalosporinů se širokým spektrem účinku [8]. Tumbarello a kol. popisují smrtnost pacientů s infekcí krevního řečiště způsobenou ESBL-pozitivními enterobakteriemi, která v případě neadekvátní antibiotické léčby dosáhla až 60 %. Naopak v případě adekvátní antibioterapie byla smrtnost výrazně nižší s hodnotou 19 % [9]. Smrtnost pacientů s hematologickými malignitami v případě sepsí způsobených ESBL-pozitivními enterobakteriemi může být o 25 % vyšší, v případě pozitivní produkce karbapenemáz dokonce o 69 % vyšší [10,11].
Velice důležitou a současně nepříznivou informací je skutečnost, že multirezistentní bakterie mohou být součástí normální mikroflóry. Na základě studie provedené ve Fakultní nemocnici Olomouc lze dokumentovat 25% prevalenci nosičství ESBL - a AmpC-pozitivních enterobakterií v gastrointestinálním traktu pacientů s hemato-onkologickým onemocněním [12]. V případě dvou pacientů bylo prokázáno, že multirezistentní enterobakterie vyskytující se v gastrointestinálním traktu jako součást mikroflóry způsobily závažná onemocnění. Vzhledem ke skutečnosti, že přítomnost těchto bakterií byla předem známa, iniciální antibiotická léčba byla účinná a obě infekce, resp. febrilní neutropenie byly úspěšně vyléčeny [12]. Je zřejmé, že nebezpečí multirezistentních bakterií patřících do normální mikroflóry spočívá v následujících aspektech:
- zdroj genů rezistence pro další bakterie,
- potenciální etiologická agens, jejichž vysoká odolnost vůči antibiotické léčbě může způsobit selhání iniciální antibioterapie a tím podmínit vyšší morbiditu i mortalitu.
Současnou medicínu je možné charakterizovat kontinuálním zkvalitňováním diagnostické i léčebné činnosti. Závažný terapeutický problém však nadále představují bakteriální infekce, jejichž význam se v posledních letech neustále zvyšuje. Hlavní důvody této skutečnosti lze definovat následujícími body:
- bakteriální infekce jsou velmi často endogenního charakteru (původce pochází z mikroflóry primárně nebo sekundárně osídlených systémů lidského těla) a tento předpoklad se uplatňuje u řady infekcí v chirurgii,
- stoupá počet imunokompromitovaných pacientů a osob s umělými materiály,
- stále více se používají invazivní diagnostické i léčebné postupy.
Význam bakteriální mikroflóry
Rozsáhlé, život zachraňující výkony a léčebné přístupy zvyšují pravděpodobnost vzniku komplikujících bakteriálních infekcí včetně etiologické role multirezistentních bakterií. Stoupá počet léčebných přístupů (včetně chirurgických) ovlivňujících přímo či nepřímo lidskou bakteriální mikroflóru, ať už například vystavením pacientů nemocničnímu prostředí s mnoha zdroji multirezistentních bakterií, přímými zásahy do systémů s přirozenou mikroflórou nebo souvisejícím selekčním tlakem antibakteriálních přípravků. Jako příklad lze uvést výkony v kolorektální chirurgii, které mohou být, a v řadě případů skutečně jsou, komplikovány vznikem nozokomiální infekce, často z důvodů vyplývajících z vlastního charakteru pacienta, například stavu imunitního systému. Neoral a kol. ve své studii uvádějí, že u 15 % pacientů po exstirpaci jícnu a jeho náhradě pro karcinom došlo k rozvoji komplikujících infekcí, které byly asociovány s 31% smrtností [13]. Téměř všechny patogenní bakterie byly multirezistentní gramnegativní tyčinky (Enterobacter cloacae, Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter baumannii) včetně kmenů s produkcí širokospektrých beta-laktamáz [13].
Bakteriální mikroflóra je pro lidský život nezbytná, na druhé straně však představuje zdroj potenciálních patogenů, které se uplatňují v rozvoji celé řady infekcí. Velmi významným faktorem v mikrobiologickém pohledu na antibiotickou léčbu je existence primární a sekundární mikroflóry. Lze předpokládat, že u těžce probíhajících komunitních infekcí vyžadujících hospitalizaci ve zdravotnickém zařízení a časných nozokomiálních infekcí (vznik v průběhu 3. a 4. dne hospitalizace) se uplatňují jako bakteriální původci kmeny z primární mikroflóry, a tedy citlivější k účinku antibiotik. Naopak u pozdních nozokomiálních infekcí (vznik od 5. dne hospitalizace) se na etiologii podílejí bakterie ze sekundární mikroflóry ovlivněné specifickým nemocničním prostředím, které vykazují značnou odolnost k antibakteriálním přípravkům. Z tohoto důvodu by měl být přístup k antibiotické léčbě u uvedených kategorií odlišný. Tento předpoklad však nemusí platit obecně. Neméně důležitým parametrem bakteriálních infekcí je exogenní nebo endogenní zdroj. Z praktického hlediska lze endogenní infekci charakterizovat jako infekci, u níž etiologické bakteriální agens pochází z primární či sekundární mikroflóry pacienta. Lze předpokládat, že většina infekcí v chirurgii splňuje kritéria pro endogenní infekci, přičemž vyvolávající bakteriální patogen je často multirezistentní. Pudová a kol. uvádějí na souboru pacientů s nozokomiální pneumonií, že téměř 80 % bakteriálních původců byly geneticky jedinečné kmeny pocházející ze sekundární mikroflóry hospitalizovaných pacientů [14].
Zásady antibiotické léčby
Antibiotika jsou nedílnou součástí léčby bakteriálních infekcí a lze formulovat dva základní předpoklady:
- adekvátní včasnost,
- adekvátní výběr konkrétního antibakteriálního přípravku, event. jejich kombinací.
Otázka časování antibiotické léčby je velmi důležitá a současně i komplikovaná. Obecně lze formulovat doporučení, aby v případě těžce probíhajících a život ohrožujících bakteriálních infekcí byla antibiotická léčba zahajována bezprostředně po stanovení diagnózy. U méně závažných stavů je možné vyčkat na výsledky mikrobiologických vyšetření (například kultivačních, genetických nebo sérologických), jež mohou potvrdit či vyloučit bakteriální etiologii onemocnění, event. upřesnit možné etiologické agens. Rozhodnutí, kdy vyčkat s antibiotickou léčbou na mikrobiologické výsledky, je však velmi těžké. Je zde nebezpečí pozdě zahájené antibioterapie s rizikem komplikací a záleží na posouzení konkrétní situace. Z tohoto důvodu je nutné posoudit celkový klinický stav pacienta a vzít v potaz všechny nutné informace včetně hodnot příslušných zánětlivých markerů.
V případě chirurgických infekcí je iniciální antibioterapie často zahajována bez znalosti etiologického agens a stanovení jeho citlivosti či rezistence k antibiotikům. To však v žádném případě neznamená, že volba antibiotik může být náhodná, ale naopak musí vycházet z kvalifikovaného předpokladu dostatečné aktivity na nejčastější bakteriální původce (v závislosti na pravděpodobném zdroji infekce), podložené výsledky surveillance bakteriálních patogenů a úrovní jejich rezistence k antibiotikům včetně jejího trendu. Nasazení adekvátní antibiotické léčby může významně přispět k úspěšné léčbě pacienta, a je tedy nutné zajistit co nejvyšší pravděpodobnost účinku antibioterapie, jejímž limitujícím faktorem je stoupající rezistence bakterií. V odborné literatuře jsou k dispozici studie dokladující význam adekvátní antibiotické léčby a dokumentující skutečnost, že rezistence bakteriálních původců k iniciální antibiotické léčbě vede ke zvýšené morbiditě a letalitě pacientů [15]. Rello a kol. popisují 86% smrtnost u pacientů s ventilátorovou pneumonií s etiologickou rolí methicilin-rezistentních kmenů Staphylococcus aureus v porovnání s 12% v případě izolátů Staphylococcus aureus citlivých na methicilin/oxacilin [16]. Herkel a kol. uvádějí statisticky významný rozdíl mezi adekvátní a neadekvátní antibiotickou léčbou ventilátorových pneumonií ve vztahu k mortalitě. U pacientů s adekvátní léčbou byla mortalita 27 %, zatímco v případě neadekvátní, kdy byli bakteriální původci rezistentní k iniciální antibiotické léčbě, dosáhla hodnoty 45 % [17].
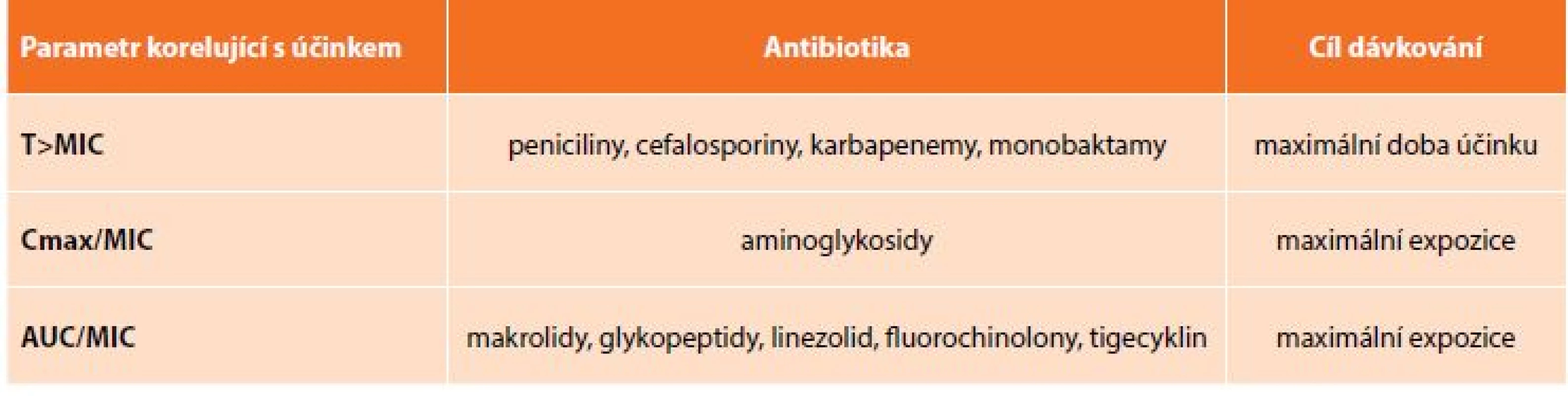
Dodržování dávkovacích intervalů antibiotik patří rovněž k velmi důležitým předpokladům úspěšné antibakteriální léčby. Je nutné si uvědomit, že nedodržování dávkovacích schémat vede k dlouhodobějšímu poklesu účinných sérových koncentrací a vytváří podmínky pro selekci rezistentních bakteriálních mutant. Neméně důležitá je otázka vlastního dávkování. Především v případě antibiotik s účinkem závislým na čase, resp. době, po kterou plazmatická koncentrace převyšuje MIC příslušného antibiotika u definovaného bakteriálního kmene (T >MIC), je vhodné použít adekvátní dávky v delších infuzích (2 hodiny a déle). Naproti tomu u antibiotik s účinkem závislým na koncentraci (např. aminoglykosidy a fluorochinolony) účinek závisí na hodnotě poměru maximální plazmatické koncentrace a MIC (Cmax/MIC) nebo poměru velikosti plochy pod křivkou v čase 0–24 hodin a MIC (AUC/MIC). Tab. 1 uvádí v přehledu účinek vybraných antibiotik z pohledu farmakokinetických a farmakodynamických vlastností. Je zřejmé, že vhodným využitím těchto vlastností může být zvýšena antibakteriální účinnost a mohou být zlepšeny klinické výsledky antibiotické léčby.
Tab. 1: Pharmacokinetic and pharmacodynamic properties of selected antibiotic groups
Terapeutické monitorování antibiotik (TDM)
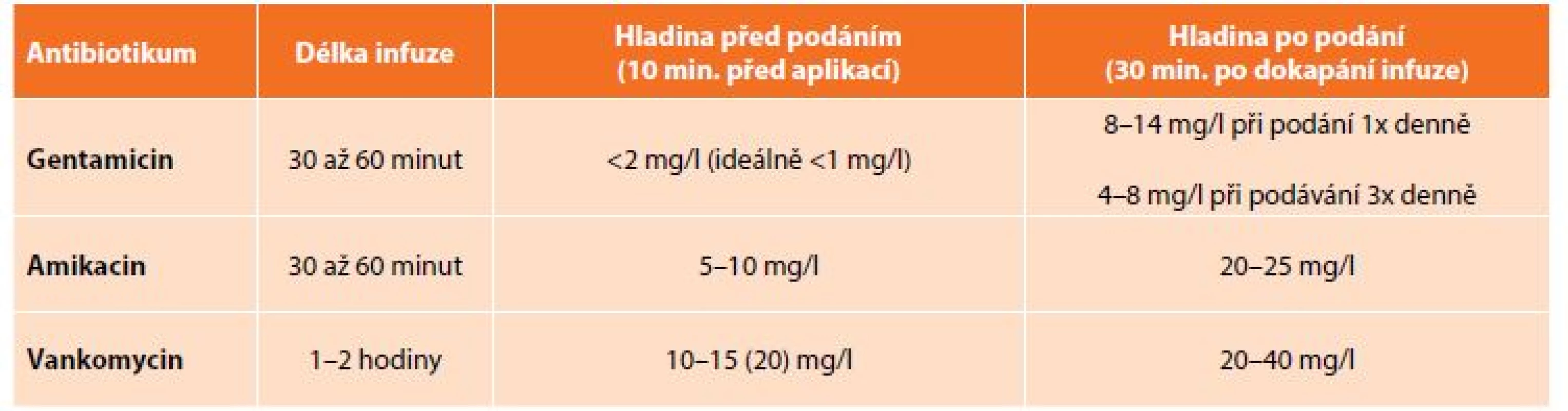
Jako přínosné se rovněž jeví TDM, a to nejen v případě „toxických“ přípravků, u nichž se v současné době spíše jedná o prevenci poddávkování (například vhodnou dávkou gentamicinu může být 320 mg/den, resp. 5-7 mg/kg). Lze předpokládat, že TDM by bylo vhodné i v případě dalších antibiotik včetně penicilinů, cefalosporinů a karbapenemů. Často aplikované přípravky – gentamicin, amikacin a vankomycin – jsou antibiotika s vysokým terapeutickým přínosem, avšak s relativně vyšším rizikem nežádoucích účinků, především nefrotoxicity a ototoxicity. Antibakteriální účinnost, stejně jako riziko nežádoucích účinků, těsně koreluje s průběhem koncentrací v plazmě pacienta během dávkovacího intervalu (Tab. 2). Z tohoto důvodu se u těchto antibiotik doporučuje stanovení plazmatických koncentrací, a je-li to potřebné, i s následnou matematickou simulací průběhu sérových koncentrací u konkrétního nemocného. Na základě takto provedeného terapeutického monitorování je možno upravit dávkování tak, aby bylo dosaženo optimálního účinku při nejmenším možném riziku. Obecně lze definovat indikaci k vyšetření hladin antibiotik jako monitorování efektivity léčby, prevenci nežádoucích toxických účinků a predikci dávky na následující období.
Modelování hladin je doporučeno provést:
- bylo-li antibiotikum dávkováno nepravidelně jak z hlediska dávky, tak času,
- je-li sérová hladina měřena během prvních 24 hodin podávání antibiotika nebo v jiných než doporučených časech odběru,
- neodpovídají-li naměřené hladiny před a/nebo po podání terapeutickému rozmezí a úpravu dávky nelze jednoduše spočítat,
- dochází-li ke změnám v ledvinových funkcích nebo hmotnosti pacienta.
Tab. 2: Recommended serum levels of some antibiotics
Stejně důležitá je i délka antibiotické léčby, která by měla být obecně 7 dní a v současné době je spíše tendence ke zkracování délky antibioterapie. Samozřejmě je v řadě případů možné antibiotickou léčbu prodloužit, vždy záleží na posouzení konkrétního pacienta, příslušné infekce, bakteriálního agens a v neposlední řadě na vlastním antibiotiku, které je využito v terapii. Zásadní otázkou při antibiotické léčbě je eradikace bakteriálních patogenů. Především v případě lehčích a středně těžkých infekcí není bezpodmínečně nutné likvidovat všechny patogenní bakteriální buňky. Za dostačující efekt lze považovat likvidaci většiny patogenní bakteriální populace a umožnění příslušným mechanismům imunitního systému, aby se významněji podílely na vyléčení bakteriální infekce. Tento předpoklad je podstatou zkracování antibiotické léčby a současně může přispět k omezení vzniku a šíření bakteriální rezistence. Důležitým souvisejícím parametrem je dále vyšší pravděpodobnost aktivace imunitního systému a její následné přetrvávání, což může přispět k prevenci reinfekcí.
Rezistence bakteriálních patogenů k antibiotikům
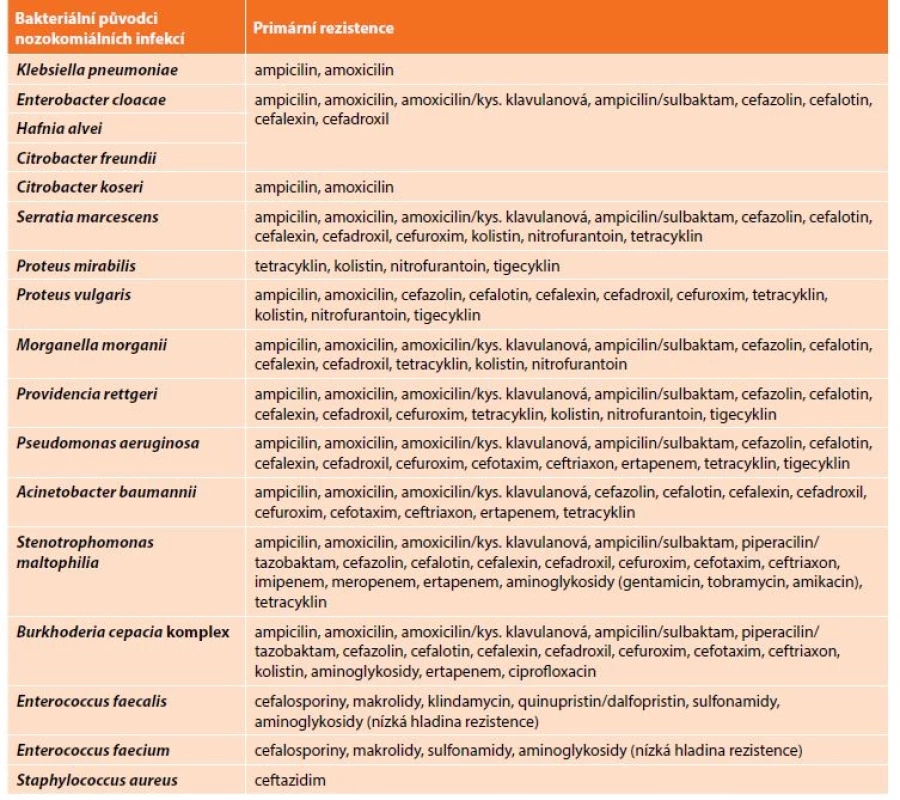
Mikrobiologické vyšetřovací metody jsou důležitou součástí komplexního diagnostického postupu při rozlišení mezi infekčními a neinfekčními procesy a jsou zásadní pro určení konkrétních etiologických agens. Významným přínosem pro včasnou identifikaci bakteriálních původců je systém MALDI-TOF využívající hmotnostní spektroskopii. Tato metodika umožňuje určit bakteriálního původce bezprostředně po primokultivaci, tedy první den po inokulaci klinického materiálu na příslušné kultivační půdy. Přes skutečnost, že není k dispozici stanovení citlivosti/rezistence bakteriálního původce k antibakteriálním přípravkům, má jeho přesná identifikace velký význam právě pro antibiotickou léčbu. Je totiž možné, a v podstatě nutné, vzít v potaz primární rezistenci a současně aktuální údaje o sekundární rezistenci příslušných bakteriálních druhů (Tab. 3). Tento postup umožňuje optimalizaci iniciální antibiotické léčby a tím snížení morbidity i mortality bakteriálních infekcí.
Tab. 3: Examples of primary resistance in the most frequent bacterial pathogens causing nosocomial infections
Nedílnou součástí mikrobiologických vyšetřovacích metod jsou postupy využívané ke stanovení citlivosti/rezistence bakteriálních patogenů k antibiotikům. Určení citlivosti bakteriálního původce na antibiotika in vitro je důležitým předpokladem kauzální antibioterapie a současně léčebného přístupu vycházejícího z PK/PD parametrů. Je zřejmé, že tento postup je velmi náročný, na druhé straně však umožňuje personalizovaný přístup, který je pro antibiotickou léčbu, především u těžce probíhajících bakteriálních infekcí pacientů na jednotkách intenzivní péče, naprosto nezbytný. PK/PD léčba může být formulována jako aplikace antibakteriálních léčiv s ohledem na hodnotu MIC, možnou přítomnost bakteriálních mechanismů rezistence, lokalizaci infekce, celkový klinický stav pacienta (včetně zánětlivých markerů) a farmakologické vlastnosti příslušného antibiotika. Kvalitativní určení (na základě diskové agarové metody) citlivosti nebo rezistence bakterie k antibiotikům má omezený význam a není zcela vhodné pro pacienty se závažnými a život ohrožujícími bakteriálními infekcemi. Z výše uvedeného rovněž vyplývá, že adekvátní antibiotická léčba musí být založena na pečlivé interpretaci získaných výsledků, komplexním posouzení klinického stavu pacienta a personalizovaném přístupu. Je nutné vzít v úvahu, že pacienti mají často rozdílnou farmakokinetiku příslušného antibiotika, například jiný distribuční objem a odlišnou rychlost eliminace než standardní populace. Běžné dávkování antibakteriálního přípravku, který byl sice určen jako účinný, může tedy být za určitých okolností neefektivní. Tab. 4 uvádí některé možnosti aplikace PK/PD indexu, který lze definovat jako dobu, resp. procento dávkovacího intervalu, po kterou je koncentrace nevázané frakce antibiotika v plazmě nad hodnotou MIC daného antibiotika. Zůstává však otázkou, jaká hodnota tohoto indexu by měla být u jednotlivých infekcí, a bude nutná další diskuze.
Tab. 4: Pharmacokinetic/pharmacodynamic indices for beta-lactam antibiotics

Principy iniciální antibioterapie
Racionální používání antibiotik u bakteriálních infekcí je důležitou součástí antibiotické politiky, resp. celkového přístupu v rámci „antibiotic stewardship“. V řadě případů však není možné aplikovat antibiotika na základě identifikace etiologické bakterie a stanovení její citlivosti k antibakteriálním přípravkům. Postupuje se tak hlavně u závažných bakteriálních infekcí, kde je riziko časové prodlevy. V těchto případech je nutné použít iniciální (necílenou) antibioterapii. To však neznamená, že lze aplikovat antibiotika bez úvahy, ale naopak to vyžaduje důsledné dodržování řady základních principů, které lze definovat následujícími body:
- znalosti o mikrobiálním osídlení místa infekce,
- znalosti o mikrobech, které se při postižení daného orgánu nejčastěji uplatňují,
- informace o epidemiologické situaci v denominátory vymezené epidemiologické jednotce,
- informace o rezistenci nejčastějších a nejdůležitějších bakteriálních patogenů včetně jejího trendu,
- znalosti o mikrobiologických a farmakologických vlastnostech antibiotik, která přicházejí v úvahu (spektrum účinku, typ účinku, biologická dostupnost, průnik do tkání atd.),
- znalosti o pacientovi:
- věk
- funkce ledvin a jater,
- alergická predispozice,
- délka hospitalizace pacienta na oddělení v případě hospitalizovaných pacientů,
- lokalizace prokázané nebo pravděpodobné bakteriální infekce,
- komunitní nebo nozokomiální charakter infekce,
- klinická forma infekce (lehký, středně těžký nebo těžký průběh),
- stav imunitního systému,
- předcházející antibiotická léčba,
- současná medikace s ohledem na interakce, například kontraindikace současného podávání simvastatinu a klaritromycinu,
- výsledky bakteriologického monitorování pacienta, resp. pečlivé posouzení všech předcházejících výsledků mikrobiologických vyšetření a analýza možné patogenní role identifikovaných bakterií.
Zásadní otázkou je indikace antibiotické léčby, která je rizikovým faktorem z pohledu selekce bakteriálních kmenů s vyšší mírou primární rezistence (například kmeny Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia, Burkholderia cepacia komplex) a rovněž bakterií se sekundární, získanou rezistencí (např. methicilin-rezistentní stafylokoky, enterobakterie s produkcí širokospektrých beta-laktamáz, karbapenem-rezistentní kmeny Pseudomonas aeruginosa). Z tohoto důvodu by měla být antibiotická léčba omezena pouze na klinicky prokázané bakteriální infekce, event. velmi pravděpodobné. Aplikaci antibakteriálních přípravků jen z důvodu tzv. „pokrytí pacienta“ je nutné odmítnout jako neopodstatněnou a rizikovou.
V rámci antibiotické léčby je úzká spolupráce klinických lékařů a mikrobiologů velmi přínosná. Mikrobiologové mohou aktivně zasahovat do realizace „antibiotic stewardship“ (včetně racionální antibioterapie) právě na základě znalosti frekvence bakteriálních patogenů a jejich rezistence v přesně vymezených epidemiologických jednotkách. Součástí je i kontrola indikací a následných aplikací antibiotik, především v případě nemocničních zařízení. Dále je nutné pečlivě zvážit interpretaci mikrobiologických kultivačních výsledků a sdělování citlivosti či rezistence bakterií k antibiotikům ošetřujícím lékařům. Správnost interpretace jak možné patogenní úlohy izolované bakterie a její citlivosti, tak i mechanismu event. rezistence, je z pohledu antibakteriální léčby vhodným způsobem spolupráce mezi mikrobiologem a klinickým lékařem, z které může pacient významně profitovat [18]. Přes skutečnost, že aplikace antibiotik je podmíněna lokálními zdroji informací, je nutné připomenout další, neméně důležitý zdroj dat, a to jsou obecně platné údaje o patogenezi bakteriálních infekcí a vlastnostech mikroorganismů, dále pak fakta o antibioticích (včetně jejich farmakokinetiky, vylučování, průniku do tkání atd.) a v neposlední řadě i výsledky surveillace bakteriální rezistence v celostátním měřítku v případě bakterií s omezeným počtem rezistentních klonů. Jako příklad lze použít infekce vyvolané bakterií Streptococcus pyogenes, u nichž je lékem první volby vždy základní penicilin a jiná antibiotika, například makrolidy, jsou indikována pouze u pacientů s alergií na peniciliny.
Zásady antibiotické profylaxe
Důležitou součástí řady chirurgických výkonů je antibiotická profylaxe, kterou lze definovat jako aplikaci vybraných antibakteriálních přípravků s cílem snížit výskyt infekcí v místě operačního nebo příslušného diagnostického výkonu. Principem je dosažení a udržení účinné koncentrace zvoleného antibiotika po celou dobu výkonu a v období bezprostředně následujícím. Účinný profylaktický režim snižuje výskyt bakteriálních komplikací. Zbytečná profylaxe, resp. aplikace antibiotik, však může vést nejen ke zvyšování nákladů, ale hlavně k selekci rezistentních bakteriálních kmenů [18].
Výběr vhodného antibiotika je podmíněn především účinností na bakterie vyskytující se v dané lokalitě, vhodnými farmakokinetickými a farmakodynamickými vlastnostmi a nízkou toxicitou. Obecné zásady antibiotické profylaxe lze shrnout do následujících bodů:
- rozhodujícím obdobím pro vznik infekce je doba trvání výkonu a následující 3−4 hodiny,
- nejvhodnějšími přípravky jsou antibiotika baktericidní a netoxická,
- jestliže je při operaci zjištěna již probíhající bakteriální infekce, nejedná se o profylaxi, ale o léčbu a je nutné aplikovat adekvátní antibioterapii.
Je však nutné i v případě profylaxe zdůraznit nutnost personalizovaného přístupu. Horáková a kol. prokazují pozitivní efekt tohoto přístupu a uvádějí významně nižší četnost infekčních komplikací u pacientů po exstirpaci jicnu, pokud byla zvolena personalizovaná profylaxe [19]. Tento přístup je založen na bakteriologickém monitorování příslušných pacientů, resp. identifikaci jejich bakteriální mikroflóry (včetně stanovení citlivosti izolovaných bakterií) v přirozeně osídlených systémech. Pro profylaxi je následně zvoleno antibiotikum odpovídající výsledkům uvedeného bakteriologického monitorování a v řadě případů jsou indikovány účinnější antibakteriální přípravky.
Aplikace zvoleného antibakteriálního přípravku by měla být co nejkratší a v řadě případů je dostatečné jednorázové podání 60−30 minut před zahájením výkonu. Počet aplikací je podmíněn délkou operace a u výkonů trvajících delší dobu je vhodné dávku opakovat. Konkrétně lze navrhnout následující režim:
- u výkonu trvajícího přes 3 hodiny je vhodné podat další dávku antibiotika 3–4 hodiny po první dávce,
- v případě potřeby aplikovat se stejným časovým odstupem ještě třetí dávku,
- prodlužování doby profylaxe není indikováno a naopak zvyšuje riziko selekce a vzniku infekce vyvolané multirezistentní bakterií.
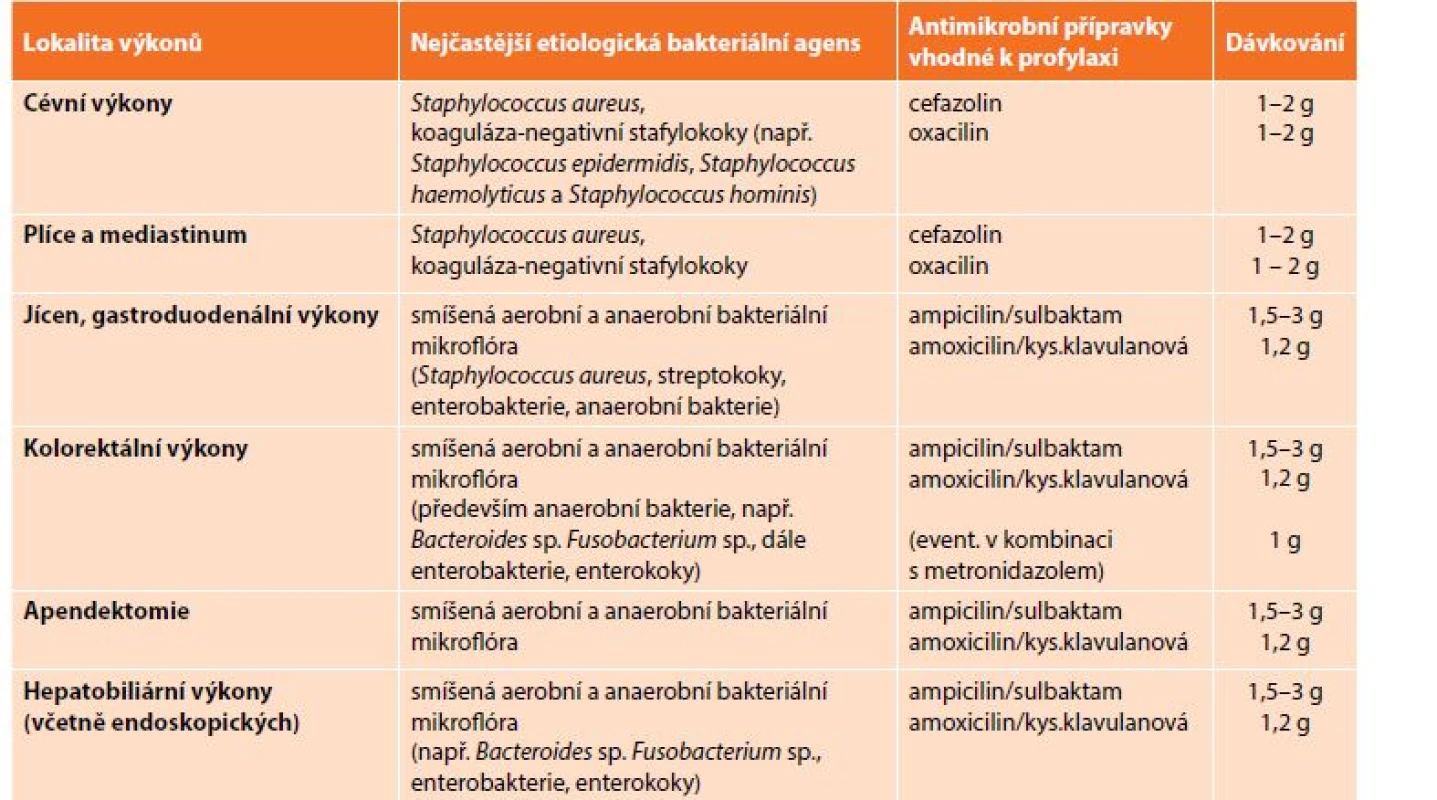
K profylaxi lze obecně doporučit antibiotika s užším spektrem účinku, především oxacilin, cefalosporiny I. generace (cefazolin), aminopeniciliny kombinované s inhibitory bakteriálních beta-laktamáz (ampicilin/sulbaktam, amoxicilin/kys. klavulanová) a nitroimidazoly (metronidazol). Antibakteriální přípravky, které lze doporučit k profylaktickým režimům, jsou přehledně uvedeny v Tab. 5.
Tab. 5: Antibiotic prophylaxis
Podpořeno grantem IGA_LF_2019_21.
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
prof. MUDr. Milan Kolář, Ph.D.
Ústav mikrobiologie
LF UP v Olomouci a FN Olomouc
Hněvotínská 3
775 15 Olomouc
e-mail: milan.kolar@fnol.cz
Sources
-
The European Committee on Antimicrobial Susceptibility Testing – EUCAST. Available from: http://www.eucast.org/
-
Scaglione F, Paraboni L. Influence of pharmacokinetics/pharmacodynamics of antibacterials in their dosing regimen selection. Expert Rev Antiinfect Ther. 2006;4 : 479−90. doi:10.1586/14787210.4.3.479
-
Ballow CH, Schentag JJ. Trends in antibiotic utilization and bacterial resistance. Report of the national nosocomial resistance surveillance group. Diag Microbiol Infect Dis. 1992;15 : 37−42.
-
Barbosa TM, Levy SB. The impact of antibiotic use on resistance development and persistence. Drug Resist Updat. 2000;3 : 303−11. doi:10.1054/drup.2000.0167.
-
Kolář M, Htoutou Sedláková M, Suchánková H, et al. Vliv selekčního tlaku karbapenemů na bakteriální rezistenci. Klin Mikrobiol Inf Lék. 2013;19 : 4−7.
-
Kolář M, Urbánek K, Látal T. Antibiotic selection pressure and development of bacterial resistance. Intern J Antimicrob Agents. 2001;17 : 357−63.
-
Htoutou Sedláková M, Vojtová V, Hanulík V, et al. Rezistence enterobakterií k vybraným antibiotikům v souvislosti s jejich spotřebou. Klin Farmakol Farmacie 2012;26 : 61−6.
-
Bush K, Jacoby GA. Updated functional classification of β-lactamases. Antimicrob Agents Chemother 2010;54 : 969−76. doi: 10.1128/AAC.01009-09.
-
Tumbarello M, Sanguinetti M, Montuori E, et al. Predictors of mortality in patients with bloodstream infections caused by extended-spectrum-ß-lactamase-producing Enterobacteriaceae: importance of inadequate initial antimicrobial treatment. Antimicrob Agents Chemother 2007;51 : 1987−94. doi:10.1128/AAC.01509-06.
-
Kang CI, Chung DR, Ko KS, et al. Risk factors for infection and treatment outcome of extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae bacteremia in patients with hematologic malignancy. Ann Hematol. 2012;91 : 115−21. doi: 10.1007/s00277-011-1247-7.
-
Satlin MJ, Calfee DP, Chen L, et al. Emergence of carbapenem-resistant Enterobacteriaceae as causes of bloodstream infections in patients with hematologic malignancies. Leuk Lymphoma 2013;54 : 799−806. doi: 10.3109/10428194.2012.723210.
-
Kolář M, Htoutou Sedláková M, Pudova P, et al. Incidence of fecal Enterobacteriaceae producing broad-spectrum beta-lactamases in patients with hematological malignancies. Biomed Papers 2015;159 : 100−3. doi: 10.5507/bp.2014.042.
-
Neoral C, Horaková M, Aujesky R, et al. Infectious complications after esophagectomy. Surg Inf 2012;13 : 159−62. doi:10.1089/sur.2011.024.
-
Pudová V, Htoutou Sedláková M, Kolář M and working group. Clonality of bacterial pathogens causing hospital
-acquired pneumonia. Current Microbiol. 2016;73 : 312−16. -
Giamarellos-Bourboulis EJ, Papadimitriou E, Galanakis N, et al. Multidrug resistance to antimicrobials as a predominant factor influencing patient survival. Int J Antimicrob Agents 2006;27 : 476−81. doi: 10.1016/j.ijantimicag.2005.12.013
-
Rello J, Torres A, Ricart M, et al. Ventilator-associated pneumonia by Staphylococcus aureus. Comparison of methicillin-resistant and methicillin-sensitive episodes. Am J Respir Crit Care Med. 1994;150 : 1545−9. doi:10.1164/ajrccm. 150.6.7952612.
-
Herkel T, Uvizl R, Adamus M, et al. Epidemiology of hospital-acquired pneumonia: results of a Central European multicenter, prospective, observational study compared with data from the European region. Biomed Papers 2016;160 : 448−55. doi: 10.5507/bp.2016.014.
-
Kolář M, Látal T, Čermák P. Klinicko-mikrobiologické podklady racionální antibiotické léčby. Trios 2002.
-
Horáková M, Ĺubušká L, Kolář M, et al. Individualized prophylaxis in patients with esophageal replacement because of cancer. Surg Inf. 2015;16 : 513−7. doi.org/10.1089/sur.2014.132
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2019 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Zásady antibiotické léčby
- Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
- Instilačná podtlaková terapia ULTRAVAC v terapii infikovaných laparotómií s fascitídou − priebežné výsledky prospektívnej randomizovanej štúdie
- Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
- Hemangiomatóza velkého omenta − kazuistika
- Intraportální aplikace kmenových buněk po embolizaci portální žíly neurychluje růst jaterních metastáz
- Chirurgická léčba alveolární echinokokózy: naše zkušenost a systematický přehled literatury
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Zásady antibiotické léčby
- Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
- Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
- Hemangiomatóza velkého omenta − kazuistika
