Minimální stimulace v programu IVF/ICSI + ET
Minimal stimulation in the IVF/ICSI+ET programme
New stimulation protocols in the in vitro fertilization/intracytoplasmic sperm injection and embryotransfer (IVF/ICSI+ET) programme bring into a part of treated infertile couples the increased risc of complications and increased expenses. Minimal stimulation is cheeper than standard stimulation. Her satisfactory results in pregancy rates per ovum pick-up and ET are an attractive alternative for younger patients with tubal factor infertility, who do not realize the conditions for treatment insurance coverage.
Key words:
minimal stimulation - in vitro fertilization - embryotransfer.
Authors:
MUDr. Jiří Dostál, Ph.D.; RNDr. Jana Březinová; Mgr. Magda Svobodová
Authors‘ workplace:
Centrum asistované reprodukce, Porodnicko-gynekologická klinika, LF UP a FN Olomouc
Published in:
Prakt Gyn 2005; 9(2): 10-12
Overview
Nové stimulační protokoly v programu in vitro fertilizace/intracytoplazmatické injekce spermie a embryotransferu (IVF/ICSI+ET) přinášejí části léčených neplodných párů zvýšené riziko komplikací a navýšení finančních nákladů na léčbu. Minimální stimulace je levnější než standardní. Její uspokojivé výsledky v poměru těhotenství na punkci a ET je atraktivní alternativou zejména pro mladší pacientky s tubárním faktorem neplodnosti, které nesplňují podmínky pro úhradu léčby ze zdravotního pojištění.
Klíčová slova:
minimální stimulace - in vitro fertilizace - embryotransfer
Úvod
Prvního úspěšného těhotenství po in vitro fertilizaci bylo dosaženo v přirozeném cyklu [1]. Od té doby došlo ke zvýšení efektivity IVF/ICSI+ET, a to díky zavedení kontrolované ovariální hyperstimulace (COH) a zdokonalením technik manipulace s gametami a embryi.
Pro COH byl zpočátku užíván klomifen citrát (CC), selektivní modulátor estrogenového receptoru, který indukuje folikulární růst cestou hypotalamického a hypofyzárního účinku [2].
Po zavedení samostatně užívaných lidských menopauzálních gonadotropinů (hMG) do stimulačních schémat [3] došlo k dramatickému nárůstu úspěšnosti léčby, ale paralelně s tím narostla cena stimulace a protokoly vyžadovaly intenzivnější monitoring. Stále nebylo možno kontrolovat předčasný vzestup luteinizačního hormonu (LH), takže velká část cyklů byla rušena.
Vývoj ve stimulaci se do doby zavedení agonistů gonadoliberinů (GnRH-a) zastavil a došlo k renesanci užívání CC, takže nejčastěji užívaným stimulačním schématem byla současně užívaná kombinace CC + hMG [4].
Vrcholem v sofistikované medikaci bylo zavedení GnRH-a v kombinaci s hMG, folikulostimulačním hormonem (FSH) nebo rekombinantním FSH (rFSH), ale už první zveřejněné zkušenosti s nimi poukázaly na to, že zlepšení výsledků je více na úkor kvantity získaných oocytů než jejich kvality [5]. Zároveň stimulační protokoly vyžadující vyšší dávky gonadotropinů přinesly zvýšené riziko komplikací, zejména ovariálního hyperstimulačního syndromu (OHSS) a vícečetných těhotenství. Logickým směrem vývoje stimulačních protokolů bylo zavedení antagonistů gonadoliberinů (GnRH–ant) [6]. Jejich výhody jsou nesporné, zejména v oblasti snížení rizika OHSS, nevýhodou zůstává cena medikace a cena léčby mnohočetných těhotenství, jejichž incidence se snižuje jen v omezené míře.
Paralelně s tímto vývojem jsou hledány jednodušší protokoly s nižší cenou medikace, jednodušším monitoringem, sníženou fyzickou, psychickou a finanční zátěží pro léčený pár, nízkým rizikem komplikací a maximálním poměrem jednočetných těhotenství. Některá pracoviště mají velké zkušenosti s IVF/ICSI+ET v přirozených cyklech a dosahují poměru těhotenství na odběr oocytů od 14 % do 26 % [7,8]. Účinnější se pak jeví minimální stimulace (MS), která dosahuje poměru těhotenství na odběr 31 % až 41 % [9,10].
Na našem pracovišti jsme zaznamenali zvýšený zájem léčených párů o levnější alternativu léčby metodou IVF/ICSI+ET. V první fázi se jednalo o páry se sníženou plodností, které podstoupily stimulaci typu CC+hMG/FSH/rFSH s cílem provést intrauterinní inseminaci a u kterých pro multifolikulární vývoj bylo zvýšené riziko vícečetného těhotenství. V druhé fázi se jednalo o páry, které nesplňovaly podmínky pro úhradu léčby ze solidárního zdravotního pojištění (socioekonomická indikace). Motivací pro užití MS byla snaha o snížení nákladnosti léčby při zajištění přijatelné šance na otěhotnění.
Abychom mohli léčeným párům poskytnout transparentní informaci o šanci na otěhotnění ve vztahu k vynaloženým finančním prostředkům, rozhodli jsme se MS vyhodnotit.
Materiál a metodika
Do sledované skupiny (E) bylo zařazeno 61 žen, které v období leden 2003 – srpen 2004 podstoupily na našem pracovišti MS v rámci léčby metodou IVF/ICSI+ET. První skupinou indikací k léčbě byl standardní tubární, ovariální a mužský faktor, dále endometrióza a jiná ženská neplodnost. Druhou skupinou pak byla socioekonomická indikace nebo osobní důvody jako např. neochota podstoupit kryokonzervaci nadpočetných embryí nebo za těchto okolností nadpočetné oocyty darovat. Všechny ženy podstoupily premenstruálně ultrazvukové vyšetření a pokud nebyly na ovariích přítomny cysty, začaly od 1. dne cyklu až do stanovení lidského choriového gonadotropinu (hCG) užívat prednison (Prednison, Léčiva) 2,5 mg ráno a 5 mg večer. Od 3. do 7. dne cyklu užily perorálně CC (Clomhexal, Hexal) v dávce 2x denně 50 mg. Od 8. dne cyklu bylo aplikováno 75–150 mezinárodních jednotek (I.U.) hMG - (Menogon, Ferring), FSH - (Fostimon, IBSA) nebo rFSH - (Gonal F, Serono; Puregon Pen, Organon) a pacientka se dostavila na první ultrazvukovou kontrolu 9. den cyklu. Podle individuální reakce pak bylo pokračováno v denní aplikaci gonadotropinů až do dne, kdy vedoucí folikl dosáhl průměrné velikosti ≥ 18 mm. V tento den byl proveden odběr 17β estradiolu (E2) a LH. Večer pak bylo aplikováno 10 000 I.U. hCG (Pregnyl, Organon) a odběr oocytů byl načasován za 34,5–35 hodin.
Kontrolní skupina (K) sestávala z 61 žen, které byly ve stejném období stimulovány u nás standardně užívaným dlouhým folikulárním stimulačním protokolem GnRH-a+hMG/FSH/rFSH (Decapeptyl depot, Ferring Diphereline depot, Ipsen Zoladex depot, Zeneca) [11]. Pacientky do kontrolní skupiny byly vybírány podle věku a diagnózy retrospektivně od konce srpna 2004.
Odběr oocytů byl proveden transvaginální punkcí foliklů. Kryokonzervaci nadpočetných embryí jsme uskutečnili v pronukleárním stadiu a embryotransfer následoval po 3denní kultivaci.
Všechny pacientky užívaly od 2. dne po punkci luteální podporu 3x denně 1 tabletu dydrogesteronu 10 mg (Duphaston, Solvay Duphar) nebo 3x denně 200 mg mikronizovaného progesteronu (Utrogestan, Besins Iscovesco) až do stanovení hCG. Klinické těhotenství bylo potvrzeno ultrazvukovým průkazem srdeční akce embrya.
Statistické vyhodnocení kvantitativních parametrů jsme provedli t-testem a verifikovali u-testem, kvalitativní parametry byly porovnány testem χ2.
Výsledky:
Charakteristika souborů pacientek je uvedena v tab. 1.
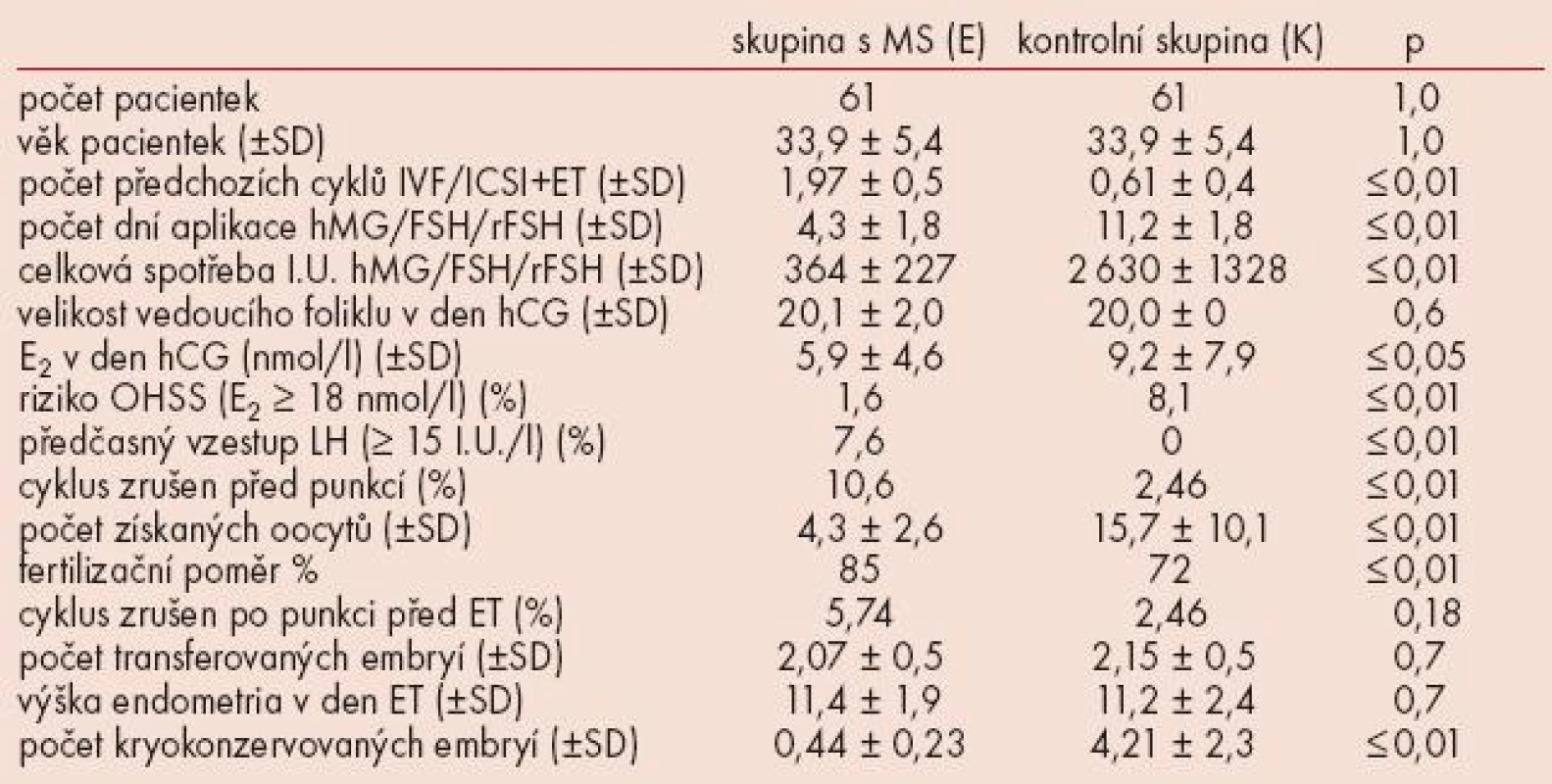
Průměrný věk pacientek byl vzhledem ke způsobu sestavení kontrolní skupiny v obou skupinách stejný, a to 33,9 roků. Pacientky ve skupině s MS prodělaly statisticky významně větší počet předchozích cyklů IVF/ICSI+ET (1,97 vs 0,61). Počet dní aplikace (4,3 vs 11,2) a celková spotřeba I.U. gonadotropinů (364 vs 2 630) byla významně vyšší v kontrolní skupině. Velikost vedoucího foliklu v den aplikace hCG byla v obou skupinách minimálně odlišná (20,1 vs 20,0). S ohledem na způsob stimulace byly ve skupině s MS nižší hladiny E2 v den aplikace hCG (5,9 vs 9,2), nižší počet získaných oocytů (4,3 vs 15,7) a nižší průměrný počet kryokonzervovaných nadpočetných embryí (0,44 vs 4,21). Riziko rozvoje závažného stupně OHSS definované jako hladina E2 v den aplikace hCG ≥ 18 nmol/l bylo vyšší v kontrolní skupině (1,6 vs 8,1). Předčasný vzestup LH (≥ 15 I.U./l) jsme zaznamenali ve skupině s MS v 7,6 % sledovaných cyklů a ve skupině s MS bylo statisticky významně více zrušených cyklů před punkcí (10,6 vs 2,46). Fertilizační poměr (%) byl vyšší ve skupině s MS (85 vs 72), nezjistili jsme statisticky významný rozdíl v procentuálně vyjádřeném počtu zrušených cyklů po punkci před ET (5,74 vs 2,46), průměrném počtu transferovaných embryí (2,07 vs 2,15), ani výšce endometria v den ET (11,4 vs 11,2).
Výsledky cyklů IVF/ICSI+ET jsou uvedeny v tabulce 2.
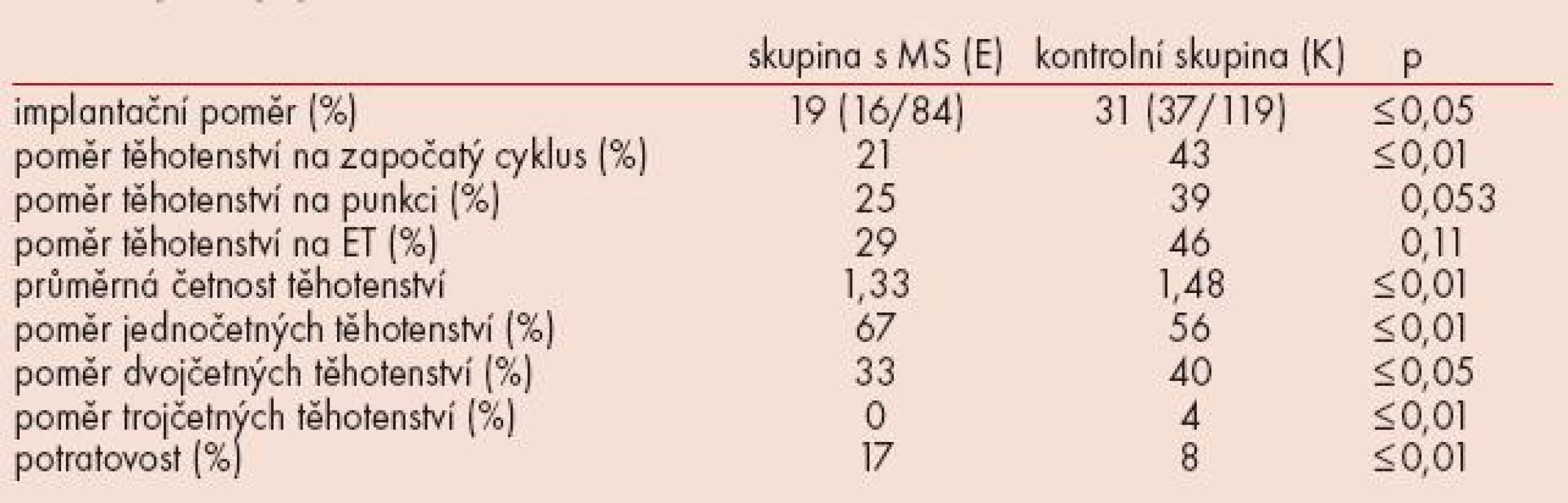
Implantační poměr ve skupině s MS byl nižší než v kontrolní skupině (19 vs 31). Jakkoliv byl poměr těhotenství na započatý cyklus (%) nižší ve skupině s MS (21 vs 43), v poměru těhotenství na punkci (25 vs 39) a na embryotransfer (29 vs 46) nebyl zjištěn statisticky významný rozdíl. Ve skupině s MS jsme zaznamenali nižší průměrnou četnost těhotenství (1,33 vs 1,48) a naopak vyšší potratovost (17 vs 8). V kontrolní skupině byl vyšší poměr dvojčetných těhotenství (33 vs 40) a jedno těhotenství bylo trojčetné. To bylo na žádost pacientky redukováno na dvojčetné.
Diskuse
V České republice jsou neplodným párům v programu mimotělního oplodnění hrazeny ze zdravotního pojištění 4krát za život ženy léky pro COH a 3krát cyklus s embryotransferem. S ohledem na pravděpodobnost otěhotnění po 3 cyklech s embryotransferem a za situace, že úhrada je poskytována do dosažení 40 let věku ženy, je část neplodných párů postavena do situace, že léčiva i výkony IVF/ICSI + ET hradí přímo jako samoplátci. Tato skutečnost není neobvyklá v zahraničí a v poslední době se objevují v literatuře zprávy o tom, že způsob úhrady ze zdravotního pojištění má vliv na postup léčby navržený neplodnému páru [12,13].
V naší studii jsme vyhodnotili MS u skupiny pacientek, která vzhledem ke kontrolní skupině měla identický věkový průměr, byla však handicapována v průměrném počtu absolvovaných neúspěšných cyklů (1,97 vs 0,61). Při MS jsme zaznamenali významnou redukci spotřeby gonadotropinů (364 I.U. vs 2.630 I.U.) pro COH, a tím úsporu nákladů na léčbu.
Po MS jsme dosáhli očekávaného nižšího zisku oocytů a nižšího počtu nadpočetných embryí vhodných pro kryokonzervaci, očekávaný byl i vyšší poměr cyklů zrušených před punkcí, a to jak pro nedostatečnou odpověď na stimulaci, tak vzhledem k zachycenému předčasnému vzestupu LH.
Vyšší fertilizační poměr ve skupině s MS lze přisoudit volnější indikaci k provedení ICSI v cyklech s celkově nižším počtem získaných oocytů, zároveň při MS nebylo po punkci před ET rušeno statisticky významně více cyklů.
Překvapivě byla výška endometria v den ET srovnatelná v obou stimulačních schématech (11,4 vs 11,2), což lze vysvětlit ve skupině s MS sekvenčním podáním CC a hMG/FSH/rFSH. Za těchto okolností může nižší implantační poměr ve skupině s MS odpovídat postzygotickým selekčním mechanizmům, kterými lze vysvětlit i vyšší potratovost v experimentální skupině. Kromě toho hodnocená výška endometria není jediným faktorem, který by vypovídal o jeho receptivitě.
Za situace, že jsme v obou skupinách přenášeli srovnatelný počet embryí, vyšší četnost těhotenství v kontrolní skupině odpovídá v ní popsanému vyššímu implantačnímu poměru.
Léčené neplodné páry, které akceptují protokol MS, mimo jiné informujeme o tom, že za nižší cenu stimulace je u nich vyšší pravděpodobnost, že nebudou mít dostatečný počet embryí k výběru pro ET a ke kryokonzervaci. Tato skutečnost je zřejmá zvláště u pacientek s ovariálním a mužským faktorem sterility a u žen vyššího věku. Pro ně je pak vhodnější užít stimulační protokol s GnRH-ant nebo GnRH-a.
Závěr
MS v programu IVF/ICSI + ET je jednoduchá a levnější varianta COH, která snižuje riziko OHSS a poskytuje srovnatelné výsledky v poměru těhotenství na punkci a na ET. Naše studie přispívá k informované volbě stimulačního protokolu léčenými páry a podle našich zkušeností je atraktivní alternativou zejména pro mladší ženy s tubárním faktorem sterility, které nesplňují podmínky pro úhradu léčby ze solidárního zdravotního pojištění.
Sources
1. Steptoe PC, Edwards RG. Birth after re-implatation of a human embryo. Lancet 1978; 2 : 366.
2. Adashi EY. Clomiphen citrate: Mechanism(s) and site(s) of action-a hypothesis revisited. Fertil Steril 1984; 42 : 331-343.
3. Jones HW jr, Acosta AA, Andrews MC et al. Three years of in vitro fertilization at Norfolk. Fertil Steril 1984; 42 : 826-834.
4. Diamond MP, Hill GA, Webster BW et al. Comparison of human menopausal gonadotropin, clomiphene citrate, and combined human menopausal gonadotropin-clomiphene citrate stimulation protocols for in vitro fertilization. Fertil Steril 1986; 46 : 1108-1112.
5. Liu HC, Lai YM, Davis O et al. Improved pregnancy outcome with gonadotropin releasing hormone agonist stimulation is due to the imrpovement in oocyte quantity raher than quality. J Assist Reprod Genet 1992; 9 : 338-344.
6. Diedrich K, Diedrich C, Santos E et al. Supression of the endogenous luteinizing hormone surge by the gonadotrophin-releasing hormone antagonist Cetrorelix during ovarian stimulation. Hum Reprod 1994; 9 : 788-791.
7. Paulson RJR, Sauer MV, Francis MM et al. In vitro fertilization in unstimulated cycles: the University of Southern California experience. Fertil Steril 1992; 57 : 290-293.
8. Foulot H, Ranoux C, Dubuisson JB et al. In vitro fertilization without ovarian stimulation: a simplified protocol applied in 80 cycles. Fertil Steril 1989; 52 : 617-621.
9. Corfman RS, Milad MP, Bellavance TL et al. A novel ovarian stimulation protocol for use with assisted reproductive technologies. Fertil Steril 1993; 60 : 864-870.
10. Williams SC, Gibbons WE, Musher SJ et al. Minimal ovarian hyperstimulation for in vitro fertilization using sequential climiphene citrate and gonadotropin with or without the addition of a gonadotropin-releasing hormone antagonist. Fertil Steril 2002; 78 : 1068-1072.
11. Oborná I, Talaš M, Dostál J et al. Hodnocení výsledků IVF+ET za roky 1992–1995 na gyn.-por. klinice v Olomouci, srovnání stimulačních protokolů. Čes Gynek 1996; 61 : 349-351.
12. Reynolds AM, Schieve LA, Jeng G et al. Does insurance coverage decrease the risk for multiple births associated with assisted reproductive technology? Fertil Steril 2003; 80 : 16-23.
13. Jain J, Harlow BL, Hornstein MD. Insurance coverage and outcomes of in vitro fertilization. N Engl J Med 2002; 347 : 661-666.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2005 Issue 2
-
All articles in this issue
- Chlamydie v ejakulátu: ovlivnění kvality semene a morfologie spermií
- Minimální stimulace v programu IVF/ICSI + ET
- Vývojové chyby u reprodukčných strát v 1. trimestri gravidity
- Vliv hormonální substituční terapie na poměr pas – boky
- Kontroverze v perimenopauze a postmenopauze
- Vysokorychlostní přenosy a archivace obrazových medicínských dat
- Mykotické vulvovaginitidy v našich ambulancích
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Chlamydie v ejakulátu: ovlivnění kvality semene a morfologie spermií
- Vývojové chyby u reprodukčných strát v 1. trimestri gravidity
- Minimální stimulace v programu IVF/ICSI + ET
- Kontroverze v perimenopauze a postmenopauze
