Vliv děložní myomatózy na reprodukční funkce
The impact of uterine fibroids on reproductive function
The paper provides a comprehensive overview of uterine fibroids in the context of female sterility and infertility. A uterine fibroid (myoma, leiomyoma) is the most frequent benign tumour of the uterine body, affecting 30–50% of women aged 30–50 years [1]. In view of the increasing incidence of uterine fibroids among women planning conception, myomas and reproduction disorders are a topical issue. Careful evaluation of a clinical picture and detailed diagnostics of the number, localization and type of myomas should be followed by a consideration on whether or not uterine fibroids in a specific patient are the causal factor of sterility or infertility, to what extend and what therapeutic options are available. Global studies available so far suggest that a myoma exceeding 5 cm and/or situated near the cervix or the utero-tubal junction appears to be a causing factor of sterility [11]. The actual impact on fertility is derived from the close association between uterine myoma and uterine cavity. The only statistically significant impact on the number of clinical pregnancies and live births was shown in association with submucous and intramural fibroids [12]. The traditionally accepted causal relationship between fibroids and abortions is being disputed by some studies, particularly in patients with a solitary myoma. Rather than the size or localization of the leiomyoma, the future of the pregnancy depends on the position of implantation in relation to the myoma [7]. A number of recent studies have confirmed significantly poorer results of assisted reproduction cycles (implantation rate, pregnancy rate, delivery rate) and significant reduction in the success of IVF cycles in women with leiomyoma compared to control groups (most frequently compared to women whose sterility is associated with fallopian tubes), including intramural fibroids not distorting the uterine cavity [4–6]. Laparoscopic or laparotomic myomectomy are the predominant treatment approaches for intramural and subserous myomas. This intervention is recommended in infertile women with diagnosed leiomyoma exceeding 4 cm. Myomectomy is appropriate in very large myomas (above 7 cm) and symptomatic myomas (menometrorrhagia) in women with multifactorial cause of infertility [7]. Hysteroscopic myomectomy is recommended in submucous myomas exceeding 3 cm and distorting the uterine cavity. Literature suggests that this method provides significant increase in live birth rate [34]. We discuss the correlation between performed myomectomy and an outcome of assisted reproduction. Many global studies confirm usefulness of myectomy performed prior to in vitro fertilization cycle [4,6,17,31,35]. Considering the complex relationship between uterine myomatosis and female reproduction, every specific patient case requires individual evaluation, careful assessment of reproductive history, exclusion of other factors of sterility and detailed diagnosis of the localization, number and size of myomas. Only then it will be possible to select an appropriate individualized therapeutic approach for a specific patient.
Key words:
uterine myomatosis – metrorrhagia – habitual abortion – GnRH analogues – myomectomy – heteroscopy – uterine artery embolization – hysterectomy
:
R. Krajčovičová; R. Hudeček
:
Gynekologicko-porodnická klinika LF MU a FN Brno
:
Prakt Gyn 2010; 14(4): 154-163
:
Review
Práce podává ucelený, komplexní pohled na problematiku děložní myomatózy ve vztahu ke sterilitě a infertilitě žen. Děložní myom (leiomyom) je nejčastější benigní nádor těla děložního, který postihuje 30–50 % žen ve věku mezi 30–50 lety [1]. Stoupající frekvence výskytu děložních leiomyomů mezi ženami plánujícími koncepci činí problematiku myomů a reprodukčních poruch vysoce aktuálním tématem. Po pečlivém zhodnocení klinického obrazu a podrobné diagnostice počtu, lokalizace a typů myomů následuje otázka, zda je děložní myomatóza u konkrétní pacientky příčinným faktorem sterility nebo infertility, v jakém rozsahu a jaké jsou naše terapeutické možnosti. Na základě výsledků dosavadních celosvětových studií se za příčinný faktor sterility považuje myom přesahující 5 cm a/nebo jeho lokalizace v blízkosti cervixu či tubárního ústí [11]. Dopad na fertilitu je dán zejména intimním vztahem děložního myomu k dutině děložní. Statisticky významný vliv na počet klinických těhotenství a porodů živých plodů byl jasně prokázán pouze v souvislosti se submukózní a intramurální myomatózou [12]. Tradičně udávaný příčinný vztah myomů k potrácení je některými novými studiemi zpochybňován, zejména pokud se jedná o myom solitární. Spíše než velikost a lokalizace leiomyomu je pro další osud těhotenství důležité místo nidace plodového vejce ve vztahu k myomu [7]. Mnohé studie publikované v několika posledních letech potvrzují i signifikantně horší výsledky v cyklech asistované reprodukce (implantation rate, pregnancy rate, delivery rate) a výraznou redukci úspěšnosti cyklů IVF u žen s leiomyomem oproti kontrolním skupinám (nejčastěji v porovnání s ženami s tubárním faktorem sterility), a to i v případě myomů intramurálních, nedeformujících děložní dutinu [4–6]. Dominantní léčebnou metodou intramurálních a subserozních myomů je laparoskopická nebo laparotomická myomectomie. Její provedení je doporučováno u neplodných žen s diagnostikovaným leiomyomem nad 4 cm. U žen s multifaktoriální příčinou neplodnosti je myomektomie vhodná u myomů velmi objemných (nad 7 cm) a myomů symptomatických (menometroragie) [7]. Řešení submukózních myomů představuje hysteroskopická myomektomie, která se doporučuje provést u myomů přesahujících 3 cm a deformujících dutinu děložní. Dle literárních údajů vede tato metoda k signifikantnímu nárůstu donošených gravidit (live birth rate) [34]. Diskutován je vztah provedené myomectomie k výsledkům asistované reprodukce. Mnohé světové studie prokazují prospěšnost myomektomie před zahájením cyklu in vitro fertilizace [4,6,17,31,35]. Vzhledem k složitosti vztahu děložní myomatózy k ženské reprodukci si každý konkrétní případ vyžaduje individuálního posouzení, pečlivé zhodnocení reprodukční anamnézy, vyloučení jiných faktorů sterility a podrobnou diagnostiku lokalizace, počtu a velikosti myomů. Až poté je možné správné zvolení terapeutického postupu „šitého na míru“ pro konkrétní pacientku.
Klíčová slova:
uterus myomatosus – metrorrhagia – habituální potrácení – GnRH analoga – myomectomie – hysteroskopická resekce – embolizace děložních tepen – hysterectomie
Úvod
Děložní myom (leiomyom) je mezenchymový benigní nádor vznikající proliferací hladké svaloviny děložního těla. Je nejčastějším nádorem děložního těla, který lze diagnostikovat u 30–50% žen ve věku mezi 30–50 lety [1]. Jde o hormonálně závislý nádor, v jehož tkáních lze prokázat estrogenní i progesteronové receptory. Bez hormonální stimulace (v menopauze, nebo po léčbě GnRH analogy) myomy regredují [1].
V současné době vlivem řady socioekonomických a kulturních faktorů (zejména prodlužující se průměrný věk plánované první gravidity) bývají děložní myomy mnohem častěji diagnostikovány u žen gravidních nebo graviditu plánujících. Také metody asistované reprodukce dnes umožňují otěhotnět ženám podstatně starším než v minulosti, což přináší další nárůst výskytu myomů u koncepci plánujících a těhotných žen. Otázkou zůstává, zda děložní myomy ovlivňují plodnost a potratovost žen, v jakém rozsahu a jaké jsou naše terapeutické možnosti.
V posledních letech se zejména v zahraniční literatuře touto problematikou zabývá řada prací. Věnují se novým poznatkům jak z oblasti základního výzkumu (molekulární genetika, etiopatogeneze), tak z oblasti klinické (nové možnosti konzervativní i operační léčby, vztah myomů k dysfertilitě). Řada otázek spojených s děložními myomy však teprve čeká na definitivní objasnění [2].
Přes velmi častý výskyt myomů je jejich etiopatogeneze nejasná. Předpokládá se působení řady faktorů genetických. Je popsán častější výskyt myomů u dcer žen operovaných pro myom nebo u sester-dvojčat, cytogenetické abnormity ve tkáni myomů, genovými mutacemi podmíněné enzymatické defekty u žen s myomy. Vliv hormonálních faktorů u části myomů lze prokázat estrogenové i progesteronové receptory. Užívání antikoncepce však riziko vzniku myomu nezvyšuje. Za další etiologické faktory lze označit vlivy civilizační, vlivy okolního prostředí, antropometrické faktory, jako je častější nadváha až obezita u žen s myomy a faktory reprodukční jako vyšší parita a nižší věk při prvním porodu u žen s myomy. Myomy nepostihují dívky před nástupem měsíčků; jejich výskyt je častější např. u kuřaček a u Afroameričanek (3× vyšší incidence než u Američanek jiných ras) [2]. Histologicky maligní variantou myomů jsou leiomyosarkomy. Dřívější představy o malignizaci již dříve existujících leiomyomů jsou však dnes překonány a převládá názor o primárně maligním růstu sarkomu [3].
Klasifikace
Bližší charakteristika myomů významně ovlivňuje jejich příznaky i léčbu. Přes 90% myomů vychází z oblasti těla děložního a jen malá část z děložního hrdla.
Myomy klasifikujeme podle následujících kritérií.
a) podle počtu:
solitární
mnohočetné
b) podle velikosti – drobné (několik milimetrů) až obrovské (několik decimetrů)
c) podle lokalizace vzhledem k jednotlivým vrstvám děložní stěny (obr. 1):
submukózní – deformují dutinu děložní
- typ 0 – pendulující
- typ I – více než 50% do dutiny děložní
- typ II – méně než 50% do dutiny děložní
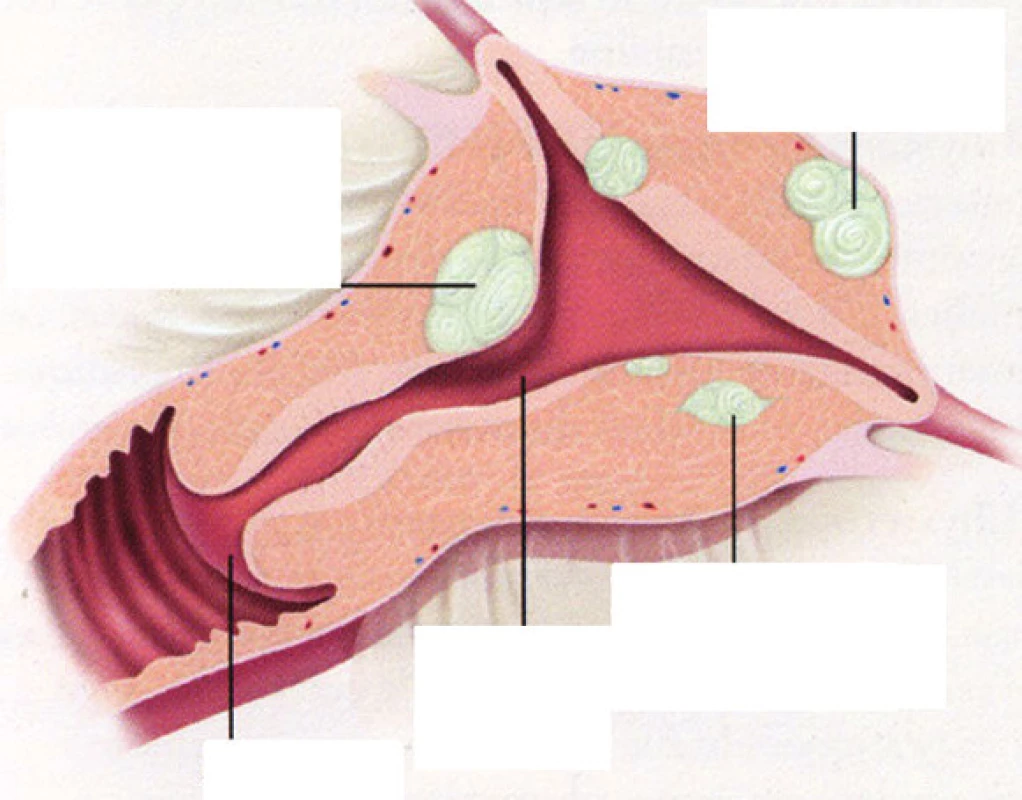
intramurální – mohou, ale nemusí deformovat dutinu děložní
subserózní – nedeformují dutinu děložní, více než 50% myomu zasahuje do dutiny břišní
- subserozní široce přisedlý
- subserozní pendulující
- subserozní intraligamentózní
Klinický obraz
Klinické projevy myomatózy ovlivňuje především velikost, lokalizace a počet myomů [1]. Většina žen s menšími myomy je zpravidla asymptomatická. S jejich růstem a blížícím se klimakteriem příznaky často přibývají; po menopauze se myomy obvykle spontánně zmenšují (podléhají involuci) a většinou již nevyžadují léčbu. Jako klinicky signifikantní (významné) lze označit takové myomy, které způsobují obtíže, jsou objemné (u solitárních cca nad 3–4cm, u mnohočetných zvětšují-lidělohu více než odpovídá II. měsíci gravidity) či nápadně rostou nebo vyskytují-li se u ženy mladé s neuzavřenou reprodukcí, zvláště pak u žen sterilních či infertilních [2].
Symptomy v příčinném vztahu k děložním myomům lze rozdělit na krvácivé, bolestivé a jiné. Nejčastějším příznakem je nepravidelné děložní krvácení. Mezi krvácivé projevy patří všechny typy poruch menstruačního cyklu ve smyslu +, zejména hypermenorea (nadměrné menstruační krvácení) a menorágie (prodloužená délka menses) [2]. Krvácivé projevy jsou ovlivněny zejména lokalizací myomu. Vyklenující se myom do dutiny děložní komprimuje endometrium, tím je porušena vaskularizace a nedochází k fyziologickému odlučování endometria. V některých případech může být i malý submukózní myom příčinou silného krvácení s následkem těžké sekundární sideropenické anemie [1]. Velké subserózní myomy mohou naopak růst dlouho asymptomaticky a projevují se až v pozdějším období zejména bolestivými obtížemi. Mezi bolestivé příznaky patří pelipathia (chronická bolest v pánvi bez závislosti na cyklu – není u myomů zcela typická, spíše ji lze očekávat u endometriózy či pánevní zánětlivé nemoci), dysmenorea a dyspareunie (bolest při pohlavním styku). Dojde-li k akutní nekróze myomu nebo k torzi myomu stopkatého, může se myom projevit i akutně vzniklou bolestí a peritoneálním drážděním pod obrazem náhlé příhody břišní [2].
Ženy s objemnými či specificky lokalizovanými myomy někdy udávají nespecifické tlakové obtíže a pocit prosáknutí až edému podbřišku, často ve spojení s obstipací a obtížným či častým močením. Tyto příznaky se někdy označují jako „bulky symptoms“ – obtíže vyplývající z objemné masy zvětšené dělohy. Vztah myomů k inkontinenci moči je diskutabilní, spíše přidružený než příčinný. Hysterektomie tak, přestože někdy bývá součástí urogynekologických operací, rozhodně nepatří mezi operace určené k léčbě stresové inkontinence [2]. Specifickým problémem je vztah myomů k ženské (ne)plodnosti (viz níže). Obecně lze říci, že děložní myomy jsou za specifických podmínek jednou z příčin sterility, zvyšují incidenci habituálního potrácení [8] a jsou dávány do souvislosti s řadou komplikací těhotenství a šestinedělí [1].
Diagnostika
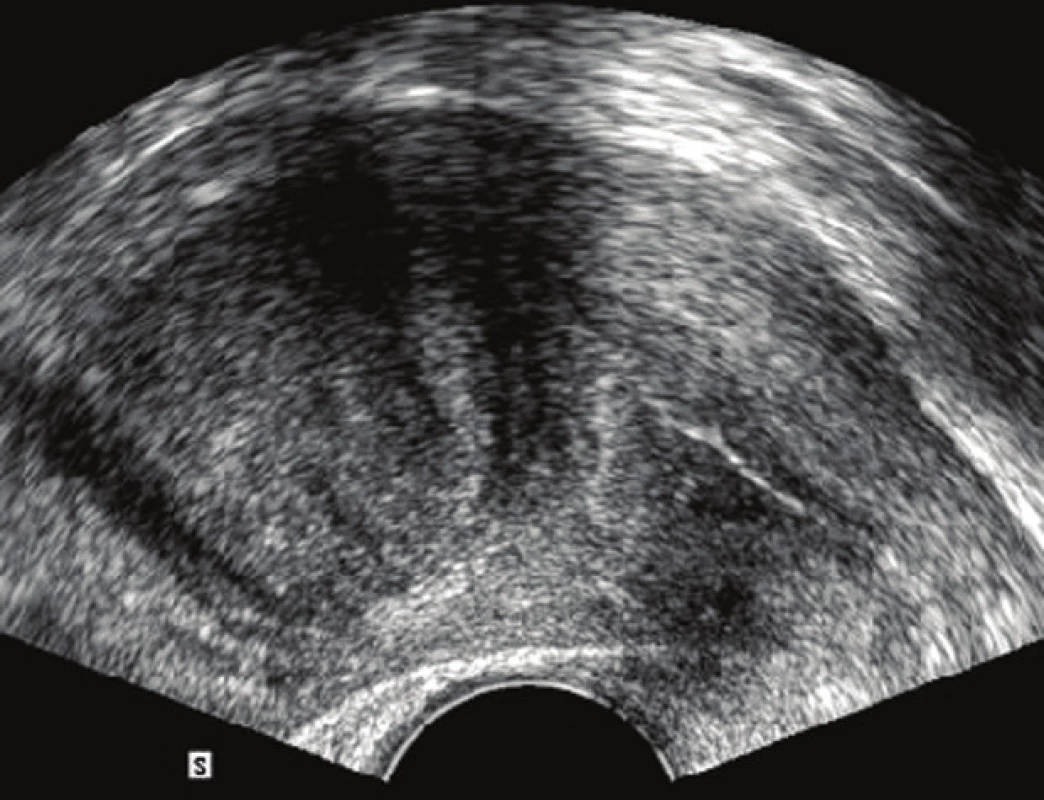
Diagnostika děložní myomatózy vychází z pečlivě odebrané anamnézy a klinického gynekologického vyšetření (zejména z bimanuální palpace). Dominantní postavení v diagnostice myomů má v současnoti jednoznačně ultrasonografie. Používá se většinou vaginální přístup, v případě velkého zvětšení dělohy je výhodné kombinovat sondu vaginální a abdominální. Lze tak poměrně přesně popsat počet myomů, jejich velikost a případné sekundární změny (kalcifikace, nekróza apod.), stanovit přesnou lokalizaci myomu i vztah k dutině děložní (obr. 2) [2]. K ještě přesnějšímu určení vztahu k děložní dutině slouží, zejména u infertilních pacientek, klasická RTG hysterosalpingografie (HSG) (obr. 3) nebo nově ultrazvuková hysterosalpingografie. Pomocí barevné dopplerovské ultrasonografie lze zobrazit vaskularizaci myomu. Potvrzení diagnózy přinese v některých případech až operace (hysteroskopie či laparoskopie, případně laparotomie), definitivní biologickou povahu nádoru určí vyšetření histopatologem [2].
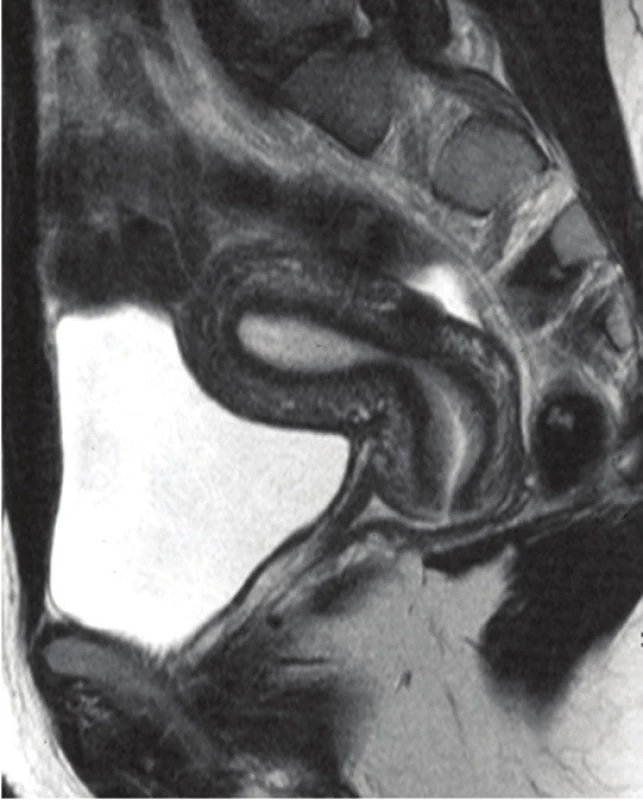
V nejasných situacích (zejména při nejasném UZ nálezu) lze využít i podrobnějších zobrazovacích metod, jako je magnetická rezonance nebo CT(obr. 4). Lze tak (ne ve všech přípa - dech) diferencovat myom od adenomyózy, sarkomu, solidního ovariálníhotumoru či jiné pánevní patologie [2].
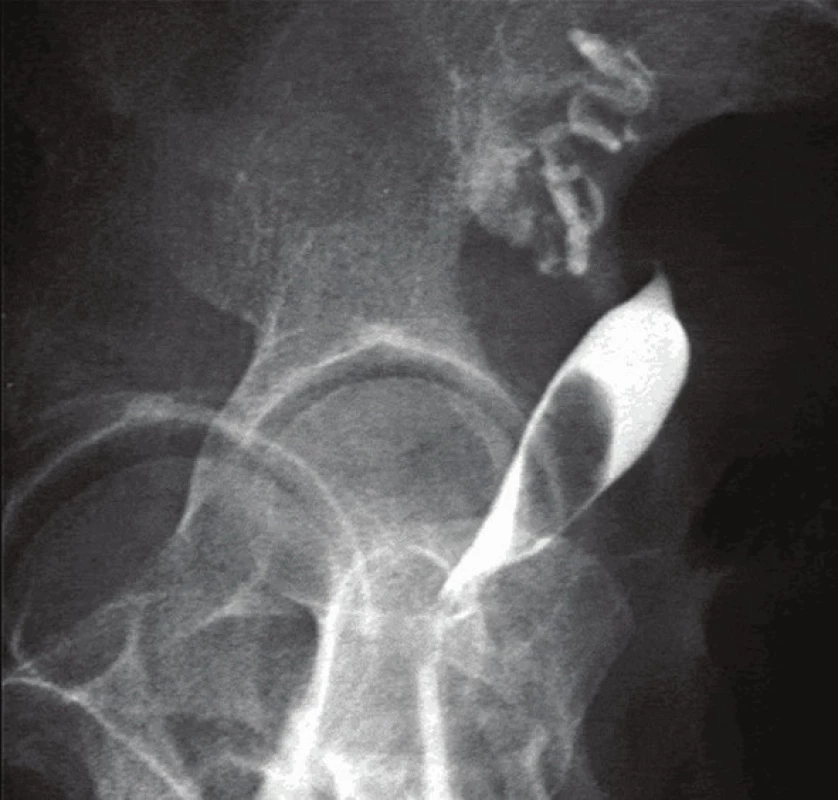
Myomy a poruchy plodnosti
Specifickým problémem je vztah myomů k ženské (ne)plodnosti. Je známo, že se myomy vyskytují u 1–4% všech donošených gravidit a že řada žen s myomy není sterilních. Na druhé straně se podle výsledků četných studií myomy nepochybně spolupodílí na sterilitě, opakovaném potrácení i mnoha těhotenských a porodnických komplikacích. Většina studií z poslední doby [4–6] týkající se vlivu myomů na výsledky metod asistované reprodukce prokázala signifikantně horší reprodukční výsledky u žen s intramurálně uloženými myomy. Z toho lze usuzovat, že i myomy, které dutinu děložní nedeformují, negativně ovlivňují ženskou plodnost [7].
Myomy a sterilita
Přítomnost drobného děložního myomu rozhodně nelze označit za jeden ze zásadních faktorů sterility. Z praxe jsou známé případy žen, které při myomatózní děloze bez problémů otěhotněly a úspěšně těhotenství završily. Přesto je nález myomu, jako jediné verifikované patologie, udáván u téměř 10% neplodných žen [9,10]. Mezi způsoby a mechanizmy, kterými mohou myomy ovlivňovat fertilitu, patří [11]:
- porušení celistvosti povrchu endometria ohrožuje implantaci
- nepravidelný růst endometria a poruchy jeho zrání může narušovat implantaci
- gravidita implantovaná přímo nad myomem může mít zhoršené cévní zásobení v rámci placentace
- změny v místních parakrinních faktorech mohou nepříznivě ovlivňovat podmínky pro spermie a embrya
- anatomické deformace vyvolané myomem mohou stěžovat vstup sper - mií do oblasti děložního hrdla a nepříznivě ovlivňovat transport spermií
- rozšíření děložní dutiny zvětšuje vzdálenost pro pohyb spermií
- poruchy děložní kontraktility mají nepříznivý vliv na transport spermií a embrya
- děložní myomy mohou být příčinou uzávěru vejcovodů
Skutečný vliv myomů na reprodukci a prospěch myomectomie u sterilních pacientek zůstává i v současnosti částečně nevyjasněný. Pokles fertility byl přesvědčivě prokázán v přímé souvislosti s deformací dutiny děložní u žen se submukózními nebo intramurálními myomy [11]. Existuje však domněnka, že i intramurální myomy nezasahující do dutiny děložní mají ne zcela specifikovaný negativní dopad na fertilitu. Výsledky studií u žen s myomy bez prokazatelné deformace dutiny děložní nejsou jednoznačné. V jedné prospektivní studii z oblasti asistované reprodukce (celkový počet 91 IVF cyklů) byly u žen s děložní myomatózou, bez deformace dutiny děložní, těhotenské výsledky signifikantně horší (clinical pregnancy rate 37,4%) než ve skupině bez myomů (52,7%) [5]. Eldar-Geva et al [4] komparovali pregnancy rate skupiny žen s intramurálním myomem oproti skupině se subserózní lokalizací myomu a skupině žen zdravých a dosáhli následujících výsledků pregnancy rate 16,4%, 34,1% a 30,1%. Uvedené poznatky o poklesu četnosti implantací, klinických těhotenství i porodů živých novorozenců potvrzuje i studie Venkate et al [12] provedená u žen s myomy léčených in vitro fertilizací. Statisticky významný vliv na počet klinických těhotenství a porodů živých plodů byl jasně prokázán pouze v souvislosti se submukózní a intramurální myomatózou. Počet implantací však byl významně ovlivněn u všech tří typů děložních myomů. Zdá se, že čím je intimnější vztah děložního myomu k dutině, tím je pravděpodobnější jeho dopad na fertilitu. V pořadí nepříznivých účinků jsou tak na prvním místě myomy submukózní, poté myomy intramurální a subserózní [11].
Myomy a potrácení
Děložní myomatóza patří ke klasicky uváděným příčinám spontánních i opakovaných potratů (sekundární anatomický faktor), a to zejména v II. trimestru gravidity, kdy se podílí až jedna třetina všech abortů [13]. Těhotenské ztráty u žen s myomy jsou spojovány s nálezem nízkého, omezeně vaskularizovaného endometria s nedostatečným krevním zásobením, zvýšenou děložní kontraktilitou nebo zánětlivými procesy děložní sliznice v důsledku degenerace myomu. Všechny uvedené okolnosti mohou potenciálně zhoršit vývoj placenty nebo placentaci a následně ohrožovat embryo nebo plod [11]. Na druhou stranu je známo, že se myomy vyskytují v 1–4 % všech donošených gravidit a existují práce, které uvádějí, že až v 80% případů během těhotenství nemění svou velikost nebo se dokonce zmenšují [14]. To znamená, že otázka, kterou si gynekolog v této souvislosti musí položit, je, zda je děložní myomatóza skutečnou příčinou těhotenských ztrát, nebo zda se jedná o pouhou koincidenci. Údaje recentní světové literatury, sledující tento vztah, jsou však natolik protichůdné, že neposkytují klinikům jasný návod, jak v těchto případech postupovat [11].
Studie autorů z Harvard Medical School v Bostonu zahrnovala 143 žen s myomem diagnostikovaným v I. trimestru v porovnání s 715 těhotných s normální dělohou. Studie prokázala kromě očekávané vyšší frekvence operačních porodů (38% u žen s myomy, 28% u kontrol) téměř dvojnásobnou frekvenci těhotenských ztrát u žen s myomy (14%) oproti kontrolní skupině (7,6%). Při podrobnějším rozboru vyplynulo, že frekvence abortů byla výrazně vyšší pouze v podskupině žen s více než jedním myomem (23,6%), zatímco u žen s myomem solitárním (8%) se potratovost téměř nelišila od skupiny kontrolní. Zajímavým zjištěním byl i fakt, že frekvence potratů nebyla nijak ovlivněna velikostí či lokalizací myomů [15]. Podobně francouzská práce Bernarda et al z roku 2000 poukazuje, i když pouze na malém souboru, na souvislost abortů s mnohočetností leiomyomů [16]. Studie sledovala fertilitu a průběh těhotenství po hysteroskopické resekci submukózních myomů u 31 sterilních žen. V průběhu čtyř let trvání studie otěhotnělo 11 žen (35,5%), z toho dvě ženy dvakrát (celkem 13 těhotenství). Ve skupině žen, u nichž bylo resekováno dva a více myomů a/nebo u nichž byly ponechány další myomy intramurální, byla signifikantně vyšší frekvence spontánních abortů než u žen po hysteroskopické resekci myomu solitárního. Také tato studie nezjistila signifikantní vliv velikosti či uložení resekovaného myomu na následnou fertilitu [16].
Obecně lze říci, že riziko reprodukčních ztrát u žen s myomem menším než 3cm bývá považováno za zanedbatelné [11]. Bajekal et al však právě u žen s takto „malými“ intramurálními či submukózními myomy pozorovali 40% frekvenci potratů v I. trimestru a 17% potratů v II. trimestru [14]. Titíž autoři udávají 40% výskyt abortů u myomů submukózních, resp. 33% u myomů intramurálních a subserózních (bez ohledu na velikost myomu) při 16% frekvenci abortů u kontrol. Z většiny dostupných literárních údajů však není možné blíže analyzovat vliv velikosti a počtu myomů na reprodukční výsledky [11].
Protichůdnost výše uvedených dat lze částečně vysvětlit tím, že pro osud těhotenství je významnější místo implantace plodového vejce ve vztahu k myomu než absolutní velikost či lokalizace myomu. Toto místo je ovlivněno řadou různých faktorů a je těžko předvídatelné; z toho vyplývá často velmi odlišný výsledek různých gravidit u téže pacientky [11].
Myomy a asistovaná reprodukce
Vzhledem k tomu, že děložní myomatóza je za určitých specifických okolností považována za příčinný faktor sterility a infertility, ocitají se takto postižené ženy často v péči center asistované reprodukce. Zde přichází na řadu otázka, zda děložní myomy ovlivňují výsledky asistované reprodukce. V současnosti poskytuje světová literatura mnoho retrospektivních a prospektivních studií věnujících se vlivu leiomyomů na ženskou plodnost, zejména na schopnost implantace v endometriu.
Mnohé studie publikované v několika posledních letech potvrzují signifikantně horší výsledky ART (implantation rate, pregnancy rate, delivery rate) a výraznou redukci úspěšnosti cyklů IVF u žen s leiomyomem oproti kontrolním skupinám (nejčastěji v porovnání s ženami s tubárním faktorem sterility), a to i v případě myomů intramurálních, nedeformujících děložní dutinu [4–6]. Podle Harta et al dokonce i přítomnost drobného intramurálního myomu (průměrná velikost největšího myomu u 112 žen v podskupině s myomem 2,3cm; u 106 z nich myom </= 5cm) redukuje šanci na klinickou graviditu po ART na polovinu [5]. V literatuře však najdeme i studie, které horší reprodukční výsledky potvrzují pouze u myomů s intrakavitální komponentou [17]. Tento názor podporují i Dietterich et al, kteří zjistili obdobnou frekvenci implantací a klinických těhotenství po embryotransferu u žen starších 35 let s malou myomatózou nenarušující děložní dutinu i u stejně starých žen bez myomů [18].
Terapie
Léčbě děložních myomů je v současné době věnována stále větší pozornost. Je tomu tak hned z několika důvodů. Jednak jsou děložní myomy jedním z nejčastějších gynekologických onemocnění a nejčastějším ženským tumorem vůbec. Odhadem každá druhá až třetí pacientka se do své menopauzy setká s problémy, které souvisejí s myomy. Klinické příznaky způsobené děložní myomatózou výrazně zhoršují kvalitu života takto postižených žen. A v neposlední řadě stoupá zájem veřejnosti i odborníků o děložní myomatozu zejména proto, že přibývá žen, které zatím v důsledku mnohých socioekonomických a kulturních faktorů (zejména prodlužující se průměrný věk plánovaného prvního těhotenství) nesplnily svoje reprodukční plány. Také metody asistované reprodukce dnes umožňují otěhotnět ženám podstatně starším než v minulosti, což přináší další nárůst výskytu myomů u koncepci plánujících a těhotných žen. Zde se otevírá otázka, jaké jsou naše terapeutické možnosti.
Všeobecně lze říct, že terapeu-tický přístup při řešení myomatózy by měl být přísně individuální, tzv. „ušitý na míru“ každé pacientky. Optimální léčba by měla respektovat individuální obtíže a věk pacientky a zejména musí zohlednit její plány stran těhotenství. Terapii děložních myomů můžeme rozdělit na:
konzervativní (dělohu zachovávající)
• expektační (vyčkávací)
• farmakologickou
- symptomatickou (zaměřená na klinické příznaky)
- kauzální (zaměřená na samotný myom)
• invazivní
- cílenou na myom
myomectomie
myolýza
- cílenou na cévní zásobení
radiologická – embolizace děložních tepen
chirurgická – laparoskopická okluze děložních tepen
radikální (odstranění dělohy)
Konzervativní terapie
Expektační postup
Expektační postup je založen na pouhém sledování myomu. Má své nevyhnutné místo zejména u žen asymptomatických. Sledování se opírá o pravidelné klinické a ultrasonografické kontroly prováděné nejlépe jedním lékařem. Vyčkávací postup se řídí jinými pravidly u žen plánujících graviditu, kde je hlavním rizikem promarnění vhodné chvíle pro co nejméně invazivní léčbu, a u pacientek starších, kde převažují obavy z přehlédnutí malignity [11]. Nelze určit jednoznačnou hranici velikosti myomu či dělohy, při níž ještě lze pacientku pouze sledovat – mimo jiné je třeba zohlednit rychlost růstu myomu, a to nejlépe na základě objektivních dat ze zobrazovacích vyšetření. U žen dosud nerodivších je observace vhodná u méně objemných (do 3–4cm) nestopkatých myomů (stopkaté hrozí akutními komplikacemi, navíc je většinou snadné je odstranit), které nedeformují děložní dutinu a nekomprimují odstupy vejcovodů. Expektace bývá, až na výjimky, metodou volby také v případě těhotenství v myomatózní děloze [2].
Farmakologická terapie
Farmakologická symptomatická terapie
Symptomatická medikamentózní léčba je určena k tlumení obtíží spojených s myomy. Patří sem analgetika a spasmolytika podávaná při pánevní bolesti nebo bolestivé menstruaci, hemostyptika, uterotonika či některé hormonální preparáty (gestageny, kontraceptiva) při krvácivých projevech, antianemika (zejména preparáty železa) při chudokrevnosti. Velice častým, akutním řešení silného děložního krvácení na podkladě myomatózy je kyretáž. Symptomatická léčba myomů obecně je používána u pacientek, jejichž myomy nejsou objemné, obtíže jsou mírné nebo nahodilé, u nichž se blíží menopauza (naděje na involuci myomu v postmenopauze), či u těch, které odmítají doporučované operační řešení [2].
Kauzální farmakologická terapie
Kauzální farmakologická terapie je zaměřena přímo na myom a má za cíl zejména jeho zmenšení a zmenšení jeho překrvení. Do této skupiny léků patří takřka výlučně hormonální preparáty. Nejrozšířenějšími hormonálními preparáty pro léčbu myomů jsou bezpochyby agonisté gonadoliberinu (GnRH analoga). GnRH analogy svým působením na receptory GnRH v hypofýze (down regulation) způsobí pokles produkce FSH, LH, ovariálních steroidů a hypoestrogenní stav, jehož důsledkem je nejen rychlé zmenšení objemu myomu i celé dělohy (průměr 35–65% v průběhu prvních tří měsíců léčby), ale i typické klimakterické výpadové jevy, a při delším užívání i pokles kostní denzity [19]. S tím souvisí úskalí této léčby, jež je limitována časem. Po vysazení GnRH analog se totiž myomy během několika měsíců vrátí ke své původní (či dokonce větší) velikosti [19]. Mnohem logičtější než samotná terapie je využití aplikaci GnRH analog v kombinaci s léčbou chirurgickou, tj. s myomectomií nebo hysterectomií. Výhody této předléčby potvrdila řada studií [20,21]. Výhody aplikace GnRH analog před plánovanou chirurgickou terapií shrnuje tab. 1 [11]. Vzhledem k výše uvedeným nežádoucím účinkům je i při léčbě myomů možné kombinovat GnRH analoga s dlouhodobým podáváním estrogen-progesteronových preparátů (HRT, add back therapy), a to zejména u žen velmi rizikových k operaci. V léčbě, resp. prevenci vzniku myomatózy možno použít i dlouhodobé podávání hormonální kontracepce (COC) [22]. Pětileté užívání COC snižuje riziko vzniku myomatózy o 17%. Protektivní účinek je připisován gestagenní složce COC a je prokazatelný i u nízkodávkované COC [23].
![Potenciální výhody předoperačního podání GnRH analog (upraveno dle Stewarta a Friedmana, resp. Barbieriho a Friedmana) [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/909f849f30470020f18491817998572f.png)
Invazivní konzervativní terapie
Pod pojmem konzervativní invazivní terapie rozumíme léčbu směřující k odstranění či zmenšení myomu a ušetření dělohy pro případné těhotenství. V poslední době z různých zejména socioekonomických a kulturních důvodů však roste zájem o tuto léčbu i mezi ženami v postfertilním období. Jak bylo uvedeno výše, s výhodou před plánovanou operací se jako „předléčba“ používají GnRH analogy. Poté následuje samotný zákrok, který je cílený na samotný myom (většinou se jedná o chirurgickou exstirpaci – myomectomii) anebo je zacílený na cévní zásobení dělohy (tzv. okluzivní metody).
Invazivní konzervativní terapie cílená na myom
Konzervativní invazivní léčba cílená na myom je metodou volby u pacientek s neukončenými reprodukčními plány. Hlavní otázka stojící na začátku terapeutické rozvahy je, kdy můžeme zvolit pouze expektační postup a kdy již intervenovat. V současnosti již rutinně používaná citlivá vaginální ultrasonografie umožňuje diagnostikovat i drobné myomy (o velikosti 2–3cm). Tyto nálezy bývají obvykle klinicky nevýznamné u dosud zcela asymptomatických žen. Zde je jakákoli intervence sporná či přímo zbytečná [2]. U myomů do 4cm, nedeformujících děložní dutinu a nezpůsobujících výrazné klinické obtíže neindikujeme žádný operační výkon, a to zejména plánuje-li pacientka brzy otěhotnět [2]. U pacientek velmi mladých, resp. u žen plánujících těhotenství až v mnohaletém odstupu, při výše uvedeném nálezu doporučíme většinou 6–12 měsíců vyčkat a teprve při progresi nálezu intervenovat. Výjimkou z výše uvedeného doporučení jsou ženy se zatíženou reprodukční anamnézou, tj. například po opakovaných spontánních či zamlklých abortech nebo po opakovaných selháních mimotělního oplodnění (IVF), zejména nedají-li se vysvětlit jinak [2].
Když se již rozhodneme intervenovat, je další důležitou otázkou volba operační techniky. Typy operačních výkonů cílených na odstranění myomu:
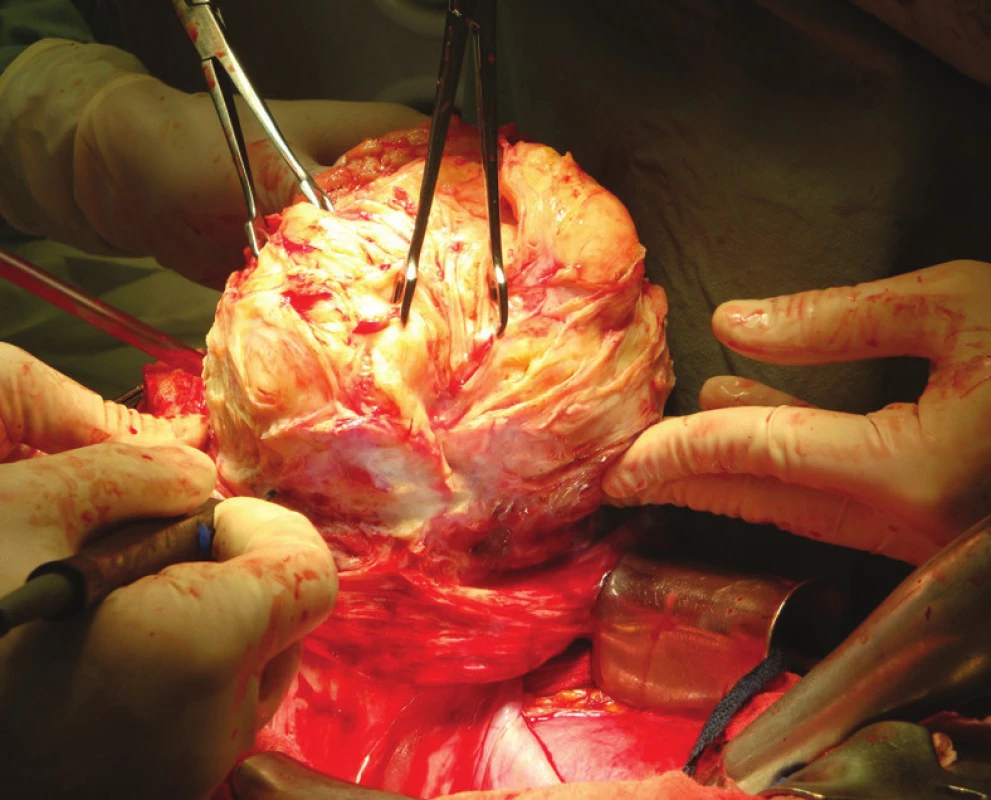
- laparoskopická myomektomie (obr. 5a)
- laparotomická myomektomie (obr. 6)
- hysteroskopická myomektomie
- laparoskopická myolýza

Výběr léčby závisí nejvíce na vlastním anatomickém nálezu, tj. na množství, velikosti a lokalizaci myomů. Tyto otázky zodpoví z větší části palpační vaginální vyšetření a zejména ultrazvukové vyšetření, kde kombinujeme abdominální a vaginální přístup spolu s využitím dopplerovského vyšetření vaskularizace dělohy a myomů. V některých vybraných případech (např. diferenciální diagnostika adenomyózy nebo děložního sarkomu) lze využít magnetickou rezonanci (MRI) s aplikací kontrastu.
V současnosti je v medicíně trend provádět výkony s minimální invazitou. Kritérium minimální invazivity jednoznačně splňuje laparoskopie. Výhodou laparoskopického přístupu je menší morbidita pacientek, kratší doba hospitalizace a kratší doba rekonvalescence. V kontrastu s laparotomií je výhodou i výrazně menší tendence k tvorbě adhezí, čímž se snižuje riziko chronických bolestí po operaci [2]. Laparoskopická myomektomie (LM) je ale metodou technicky náročnou, jejíž správné provedení vyžaduje pokročilé dovednosti především v oblasti endoskopického šití. Sutura stěny děložní po enukleaci myomu (obr. 5b), jako nejpodstatnější fáze operace, musí zajišťovat nejen dostatečnou hemostázu, ale také pevnost a funkční zdatnost dělohy v budoucnu plánovaném těhotenství, kdy ruptura dělohy v místě myomektomie patří k obávaným komplikacím [2]. Tendence k preferování laparoskopického přístupu při řešení děložní myomatózy potvrzuje i soubor 133 pacientek operovaných na Gynekologicko-porodnické klinice FN Brno v letech 2005–2009. V posledních letech je evidentní výrazní nárůst laparoskopické myomectomie v kontrastu s laparotomií preferovanou zejména v dřívějších letech.

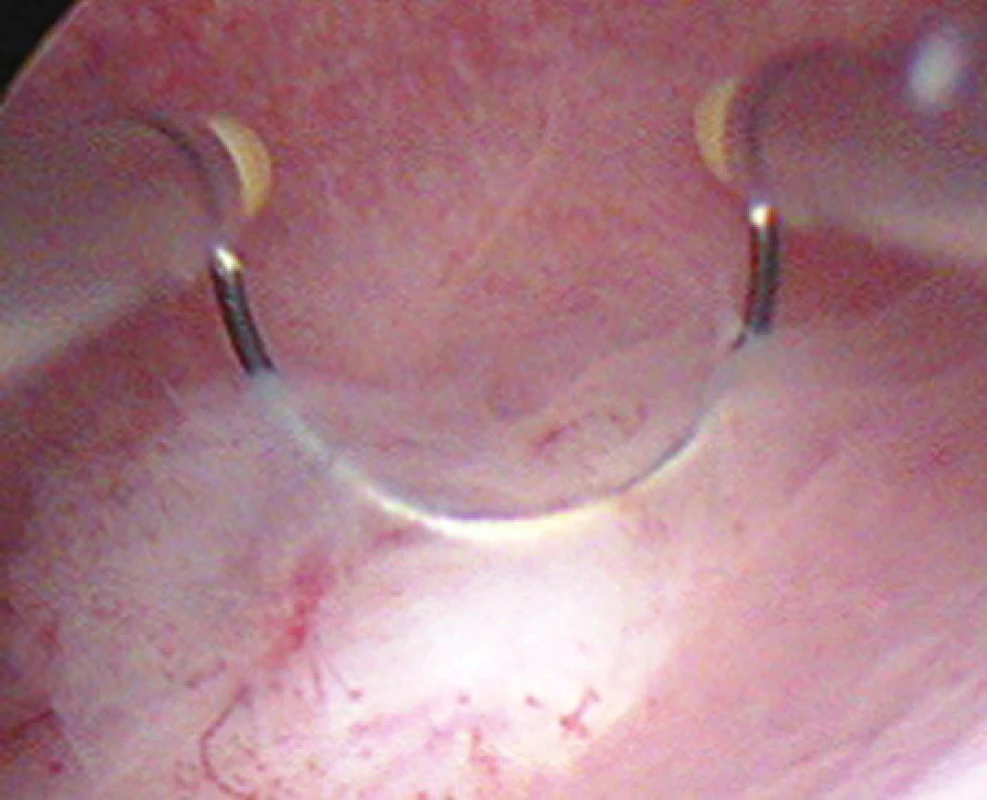
Laparoskopickou myomectomii volíme zejména u intramurálních a subserózních myomů nepřesahujících 7cm v průměru. Důležitou podmínkou je vhodná lokalizace k laparoskopické exstirpaci. U vícečetných myomů se odstraňuje dominantní myom a drobné, jsou-li lokalizovány mimo děložní dutinu, je možné ponechat. Laparoskopická myomectomie je dále jasnou metodou volby u myomů pendulujících neboli stopkatých, které komunikují se zevním povrchem dělohy jen více či méně širokou stopkou a vůbec nezasahují do svaloviny stěny děložní, a sutura dělohy tudíž většinou není potřebná. Je-li myom naopak lokalizován převážnou částí svého objemu v děložní dutině (submukózní myomy klasifikované Evropskou společností pro hysteroskopii – ESH jako typ 0 nebo typ I), je na místě jeho hysterosko-pická neboli transcervikální resekce (obr. 7) [2].
Případy obrovských myomů (nad 8–10cm) nebo myomů mnohočetných, kde se celková velikost dělohy podobá její velikosti v 5. měsíci gravidity i více, tedy kdy vyplňuje nejen většinu malé pánve, ale z ní výrazně vystupuje a blíží se pupku, obvykle přesahují limity laparoskopie a jsou řešeny primárně laparotomicky [2]. Za jistých okolností je možné kombinovat laparoskopii a minilaparotomii provedením laparoskopicky asistované myomektomie, nebo když je myom lokalizován v kaudální části zadní stěny děložní je možné využit přístup laparosko-pický a vaginální. Na snížení incidence pooperačních adhezí se doporučuje aplikovat na suturu po myomektomii některý z nabízených antiadhezivních preparátů většinou na bázi 100% kyseliny hyaluronové ve formě gelu [24].
Pacientkám po provedené laparoskopické nebo laparotomické myomectomii se doporučuje cca po třech měsících podstoupit sekond look laparoskopii. Výhodou tohoto postupu je možnost kontroly celistvosti sutury po myomectomii a možnost provedení adheziolýzy. Těhotenství dnes bývá většinou doporučováno s odstupem alespoň šesti měsíců po enukleaci intramurálních myomů. Porody lze primárně vést vaginálně; elektivnímu císařskému řezu dáváme přednost po enukleaci objemných myomů dosahujících do dutiny děložní nebo intimně k ní [25].
Invazivní konzervativní terapie cílená na cévní zásobení dělohy
Společným principem těchto tzv. okluzivních metod je snaha ovlivnit velikost a symptomy myomů (a tím eventuálně i jejich působení na reprodukční funkce dělohy) omezením či úplnou eliminací jejich krevního zásobení [11].
První takovou metodou, používanou od poloviny 90. let minulého století je embolizace děložních tepen (UAE). Jde o výkon katetrizační, intraarteriální, prováděný intervenčním radiologem pod skiaskopickou kontrolou. Cílem je postupným vplavením speciálních mikročástic do uterinního oběhu selektivně vyřadit myom z perfuze. Dnes jsou nejčastěji používané sférické partikule tris-akryl-želatinové o velikosti 500–900 µm [11]. Problémem je dosud predikce objemového efektu UAE a jejího vlivu na reprodukční funkce. Zatímco u starších premenopauzálních žen je považován za hlavní cíl léčby ústup jejich zejména krvácivých obtíží, u žen plánujících těhotenství je hlavním cílem léčby zmenšení myomů („shrinkage“) a jejich tlaku na děložní dutinu. Objemové zmenšení myomu vzhledem k variabilnímu cévnímu zásobení lze jen těžko předvídat (v průměru se pohybuje mezi 30–60% objemové redukce za šest měsíců od UAE). Daný fakt je nutno zakalkulovat do indikační rozvahy [11]. Na druhou stranu, i pacientky s jen malou objemovou odezvou myomu je často snazší následně operovat pro lepší demarkaci avaskulárního myomu oproti zdravým tkáním dělohy [11]. Druhým problémem embolizační léčby myomů je přetrvávající nejistota o jejím vlivu na fertilitu. V literatuře bylo popsáno několik typů komplikací UAE, z nichž zejména zánět myomu či celé dělohy a předčasné ovariální selhání jsou rizika obzvláště závažná pro graviditu plánující nemocné. Embolizace může negativně ovlivňovat fertilní potenciál, zejména pokud dochází ke komunikaci embolizovaného, většinou nekrotického myomu s děložní dutinou [11]. Tehdy je metodou volby jednoznačně chirurgická intervence.
V současnosti se vyvíjejí i další metody zaměřené na vaskularitu, resp. devitalizaci myomů. Největšího rozšíření včetně několika specializovaných center v ČR dosáhly laparoskopická, dopplerem asistovaná myolýza a laparoskopická okluze uterinních tepen, tzv. LUAO [11]. Výhodou LUAO je její nízká invazivita a systémovost, tedy ischemické působení na vícečetné či nepříznivě lokalizované myomy. Její limitací jsou technické nároky na operatéra (blízkost ureteru, obturatorního nervu a dalších významných retroperitoneálních struktur; variabilita větvení vnitřní ilické tepny, z níž uterinní arterie vychází, a její nesnadná dostupnost u některých nálezů) [11].
Radikální terapie
Radikálním operačním řešením děložní myomatózy je hysterektomie. V současnosti pozorujeme i v této oblasti trend zavádění minimálně invazivních technik. Otevřenou abdominální hysterektomii, v minulosti takřka výhradně používanou, dnes nahrazuje méně invazivní přístup vaginální, s laparoskopickou asistencí, či bez ní. Abdominální hysterektomie zůstává metodou volby u výrazně objemných myomatóz. Z pohledu terapie děložních myomů je hysterektomie metodou léčby nejefektivnější, nicméně definitivní a je vyhrazena pouze pro pacientky s ukončenými reprodukčními plány.
Diskuze
Současný stav medicíny umožňuje využít v léčbě děložní myomatózy celou řadu metod (viz výše). Po pečlivé diagnostice a precizním provedení terapeutického výkonu však pořád zůstává otázka, zda provedený výkon zlepší reprodukční snahy pacientky, zda se sníží incidence opakování potratů a zda exstirpace myomů zlepší výsledky cyklů asistované reprodukce. Na dané otázky se snaží odpovědět množství celosvětově probíhajících, nebo již ukončených studií.
Několik studií z poslední doby doporučuje u sterilních žen s diagnózou signifikantního myomu (nad 4cm) jeho odstranění a toto doporučení opírá o významné zlepšení reprodukčních výsledků (conception rate, delivery rate) po myomektomii oproti výsledkům žen léčených konzervativně [26–29]. Až 60% žen po exstirpaci myomu spontánně otěhotní do 24 měsíců po výkonu [30]. Většina žen, které po myomektomii otěhotní, otěhotní do jednoho roku po výkonu; po té počet těhotenství prudce klesá [9].
Jiné studie se zaměřují na faktory ovlivňující kladný efekt provedené myomectomie na fertilitu žen. Pro spontánní (lékařsky neasistovanou) plodnost ženy po myomektomii jsou na základě těchto studií nepříznivé následující faktory: intramurální a/nebo posteriorní lokalizace myomu, resp. nutnost provést suturu defektu po enukleaci (častější tvorba adhezí), asymptomatičnost myomu (sterilní ženy s myomem doprovázeným metroragiemi po jeho odstranění otěhotněly častěji), věk nad 35 let, délka trvání sterility nad dva roky, přítomnost dalších faktorů sterility [31–33]. Překvapivým zjištěním jediné ze studií byl fakt, že fertilita po myomektomii nebyla negativně ovlivněna věkem pacientek (jen nevýznamný pokles cumulative conception rate u žen nad 40 let) [31].
Prospěšnost provedení myomectomie ve vztahu k habituálnímu potrácení zůstává pořád nedořešena. Fernandeze et al ve své studii zjistili, že po transcervikální myomektomii se sice upravily menstruační poruchy, avšak vliv výkonu na fertilitu nebyl výrazný [34]. Z 59 žen ve studii otěhotnělo 16 (27%), z kterých pouze 6 (10%) porodilo v termínu. Výsledky mohly být ovlivněny věkem pacientek (v průměru 36,6 let) a poměrně krátkou dobou sledování (v průměru 26 měsíců). Nejlepších výsledků (zvýšení pregnancy rate na 57%) bylo dosaženo, pokud resekovaný myom byl větší než 5cm [34]. Prosperitu těhotenství u 51 žen před laparoskopickou myomektomií intramurálních či subserózních myomů a po ní sledovali Li et al z Jessopovy ženské nemocnice v Sheffieldu [28]. Zatímco před operací byla frekvence potratů 60% (potratilo 24 žen ze 40), po myomektomii poklesla na 24% (potrat u 8 žen z 33) (p < 0,0001). Frekvence otěhotnění po myomektomii (conception rate) v celém souboru byla 57% a jediným faktorem ovlivňujícím tento výstup byl věk: 74% (23 z 31 žen otěhotnělo) u žen do 36 let, resp. 30% (6/20) u žen nad 36 let (p < 0,005). Mezi 25 těhotenstvími završenými porodem životaschopného dítěte nedošlo k jediné ruptuře dělohy ani k předčasnému porodu [28].
Stále více diskutovanou otázkou zůstává přínos operačního řešení myomatózy ve vztahu k výsledkům asistované reprodukce. Otázkou je, zda benefit exstirpace myomu u sterilní pacientky převáží možná rizika s touto intervencí spojena. Mnohé světové studie a práce prokazují prospěšnost myomektomie před započetím ART [4,6,17,31,35]. Fernandez et al se domnívá, že k exstirpaci menších myomů před ART přistupujeme až tehdy, zasahují-li do děložní dutiny [36]. Jiné práce se staví k provádění této operace před plánovanou asistovanou koncepcí rezervovaně a zdůrazňují nutnost individuálního posouzení každého případu (reprodukční anamnéza, vyloučení jiných faktorů sterility, lokalizace/počet/velikost myomů) [9,37,38]. Většina těchto doporučení je však vyvozena pouze nepřímo a prospektivní, randomizovaná studie porovnávající výsledky ART u žen po myomektomii s ženami léčenými konzervativně dosud chybí [7]. Poncelet ve své literární analýze zhodnotil výsledky studií zabývajících se myomy a reprodukčními výsledky publikovanými v letech 1988–2000 a závěrem poukazuje na nezbytnost randomizovaných studií k ověření pozitivního vlivu myomektomie na následnou reprodukci, včetně asistované [30].
Závěr
Stoupající frekvence výskytu děložních leiomyomů mezi ženami plánujícími koncepci činí problematiku myomů a reprodukčních poruch vysoce aktuálním tématem, kterým se v recentní světové literatuře zabývá množství prací. Přesto vztah leiomyomů a reprodukčních výsledků, stejně jako význam různých léčebných postupů, zůstává kontroverzní [7].
Na základě výsledků dosavadních celosvětových studií se za příčinný faktor sterility považuje myom přesahující 5cm a/nebo jeho lokalizace v blízkosti cervixu či tubárního ústí. Tradičně udávaný příčinný vztah myomů k potrácení je některými novými studiemi zpochybňován, zejména pokud se jedná o myom solitární. Spíše než velikost a lokalizace leiomyomu je pro další osud těhotenství důležité místo nidace plodového vejce ve vztahu k myomu [7].
Dominantní léčebnou metodou intramurálních a subserozních myomů je laparoskopická nebo laparotomická myomectomie. Její provedení je doporučováno u neplodných žen s diagnostikovaným leiomyomem nad 4cm. U žen s multifaktoriální příčinou neplodnosti je myomektomie vhodná u myomů velmi objemných (nad 7cm) a myomů symptomatických (menometroragie) [7]. Řešení submukózních myomů představuje jejich hysteroskopická resekce. Její provedení je doporučeno u myomů přesahujících 3cm, deformujících dutinu děložní a dle údajů literatury vede tato metoda k signifikantnímu nárůstu donošených gravidit (live birth rate) [34]. Pokud je zvažována myomektomie u asymptomatické nulipary, je vhodné operaci doporučit až v době, kdy graviditu již plánuje, nikoli s dlouhým předstihem [7].
Vzhledem k tomu, že je děložní myomatóza považována za příčinný faktor sterility a infertility, ocitají se takto postižené ženy často v péči center asistované reprodukce. Zde přichází na řadu otázka, zda děložní myomy ovlivňují výsledky asistované reprodukce. Mnohé studie publikované v několika posledních letech potvrzují signifikantně horší výsledky ART (implantation rate, pregnancy rate, delivery rate) a výraznou redukci úspěšnosti cyklů IVF u žen s leiomyomem oproti kontrolním skupinám (nejčastěji v porovnání s ženami s tubárním faktorem sterility), a to i v případě myomů intramurálních, nedeformujících děložní dutinu [4–6]. Diskutován je vztah provedené myomectomie k výsledkům asistované reprodukce. Mnohé světové studie a práce prokazují prospěšnost myomektomie před započetím ART [4,6,17,31,35]. Jiné práce se staví k provádění této operace před plánovanou asistovanou koncepcí rezervovaně a zdůrazňují nutnost individuálního posouzení každého případu (reprodukční anamnéza, vyloučení jiných faktorů sterility, lokalizace/počet/velikost myomů) [9,37,38].
V neposlední řadě je nutno uvést, že gravidita a porod u ženy s myomem nebo po myomectomii jsou považovány za rizikové a vyžadují komplexní péči. Ženy s velkou myomatózou by měly být sledovány a rodit v perinatologických centrech se zázemím a zkušenostmi s předčasnými a komplikovanými operačními porody. Porod je možné po provedené myomectomii za určitých okolností vést s výhodou vaginálně. Případný císařský řez může být spojen s vážnými komplikacemi plynoucími z atypických anatomických poměrů. Z hlediska komplikací v třetí době porodní jsou rizikové jak pacientky po myomectomii (placenta acreta, nepoznaná děložní ruptura), tak ženy s myomem ponechaným (nebezpečí poporodního krvácení z hypotonie dělohy nebo ze submukózní části myomu) [11].
Doručeno do redakce: 22. 10. 2010
Přijato po recenzi: 8. 11. 2010
MUDr. Renáta Krajčovičová
prim. MUDr. Robert Hudeček, Ph.D.
Gynekologicko-porodnická klinika LF MU a FN Brno
rkrajcovicova@gmail.com
Sources
1. Citterbart K et al. Gynekologie. Praha: Galén 2001.
2. Mára M, Fučíková Z, Mašata M et al. Management děložních myomů u žen ve fertilním věku. Čes Gynek 2003; 68 : 30–35.
3. Pluta M et al. Zhoubné nádory děložního těla. Mod Gynek Porod 2000; 9 : 661.
4. Eldar-Geva T, Meagher S, Healy DL et al. Effect of intramural, subserosal, and submucosal uterine fibroids on the outcome of assisted reproductive technology treatment. Fertil Steril 1998; 70(4): 687–691.
5. Hart R, Khalaf Y, Yeong CT et al. A prospective controlled study of the effect of intramural uterine fibroids on the outcome of assisted conception. Hum Reprod 2001; 16(11): 2411–2417.
6. Stovall D et al. Uterine leiomyomata reduce the efficacity of assisted reproduction cycles: results of a matched follow-up study. Hum Reprod 1998; 13 : 192.
7. Mára M, Řežábek K, Živný J. Děložní myom a poruchy plodnosti. Mod Gynek Porod 2002; 11 : 614.
8. Krajčovičová R, Hudeček R, Kalvodová J. Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část. Prakt Gyn 2007; 11(4): 164–168.
9. Bajekal N, Li T C. Fibroids, infertility and pregnancy wastage. Hum Reprod Update 2000; 6 : 614.
10. Kučera E, Živný J. Sterilita při děložním myomu a její ovlivnění operační léčbou. Čes Gynek 1997; 42 : 324.
11. Mára M, Holub Z et al. Děložní myomy – moderní diagnosti a léčba. Praha: Grada 2009.
12. Venkat G, Amiri N, Al-nasser R et al. The effect of submucosal, intramural and subserosal sterine fibroids on the pregnancy. Outcome in ovocyte recipients. Fertil Steril 2005; 84: S258.
13. Zwinger A. Spontánní a opakovaný potrat. Mod Gynek Porod 2000; 9 : 367.
14. Bajekal N, Li TC. Fibroids, infertility and pregnancy wastage. Hum Reprod 2000; 6(6): 614–620.
15. Benson CB et al. Outcome of pregnancies in women with uterine leiomyomas identified by sonography in the first trimester. J Clin Ultrasound 2001; 29(5): 261–264.
16. Bernard G, Darai E, Poncelet C et al. Fertility after hysteroscopic myomectomy: effect of intramural myomas associated. Eur J Obstet Gynecol Reprod Biol 2000; 88(1): 85–90.
17. Farhi J, Ashkenazi J, Feldberg D et al. Effect of uterine leiomyomata on the results of in-vitro fertilization treatment. Hum Reprod 1995; 10(10): 2576–2578.
18. Dietterich C et al. The presence of small uterine fibroids not distorting the endometrial cavity does not adversely affect conception outcome following embryo transfer in older recipients. Clin Exp Obstet Gynecol 2000; 27 : 168–170.
19. De Leo V, Morgante G, La Marca A et al. A benefit-risk assessment of medical treatment for uterine leiomyomas. Drug Staf 2002; 25(11): 759–779.
20. Friedman AJ, Rein MS, Harrison-Atlas D et al. A randomized, placebo controlled, double blind study evaluating leuprolide acetate depot traetment efore myomectomy. Steril Fertil 1989; 52(5): 728–733.
21. Golan A. GnRH analogues in the traetment of sterine fibroids. Human Repris 1996; 11(3): 33–41.
22. Hudeček R, Ventruba P, Crha I. Podpůrná hormonální léčba v programu asistované reprodukce. Prakt Gyn 2005; 9(5): 6–8.
23. Gerhard I, Mastthes J, Runnebaum B. The induction of ovulation with pulsatile gonadotrophin releasing hormone administration in hyperandrogenic women after down-regulation with buserelin or suppresion with an oral contraceptive. Hum Reprod 1993; 8(12): 2033–2038.
24. Pánková S, Hudeček R, Račanská E. Peroperační prevence adhesí v gynekologii. Prakt Gyn 2009; 13(2): 70–75.
25. Mára M. Současné možnosti léčby děložních myomů. Mod Bab 2007; 13 : 1–7.
26. Bulletti C et al. The role of leiomyomas in infertility. J Am Assoc Gynecol Lapar 1999; 6 : 441–445.
27. Dubuisson JB, Fauconnier A, Chapron C et al. Reproductive outcome after laparoscopic myomectomy in infertile women. J Reprod Med 2000; 45(1): 23–30.
28. Li TC, Mortimer R, Cooke ID et al. Myomectomy: a retrospective study to examine reproductive performance before and after surgery. Hum Reprod 1999; 14(7): 1735–1740.
29. Smith DC, Uhlir JK. Myomectomy as a reproductive procedure. Am J Obstet Gynecol 1990; 162(6): 1476–1482.
30. Poncelet C et al, Benifla JL, Batallan A. Myoma and infertility: analysis of the literature. Gynecol Obstet Fertil 2001; 29(6): 413–421.
31. Dubuisson JB et al. Myomectomy: It´s Role in Infertility. Proceedings of the 2nd World Congress on Controversies in Obsterics, Gynecology & Infertility. Paris, September 2001.
32. Tulandi T, Murray C, Guralnick M et al. Adhesion formation and reproductive outcome after myomectomy and second-look laparoscopy. Obstet Gynecol 1993; 82(2): 213–215.
33. Vercellini P, Maddalena S, De Giorgi O et al. Determinants of reproductice outcome after abdominal myomectomy for infertility. Fertil Steril 1999; 72(1): 109–114.
34. Fernandez H, Sefrioui O, Virelizier C et al. Hysteroscopic resection of submucosal myomas in patients with infertility. Hum Reprod 2001; 16(7): 1489–1492.
35. Narayan R, Rajat, Goswamy K. Treatment of submucous fibroids, and outcome of assisted conception. J Am Assoc Gynecol Laparosc 1994; 1 : 307–311.
36. Fernandez H. Infertilité et petit myome: role de la myomectomie. Contracept Fertil Sex 1997; 25 : 348–349.
37. Jun SH, Ginsburg ES, Racowsky C et al. Uterine leiomyomas and their effect on in vitro fertilization outcome: a retrospective study. J Assist Reprod Genet 2001; 18(3): 139–143.
38. Lumsden MA, Wallace EM. Clinical presentation of uterine fibroids. Baillieres Clin. Obstet Gynaecol 1998; 12(2): 177–195.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2010 Issue 4
-
All articles in this issue
- The impact of uterine fibroids on reproductive function
- The effect of tadalafil treatment on sperm count in men with erectile dysfunction
- Sexual life in pregnancy – assessment by the SFW questionaire (Sexual Function of a Woman)
- – mature sperm selection for human oocyte fertilization by ICSI method
- Date rape
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Date rape
- The effect of tadalafil treatment on sperm count in men with erectile dysfunction
- The impact of uterine fibroids on reproductive function
- Sexual life in pregnancy – assessment by the SFW questionaire (Sexual Function of a Woman)