PRINCIPY ANTIMIKROBIÁLNÍ LÉČBY U UROINFEKCÍ
The principles of antimicrobial treatment in uroinfections
Alongside the upper respiratory infections, the urinary tract infections (UTI) are the second of the most frequent infectuous diseases in population. Their incidence is changing dependent on age and sex. The majority of non-complicated lower urinary infections is well curable, nevertheless, the increasing resistance to antibiotics complicates the treatment of reccurent infections, complicated cystitis and pyelonephritis. It becomes a big problem at nosocomial infections. The authors recount the pathophysiology, ethiology and diagnostic methods of urinary tract infections (UTI). In the conclusion they give an overview of general principles of their antibacterial treatment.
KEY WORDS:
urinary tract infections, uropathogenous bacteria, antibacterial drugs, antibiotics
:
A. Ševčíková; P. Ševčík
:
Anesteziologicko-resuscitační klinika LF MU a FN u sv. Anny v Brně
; Oddělení klinické mikrobiologieLF MU a FN Brno
:
Urol List 2005; 3(2): 5-12
Infekce močových cest (IMC) jsou vedle infekcí horních cest dýchacích druhé z nejčastějších infekčních onemocnění v populaci. Jejich incidence se mění v závislosti na věku a pohlaví. Většina nekomplikovaných infekcí dolních cest močových je dobře léčitelná, avšak stoupající rezistence na antibiotika komplikuje léčbu rekurentních infekcí, komplikovaných cystitid a pyelonefritid. Velkým problémem se stává u nozokomiálních infekcí. Autoři podrobně popisují patofyziologii, etiologii infekcí močových cest a diagnostické metody při jejich odhalování. V závěru podávají přehled obecných principů jejich antibakteriální léčby.
KLÍČOVÁ SLOVA:
infekce močových cest, uropatogenní bakterie, antibakteriální léky, antibiotika
ÚVOD
Infekce močových cest (IMC) jsou vedle infekcí horních cest dýchacích druhé z nejčastějších infekčních onemocnění v populaci. Jejich incidence se mění v závislosti na věku a pohlaví. U novorozenců je častější IMC u chlapců než u dívek s incidencí kolem 1 % a je často spojena s kongenitálními abnormalitami močových cest a s bakteriemií. U dětí ve věku mezi 1 a 5 roky roste prevalence bakteriurie u děvčat k 5 %, zatímco u chlapců klesá pod 0,5 %. Mezi 20.–50. rokem věku jsou infekce močových cest až 50krát častější u žen. Později stoupá incidence IMC u obou pohlaví a přibližuje se zastoupení mužů a žen [1].
V nemocnici jsou IMC nejčastějšími nozokomiálními infekcemi, vyskytujícími se především v souvislosti s katetrizací močových cest. Na jednotkách intenzivní péče (JIP) zaujímají druhé místo za záněty plic a dýchacích cest. Komunitní a nozokomiální infekce jsou většinou bakteriálního původu, pocházející z endogenní flóry jedince. U nozokomiálních močových infekcí se vedle endogenní flóry uplatňuje i exogenní flóra prostředí přenášená rukama personálu, popřípadě vzácně z kontaminovaných roztoků nebo pomůcek [2,3].
Charakteristická klinická symptomatologie infekcí dolních a horních cest močových je zpravidla provázena signifikantní bakteriurií, která vyjadřuje kvantitativně významnou bakteriurii ve standardním, přesně definovaném množství vzorku spontánně vymočené, případně vycévkované moči. Signifikantní bakteriurie může chybět při časném stadiu infekce, při nízkém pH moči, při výrazně zředěné moči následkem velkého přísunu tekutin, u pacientů s antibiotickou clonou, při nevhodném použití dezinfekčního prostředku při odběru moči, u uretritid (gonokokových, chlamydiových), u specifických procesů, případně pomalu rostoucích mikroorganizmů, u pacientů s infekcí hematogenního původu (absces ledviny), popřípadě u pacientů s neinfekční etiologií klinické symptomatologie (konkrementy, infarkt ledviny aj) [4].
BRÁNY VSTUPU
Ascendentní typ
Nejčastější bránou vstupu je ascendentní cesta. IMC u žen a dívek jsou většinou vyvolávány enterobakteriemi fekálního původu z kolonizace vaginálního introitu, periuretrální oblasti a uretry, s následnou invazí do močového měchýře, popřípadě ledvinné pánvičky a parenchymu ledvin.
U mužů je rezervoárem pro tento typ šíření IMC obvykle bakteriemi osídlená prostata s poruchou mikce obstrukčního charakteru, eventuálně u chlapců kolonizované perineum a preputium.
Predispozicí IMC u obou pohlaví z iatrogenních příčin jsou invazivní vyšetřovací a terapeutické postupy v močových cestách, včetně katetrizace.
Hematogenní typ
Při méně častém hematogenním typu jsou mikroorganizmy během bakteriemie zavlečeny do močového systému ze vzdáleného endogenního zdroje. Tímto způsobem se mohou uplatnit salmonely, Staphylococcus aureus nebo mykobakteria.
Lymfatický typ
Podíl tohoto typu šíření infekce není v patogenezi IMC zcela objasněn. Výjimkou je šíření sexuálně přenosných infekcí do regionálních lymfatických uzlin z primární léze.
Per continuitatem
Šíření infekce v oblasti malé pánve a perinea je vyvolané smíšenou bakteriální flórou.
Přenos infekce pohlavním stykem
Patří do geneze uretritid, prostatitid, epididymitid mužů a uretritid žen, vyvolaných sexuálně přenosnými bakteriemi, parazity, eventuálně viry [3,4].
PATOFYZIOLOGIE
Na vzniku IMC se podílí jednak faktory virulence některých uropatogenních bakteriálních kmenů a velikost inokula, na straně druhé stojí obranné mechanizmy hostitele. U katetrizovaných jedinců přistupuje další ovlivnění vyplývající z mechanického poškození, přítomnosti cizího tělesa a tvorby biofilmu.
Obranné mechanizmy hostitele
Zdravý močový systém je odolný vůči kolonizaci bakteriemi a je schopný je rychle eliminovat. Inhibiční až baktericidní efekt má vysoká osmolarita a nízké pH moči, koncentrace urey, solí a organických kyselin. Fyziologická kolonizace zevního ústí uretry komenzální mikroflórou (např. koaguláza-negativní stafylokoky, enterokoky, difteroidy, enterobakterie), fyziologická kolonizace vaginy v závislosti na hladině estrogenu s ochrannou funkcí fyziologického pH chrání před osídlením a invazí patogenních kmenů. Fyziologický režim močení zajišuje včasné odstranění bakterií po vniknutí do močových cest. Vyměšování prostatického sekretu, mechanická funkce uretry a vezikoureterálních junkcí bránících ascendentnímu šíření infekce, účinná hladina sekrečních IgA protilátek suspendovaných do moči s antiadherenční schopností vůči uropatogenním koliformním kmenům, glykosaminoglykanový povlak epitelu močových cest jako inhibitor adherence bakterií k povrchu epiteliálních buněk a nespecifické obranné mechanizmy (interleukiny, TNF, složky komplementu) pomáhají v eliminaci již vniklých bakterií [4].
Faktory virulence některých uropatogenních bakteriálních kmenů
Přítomnost bakterií v močovém systému není synonymem infekce močových cest. Asymptomatická bakteriurie je signifikantní bakteriurie prokázaná nejméně 2krát po sobě u jedinců bez klinických symptomů. Charakter infekce se kromě jiného odvíjí od virulentních vlastností vyvolavatele a schopnosti obranných mechanizmů jedince jim čelit.
Nejčastějším vyvolavatelem močových infekcí je Escherichia coli. Jen některé sérotypy Escherichia coli (01, 02, 04, 06, 07, 075, 0150), tzv. uropatogenní E. coli, jsou vybaveny faktory virulence, které jim umožní kolonizovat močové cesty a způsobit infekci.
Fimbrie P, S a typ 1 jsou povrchové proteinové organely schopné se vázat na specifické receptory buněk hostitele. Zdá se, že přítomnost těchto faktorů souvisí se závažností a typem močové infekce. Tyto fimbrie byly prokázány u 80 % kmenů izolovaných u případů akutní pyelonefritidy, u 40–50 % kmenů u případů akutní cystitidy a pouze u 20 % kmenů izolovaných u asymptomatických bakteriurií [3,4,5].
Z dalších faktorů virulence se uplatňuje lipopolysacharid přítomný v zevní membráně gramnegativních bakterií. Inhibuje peristaltiku ureteru a při vysoké koncentraci při systémové zánětlivé reakci může vyústit v život ohrožující septický šok. Přítomnost kapsulárního polysacharidu (mukózní kmen, tzv. M fáze) zvyšuje odolnost kmene vůči obranným mechanizmům hostitele a je významným nositelem virulence. Hemolyzin (u tzv. hemolytických kmenů) svým cytotoxickým efektem na erytrocyty, polymorfonukleáry, monocyty a buňky v renálních tubulech má inhibiční vliv na fagocytózu, může způsobit poškození ledvin a anémii u pyelonefritid.
Proteus mirabilis produkuje ureázu, která se podílí na alkalizaci moči a tvorbě amoniaku s nekrotickým účinkem ve dřeni ledvin. Inhibuje funkci komplementu a fagocytózy s následným častějším intracelulárním přežíváním bakteriálních buněk a má podíl na tvorbě močových kamenů [3,4,5,6].
ETIOLOGIE IMC
Nejčastějším původcem akutních nekomplikovaných cystitid je v 80–90 % Escherichia coli. Staphylococcus saprophyticus asi v 10 % vyvolává akutní cystitidy u zdravých žen ve fertilním věku.
Rekurentní, komplikované komunitní i nozokomiální IMC bývají vyvolány širším spektrem mikroorganizmů např. Klebsiella sp., Enterobacter sp., Proteus sp., Serratia sp.,Pseudomonas sp., Enterococcus sp. Kmeny se vyznačují častou rezistencí na ATB.
Koaguláza-negativní stafylokoky jsou častou kontaminací z perineální flóry. Vzácně mohou způsobit IMC při strukturálních a funkčních abnormalitách nebo při dlouhodobě zavedených močových katétrech. Streptococcus agalactiae většinou bývá přítomen jako kontaminace z vaginální flóry.
Corynebacterium urealyticum bývá vzácně původce nozokomiálních infekcí vyznačující se rezistencí k ATB
Staphylococcus aureus vyvolává IMC převážně hematogenní cestou, případně se vznikem renálního abscesu. Ascendentní cesta je možná v souvislosti s instrumentálními a katetrizačními výkony.
Anaerobní bakterie se vyskytují vzácně jako původci IMC v souvislosti s invazivními rozpadovými patologickými procesy (tumory). Jejich podíl na rozvoji chronické prostatitidy není zcela objasněn.
Jako vyvolavatelé sexuálně přenosných urogenitálních infekcí se uplatňují Chlamydia trachomatis, Ureaplasma urealyticum, Neisseria gonorrhoeae.
Mycobacterium tuberculosis je příčinou specifického zánětu ledvin, prostaty, eventuálně dalších částí močopohlavního systému.
Jako vyvolavatelé IMC se nohou uplatnit i viry. Adenovirus sérotyp 11, 21, 8 bývá původcem hemoragické cystitidy. Polyoma viry (BK a JC viry) se mohou uplatnit jako původci infekce ledvin a hemoragických cystitid u imunosuprimovaných pacientů po transplantaci ledvin.
Močí může být dlouhodobě vylučován cytomegalovirus a viry při systémových infekcích (morbilli, parotitis, varicella--zoster, hantaviry).
Z parazitů Trichomonas vaginalis - vyvolavatel sexuálně přenosných uretritid u mužů, eventuálně prostatitid [4].
Schistosoma haematobium - původce chronické granulomatózní infekce močového měchýře. V našich podmínkách se s ní můžeme setkat jako s importovanou nákazou z endemických oblastí Středního východu a Afriky [4,7,8,10].
V tab. 1 je uvedena klasifikace uropatogenů (upraveno dle Scandinavian Journal of Clinical and Laboratory Investigation: European Urinalysis Guidelines: Summary, 2000), v níž jsou bakterie roztříděny do 16 kategorií z hlediska stupně patogenity I.-IV. a klinicky významné frekvence výskytu A-D v procentech.
![Klasifikace uropatogenů - patogenita a frekvence výskytu mikroorganizmů ve vzorku ze středního proudu moči spontánně vymočené (upraveno dle [18]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/14cf791cfe367fdbee2adab4755d4821.png)
I. Primárně patogenní kmeny
Jsou schopny vyvolat IMC u jedinců s normálním močovým systémem. Patří sem Escherichia coli s běžnou frekvencí nad 10 % (A), a Staphylococcus saprophyticus s častou frekvencí 1–10 % (B). Salmonella sp. se vzácnou frekvencí méně než 0,1 % (D) se jako vyvolavatel IMC může uplatnit z hematogenního šíření v průběhu onemocnění septického charakteru, avšak nízká koncentrace v moči je spíše známkou fekálního znečištění při odběru. Vzácně se mohou vyskytnout leptospiry a mykobakteria (D).
II. Sekundárně patogenní kmeny
Jsou bakterie, které zřídka vyvolávají IMC u jedinců s normálním močovým systémem, ale jsou častými vyvolavateli nozokomiálních infekcí. Patří sem Enterobacter sp., Klebsiella sp., Proteus mirabilis, Pseudomonas aeruginosa, Enterococcus sp. s častou frekvencí 1–10 % (B), Citrobacter sp., Morganella Morgani, Proteus vulgaris, Serratia sp., Staphylococcus aureus s neobvyklou frekvencí 0,1–1 % (C), Corynebacterium urealyticum se vzác-nou frekvencí méně než 0,1 % (D). Se vzácnou frekvencí mohou být z dětské moči izolovány také Haemophilus sp. a Pneumococcus sp.
III. Nejisté patogenní kmeny
Tvoří často kolonizující kožní a slizniční mikroflóru a mohou někdy osidlovat hospitalizované jedince a vyvolávat nozokomiální IMC. Nález těchto kmenů v moči lze považovat za relevantní pouze v případě, jsou-li prokázány ve vzorku moči získaném suprapubickou aspirací. Patří sem s častou frekvencí 1–0,1 % (B) Streptococcus agalactiae, výjimečný původce IMC u žen, většinou se jedná o kontaminaci moči z poševní mikroflóry. Kvasinky, nejčastěji Candida albicans, která může být vyvolavatelem ascendentního typu infekce u pacientů s dlouhodobě zavedeným permanentním katétrem, v průběhu léčby širokospektrými antibiotiky, u diabetiků a jiných imunokompromitovaných jedinců a u pacientů po invazivních vyšetřovacích technikách. Diseminovaná kandidóza může být příčinou solitárních nebo multifokálních abscesů v ledvinách v důsledku hematogenního rozsevu. Přítomnost Candida sp. v moči je častou příčinou diagnostických rozpaků, protože kandidy mohou být kontaminací z genitálního systému. Kmeny koaguláza-negativních stafylokoků (CNS), které produkují ureázu nebo kmeny v moči pacientů s permanentním katétrem, mohou být významné. Většinou však jsou kmeny CNS známkou kontaminace a mají velmi nízkou vypovídací hodnotu. S neobvyklou frekvencí 0,1–1 % (C) sem dále patří Acinetobacter sp., Pseudomonas sp., Stenotrophomonas maltophilia jako vyvolavatelé nozokomiálních infekcí, s vysokou rezistencí na antibiotika.
IV. Mikroflóra osidlující distální úsek uretry a vaginu
Představuje v moči prakticky vždy kontaminující příměs a stanovení testu citlivosti k antibiotikům nemá smysl, pouze je-li speciálně indikováno ve výjimečných případech. Patří sem Streptococcus sp., Gardnerella vaginalis, Lactobacillus sp., s frekvencí častou 1–10 % (B), Bifidobacterium sp. s frekvencí neobvyklou 0,1–1 % (C) [4].
BAKTERIOLOGICKÁ DIAGNOSTIKA IMC
Základním kultivačním vyšetřením moči získáme informace o druhu mikrobiálního agens, jeho kvantitativní přítomnosti v moči a jeho citlivosti na antibiotika.
Odběr musí být proveden zásadně před nasazením antibiotik, nejlépe ráno. Vzorek musí být zpracován do 2 hodin po odběru. Pokud to není možné, musí být skladován a transportován při chladničkové teplotě 4 °C, maximálně však 24 hodin.
Vzorky dle způsobu odběru:
- ze středního proudu moči spontánně vymočené po předchozí očistě do sterilní nádobky. Jedná se o rutinní typ s určitým rizikem sekundární kontaminace při odběru.
- jednorázová katetrizace močového měchýře představuje minimální riziko kontaminace při odběru, nelze ji však pro riziko zavlečení infekce do močových cest doporučit jako běžný typ odběru.
- získané z uzavřeného systému permanentního katétru - kritéria interpretace nejsou jednoznačná, závisí na klinické symptomatologii; bakterie mohou být součástí biofilmu povrchu katétru, ale i zdrojem klinických komplikací.
- získané z adhezivních sáčků u dětí - spojeno s velkým rizikem sekundární kontaminace; před inzercí sáčku by měl být genitál pečlivě omyt vodou a sáček by neměl být nalepen déle než 30 minut a odstraněn ihned po mikci.
- v pediatrické praxi je výhodnější použít k odběru i transportu komerčně vyráběné odběrové soupravy, tj. plastikové fólie potažené kultivačními médii, která se bezprostředně po odběru moči do ní ponoří, vyjmou a již inokulovaná se zasílají do laboratoře.
- získané suprapubickou punkcí močového měchýře - metoda považovaná za zlatý standard u pacientů s obtížnou interpretací kultivačního nálezu a pro odběr vzorku k anaerobní kultivaci.
- získané v souvislosti s chirurgickými výkony (z nefrostomie, ureteroskopie, cystoskopie, výplachu močového měchýře); tyto vzorky nejsou zpracovávány kvantitativně, protože jakékoliv množství bakterií může být signifikantní [9].
Interpretace výsledků kultivace
V roce 2000 byla Evropskou společností klinické mikrobiologie a infekčního lékařství a Evropskou konfederací laboratorní medicíny vydána doporučení k nové definici bakteriální koncentrace vyjadřující signifikantní bakteriurii ve vztahu k typu odebraného vzorku, ke klinické symptomatologii a počtu druhů zachycených uropatogenů. Dosud uváděný cfu (colony-forming units) na 1 ml je nahrazen cfb (colony-forming bacteria) na 1 l moči. Termín cfu je považován za obsoletní a příliš abstraktní a jednotka 1 ml není na rozdíl od 1 l standardizovaná. Poněvadž nová terminologie není ještě všeobecně známá a zažitá, a pro srovnání s dosavadním hodnocením bude na prvním místě uveden dosud používaný termín cfu/ml (tab. 2).
![Navržené hodnoty signifikantní bakteriurie ve vztahu k typu odebraného vzorku, ke klinické symptomatologii a počtu druhu zachycených uropatogenů, zdůvodňující testování kmene k antibiotikům [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/222f13e6f295a9712eadb6b7a77b0f58.png)
Za signifikantní množství u symptomatické bakteriurie a u primárních patogenů je považováno již množství 103 cfu/ml, které může být přítomno v úplném počátku klinických obtíží a dosud používané hraniční kvantity 105 cfu/ml a více je dosaženo během několika dnů. Kultivace více než 1–2 kmenů je považováno za kontaminaci. 3 typy kmenů jsou tolerovány pouze u symptomatických pacientů s permanentním katétrem a s pyelonefritidou nebo urosepsí. Test citlivosti se provádí pouze u gramnegativních bakterií, je-li každáv koncentraci 104 cfu/ml a více [9].
OBECNÉ PRINCIPY ANTIBAKTERIÁLNÍ LÉČBY MOČOVÝCH INFEKCÍ
Bakteriální rezistence k antibiotikům
Rezistence bakterie k antimikrobnímu přípravku lze definovat jako schopnost bakteriální populace odolávat účinku inhibiční koncentrace příslušného antibiotika.
Přirozená primární rezistence je trvalá, geneticky podmíněná nevnímavost celé populace určitého mikrobiálního druhu vůči účinkům určitého antibiotika.
Získaná sekundární rezistence je změna původně citlivé populace bakterií na rezistentní. Sekundární rezistence vzniká buï mutacemi nebo přenosem genetické informace.
Mutacemi DNA vznikají rezistentní buňky v každé bakteriální populaci v poměru 1 : 10-7–10-12. Takto vzniklé rezistentní varianty se mohou uplatnit při selekčním tlaku antibiotika, na které je původní populace citlivá. Přenos rezistence se uskutečňuje předáváním genetického materiálu z rezistentní buňky na buňku citlivou. Tento genetický materiál je uložen buï v chromozomech nebo extrachromozomálně v plazmidech nebo v transpozonech. Přenos rezistence může probíhat mezi buňkami téhož druhu nebo mezidruhově. Tento typ je v současné době závažným medicínským problémem a může vést k selhání antibiotické léčby [8].
Rezistence bakterií je způsobena řadou odlišných mechanizmů:
- produkcí bakteriálních enzymů, které rozrušují, nebo modifikují strukturu antibiotik (např. ß-laktamázy, aminoglykosid modifikující enzymy)
- alterací bakteriální stěny vedoucí ke snížení její permeability a zhoršenému průniku antibiotika do buňky
- modifikací cílových míst antibiotik
- zvýšeným vylučováním antibiotika z bakteriálních buněk (bakteriální reflux)
Racionální antibiotická léčba infekcí močového systému se řídí podle základních informací, jako je věk pacienta, pohlaví, gravidita, přítomnost symptomů infekce, lokalizace infekčního procesu, zda se jedná o infekci komunitní, nebo nozokomiální, komplikovanou, či nekomplikovanou, sporadickou, či rekurentní.
S volbou antibiotika většinou nelze čekat na kultivační vyšetření, ale empirické nasazení antibiotik by mělo být provedeno na základě výše uvedených informací a znalosti aktuální epidemiologické situace na daném oddělení nebo v rámci regionu. Rutinní kultivační vyšetření moči pomůže zmapovat stav rezistence v dané oblasti a pomůže ve výběru dalšího antibiotika při případném selhání empirické léčby [11].
Farmakokinetika
Obecně platí, že pro léčbu nekomplikovaných infekcí dolních cest močových (cystitidy) je třeba volit léky, které se dostatečně koncentrují v moči, ale jejichž vysoké sérové hladiny a spolehlivá tkáňová dostupnost nejsou nezbytné. Téměř vždy se jedná o perorální přípravky. Malá část antibakteriálních léků je díky farmakokinetickým vlastnostem (vysoká koncentrace v moči, omezená tkáňová distribuce) určená právě pro léčbu těchto močových infekcí (nitrofurantoin). Naopak pro léčbu komplikovaných infekcí a infekcí horních močových cest postihujících ledvinný parenchym a rovněž v případě bakteriemie je nezbytné použít přípravky se spolehlivým systémovým účinkem a podle závažnosti infekce alespoň v iniciální fázi léčby v parenterální formě.
U pacientů s ledvinným selháním je nezbytná úprava dávek a dávkovacího intervalu především u léků, které jsou primárně vylučovány renální cestou, a nemohou být eliminovány jiným způsobem. Pokud se jedná o koncentrační poruchu ledvin, může docházet k selhání antibakteriální léčby na podkladě nedostatečných hladin antibiotik v moči, a tím omezeným možnostem eradikace močového patogenu (aminoglykosidy).
Aktivita antibakteriálních přípravků může být do jisté míry ovlivněna pH moči, a nemusí tak odpovídat stanoveným hodnotám MIC (minimální inhibiční koncentrace v mg/l).
Alkalizace např. zvyšuje účinnost aminoglykosidů a benzylpenicilinu, acidifikace zvyšuje aktivitu tetracyklinů a nitrofurantoinu [9,12].
Akutní cystitida u žen
Akutní cystitida postihující převážně ženy je nejčastějším důvodem léčby infekcí močového systému. Nejfrekventovanějším původcem je E. coli. Podle současných znalostí je doporučována zejména u dospělých zdravých žen krátkodobá 3denní léčba (s výjimkou nitrofurantoinu), jejíž účinnost je srovnatelná se 7denním i vícedenním podáváním. 3denní terapie významně snižuje výskyt nežádoucích účinků a současně omezuje selekční tlak vedoucí ke vzniku a šíření rezistence. Jednorázové podání již není doporučováno, protože bývá spojeno s vyšším počtem selhání léčby (tab. 3). Léčebný přístup k relapsům má komplexní charakter a může zahrnovat i dlouhodobou (několikatýdenní) aplikaci antibiotik.
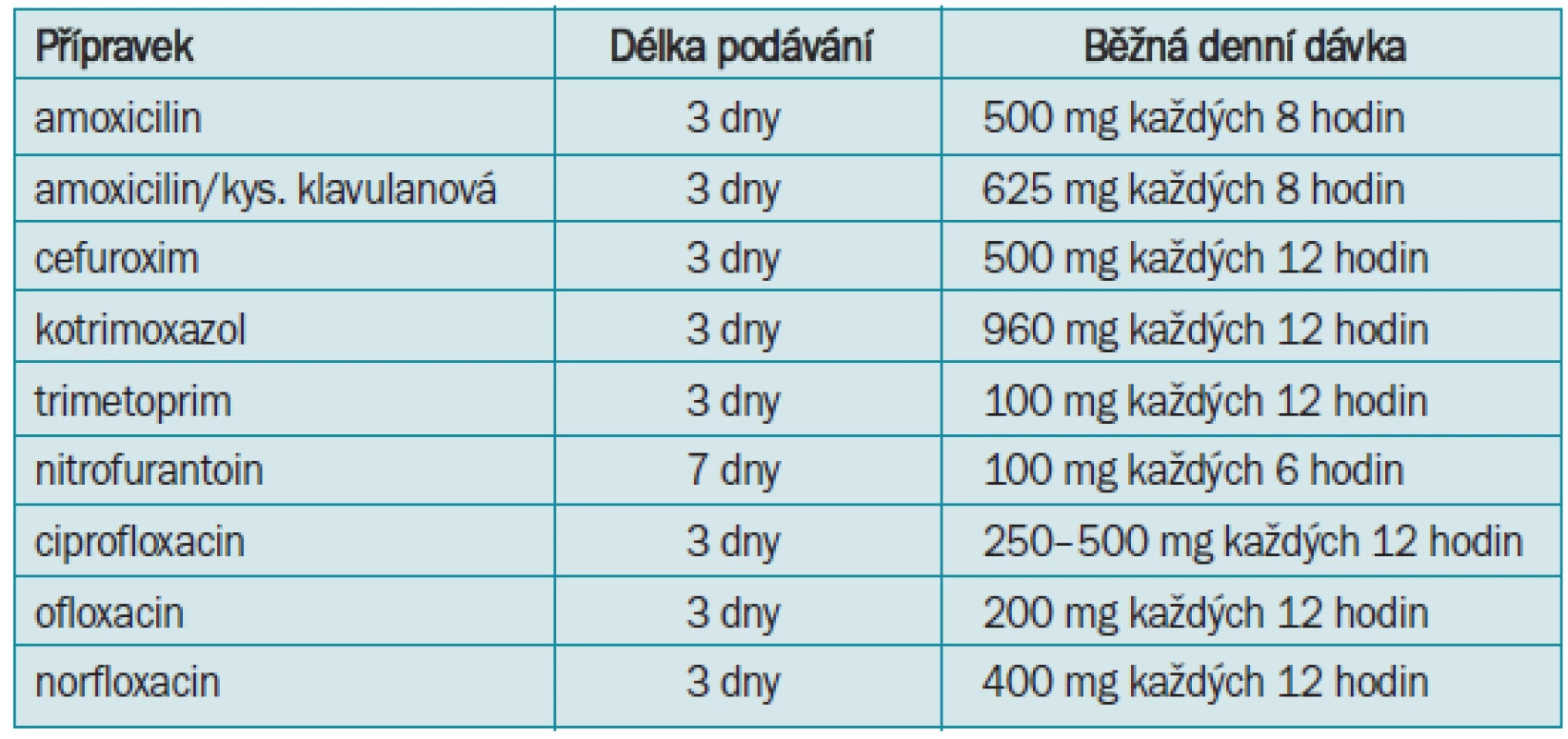
Standardní 7–10denní terapie cystitidy je určena pro pacientky s opakovanými IMC a se souběžnými komorbiditami (diabetes, kortikoterapie, onkologická onemocnění). Prolongovaná léčba, zejména subinhibičními dávkami antibiotik (podávány v jedné dávce 1 tbl kotrimoxazolu, nebo 1 tbl nitrofurantoinu na noc) má velmi dobrý efekt při chronických zánětech s intermitentními exacerbacemi. Principem postkoitální profylaxe je vymočit po styku obsah měchýře a podat subinhibiční dávku antibiotika, která potlačí exponenciální růst mikroorganizmu. Předpokládá se dostatečný pitný režim.
Je-li původcem Staphylococcus saprophyticus, je doporučováno 7denní podávání bez ohledu na typ zvoleného antibiotika.
Optimální léčba by měla vycházet z bakteriologického nálezu a antibiogramu. V případě empirického podání připadají v úvahu aminopeniciliny, případně kombinované s inhibitory ß-laktamáz, dále trimetoprim, kotrimoxazol, nitrofurantoin. Fluorochinolony mají své místo v empirické léčbě pouze v těch případech, v nichž nelze z nějakého důvodu (vysoká hladina rezistence k ostatním antibiotikům, alergie, případně jiné vedlejší účinky) použít některou z výše jmenovaných skupin, v žádném případě by neměly být lékem první volby [9,11,16].
Aminopeniciliny - z hlediska biologické dostupnosti je výhodnějším lékem amoxicilin, jehož vstřebávání je po perorální aplikaci vyšší než u ampicilinu a resorpce je méně ovlivňována potravou. Nevýhodou je poměrně vysoká rezistence, která dosahuje dle dat NRL u E. coli průměrně 36 %, proto by měl být podáván pouze na základě potvrzené citlivosti in vitro [13].
Hlavním mechanizmem rezistence k aminopenicilinům je produkce ß-laktamáz typu TEM1,2. Proto v oblastech se zvýšenou hladinou rezistence k aminopenicilinům lze k empirické léčbě použít aminopenicilinů chráněných inhibitory ß-laktamáz (ampicilin/sulbaktam, amoxicilin/kyselina klavulanová). Výhodou je vysoká aktivita na kmeny enterokoků.
Perorální cefalosporiny 1. a 2. generace (např. cefalexin a cefuroxim) jsou určitou alternativou k aminopenicilinům s tím rozdílem, že neinhibují kmeny enterokoků. Cefalosporiny 2. generace mají v oblasti gramnegativních bakterií širší spektrum účinnosti a vyšší stabilitu k účinku běžných typů ß-laktamáz.
Podle některých autorů je skupina aminopenicilinů a cefalosporinů v léčbě močových infekcí méně účinná než kotrimoxazol, nitrofurantoin a fluorochinolony [7,16]. Kotrimoxazol (trimetoprim/sulfamethoxazol) nebo trimetoprim patří k velice účinným lékům jak pro cílenou, tak pro empirickou léčbu. Limitem empirické léčby je hladina rezistence, která by v dané lokalitě neměla přesahovat 10–20 %. Průměrná incidence rezistence k E. coli je v ČR 17,4 % [13].
Nitrofurantoin patří u močových infekcí k nejúčinnějším. Průměrná rezistence u E. coli je v ČR 1,7 %. Naopak Proteus mirabilis je k nitrofurantoinu primárně rezistentní.
Aplikace nitrofurantoinu by měla být 7denní a ve vyšších věkových skupinách by se neměl běžně podávat pro zvýšené riziko plicních nežádoucích účinků.
Chinolony jsou chemoterapeutika, jejichž antibakteriální aktivita patří u močových infekcí k nejvyšším a je srovnatelná s kotrimoxazolem. Bakteriální kmeny rezistentní ke starším chinolonům (kyselině nalidixové a oxolinové) mohou být zkříženě rezistentní i k moderním fluorovaným chinolonům (ciprofloxacin, ofloxacin), případně při terapii může vzniknout rezistence velice rychle. V současné době je rezistence ke kyselině nalidixové u E. coli 6,2 % a u Proteus mirabilis 12,1 % [9,13].
V našich podmínkách by měly fluorochinolony zůstat nadále rezervními léky určenými pro nemocniční léčbu komplikovaných infekcí nebo infekcí vyvolaných multirezistentními kmeny. Jejich paušální používání v terénu může vést k výrazné selekci a šíření rezistence jak u močových, tak i ostatních, především respiračních patogenů [9,11,14,15]
Akutní cystitida u mužů
U mužů není doporučováno krátkodobé podávání antibiotik. Léčba i nekomplikované akutní cystitidy by měla trvat 7 dní. Prodloužená léčba je odůvodněna menším nebezpečím vzniku prostatitidy. Časný relaps cystitidy svědčí pro fokus infekce v prostatě. Léčba by měla být vždy cílená [9,16].
Prostatitida
Průnik většiny antibakteriálních léků do prostaty je za normálních okolností omezený. Akutní forma vyžaduje intenzivní, nejlépe parenterální léčbu po dobu minimálně 2 týdnů. K léčbě jsou vhodné aminopeniciliny s inhibitory ß-laktamáz, cefalosporiny vyšších generací, kotrimoxazol, aminoglykosidy v kombinaci s ß-laktámovými antibiotiky a fluorochinolony. Předpokládá se, že v době akutního zánětu je tkáňová dostupnost dostatečná. U chronických infekcí by měly být i bez známek přítomnosti akutního zánětu preferovány léky se spolehlivým účinkem. Jako spolehlivé se uvádí kotrimoxazol, trimetoprim a fluorochinolony. Celková léčba u chronické prostatitidy se prodlužuje na 4–6 týdnů, případně déle [9,17].
Epididymitida a orchitida
Mezi bakteriální původce epididymitidy u dospělých patří nejčastější močové patogeny a Chlamydia trachomatis. V empirické léčbě mají z hlediska spektra účinku a farmakokinetiky důležité postavení fluorochinolony. Pokud jde o laboratorně potvrzenou chlamydiovou infekci, je lékem volby doxycyklin v dávce 200 mg denně po dobu nejméně 2 týdnů. Další alternativou jsou makrolidová antibiotika (erytromycin, spiramycin, roxitromycin, klaritromycin) se stejnou délkou podávání jako fluorochinolony a doxycyklin [9].
Uretritida
U gonokokových infekcí je lékem volby ceftriaxon, případně fluorochinolon. Léčba by měla být vždy podložena laboratorním vyšetřením citlivosti vzhledem k významnému nárůstu rezistence Neisseria gonorrhoeae. Fluorochinolony jsou kontraindikovány u osob pod 17 let, u těhotných a u matek během kojení (tab. 4). V případě chlamydiové infekce, která může být spojena s gonokokovou, je lékem volby doxycyklin nebo makrolidy (tab. 5). Při selhání je třeba zvážit účast Trichomonas vaginalis a Mycoplasma sp., a podat kombinaci metronidazolu 2 g jednorázově a erytromycinu 500 mg po 6 hodinách nebo jiného makrolidu po dobu 7 dnů.

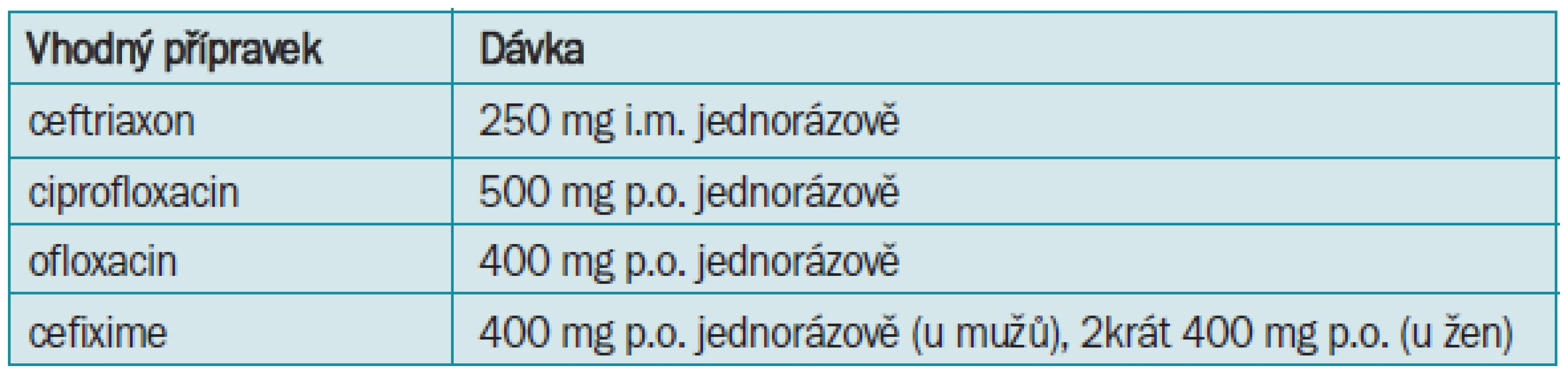

Při infekci Ureaplasma urealyticum se předpokládá citlivost k doxycyklinu, možno použít i makrolidy [9].
Akutní pyelonefritida
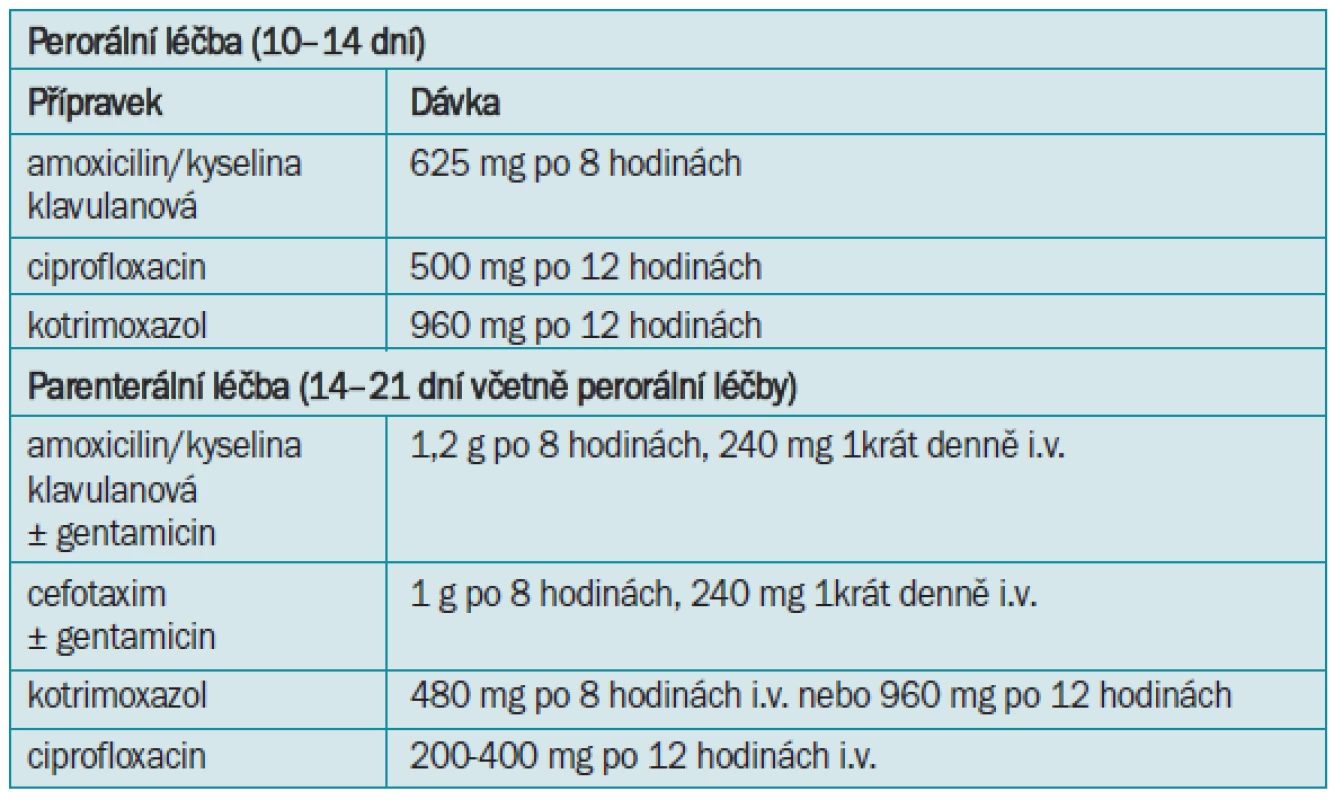
Spektrum původců je shodné jako u akutních cystitid. Délka podávání antibiotik je delší, minimálně 10–14 dnů. U těžších forem, které jsou indikovány k hospitalizaci, a u rekurentních infekcí je vhodné zahájit léčbu parenterální aplikací antibiotik a podle dalšího průběhu případně pokračovat perorálními formami (tab. 6). Pokud není dosaženo negativního bakteriologického nálezu do 48 hodin, nebo není alespoň signifikantně snížena bakteriurie, je třeba změnit léčbu na podkladě aktuálního bakteriologického nálezu [9].
Komplikované uroinfekce
Vedle klinických a laboratorních nálezů jsou pro racionální léčbu nezbytná bakteriologická vyšetření a na jejich základě cílená léčba. Délka antibiotické terapie by měla podle typu a závažnosti trvat alespoň 2 týdny [16].
Nozokomiální infekce
Nejčastějšími původci jsou enterobakterie (E. coli, Klebsiella sp, Enterobacter sp., Proteus sp.,) Ps. aeruginosa, Acinetobacter sp., Serratia sp., enterokoky, případně i kvasinky. Výskyt a citlivost na antibiotika těchto nozokomiálních kmenů je velice rozdílný a liší se nejen v rámci republiky, ale i v rámci jednotlivých zdravotnických zařízení. Velkým terapeutickým problémem se stávají multirezistentní kmeny, enterobakterie s tvorbou širokospektré ß-laktamázy (ESBL), enterokoky s rezistencí k vankomycinu a stafylokoky s rezistencí k oxacilinu. Pro efektivní řešení těchto závažných situací je nezbytná spolupráce kliniků, nemocničních epidemiologů, mikrobiologů, antibiotického střediska, případně dalších odborností. U pacientů s renální insuficiencí je nutné se vyvarovat nefrotoxických léků (např. aminoglykosidů) a přizpůsobit dávkování podle stupně poruchy ledvinných funkcí snížením dávky, eventuálně prodloužením intervalu podávání.
Pro zahájení antibiotické léčby u pacientů se zavedeným močovým katétrem je nezbytné odlišit kolonizaci katétru od infekce. Při léčbě katetrových infekcí je třeba počítat s přítomností biofilmu, který ztěžuje možnost eradikace infekce a nutí k odstranění nebo výměně katétru. Přetrvávání kandidurie i po odstranění nebo výměně katétru svědčí pro systémovou mykotickou infekci [9].
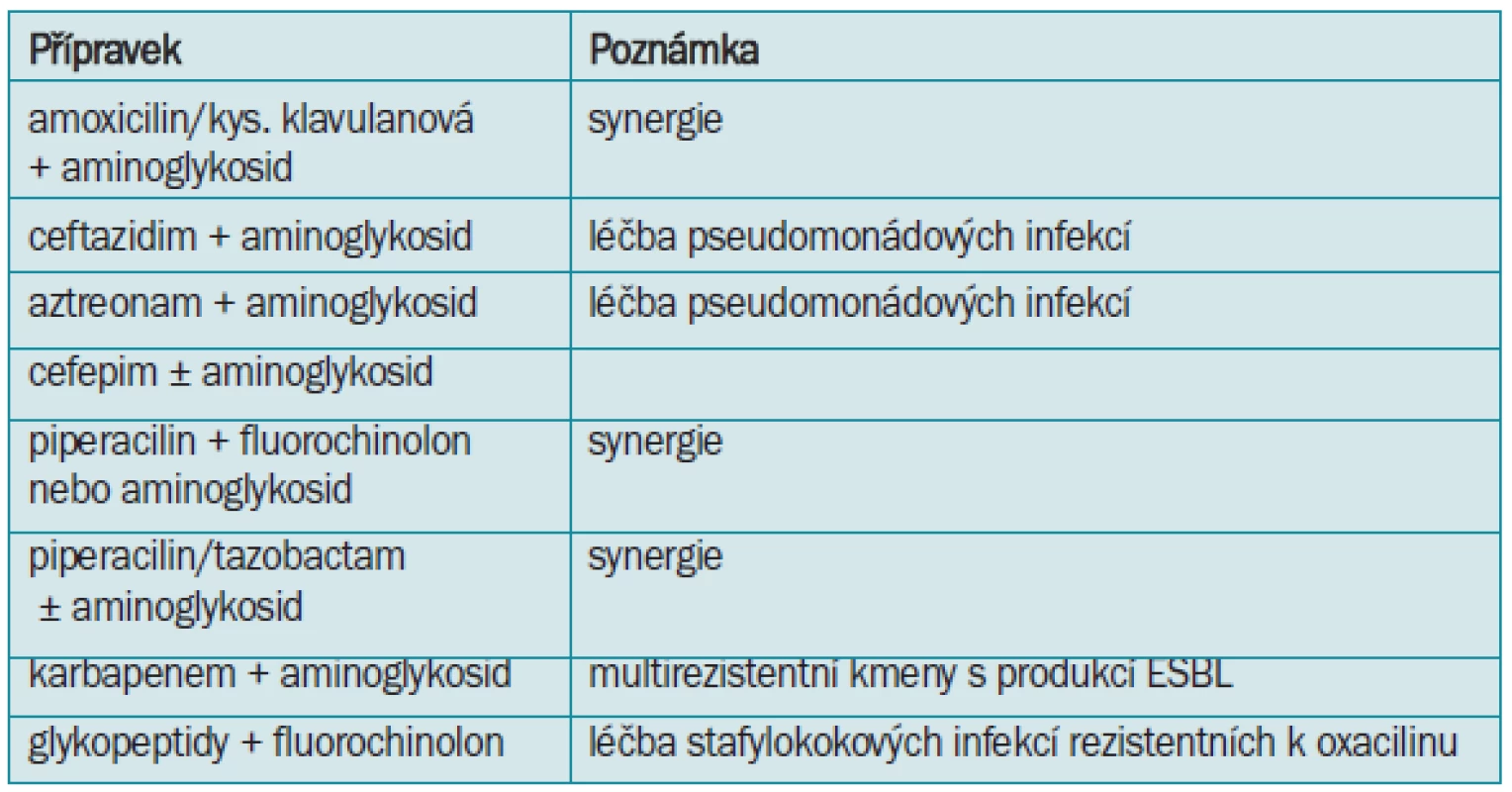
Urosepse
Původcem urosepse může být kterýkoliv bakteriální kmen způsobující IMC. Velice často se daří prokázat stejného původce v moči i v hemokultuře. Předpokladem úspěšné léčby je cílená a intenzivní parenterální antibiotická terapie jedním lékem nebo kombinací léků. S terapií nelze čekat na výsledky bakteriologického vyšetření. Při volbě antibiotika je nutné posoudit, zda se jedná o komunitní, či nozokomiální infekci a v případě nozokomiální infekce vzít v úvahu aktuální stav fenotypu rezistence na oddělení a před nasazením antibiotické terapie odebrat materiál na kultivaci (moč, nejméně 2 hemokultury, případně materiál z jiného místa podezřelého ze zdroje infekce). Dávkování se volí maximální s ohledem na funkci ledvin. Při jejich snížené funkci je třeba dávky redukovat, případně prodlužovat interval podávání (tab. 7) [9].
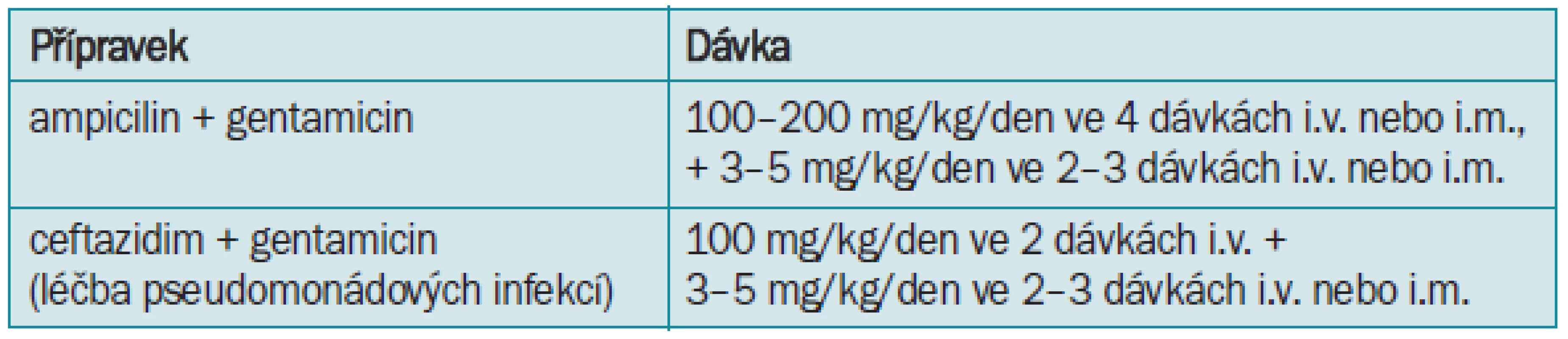
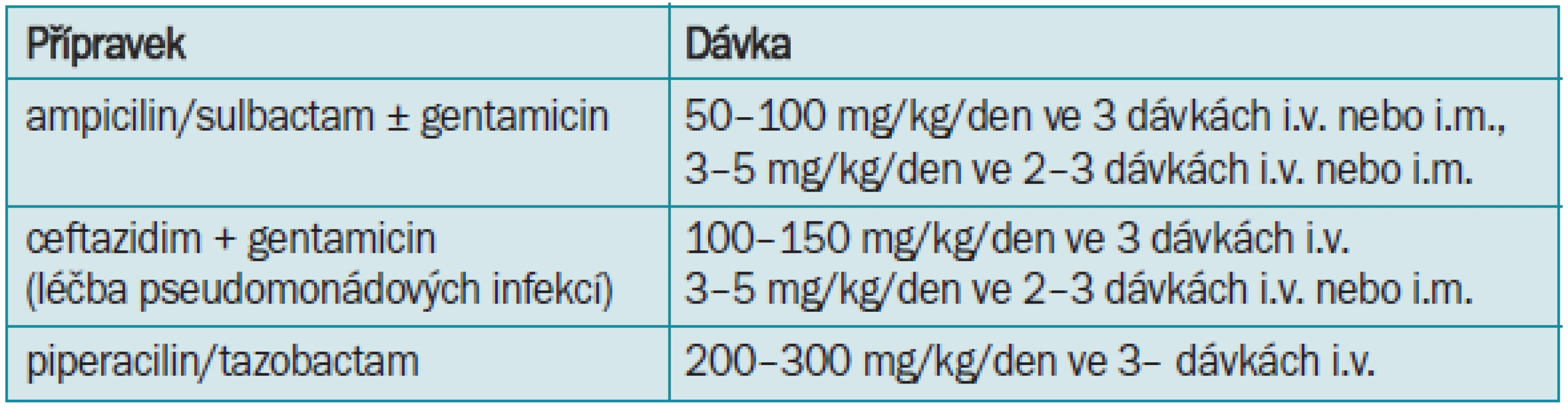
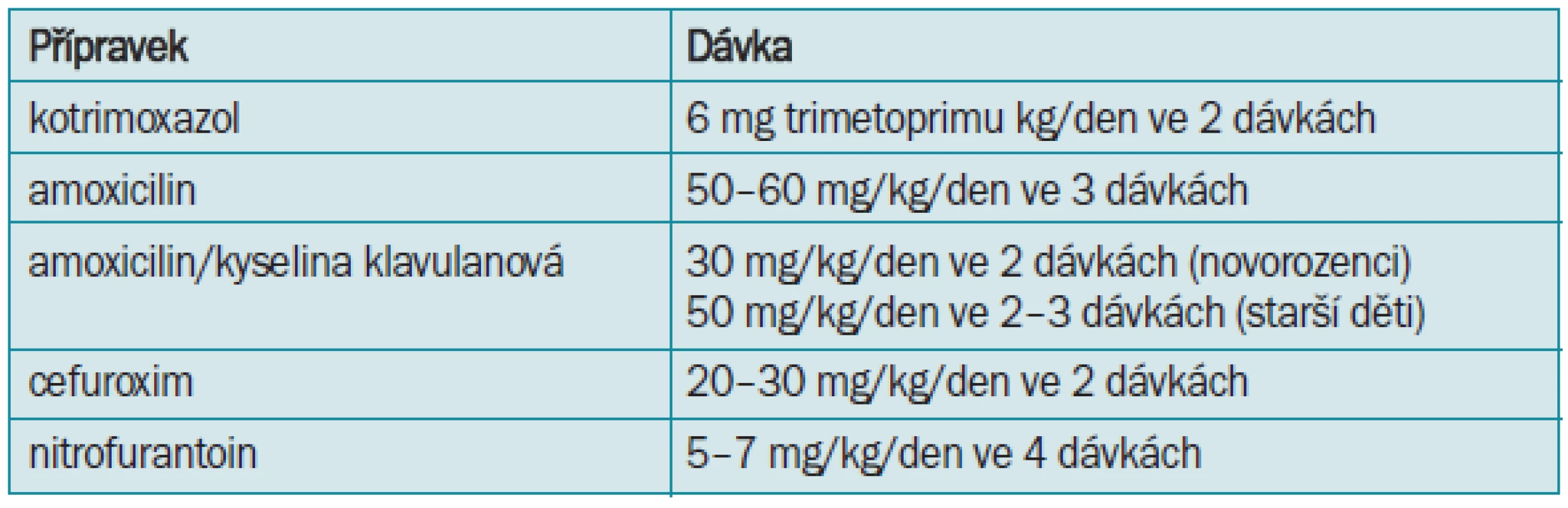
Léčba uroinfekcí v dětském věku
Krátkodobá 3denní antibiotická terapie není v dětském věku považována za dostatečnou. Podle závažnosti a typu infekce je preferováno 7–10denní podávání.
U novorozenců jsou kontraindikovány rifampicin a sulfonamidy, a po celý dětský věk fluorochinolony pro svůj negativní vliv na růstovou chrupavku, a tetracykliny pro negativní vliv na zubní sklovinu (tab. 8,9,10). V současnosti převládá názor, že stejně jako u dospělých je lépe asymptomatickou bakteriurii bez průvodní pyurie neléčit. Léčba vede k selekci rezistentních kmenů a některé studie ukazují, že může zvýšit riziko vzniku pyelonefritidy. Pokud je pyurie přítomna, doporučuje se léčba jako u cystitidy. Při opakovaných IMC lze doporučit i u dětí imunoterapii podáváním Urovaxomu.
Léčba uroinfekcí v graviditě
V těhotenství je nutno přeléčit nejen symptomatické, ale i asymptomatické bakteriurie. Léčba asymptomatické bakteriurie v těhotenství snižuje riziko pyelonefritidy. Bakteriurie může být spojena s nižší porodní váhou novorozence, zkrácením gestace a vyšší novorozeneckou mortalitou. Antibakteriální léčba by měla být kauzální v délce 7 dnů.
Antibiotika vhodná v těhotenství: aminopeniciliny, aminopeniciliny s inhibitory, cefalosporiny 2. a 3. generace, případně v kombinaci s aminoglykosidy.
Antibiotika kontraindikovaná v těhotenství: fluorochinolony, tetracykliny, trimetoprim, sulfonamidy, kotrimoxazol [9].
ZÁVĚR
Většina nekomplikovaných infekcí dolních cest močových je dobře léčitelná, avšak stoupající rezistence na antibiotika komplikuje léčbu rekurentních infekcí, komplikovaných cystitid a pyelonefritid. Velkým problémem se stává u nozokomiálních infekcí. Uvážlivý výběr antibiotika první volby u nekomplikovaných cystitid a cílená terapie komplikovaných a nozokomiálních infekcí jsou nezbytné podmínky pro zachování účinnosti antibakteriálních léků.
prim. MUDr. Alena Ševčíková
Oddělení klinické mikrobiologieLF MU a FN Brno
prof. MUDr. Pavel Ševčík, CSc.
Anesteziologicko-resuscitační klinika LF MU a FN u sv. Anny v Brně
Sources
1. Teplan V. Úvod do problematiky. In: Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest. Praha: Grada Publishing 2004 : 15-16.
2. Bartoníčková K. Uroinfekce. Praha: Galén 2000; 8. vol.
3. Alvarez-Rocha L, Rascado-Sedes P, Castro-Orjales MJ. Urinary tract infections. In: Rello J, Valles J, Kollef M (eds). Boston Critical Care Infectious Diseases. Boston: Kluwer Academic Publishers 2001 : 731-748.
4. Bébrová E. Mikrobiologické aspekty patogeneze infekcí močových cest. In: Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest. Praha: Grada Publishing 2004 : 31-44.
5. Kantele A, Möttönen T, Ala-Kaila K, Arvilommi HSP. Fimbria-specific B cell responses in patients with urinary tract infection. J Infect Dis 2003; 188 : 1885-1891.
6. Votava M. Lékařská mikrobiologie obecná. 1. ed. Brno: Hortus 2000.
7. Förstl M, Kolářová L, Veselský Z, Macek P, Dvořák P. Schistosomóza (Bilharzióza) močového traktu. Urologie pro praxi 2003; 4(1): 8-10.
8. Förstl M, Kolářová L, Konštacký M, Veselský Z, Macek P, Dvořák P. Riziko importu schistosomózy (bilharziózy). Interní medicína pro praxi 2003; 5(2): 57-60.
9. Bébrová E. Bakteriologická diagnostika infekce močových cest, racionální léčba antibiotiky a chemoterapeutiky. In: Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest. Praha: Grada 2004 : 45-62.
10. Alves LS, Assis BP, Rezende MM. Schistosomal epididymitidis. Int Braz J Urol. 2004; 30 : 413-415.
11. Kolář M. Klinicko-mikrobiologické podklady racionální antibiotické léčby. Praha: Trios 2002.
12. Wagenlehner FM, Naber KG. Antibiotic treatment for urinary tract infections: pharmacokinetic/pharmacodynamic principles. Expert Rev Anti Infect Ther 2004; 2 : 923-931.
13. Urbánková P. Pracovní skupina pro monitorování rezistence NRL pro antibiotika. Rezistence nejčastějších původců komunitních močových infekcí v ČR v roce 2001.
14. Lacombe K, Cariou S, Tilleul P, Offenstadt G, Meynard JL. Optimizing fluoroquinolone utilization in a public hospital: a prospective study of educational intervention. Eur J Clin Microbiol Infect Dis 2005; 24(1): 6-11.
15. Hooton TM, Besser R, Foxman B, Fritsche TR, Nicolle LE. Acute Uncomplicated Cystitis in an Era of Increasing Antibiotic Resistance: A Proposed Approach to Empirical Therapy. Clin Infect Dis 2004; 39 : 75-80.
16. Hummers-Pradier E, Ohse AM, Koch M, Heizmann WR, Kochen M. Urinary tract infection in men. Int J Clin Pharmacol Ther 2004; 42 : 360-6.
17. Members of the UTI Working Group EAU. Guidelines for the Management of Urinary and Male Genital Tract Infections. Eur Urol 2001; 40 : 576-588.
18. Members of the ECLM and ESMID Working Party. Articles European Urinalysis Guidelines: Summary. Scand J Clin Lab Incest 2000; 60(4 Suppl): 231.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2005 Issue 2
-
All articles in this issue
- Non- complicated uroinfections - what is new and what has changed
- COMPLICATED UROINFECTIONS: WHAT IS NEW AND WHAT HAS CHANGED
- URINARY TRACT INFECTIONS IN CHILDREN AND DURING PREGNANCY
- Mycotic infections
- Urogenitary tuberculosis early the third century
- Sexually transmitted disease from the urologist's point of view
- CHRONIC PELVIC PAIN
- Septic shock at uroinfections
- The principles of antimicrobial treatment in uroinfections
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Mycotic infections
- URINARY TRACT INFECTIONS IN CHILDREN AND DURING PREGNANCY
- Septic shock at uroinfections
- Non- complicated uroinfections - what is new and what has changed
