Místo a rozsah lymfadenektomie u pacientů s nádory močového měchýře
The role and the extent of lymphadenectomy in patients with bladder cancer
The pelvic lymph nodes represent the primary metastatic site in bladder carcinoma. The risk of lymph node involvement is increasing depending on the depth of tumor invasion into the bladder wall. Prognosis depends on the extent of lymph node involvement. The lymph node density (including not only the number of positive nodes but also the number of removed nodes) is considered to be the most important prognostic factor.
Pelvic lymphadenectomy is the most reliable staging procedure. Retrospective evaluations show the possible therapeutic benefit of the removal of more nodes; however the consensus concerning the extent of lymphadenectomy has not been achieved yet. Most authors recommend meticulous pelvic lymphadenectomy up to the common iliac bifurcation.
Key words:
bladder tumors, cystectomy, lymphadenectomy, lymph node density
Authors:
M. Babjuk
Published in:
Urol List 2008; 6(2): 32-35
Overview
Karcinomy močového měchýře metastazují lymfatickou cestou do pánevních uzlin. Riziko postižení stoupá v závislosti na hloubce invaze lokálního tumoru v měchýři. Prognóza je poměrně variabilní a závisí na rozsahu uzlinového postižení. Za nejpřesnější prognostický faktor je považována tzv. uzlinová denzita (lymph node density = LND), která bere v úvahu nejen počet pozitivních, ale i počet odstraněných uzlin.
Nejspolehlivější metodou umožňující přesné posouzení stavu pánevních lymfatických uzlin je pánevní lymfadenektomie. Retrospektivní hodnocení ukazuje možný terapeutický benefit při větším počtu odstraněných uzlin, jednoznačný konsenzus ohledně rozsahu lymfadenektomie však přijat nebyl. Většina autorů doporučuje provedení pečlivé pánevní lymfadenektomie až k bifurkaci společných ilických cév.
Klíčová slova:
nádory močového měchýře, cystektomie, lymfadenektomie, uzlinová denzita
ÚVOD
Radikální cystektomie je v současné době považována za standardní způsob léčby lokálně pokročilých nádorů močového měchýře vzhledem k nízké mortalitě, dobrým onkologickým výsledkům a vynikající lokální kontrole onemocnění. U nádorů s extravezikálním šířením (T3, T4) a v případě uzlinového postižení však nejsou dosažené výsledky uspokojivé, když přežívá jen zhruba třetina pacientů. Cílem je proto optimalizovat léčebné postupy v těchto situacích. Kromě širší aplikace systémové chemoterapie je naše snaha zaměřena i na zdokonalení chirurgické techniky s cílem dosažení maximální radikality. Významným bodem je zde otázka terapeutického významu lymfadenektomie, respektive jejího optimálního rozsahu.
JAK ČASTÉ JE UZLINOVÉ POSTIŽENÍ U NÁDORŮ MĚCHÝŘE?
Karcinomy močového měchýře metastazují lymfatickou cestou do pánevních uzlin. Lokalizace primárně postižených uzlin je variabilní a závisí na umístění nádoru v močovém měchýři. Primární metastatická ložiska tak můžeme najít v oblasti zevních, vnitřních a společných ilických uzlin, respektive v obturatorních nebo presakrálních uzlinách.
Odhadujeme, že až polovina pacientů s invazivními nádory má již přítomné metastázy v lymfatických uzlinách. Procento prokázaných případů samozřejmě závisí na pečlivosti a rozsahu provedené lymfadenektomie. V našem souboru 220 nemocných stoupl počet pacientů s uzlinovou pozitivitou po rozšíření lymfadenektomie z 19,1 na 26,9 %. Leissner v multicentrické studii zaměřené na pečlivé provedení extenzivní lymfadenektomie nalezl uzlinové metastázy u 27,9 % z 290 pacientů [1].
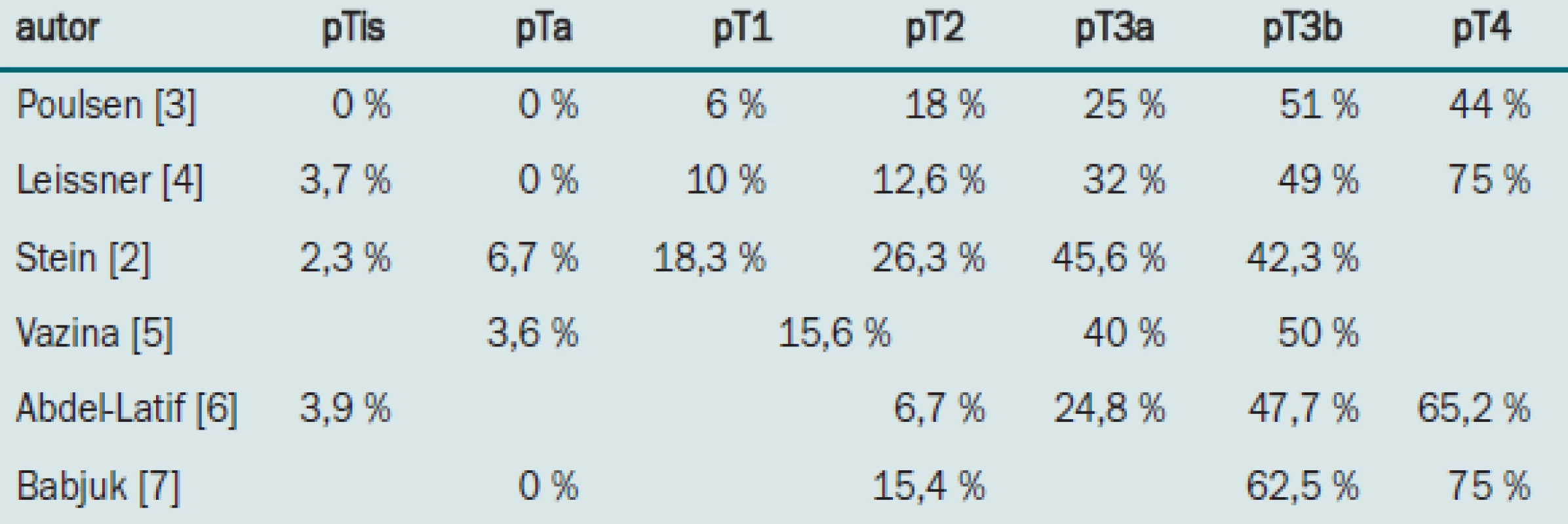
Riziko postižení lymfatických uzlin stoupá v závislosti na hloubce invaze lokálního tumoru v měchýři. Stein uvádí pozitivní uzlinový nález u 11,2 % nádorů ohraničených na stěnu měchýře a u 44,4 % malignit prorůstajících mimo měchýř [2]. Pravděpodobnost přítomnosti uzlinových metastáz v závislosti na kategorii primárního nádoru je patrná z tab. 1 [2-7].
JAKOU PROGNÓZU MAJÍ PACIENTI S UZLINOVÝMI METASTÁZAMI?
Pozitivní uzlinový nález je považován za špatnou prognostickou známku. Frazier prokázal signifikantní zkrácení průměrného přežití (median cancer-specific survival) z 9,3 roku u pacientů bez metastáz na pouhý 1 rok u nemocných, kde byla ložiska v uzlinách nalezena [8]. Dnes odhadujeme, že přežívá zhruba třetina pacientů s pozitivními uzlinami, konkrétní údaje jsou uvedeny v tab. 2 [2,3,9-11].

Prognóza pacientů s uzlinovými metastázami je však poměrně variabilní a závisí na rozsahu onemocnění. Pravděpodobnost přežití klesá se vzestupem kategorie primárního tumoru. Dle Viewega činilo 5leté přežití u nádorů ohraničených na stěnu měchýře (kategorie pTa-2b pN1-3) 52 %, zatímco u nádorů s šířením mimo stěnu měchýře (pT3a-4 N1-3) 17 % [11]. Obdobně hovoří Stein o poklesu 5letého přežití ze 46 % na 30 % při průniku primárního tumoru extravezikálně [2].
Osud pacienta je závislý hlavně na rozsahu uzlinového postižení. Vieweg uvádí 5leté přežití 44,5 % u kategorie N1 a 26,6 % u N2, přičemž u rozsáhlých nádorů N3 žádný pacient 5 let nepřežil [11].
Většina autorů však definuje rozsah uzlinového postižení počtem pozitivních uzlin. Dle Steina přežívá 10 let 41 % nemocných s maximálně 4 postiženými uzlinami oproti 24 % u postižení 5 a více uzlin [2]. Podobných výsledků dosáhl i Fleischmann, který navíc ukázal signifikantně horší prognózu v případě, že byla zachycena penetrace uzlinového pouzdra nádorem [12].
V poslední době je za nejpřesnější prognostický faktor považována tzv. uzlinová denzita (lymph node density = LND), která bere v úvahu nejen počet pozitivních, ale i počet odstraněných uzlin. Její hodnotu snadno vypočítáme stanovením poměru mezi počtem pozitivních uzlin a celkovým počtem odstraněných uzlin [13-17]. Dle Steina přežívalo 10 let bez známek onemocnění 43 % pacientů s LND pod 20 % (tedy méně než 20 % pozitivních uzlin) oproti 17 % pacientů s LND vyšším než 20 % [14].
MÁ LYMFADENEKTOMIE PROGNOSTICKÝ A TERAPEUTICKÝ VÝZNAM?
Vzhledem k nízké senzitivitě CT a NMR je lymfadenektomie v současnosti nejspolehlivější metodou umožňující přesné posouzení stavu pánevních lymfatických uzlin. Lymfadenektomie však plní kromě diagnostické i roli kurativní, protože metastázy v pánevních lymfatických uzlinách nemusí být u nádorů měchýře spojeny s přítomností vzdálených ložisek. Tato skutečnost je i jedním z argumentů podporujících rozšíření hranic lymfadenektomie.
Význam pečlivého odstranění lymfatických uzlin zdůrazňoval již Leadbetter v 50. letech minulého století a na možný terapeutický přínos upozornil před 20 lety Skinner [18]. Některé práce poukázaly na přímou souvislost prognózy onemocnění a počtu odstraněných lymfatických uzlin, a to i v případech, kdy nejsou v uzlinách přítomny metastázy. Vysvětlením může být odstranění mikrometastáz, které histologické vyšetření nedokázalo zachytit. Leissner zaznamenal vyšší pravděpodobnost přežití u operovaných, kde se podařilo odstranit více než 16 uzlin, Herr považuje za významnou hranici 9 odstraněných uzlin [4,19]. Signifikantní přínos většího počtu odstraněných uzlin pro pravděpodobnost a délku přežití prokázala i analýza dat od 1 923 pacientů z programu SEER (National Cancer Institute Surveillance, Epidemiology and End Results) publikovaná Konetym [20].
Je však třeba zdůraznit, že všechny tyto argumenty dokládající klinický přínos vyššího počtu odstraněných uzlin jsou založeny na retrospektivních pozorováních, případně na srovnání skupin pacientů operovaných v různých historických obdobích. Srovnání jednotlivých podskupin, například dle počtu odstraněných uzlin, může být zkresleno fenoménem přesunu stadií (stage migration = fenomén Willa Rogerse), který je typickým příkladem dezinterpretace výsledků nových přístupů, v tomto případě rozšíření lymfadenektomie. Další potenciální chyba hodnocení může být dána adjuvantní systémovou chemoterapií, kterou obvykle indikujeme u pacientů s pozitivními uzlinami. Se stoupajícím počtem odstraněných uzlin totiž vzrůstá šance na detekci metastáz, a tím i pravděpodobnost podání chemoterapie [21].
JAKÝ BY MĚL BÝT OPTIMÁLNÍ ROZSAH A ANATOMICKÉ HRANICE LYMFADENEKTOMIE?
V současné době neexistuje úplná shoda o anatomických hranicích lymfadenektomie. Přes výše zmíněnou absenci jednoznačných důkazů terapeutického přínosu lymfadenektomie je odstranění lipolymfatické tkáně pouze z obturatorní jámy většinou autorů považováno za nedostatečné. Hlavním argumentem je nález jediných pozitivních uzlin mimo tuto lokalizaci [1,12,22]. Dle Leissnera by při takto provedené lymfadenektomii nebyly metastázy zachyceny u 6,8 % z celkového počtu operovaných pacientů, respektive u 24,7 % ze skupiny nemocných s pozitivním uzlinovým nálezem [1].
Za standardní lymfadenektomii je dnes obvykle považováno odstranění lipolymfatické tkáně v oblasti ohraničené křížením ureteru se společnou ilickou tepnou kraniálně, laterálním okrajem zevní ilické tepny případně genitofemorálním nervem laterálně, tříselným vazem kaudálně a stěnou močového měchýře mediálně (obr. 1, 2). V případě cystektomie s kurativním záměrem musí být lymfadenektomie vždy oboustranná.
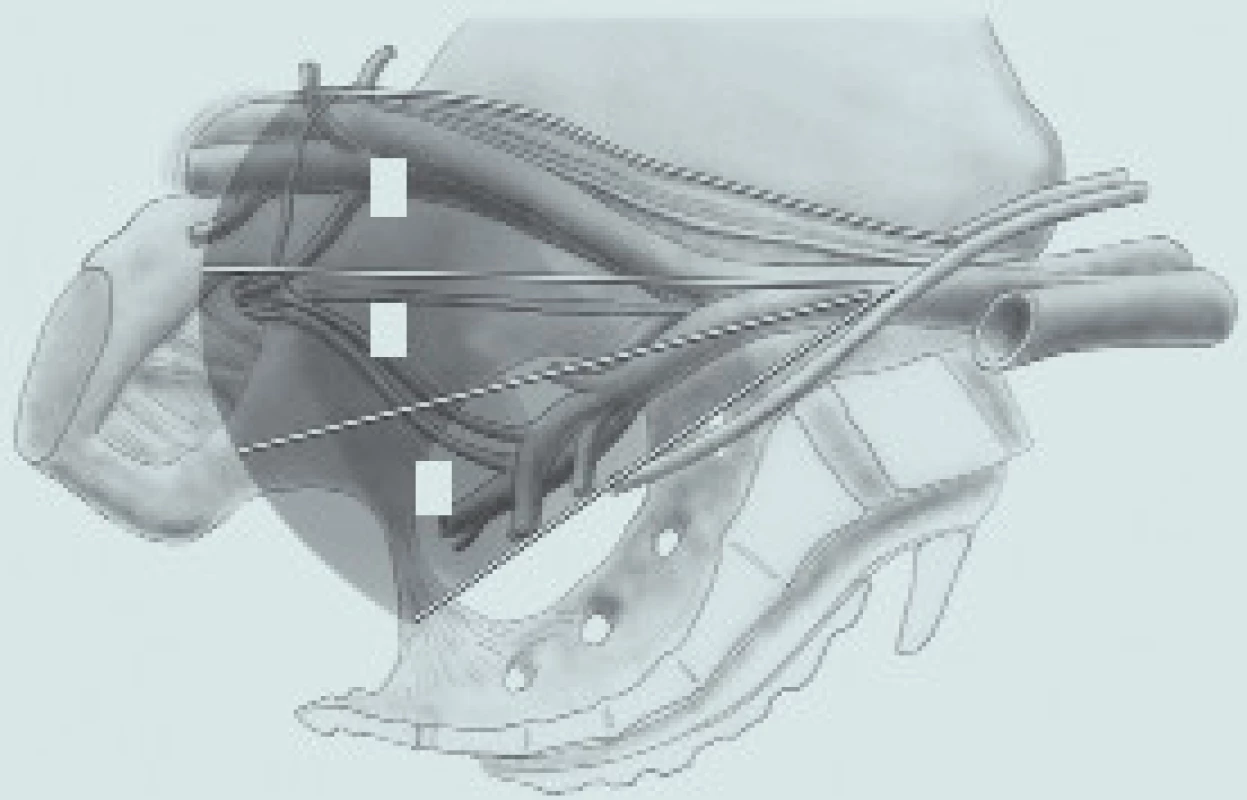
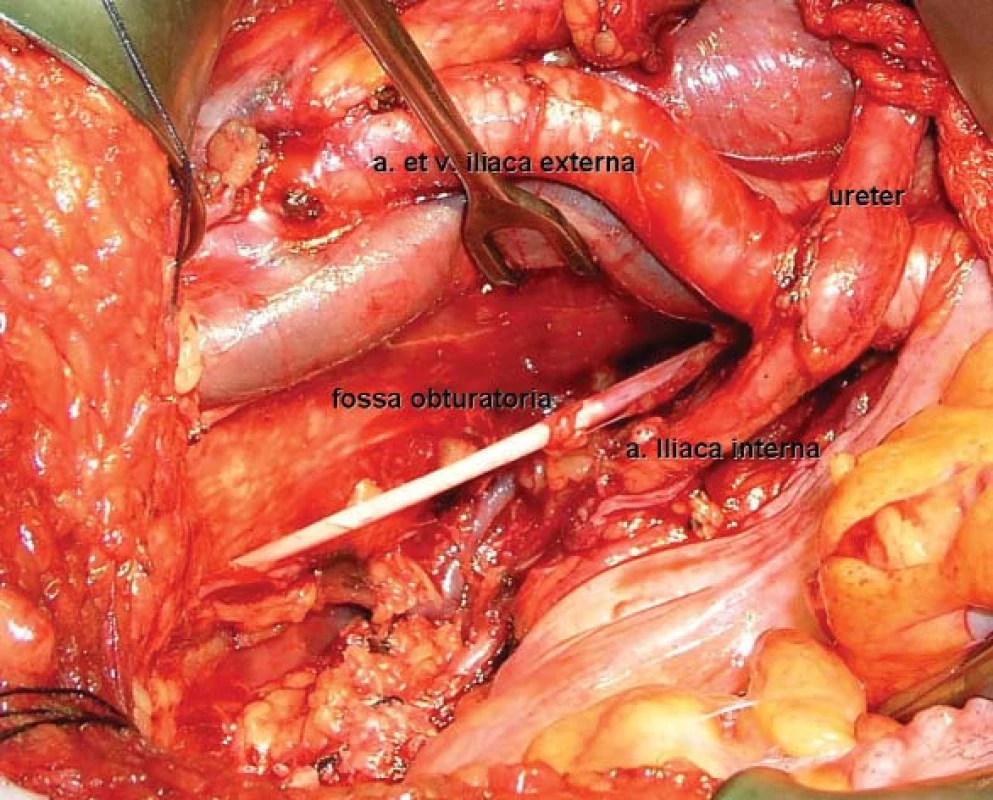
Kontroverzní je pokračování lymfadenektomie výše podél společných ilických cév případně až nad bifurkaci aorty, nejsou-li uzliny makroskopicky zvětšené. Tento postup je některými autory doporučován [1,23], protože zvyšuje pravděpodobnost záchytu metastáz, jinými je naopak onkologický přínos zpochybňován [24]. Také nesmíme zapomenout, že rozšíření lymfadenektomie nad zkřížení ilických cév s ureterem vede k poškození vegetativních nervů hypogastrické pleteně, které hrají určitou roli při dosažení kontinence u následné ortotopické derivace moči. Proto obvykle odstraňujeme tyto uzliny, stejně jako uzliny presakrální, jen v případě jejich makroskopického postižení.
JAKÉ JSOU DALŠÍ PERSPEKTIVY?
Pečlivé retrospektivní hodnocení nám v posledních letech přineslo nové poznatky, které umožňují zlepšení výsledků léčby u pacientů s uzlinovými metastázami. Přesto zůstává řada nezodpovězených otázek, a tím i úkolů do budoucna. Je třeba systematicky doplňovat naše informace o způsobu lymfatického šíření nádoru. Standardem by proto měla být důsledně prováděná lymfadenektomie dle předem daného protokolu se selektivním odstraněním uzlin z jednotlivých anatomických lokalit a jejich následným pečlivým histologickým vyšetřením.
Vliv lymfadenektomie a jejího rozsahu na přežití však bude muset posoudit prospektivní randomizovaná studie. Není pochyb o tom, že její realizace i hodnocení nebude snadné.
Ideálem do budoucna je cílené odstranění pouze pozitivních nebo spádových uzlin pro danou lokalizaci tumoru. Předpokladem první možnosti by bylo zdokonalení zobrazovacích metod, z nichž se například MR lymfografie jeví relativně perspektivně. Spádové uzliny bychom mohli identifikovat peroperačně pomocí intratumorózně aplikované radioaktivní látky, jak to některé studie naznačily [22].
doc. MUDr. Marko Babjuk, CSc.
Urologická klinika VFN a 1. LF UK Praha
Ke Karlovu 6
128 08 Praha 2
marko.babjuk@lf1.cuni.cz
Sources
1. Leissner J, Ghoneim MA, Abol-Enein H et al. Extended radical lymphadenectomy in patients with urothelial bladder cancer: results of prospective multicenter study. J Urol 2004; 171(1): 139–144.
2. Stein JP, Lieskovsky G, Cote R et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J Clin Oncol 2001; 19(3): 666–675.
3. Poulsen AL, Horn T, Steven K. Radical cystectomy: extending the limits of pelvic lymph node dissection improves survival for patients with bladder cancer confined to the bladder wall. J Urol 1998; 160(6): 2015–2020.
4. Leissner J, Hohenfellner R, Thüroff JW et al. Lymphadenectomy in patients with transitional cell carcinoma of the urinary bladder; significance for staging and prognosis. BJU Int 2000; 85(7): 817–823.
5. Vazina A, Dugi D, Shariat SF et al. Stage specific lymph node metastasis mapping in radical cystectomy specimens. J Urol 2004; 171(5): 1830–1834.
6. Abdel-Latif M, Abol-Enein H, El-Baz M et al. Nodal involvement in bladder cancer cases treated with radical cystectomy: incedence and prognosis. J Urol 2004; 172(1): 85–89.
7. Babjuk M, Hanuš T, Šafařík L et al. Radikální cystektomie u pacientů s nádory močového měchýře. Výsledky u 125 operovaných pacientů. čas Lék čes 2007; 146 : 746–760.
8. Frazier HA, Robertson JE, Dodge RK et al. The value of pathologic factors in predicting cancer-specific survival among patients treated with radical cystectomy for transitional cell carcinoma of the bladder and prostate. Cancer 1993; 71 : 3993–4001.
9. Ghoneim MA, El-Mekresh MM, El-Baz MA et al. Radical cystectomy for carcinoma of the bladder: critical evaluation of the results in 1,026 cases. J Urol 1997; 158 (2), 393–399.
10. Hautmann RE, Gschwend JE, de Petriconi RC et al. Cystectomy for transitional cell carcinoma of the bladder: results of surgery only series in the neobladder era. J Urol 2006; 176(2): 486–492.
11. Vieweg J, Gschwend JE, Herr HW et al. Pelvic lymph node dissection can be curative in patients with node positive bladder cancer. J Urol 1999; 161(2): 449–454.
12. Fleischmann A, Thalmann GN, Markwalder R et al. Extracapsular extension of pelvic lymph node metastases from urothelial carcinoma of the bladder is an independent prognostic factor. J Clin Oncol 2005; 23(10): 2358–2365.
13. Herr HW. Superiority of ratio based lymph node staging for bladder cancer. J Urol 2003; 169(3): 943–945.
14. Stein JP, Cai J, Groshen S et al. Risk factors for patients with pelvic lymph node metastases following radical cystectomy with en bloc pelvic lymphadenectomy: the concept of lymph node density. J Urol 2003; 170(1): 35–41.
15. Kassouf W, Leibovici D, Munsell MF et al. Evaluation of the relevance of lymph node density in a contemporary series of patients undergoing radical cystectomy. J Urol 2006; 176(1): 53–57.
16. Herr HW. The concept of lymf node density – is it ready for clinical practice? J Urol 2007; 177(4): 1273–1376.
17. Kassouf W, Agarwal PK, Herr HW, Munsell MF, Spiess PE, Brown GA et al. Lymph node density is superior to TNM nodal status in predicting disease-specific survival after radial cystectomy for bladder cancer: analysis of pooled data from MDACC and MSKCC. J Clin Oncol 2008; 26 : 121–126.
18. Skinner DG. Management of invasive bladder cancer: a meticulous pelvic node dissection can make a difference. J Urol 1982; 128(1): 34–36.
19. Herr HW, Bochner BH, Dalbagni G et al. Impact of the number of lymph nodes retrieved on outcome in patients with muscle invasive bladder cancer. J Urol 2002; 167(3): 1295–1298.
20. Konety BR, Joslyn SA, O´Donnell MA. Extent of pelvic lymphadenectomy and its impact on outcome in patients diagnosed with bladder cancer: analysis of data from the surveillance, epidemiology and end results program data base. J Urol 2003; 169(3): 946–950.
21. Suttmann H, Kamradt J, Lehmann J, Stöckle M. Improving the prognosis of patients after radical cystectomy. Part I: the role of lymph node dissection. BJU Int 2007; 100(6): 1221–1224.
22. Sherif A, De La Torre M, Malmström P-U et al. Lymphatic mapping and detection of sentinel nodes in patients with bladder cancer. J Urol 2001; 166(3): 812–815.
23. Bochner BH, Cho D, Herr HW et al. Prospec-tively packaged lymph node dissections with radical cystectomy: evaluation of node count variability and node mapping. J Urol 2004; 172(1): 1286–1290.
24. Abol-Enein H, El-Baz M, Abd El-Hameed A et al. Lymph node involvement in patients with bladder cancer treated with radical cystectomy: a patho-anatomical study – a single center experience. J Urol 2004; 172(1): 1818–1821.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2008 Issue 2
-
All articles in this issue
- Současná praxe při řešení povrchového karcinomu močového měchýře v Nizozemí a belgických Flandrech: průzkum
- Neinvazivní karcinom močového měchýře – kdy je indikována adjuvantní intravezikální instilační léčba a co dělat při jejím selhání?
- Postup při selhání terapie BCG u pacientů s povrchovým karcinomem močového měchýře
- Místo a rozsah lymfadenektomie u pacientů s nádory močového měchýře
- Sexuální funkce šetřící radikální cystektomie
- Komplikace spojené s cystektomií a derivací moči
- Derivace moči po cystektomii
- „Indiana pouch“ – minulost a současnost
-
TVT – nová epocha urogynekologické operativy
Současná urogynekologická operativa II
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neinvazivní karcinom močového měchýře – kdy je indikována adjuvantní intravezikální instilační léčba a co dělat při jejím selhání?
- Derivace moči po cystektomii
- Komplikace spojené s cystektomií a derivací moči
- Sexuální funkce šetřící radikální cystektomie
