Klinická praxe založená na důkazech: Úvod do problematiky pro urology
Evidence based clinical practice: an introduction for urologists
Introduction:
Evidence-based clinical practice (EBCP) has been defined as the conscientious, explicit and judicious use of the current best evidence in making decisions about the care of individual patients and refers to a broad set of principles and methods intended to ensure that medical decisions, guidelines and health policy are based on well designed studies of therapeutic effectiveness and benefit.
Methods:
This article reviews the principles and practice of EBCP using examples from the urology literature. It further provides a guide to currently available web-based EBCP resources and guidelines for urologists.
Results:
EBCP integrates a hierarchy of evidence and patient's values with the practitioner's judgment to guide decision-making for the individual patient. Important steps in the EBCP process include the formulation of an answerable question and a systematic search of the literature. In absence of pre-appraised evidence or disease-specific guidelines, the practice of EBCP relies heavily on the evaluation of the primary literature by the individual urologist. Depending upon the question domain (therapy/prevention, etiology/cause/harm, diagnosis or prognosis) and study design a given study is critically appraised for its validity, impact and applicability. Evidence is then integrated with clinical judgment and a patient's individual circumstances and preferences. Finally, the practice of EBCP includes a self-assessment of the provider's performance.
Conclusion:
Knowledge, practice, and documentation of EBCP are of increasing importance to every urologist. Urologists should embrace EBCP principles by acquiring the necessary skills to critically appraise the literature for the best evidence to apply to patient care.
Key words:
evidence-based medicine, research methodology, clinical trials, bias
Authors:
P. Dahm
Published in:
Urol List 2008; 6(4): 70-77
Overview
Úvod:
Klinickou praxi založenou na důkazech (EBCP) lze definovat jako kritickou a explicitní aplikaci nejnovějších vědeckých důkazů při péči o jednotlivé pacienty. EBCP se řídí celou řadou pravidel a metod, které si kladou za cíl zajistit, aby rozhodnutí týkající se výběru léčby, guidelines i terapeutické postupy vycházely z kvalitních studií, které přinášejí terapeutický efekt i benefit.
Metody:
Tento článek uvádí přehled pravidel a praktické aplikace EBCP s využitím příkladů z urologické literatury. Dále slouží jako jakýsi rádce pro v současné době dostupné internetové zdroje a jako guidelines pro urology.
Výsledky:
EBCP zahrnuje celý systém důkazů, charakteristiky pacientů a názory lékařů, které slouží jako rádce pro volbu postupu při léčbě jednotlivých pacientů. Nejdůležitější kroky procesu EBCP zahrnují formulaci zodpověditelných otázek a systémový průzkum literatury. Vzhledem k absenci guidelines specifických pro daná onemocnění vychází EBCP zejména z hodnocení primární literatury jednotlivými urology. U každé studie se hodnotí její validita, význam a použitelnost s ohledem na danou doménu (terapie/prevence, etiologie/příčina/poškození, diagnóza nebo prognóza) a design. Jednotlivé důkazy jsou následně zařazeny do systému na základě hodnocení klinického lékaře a preferencí a charakteristik jednotlivých pacientů. EBCP dále zahrnuje sebehodnocení jednotlivých lékařů.
Závěr:
Vědomosti, praxe a dokumentace EBCP mají pro každého urologa nesmírný význam. Urologové by si měli osvojit nezbytnou techniku kriticky hodnotit publikované údaje s cílem vybrat nejlepší důkazy, které mohou následně aplikovat při péči o pacienty.
Klíčová slova:
medicína založená na důkazech, metody výzkumu, klinické studie, předpojatá chyba
ÚVOD
Klinickou praxi založenou na důkazech (EBCP) lze definovat jako „kritickou a explicitní aplikaci nejnovějších vědeckých důkazů při péči o jednotlivé pacienty“ [1,2]. Hlavními principy EBCP jsou uvědomění si nezbytnosti důkazů, formulace jasně zaměřených a zodpověditelných otázek týkajících se konkrétního klinického problému, výběr a kritické hodnocení vhodných studií a uvážlivá aplikace nejlepších dostupných důkazů u individuálních pacientů [3].
Nejdůležitějším aspektem EBCP praxe je vyvážená aplikace důkazů, která závisí na klinických zkušenostech a rozhodnutí lékaře, charakteristikách pacienta, společenském významu a volbě nejlepších současně dostupných důkazů. Na konci každého takového cyklu lékař kriticky hodnotí celý proces, který vedl ke stanovení konečného rozhodnutí.
V tomto článku se s pomocí příkladů z urologické literatury a urologické praxe snažíme nastínit základní principy EBCP. Naleznete zde popis procesu formulace otázek zaměřených na konkrétní klinické problémy a výběru a kritického hodnocení nejlepších dostupných důkazů. Dále se snažíme ukázat, jak dané důkazy aplikovat na základě charakteristik jednotlivých pacientů a okolností volby klinického rozhodnutí. Vybrané informační zdroje mohou zájemcům dále pomoci při studiu EBCP.
PRINCIPY EBCP
EBCP jako specifický přístup k péči o pacienta se opírá o dva základní principy. První princip – důkazy jsou uspořádány hierarchicky; druhý princip – klinické rozhodnutí musí brát v potaz preference a charakteristiku pacienta a nejlepší dostupné důkazy [3].
Koncept hodnocení důkazů pomocí bodovací škály poprvé představil David Sackett se svými kolegy, kteří bodovací stupnici užívali k hodnocení klinických rozhodnutí [4]. Klinické rozhodnutí by se mělo v ideálním případě opírat o co nejvalidnější důkazy, z čehož lze vyvodit závěr, že ne všechny publikované studie jsou při klinickém rozhodování stejně vhodné [5]. Kupříkladu pozorovací studie mohou nepředvídatelným způsobem nadhodnocovat výsledný efekt léčby – výsledky těchto studií jsou méně spolehlivé než výsledky randomizovaných kontrolovaných studií. Hodnocení důkazů na základě hierarchického bodovacího systému umožní tedy klinickým lékařům utvořit si jakousi představu o tom, s jako důvěrou pohlížet na výsledky dané studie.
Systém klasifikace důkazů prodělal celou řadu úprav – nejnovější verze (květen 2001) je uveřejněna na webové stránce oxfordského Centra pro medicínu založenou na důkazech (CEBM, viz příloha). Úrovně jednotlivých důkazů jsou stanoveny na základě dotazované domény (např. terapie, prognóza, diagnóza nebo ekonomická analýza) a designu studie (tab. 1). Mezi studiemi testujícími účinnost dané léčby je v pomyslné hierarchii nejvýše řazen systematický přehled (SR) randomizovaných kontrolovaných studií (RCTs). V případě, že jsou RCTs kvalitní a neuvádějí heterogenní výsledky, je pravděpodobné, že obsahují nepředpojaté důkazy [6]. Tato „vysoká kvalita“ RCTs se týká realizace a publikace RCTs na základě kritérií definovaných skupinou CONSORT (Consolidated Standards of Reporting Trials). Nejnovější studie urologické literatury provedená Scalesem et al uvádí, že pouze 35 % v současné době publikovaných RCTs uvádí adekvátní popis randomizace a pouze 48 % uvádí adekvátní zaslepení studie [7]. Absence těchto kritérií empiricky souvisí se vznikem předpojaté chyby [8,9]. Heterogenita se týká variability nebo odlišností mezi jednotlivými studiemi s ohledem na významnost jejich výsledků [10]. Kromě jiného může být tato heterogenita způsobena odlišnou metodologií jednotlivých studií nebo rozdílnou charakteristikou pacientů, rozdílným typem léčby či rozdílnými parametry měření výsledků.

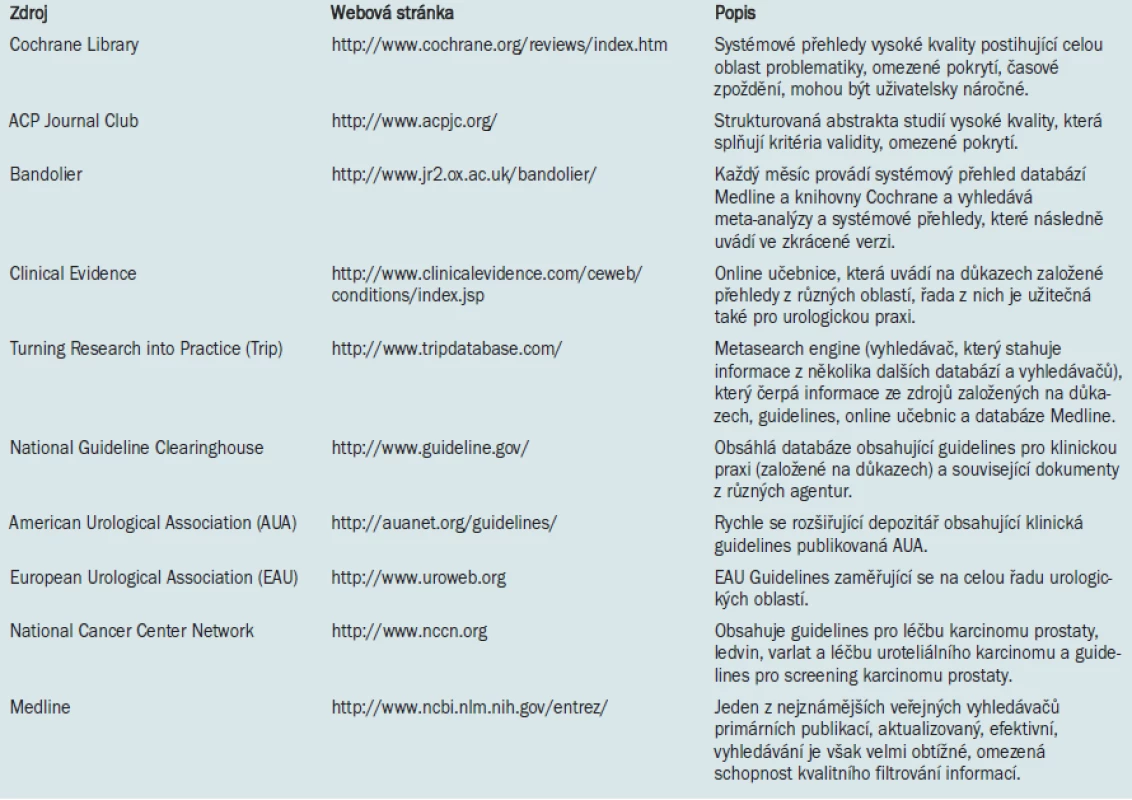
Systematické přehledy RCTs, které by mohly být přínosem pro urologickou praxi, jsou však bohužel obvykle těžko dostupné. SR navíc obvykle hodnotí zejména farmakologické terapie [11–13]. Při absenci SR jsou další nejlepší volbou pro klinické rozhodování RCTs vysoké kvality nebo dobře designované pozorovací studie zahrnující dostatečné množství konzistentních informací týkajících se účinnosti terapie.
Druhým zásadním principem EBCP je integrace charakteristik jednotlivých pacientů, okolností léčby a dostupných důkazů. Klasický příklad uvádějí Guyatt et al – pacientka s gynekologickým onemocněním v konečném stadiu, které má za následek vznik bilaterální ureterální obstrukce vedoucí k progresivnímu renálnímu selhání [14]. Ačkoliv existují důkazy prokazující, že bilaterální perkutánní nefrostomie (PCN) může zabránit renálnímu selhání a pravděpodobně prodloužit délku života pacientky, je zcela v souladu s praxí založenou na důkazech poskytnout pacientce v případě, že si nepřeje tuto operaci podstoupit, pouze podpůrnou péči. Dalším příkladem je aplikace finasteridu (inhibitoru 5-alfa-reduktázy) v rámci prevence vzniku karcinomu prostaty (KP). V průběhu sedmi let bylo při aplikaci finasteridu ve srovnání s placebem zaznamenáno 25% snížení relativního rizika vzniku KP (95% CI: 18,6–30,6%) [15]. Stejná studie však prokázala zvýšení incidence karcinomů vysokého grade (Gleasonovo skóre 7–10) ve větvi zahrnující pacienty užívající finasterid (finasterid 6,4 % vs. placebo 5,1 %). Ačkoliv příčiny a význam tohoto zjištění jsou stále předmětem diskuze, potenciálně vyšší riziko vzniku onemocnění vyššího grade může odradit pacienty od užívání finasteridu v této indikaci. Dalším znepokojivým aspektem je cena dlouhodobé aplikace finasteridu. Je tedy v souladu s praxí založené na důkazech aplikaci finasteridu u pacientů s rizikem KP nedoporučovat, navzdory vysoce kvalitním důkazům RCT prokazujícím, že finasterid je účinné chemopreventivní agens. Oba dva příklady jasně ilustrují druhý princip EBCP, že samotný důkaz bez kontextu není v žádném případě dostačující. Důkazy je třeba přizpůsobit okolnostem léčby a přáním konkrétního pacienta.
JAKÉ JSOU KROKY PRO APLIKACI EBCP V PRAXI?
Systém EBCP umožňuje lékařům najít, interpretovat a aplikovat výsledky klinického výzkumu. Tyto výsledky pak urolog v kontextu charakteristiky konkrétních pacientů a na základě svých klinických zkušeností a kvalifikace využívá při klinickém rozhodování [16]. V rámci tohoto procesu bylo definováno šest samostatných kroků (všechny začínají na písmeno A):
- Assess (hodnotit) – Posoudit nezbytnost získání dalších informací pro péči o konkrétního pacienta.
- Ask (klást dotazy) – Formulovat zodpověditelný dotaz zaměřený na konkrétní klinický problém.
- Acquire (získat) – Získat nejlepší a nejlépe dostupné důkazy umožňující zodpovězení daného dotazu.
- Appraise (ohodnotit) – Kriticky ohodnotit validitu (blízkost k pravdě), význam a přesnost (stupeň účinnosti a jistoty) a použitelnost (aplikace v klinické praxi) daného důkazu.
- Apply (aplikovat) – Výsledky předchozího kritického hodnocení posoudit v kontextu s klinickými zkušenostmi a klinickou situací a charakteristikou konkrétního pacienta.
- Assess (hodnotit) – Ohodnotit vlastní postup při provádění výše uvedených kroků a snažit se o zlepšení.
Pro účel hodnocení všech kroků EBCP procesu si představme následující klinický scénář: Vyšetřujeme 45letého muže v jinak celkově dobrém zdravotním stavu s nově diagnostikovaným konkrementem o velikosti 5 mm v největším průměru lokalizovaným v pravém distálním ureteru. Pacient si stěžuje na občasnou bolest v pravém boku, netrpí horečkou, zimnicí ani jinými symptomy, charakteristickými pro toto onemocnění. Hladina kreatininu se pohybuje v normálním rozmezí, CT sken prokáže normálně vypadající kontralaterální ledvinu.
Tento scénář může vyvolat celou řadu klinických otázek, které lze rozdělit do dvou skupin – na otázky obecné a speciální.
Obecné otázky se týkají patofyziologie onemocnění a znalostí, které lékař obvykle získá hned na počátku své profesní dráhy. Příkladem obecné otázky mohou být faktory zapříčiňující vznik nefrolitiázy. Speciální otázky se týkají znalostí nezbytných pro specifické klinické rozhodování. V námi nastíněném scénáři se může podobná otázka týkat nejvhodnější léčby pacienta s 5mm konkrementem lokalizovaným v distálním ureteru za těchto specifických okolností. Další potenciální dotazy mohou souviset s diagnostikou onemocnění (jakým způsobem nejlépe diagnostikovat konkrement lokalizovaný v distálním ureteru?), prognózou (jaký je přirozený vývoj u pacienta s ureterolitiázou?) nebo cenou terapie (která strategie nabízí optimální poměr mezi účinností a cenou?). Spolu s nabýváním klinických zkušeností budou urologové řešit zejména speciální otázky – z tohoto důvodu představují tyto dotazy jádro EBCP procesu. Dokonce i specialisté v tomto oboru budou muset aktualizovat své znalosti týkající se obecných témat.
Užitečnou mnemotechnickou pomůckou při procesu formulování zodpověditelných klinických otázek je akronym PICOS – tento akronym je tvořen prvními písmeny slov pacient (patient), intervence (intervention), srovnání (comparison), výsledek (outcome) a výzkum (study). Dotaz je třeba formulovat tak, aby umožnil výběr nejvhodnějších důkazů. Pro formulaci klinického dotazu je tedy nezbytná nejenom znalost klinického scénáře (např. dospělý muž s konkrementem lokalizovaným v distálním ureteru), ale i znalost použitelných terapeutických strategií, jako jsou například intervence a srovnání (např. aplikace alfa-blokátorů a pozorování) a výsledných parametrů (např. stone-free rate – SFR). Formát PICOS vyžaduje specifikaci designu studie, která poskytne důkazy nejvyšší úrovně. Pro otázky terapeutické účinnosti by se mělo jednat o systematický přehled s meta-analýzou několika RCTs s nízkou heterogenitou.
Příkladem PICOS dotazu může být následující: „Jaká je u pacienta mužského pohlaví s konkrementem lokalizovaným v distálním ureteru (P) účinnost aplikace alfa-blokátorů (I) ve srovnání s pozorným vyčkáváním (C) s ohledem na SFR (O) v randomizovaných kontrolovaných studiích (S)?“
ZDROJE DŮKAZŮ
Ačkoliv existuje celá řada zdrojů důkazů, které lze využít při řešení specifických klinických dotazů, zdroje důkazů využitelných v urologické praxi lze rozdělit do tří kategorií: guidelines, databáze obsahující hodnocené informace a databáze zahrnující originální publikace.
Klinické guidelines publikované profesionálními organizacemi představují pohodlný zdroj informací, které můžeme nalézt na veřejnosti přístupné webové stránce National Guidelines Clearing House. Guidelines typicky představují konsenzuální názor panelu expertů, kteří hodnotí kvalitu důkazů týkajících se konkrétního klinického problému a následně klasifikují význam doporučení pomocí bodové škály. Ačkoliv guidelines hrají v EBCP důležitou roli, mají i své nedostatky: 1. jsou příliš obecná a použitelná pouze pro ideálního „index“ pacienta s určitou klinickou charakteristikou; 2. pouze výjimečně jsou guidelines k dispozici pro všechny klinické oblasti a mezi publikací nejnovějších studií a jejich zařazením do profesionálních guidelines často uplyne dlouhý časový interval; 3. guidelines publikovaná různými organizacemi mohou uvádět různé závěry, a to dokonce i v případě, že vycházejí ze stejných důkazů (rozdíly mezi guidelines uvádějících doporučení pro PSA screening, které lze zčásti přičítat rozdílné metodologii při tvorbě doporučení). V současné době se členové jednotlivých organizací snaží při tvorbě guidelines zavádět jednotící proces.
Druhým významným zdrojem informací jsou databáze obsahující již hodnocené důkazy. Nejvýznamnější databází je Cochrane Database of Systematic Reviews (CDSR), kterou provozuje Cochrane Collaboration – mezinárodní nezisková organizace založená v roce 1993. CDSR obsahuje systematické přehledy (SRs) zaměřující se zejména na RCTs pokrývající různé oblasti medicíny. Tato databáze obsahuje také Controlled Trials Registry, který poskytuje vyčerpávající přehled RCTs týkajících se urologie i jiných oborů. Vzhledem k nedostatku dobře designovaných RCTs v jednotlivých subspecializacích operačních oborů uspokojí tyto databáze v současné době spíše internisty a lékaře primární péče. I v současné době však CDSR poskytuje SR týkající se celé řady témat užitečných pro urologickou praxi, jako jsou například PSA screening, aplikace chinolonů při léčbě nekomplikované cystitidy u žen nebo relativní benefit zavádění různých typů katétrů hospitalizovaným pacientům [20–22].
Primární literatura představuje nejdůležitější zdroj informací pro urologickou praxi založenou na důkazech. Pomocí vyhledávacích programů, jako jsou PubMed nebo OVID, mohou kliničtí lékaři vyhledávat potřebné studie z Národní lékařské knihovny (National Library of Medicine) (tab. 1). Nevýhodou primárních zdrojů informací je nutnost identifikace kvalitních studií mezi obrovským množstvím dokumentů zabývajících se konkrétním tématem. Vyhledávání lze usnadnit užíváním specifických strategií a kvalitních filtrů. Pokud například chceme vyhledat studie zabývající se problematikou léčby ureterolitiázy pomocí alfa-blokátorů, získáme při zadání hesel „ureterální konkrement“ a „alfa-blokátor“ 21 studií. V případě, že vyhledávání dále omezíme zadáním hesla „randomizovaná kontrolovaná studie“, máme k dispozici 14 studií (datum přístupu: 9/3/2006). Poté, co výše uvedeným způsobem získáme požadovaná abstrakta, zhodnotíme jejich využitelnost v našem klinickém scénáři. U požadovaných studií je nezbytné kriticky posoudit jejich validitu, význam a použitelnost.
JAK U DANÉ STUDIE POSOUDIT ÚČINNOST TESTOVANÉ TERAPIE?
Příručka pro uživatele lékařské literatury (User`s Guide to Medical Literature) doporučuje čtenáři položit si při čtení studie následující tři otázky: 1. Jsou výsledky studie validní?, 2. Jaké jsou výsledky studie? a 3. Jak mohu tyto výsledky aplikovat v rámci léčby pacienta? [3]. Všechny tyto aspekty jsou na sobě vzájemně závislé a z tohoto důvodu jsou stejně významné. Uveďme si příklad: Nebudeme přikládat význam novému orálnímu preparátu, u něhož byla prokázána velká účinnost při léčbě erektilní dysfunkce, pakliže nebudeme přesvědčení o validitě studie uvádějící tyto výsledky. Stejně je tomu i v opačném případě – dobře designovaná studie, která neprokáže klinicky signifikantní výsledky, nemá pro klinickou praxi žádný význam. Výsledky studie musí být navíc použitelné při léčbě pacientů, s nimiž se setkáváme v rámci vlastní urologické praxe, a pravděpodobný benefit léčby musí vyvážit potenciální cenu a komplikace s léčbou spojené. V případě, že studie nesplňuje poslední uvedené kritérium, validita studie ani rozsah účinnosti léčby nehrají potom žádnou roli.
Tabulka 2 uvádí přehled kritérií nezbytných pro kritické hodnocení terapie nebo preventivního opatření. Validita všech studií (včetně RCT) závisí na kvalitě užité metodologie [23,24]. Mezi nejvýznamnější kritéria procesu hodnocení studie patří randomizace a zaslepení. Náhodné rozdělení pacientů je jedním z nejdůležitějších aspektů designu klinické studie. Charakteristiky pacienta, jako jsou věk, pohlaví, stadium tumoru apod., které mohou ovlivnit výsledek terapie, jsou v jednotlivých randomizovaných skupinách procentuálně stejně zastoupeny. Cílem randomizace je vytvoření skupin pacientů se stejnou prognózou, čehož docílíme stejným zastoupením známých, ale také neznámých prognostických faktorů. Pokud bychom kupříkladu analyzovali uchované vzorky krve pacientů zahrnutých do RCT provedené v období před zavedením screeningu na PSA, zjistili bychom (v případě, že randomizace byla provedena náležitým způsobem) v jednotlivých randomizovaných skupinách podobnou distribuci PSA. Je tedy nutné zajistit adekvátní randomizaci pacientů, aniž by došlo k jejímu záměrnému nebo bezděčnému narušení.

Dalším charakteristickým znakem RCT je její zaslepení. Zaslepení studie zabraňuje vzniku předpojaté chyby, která je definována jako systematické odchýlení výsledků studie od „skutečné reality“. Zaslepení chrání před placebo efektem, vlivem doplňujících intervencí na výsledek a předpojatému hodnocení výsledků studie. Zaslepení se nevztahuje pouze na subjekt studie a výzkumníka, ale také na další úrovně zdravotnického personálu (tj. urolog, sestra, koordinátor studie) a osoby zodpovědné za hodnocení výsledků (tj. radiolog, patolog etc.). Zaslepení zdravotnického personálu je obvykle možné u studií testujících medikamentózní léčbu (např. agens pro léčbu symptomů nutkavé inkontinence), u studií zkoumajících operační procedury a zákroky (tj. KTP laserová ablace vs. TURP při léčbě obstrukční BPH) je tato možnost poněkud obtížnější. Zaslepení osob zodpovědných za hodnocení výsledků studie je možné téměř u všech typů studií. Tento postup je obzvláště důležitý ve studiích, kde hodnocení výsledku vyžaduje určitou subjektivitu (např. stanovení velikosti metastazující léze před a po léčbě ve studii zahrnující pacienty s metastazujícím karcinomem z renálních buněk). Ve studiích, v nichž lze výsledek hodnotit poměrně objektivním způsobem (např. doba do úmrtí pacienta vyvolaného všemi příčinami), nehraje zaslepení osob zodpovědných za hodnocení výsledků tak významnou roli. Doporučujeme nepoužívat termíny typu „dvojitě zaslepená“ nebo „trojitě zaslepená“, protože podobné výrazy nejsou dobře definované a jsou zavádějící [25].
Vedle randomizace a zaslepení existují další metodologické strategie ovlivňující validitu studie, jako jsou například úplnost (dostatečná doba) sledování nebo adekvátní statistická analýza. Scales et al prokázali ve své v nedávné době provedené studii (studie se neomezovala pouze na RCT) významné nedostatky týkající se adekvátnosti statistické analýzy v urologické literatuře [26]. S tímto tématem souvisí další RCTs, jejichž autoři uvádějí ekvivalentní účinnost dvou nebo více léčebných modalit, ačkoliv obě studie neměly dostatečný potenciál na to, aby vyloučily klinicky významné rozdíly mezi jednotlivými skupinami [27]. Obě studie jsou jasným důkazem toho, jak je nezbytné, aby si urologové osvojili znalost základních statistických konceptů a chyb [28].
Poté, co danou studii klasifikujeme jako validní (a tedy jako objekt hodný dalšího hodnocení), je nezbytné stanovit výsledky studie. Za významný aspekt výsledků lze považovat míru dosaženého výsledku a přesnost, se kterou byla stanovena.
Měření rozsahu účinnosti léčby závisí na typu výsledných parametrů. U výsledků, které podléhají průběžným změnám, jako např. ztráta krve v mililitrech, určíme rozsah účinnosti léčby na základě rozdílu průměrné hodnoty mezi oběma skupinami. V případě „time-to-event“ (době potřebné k dosažení výsledku) identifikuje HR (poměr rizik) zvýšení rizika související s danou expozicí. V případě, že je výsledek vyjádřen pomocí dichotomické proměnné (např. ano/ne), můžeme rozsah účinnosti vyjádřit různými způsoby – např. pomocí relativního rizika (RR), snížením relativního rizika (RRR), snížením absolutního rizika (ARR) anebo počtem pacientů vyžadujících léčbu (NNT) [29]. Příklad demonstrujeme na výsledcích RCT Dellabella et al, kteří srovnávali SFR pacientů s ureterolitiázou, kteří byli léčeni pomocí tamsulosinu, nifedipinu nebo floroglucinolu [30]. Do každé větve studie bylo zařazeno 70 pacientů a všichni pacienti podstoupili dodatečnou léčbu kortikosteroidy a antibiotiky. Uváděná míra dosáhla 3 % (2/70) ve skupině pacientů užívajících tamsulosin, 23 % (16/70) ve skupině pacientů užívajících nifedipin a 36 % (25/27) ve skupině pacientů užívajících floroglucinol. Na základě těchto údajů je relativní riziko u pacientů užívajících tamsulosin (versus floroglucinol) 8% (0,03/0,36)*100, snížení relativního rizika 92% ([0,36–0,03]/ 0,36)*100, snížení absolutního rizika 33% (0,36–0,03)*100 a NNT 3 (100/ARR). Hodnota NNT představuje pro klinické lékaře obvykle nejužitečnější údaj, protože souvisí s absolutním rizikem. Výsledky této studie by nasvědčovaly tomu, že chceme-li odstranit litiázu u jednoho pacienta, musíme 3 pacienty léčit pomocí tamsulosinu namísto floroglucinolu.
Tento rozsah účinnosti lze považovat za významný a klinicky signifikantní.
Dále je nezbytné zhodnotit přesnost rozsahu účinnosti [31]. Tuto přesnost obvykle vyjadřuje 95% CI (interval spolehlivosti). Podle paradigmatu testujícího platnost hypotézy představuje populace pacientů zařazených do studie podmnožinu všech potenciálních pacientů, a výsledek studie je tedy bodovým odhadem skutečné účinnosti v celkové populaci. Ačkoliv CI představuje jen odhadovaný údaj, často se užívá pro popis odhadovaného rozmezí hodnot, který bude pravděpodobně zahrnovat parametry neznámé populace, jako jsou např. střední hodnota, proporce, poměr rizik. Čím větší je velikost vzorku, tím užší bude CI rozsahu účinnosti. V pozitivní studii (= studii potvrzující účinnost léčby) může čtenář užívat dolní hranici CI k odhadu, zda nejmenší rozsah efektu konzistentní se studií je klinicky významný, nebo nikoliv.
V předchozím příkladu se CI pro NNT pohybuje v rozmezí 2–5. Při aplikaci výsledků této studie do praxe je tedy třeba posoudit, zda hodnota NNT = 5 opravňuje aplikaci tohoto preparátu v klinické praxi.
Po zhodnocení validity studie a jejích výsledků (rozsah a přesnost účinku) je třeba posoudit zda (a jak) lze výsledky studie aplikovat v naší konkrétní klinické situaci. Jedním z možných přístupů je posouzení, zda konkrétní pacient splňuje všechna kritéria konkrétní studie, a v případě, že nikoliv, nebrat výsledky dané studie v potaz. Parametry „skutečných“ pacientů se však s parametry uváděnými ve studiích shodují pouze výjimečně. Mnohem praktičtější je tedy posoudit, zda existuje závažný důvod, který znemožňuje aplikaci výsledků u konkrétního pacienta. Při aplikaci výsledků je také třeba přihlédnout k tomu, zda je léčba proveditelná s ohledem na dostupné zdroje. Dále je třeba zvážit pacientova očekávání týkající se nabízené léčby a možných rizik. Co se týče RCT užité v našem příkladu, je třeba zdůraznit, že tato studie srovnává účinnost tamsulosinu a floroglucinolu (tj. preparátu, který není v USA dostupný). Pacienti ve všech větvích studie navíc podstoupili systémovou léčbu steroidy, která není běžně indikována. Stručně shrnuto, EBCP namísto „slepého“ následování výsledků klinických studií vyžaduje pečlivé zhodnocení výsledků a jejich individuální aplikaci.
DISKUZE
Ačkoliv se koncepty EBCP dočkaly všeobecné podpory a jsou stále častěji začleňovány do každodenní praxe, v chirurgických oborech, jako je například urologie, jsou principy medicíny založené na důkazech pouze v počátcích [32]. Chirurgové po dlouhou dobu čelili kritice, že vědecká základna jejich oboru je poměrně chabá. Jedna starší studie uvádí, že pouze v 24 % případů byla chirurgická léčba založena na důkazech RCTs (ve srovnání s 50 % případů v obecné medicíně) [33,34]. Příčiny zjevného nedostatku báze důkazů v urologii mají své kořeny v minulosti. Na rozdíl od řady medikamentózních terapií se běžné urologické procedury, jako například radikální prostatektomie nebo veziko-ureterální reimplantace, prováděly již v době před vznikem RCT. Ačkoliv terapeutický benefit těchto zákroků byl ve své době zcela samozřejmý, obraz onemocnění, u nichž jsou tyto dvě operace indikovány, prodělal významnou změnu. Kupříkladu dramatické migrace stadií karcinomu prostaty v době PSA a zavedení silných antibiotik v rámci léčby a profylaxe refluxu u dětských pacientů si vynutily přehodnocení důkazů a léčebných postupů. Obzvláště obtížné je testovat v RCTs u dobře zavedených léčebných metod s prokázanými výsledky, které znemožňují objektivní hodnocení jejich účinnosti.
Jak pacient, tak urolog často postrádají takzvanou „rovnováhu“, tzn. neznalost týkající se benefitu určité formy léčby, která je jednou z prerekvizit pro náhodné přidělení pacientů ke dvěma nebo třem různým typům léčby [35,36].
Nové formy medikamentózní terapie, moderní zařízení a procedury však vyžadují, abychom podobné přehodnocování začlenili do každodenní praxe, a představují tedy určitou výzvu pro každodenní urologickou praxi.
Častou překážkou úspěšné implementace EBCP do urologické praxe jsou její chybná pojetí [37]. Jedním z příkladů je koncepce EBCP kladoucí rovnítko mezi EBCP a důkazy získané výhradně z RCTs. Cíl EBCP však naopak spočívá v začleňování informací z celé „hierarchie důkazů“. Ačkoliv RCTs hrají v rámci EBCP klíčovou roli, bylo by nesprávné přehlížet kvalitní pozorovací studie, které mohou sloužit jako cenný zdroj informací, zejména při hodnocení chirurgických postupů a zařízení. Odhaduje se, že pouze méně něž 40 % klinických otázek týkajících se problematiky chirurgických zákroků lze úspěšně testovat v rámci RCT (dokonce i v ideálních podmínkách s neomezenými zdroji) [36].
Druhá mylná představa spočívá v tom, že EBCP je jakousi obecnou „kuchařkou“ pro všechny subspecializace medicíny, jejíž implementace do urologie naruší nezávislost rozhodování pracovníků zdravotní péče [1,38]. Tento přehled je důkazem toho, že i tato koncepce je nesprávná. Jedním z hlavních principů EBCP je integrace přání pacienta, klinických faktorů a zkušeností urologa v rámci procesu volby vhodné léčby.
Koncepce EBCP je tak rozšířená, že urologové, kteří se chtějí orientovat v lékařské literatuře, nemají jinou možnost, než se obeznámit s terminologií a pravidly EBCP [12,39,40]. Ačkoliv nejsilnější motivací k seznámení se s principy EBCP a implementací této koncepci do běžné praxe je pro urology samozřejmě touha poskytovat svým pacientům nejlepší možnou péči, nelze opomenout ani další aspekty. Větší pozornost věnovaná bezpečnosti, kvalitě a ceně zdravotní péče má za následek vznik řady organizací, úzce souvisejících s trendem EBPC. Například sdružení „pay for performance“ (P4P) vzniklo za spolupráce CMS (Centers for Medicare), JCAHO (Joint Commission of Accreditation of Health Care Organizations), AMA (American Medical Association), AHRQ (Agency for Health Care Research and Quality) a dalších veřejných i soukromých organizací, jejichž činnost začíná nabírat na obrátkách a má potenciál restrukturalizovat systém zdravotní péče v USA [41]. P4P spojuje odměňování lékařů nejenom s výsledky, ale také s dokumentací praxe, která je v souladu s guidelines založenými na důkazech publikovaných odbornými společnostmi [42]. Snahy ABU (American Board of Urology) implementovat dokumentaci medicíny založené na důkazech do AUA klinických guidelines v rámci procesu certifikace (MOC) jistě v budoucnosti ovlivní urologickou praxi.
Není tedy pochyb, že i EBCP zaujme v urologické praxi významné místo.
ZÁVĚR
Tento článek představuje některé z klíčových konceptů EBCP tak, jak je lze aplikovat v urologické praxi. Čtenářům doporučujeme rozšířit své znalosti prostřednictvím některých online zdrojů uvedených v příloze dokumentu nebo účastí na některých z kurzů nabízených různými EBCP centry (viz příloha) a odbornými společnostmi, jako je například AUA. Je nutné si uvědomit, že většina urologických studií má pouze pozorovací povahu, může tedy obsahovat potenciální systematickou chybu a poskytovat pouze důkazy nižší úrovně. V mnoha ohledech je „urologie založená na důkazech“ (evidence based urology) zatím stále ve svých počátcích [12]. To se však může změnit, pokud si všichni, kteří jsou zapojeni do procesu EBCP, uvědomí význam této problematiky. Prostředí, v němž se v současnosti věnujeme klinické praxi, nám diktuje stále větší zodpovědnost za kvalitu péče, kterou svým pacientům poskytujeme. Je tedy nezbytné, aby všichni urologové porozuměli základním principům EBCP.
Philipp Dahm, M.D., MHSc., F.A.C.S.
Department of Urology, University of Florida, College of Medicine, Gainesville, FL
p.dahm@urology.ufl.edu
Sources
1. Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and what it isn't. BMJ 1996; 312 : 71.
2. Shaneyfelt T, Baum KD, Bell D, Feldstein D, Houston T.K, Kaatz S. et al. Instruments for evaluating education in evidence-based practice: a systematic review. JAMA 2006; 296 : 1116.
3. Guyatt GH, Rennie D. User's Guide to the Medical Literature, 4 ed. Chicago IL: AMA Press 2002 : 706.
4. Sackett DL. Rules of evidence and clinical recommendations on the use of antithrombotic agents. Chest 1986; 89 : 2S.
5. Brighton B, Bhandari M, Tornetta P, 3rd, Felson DT. Hierarchy of evidence: from case reports to randomized controlled trials. Clin Orthop Relat Res 2003; 413 : 19.
6. Hatala R, Keitz S, Wyer P, Guyatt G. Tips for lear-ners of evidence-based medicine: 4. Assessing heterogeneity of primary studies in systematic reviews and whether to combine their results. CMAJ 2005; 172 : 661.
7. Scales CD Jr, Norris RD, Keitz SA, Peterson BL, Preminger GM, Vieweg J et al. A critical assessment of the quality of reporting of randomized controlled trials in the urology literature. J Urol 2007; 177(3): 1090.
8. Schulz KF, Chalmers I, Hayes RJ, Altman DG. Empirical evidence of bias. Dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA 1995; 273 : 408.
9. Altman DG, Schulz KF, Moher D, Egger M, Davidoff F, Elbourne D et al. The revised CONSORT statement for reporting randomized trials: explanation and elaboration. Ann Intern Med 2001; 134 : 663.
10. Greenhalgh T. Papers that summarise other papers (systematic reviews and meta-analyses). BMJ 1997; 315 : 672.
11. Wilt TJ, Howe RW, Rutks IR, MacDonald R. Terazosin for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002; CD003851.
12. Mansson W. Evidence-based urology--a utopia? Eur Urol 2004; 46 : 143.
13. Albert X, Huertas I, Pereiro II, Sanfelix J, Gosalbes V, Perrota C. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; CD001209.
14. Guyatt G, Haynes B, Jaeschke R, Cook D, Greenhalgh T, Meade M et al. Introduction: the philosophy of evidence-based medicine. In: Users' guide to the medical literature. Edited by G. Guyatt and D. Rennie. Chicago, IL: American Medical Association Press 2002 : 3-12.
15. Thompson I.M, Goodman PJ, Tangen CM, Lucia MS, Miller GJ, Ford L G et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003; 349 : 215.
16. Petrisor BA, Bhandari M. Principles of teaching evidence-based medicine. Injury 2006; 37 : 335.
17. Guidelines on Prostate Cancer: European Urological Association, 2005.
18. Practice Guidelines in Oncology – v.1.2005 –Prostate Cancer Early Detection National Cancer Center Network, 2005.
19. Guyatt G, Vist G, Falck-Ytter Y, Kunz R, Magrini N, Schunemann H. An emerging consensus on grading recommendations? ACP J Club 2006; 144: A8.
20. Brosnahan J, Jull A, Tracy C. Types of urethral catheters for management of short-term voiding problems in hospitalised adults. Cochrane Database Syst Rev 2004; CD004013.
21. Rafalsky V, Andreeva I, Rjabkova E. Quinolones for uncomplicated acute cystitis in women. Cochrane Database Syst Rev 2006; 3: CD003597.
22. Ilic D, O'Connor D, Green S, Wilt T. Screening for prostate cancer. Cochrane Database Syst Rev 2006; 3: CD004720.
23. Devereaux PJ, Yusuf S. The evolution of the randomized controlled trial and its role in evidence-based decision making. J Intern Med 2003; 254 : 105.
24. Davis JW, Chang SS, Schellhammer PF. Clinical Trials Methodology. AUA Update Series 2004; 23 : 138.
25. Devereaux PJ, Manns BJ, Ghali WA, Quan H, Lacchetti C, Montori VM et al. Physician interpretations and textbook definitions of blinding terminology in randomized controlled trials. JAMA 2001; 285 : 2000.
26. Scales CD Jr, Norris RD, Peterson BL, Preminger GM, Dahm P. Clinical research and statistical methods in the urology literature. J Urol 2005; 174 : 1374.
27. Breau RH, Carnat TA, Gaboury I. Inadequate statistical power of negative clinical trials in urological literature. J Urol 2006; 176 : 263.
28. Sur RL, Scales CD Jr, Preminger GM, Dahm P. Evidence-based medicine: a survey of American Urological Association members. J Urol 2006; 176 : 1127.
29. Barratt A, Wyer PC, Hatala R, McGinn T, Dans AL, Keitz S et al. Tips for learners of evidence-based medicine: 1. Relative risk reduction, absolute risk reduction and number needed to treat. CMAJ 2004; 171 : 353.
30. Dellabella M, Milanese G, Muzzonigro G. Randomized trial of the efficacy of tamsulosin, nifedipine and phloroglucinol in medical expulsive therapy for distal ureteral calculi. J Urol 2005; 174 : 167.
31. Montori VM, Kleinbart J, Newman TB, Keitz S, Wyer PC, Moyer V. et al. Tips for learners of evidence-based medicine: 2. Measures of precision (confidence intervals). CMAJ 2004; 171 : 611.
32. Bhandari M, Zlowodzki M, Cole PA. From eminence-based practice to evidence-based practice: a paradigm shift. Minn Med 2004; 87 : 51.
33. Horton R. Surgical research or comic opera: questions, but few answers. Lancet 1996; 347 : 984.
34. Howes N, Chagla L, Thorpe M, McCulloch P. Surgical practice is evidence based. Br J Surg 1997; 84 : 1220.
35. Young J, Harrison J, White G, May J, Solo-mon, M. Developing measures of surgeons' equi-poise to assess the feasibility of randomized controlled trials in vascular surgery. Surgery 2004; 136 : 1070.
36. Solomon MJ, McLeod RS. Should we be performing more randomized controlled trials evaluating surgical operations? Surgery 1995; 118 : 459.
37. EBM: unmasking the ugly truth. BMJ 2002; 325 : 1496.
38. Timmermans S, Mauck A. The Promises and Pitfalls of Evidence-Based Medicine. In: Health Affairs 2005; vol. 24 : 18–28.
39. Evans CP. Evidence-based medicine for the urologist. BJU Int 2004; 94 : 1.
40. Sand PK. Urogynecology: the death of dogma. Int Urogynecol J Pelvic Floor Dysfunct 2001; 12 : 1.
41. Jones RS, Brown C, Opelka F. Surgeon compensation: “Pay for performance,"” the American College of Surgeons National Surgical Quality Improvement Program, the Surgical Care Improvement Program, and other considerations. Surgery 2005; 138 : 829.
42. Miller DC, Wei JT, Montie JE, Hollenbeck BK. Quality of care and performance-based reimbursement: the contemporary landscape and implications for urologists. Urology 2006; 67 : 1117.
43. Miller SH. American Board of Medical Specialties and repositioning for excellence in lifelong learning: maintenance of certification. J Contin Educ Health Prof 2005; 25 : 151.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2008 Issue 4
-
All articles in this issue
- Peyronieho choroba
- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Priapismus
- Systém hodnocení erektilní dysfunkce pomocí stupnice EHS
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
- Aktuality v andrologické endokrinologii
- Role retroperitoneální lymfadenektomie u pacientů s nonseminomovými germinálními tumory varlat a poruchy ejakulace
- Klinická praxe založená na důkazech: Úvod do problematiky pro urology
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Peyronieho choroba
- Priapismus
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
