Peyronieho choroba
Peyronie´s disease
Peyronie's disease is believed to be a wound healing disorder resulting in a fibrous inelastic scar resulting in a variety of penile dysfunctions. This includes deformity in the erect state, shortening, narrowing, indentations, pain and is frequently associated with erectile dysfunction. Historical reviews have suggested that Peyronie's disease is rare and tends to resolve spontaneously. More recent demographic and natural history studies have demonstrated that Peyronie's disease has been reported to occur in 4–9 % of adult males and rarely resolves spontaneously. As a result of the deformity and associated sexual dysfunction this disorder can be devastating both physically and psychologically. This article will review the history, current understanding of pathophysiology, epidemiology, and recommended patient evaluation. There will also be a review of current non-surgical and surgical treatment options. The goal is to familiarize the practicing urologist with the contemporary approach to Peyronie's disease with hopes that this will guide more effective treatment, as well as a better understanding of this devastating disorder.
Key words:
Peyronie's disease, penile deformity, erectile dysfunction, injection therapy, traction therapy
Authors:
L. A. Levine; F. L. Taylor
Published in:
Urol List 2008; 6(4): 5-17
Overview
Peyronieho choroba (PD) představuje poruchu hojení poranění, při níž dochází k zjizvení fibrotické tkáně. Vznik neelastické jizvy má za následek celou řadu penilních dysfunkcí, jako je například deformace penisu ve ztopořeném stavu, zkrácení a zúžení penisu, vznik zářezů nebo bolestivost. Peyronieho onemocnění je často spojeno se vznikem erektilní dysfunkce. Autoři starších přehledů považovali Peyronieho chorobu za vzácně se vyskytující onemocnění, které má tendenci ke spontánnímu vymizení. Nejnovější studie zabývající se demografií a přirozeným vývojem PD však uvádějí, že Peyronieho choroba se vyskytuje u 4–9 % dospělých mužů a pouze výjimečně dochází k jejímu spontánnímu vymizení. Vzhledem k deformaci penisu a s ní souvisejícímu výskytu sexuální dysfunkce může PD představovat pro pacienta velmi závažnou jak fyzickou, tak i psychickou zátěž. Tento článek předkládá přehled vývoje, nejnovější poznatky týkající se patofyziologie a epidemiologie PD a doporučené vyšetřovací metody. Autoři dále uvádějí přehled v současné době užívaných operačních i neoperačních metod léčby. Cílem této práce je obeznámit praktikující urology s nejnovějšími přístupy k řešení PD a umožnit tak efektivnější léčbu a lepší porozumění tomuto onemocnění.
Klíčová slova:
Peyronieho choroba, penilní deformita, erektilní dysfunkce, injekční terapie, trakční zařízení
HISTORIE
Definice
Peyronieho choroba (PD) představuje psychicky i fyzicky zatěžující poruchu, jejíž podstatou je fibrózní neelastické zjizvení tkáně tuniky albuginea, které má za následek vznik hmatné jizvy na penisu (v ochablém stavu) způsobující jeho deformaci. Deformace se projevuje zakřivením, vyvrácením, zúžením či zkrácením penisu a bolestivou erekcí. Navzdory celé řadě terapeutických postupů, které máme k dispozici od roku 1743, kdy François de la Peyronie jako první popsal tuto chorobu [1], představuje i v současné době volba vhodné léčby PD pro urology oříšek.
Vývoj
François de la Peyronie působil jako chirurg ve Francii v letech 1693–1747 [2]. Jeho kariéra byla velmi produktivní, za vlády Ludvíka XIV. byl velitelem lékařského sboru, v roce 1737 založil Královskou chirurgickou akademii a v Paříži patřil mezi nejvýznamnější chirurgy – mezi jeho pacienty se řadili vlivní občané Paříže, a dokonce i polští a pruští panovníci [2]. Za jeho nejvýznamnější příspěvek medicíně se považuje Peyronieho studie o plastické induraci penisu (IPP) [1], kde popisuje „znetvořené penisy“ a „indurace“ způsobující zahnutí penisu. Léčbou Peyronieho choroby se v minulosti zabývala řada lékařů, mezi první průkopníky patřil boloňský biskup Theodorik (13. století) [3].
ETIOLOGIE A MOLEKULÁRNÍ MECHANISMUS
Etiologie Peyronieho choroby je i v současné době předmětem vědeckého výzkumu. Za příčinu vzniku PD bylo dříve považováno sexuální chování pacienta nebo jeho „deviantní chování“ [4,5]. Za faktory zapříčiňující vznik PD byly po mnoho let považovány násilná penetrace a trauma [6], a ačkoliv další výzkumníci vyslovili pochybnosti týkající se souvislosti mezi těmito faktory a vznikem PD [7], je pravděpodobné, že skutečně představují významný spouštěcí nebo epigenetický moment ve vývoji tohoto onemocnění. Modernější hypotéza pokládá Peyronieho chorobu za poruchu hojení poranění (podobně jako tvorba hypertrofických jizev). Nejnovější výzkum se zaměřuje na objasnění mechanismu hojení poranění, fibrózy a vzniku jizev a hledá souvislost mezi výsledky a populací pacientů s PD.
Normální proces hojení ran lze na základě biochemické aktivity rozdělit do tří fází: akutní fáze, pro niž je charakteristická hemostáza a zánět, proliferativní fáze charakteristická růstem fibroblastů a epitelu a remodelační fáze, v níž dochází k rozpadu kolagenu a reorganizaci tkáně. Základní studium této poruchy hojení poranění vyžaduje porozumění biochemickým pochodům typickým pro každou z těchto fází.
Hlavním rysem akutní fáze je reakce organismu na poranění krevních cév, ke kterému dochází při poranění tkáně. Expozice krevních destiček unikajících z poškozených cév subendoteliálnímu kolagenu vede k jejich agregaci a aktivaci koagulační kaskády. Krevní destičky uvolňují granule obsahující různá lokálně aktivní a chemotaktická agens, jako jsou destičkový růstový faktor (PDGF), transformující růstový faktor (TGF-β) a faktor aktivující trombocyty (PAF). Následkem této aktivity dochází ke spuštění koagulační kaskády, usazování fibrinu a tvorbě krevní sraženiny. Krevní sraženina umožňuje nejenom vznik hemostázy, ale účinkuje také jako podklad pro pohyb elementů podílejících se na akutní buněčné odpovědi do oblasti poranění.
Buněčná odpověď probíhá na základě ustáleného postupu – nejprve se do místa poranění dostanou neutrofily, které jsou přitahovány chemotaktickými agens, jako jsou TGF-β, tumor nekrotizující faktor (TNF-α) a interleukin 1 [8].
Přibližně 48 hodin po neutrofilech se do místa poranění dostanou makrofágy.
Makrofágy svým účinkem připomínají fagocytické pohlcování mrtvého nebo škodlivého materiálu a pomocí reakce volných kyslíkových radikálů likvidují bakterie a další cizí buňky. Makrofágy navíc díky uvolňování TGF-β přitahují další buněčné elementy [9] a uvolňováním vaskulárního endotelového růstového faktoru (VEGF), inzulinu podobného růstového faktoru (IGF) a epidermálního růstového faktoru (EGF) stimulují lokální obnovu tkáně.
Proliferativní fáze obvykle nastupuje 4–12 dnů po vzniku poranění a právě v této fázi dochází k počátečnímu formování jizvy. Fibroblasty se (obvykle pomocí účinku PDGF) přemisťují do oblasti poranění. Jejich role spočívá v tvorbě kolagenu a obnovení extracelulární matrix, zničené při poranění. Ačkoliv je v organismu přítomno několik typů kolagenu, na hojení poranění se podílejí hlavně I. a III. typ. Kolagen I. typu je primárně kožní kolagen, zatímco III. typ má významnější roli během hojení rány. Ukládání kolagenu závisí na několika dalších faktorech, mezi něž patří adekvátní zásobení aminokyselinami a vitamínem C, který účinkuje jako donor elektronů během klíčových fází syntézy. Fibroblasty vytvářejí také glykosaminoglykany (GAG), mezi jejichž hlavní elementy podílející se na hojení ran patří chondroitin sulfát a dermatan. Vzájemné působení kolagenu a GAGs zůstává nadále předmětem zájmu studia procesů hojení poranění. Endoteliální buňky proliferují a vytvářejí stimulací VEGF nové kapiláry.
Remodelační fáze hojení rány začíná během proliferativní fáze a v závěru vede ke vzniku menší, potenciálně kontrahované jizvy. Pro tuto fázi je charakteristické dosažení rovnováhy mezi matrix metaloproteinázou (MMPs), která způsobuje rozpad kolagenu, a tvorbou kolagenu ve fibroblastech. MMPs jsou vyvolány IL-1 a inhibovány tkáňovými inhibitory metaloproteinázy (TIMP) (doposud byly identifikovány dvě molekuly – TIMP 1 a TIMP 2) a fibrinolytickými inhibitory, jako jsou inhibitor aktivátoru fibrin/plasminogenu 1 (PAI-1) [10].
Další studium molekulární etiologie PD vedlo k odhalení několika významných růstových faktorů, které lze rozdělit na dvě skupiny – profibrotické a antifibrotické faktory. Mezi profibrotické faktory patří TGF-β1 spouštějící syntézu kolagenu I [11], který je uvolňován neutrofily a makrofágy během akutní a proliferativní fáze procesu hojení rány. El Sakka et al [12] prokázali při srovnávání pacientů s PD s kontrolní skupinou nadměrnou expresi proteinu TGF-β1 u populace pacientů s PD plakem. U těchto pacientů nebyla pozorována nadměrná exprese TGF-β2 ani TGF-β3, což podporuje domněnku, že nadměrná exprese TGF-β1 může hrát roli při vzniku PD. TGF-β1 byl užit k indukci PD na krysím modelu, což dále potvrdilo roli TGF-β1 jako centrálního modulátoru ukládání kolagenu u PD [13].
Do druhé skupiny profibrotických enzymů patří inhibitor aktivátoru fibrin/ plasminogenu 1 (PAI-1) [10]. Plasmin rozkládá extracelulární matrix, a to jak přímo, tak aktivací MMPs, která má za následek rozkládání kolagenu. PAI-1 pak inhibuje MMPs a aktivátor plasminogenu (t-PA), který aktivuje plasmin [14]. Také samotný fibrin byl testován pro svou schopnost indukovat PD [15,16] a byl užit jako induktor PD na zvířecím modelu [17]. Bylo prokázáno, že pacienti s PD plakem vyvolaným fibrinem mají vyšší hladinu TGF-β1 a PAI-1 [16].
Mezi nejvýznamnější doposud identifikované antifibrotické enzymy patří MMPs. Ačkoliv byla objevena celá řada různých MMPs, některé enzymy hrají zřejmě při výzkumu PD významnější roli než ostatní. Rozpad kolagenu typu I je zprostředkován MMP-1 a MMP-13, zatímco na rozpadu kolagenu typu III se nejvíce podílejí MMP-1, MMP-3, MMP-10 a MMP-13. V současné době probíhají zajímavé studie testující možnost regrese fibrózy (umožněné indukcí dráhy syntetázy oxidu dusného).
Nejnovější práce pomohly dále objasnit molekulární biologii PD a stanovit potenciální cíle pro molekulární terapie. Ryu et al [18] hodnotili účinnost inhibitoru TGF-β1 při léčbě vyvolané PD na krysím modelu. Krysám byl do tuniky albuginea injekcí aplikován TGF-β1, který vyvolal stav podobný PD. Krysy byly randomizovány do čtyř skupin: kontrolní skupina, skupina s PD bez jakékoliv léčby, skupina s PD léčená aplikací fyziologického roztoku a skupina s PD léčená aplikací IN-1130. IN-1130 je molekula inhibitoru ALK5 (activin receptor-like kinase 5), která je receptorem pro TGF-β1. U krys s PD léčených pomocí IN-1130 bylo prokázáno signifikantní zmírnění zakřivení a fibrózy ve srovnání s neléčenými krysami a krysami léčenými aplikací fyziologického roztoku. U krys léčených pomocí IN-1130 bylo po léčbě naměřeno zakřivení 9,1 °, u neléčených krys 23,0 ° a u krys léčených aplikací fyziologického roztoku 32,6 °.
De Carlo et al [19] zkoumali roli MMPs a TIMPs při patogenezi PD s užitím plaku získaného od lidských pacientů s PD. Ve vzorcích tkáně z léze pacientů s PD byla ve srovnání s odpovídajícími vzorky tuniky vedle léze detekována nižší hladina MMP 1, 8 a 13. Fibroblasty z PD léze byly po aplikaci TGF-β1 nebo IL-β1 kultivovány v roztoku MMPs a TIMPs. Autoři zjistili, že stimulace pomocí IL-β1 zvyšuje u fibroblastů z PD léze produkci MMP 1, 2, 8, 9, 10 a 13, zatímco TGF-β1 zvyšuje produkci pouze MMP 10, a naopak snižuje produkci MMP 13, což nasvědčuje tomu, že abnormální fibroblasty v PD lézi mohou být indukovány k produkci MMPs.
Existuje možnost, že někteří pacienti mají genetické predispozice pro vznik PD a horší hojení poranění. Qian et al [20] zjistili při srovnávání profilu exprese genů ve vzorcích odebraných z tuniky albuginea u pacientů s PD plakem, pacientů s Dupuytrenovou kontrakturou a pacientů s normální palmární fascií, že mezi pacienty s PD a Dupuytrenovou kontrakturou existují jisté genové podobnosti. Tyto shody se týkaly MMP-2, MMP-9 a thymosinů TM β10 a TM β4.
EPIDEMIOLOGIE
Epidemiologické údaje týkající se PD jsou bohužel značně nedostatečné a nekonzistentní. První epidemiologickou zprávu zahrnující 550 pacientů o PD publikoval Pokley v roce 1928 [21]. Studie Ludvika [22] a Devina [23] rozšířily hypotézu, která, ačkoliv byla patrně nesprávná, byla akceptována, že prevalence PD u americké populace se pohybuje kolem 1 %. Lindsay et al [24] zjistili v roce 1991 na základě hodnocení nemocničních záznamů 0,38% míru celkové prevalence. Tento údaj nasvědčuje tomu, že v této době bylo v USA 423 000 pacientů s PD a každý rok přibylo dalších přibližně 32 000 případů. Průměrný věk pacienta v době diagnostikování onemocnění byl v populaci této studie 53 let, nejvyšší incidence byla zaznamenána u pacientů ve věkové skupině 50–59 let. Sommer et al [25] zkoumali prevalenci PD u evropské populace. Do studie bylo zařazeno 8000 mužů (Kolín nad Rýnem, Německo), 3,2 % mužů si samo diagnostikovalo hmatný plak na penisu. Nejvyšší incidence (6,5%) byla zaznamenána u pacientů ve věku ≥ 70 let. U 8,4 % pacientů (pacienti vybráni na základě screeningu prostaty) byly detekovány objektivní známky přítomnosti PD [26]. Tyto studie by nasvědčovaly tomu, že skutečná prevalence PD se pohybuje někde kolem 10 %. Navzdory těmto nejnovějším zjištěním se však celá řada lékařů včetně urologů mylně domnívá, že skutečná míra prevalence je ono dříve uváděné 1 % [27]. Uváděná míra prevalence může být dokonce ještě nižší z toho důvodu, že řada pacientů pociťuje stud přijít za lékařem s podobně choulostivým problémem.
Rozporuplnou otázkou je také věk, kdy u pacientů dochází k manifestaci PD. Ačkoliv je PD považována spíše za onemocnění vyskytující se u starších mužů, nejnovější výzkumy ukazují, že PD se vyskytuje i u mladších mužů, kde může vyžadovat časnou agresivnější terapii. PD byla detekována dokonce u pacientů ve věku 18 let [28]. Tato studie dále prokázala [28], že pacienti, u nichž se onemocnění manifestuje ve věku < 40 let, mají nižší míru výskytu erektilní dysfunkce (ED) a snáze si vybavují konkrétní případ traumatického poranění. U těchto pacientů se také onemocnění častěji manifestuje v akutní fázi a častěji jsou u nich detekovány vícečetné plaky nebo komplikovanější zakřivení. Tefekli et al [29] uvádějí 8,2% prevalenci PD u mužů mladších 40 let. Tito autoři dále zjistili, že u mladších pacientů se onemocnění častěji projevuje během akutní fáze, že tito pacienti mají obvykle menší zakřivení penisu (méně než 60°) a 21% míru výskytu ED. Briganti et al [30] zjistili při srovnání 20 pacientů s PD mladších 40 let a 28 pacientů s PD starších 40 let, že mladší pacienti mají signifikantně odlišné skóre International Index of Erectile Function (IIEF) a uvádějí odlišné subjektivní zkrácení délky penisu. Mulhall et al [31] v nedávné době prokázali, že onemocnění u mužů mladších 40 let se častěji projevuje v časnějším stadiu, tito pacienti častěji trpí diabetem a mají vícečetné plaky ve srovnání s pacienty > 40 let. Je tedy zřejmé, že PD postihuje i mladší muže, u nichž může léčba pomoci minimalizovat progresi onemocnění.
V minulosti se lékaři domnívali, že u pacientů s PD dojde k samovolnému zhojení onemocnění [32]. Nejnovější studie však tuto teorii vyvrátily. V roce 1990 provedli Gelbard et al [33] výzkum zahrnující 97 mužů s PD. Po uplynutí sledování (3 měsíce–8 let) se 47 % pacientů domnívalo, že nedošlo k žádné změně onemocnění, 40 % pacientů uvedlo zhoršení onemocnění a pouze 13 % pacientů pociťovalo postupné spontánní zlepšování. Kadioglu et al [34] retrospektivně hodnotili 63 pacientů s akutní PD, kteří byli sledováni po dobu 6 měsíců bez aplikace jakékoliv léčby. 30 % pacientů zaznamenalo zhoršení onemocnění, 67 % pacientů uvedlo, že nedošlo k žádné změně onemocnění. Pouze u 2 pacientů došlo ke spontánnímu zlepšení PD. Mulhall et al [35] hodnotili v největší doposud publikované studii zabývající se přirozeným vývojem PD u neléčených pacientů 246 mužů, u nichž došlo k manifestaci onemocnění v průběhu 6 měsíců od jeho vzniku. Pacienti byli sledováni po dobu minimálně 12 měsíců, kdy nepodstoupili žádnou léčbu. Po průměrné době 18 měsíců nedošlo u 40 % pacientů k žádné změně zakřivení, u 48 % pacientů došlo ke zhoršení a pouze u 12 % pacientů ke zlepšení onemocnění. PD je progresivní choroba a pouze u malého procenta pacientů dojde k jejímu spontánnímu vymizení. Navzdory těmto v literatuře publikovaným závěrům průzkumy prokazují, že řada praktických lékařů a urologů stále předpokládá, že PD je choroba s vysokou mírou spontánního vymizení [27]. U mužů s aktivní PD a závažnou deformitou je třeba přistoupit k léčbě, která může vést ke zlepšení deformace nebo stabilizaci PD. Naopak „pozorné vyčkávání“ se doporučuje u pacientů, u nichž onemocnění nenarušuje funkci.
VYŠETŘENÍ PACIENTA S PD
Pečlivé vyšetření pacientů s PD je nezbytné pro správné stanovení diagnózy, ale také pro volbu vhodné léčby. V současné době neexistuje žádný obecně standardizovaný postup pro vyšetřování pacientů s PD, k dispozici nemáme ani žádný validovaný dotazník. V této kapitole uvádíme doporučované guidelines [36] pro počáteční hodnocení pacienta s PD, které zahrnuje odebrání anamnézy, fyzikální vyšetření a zobrazovací vyšetření. Subjektivní i objektivní údaje jednotlivých lékařů a výzkumníků jsou rozporuplné, což činí interpretaci údajů klinických studií přinejmenším zavádějící. Zdá se, že nejúčinnějším postupem při vyšetřování pacientů s PD je subjektivní a objektivní hodnocení s cílem aplikace známých příčin vzniku PD, které jsou popsány na začátku této kapitoly.
Subjektivní hodnocení zahájíme rozhovorem s pacientem. Při odebírání anamnézy je třeba se zaměřit na nástup a délku trvání výskytu symptomů, znaky a symptomy a přítomnost nebo absenci bolesti. Zvláště užitečné je zjistit, zda pacient pociťuje bolest již při prvním vyšetření. Pozitivní odpověď nasvědčuje tomu, že onemocnění je ve své akutní fázi. Bolest může pacient pociťovat během palpace, erekce nebo během koitu. Je nutné identifikovat, o který typ bolesti se jedná, protože každý typ bolesti indikuje jiný stupeň akutního zánětu. Dále je třeba zaznamenat pacientovo subjektivní hodnocení zakřivení. Stojí za to zmínit, že vzhledem k tomu, že nejvíce obtěžujícím symptomem může být ED, až 90 % mužů si může stěžovat na ED. Pro zvolení dalšího postupu je nezbytné zjistit, jakou (pokud nějakou) léčbu PD již pacient prodělal v minulosti.
Součástí každého prvotního vyšetření pacienta s PD by mělo být odebrání detailní celkové a sexuální anamnézy. Při odebírání celkové anamnézy je třeba se zaměřit na výskyt poruch hojení poranění u pacienta nebo v rodině pacienta, včetně výskytu Dupuytrenovy kontraktury, která se vyskytuje až u 20 % pacientů s PD. Dále je třeba se pacienta dotázat na přítomnost rizikových faktorů pro ED, jako jsou dyslipidemie, aterosklerotické onemocnění, anamnéza kuřáctví a diabetes. Pomocí validovaného dotazníku je nutné zhodnotit stav erektilní funkce pacienta na počátku léčby. Vzhledem k tomu, že validovaný dotazník pro pacienty s PD je doposud ve fázi vývoje, k posouzení pacientovy počáteční sexuální funkce lze použít IIEF.
Objektivní vyšetření zahájíme provedením fyzikálního vyšetření. Vyšetření je třeba zaměřit na oblast genitálu; na základě pacientovy anamnézy může být vhodné provést také vyšetření rukou nebo chodidel. Důležitou součástí vyšetření je zjištění délky penisu, protože zkrácení penisu je nejenom komplikací spojenou s PD, ale také příčinou znepokojení většiny pacientů. Penis měříme natažený v ochablém stavu dorsálně od stydké kosti ke koroně nebo meatu. Při měření je třeba stlačit tukový polštář v suprapubické oblasti. Objektivní zhodnocení zakřivení penisu se nejlépe provádí pomocí duplexního ultrazvukového vyšetření penisu po aplikaci farmakologického stimulantu, pomocí něhož navodíme plnou erekci (stejnou nebo lepší než erekce, jíž pacient dosáhne doma). Pouhé navození erekce v ordinaci lékaře umožní objektivní hodnocení deformace penisu. Duplexní ultrazvukové vyšetření nám umožní zhodnotit vaskulární průtok, stupeň zakřivení, který měříme pomocí protraktoru, přítomnost a lokalizaci Peyronieho plaku(ů) a přítomnost „hinge“ (závěsného) efektu. Dále je nutné zhodnotit stupeň kalcifikace plaku. Měření zakřivení pomocí autofotografie není dostačující, protože tato metoda může být nekonzistentní a nepřesná.
Poslední částí vyšetření pacienta s PD je objektivní hodnocení pacientovy erektilní kapacity a citlivosti penisu. Během duplexního ultrazvukového vyšetření je pacient požádán, aby erekci vyvolanou aplikací farmaka srovnal s erekcí, jíž dosáhne sám doma. Pro hodnocení citlivosti penisu se doporučuje biothesiometrie. Okamžik, při kterém je pociťován vibrační vjem, by měl být měřen bilaterálně uprostřed těla penisu a na glandu. Jako pozitivní kontrola se užívá distální článek ukazováku, jako negativní kontrola ventrální povrch obou stehen.
NEOPERAČNÍ LÉČBA PEYRONIEHO ONEMOCNĚNÍ
Od objevu první zprávy o PD v literatuře se lékaři pokoušejí najít vhodnou medikamentózní léčbu tohoto onemocnění. Tato snaha se doposud setkala pouze s minimálním úspěchem, jako slibný se v současné době jeví výzkum molekulární patofyziologie PD, který patrně jednou umožní vyléčit PD pomocí medikamentózní terapie. Přesto máme k dispozici několik neoperačních možností léčby PD, které umožňují stabilizaci nebo zmírnění deformace penisu a zlepšení sexuální funkce. Jejich účinnost však byla hodnocena pouze v malých klinických studiích, které ve většině případů nezahrnovaly kontrolní skupinu s placebem. Bez validovaných dotazníků a u onemocnění s 5–12% mírou spontánního vyléčení je interpretace těchto výsledků obtížná [31–34]. Neoperační možnosti léčby bolesti a zakřivení zahrnující perorální léčbu, topickou léčbu, aplikaci medikamentů přímo do PD léze a zevní aplikaci energie a kombinované možnosti léčby jsou uvedeny v tab. 1.
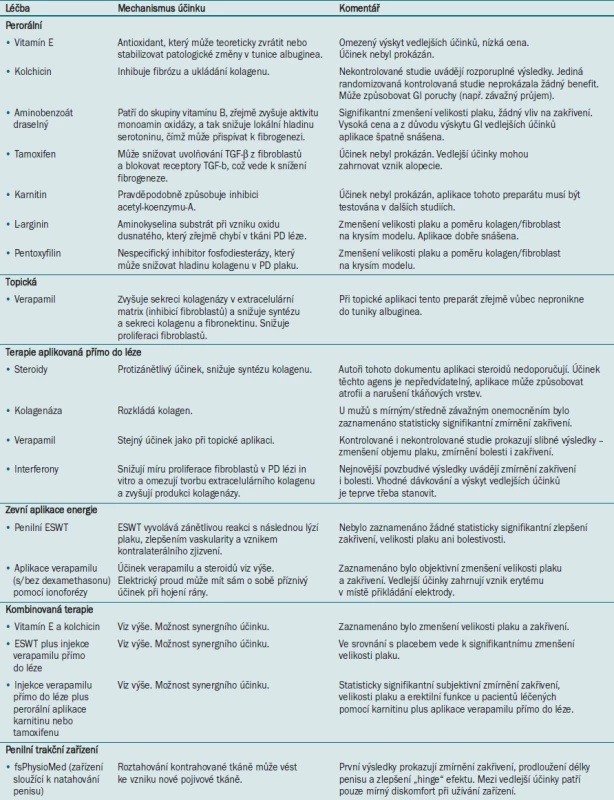
Perorální terapie
Vitamín E
Vitamín E byl první agens užitý pro perorální léčbu PD [37]. Vitamín E je rozpustný v tucích, je metabolizován v játrech, vylučován žlučí a v lidském organismu má pravděpodobně antioxidační účinky. Během akutní a proliferativní fáze hojení rány dochází ke zvýšení oxidačního stresu a tvorby různých druhů reakčního kyslíku (ROS), protože ROS jsou produkovány makrofágy a neutrofily [38] a u pacientů s PD dochází k prodloužení zánětlivé fáze hojení [39]. Biochemický mechanismus účinku vitamínu E tedy byl popsán.
Gelbard et al [33] srovnávali aplikaci vitamínu E a žádnou léčbu (přirozený průběh PD) u 86 pacientů. Mezi oběma skupinami nebyl zjištěn žádný rozdíl s ohledem na zakřivení, bolestivost a schopnost uskutečnit pohlavní styk.
Pryor et al zkoumali v roce 1983 ve dvojitě zaslepené, placebem kontrolované zkřížené studii účinek vitamínu E při léčbě PD u 40 pacientů [40]. Autoři nezaznamenali žádný rozdíl ve velikosti plaku ani zakřivení penisu, a aplikaci vitamínu E tedy v rámci léčby ED nedoporučují, protože placebem kontrolované studie neprokázaly žádný benefit této terapie.
Kolchicin
Kolchicin je preparát užívaný k léčbě dny, jehož účinek spočívá v inhibici fibrózy a ukládání kolagenu (zvláště prostřednictvím inhibice zánětlivé reakce). Vzhledem k těmto faktorům se kolchicin užívá při léčbě ED jako primární perorální terapie i v kombinaci s dalšími modalitami. Akkus et al [41] aplikovali v nerandomizované studii, nezahrnující kontrolní skupinu s placebem, zvyšující se dávku kolchicinu 19 pacientům s PD po dobu 3–5 měsíců. 36 % pacientů zaznamenalo zmírnění zakřivení, 63 % pacientů pocítilo zlepšení hmatného plaku. U 78 % pacientů, kteří před zahájením léčby trpěli bolestivou erekcí, došlo k vymizení těchto symptomů. Kadioglu et al [42] léčili 60 pacientů s PD aplikací 1 mg kolchicinu dvakrát denně po průměrnou dobu 11 měsíců. U 95 % pacientů došlo k signifikantnímu zmírnění bolestivosti, 30 % pacientů uvedlo zmírnění zakřivení penisu, zatímco 22 % pacientů pozorovalo zhoršení zakřivení. Safarinejad provedl v roce 2004 randomizovanou, placebem kontrolovanou studii testující účinnost kolchicinu u 84 mužů [43]. S ohledem na zmírnění bolesti, úhlu zakřivení a zmenšení velikosti plaku (měřeno pomocí ultrazvukového vyšetření) nebyla aplikace kolchicinu účinnější než aplikace placeba. Autoři této studie aplikaci kolchicinu vzhledem k jeho nedostatečné účinnosti prokázané v kontrolovaných studiích nedoporučují. Aplikace tohoto preparátu je také spojena s gastrointestinálními potížemi, jako je průjem, a vzácně se vyskytující aplastickou anémií.
Aminobenzoát draselný
Aminobenzoát draselný (Potaba, Glenwood) patří do skupiny vitamínu B. Tento preparát zvyšuje aktivitu monoaminoxidázy v tkáni, a tak snižuje lokální hladinu serotoninu, což má pravděpodobně za následek snížení fibrogeneze. Tento účinek byl prokázán na vzorku tkáně PD in vitro. Aminobenzoát draselný se užívá k léčbě dalších onemocnění, jako jsou skleroderma, dermatomyositida a pemfigus. Aplikaci aminobenzoátu draselného při léčbě PD poprvé popsali Zarafonatis a Horrax [44]. Evropská studie z roku 1978 zahrnující 2653 pacientů [45] uvádí 57% míru úspěšnosti a 9% míru úplného zhojení onemocnění. Tato studie však nezahrnovala kontrolní skupinu ani skupinu užívající placebo. Weidner et al [46] publikovali v roce 1999 randomizovanou, placebem kontrolovanou studii, v níž testovali účinek perorální aplikace 3 g aminobenzoátu draselného 4krát denně po dobu jednoho roku u 103 pacientů. Jediným signifikantním rozdílem mezi oběma skupinami byla velikost plaku. Mezi velikostí plaku a zmírněním zakřivení penisu však nebyla prokázána žádná souvislost. Další studie Weidnera et al [47] z roku 2005 prokázala, že aplikace aminobenzoátu draselného může sloužit jako protekce před progresí PD plaku. Aminobenzoát draselný je drahý preparát, který je z důvodu gastrointestinálních vedlejších účinků špatně snášen. Tento preparát se aplikuje perorálně v dávce 3 g 4krát denně. Vzhledem k nedostatku důkazů prokazujících jeho účinnost při léčbě PD však autoři jeho aplikaci nedoporučují.
Tamoxifen citrát
Tamoxifen je nesteroidní antiestrogen, jehož účinek spočívá v kompetetivní inhibici s vazbou estrogenu v cílové tkáni. Tamoxifen dále ovlivňuje uvolňování TGF-β z fibroblastů a blokuje receptory TGF-β, čímž potenciálně snižuje fibrogenezi [48,49]. Ralph et al [48] testovali v roce 1992 účinek tamoxifenu u 36 pacientů s PD, u nichž došlo k nástupu onemocnění před < 4 měsíci. 80 % pacientů zaznamenalo zmírnění bolestivosti, 35 % pacientů uvedlo subjektivní zmírnění zakřivení a u 34 % pacientů došlo ke zmenšení plaku. Sledovací studie, kterou v roce 1999 provedli Teloken et al [50], neprokázala žádný statisticky signifikantní rozdíl mezi tamoxifenem a placebem; u pacientů užívajících tamoxifen byl naopak zaznamenán zvýšený výskyt alopecie. Aplikaci tamoxifenu nedoporučujeme.
Karnitin
Karnitin je látka, která se přirozeně účastní metabolismu. Karnitin usnadňuje vstup mastných kyselin s dlouhým řetězcem do mitochondrií svalové tkáně, které pak představují zdroj energie. Karnitin také zřejmě inhibuje acetyl koenzym - A, který se může podílet na obnově poškozených buněk. Biagiotii a Cavallini testovali v roce 2001 účinek karnitinu při léčbě PD [51]. 48 mužů zahrnutých do jejich studie bylo rozděleno do dvou skupin – jedna skupina užívala 20 mg tamoxifenu dvakrát denně po dobu 3 měsíců, druhá skupina užívala 1 g acetyl-L-karnitinu dvakrát denně pod dobu 3 měsíců. Pacienti užívající karnitin pozorovali daleko menší výskyt vedlejších účinků než pacienti užívající tamoxifen. Pro objasnění role karnitinu při léčbě PD je třeba provedení dalších studií.
L-arginin
L-arginin je aminokyselina, která se při katalýze NOS syntetázou oxidu dusnatého sloučí s kyslíkem a v konečné fázi vytváří oxid dusnatý (NO). Je známo, že k expresi iNOS dochází ve fibrotických placích PD a že dlouhodobá suprese iNOS zhoršuje fibrózu tkáně [52]. Valente et al ve své studii z roku 2003 prokázali na krysím modelu s PD plakem vyvolaným TGF-β1, že aplikace L-argininu v pitné vodě jednou denně vedla k 80–95% zmenšení velikosti plaku a poměru kolagen/fibroblast [52]. Autoři dále zjistili, že in vitro má L-arginin antifibrotické účinky, což nasvědčuje tomu, že aplikace L-argininu jako biochemického prekurzoru NO může vést ke zmenšení velikosti plaku.
Pentoxyfilin
Pentoxyfilin je nespecifický inhibitor PDE. Valente et al [52] prokázali, že normální tunika albuginea u člověka i u krysy a tkáň PD plaku produkuje PDE5A-3 a PDE4A, B a D. V rámci in vitro studie provedli kultivaci fibroblastů PD léze pomocí pentoxyfilinu a zjistili, že ve srovnání s kontrolní skupinou měl vzorek PD léze vyšší hladinu cAMP a nižší hladinu kolagenu typu I. Perorální aplikace pentoxyfilinu krysám s TGF - β1 vyvolanou PD měla navíc za následek zmenšení velikosti PD plaku a poměru kolagen/fibroblast. Brant et al prokázali ve své kazuistice účinnost samotné aplikace pentoxyfilinu při léčbě PD [53]. Pro definitivní stanovení role pentoxyfilinu při léčbě PD je nutné provedení dalších studií. Známý biochemický účinek tohoto preparátu a jeho účinek ve studiích na zvířatech však z L-argininu činí zajímavou modalitu pro perorální terapii.
Topické terapie
Verapamil
Zájem o topickou aplikaci verapamilu při léčbě PD vzbudila jeho účinnost při aplikaci medikamentu přímo do léze (viz níže). Jedna studie však prokázala, že prostřednictvím topické aplikace nelze dosáhnout dostatečné koncentrace verapamilu ve tkáni tuniky albuginea [54]. V nedávné době provedená studie zahrnující 3 větve a nezahrnující informaci, v které větvi bylo aplikováno placebo, prokázala benefit topické aplikace verapamilu [55], tato studie však nebyla dobře designována [56]. Topická aplikace verapamilu se v rámci léčby PD nedoporučuje.
Terapie s aplikací medikamentu přímo do léze
Steroidy
Díky svému silnému protizánětlivému účinku byly steroidy mezi prvními agens užívanými pro léčbu PD. V roce 1954 Bodner et al [57] zaznamenali při aplikaci hydrokortizonu a kortizonu přímo do léze zlepšení u 17 pacientů. Winter a Khanna [58] neprokázali ve své studii v roce 1957 mezi skupinou pacientů léčených pomocí injekce dexamethasonu a skupinou pacientů bez jakékoliv léčby žádný rozdíl. Williams a Green [59] publikovali v roce 1980 prospektivní studii testující účinek aplikace triamcinolonu přímo do léze. Všichni pacienti byli po zařazení do studie sledováni po dobu jednoho roku – během tohoto intervalu zaznamenala zlepšení pouze 3 % pacientů. Po 36týdenní léčbě s aplikací triamcinolonu jednou za šest týdnů pozorovalo 33 % pacientů zlepšení – zvláště zlepšení bolesti a velikosti plaku. V současné době se aplikace steroidů přímo do léze z důvodu výskytu vedlejších účinků nedoporučuje (atrofie lokální tkáně, fibróza, potlačení imunity a nedostatek objektivních důkazů pro benefit léčby).
Kolagenáza
Účinek kolagenázy in vitro poprvé testovali Gelbard et al v roce 1982 [60]. Ve své klinické studii [61] prokázali autoři při 4týdenní aplikaci tohoto preparátu subjektivní zlepšení u 64 % pacientů. Deset let po publikaci této studie uveřejnili stejní autoři výsledky dvojitě zaslepené studie zahrnující 49 mužů [62]. Ve skupině pacientů užívajících kolagenázu bylo pozorováno statisticky signifikantní zmírnění zakřivení. K tomuto zlepšení však došlo pouze u pacientů se zakřivením < 30 ° a plakem o velikosti < 2 cm. Účinek tohoto agens je v současnosti testován ve větších kontrolovaných studiích.
Verapamil
Verapamil je blokátor kalciového kanálu. In vitro studie prokázaly, že tento preparát inhibuje tvorbu lokální extracelulární matrix ve fibroblastech, snižuje proliferaci fibroblastů, zvyšuje lokální aktivitu kolagenázy a ovlivňuje cytokinové prostředí fibroblastů [63,64]. Levine et al [65] uvedli v roce 1994 výsledky studie zahrnující 14 mužů, kteří byli po dobu 6 měsíců jednou za 2 týdny léčeni aplikací verapamilu přímo do léze. U všech pacientů došlo k signifikantnímu zlepšení plaku souvisejícímu se zúžením, u 42 % pacientů došlo ke zmírnění zakřivení penisu. V roce 1998 byla publikována první randomizovaná, prostě zaslepená studie testující účinek aplikace verapamilu přímo do léze [66]. Tato studie prokázala signifikantní rozdíly v kvalitě erekce a objemu plaku. Zaznamenán byl také trend ke zmírnění zakřivení penisu. Levine a Estrada hodnotili 156 mužů s PD zařazených do prospektivní nerandomizované studie se střední dobou sledování 30,4 měsíců [67]. Pomocí aplikace 10–20 ml 0,5% bupivicainu byl proveden lokální blok a následně byla pacientům aplikována injekce 10 mg verapamilu rozpuštěného v 6 ml normálního fyziologického roztoku (celkový objem 10 ml) do Peyronieho plaku jedním až pěti kožními vpichy a to tak, aby jehla několikrát prošla plakem. Cílem tohoto postupu je ponechat preparát ve vpichu po proniknutí jehly bez porušení plaku. Pacienti podstoupili aplikaci celkem 12 injekcí, vždy v intervalu 2 týdnů. U 84 % pacientů trpících bolestí došlo k jejich kompletnímu vyléčení, u 62 % pacientů bylo při objektivním měření zjištěno zlepšení zakřivení v rozmezí 5–75 ° (průměr 30 °), pouze u 8 % pacientů došlo ke zhoršení zakřivení. V jiné (novější) studii Bennett et al [68] aplikovali 6 injekcí verapamilu (10 mg v 5 ml) přímo do léze každé dva týdny 94 po sobě jdoucím pacientům. Po aplikaci šesté injekce autoři zahájili sledování pacientů, které trvalo v průměru 5,2 měsíce. U 18 % pacientů (n = 17) došlo ke zmírnění zakřivení (průměrné zlepšení o 12 °), u 60 % pacientů (n = 56) nedošlo k žádné změně zakřivení, u 22 % pacientů (n = 21) došlo ke zhoršení zakřivení (průměrné zhoršení 22 °). U všech pacientů, kteří před zahájením léčby trpěli bolestí, došlo během sledování k jejímu zmírnění. Autoři uvádějí, že tyto údaje prokazují účinnost verapamilu při stabilizaci PD. Je možné, že po 6 injekcích dojde ke stabilizaci onemocnění, ovšem tato dávka není dostatečná pro zmírnění zakřivení. V současné době doporučujeme aplikaci 6 injekcí s dvoutýdenním intervalem mezi jednotlivými aplikacemi. V případě, že nezaznamenáme žádné zlepšení, můžeme terapii ukončit, dávku zvýšit na 20 mg nebo zahájit aplikaci interferonu (INF). Aplikace verapamilu by měla být kontraindikována u pacientů s ventrálně lokalizovaným plakem nebo rozsáhlou kalcifikací plaku.
Interferony
Duncan et al [69] v roce 1991 prokázali, že aplikace IFNs snižuje míru proliferace fibroblastů v PD placích in vitro, snižuje tvorbu extracelulárního kolagenu a zvyšuje aktivitu kolagenázy. První studie Wegnera et al [70,71] prokázala nízkou míru zlepšení, ovšem vysokou incidenci vedlejších účinků, jako jsou například myalgie a horečka. Ahuja et al [72] testovali účinnost aplikace 1 × 106 jednotek IFN-α-2b dvakrát týdně po dobu 6 měsíců. 100 % pacientů uvedlo změkčení plaku, u 90 % mužů, kteří pociťovali bolestivost, došlo k jejímu zmírnění, u 55 % pacientů došlo k subjektivnímu zmenšení velikosti plaku. Dang et al [73] testovali aplikaci 2 × 106 jednotek 21 mužům dvakrát týdně po dobu 6 týdnů – u 67 % pacientů došlo k objektivnímu zmírnění zakřivení, u 80 % pacientů došlo ke zmírnění bolestivosti. 71 % pacientů zaznamenalo zlepšení symptomů ED. Hellstrom et al [74] provedli v roce 2006 placebem kontrolovanou multicentrickou studii zahrnující 117 pacientů, kterým byla po dobu 12 týdnů aplikována injekce 5 × 106 jednotek IFN (2krát týdně). Ve skupině pacientů podstupujících léčbu došlo ke zmírnění zakřivení o 13 ° (vs. 4 ° ve skupině užívající placebo), u 27 % pacientů bylo zaznamenáno měřitelné zlepšení (vs. 9 % u pacientů léčených pomocí aplikace fyziologického roztoku). U 67 % pacientů podstupujících léčbu došlo k vymizení bolesti (vs. 28 % u pacientů užívajících placebo). Před zahájením běžného užívání IFN terapie při léčbě PD je nezbytné provedení dalších studií, které umožní stanovit účinnost, vhodné dávkování a profil vedlejších účinků této modality.
Terapie založená na zevní aplikaci energie
Penilní extrakorporální terapie rázovou vlnou (ESWT )
Řada publikací uvádí, že lokální ESWT představuje užitečnou modalitu. Existují různé hypotézy vysvětlující mechanismus účinku ESWT, mezi něž patří přímé poškození plaku, které má za následek vznik zánětlivé reakce a zvýšení aktivity makrofágů vedoucí k lýzi plaku, zlepšení vaskulární funkce způsobující resorpci plaku a vznik kontralaterálního zjizvení, které vyvolává dojem „falešného“ narovnání penisu [75]. Hauck et al [76] randomizovali 43 mužů k ESWT nebo perorální aplikaci placeba po dobu 6 měsíců. Ve skupině pacientů léčených ESWT nebyl zaznamenán žádný signifikantní účinek s ohledem na stupeň zakřivení, velikost plaku ani subjektivní zlepšení sexuální funkce nebo rigidity. Autoři novější německé studie [77,78] randomizovali 102 mužů k ESWT nebo aplikaci placebo šoků. Mezi oběma skupinami nebyl zaznamenán žádný rozdíl s ohledem na velikost plaku, zmírnění deformity ani sexuální funkci po ukončení léčby. ESWT nelze v současné době pro léčbu PD doporučit.
Iontoforéza
Iontoforéza spočívá v transportu iontů tkání prostřednictvím elektrického proudu. Několik studií testovalo účinek topické aplikace verapamilu s nebo bez dexamethasonu s užitím iontoforézy ke zvýšení penetrace preparátu [79–82]. Levine et al v roce 2002 prokázali při prozkoumání vzorku tuniky albuginea získaného během incize plaku nebo operace s vytvořením štěpu, že v tunice vystavené účinku iontoforézy byl skutečně přítomen verapamil [83]. Di Stasi et al v nedávné době provedli prospektivní randomizovanou studii zahrnující 96 pacientů, kteří podstoupili aplikaci 5 mg verapamilu a 8 mg dexamethasonu s užitím iontoforézy nebo 2% lidokainu [82]. 43 % pacientů léčených pomocí verapamilu/dexamethasonu zaznamenalo objektivní zmenšení velikosti plaku a zmírnění zakřivení, zatímco ve skupině pacientů léčených pomocí aplikace lidokainu nebyla zaznamenána žádná změna. Greenfield et al [84] testovali ve své studii (2005) aplikaci 10 mg verapamilu vs. aplikaci fyziologického roztoku pomocí iontoforézy. Účinek léčby byl hodnocen na základě erekce navozené aplikací papaverinu jeden měsíc před a jeden měsíc po terapii. Ke zmírnění zakřivení došlo u 65 % pacientů užívajících verapamil, a pouze u 58 % pacientů léčených pomocí fyziologického roztoku. Ve skupině pacientů léčených pomocí verapamilu bylo zaznamenáno zmírnění zakřivení o 9,1 °, ve skupině pacientů léčených pomocí fyziologického roztoku o 7,6 °. Tento účinek není tak významný jako při aplikaci verapamilu přímo do léze. Elektrický proud sám o sobě může mít pozitivní vliv při hojení rány, tento účinek je popsán v řadě dermatologických publikací [85]. V současné době probíhají nové studie testující význam iontoforézy.
Kombinovaná terapie
Vitamín E a kolchicin
Preito Castro et al [86] randomizovali ve své placebem kontrolované studii 45 pacientů k aplikaci vitamínu E a kolchicinu nebo ibuprofenu. Ve skupině léčených pacientů bylo zaznamenáno statisticky signifikantní zmírnění zakřivení i zmenšení velikosti plaku. Pacienti v této větvi studie také uváděli větší úlevu od bolesti, tento výsledek však nebyl statisticky signifikantní.
ESWT a injekce verapamilu aplikovaná přímo do léze
Mirone et al [87] v roce 1999 prospektivně hodnotili dvě skupiny pacientů s PD – jedna skupina pacientů podstoupila ESWT, druhá skupina pacientů byla léčena pomocí ESWT v kombinaci s injekcí verapamilu aplikovanou přímo do léze. Ve skupině pacientů léčených pouze pomocí ESWT bylo zaznamenáno 52% zmenšení velikosti plaku (velikost měřena pomocí ultrazvukového vyšetření), ve skupině pacientů léčených pomocí kombinované terapie bylo zaznamenáno pouze 19% zmenšení. Autoři provedli sledovací studii zahrnující 481 pacientů, v níž zaznamenali 49% zmenšení velikosti plaku u pacientů léčených pomocí kombinované terapie [88].
Aplikace verapamilu přímo do léze v kombinaci s perorální aplikací karnitinu nebo tamoxifenu
Cavallini et al [89] (2002) randomizovali 60 pacientů k aplikaci verapamilu přímo do léze v kombinaci s perorální aplikací karnitinu nebo k aplikaci verapamilu přímo do léze plus perorální aplikaci tamoxifenu. Ve skupině pacientů léčených pomocí karnitinu došlo k statisticky signifikantnímu subjektivnímu zmírnění zakřivení, zmenšení velikosti léze a zlepšení erektilní funkce. Mezi oběma skupinami nebyl zaznamenán žádný rozdíl s ohledem na úlevu od bolesti.
Penilní trakční zařízení
Tkáňové expandery se běžně užívají při léčbě onemocnění v oblasti ortopedie, obličejové a čelistní chirurgie a plastické chirurgie. Bylo prokázáno, že postupné roztahování tkáně vede ke vzniku nové kostní a pojivové tkáně. V nedávné době byla publikována první práce testující účinek zařízení sloužícího k prodlužování penisu (fsPhysioMed®, FastSize LLC, Aliso Viejo, CA) při léčbě PD. Pilotní studie provedená v naší instituci, která zahrnovala 10 pacientů, prokázala, že každodenní užívání fsPhysioMed® vede k 33% zmírnění zakřivení (z průměrného zakřivení 51 ° na 34 °), prodloužení délky penisu o 0,5–2,0 cm a zlepšení „hinge“ efektu u všech pacientů, u nichž bylo přítomno zúžení nebo vznik zářezů. U žádného pacienta nedošlo k recidivě ani zhoršení zakřivení, ani nebyla zaznamenána incidence lokálních změn na kůži, ulcerací nebo ztráty citlivosti. Předtím, než bude možné doporučit rutinní užívání penilních extenderů u všech pacientů s PD, je nezbytné provedení dlouhodobých a rozsáhlejších studií. První povzbudivé výsledky jsme však v našem centru přivítali s velkým nadšením.
V současné době upřednostňujeme v rámci léčby PD multimodální přístup před operační léčbou. Pacientům indikujeme perorální aplikaci 400 mg pentoxyfilinu třikrát denně a aplikaci 1000 mg L-argininu dvakrát denně. Dále pacientům doporučujeme užívat po dobu 6 měsíců fsPhysioMed® (2–8 hodin denně). Pro zmírnění zakřivení penisu a bolesti (v případě, že je přítomna) nabízíme pacientům injekci verapamilu.
OPERAČNÍ LÉČBA PEYRONIEHO ONEMOCNĚNÍ
Operace představuje stále zlatý standard léčby PD. Abychom zajistili dlouhodobý účinek, doporučujeme operaci provádět pouze u pacientů s onemocněním ve stabilním stadiu. Obecně se provedení operace doporučuje u pacientů, u nichž onemocnění přetrvává po dobu 9 měsíců – 1 rok a v případě, že je onemocnění ve stabilním stadiu po dobu minimálně 6 měsíců.
Ke stanovení terapeutického plánu je nutné odebrání předoperační anamnézy, provedení fyzikálního vyšetření a duplexní ultrasonografie. Lékaři z Medical Centre v Rush University v Chicagu (IL) vyvinuli algoritmus pro léčbu PD, který je založen na erektilní funkci pacienta, stupni zakřivení penisu a přítomnosti „hinge“ efektu [90] (schéma 1).
![Schéma 1. Algoritmus pro operační léčbu Peyronieho onemocnění [90].](https://pl-master.mdcdn.cz/media/image/c3cc04b2adb54477f12cb995d49e04c9.png?version=1537796491)
Ve stručnosti: v případě, že rigidita penisu umožňuje s nebo bez farmakoterapie adekvátní imisi, pacient má prosté zakřivení penisu < 60 ° bez „hinge“ efektu nebo efektu „přesýpacích hodin“, doporučuje se provedení plikační procedury. V případě složitého zakřivení > 60 ° s destabilizujícím „hinge“ efektem nebo efektem „přesýpacích hodin“ nabízíme pacientům proceduru s vytvořením štěpu. Pacientům, u nichž rigidita penisu navzdory farmakoterapii neumožňuje imisi, nabízíme zavedení penilní protézy s manuální modelací. Před zahájením jakéhokoliv typu léčby PD, zejména před operační korekcí, je nezbytné získat pacientův informovaný souhlas. Dále je nutné s pacientem prodiskutovat všechna rizika týkající se snížení rigidity penisu, snížení citlivosti penisu, opožděné ejakulace, zkrácení délky penisu a recidivy nebo přetrvání zakřivení a vše pečlivě zaznamenat do lékařské zprávy. Doporučujeme s pacientem probrat jeho očekávání týkající se výsledného tvaru penisu.
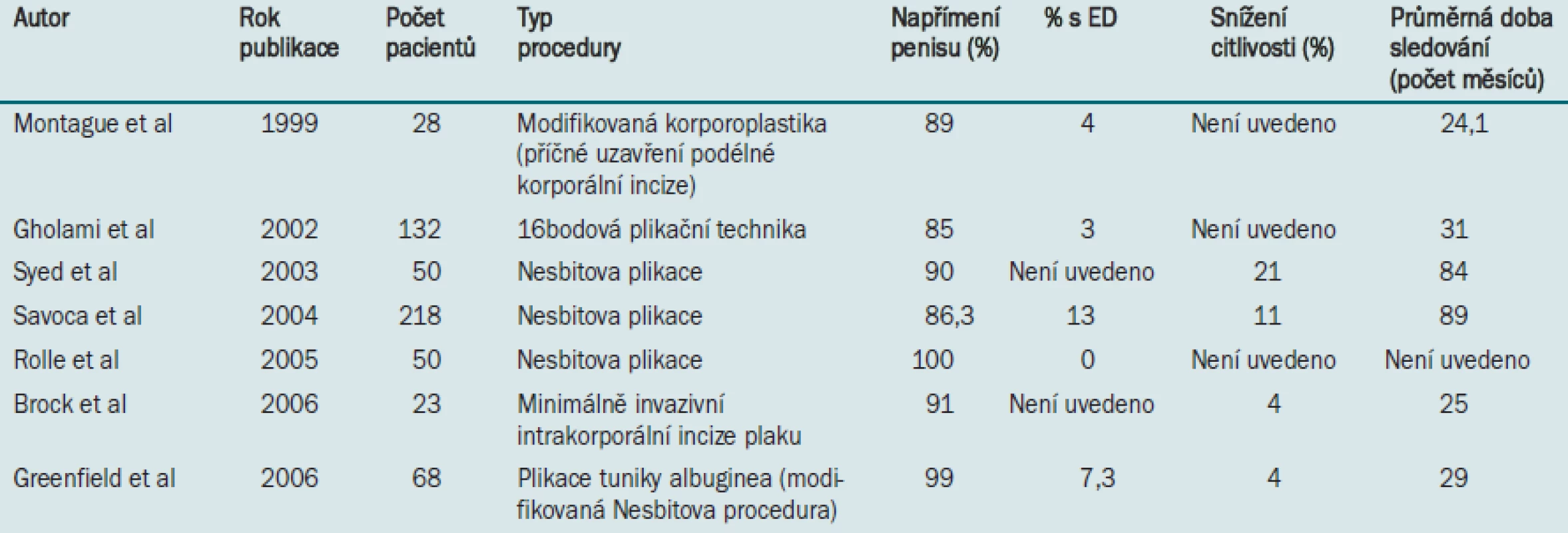
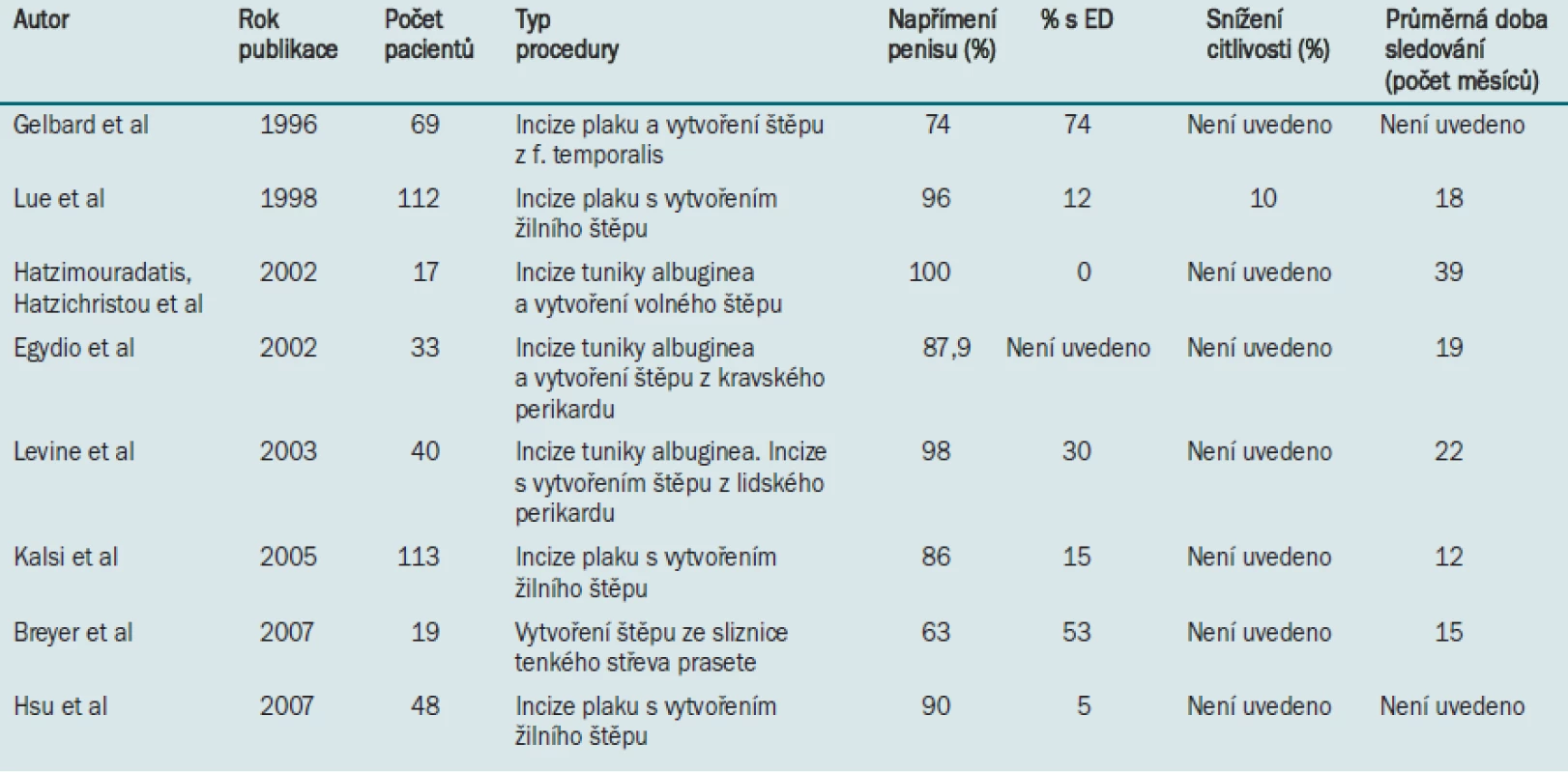
Operační léčbu PD lze obecně rozdělit do dvou kategorií: plikační procedury indikované u pacientů s méně závažným onemocněním a vytvoření štěpu indikované u pacientů s vážnějším zakřivením penisu (> 60 °) nebo u pacientů s „hinge“ efektem. Detailní popis všech dostupných a užívaných technik je mimo rámec tohoto dokumentu. V následující části dokumentu se zabýváme plikací tuniky albuginea a incizí plaku pomocí Tutoplastu® (Coloplast, Minneapolis, MN), jak jsou prováděny v Rush University (Chicago). Další v literatuře publikované výsledky jsou uvedeny v tabulkách 2 a 3.
Plikace tuniky albuginea
Aplikací 60 mg papaverinu a infuzí fyziologického roztoku pomocí infuzní pumpy na operačním sále navodíme artificiální erekci. 1,5–2 cm proximálně ke koroně provedeme obřízkovou incizi, penis obnažíme, čímž odhalíme Buckovu fascii až do oblasti báze penisu. Hemostáze nejlépe dosáhneme pomocí bipolárního proudu a zabráníme tak poranění senzorických nervů.
U pacientů s ventrálním zakřivením otevřeme segment Buckovy fascie, která je uložena na hluboké dorsální žíle, a excidujeme žílu nacházející se naproti bodu maximálního zakřivení. Cirkumflexní a perforující žíly podvážeme pomocí 4-0 hedvábné ligatury. Následně opatrně nadzvedneme laterální neurovaskulární svazky tak, abychom odhalili dorsum tuniky. Přímo nad septem provedeme dvě příčné incize o délce 1,0 cm, které jsou od sebe vzdáleny 0,7–1,5 cm. Incizi dále směřujeme směrem dolů skrze podélná vlákna tuniky, cirkulární vlákna ponecháme intaktní. Tuniku nacházející se mezi těmito dvěma incizemi ztenčíme tak, abychom zmenšili objem tkáně v místě plikace. Pomocí 2-0 pleteného polyesterového vlákna (Tevdek, Teleflex Medical, Fall River, MA) provedeme plikaci tuniky. Steh provedeme invertním vertikálním matracovým způsobem, abychom zanořili uzlík – obvykle umístíme jednu centrální plikační suturu. Plikaci následně posílíme pomocí několika Lembertových 3-0 PDS TM stehů (Ethicon, Somerville, NJ). Napřímení penisu ověříme obnovením artificiální erekce pomocí fyziologického roztoku. Obvykle postačí umístění 2–3 stehů, u některých pacientů může být nezbytné umístění jiného počtu stehů (maximální rozmezí 1–6 stehů).
U pacientů s dorsálním zakřivením otevřeme Buckovu fascii podélně na obou stranách močové trubice a plikační incize vedeme skrze hřeben tuniky, který se nachází po obou stranách uretry. Plikační stehy umístíme stejným způsobem jako při operaci ventrálního zakřivení.
Jakmile dosáhneme uspokojivého napřímení penisu, přiblížíme okraje Buckovy fascie pomocí pokračující 4-0 chromové sutury a incizi uzavřeme pomocí řezací jehly umístěním 4-0 chromové horizontální matracové sutury. Přes suturu umístíme Xeroform® krytí (Tyco Health Care, Mansfield, MA) a ránu překryjeme sterilní gázou. Penis od žaludu až po bázi zabalíme do Coban™ krytí (3M, St. Paul, MN).
Krytí ponecháme po dobu tří dnů, po uplynutí této doby si pacient krytí sám doma odstraní. Dva týdny po operaci pacient podstoupí ambulantní vyšetření. Po uplynutí 2–6 týdnů mají pacienti za úkol provádět dvakrát denně pod dobu 5 minut rehabilitaci (masáž a natahování penisu). Sexuální aktivitu smí pacient zahájit po uplynutí 6 týdnů. Moncada et al [91] ve své studii doporučují pacientům podstupujícím operační rekonstrukci užívání penilního trakčního zařízení 2–3 týdny po operaci. Při každodenním užívání tohoto zařízení po dobu 3 měsíců (8 hodin denně) může pacient zmírnit pooperační zkrácení penisu.
V nedávné době byl proveden přehled údajů týkajících se dlouhodobého sledování pacientů podstupujících TAP (plikaci tuniky albuginea) [92]. Autoři tohoto přehledu hodnotili celkem 90 pacientů (průměrná doba sledování 72 měsíců). U 93 % pacientů došlo k vyléčení zakřivení penisu, pouze u 2 % pacientů došlo k recidivě. 28 % uvedlo výrazné zhoršení rigidity, 88 % pacientů však bylo při perorální aplikaci inhibitorů fosfodiesterázy-5 stále schopno imise. U 68 % pacientů nedošlo k žádné změně citlivosti penisu, 98 % pacientů bylo schopno dosáhnout orgasmu. S ohledem na zkrácení délky penisu, které je známou komplikací plikační operace, uvedlo 74 % pacientů subjektivní zkrácení penisu. Objektivní údaje však prokazují, že u většiny pacientů (82 %) ke zkrácení penisu nedošlo.
Incize Peyronieho plaku/částečná excize a vytvoření štěpu z materiálu Tutoplast®
Penilní rekonstrukce u pacientů se závažnou deformitou vyžaduje incizi plaku nebo částečnou excizi s umístěním štěpu v místě defektu. Štěp lze vytvořit z různých typů tkání, z autologní žíly, z kůže nebo fascie nebo z komerčně dostupných materiálů. Mezi komplikace spojené s vytvářením štěpu patří kontraktura štěpu, recidiva zakřivení penisu, poranění neurovaskulárního svazku a impotence. Ideální materiál pro vytvoření štěpu by měl být snadno dostupný, měl by umožnit navození erekce a užívání tohoto materiálu by mělo umožnit vysokou míru účinnosti s nízkým výskytem komplikací [93]. Ačkoliv ideální materiál pro vytváření štěpu nebyl doposud jednoznačně stanoven, v naší instituci upřednostňujeme Tutoplast® (štěp z perikardu).
Aplikací 60 mg papaverinu a infuzí fyziologického roztoku pomocí infuzní pumpy na operačním sále navodíme artificiální erekci. Penis obnažíme pomocí obřízkové incize, kterou zahájíme 1,5–2 cm proximálně ke koroně. Při korekci dorsálního zakřivení nadzvedneme neurovaskulární svazek nad oblastí maximálního zakřivení a po obou stranách močové trubice provedeme incizi Buckovy fascie. U pacientů bez „hinge“ efektu provedeme prostou příčnou incizi, jejíž střed se nachází v místě maximálního zakřivení, kterou vedeme dále ve směru pozice třetí a deváté hodiny na hodinovém ciferníku po obou dvou stranách těla penisu. Tuto incizi můžeme podélně rozšířit tak, aby s příčnou incizí svírala úhel 30 °. Vytvoříme tak incizi ve tvaru písmene „H“, čímž vznikne obdélníkový defekt. U pacientů s „hinge“ efektem, zářezy nebo rozsáhlou kalcifikací je nutné tkáň před umístěním štěpu excidovat.
Po provedení incize nebo částečné excize plaku penis napřímíme a do všech čtyř rohů defektu umístíme 4-0 PDS™ (Ethicon, Somerville, NJ) fixační sutury. V této fázi operace je nutné změřit délku nataženého penisu, který bude s největší pravděpodobností o 1–3 cm delší než před operací. Fixační sutury jsou užity k napnutí defektu tak, aby umožnily přesné změření defektu v podélném i příčném směru.
Další fixační suturu umístíme do polohy 12 hodin na ciferníku. Tutoplast (štěp z perikardu) připevníme k tunice pokračujícím stehem. Štěp vytvoříme přibližně o 10 % větší pro případ, že by došlo k jeho mírnému zkrácení vlivem svraštění. Znovu navodíme artificiální erekci a provedeme inspekci penisu s cílem detekce jakékoliv zbývající deformace. V případě nutnosti provedeme další plikační proceduru nebo vytvoříme další štěp. Nejnovější analýza prokázala, že dodatečné provedení plikace nemá za následek zhoršení rigidity ani významné zkrácení penisu [94]. Štěp připevníme k vláknům septa pomocí 2–3 prostých 4-0 PDS stehů. Okraje Buckovy fascie přiblížíme pomocí 4-0 chromové sutury (Ethicon, Somerville, NJ), incizi uzavřeme pomocí řezací jehly umístěním 4-0 chromové horizontální matracové sutury. Užíváme stejné krytí jako u TAP procedury, Xeroform® gázu, suché sterilní krytí a Coban™ krytí.
Coban krytí odstraníme tři dny po operaci, 14 dnů po operaci pacient podstoupí ambulantní vyšetření. Pacient má za úkol provádět rehabilitaci v podobě masáže a natahování penisu s cílem urychlení rekonvalescence. 2–3 týdny po operaci se doporučuje užívání penilních trakčních zařízení. Této skupině pacientů také doporučujeme aplikovat 10–50 dní po operaci každou noc nízkou dávku inhibitoru fosfodiesterázy, která umožní obnovu erektilní funkce [94].
V nedávné době jsme provedli přehled dlouhodobých výsledků, jichž dosahujeme v našem centru při léčbě pacientů se závažnou PD pomocí štěpu z materiálu Tutoplast [92]. Tento přehled zahrnoval retrospektivní hodnocení 111 pacientů, kteří podstoupili naši korekční operaci s vytvořením štěpu (průměrná doba sledování 58 měsíců). U 92 % pacientů, z nichž u 12 % došlo k recidivě, umožnila tato technika uspokojivé napřímení penisu. U 35 % došlo následkem operace ke vzniku erektilní dysfunkce, 76 % pacientů však bylo schopno při aplikaci inhibitorů PDE-5 dosáhnout erekce. Stojí za zmínění, že 90 % pacientů užívalo inhibitory PDE-5 již před podstoupením korekční operace. Přestože 65 % pacientů uvedlo, že pociťují zkrácení svého penisu, měření penisu v ochablém stavu v rámci vyšetření prokázalo, že průměrně u pacientů došlo naopak k prodloužení penisu o 0,2 cm. Korekční operace u většiny pacientů žádným způsobem neovlivnila citlivost, 89 % pacientů uvedlo, že jsou schopni dosáhnout orgasmu.
Napřímení penisu pomocí implantace penilní protézy
U pacientů, u nichž se vyskytuje zároveň PD i ED, můžeme korekce zakřivení a definitivní mechanické erekce dosáhnout implantací penilní protézy. Rizika vzniku PD po operační korekci PD jsou dobře známa a byla popsána v řadě publikací a pacientům, kteří jsou před zákrokem schopni dosáhnout erekce, pacientům s vaskulárními komorbiditami nebo závažným zakřivením, které bude pravděpodobně vyžadovat signifikantní excizi plaku a vytvoření štěpu, je tedy vhodné doporučit implantaci penilní protézy. Volba vhodné protézy závisí na rozhodnutí operatéra i pacienta. Dostupná lékařská literatura uvádí implantaci semirigidních implantátů [95,96], dvoudílných implantátů [97,98] a trojdílných implantátů [99,100], pacienti jsou však obvykle nejvíce spokojeni s implantací inflatabilních zařízení [101]. Náš postup spočívá v implantaci penilní protézy, následné modelaci a v případě nutnosti také ve vytvoření uvolňující incize v tunice albuginea s nebo bez vytvoření štěpu ve tvaru „záplaty“ (schéma 2). Protézu zavedeme obvyklým způsobem. Po uzavření korporotomie protézu naplníme, a tak demonstrujeme zakřivení penisu. Hadičku vedoucí k cylindru zasvorkujeme, abychom ochránili pumpu, a penis ohneme v opačném směru, než je směr zakřivení, a v této poloze ho držíme po dobu 60–90 sekund. Cylindry následně naplníme větším množstvím fyzikálního roztoku a proceduru opakujeme tak dlouho, dokud nedosáhneme adekvátního napřímení penisu (reziduální zakřivení ≤ 30 °). Poté cylindry vyprázdníme a naplníme tak, abychom dosáhli 75% rigidity, v této fázi znovu zhodnotíme stupeň napřímení penisu. V případě, že je zakřivení v tomto momentu > 30 °, jednou z možností je provedení uvolňující incize v tunice albuginea a po elevaci překrývající Buckovu fascii. Defekt ≥ 2 cm vyžaduje vytvoření štěpu (upřednostňujeme Tutoplast – štěp z perikardu), který umožní předejít herniaci cylindru nebo recidivující kontraktuře jizvy. Pravidelné užívání penilní protézy po dokonalém zahojení rány také pomáhá zachovat napřímení penisu, protože cylindr implantátu funguje jako vnitřní tkáňový expander.
![Schéma 2. Algoritmus pro implantaci protézy při řešení Peyronieho onemocnění [97].](https://pl-master.mdcdn.cz/media/image/0c64216d0e72b9c05f305571236ce333.png?version=1537792260)
ZÁVĚR
Upřímně doufáme, že vám náš přehled pomůže porozumět vývoji a patogenezi Peyronieho onemocnění a poslouží jako vodítko při výběru vhodné léčby.
Laurence A. Levine, M.D., F.A.C.S.
Professor of Urology,
Department of Urology,
Rush University Medical Center
DrLevine@hotmail.com
Sources
1. La Peyronie F. Sur quelques obstacles qui s'opposent á l'éjaculation naturelle de la semence. Mem Acad Royale Chir 1743; 1 : 337–342.
2. Akkus E. Historical Review of Peyronie's Disease. In: Laurence A. Levine. Peyronie's Disease: a guide to clinical management. New Jersey: Humana Press 2007.
3. Borgogni T. Cyrurgia Edita et Compilata. Venice, 1498 (written 1265–1275).
4. Murphy LJT. Miscellanea: Peyronie's disease (fibrous cavernositis). In: Ch. C. Thomas. The History of Urology. 1st ed. Illinois: Springfield 1972 : 485–486.
5. Wesson MD. Peyronie's disease (plastic induration) cause and treatment. J Urol 1943; 49 : 350–356.
6. Devine et al. Proposal: trauma as the cause of the Peyronie's lesion. J Urol 1997; 157(1): 285–290.
7. Zargooshi et al. Trauma as the cause of Peyronie's disease: penile fracture as a model of trauma. J Urol 2004; 172(1): 186–188.
8. Feiken E, Romer J, Eriksen J et al. Neutrophils expresstumor necrosis factor-alpha during mouse skin wound healing. J Invest Dermatol 1995; 105 : 120.
9. DiPietro LA. Wound healing: The role of the macrophage and other immune cells. Shock 1995; 4 : 233.
10. Ravanti L, Kahari VM. Matrix metalloproteinases in wound repair. Int J Mol Med 2000; 6 : 391–407.
11. El Sakka AI, Hassoba HM, Chui RM. An animal model of Peyronie's like condition associated with an increase of transforming growth factor β mRNA and protein expression. J. Urol 1997; 158 : 2284 – 2290.
12. El Sakka AI, Hassoba HM, Pillarisetty RJ et al. Peyronie's disease is associated with an increase in transforming growth factor-beta protein expression. J Urol 1997; 158 : 1391–1394.
13. Bivalacqua TJ, Champion HC, Leungwattanakij S et al. Evaluation of nitric oxide synthase and arginase in the induction of a Peyronie's like condition in the rat. J Androl 2001; 22 : 497–506.
14. Kucharewicz I, Kowal K, Buczko W et al. The plasmin system in airway remodeling. Thromb Res 2003; 112 : 1–7.
15. Van de Water L. Mechanisms by which fibrin and fibronectin appear in healing wounds: implications for Peyronie's disease. J Urol 1997; 157 : 306–310.
16. Davila H, Magee TR, Rajfer J et al. Peyronie's disease is associated with an increase of plasminogen activator inhibitor-1 in fibrotic plaque. Urology 2005; 65 : 645–648.
17. Davila H, Ferrini M, Rajfer J et al. Fibrin induction of a Peyronie's-like plaque in the rat penile tunica albuginea. BJU Int 2003; 91 : 830–838.
18. Ryu JK, Piao S, Shin HY, et al. IN-1130, A Novel Transforming Growth Factory Type 1 Receptor Kinase (ALK 5) Inhibitor Regresses Fibrotic Plaque and Corrects Penile Curvature in a Rat Model of Peyronie's Disease. [Abst 749]. Annual Meeting of the American Urological Association; 2007.
19. Del Carlo M, Levine LA, Cole AA. Differential regulation of matrix metalloproteinases (MMPs) and tissue inhibitors of matrix metalloproteinases (TIMPs) by interleukin-1 – (IL-1–) and transforming growth factor β (TGF - β in Peyronie's fibroblasts). Abstract, 2007 AUA Meeting.
20. Qian A, Meals RA, Rajfer J et al. Comparison of gene expression profiles between Peyronie's disease and Dupuytren's contracture. Urology 2004; 64(2): 399–404.
21. Polkey HJ. ID induratio penis plastica. Urol Cut Rev 1928; 32 : 287–308.
22. Ludvik W, Wasserburger K. Die Radiumbehandlung der induration penis plastica. Z Urol Nephrol 1968; 61 : 319–325.
23. Devine CJ. Introduction to Peyronie's Disease. J Urol 1997; 157 : 272–275.
24. Linday MB et al. The incidence of Peyronie's disease in Rochester, Minnesota, 1950 through 1984. J Urol 1991; 146 : 1007–1009.
25. Sommer F et al. Epidemiology of Peyronie's disease. Int J Impot Res 2002; 14 : 379–383.
26. Mulhall JP, Creech SD, Boorjian SA et al. Subjective and objective analysis of the prevalence of Peyronie's disease in a population of men presenting for prostate cancer screening. J Urol 2004; 171 : 2350 – 2353.
27. La Rochelle JC, Levine LA. A Survey of Primary - Care Physicians and Urologists Regarding Peyronie's Disease. J Sex Med; 4 : 1167–1173.
28. Levine LA, Estrada CR, Storm DW et al. Peyronie's disease in younger men: Characteristics and treatment results. J Androl 2003; 24 : 27–32.
29. Tefekli A, Kandirali E, Erol H et al. Peyronie's disease in men under 40: characteristics and outcome. Int J Impot Res 2001; 13 : 18–23.
30. Briganti A et al. Clinical presentation of Peyronie's disease in young patients. Int J Impt Res 2003; 15: S44–47.
31. Deveci S, Hopps CV, O'Brien K et al. Defining the clinical characteristics of Peyronie's disease in young men. J Sex Med 2007; 4(2): 485–490.
32. Williams JL, Thomas GG. The natural history of Peyronie's disease. J Urol 1970; 103 : 75.
33. Gelbard MK, Dorey F, James K. The natural history of Peyronie's disease. J Urol 1990; 144 : 1376 – 1379.
34. Kadioglu A et al. A retrospective review of 307 men with Peyronie's disease. J Urol 2002; 168 : 1075–1079.
35. Akin-Olugbade Y, Mulhall JP. The medical management of Peyronie's disease. Nature Clinical Practice Urology 2007; 4(2): 95–103.
36. Levine LA, Greenfield JM. Establishing a standardized evaluation of the man with Peyronie's disease. International Journal of Impotence Research 2003; 15(5): S103–112.
37. Scott WW, Scardino PL. A new concept in the treatment of Peyronie's disease. South Med J 1948; 41 : 173–177.
38. Sikka SC, Hellstrom WJ. Role of oxidative stress and antioxidants in Peyronie's disease. Int J Impot Res 2002; 14 : 353–360.
39. Gholami SS, Gonzalez-Cadavid NF, Lue TF et al. Peyronie's disease: a review. J Urol 2002; 169 : 1234 – 1241.
40. Pryor JP, Farell CF. Controlled clinical trial of Vitamin E in Peyronie's disease. Prog Reprod Biol 1983; 9 : 41–45.
41. Akkus E, Carrier S, Rehman J et al. Is colchicine effective in Peyronie's disease? A pilot study. Urology 1994; 44 : 291–295.
42. Kadioglu A, Tefekli A, Koksal T et al. Treatment of Peyronie's disease with oral colchicine: long term results and predictive parameters of successful outcome. Int J Impot Res 2000; 12 : 169–175.
43. Safarinejad MR. Therapeutic effects of colchicine in the management of Peyronie's disease: a randomized double-blind, placebo-controlled study. Int J Impot Res 2004;16 : 238–243.
44. Zarafonetis CJ, Horrax TM. Treatment of Peyronie's disease with potassium para-aminobenzoate (potaba). J Urol 1959; 81 : 770–772.
45. Hasche-Klunder R. Treatment of peyronie's disease with para-aminobenzoacidic potassium (POTABA) (author's transl). Urologe A 1978; 17 : 224–227.
46. Weidner W, Schroeder-Printzen I, Rudnick J et al. Randomized prospective placebo-controlled therapy of Peyronie's disease (IPP) with Potaba (aminobenzoate potassium). J Urol 1999; 6 : 205.
47. Weidner W, Hauck EW, Schnitker J. Potassium paraaminobenzoate (Potaba) in the treatment of Peyronie's disease: a prospective, placebo-controlled, randomized study. Eur Urol 2005; 47 : 530–535.
48. Ralph DJ, Brooks MD, Bottazzo GF et al. The treatment of Peyronie's disease with tamoxifen. Br J Urol 1992; 70 : 648–651.
49. Colletta AA, Wakefield LM, Howell FV et al. Antioestrogens induce the secretion of active transforming growth factor beta from human fetal fibroblasts. Br J Caner 1990; 62 : 405–409.
50. Teloken C, Rhoden EL, Grazziotin TM et al. Tamoxifen versus placebo in the treatment of Peyronie's disease. J Urol. 1999; 162 : 2003–2005.
51. Biagiotti G, Cavallini G. Acetyl-L-carnitine vs. tamoxifen in the oral therapy of Peyronie's disease: a preliminary report. BJU Int 2001; 88 : 63–67.
52. Valente EG, Vernet D, Ferrini M et al. L-Arginine and phosphodiesterase (PDE) inhibitors counteract fibrosis in the Peyronie's fibrotic plaque and related fibroblast cultures. Nitric Oxide 2003; 9 : 229–244.
53. Brant WO, Dean RC, Lue TF. Treatment of Peyronie's disease with oral pentoxifylline. Nat Clin Pract Urol 2006; 3 : 111–115.
54. Martin DJ, Badwan K, Parker M et al. Transdermal application of verapamil gel to the penile shaft fails to infiltrate the tunica albuginea. J Urol 2002; 168 : 2483–2485.
55. Fitch WP, Easterling J, Talbert RL et al. Topical Verapamil HCl, Topical Trifluoperazine, and Topical Magnesium Sulfate for the Treatment of Peyronie's Disease – A Placebo-Controlled Pilot Study. J Sex Med 2007; 4 : 477–484.
56. Levine LA. Comment on Topical Verapamil HCl, Topical Trifluoperazine, and Topical Magnesium Sulfate for the Treatment of Peyronie's Disease – A Placebo - Controlled Pilot Study. J Sex Med 2007; 4 : 1081 – 1082.
57. Bodner H, Howard AH, Kaplan JH. Peyronie's disease: cortisone-hyaluronidase-hydrocortisone therapy. J Urol 1954; 400–403.
58. Winter CC, Khanna R. Peyronie's disease: results with dermo-jet injection of dexamethasone. J Urol 1975; 114(6): 898–900.
59. Williams G, Green NA. The non-surgical treatment of Peyronie's disease. Br J Urol 1980; 52 : 392–395.
60. Gelbard MK, Walsh R, Kaufman JJ. Collagenase for Peyronie's disease experimental studies. Urol Res 1982; 10 : 135–140.
61. Gelbard MK, Linkner A, Kaufman JJ. The use of collagenase in the treatment of Peyronie's disease. J Urol 1985; 134 : 280–283.
62. Gelbard MK, James K, Riach P, Dorey F. Collagenase vs. placebo in the treatment of Peyronie's disease: a double blind study. J Urol 1993; 149 : 56–58.
63. Roth M, Eickelberg O, Kohler E et al. Ca2 + channel blockers modulate metabolism of collagens within the extracellular matrix. Proc Natl Acad Sci USA 1996; 93 : 5748–5482.
64. Mulhall JP, Anderson MS, Lubrano T et al. Peyronie's disease cell culture models: phenotypic, genotypic and functional analyses. Int J Impot Res 2002; 14 : 397–405.
65. Levine LA, Merrick PF, Lee RC. Intralesional verapamil injection for the treatment of Peyronie's disease. J Urol 1994; 151 : 1522–1524.
66. Rehman J, Benet A, Melman A. Use of intralesional verapamil to dissolve Peyronie's disease plaque: a long term single-blind study. Urology 1998; 51 : 620–626.
67. Levine LA, Estrada CR. Intralesional verapamil for the treatment of Peyronie's disease: a review. Int J Impot Res 2002; 14 : 324–328.
68. Bennett NE, Guhring P, Mulhall JP. Intralesional verapamil Prevents the Progression of Peyronie's Disease. Urology 2007; 69 : 1181–1184.
69. Duncan MR, Berman B, Nseyo UO. Regulation of the proliferation and biosynthetic activities of cultured human Peyronie's disease fibroblasts by interferonsalpha, -beta and -gamma. Scand J Urol Nephrol 1991; 25 : 89–94.
70. Wegner HE, Andreson R, Knipsel HH et al. Treatment of Peyronie's disease with local interferon-alpha - 2b. Eur Urol 1995; 28 : 236–240.
71. Wegner HE, Andresen R, Knipsel HH et al. Local interferon-alpha-2b is not an effective treatment in early-stage Peyronie's disease. Eur Urol 1997; 32 : 190–193.
72. Ahuja S, Bivalacqua TJ, Case J, Vincent M, Sikka SC, Hellstrom WJ. A pilot study demonstrating clinical benefit from intralesional interferon alpha 2B in the treatment of Peyronie's disease. J Androl 1999; 20 : 444–448.
73. Dang G, Matern R, Bivalacqua TJ et al. Intralesional interferon-alpha-2b injections for the treatment of Peyronie's disease. South Med J 2004; 97 : 42–46.
74. Hellstrom WJ, Kendirici M, Matern R et al. Singleblind, multicenter placebo-controlled parallel study to asses the safety and efficacy of intralesional interferon - alpha-2b for minimally invasive treatment for Peyronie's disease. J Urol 2006; 176 : 394–398.
75. Levine LA. Review of current nonsurgical management of Peyronie's disease. Int J Impot Res 2003; 15: S113–120.
76. Hauck EW, Altinkilic BM, Ludwig M et al. Extracorporeal shock wave therapy in the treatment of Peyronie's disease. First results of a case-controlled approach. Eur Urol 2000; 38 : 663–669.
77. Hatzichristodoulou G, Meisner C et al. Efficacy of Extracorporeal Shock Wave Therapy (ESWT) in patients with Peyronie's disease (PD) ? first results of a prospective, randomized, placebo-controlled, singleblind study. [Abst 993] Annual Meeting of the American Urological Association; 2006.
78. Hatzichristodoulou G, Meisner C et al. Efficacy Of Extracorporeal Shock Wave Therapy On Plaque Size And Sexual Function In Patients With Peyronie's Disease – Results of a Prospective, Randomized, Placebo - Controlled Study. [Abst. 747] Annual Meeting of the American Urological Association; 2007.
79. Riedl CR, Plas E, Engelhard P et al. Iontophoresis for treatment of Peyronie's disease. J Urol 2000; 163 : 95–99.
80. Montorsi F, Salonia A, Guazzoni G et al. Transdermal electromotive multi-drug administration for Peyronie's disease: preliminary results. J Androl 2000; 21 : 85–90.
81. Di Stasi SM, Giannantoni A, Capelli G et al. Transdermal electromotive administration of verapamil and dexamethasone for Peyronie's disease. BJU Int 2003; 91 : 825–829.
82. Di Stasi SM, Giannantoni A, Stephen RL et al. A prospective, randomized study using transdermal electromotive administration of verapamil and dexamethasone for Peyronie's disease. J Urol 2004; 171 : 1605–1608.
83. Levine LA, Estrada CR, Show W et al. Tunica albuginea tissue analysis after electromotive drug administration. J Urol 2003; 169 : 1775–1778.
84. Greenfield JM, Shah SJ, Levine LA. Verapamil vs. saline in electromotive drug administration (EDMA) for Peyronie's disease: a double blind, placebo controlled trial. J Urol 2007; 177 : 972–975.
85. Ojingwa JC, Isseroff RR. Electrical stimulation of wound healing. J Invest Dermatol 2003; 121 : 1–12.
86. Preito Castro RM, Leva Vallejo ME, Regueiro Lopez JC et al. Combined treatment with vitamin E and colchicines in the early stages of Peyronie's disease. BJU Int 2003; 91 : 522–524.
87. Mirone V, Palmieri A, Granata AM et al. Ultrasound - Guided ESWT in Peyronie's disease plaques. Arch Ital Urol Androl 2000; 72 : 384–387.
88. Mirone V, Imbimbo C, Palmieri A et al. Our experience on the association of a new physical and medical therapy in patients suffering from induration penis plastica. Eur Urol 1999; 36 : 327–330.
89. Cavallini G, Biagiotti G, Koverech A et al. Oral propionyl - l-carnitine and intraplaque verapamil in the therapy of advanced and resistant Peyronie's disease. BJU Int 2002; 89 : 895–900.
90. Levine LA, Lenting EL. Experience with a surgical algorithm for Peyronie's disease. J Urol 1997; 158 : 2149–2152.
91. Moncada I, Jara J, Marinez J et al. Managing Penile Shortening After Peyronie's Disease Surgery. [Abst 750] Annual Meeting of the American Urological Association; 2007.
92. Taylor FL, Levine LA. Surgical Correction of Peyronie's Disease via Tunica Albuginea Plication or Plaque Partial Excision with Pericardial Graft: Long Term Follow-Up. [Abst 748 ] Annual Meeting of the American Urological Association; 2007.
93. Kadioglu A, Sanli O, Akman T et al. Graft materials in Peyronie's disease surgery: a comprehensive review. J Sex Med 2007; 4 : 581–595.
94. Greenfield JM, Estrada CR, Levine LA. Erectile dysfunction following surgical correction of Peyronie's disease and a pilot study of the use of sildenafil citrate rehabilitation for postoperative erectile dysfunction. J Sex Med 2005; 2 : 241–247.
95. Carson CC, Hodge GB, Anderson EE. Penile prosthesis in Peyronie's disease. Br J Urol 1983; 55 : 417–421
96. Ghanem HM, Fahmy I, El Meliegy A. Malleable penile implants without plaque surgery in the treatment of Peyronie's disease. Int J Impot Res 1998; 10 : 171–173.
97. Levine LA, Dimitriou RJ. A surgical algorithm for penile prosthesis placement in men with erectile failure and Peyronie's disease. Int J Impot Res 2000; 12 : 147–151.
98. Levine LA, Estrada CR, Morgentaler A. Mechanical reliability and safety of and patient satisfaction with the Ambicor inflatable penile prosthesis: results of a two center study. J Urol 2001; 166 : 932–937.
99. Montague DK, AngermeierKW, Lakin MM, Ingleright BJ. AMS 3-piece inflatable penile prosthesis implantation in men with Peyronie's disease: comparison of CX and Ultrex cylinders. J Urol 1996; 156 : 1633–1635.
100. Dowalczyk JJ, Mulcahy JJ. Penile curvatures and aneurismal defects with the Ultrex penile prosthesis corrected with insertion of the AMS 700CX. J Urol 1996; 156 : 398–401.
101. Montorsi F, Rigatti P, Carmignani G et al. AMS three-piece inflatable implants for erectile dysfunction: a long-term multi-institutional study in 200 consecutive patients. Eur Urol. 2000; 37 : 50–55.
Literatura k tabulce 2
1. Daitch JA, Angermeier KW, Montague DK. Modified corporoplasty for penile curvature: long-term results and patient satisfaction. J Urol 1999; 162 : 2006 – 2009.
2. Gholami SS, Lue TF. Correction of penile curvature using the 16-dot plication technique: a review of 132 patients. J Urol 2002; 167 : 2066–2069.
3. Syed AH, Abbasi Z, Hargreave TB. Nesbit procedure for disabling Peyronie's curvature: a median follow-up of 84 months. Urology 2003; 61 : 999–1003.
4. Savoca G, Scieri F, Pietropaolo F et al. Straightening corporoplasty for Peyronie's disease: a review of 218 patients with median follow-up of 89 months. Eur Urol 2004; 6 : 610–614.
5. Rolle L, Tamagnone A, Timpano M et al. The Nesbit operation for penile curvature: an easy and effective technical modification. J Urol 2005; 173 : 171–173.
6. Bella AJ, Beasley KA, Obied A, Brock GB. Minimally invasive intracorporeal incision of Peyronie's plaque: initial experiences with a new technique. Urology 2006; 68 : 852–857.
7. Greenfield JM, Lucas S, Levine LA. Factors affecting the loss of length associated with tunica albuginea plication for correction of penile curvature. J Urol 2006; 175 : 238–241.
Literatura k tabulce 3
1. Gelbard MK. Relaxing incisions in the correction of penile deformity due to Peyronie's disease. J Urol 1995; 154 : 1457–1460.
2. El-Sakka AI, Rashwan HM, Lue TF. Venous patch graft for Peyronie's disease. Part II: outcome analysis. J Urol 1998; 160 : 2050–2053.
3. Hatzichristou DG, Hatzimouratidis K, Apostolidis A et al. Corporoplasty using tunica albuginea free grafts for penile curvature: surgical technique and long-term results. J Urol 2002; 167 : 1367–1370.
4. Egydio PH, Lucon AM, Arap S. Treatment of Peyronie's disease by incomplete circumferential incision of the tunica albuginea and plaque with bovine pericardium graft. Urology 2002; 59 : 570–574.
5. Levine LA, Estrada CR. Human cadaveric pericardial graft for the surgical correction of Peyronie's disease. J Urol 2003; 170 : 2359–2362.
6. Kalsi J, Minhas S, Christopher N, Ralph D. The results of plaque incision and venous grafting (Lue procedure) to correct the penile deformity of Peyronie's disease. BJU Int 2005; 95 : 1029–1033.
7. Breyer BN, Brant WO, Garcia MM et al. Complications of porcine small intestine submucosa graft for Peyronie's disease. J Urol 2007; 177 : 589–591.
8. Hsu GL, Chen HS, Hsieh CH et al. Long-term results of autologous venous grafts for penile morphological reconstruction. J Androl 2007; 28 : 186–193.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2008 Issue 4
-
All articles in this issue
- Peyronieho choroba
- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Priapismus
- Systém hodnocení erektilní dysfunkce pomocí stupnice EHS
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
- Aktuality v andrologické endokrinologii
- Role retroperitoneální lymfadenektomie u pacientů s nonseminomovými germinálními tumory varlat a poruchy ejakulace
- Klinická praxe založená na důkazech: Úvod do problematiky pro urology
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Peyronieho choroba
- Priapismus
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
