Jak lépe pracovat s odbornou literaturou
HOW TO BECOME A BETTER CONSUMER OF THE LITERATURE
Every urologists, irrespective as to whether he practices in a community or academic setting is faced with the routine challenge of sifting through a myriad of scientific articles each month. Whether the literature is industry sponsored literature obtained through the mail or one of a growing body of peer reviewed urological and surgical journal articles, there seems to be no end to the body of evidence that the urologist must evaluate. The challenge is daunting to all of us, in particular those that have not received any further training in clinical study design and biostatistics since medical school. The following article hopes to address this issue by introducing the basic tenets of how to evaluate with regards to the statistics. The article will examine several Inferential statistical concepts (reaching conclusions beyond the data itself) that should assist one in critical appraisal of the literature.
Key words:
evidence-based medicine, statistics, outcomes, urology
Authors:
R. L. Sur
Authors‘ workplace:
Assistant Professor of Surgery Division of Urology, UCSD Comprehensive Kidney Stone Center, Director
Published in:
Urol List 2009; 7(4): 46-49
Overview
Každý urolog bez ohledu na to, zda působí v soukromé praxi nebo na akademické půdě, musí každý měsíc čelit obrovskému přívalu vědeckých statí. Ať se jedná o propagační sponzorované materiály nebo stále se zvětšující objem recenzovaných urologických a chirurgických časopisů, zdá se, že objem literatury, kterou musí urolog zvládnout, je téměř nekonečný. Tento úkol je skličující pro všechny, zejména pro ty lékaře, kteří po ukončení lékařské fakulty neabsolvovali žádný další kurz zaměřený na design klinických studií a biostatistiku. Náš článek se zabývá touto problematikou a uvádí přehled základních principů pro hodnocení literatury na základě statistických modelů. Autor popisuje několik konceptů statistické inference, které mohou být užitečné při kritickém hodnocení literatury.
Klíčová slova:
medicína založená na důkazech, statistika, výsledky, urologie
TESTOVÁNÍ HYPOTÉZY
Testování hypotézy je postup, který kliničtí vědci užívají při hodnocení otázek a ověřování nebo vyvracení validity. Jedná se o strukturovaný postup, pomocí něhož lze vyvodit závěr ze souboru údajů (např. srovnání dvou nebo více skupin). Po vytvoření hypotézy je navržena studie, která umožní potvrdit nebo vyvrátit danou hypotézu. Tento koncept je třeba odlišovat od „generování hypotézy“, což je proces shromáždění dat, a na jejich základě vytvoření hypotéz nebo otázek. Povšimněme si zavedeného pořadí – v případě testování hypotézy je nejprve design studie a poté závěr, zatímco v případě generování hypotézy se nejprve nashromáždí patřičná data a následně se formuluje otázka. V druhém případě může být závěr vyvozen na základně chybné metodiky vzhledem k tomu, že závěr vychází z údajů, které nemusely být nutně nashromážděny pro zodpovězení daného dotazu.
Testování hypotézy vyžaduje nulovou hypotézu (Ho) a alternativní hypotézu (HA). Ho předpokládá, že zastoupení hodnot ve dvou nebo více populacích je totožné – např. objem stolice u kojenců léčených pomocí loperamidu je ekvivalentní jako objem stolice u kojenců neužívajících loperamid. HA předpokládá, že zastoupení hodnot ve dvou nebo více populacích není totožné – např. objem stolice u kojenců léčených pomocí loperamidu není ekvivalentní jako objem stolice u kojenců neužívajících loperamid.
CHYBY 1. A 2. DRUHU
Porozumění hypotézám Ho a HA nám pomůže pochopit výskyt dvou základních chyb, k nimž dochází při testování hypotézy – chyb 1. a 2. druhu. K chybě prvního druhu (rovněž nazývaná jako α chyba) dochází, pokud nulová hypotéza platí, ovšem studie tuto skutečnost (tj. že nulová hypotéza je pravdivá) neprokáže. Jinými slovy je možné tvrzení, že dvě nebo více skupin mají různá zastoupení, i když ve skutečnosti mají zastoupení stejné. Využijeme opět náš předchozí příklad – předpokládejme, že ve skutečnosti je objem stolice kojenců léčených loperamidem totožný. Výsledek studie však ukazuje, že objem stolice je rozdílný. V tomto případě se jedná o chybu prvního druhu (α).
Chyba 1. druhu je hodnota předem stanovená výzkumníkem během designování studie nebo a priori. Tato chyba by neměla být v žádném případě stanovena až po analýze souboru dat. Po ukončení studie jsou údaje analyzovány a v případě, že je p-hodnota menší než hladina spolehlivosti α (obvykle, ale nikoliv nezbytně α = 0,05), je tato považována za statisticky signifikantní. Pokud je p-hodnota menší než α hladina, výzkumník potvrzuje statistickou významnost, nebo jinými slovy „zamítne nulovou hypotézu“. Konečně p-hodnotu lze také interpretovat jako pravděpodobnost nesprávného zamítnutí nulové hypotézy – tj. pravděpodobnost, že výzkumník potvrzuje existenci rozdílu, ačkoliv ve skutečnosti žádný rozdíl neexistuje.
Podobně chyba 2. druhu (nebo taktéž β chyba) znamená předpoklad tvrzení, že distribuce dvou nebo více populací je stejná, ačkoliv se ve skutečnosti liší. K této chybě dochází, pokud alternativní hypotéza platí, ovšem studie tuto skutečnost neprokáže. Pokud využijeme náš předchozí příklad – předpokládejme, že ve skutečném životě je objem stolice kojenců léčených loperamidem rozdílný, studie však tento fakt neprokáže. V tomto případě se jedná o chybu druhého druhu (β).
Chyba druhého druhu nabývá na významu, pokud se dostáváme ke konceptu „statistické síly“. Sílu studie lze definovat jako schopnost detekovat rozdíly. Matematicky se síla vyjádří jako 1-β. Čím nižší je chyba β, tím větší je síla studie. Hodnota β byla na základě úmluvy stanovena na 2,0 (20 %), tato hodnota byla předem domluvena, stejně jako α = 0,05.
Praktickou ukázkou demonstrujeme, jaký klinický význam má změna chyby prvního druhu. Tyto hodnoty jsou opět stanoveny a priori – nikoliv po nashromáždění dat. Pokud zvolíme nižší α, dojde ke vzniku menšího počtu chyb prvního druhu. Kupříkladu testujeme nový chemoterapeutický protokol pro léčbu povrchového karcinomu močového měchýře o nízkém grade, kdy dosavadní možnosti léčby dosahují vynikajících výsledků. Je třeba se ujistit o tom, že nový medikament je vysoce účinný – v tomto případě zvolíme nízkou chybu prvního druhu (např. α = 0,01).
V případě, že zvolíme větší α, dojde k výskytu většího počtu chyb prvního druhu, tj. může se zdát, že je přítomen rozdíl, který ve skutečnosti neexistuje. Kupříkladu testujeme novou modalitu pro léčbu metastazujícího karcinomu močového měchýře, kdy k dispozici máme pouze velmi málo jiných alternativních možností. V tomto případě se jeví jako logické zvolit větší šanci volbou neúčinné léčby (tj. můžeme zvolit α = 0,10) a pokračovat v dalším výzkumu.
Užívání chyb prvního a druhého druhu má pro sestavení studie nesmírný význam. Tyto hodnoty jsou stanoveny před zahájením studie a je možné je nastavit na jakoukoli hodnotu klinického scénáře. P-hodnota je naopak stanovena po nashromáždění dat. Jedná se o hodnotu stanovenou na základě výpočtu (podle užívaného statistického nástroje, např. t-test, chí-kvadrát), nikoliv výzkumníkem samotným. Pokud je p-hodnota < než chyba prvního druhu nebo α, je dosaženo statistické významnosti.
NEGATIVNÍ STUDIE
Přehled 112 randomizovaných kontrolovaných studií publikovaných v urologické literatuře, které neprokázaly „žádný rozdíl“ mezi léčenými větvemi, prokázal, že dvě třetiny studií nemělo ve skutečnosti dostatečnou statistickou sílu [1]. Dvě třetiny studií, které byly v tomto přehledu klasifikovány jako „negativní studie“, by měly být označovány jako „neprůkazné“. K důkazu toho, zda tyto neprůkazné studie jsou skutečně negativní, byly nutné větší studie. Námitka, kterou lze vznést u skutečně negativních studií, je, že nemají dostatečnou statistickou sílu – dostatek subjektů, které mohou ospravedlňovat tvrzení, že se jedná skutečně o negativní studii.
Studie bez dostatečné statistické síly představují velké riziko, a to hned z několika důvodů. Zaprvé mohou vést k chybným závěrům, a ohrozit tak další výzkum. Zadruhé mohou být sestaveny způsobem, který vede k plýtvání klinickým výzkumem. Dále mohou být subjekty vystaveny zbytečnému riziku, případně se může jevit jako neetické vyvozovat definitivní závěry bez adekvátního výzkumu.
VÝSKYT CHYB PŘI SLOŽITĚJŠÍM TESTOVÁNÍ
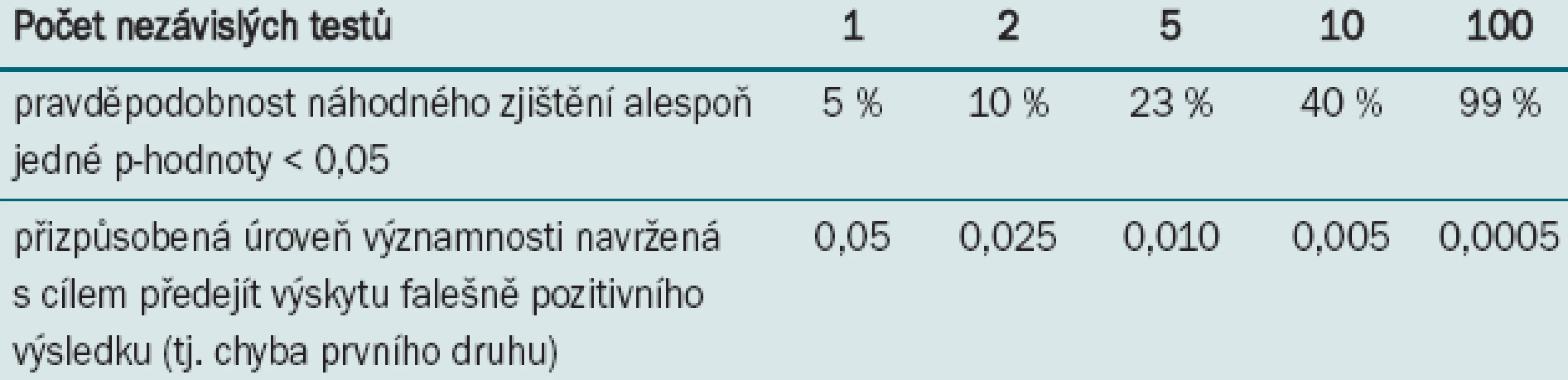
Jak již bylo uvedeno, běžná chyba prvního druhu je nastavena na α = 0,05. P-hodnota < 0,05 je v tomto případě považována za statisticky významnou, což znamená, že existuje 5% pravděpodobnost, že rozdíl vznikl náhodně. Tato statisticky významná p-hodnota = 5 % předpokládá, že je testován pouze jeden nezávislý test. Pokud testujeme více než jeden nezávislý test, je pravděpodobnost, že je signifikantní p-hodnoty dosaženo náhodně, vyšší než 5 %. Při provádění dvou nezávislých testů je pravděpodobnost 10 % a při provádění tří nezávislých testů 23 %. V podstatě platí, že čím více testů provádíme, tím vyšší je pravděpodobnost, že náhodně dospějeme k statisticky významnému výsledku. Přehlédnutí této zvyšující se pravděpodobnosti se nazývá chyba mnohonásobného testování. Jednou z celé škály metod umožňujících identifikaci tohoto druhu chyby (a zároveň metodou nejjednodušší) je Bonferroniho test (tab. 1).
VELIKOST ÚČINKU
Rozdíly (nebo naopak podobnost) různých typů léčby lze nejlépe vyjádřit pomocí veličiny nazývané velikost účinku. Tato veličina může mít celou řadu podob, pečlivý čtenář odborné literatury však porozumí všem. Jednotlivé aspekty lze nejlépe ilustrovat na příkladu.
Vezměme si dvě větve randomizované kontrolované studie (RCT) testující skutečnost, zda daný medikament zvyšuje mortalitu. Tato studie má dichotomický výsledek (tj. „ano“, pakliže daná skutečnost nastane, a „ne“, pakliže nikoliv). Existuje několik způsobů, jak vyjádřit následující výsledek studie. Ve skupině pacientů užívajících medikament (x) byla zaznamenána 6% míra mortality, zatímco v placeno skupině (y) 10% míra mortality.
Můžeme pouze konstatovat, že aplikace medikamentu snižuje riziko mortality o 4 %, což znamená, že snížení absolutního rizika (ARR) = y – x (0,10 – 0,06 = 0,04).
Další možností jak tento výsledek interpretovat je pomocí relativního rizika (RR), kdy započteme poměr rizika. Každá ze skupin může být čitatel nebo jmenovatel (např. x/y (0,06/0,10 = 0,60), což lze interpretovat jako 60% riziko úmrtí při farmakoterapii (ve srovnání s placebem).
Toto riziko lze dále vyjádřit pomocí snížení relativního rizika (RRR), kdy je riziko 1-RR nebo 1 – x/y (1 – 0,60 = 0,40). RRR potom představuje 40% snížení mortality při farmakoterapii.
Další metodou je NNT, což vyjadřuje počet pacientů, které je nezbytné léčit za určitý časový interval, aby bylo dosaženo pozitivního výsledku nebo zamezeno výskytu negativní příhody. NNT vypočítáme jako 1/ARR nebo 1/y – x(1/0,04 = 25). Tento výsledek lze interpretovat následujícím způsobem: pro zachránění jednoho života musí léčbu podstoupit 25 pacientů.
Poslední metodou, kterou se budeme zabývat, je poměr šancí (OR). Pro vysvětlení tohoto konceptu je užitečné použít tabulku sestávající ze 2 × 2 buněk (tab. 2). V našem příkladu užijeme údaje ze studie PCPT (tab. 3) [2]. Poměr šancí představuje jednoduše vyhlídky jednotlivých kohort. Nejprve spočítáme na základě údajů PCPT vyhlídky pro každou větev studie zvlášť. Šance vzniku karcinomu prostaty u pacienta užívajícího finasterid je 0,22 = 803/3565, zatímco šance vzniku karcinomu prostaty u pacienta užívajícího placebo je 0,32 = 1147/3545. Oba výsledky následně podělíme a získáváme OR = 0,69 = 0,22/ 0,32. Tuto analýzu lze interpretovat následujícím způsobem: šance, že u pacienta užívajícího finasterid dojde v průběhu sedmi let (délka trvání PCPT studie) ke vzniku karcinomu prostaty, je 0,69 (ve srovnání s placebem). Nebo jinými slovy: aplikace finasteridu snižuje pravděpodobnost vzniku karcinomu prostaty o 31 % (1 – 0,69 = 0,31). Povšimněte si ve schématu 1, že relativní riziko (RR) a poměr šancí (OR) představují matematicky rozdílné výpočty. Existují však případy, kdy se sobě oba výpočty poměrně blíží. V případě, že je riziko [a/(a + b) ] velmi nízké, tzn. hodnota „a“ je velmi nízká, vzorec RR se blíží vzorci OR – tj. a/b. OR a RR se tedy potom stávají ekvivalentní.


Volba prezentace údajů jedním z výše uvedených způsobů závisí pouze na výzkumníkovi. Přesto je důležité, aby čtenář odborné literatury efektu různých metod prezentace údajů rozuměl. Zejména velikost účinku je nejzřetelnější při užití RRR (ve srovnání s ARR), jak můžeme vidět v prvním příkladě, kdy je aplikace medikamentu (x) spojena s 6% mírou mortality a aplikace placeba (y) s 10% mírou mortality. Při aplikaci medikamentu bylo zaznamenáno 4% ARR mortality, zatímco RRR mortality bylo 40 %, čímž v druhém případě získáváme dojem větší účinnosti. Studie sponzorované komerčními subjekty z tohoto důvodu obvykle upřednostňují uvádění výsledků za pomoci RRR, informovaný a poučený čtenář však bude rozumět efektu jednotlivých způsobů prezentace údajů. Možnost přepočítání výsledků pomocí dalších metod (ARR, OR, RRR, NNT apod.) umožní čtenáři vytvořit si přesnější představu o prezentovaných údajích.
INTERVAL SPOLEHLIVOSTI
Jak přesný byl odhad výsledku léčby?
Odhad výsledku léčby je skutečně pouhý odhad založený na vzorku studie a pravděpodobně neodráží skutečný odhad vzhledem k tomu, že za daných podmínek nelze testovat celkovou populaci. Výše popsaný výpočet se nazývá bodový odhad. My však potřebujeme vyjádřit odhadované rozmezí skutečného účinku. K tomuto účelu se užívá CI (interval spolehlivosti) – měřítko přesnosti. Obvykle se uvádí jako 95% CI, což znamená, že s 95% pravděpodobností se náš „pravdivý“ odhad nachází v konkrétním rozmezí hodnot. Tyto složitější výpočty lze provádět pomocí statistických programů, další detaily týkající se této problematiky lze vyhledat v seznamu literatury [3].
PCPT studie uvádí 25% ARR mortality a 95% CI 18–30 %, což jinými slovy znamená, že s 95% pravděpodobností se výzkumníci domnívají, že skutečný odhad poklesu mortality při aplikaci finasteridu leží v rozmezí 18–30 %. V případě, že CI – pro hodnocení velikosti účinku léčby na základě ARR nebo RRR – zahrnuje nulu, hodnoty jsou pova-žovány za statisticky nevýznamné (CI v PCPT studii nezahrnoval nulu a výsledek byl tedy statisticky významný (p < 0,001)).
ZÁVĚR
Tento článek představuje čtenáři přehled základních konceptů statistické inference, která je osnovou pro kritické hodnocení odborné literatury. Pochopení této problematiky pomůže čtenáři lépe se orientovat v odborné literatuře a stanovit klinická rozhodnutí.
Roger L. Sur, M.D.
Assistant Professor of Surgery
Division of Urology
UCSD Comprehensive Kidney Stone
Center, Director
200 West Arbor Drive #8897
San Diego, CA 92103
rogersur@mac.com
Sources
1. Breau RH, Carnat TA, Gaboury I. Inadequate statistical power of negative clinical trials in urological literature. J Urol 2006; 176(1): 263–266.
2. Thompson IM, Goodman PJ, Tangen CM et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003; 349(3): 215–224.
3. Motulsky H. Intuitive biostatistics. New York: Oxford University Press; 1995.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2009 Issue 4
-
All articles in this issue
- Vývoj a implementace laparoskopické simulace na zvířecím modelu v rámci urologických tréninkových programů
- Jak lépe pracovat s odbornou literaturou
- Technika se zachováním cév při operaci striktury v proximální anteriorní části močové trubice: primární anastomóza a augmentovaná anastomóza
- Léčba hyperaktivního měchýře u žen
- Roboticky asistovaná laparoskopická prostatektomie: kritické hodnocení výsledků
- Srovnání peroperačního průběhu, časných komplikací a funkčních výsledků robotické a otevřené radikální prostatektomie
- Operační anatomie prostaty a pánevního dna pro účely provádění radikální prostatektomie a radikální cystektomie: nejdůležitější body pro dosažení onkologické bezpečnosti, kontroly močové kontinence a erektilní funkce
- Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
- Možnosti léčby kostního postižení u karcinomu prostaty
- Roboticky asistované a laparoskopické urologické operační výkony ve Spojených Státech: současný stav
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Srovnání peroperačního průběhu, časných komplikací a funkčních výsledků robotické a otevřené radikální prostatektomie
- Operační anatomie prostaty a pánevního dna pro účely provádění radikální prostatektomie a radikální cystektomie: nejdůležitější body pro dosažení onkologické bezpečnosti, kontroly močové kontinence a erektilní funkce
- Roboticky asistovaná laparoskopická prostatektomie: kritické hodnocení výsledků
- Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
