Guidelines EAU pro léčbu chronické pánevní bolesti
EAU Guidelines on Chronic Pelvic Pain
Context:
These guidelines were prepared on behalf of the European Association of Urology (EAU) to help urologists assess the evidence-based management of chronic pelvic pain (CPP) and to incorporate the recommendations into their clinical practice.
Objective:
To revise guidelines for the diagnosis, therapy, and follow-up of CPP patients.
Evidence acquisition:
Guidelines were compiled by a working group and based on a systematic review of current literature using the PubMed database, with important papers reviewed for the 2003 EAU guidelines as a background. A panel of experts weighted the references.
Evidence synthesis:
The full text of the guidelines is available through the EAU Central Office and the EAU Web site (www.uroweb.org). This article is a short version of the full guidelines text and summarises the main conclusions from the guidelines on the management of CPP.
Conclusions:
A guidelines text is presented including chapters on chronic prostate pain and bladder pain syndromes, urethral pain, scrotal pain, pelvic pain in gynaecologic practice, neurogenic dysfunctions, the role of the pelvic floor and pudendal nerve, psychological factors, general treatment of CPP, nerve blocks, and neuromodulation. These guidelines have been drawn up to provide support in the management of the large and difficult group of patients suffering from CPP.
Key words:
bladder pain syndrome, chronic pelvic pain, EAU guidelines, interstitial cystitis, prostate pain syndrome, prostatitis
Authors:
M. Fall 1; A. P. Baranowski 2; S. Elneil 3; D. Engeler 4; J. Hughes 5; E. J. Messelink 6; F. Oberpenning 7; A. C. De C. Williams 8
Authors‘ workplace:
Department of Urology, Sahlgrenska Academy, Göteborg University, Göteborg, Sweden
1; Pain Management Centre, The National Hospital for Neurology and Neurosurgery, University College London Hospitals Foundation Trust, London, United Kingdom
2; Centre for Urogynaecology, The National Hospital for Neurology and Neurosurgery, University College London Hospitals Foundation Trust, London, United Kingdom
3; Department of Urology, Cantonal Hospital St. Gallen, St. Gallen, Switzerland
4; Pain Management Unit, The James Cook University Hospital, Middlesborough, United Kingdom
5; Department of Urology, University Hospital Groningen, Groningen, The Netherlands
6; Department of Urology, St-Agnes Hospital, Bocholt, Germany
7; University College London Hospitals Foundation Trust, London, United Kingdom
8
Published in:
Urol List 2010; 8(3): 93-106
Overview
Kontext:
Tato guidelines byla vytvořena jménem Evropské urologické asociace (EAU) s cílem pomoci urologům při řešení chronické pánevní bolesti (CPP) a začlenit doporučení uvedená v těchto guidelines do běžné klinické praxe.
Cíl:
Aktualizace guidelines pro diagnostiku, léčbu a sledování pacientů s CPP.
Získání důkazů:
Údaje sloužící jako podklad pro tento dokument získala pracovní skupina na základě systematického průzkumu současné literatury s pomocí databáze PubMed. Osnovu tvoří významné články hodnotící EAU guidelines z roku 2003. Vybraná literatura byla posouzena panelem odborníků.
Syntéza důkazů:
Úplná verze guidelines je k dispozici prostřednictvím EAU Central Office a webových stránek Evropské urologické asociace (www.uroweb.org). Tento dokument představuje zkrácenou verzi těchto guidelines a uvádí souhrn nejvýznamnějších závěrů guidelines pro léčbu CPP.
Závěr:
Tento dokument zahrnuje kapitoly týkající se chronické bolesti prostaty a syndromu bolesti v oblasti močového měchýře, bolesti v močové trubici, bolesti ve skrotu, pánevní bolesti v gynekologické praxi, neurogenní dysfunkce, role pánevního dna a pudendálního nervu, psychologických faktorů, obecné léčby CPP, nervové blokády a neuromodulace. Tato guidelines byla vytvořena s cílem poskytnout podporu lékařům při léčbě velké a komplikované populace pacientů trpících chronickou pánevní bolestí.
Klíčová slova:
syndrom bolesti v močovém měchýři, chronická pánevní bolest, EAU guidelines, intersticiální cystitida, syndrom bolesti v prostatě, prostatitida
1. ÚVOD
Pracovní skupina Evropské urologické asociace (EAU) zabývající se tematikou chronické pánevní bolesti (CPP) připravila tato guidelines s cílem pomoci urologům hodnotit CPP na základě důkazů a zařadit doporučení uvedená v guidelines do běžné klinické praxe. Tento přehledný článek představuje jakýsi souhrn v nedávné době aktualizované verze EAU guidelines CPP z roku 2008, která je k dispozici jak v tištěné podobě, tak na webových stránkách Evropské urologické asociace [1].
2. ZÍSKÁNÍ DŮKAZŮ
Údaje sloužící jako podklad pro tento dokument získala EAU Guidelines Group (EAU pracovní skupina) na základě systematického průzkumu literatury. Články pocházejí z databáze Medline, výukových materiálů na dané téma a dalších pomocných dokumentů. Autoři se zaměřili na získání kvalitních údajů, a to tak, aby pokryli časový úsek mezi touto publikací a předchozí verzí guidelines z roku 2003 [2].
V případě, že to bylo možné, klasifikovala EAU pracovní skupina doporučení pro léčbu pomocí třístupňové bodovací škály (A–C), která čtenářům usnadní posoudit validitu jednotlivých doporučení.
3. SYNTÉZA DŮKAZŮ
3.1. Diagnostika a klasifikace
Chronická (rovněž označovaná jako perzistentní) bolest souvisí se změnami v centrálním nervovém systému (CNS), které mohou způsobovat, že pacient pociťuje bolest i navzdory absenci akutního poranění. Tyto změny mohou dále zintenzivňovat jednotlivé vjemy – nebolestivé stimuly jsou pak vnímány jako bolestivé (alodynie) a bolestivé stimuly jsou vnímány jako více bolestivé, než bychom předpokládali (hyperalgezie). Hlavní svalovina (např. pánevní svalovina) se může stát hyperalgetickou v důsledku celé řady spouštěcích momentů. Senzitivizovat se mohou i další orgány (např. děloha při dyspareunii a dysmenorrhoee nebo střeva při symptomech dráždivého střeva).
Ke změnám v centrálním nervovém systému dochází podél celé nervové osy. Abnormální eferentní aktivita pak může vyvolávat funkční (např. symptomy dráždivého střeva) a strukturální změny (např. neurogenní otok u některých pacientů se syndromem bolestivého močového měchýře). Centrální změny mohou být příčinou psychických změn, které pak svým vlastním způsobem ovlivňují mechanizmy bolesti.
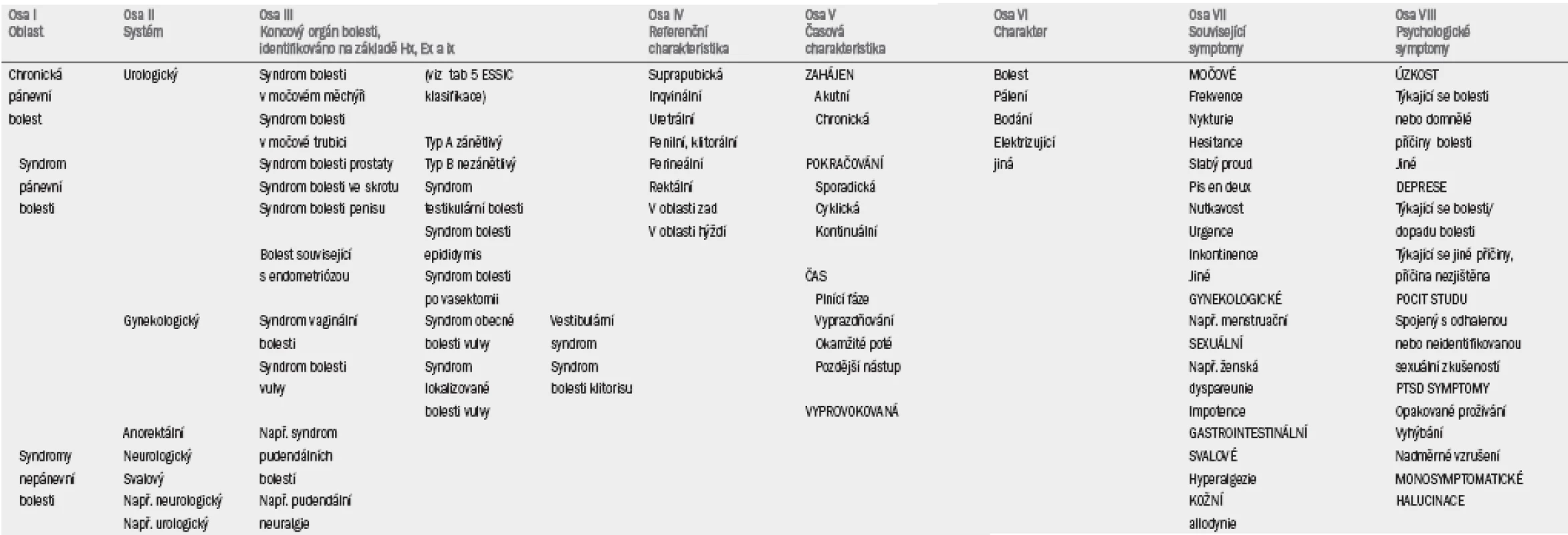
Pomocí základního vyšetření je nutné vyloučit přítomnost „dobře definovaných“ patologií. V případě negativního výsledku je nepravděpodobné, že u pacienta bude přítomna dobře definovaná patologie. Při speciálních indikacích je nutné provedení dalších vyšetření (např. pro subklasifikaci bolestivého syndromu). Autoři EAU guidelines se vyhýbají užívání nepodložené diagnostické terminologie, jež má za následek indikaci nevhodných vyšetření, nepatřičné léčby a pacientova očekávání a v neposlední řadě horší prognózu [4]. Klasifikace uváděná v těchto guidelines představuje výsledek snahy celé řady pracovních skupin. Je pravděpodobné, že stávající klasifikace bude dále modifikována. Tab. 1 není zcela vyčerpávající a zdůrazňuje hlavně urologické bolestivé syndromy.
3.2 Terminologie syndromu chronické pánevní bolesti
Tab. 2 uvádí definice některých termínů užívaných pro popis chronické pánevní bolesti [1,2,5].

3.3 Klasifikace syndromů chronické pánevní bolesti
EAU klasifikace z roku 2004 byla aktualizována tak, aby odrážela výsledky vyšetření a další léčby bolestivých syndromů, což umožňuje překrývání mechanizmů u různých onemocnění. Dále podporuje fenomén vzájemného překrývání symptomů a multidisciplinární přístup k léčbě (tab. 1) [1,2,5,6].
Při užívání klasifikace v tab. 1 je nutné začít v levé části tabulky a pokračovat do pravé části pouze v případě, že je možné bezpečně potvrdit, že bolest je přítomna v konkrétním systému a orgánu. V řadě případů nelze postoupit dále než k označení stavu jako syndromu pánevní bolesti. Například u mnoha případů označovaných dříve jako prostadynie nelze jistě stanovit, zda bolest pochází z prostaty nebo jiné oblasti (např. svaloviny pánevního dna). Z tohoto důvodu jsou podobné případy označovány termínem syndrom pánevní bolesti.
ESSIC (European Society for the Study of IC/PBS) v nedávné době definovala syndrom BPS/intersticiální cystitidy [7,8], který byl podpořen mezinárodním konsenzem [7,8]. Podobně jako v EAU systému ESSIC vyloučila dobře definované nepánevní (nejednoznačné) stavy. ESSIC dále rozdělila BPS/IC syndrom na základě výsledků cystoskopie a biopsie (tab. 5) [8].
3.4 Algoritmus pro diagnostiku a léčbu chronické pánevní bolesti
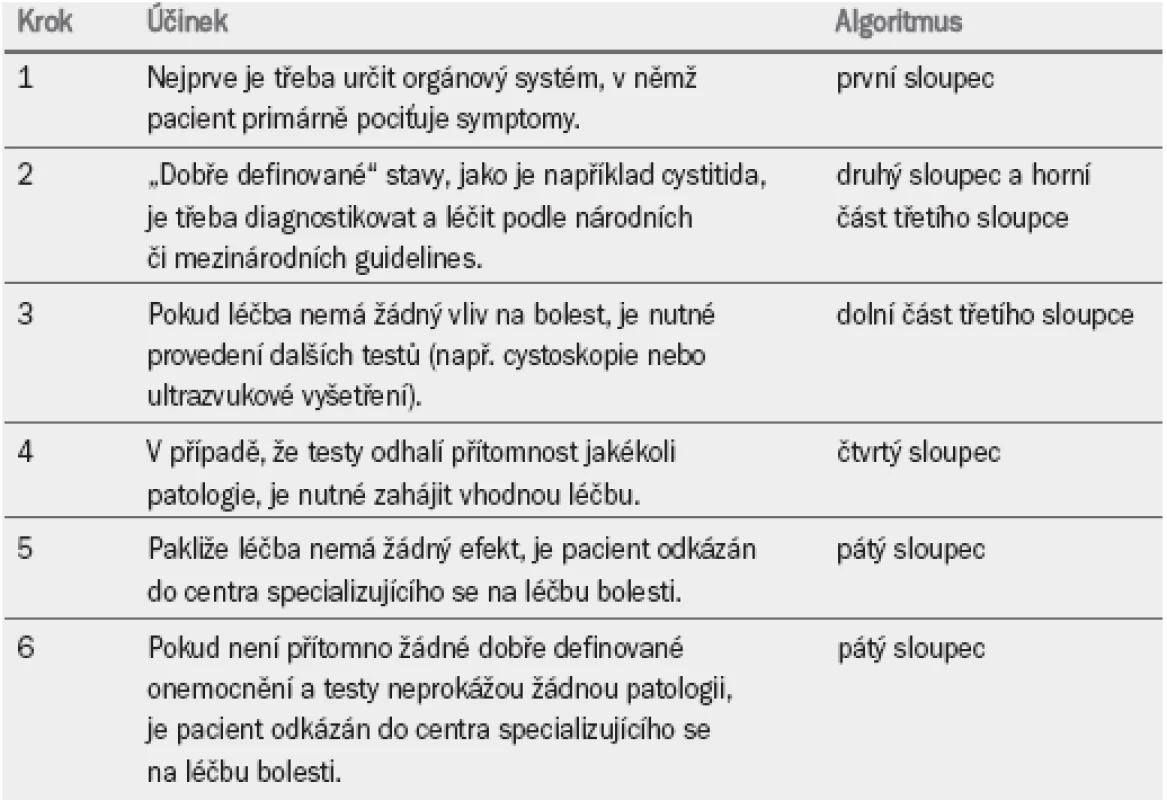
Algoritmus pro diagnostiku a léčbu CPP (schéma 1) byl navržen jako návod provázející lékaře celým procesem od diagnostiky k léčbě. Lékař by měl postupovat po krocích 1–6 (tab. 3) při dodržování vhodného sloupce v algoritmu. Podle klinické praxe jsou nejprve prezentovány různé bolestivé syndromy, po kterých následují obecné možnosti léčby.
![Schéma 1. Algoritmus pro diagnostiku a léčbu chronické pánevní bolesti (CPP). Pro další vysvětlení je čtenář odkázán ke kompletnímu textu CPP Guidelines [1].](https://pl-master.mdcdn.cz/media/image/ce160bdd924cf7edc458e7deebfed703.png?version=1537790281)
4. ZÁVĚRY
4.1 Syndrom bolesti prostaty
Na základě obecnější definice (tab. 2) se užívá termín syndrom bolesti prostaty (PPS) raději než termín chronická prostatitida/syndrom chronické pánevní bolesti, který navrhla NIDDK (National Institute of Diabetes and Digestive and Kidney Diseases). PPS popisuje přetrvávající pocit dyskomfortu nebo bolesti v pánevní oblasti při současně sterilním vzorku kultivace moči a signifikantním/nesignifikantním počtu bílých krvinek ve vzorcích specifických pro prostatu (tj. semeno, prostatická sekrece, moč odebraná po masáži prostaty) [9]. Vzhledem k tomu, že rozlišení PPS na zánětlivý/nezánětlivý podtyp nemá žádný klinický dopad na diagnózu ani terapii onemocnění, lze PPS považovat za jeden celek.
4.1.1 Patogeneze
Etiologie i patofyziologie PPS zůstávají nadále záhadou, ačkoli je pravděpodobné, že zde jistou roli hrají centrální neurologické mechanizmy. U pacienta s PPS nejsou zjištěny žádné známky infekce, není přítomna uretritida, urogenitální karcinom, uretrální striktura ani neurologické onemocnění ovlivňující močový měchýř. Prokázáno není rovněž ani žádné zjevné onemocnění renálního systému [9].
4.1.2 Diagnostika
PPS představuje symptomatické onemocnění. Je diagnostikováno na základě anamnézy přetrvávající bolesti v močopohlavním systému a absence jiných patologií v dolních cestách močových. Závažnost onemocnění, jeho progresi a odpověď na léčbu lze hodnotit pouze prostřednictvím validovaných symptom skóre [10,11], jako je například Prostatitis Symptom Index amerického National Institutes of Health [12].
Test čtyř sklenic (považovaný za zlatý standard) ke zjištění lokalizace bakteriální infekce [13] je pro užití v běžné urologické praxi příliš složitý [9]. Úspěch diagnostiky lze za cenově rozumných podmínek zvýšit při užití snadné screeningové metody – testu dvou sklenic nebo pomocí testu před masáží prostaty a po ní (PPMT) [14], kdy PPMT umožňuje stanovit správnou diagnózu u více než 96 % pacientů [15].
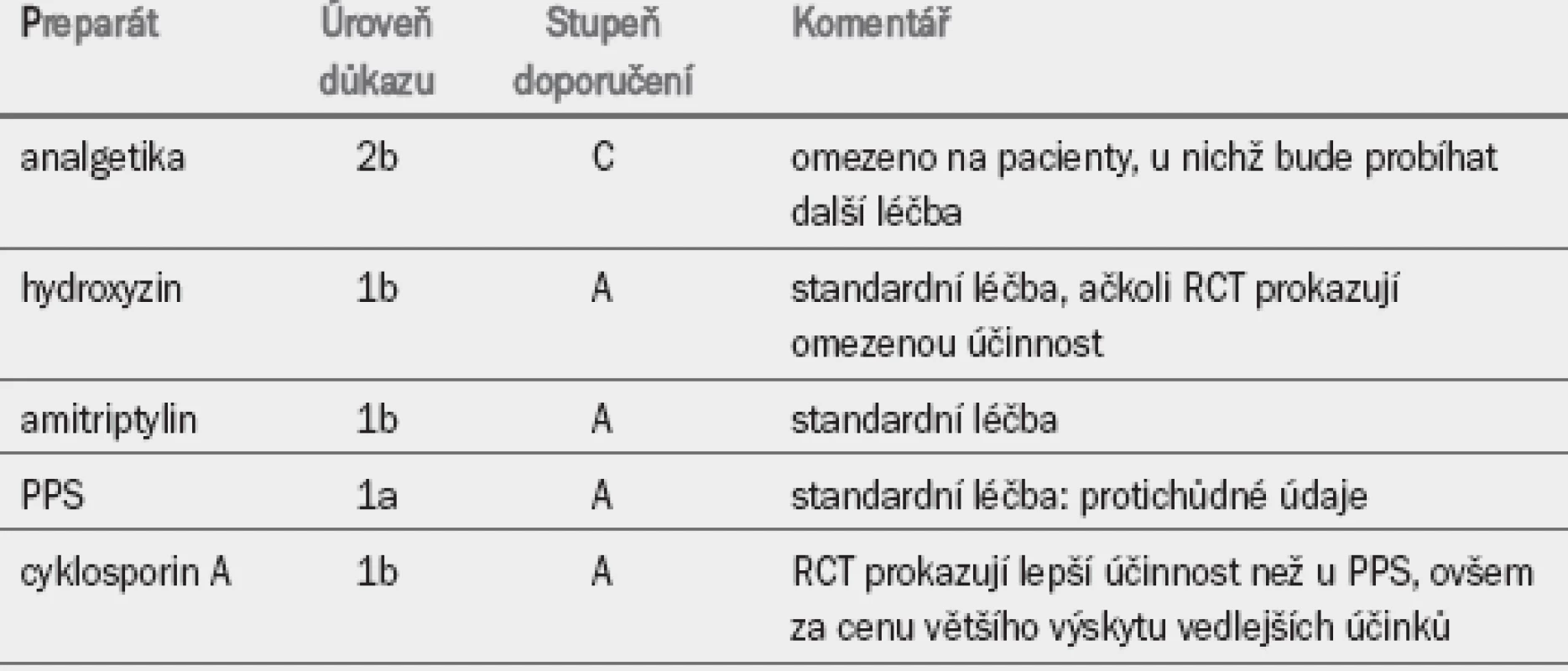
4.1.1 Léčba
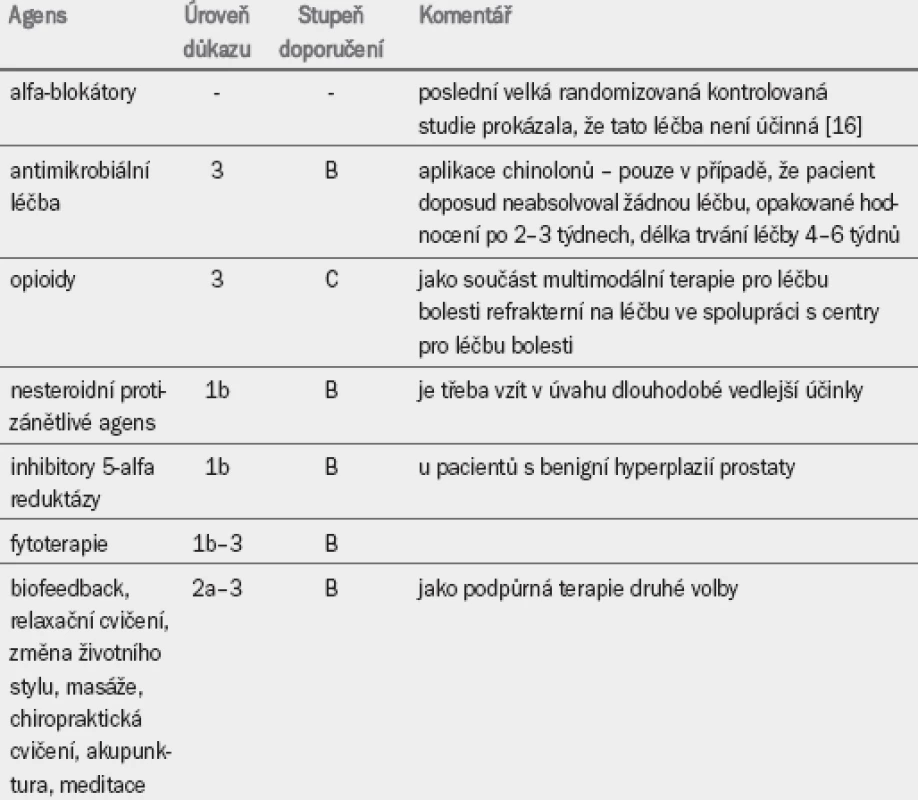
Vzhledem k neznámé etiologii PPS je léčba často individuální. Většina pacientů vyžaduje multimodální léčbu zaměřenou na hlavní symptomy se zřetelem na ostatní komorbidity. Nejnovější výsledky randomizovaných kontrolovaných studií obohatily naše poznatky o různých léčebných modalitách (tab. 4) [16].
4.2 Syndrom bolesti v oblasti močového měchýře/intersticiální cystitida
Je velmi důležité si uvědomit, že BPS/IC představuje heterogenní spektrum poruch, které jsou doposud špatně definovány, kdy zánět hraje významnou roli pouze u malé skupiny pacientů. Aby bylo možné obsáhnout všechny pacienty, kteří trpí bolestí v močovém měchýři, doporučují se přesnější termíny syndrom bolestivého močového měchýře (PBS) a syndrom bolesti v močovém měchýři [6,8]. Což znamená, že IC představuje specifický typ chronického zánětu močového měchýře, zatímco PBS nebo BPS označují bolest, kterou pacient pociťuje v oblasti močového měchýře. V tomto dokumentu používáme termín syndrom bolesti v močovém měchýři (tedy BPS).
4.2.1 Definice
Vzhledem k obtížnosti definovat IC (např. kritéria NIDDK konsenzu na konci osmdesátých let minulého století [17]) se užívá velmi široká škála diagnostických kritérií.
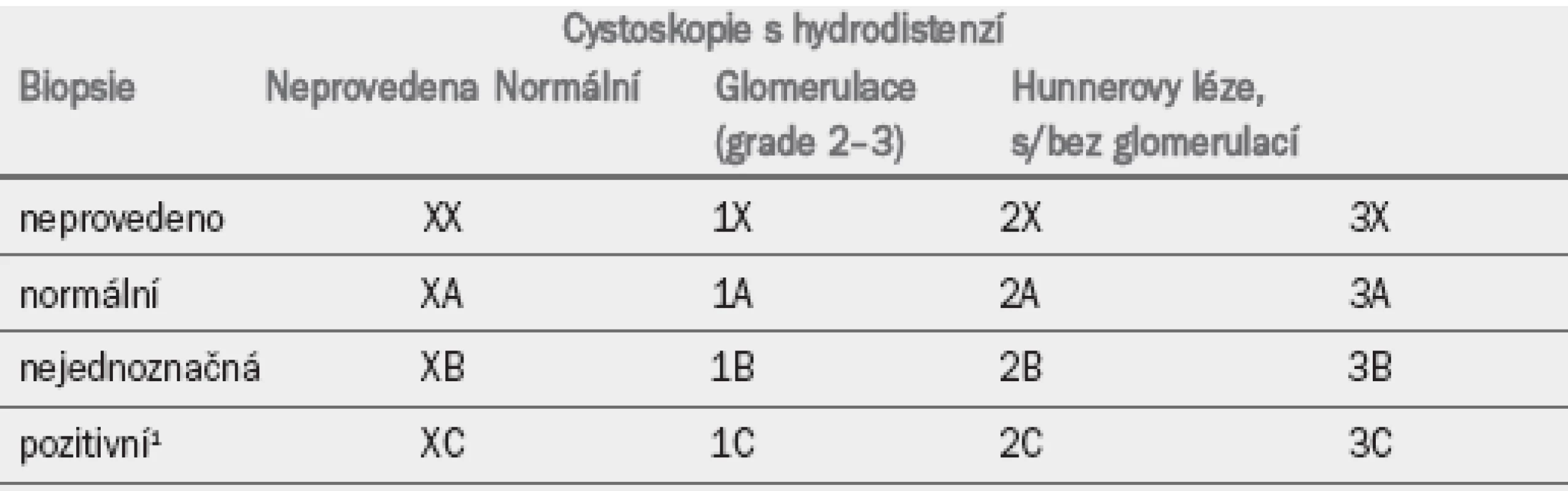
ESSIC navrhla v roce 2004 a opakovaně v roce 2008 standardizované schéma diagnostických kritérií [8,18], která by usnadnila srovnávání různých studií. BPS/IC by měla být diagnostikována na základě bolestivých symptomů souvisejících s močovým měchýřem, doprovázených alespoň jedním dalším symptomem, jako je například denní a/nebo noční frekvence. Je třeba prokázat, že příčinou symptomů není žádné nejednoznačné onemocnění. Může být indikována cystoskopie s hydrodistenzí a biopsie (tab. 5) [8].
4.2.2 Patogeneze
Pro vysvětlení příčiny BPS/IC existuje řada odlišných hypotéz, včetně infekce, zánětu, autoimunitní reakce, defektu vrstvy glykosaminoglykanů, hypoxie a centrálních neurologických mechanizmů [19].
4.2.3 Epidemiologie
Zprávy uvádějící prevalenci BPS/IC se významně liší – americká studie uvádí, že tímto onemocněním může trpět až 20 % žen [20]. Naopak incidence BPS/IC na základě diagnostiky lékařů v okrese Olmsted (MN, USA) byla extrémně nízká – pouhých 1,1 případů na 100 000 osob [21]. Existuje stále větší množství důkazů, které prokazují, že BPS/IC může mít genetickou komponentu – urgence/frekvence byla častěji zaznamenána u 35 % příbuzných (ženského pohlaví) pacientů s BPS a 33 % pacientů s uretrálním syndromem [22]. Dále byla prokázána souvislost mezi BPS a zánětlivým onemocněním střev, systémovým onemocněním lupus erythematosus, Sjögrenovým syndromem, syndromem dráždivého střeva, fibromyalgií, endometriózou a panickými stavy [23–26]. Vynikající přehled zkoumá společný výskyt BPS/IC s dalšími nevysvětlenými klinickými stavy popsanými v literatuře [27].
4.2.4 Diagnostika
BPS/IC je diagnostikována na základě symptomů, vyšetření, rozboru moči, cystoskopie s hydrodistenzí a biopsie (schéma 2). Pacienti si stěžují na charakteristickou bolest a močovou frekvenci, která je v některých případech extrémní a vždy zahrnuje nykturii. Charakter bolesti souvisí se stupněm naplnění močového měchýře – obvykle se zhoršuje spolu se zvětšujícím se objemem měchýře. Je lokalizována suprapubicky, v některých případech vystřeluje do třísel, vaginy, rekta nebo sakra. Při vymočení dochází k úlevě od bolesti, která se ovšem brzy vrací [28–31].

Oba podtypy IC se navzájem liší klinickou manifestací a věkem pacientů [32]. Přítomnost těchto stavů lze rozlišit neinvazivními metodami [33]. Oba podtypy navíc různě odpovídají na léčbu [34–37] a vykazují odlišné histopatologické, imunologické a neurobiologické vlastnosti [19,38–43].
Diagnózu IC lze podpořit pomocí testu propustnosti močového měchýře s užitím chloridu draselného, symptom skóre a biologických markerů.
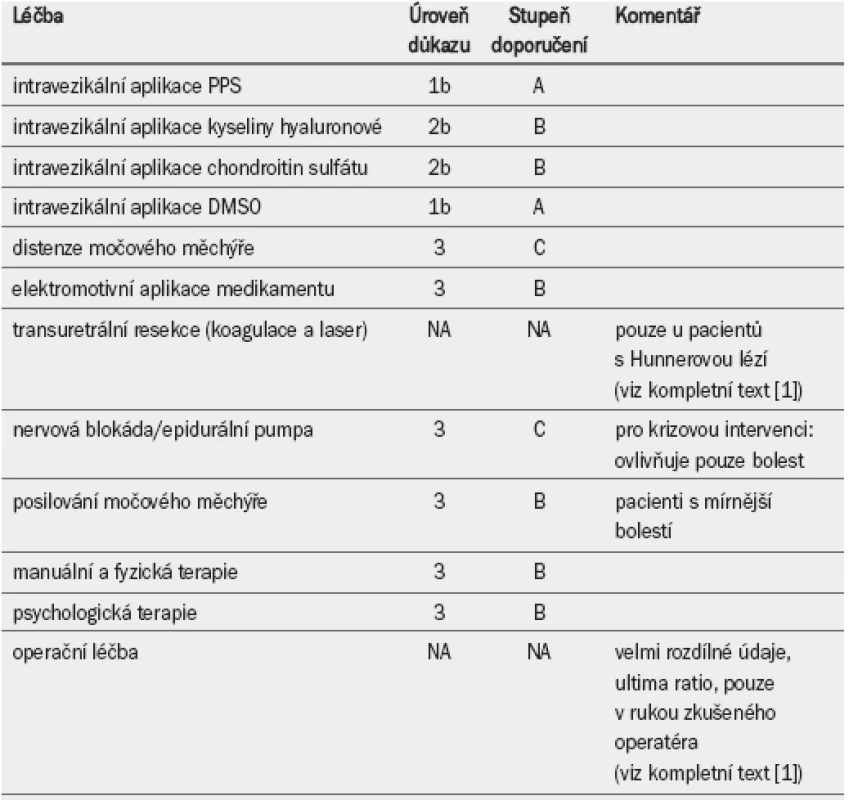
4.2.5 Léčba
Doporučení pro léčbu BPS/IC jsou uvedena v tabulkách 6 a 7.
4.3 Syndrom bolesti ve skrotu
U pacientů s bolestmi ve skrotu je nutné v každém případě provést fyzikální vyšetření. Jemná palpace každé části skrota umožní detekovat jakékoli rezistence a bolestivá místa. Digitální rektální vyšetření slouží k detekci abnormalit na prostatě a vyšetření svaloviny pánevního dna. Ultrazvukové vyšetření skrota má při hledání příčiny bolesti pouze omezený význam [44]. Bolest ve skrotu může mít spouštěcí mechanizmy jak v pánevním dnu, tak ve svalovině dolní části břicha. U pacientů se syndromem bolesti ve skrotu existují pouze omezené důkazy pro operaci. Doporučuje se multidisciplinární přístup včetně fyzioterapie.
4.4 Syndrom bolesti v močové trubici
Syndrom bolesti v močové trubici představuje velmi špatně definované onemocnění. Mezi pozitivní diagnostické znaky (ačkoli nemusí být vždy přítomny) patří citlivost močové trubice nebo bolest pociťovaná při palpaci a zánět sliznice močové trubice detekovaný pomocí endoskopického vyšetření. Hypotézy o příčině onemocnění zahrnují přítomnost skryté infekce periuretrálních žláz nebo duktů a nedostatečnost estrogenů. Někteří autoři považují syndrom bolesti v močové trubici za méně závažnou formu „časné“ BPS/IC [22]. V klinické praxi je syndrom bolesti v močové trubici obvykle diagnostikován u pacientů, kteří uvádějí bolest nebo dyskomfort v souvislosti s močením (s frekvencí i bez ní, nykturie, urgence a nutkavé inkontinence) bez jakýchkoli známek výskytu močové infekce. Absence močové infekce je poměrně problematická, protože metody běžně užívané pro identifikaci močové infekce jsou v tomto případě extrémně necitlivé. Bolest nebo dyskomfort pociťovaný v souvislosti s močením se označuje termínem dysurie. Je třeba mít na paměti, že syndrom bolesti v močové trubici se často nevyskytuje samostatně, ale spíše jako jedna ze složek syndromu chronické bolesti.
Léčba je velmi komplikovaná a doposud nebylo dosaženo konsenzu v otázce postupu léčby. Tradičně se doporučuje dilatace močové trubice s aplikací antibiotika v podobě masti s kortizonem, k dispozici však nemáme žádné důkazy, které by tuto léčbu podporovaly. V různých studiích byly testovány další modality, jako je například systémová aplikace antibiotik, alfa-blokátorů, akupunktura nebo laserová terapie [45]. Léčba tohoto syndromu může vyžadovat multidisciplinární přístup.
4.5 Pánevní bolest v gynekologické praxi
U pacientek trpících pánevní bolestí spoléhá gynekolog na odebrání kompletní klinické anamnézy, fyzikální vyšetření a indikaci vhodných testů (např. stěr, zobrazovací vyšetření pánve a diagnostické laparoskopické vyšetření), které umožní detekci léčitelné příčiny a její léčbu s využitím nejúčinnějších dostupných terapií. Největší terapeutickou výzvu však představuje 30 % pacientek, u nichž není příčina odhalena [46].
Nejčastější případy bolesti v gynekologické praxi jsou spojeny s následujícími onemocněními: dysmenorhoea, infekce v oblasti pánve, endimetrióza a adheze. U pacientek trpících dysmenorhoeou a endometriózou může být účinná hormonální terapie a v některých případech speciální chirurgický zákrok [47–48]. U pacientek, u nichž je přítomna infekce v oblasti pánve, obvykle zabírá aplikace antibiotik. V případě, že onemocnění přetrvává v chronickém stavu, může být nutné operační odstranění hydro - nebo pyosalpingu. Gynekologická maligní onemocnění se obvykle manifestují stejnými symptomy jako BPS, léčba by tedy měla být totožná.
4.6 Neurogenní stavy
Pakliže není CPP vysvětlen přítomností lokální patologie v pánvi, je třeba vyhledat názor neurologa, který umožní vyloučit jakoukoli formu patologie míšního konusu nebo sakrálních kořenů. Zobrazovací vyšetření magnetickou rezonancí umožňuje zobrazení nervové tkáně a okolních struktur. V případě, že žádné z vyšetření neodhalí přítomnost abnormality, bude pravděpodobně diagnostikován syndrom fokální bolesti (např. zachycení pudendálního nervu). Léčbu je třeba zvolit u každého pacienta individuálně.
4.7 Funkce a dysfunkce pánevního dna
Pánevní dno zastává tři funkce: podporu, kontrakci a relaxaci. Dysfunkce pánevního dna by měla být klasifikována na základě „Standardizace terminologie pro funkci a dysfunkci“, jež publikovala ICS (International Continence Society) [49]. Stejně jako je tomu u všech ICS dokumentů, vychází z následující trojice: symptomy, znaky a onemocnění. Symptomy popisují potíže, které uvádí sám pacient, zatímco znaky jsou identifikovány během fyzikálního vyšetření.
4.7.1 Klasifikace
Kontrakce a relaxace svaloviny pánevního dna se hodnotí pomocí palpace. Na základě výsledků je funkce svaloviny pánevního dna klasifikována jako normální, hyperaktivní, hypoaktivní nebo nefunkční.
4.7.2 Myofasciální spouštěcí mechanizmy
Opakované nebo chronické přetěžování svaloviny může vést k aktivaci spouštěcích mechanizmů ve svalovině. Spouštěcí mechanizmy jsou definovány jako hypercitlivá místa související s palpovatelným uzlíkem ve svalové tkáni.
Bolest aktivovanou spouštěcími mechanizmy zhoršují specifické pohyby a naopak zmírňují určité polohy. Pacienti sami vědí, které činnosti a polohy ovlivňují bolest. Pacienti se spouštěcím mechanizmem ve svalovině pánevního dna si sedají velmi opatrně, častěji na jednu polovinu hýždí [51]. Zvednutí po určité době sezení vyvolává bolest. Bolest zhoršuje tlak na spouštěcí mechanizmy (např. bolest související s pohlavním stykem). Bolest se dále zhoršuje po opakovaných kontrakcích (např. bolest související s močením nebo defekací). Při fyzikálním vyšetření lze spouštěcí mechanizmy nahmatat. Podle stlačení těchto míst lze identifikovat lokální a přenesenou bolest. Diferenciální diagnóza zahrnuje uzel endometria nebo tumor.
U pacientů s CPP jsou často detekovány spouštěcí mechanizmy ve svalovině související s pánví (např. abdominální, gluteální a piriformní svaly).
4.7.3 Terapie
Při léčbě CPP je vhodné zvážit léčbu hyperaktivity svaloviny pánevního dna [52]. Speciální fyzioterapeutické metody mohou zlepšovat funkci a koordinaci svaloviny pánevního dna.
4.8 Sexuální dysfunkce u mužů a žen
Sexuální dysfunkce je klasifikována jako hypoaktivní sexuální touha nebo porucha sexuální touhy, vzrušení, orgasmu nebo bolest související s pohlavním stykem [53].
Téměř u 60 % mužů ve věku 60–70 let byla zjištěna erektilní dysfunkce určitého stupně závažnosti [54]. Potence však není jediný problém, s nímž se pacienti potýkají. Řada mužů má rovněž problémy s libidem, vzrušivostí, uspokojením a schopností dosáhnout orgasmu. Pakliže pacient trpí bolestí, všechny tyto obtíže se kumulují. Navzdory tomu, že bolest v močopohlavním ústrojí je poměrně častá, je literatura týkající se dopadu chronické urogenitální bolesti na mužskou psychiku poměrně omezená. Přesto je primárním důvodem, proč muži starší 50 let navštíví urologickou kliniku, právě bolest v močopohlavním systému [55].
Pouze nevelké množství studií se zabývá problematikou vlivu chronické urogenitální bolesti na sexuální funkci, ačkoli je známo, že chronická bolest má dopad i na sexuální funkci [56]. Navzdory nedostatku publikovaných údajů připouští řada pacientů zdravotnických zařízení zabývajících se léčbou urogenitální bolesti, že se vyhýbají sexuální aktivitě z důvodu již zmiňovaných čtyř faktorů. Jiní pacienti se vyhýbají pohlavnímu životu z toho důvodu, že způsobuje zhoršení bolesti. Vyhýbání se sexuální aktivitě je z lékařského hlediska významné, neboť se jedná o vynucený celibát, nikoli celibát dobrovolný.
Pacienti se vyhýbají navazování nových partnerských vztahů, aby nemuseli (mimo jiné) hovořit o svém problému, který je naplňuje pocitem studu. V důsledku tohoto multifaktoriálního stavu může docházet i k rozpadu již existujících partnerských svazků.
Není překvapující, že sexuální dysfunkce prohlubuje pocit hněvu, frustrace a depresi. Všechny výše zmiňované emoce jsou pro vztah velkou zátěží. U partnerek mužů trpících sexuální dysfunkcí a depresí mnohdy dochází k výskytu podobných symptomů [57].
Urolog zastává klíčovou roli nejenom při léčbě mužské sexuální dysfunkce, ale rovněž při léčbě sexuální dysfunkce u žen (FSD) [58]. Prevalence FSD se odhaduje na 25–63 % v závislosti na užité definici a studované populaci [59,60]. FSD je v mnoha případech příčinou dysfunkce pánevního dna, k níž dochází u mladších žen po porodu a u starších žen v důsledku menopauzy [61–63]. Pacienti s neurologickým onemocněním mají vyšší prevalenci všech typů poruch sexuální funkce [64,65], ačkoli přesné údaje nejsou k dispozici.
Ženy trpící bolestí se vyhýbají sexuální aktivitě ze stejných důvodů, které byly popsány u mužské populace, protože dále zhoršují jejich obtíže. FSD je problém, na němž se podílí celá řada faktorů, a může být dále zhoršován chronickou bolestí [66]. Heinber et al ve své studii uvádějí zajímavé zjištění, že za rozdílné symptomy (např. deprese, fyzická indispozice a přehnaný strach z následků) je zodpovědná spíše intenzita a lokalizace bolesti než pohlaví pacienta [67]. Pacienti uváděli stejný výskyt deprese, bez ohledu na lokalizaci bolesti (pánev nebo záda) nebo pohlaví. Vyšší skóre bolesti bylo spojeno s větší depresí. Problémy vyrovnat se s onemocněním (přehnaný strach z následků) a neschopnost provádět běžné činnosti byly významnější u pacientů pociťujících bolest v zádech.
Léčbu u neurologického i nonneurologického onemocnění je nutné u pacientů obou pohlaví zvolit individuálně dle potřeb pacienta. Je nutné odhalit a následně léčit definitivní příčinu bolesti. Mezi léčebné modality (u obou pohlaví) patří psychologická pomoc, posilování svaloviny pánevního dna, elektrická stimulace, kognitivní terapie a v případě nutnosti i medikamentózní léčba [68–70]. Při fyzioterapii pánevního dna je třeba svalovinu považovat za jediný celek, zejména v případě, že je bolest přídatným faktorem [71]. Léčba sexuální dysfunkce je obtížná u pacientů obou pohlaví, zejména v případě, kdy bolest představuje významný faktor. Doporučuje se tedy pacienty i s jejich partnery vyšetřovat v kontextu multidisciplinárního přístupu. Mužskou sexuální dysfunkcí v širokém kontextu se zabývají EAU guidelines pro léčbu mužské sexuální dysfunkce [72].
4.9 Psychologické faktory u přetrvávající/chronické pánevní bolesti
Psychologické faktory ovlivňují vývoj i trvání perzistentní pánevní bolesti, způsob, jakým se pacient vyrovnává s bolestí i výsledky léčby. Není to pouze bolest, která způsobuje úzkost a ztrátu oblíbených činností, které nějakým způsobem souvisejí s bolestí, ale rovněž obavy z poškození, onemocnění a déletrvajícího utrpení, zejména u pacientů bez zřejmé diagnózy [73,74].
Existují jasné důkazy o tom, že na mechanizmu bolesti se podílejí kognitivníi emocionální procesy. Alternativní model somatizace bolestivých poruch postrádá vědecký základ, je však hojně zastoupenv laické i lékařské literatuře. Absence signifikantních fyzikálních znaků však není automaticky důkazem pro psychologickou příčinu onemocnění [75].
Úzkost, deprese a sexuální poruchy se vyskytují u pacientek s CPP často, je tedy třeba je zohlednit při vyšetřování i léčbě [76,77]. Dále je poměrně běžná anamnéza sexuálního či fyzického zneužívání, která se však vyskytuje i u pacientů s jinými bolestivými, fyzickými i psychologickými problémy. Prospektivní studie [78,79] však souvislost mezi touto příčinou a CPP zpochybňují. Pouze jediná studie prokázala souvislost mezi depresí a urologickými symptomy [80], pacienti se mohou v důsledku úzkosti a deprese vyhýbat běžným denním činnostem [81]. Výskyt sexuálních problémů je pravděpodobný u pacientů obou pohlaví [82].
4.9.1 Hodnocení psychologických faktorů
Ačkoli konzultace psychologa (nebo podobného specialisty) není v této fázi hodnocení (tab. 8) nezbytná, klinický lékař je schopen při konzultaci s psychologem lépe interpretovat výsledky.
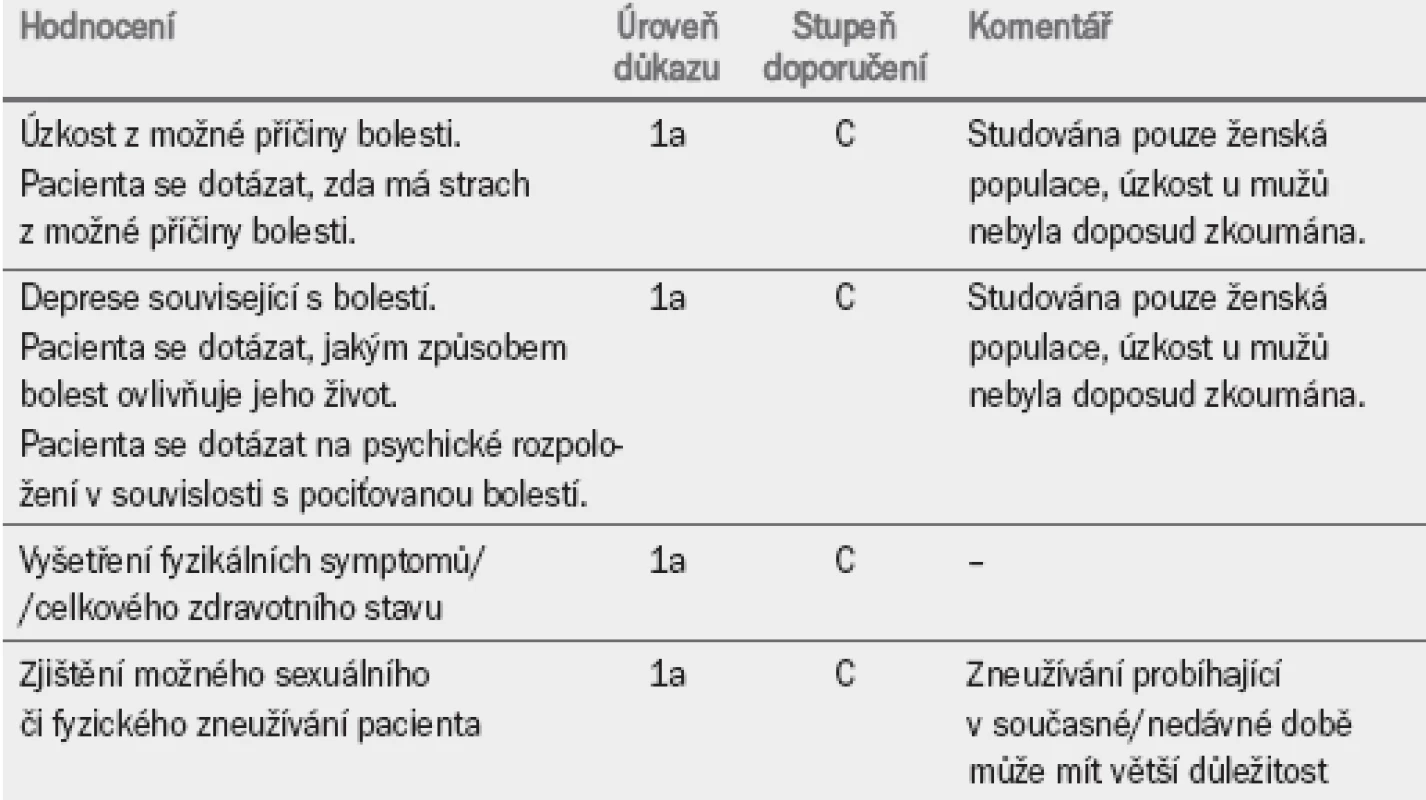
Přímé dotazování na pacientovy obavy je užitečnější než vyplňování dotazníků zaměřených na výskyt úzkostných stavů [83]. V případě, že pacient trpí depresivními stavy, které připisuje bolesti, může být nutné zvolit léčbu vycházející z psychologické komponenty. Odhalení fyzického a sexuálního zneužívání dítěte nemá žádný vliv na léčbu. Při zjištění fyzického nebo sexuálního týrání, které probíhá v současnosti, je třeba uvědomit příslušné úřady. U všech léčebných modalit je třeba posoudit jejich dopad na kvalitu života pacienta.
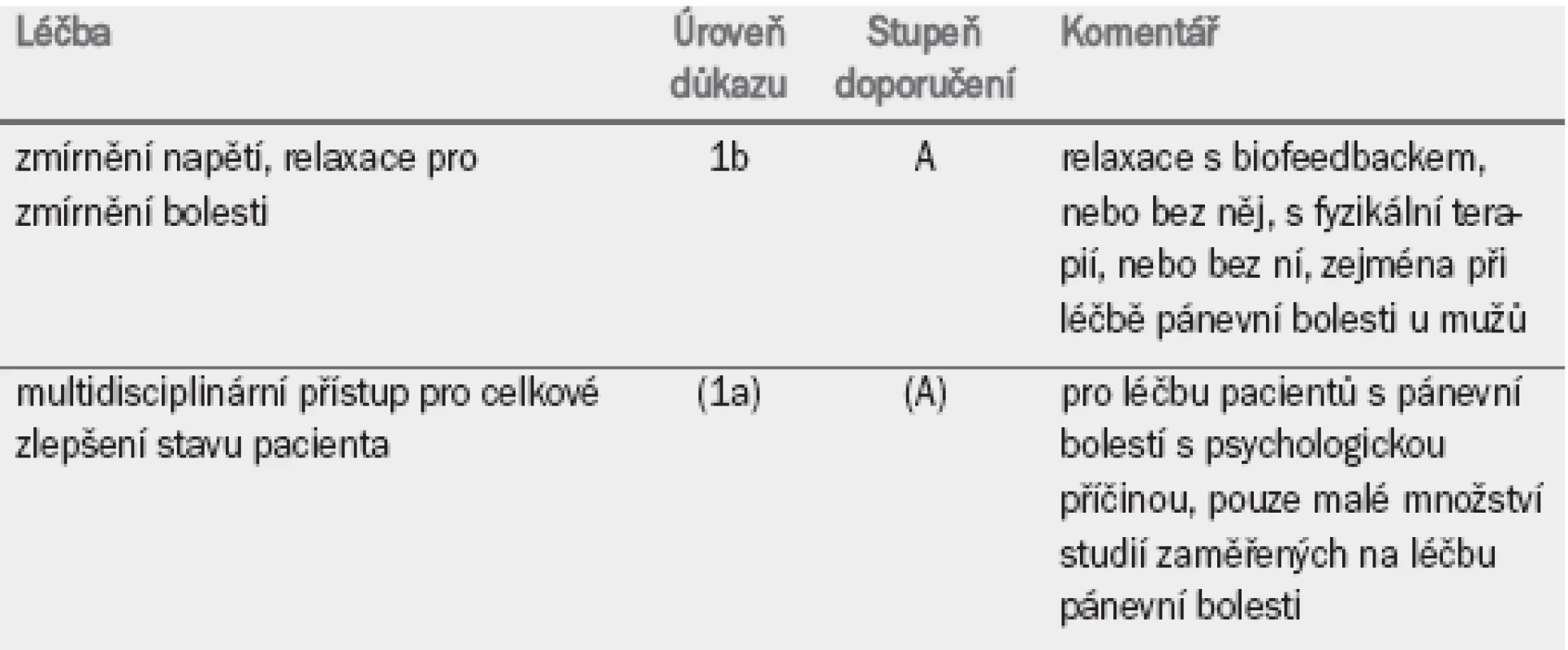
4.9.2. Psychologické faktory při léčbě pánevní bolesti
Touto problematikou se zabývá pouze několik studií. U pacientek trpících pánevní bolestí byla zaznamenána vysoká míra spontánního vymizení symptomů v průběhu několika let od jejich prvního výskytu [84]. Kombinace fyzikální a psychosociální léčby může vést k nejlepším výsledkům u pacientů obou pohlaví (tab. 9) [85].
4.10 Celková léčba chronické pánevní bolesti
Existuje pouze minimální množství údajů, které by prokazovaly roli analgetik a koanalgetik při léčbě CPP. Vzhledem k tomu, že předpokládáme, že se na CPP podílejí podobné mechanizmy jako u somatické, viscerální a neuropatické bolesti, jsou následující doporučení převzata z publikací týkajících se léčby celkové chronické bolesti (tab. 10).
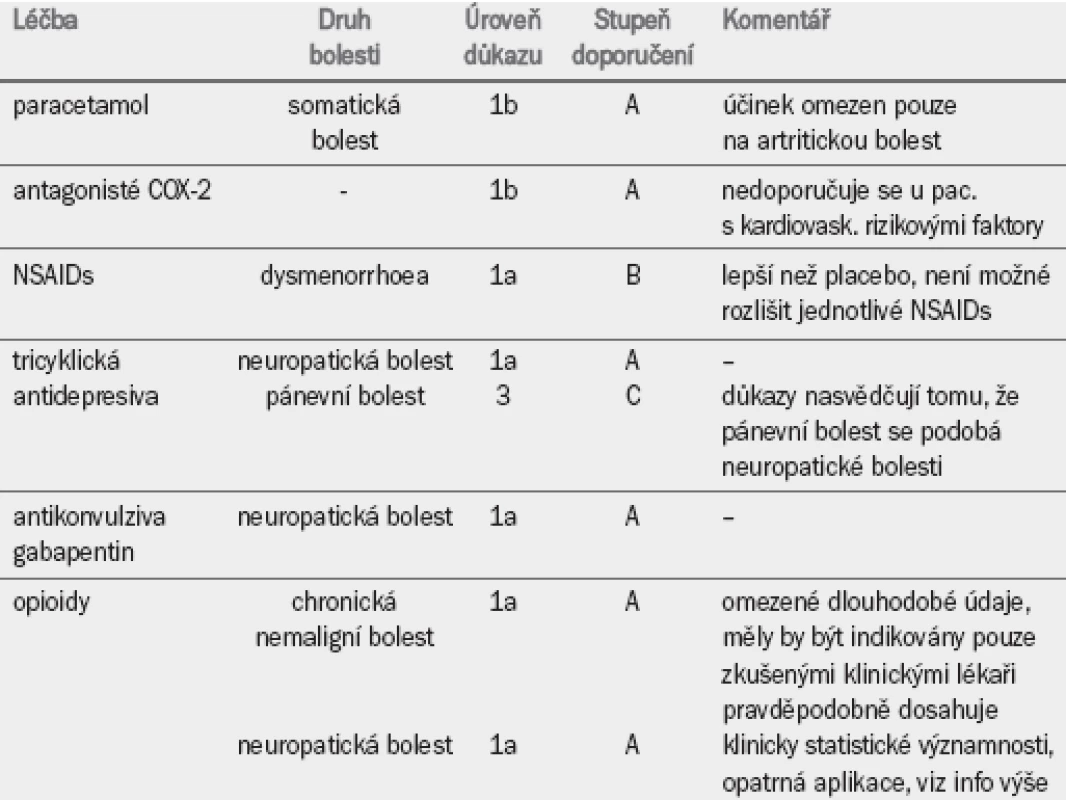
4.10.1 Jednoduchá analgetika
Paracetamol je třeba posuzovat samostatně. Paracetamol představuje vzhledem ke své dobré snášenlivosti s minimálním výskytem vedlejších účinků alternativu nebo vhodnou kombinaci s nesteroidními protizánětlivými preparáty (NSAIDs).
Existuje pouze malé množství informací o aplikaci NSAIDs při léčbě CPP. Většina studií se zabývá účinností těchto agens při léčbě dysmenorrhoey, kdy NSAIDs dosahují lepších výsledků než placebo a v některých případech než paracetamol [86].
4.10.2 Neuropatická analgetika
4.10.2.1 Tricyklická antidepresiva
Studie na zvířecím modelu nasvědčují tomu, že tricyklická depresiva mohou mít jistou roli při léčbě cystitidy [87]. V případě podezření na nervové postižení nebo centrální senzitizaci doporučujeme zvážit algoritmus ve schématu 3. Hodnocení ukázalo, že tricyklická antidepresiva přinášejí benefit při léčbě neuropatické bolesti. O účinnosti inhibitorů zpětného vychytávání serotoninu máme k dispozici pouze omezené, a u ostatních antidepresiv nedostatečné, důkazy [88].

4.10.2.2 Antikonvulziva
Antikonvulziva se užívají při léčbě bolesti již řadu let. Existuje pouze minimum důkazů podporujících jejich aplikaci v rámci léčby bolesti v močopohlavním systému, doporučuje se však tuto možnost zvážit u pacientů s podezřením na přítomnost neuropatické bolesti nebo centrální senzitizace. Aplikace antikonvulziv nemá žádný význam při léčbě akutní bolesti [89].
Pro léčbu bolesti se užívá i antiepileptikum gabapentin [90]. Ve srovnání se staršími antikonvulzivy je aplikace gabapentinu spojena s menším výskytem vážnějších vedlejších účinků. V některých státech je tento preparát schválen pro léčbu chronické neuropatické bolesti.
4.10.3 Opioidy
Role opioidů v rámci léčby chronické bolesti (nemaligního původu) je všeobecně uznávána [91]. Využití opioidů při léčbě urogenitální bolesti nebylo doposud dostatečně definováno, jejich aplikace při léčbě neuropatické bolesti je dosud rozporuplná, ačkoli metaanalýza studií prokazuje klinicky významný benefit [92].
4.10.4 Nemedikamentózní léčba
4.10.4.1 Nervová blokáda
Nervovou blokádu provádí obvykle specialista pro léčbu bolesti se znalostmi anesteziologie. Výkon bývá indikován z diagnostických důvodů a/nebo jako terapeutická modalita. V rámci diagnostiky může být interpretace nervové blokády (vzhledem k celé řadě potenciálních mechanizmů) komplikovaná. V každém případě je nutné během výkonu dbát na zvýšenou bezpečnost (zkušený tým, vhodné monitorovací a resuscitační vybavení).
Nezbytností je vhodné vybavení, jako jsou správné jehly, zařízení pro lokalizaci nervu a zobrazovací vyšetření (tj. zesílení RTG obrazu, ultrazvuk nebo počítačová tomografie).
4.10.4.2 Suprapubická transkutánní elektrická stimulace nervu u pacientů se syndromem bolesti v oblasti močového měchýře/intersticiální cystitidou
Pozorování jsou velmi vzácná. Naše dosavadní zkušenosti vycházejí z otevřených studií. Doposud největší studie týkající se TENS (suprapubické transkutánní elektrické stimulace nervu) zahrnuje 60 pacientů (33 pacientů s klasickou IC a 27 pacientů s neulcerózním onemocněním) [35]. U 54 % pacientů s klasickou IC byla TENS účinná. U pacientů s neulcerózní TENS tento přístup zaznamenal méně příznivé výsledky.
Je poměrně obtížné přesně posoudit výsledky TENS u pacientů s BPS/IC. Kontrolované studie je obtížné sestavit vzhledem k tomu, že léčba vyžaduje stimulaci o vysoké intenzitě ve specifických oblastech po velmi dlouhé časové období.
4.10.4.3 Sakrální neuromodulace u pacientů se syndromy pánevní bolesti
Neurostimulace aplikovaná do oblasti dorzálních rohů míšních a periferních nervů umožňuje účinnou léčbu neuropatické bolesti a složitých regionálních bolestivých syndromů (P3). Je možné, že neuromodulace může mít své místo i při léčbě CPP.
4.10.4.4 Toxin botulin
Nejnovější údaje nasvědčují tomu, že toxin botulin přináší benefit nejenom při léčbě hyperaktivního detrusoru, ale rovněž při léčbě bolesti v močovém měchýři [94,95].
Sources
1. Fall M, Baranowski AP, Elneil S et al. EAU guidelines on chronic pelvic pain. European Association of Urology Web site.
http://www.uroweb.org/fileadmin/tx_eauguidelines/2009/Full/CPP.pdf. Updated March 2008.
2. Fall M, Baranowski AP, Fowler CJ et al. EAU guidelines on chronic pelvic pain. Arnhem, Netherlands: European Association of Urology; 2003.
3. Agency for Health Care Policy and Research. Washington, DC: US Department of Health and Human Services, Public Health Service 1992 : 115–127.
4. Abrams P, Baranowski A, Berger R et al. A new classification is needed for pelvic pain syndromes—are existing terminologies of spurious diagnostic authority bad for patients? J Urol 2006; 175 : 1989–1990.
5. Krieger JN, Nyberg Jr L, Nickel JC. NIH consensus definition and classification of prostatitis. JAMA 1999; 282 : 236–237.
6. Abrams P, Cardozo L, Fall M et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Subcommittee of the International Continence Society. Am J Obstet Gynecol 2002; 187 : 116–126.
7. Baranowski AP, Abrams P, Berger RE et al. Urogenital pain – time to accept a new approach to phenotyping and, as a consequence, management. Eur Urol 2008; 53 : 33–36.
8. van de Merwe JP, Nordling J, Bouchelouche P et al. Diagnostic criteria, classification, and nomenclature for painful bladder syndrome/interstitial cystitis: an ESSIC proposal. Eur Urol 2008; 53 : 60–67.
9. Nickel JC, Weidner W. Chronic prostatitis: current concepts and antimicrobial therapy. Infect Urol 2000; 13: S22–28.
10. Barry MJ, Fowler Jr FJ, O’Leary MP et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. J Urol 1992; 148 : 1549–1557, discussion 1564.
11. Nickel JC. Effective office management of chronic prostatitis. Urol Clin North Am 1998; 25 : 677–684.
12. Litwin MS, McNaughton-Collins M, Fowler Jr FJ et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. Chronic Prostatitis Collaborative Research Network. J Urol 1999; 162 : 369–375.
13. Meares EM, Stamey TA. Bacteriologic localization patterns in bacterial prostatitis and urethritis. Invest Urol 1968; 5 : 492–518.
14. Nickel JC. The pre and post massage test (PPMT): a simple screen for prostatitis. Tech Urol 1997; 3 : 38–43.
15. Nickel JC, Shoskes D, Wang Y et al. How does the pre-massage and postmassage 2-glass test compare to the Meares-Stamey 4-glass test in men with chronic prostatitis/chronic pelvic pain syndrome? J Urol 2006; 176 : 119–124.
16. Nickel JC, Krieger JN, McNaughton-Collins M et al. Alfuzosin and symptoms of chronic prostatitis-chronic pelvic pain syndrome. N Engl J Med 2008; 359 : 2663–2673.
17. Gillenwater JY, Wein AJ. Summary of the National Institute of Arthritis, Diabetes, Digestive and Kidney Diseases Workshop on Interstitial Cystitis, National Institutes of Health, Bethesda, Maryland, August 28–29, 1987. J Urol 1988; 140 : 203–206.
18. Nordling J, Anjum FH, Bade JJ et al. Primary evaluation of patients suspected of having interstitial cystitis (IC). Eur Urol 2004; 45 : 662–669.
19. Twiss CO, Kilpatrick L, Triaca V et al. Evidence for central hyperexitability in patients with interstitial cystitis. J Urol 2007; 177 : 49.
20. Burkman RT. Chronic pelvic pain of bladder origin: epidemiology, pathogenesis and quality of life. J Reprod Med 2004; 49(Suppl): 225–229.
21. Roberts RO, Bergstralh EJ, Bass SE et al. Incidence of physician diagnosed interstitial cystitis in Olmsted County: a community-based study. BJU Int 2003; 91 : 181–185.
22. Parsons CL, Zupkas P, Parsons JK. Intravesical potassium sensitivity in patients with interstitial cystitis and urethral syndrome. Urology 2001; 57 : 428–432.
23. Alagiri M, Chottiner S, Ratner V et al. Interstitial cystitis: unexplained associations with other chronic disease and pain syndromes. Urology 1997; 49(Suppl): 52–57.
24. Clauw DJ, Schmidt M, Radulovic D et al. The relationship between fibromyalgia and interstitial cystitis. J Psychiatr Res 1997; 31 : 125–131.
25. Erickson DR, Morgan KC, Ordille S et al. Nonbladder related symptoms in patients with interstitial cystitis. J Urol 2001; 166 : 557–561, discussion 561–562.
26. Weissman MM, Gross R, Fyer A et al. Interstitial cystitis and panic disorder — a potential genetic syndrome. Arch Gen Psych 2004; 61 : 273–279.
27. Buffington CA. Comorbidity of interstitial cystitis with other unexplained clinical conditions. J Urol 2004; 172 : 1242–1248.
28. Fall M, Johansson SL, Aldenborg F. Chronic interstitial cystitis: a heterogeneous syndrome. J Urol 1987; 137 : 35–38.
29. Bullock AD, Becich MJ, Klutke CG et al. Experimental autoimmune cystitis: a potential murine model for ulcerative interstitial cystitis. J Urol 1992; 148 : 1951–1956.
30. Dodd LG, Tello J. Cytologic examination of urine from patients with interstitial cystitis. Acta Cytol 1998; 42 : 923–927.
31. Erickson DR, Davies MF. Interstitial cystitis. Int Urogynecol J Pelvic Floor Dysfunct 1998; 9 : 174–183.
32. Peeker R, Fall M. Toward a precise definition of interstitial cystitis: further evidence of differences in classic and nonulcer disease. J Urol 2002; 167 : 2470–2472.
33. Koziol JA, Adams HP, Frutos A. Discrimination between the ulcerous and the nonulcerous forms of interstitial cystitis by noninvasive findings. J Urol 1996; 155 : 87–90.
34. Hanno PM. Amitriptyline in the treatment of interstitial cystitis. Urol Clin North Am 1994; 21 : 89–91.
35. Fall M, Lindstrom S. Transcutaneous electrical nerve stimulation in classic and nonulcer interstitial cystitis. Urol Clin North Am 1994; 21 : 131–139.
36. Peeker R, Haghsheno MA, Holmang S et al. Intravesical bacillus Calmette-Guerin and dimethyl sulfoxide for treatment of classic and nonulcer interstitial cystitis: a prospective, randomized doubleblind study. J Urol 2000; 164 : 1912–1915, discussion 1915–1916.
37. Fritjofsson A, Fall M, Juhlin R et al. Treatment of ulcer and nonulcer interstitial cystitis with sodium pentosanpolysulfate: a multicenter trial. J Urol 1987; 138 : 508–512.
38. Dundore PA, Schwartz AM, Semerjian H. Mast cell counts are not useful in the diagnosis of nonulcerative interstitial cystitis. J Urol 1996; 155 : 885–887.
39. Johansson SL, Fall M. Clinical features and spectrum of light microscopic changes in interstitial cystitis. J Urol 1990; 143 : 1118–1124.
40. Harrington DS, Fall M, Johansson SL. Interstitial cystitis: bladder mucosa lymphocyte immunophenotyping and peripheral blood flow cytometry analysis. J Urol 1990; 144 : 868–871.
41. Peeker R, Aldenborg F, Haglid K et al. Decreased levels of S-10 protein in non-ulcer interstitial cystitis. Scand J Urol Nephrol 1998; 32 : 395–398.
42. Koziol JA, Clark DC, Gittes RF et al. The natural history of interstitial cystitis: a survey of 374 patients. J Urol 1993; 149 : 465–469.
43. Enerback L, Fall M, Aldenborg F. Histamine and mucosal mast cells in interstitial cystitis. Agents & Actions 1989; 27 : 113–116.
44. van Haarst EP, van Andel G, Rijcken TH et al. Value of diagnostic ultrasound in patients with chronic scrotal pain and normal findings on clinical examination. Urology 1999; 54 : 1068–1072.
45. Kaur H, Arunkalaivanan AS. Urethral pain syndrome and its management. Obstet Gynecol Surv 2007; 62 : 348–351.
46. Newham AP, van der Spuy ZM, Nugent F. Laparoscopic findings in women with pelvic pain. S Afr Med J 1996; 86 (Suppl): 1200–1203.
47. Howard FM. The role of laparoscopy as a diagnostic tool in chronic pelvic pain. Ballieres Best Pract Res Clin Obstet Gynaecol 2000; 14 : 467–494.
48. Porpora MG, Gomel V. The role of laparoscopy in the management of pelvic pain in women of reproductive age. Fertil Steril 1997; 68 : 765–779.
49. Messelink EJ, Benson T, Berghmans B et al. Standardisation of terminology of pelvic floor muscle function and dysfunction: report from the pelvic floor clinical assessment group of the International Continence Society. Neurourol Urodynam 2005; 24 : 374–380.
50. Carter JE. Abdominal wall and pelvic myofascial trigger points. In: Howard FM, ed. Pelvic pain. Diagnosis and management. Philadelphia, PA: Lippincott Williams & Wilkins; 2000 : 314–358.
51. Slocumb JC. Neurological factors in chronic pelvic pain: trigger points and the abdominal pelvic pain syndrome. Am J Obstet Gynaecol 1984; 149 : 536–543.
52. Glazer HI, Rodke G, Swencionis C et al. Treatment of vulvar vestibulitis syndrome with electromyographic biofeedback of pelvic floor musculature. J Reprod Med 1995; 40 : 283–290.
53. Marthol H, Hilz MJ. Female sexual dysfunction: a systematic overview of classification, pathophysiology, diagnosis and treatment [in German]. Fortschr Neurol Psychiatr 2004; 72 : 121–135.
54. Feldman HA, Goldstein I, Hatzichristou DG et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Ageing Study. J Urol 1994; 151 : 54–61.
55. Kwan KS, Roberts LJ, Swalm DM. Sexual dysfunction and chronic pain: the role of psychological variables and impact on quality of life. Eur J Pain 2005; 9 : 643–652.
56. Anderson RU, Wise D, Sawyer T et al. Sexual dysfunction in men with chronic prostatitis/chronic pelvic pain syndrome: improvement after trigger point release and paradoxical relaxation training. J Urol 2006; 176 : 1534–1538, discussion 1538–1539.
57. Shabsigh R, Anastasiades A, Cooper KL et al. Female sexual dysfunction, voiding symptoms and depression: common findings in partners of men with erectile dysfunction. World J Urol 2006; 24 : 653–656.
58. Salonia A, Zanni G, Briganti A et al. The ole of the urologist in the management of female sexual dysfunctions. Curr Opin Urol 2004; 14 : 389–393.
59. Dalpiaz O, Kerschbaumer A, Mitterberger M et al. Female sexual dysfunction: a new urogynaecological research field. BJU Int 2008; 101 : 717–721.
60. Levin RJ. The physiology of sexual arousal in the human female: a recreational and procreational synthesis. Arch Sex Behav 2002; 31 : 405–411.
61. Baessler K, Bircher MD, Stanton SL. Pelvic floor dysfunction in women after pelvic trauma. BJOG 2004; 111 : 499–502.
62. Srivastava R, Thakar R, Sultan A. Female sexual dysfunction in obstetrics and gynecology. Obstet Gynecol Surv 2008;63 : 527–537.
63. Addis IB, Van Den Eeden SK, Wassel-Fyr CL et al. Sexual activity and function in middle-aged and older women. Obstet Gynecol 2006; 107 : 755–764.
64. Borello-France D, Leng W, O’Leary M et al. Bladder and sexual function among women with multiple sclerosis. Mult Scler 2004; 10 : 455–461.
65. Burina A, Sinanovic O. Bladder, bowel and sexual dysfunction in patient with multiple sclerosis [in Bosnian]. Med Arh 2006; 60 : 182–184.
66. Achtari C, Dwyer PL. Sexual function and pelvic floor disorders. Best Pract Res Clin Obstet Gynaecol 2005; 19 : 993–1008, quiz A1–8.
67. Heinberg LJ, Fisher BJ, Wesselmann U et al. Psychological factors in pelvic/urogenital pain: the influence of site of pain versus sex. Pain 2004; 108 : 88–94.
68. Aslan E, Fynes M. Female sexual dysfunction. Int Urogynecol J Pelvic Floor Dysfunct 2008; 19 : 293–305.
69. AzamU. Late-stage clinical development in lower urogenital targets: sexual dysfunction. Br J Pharmacol 2006; 147(Suppl 2): S153–159.
70. Dorey G. Restoring pelvic floor function in men: review of RCTs. Br J Nurs 2005; 14 : 1014–1018, 1020–1021.
71. Rosenbaum TY, Owens A. The role of pelvic floor physical therapy in the treatment of pelvic and genital pain-related sexual dysfunction (CME). J Sex Med 2008; 5 : 513–523, quiz 524–525.
72. Wespes WE, Amar E, Eardley I et al. EAU guidelines on male sexual dysfunction: erectile dysfunction and premature ejaculation. European Association of Urology Web site.
http://www.uroweb.org/fileadmin/tx_eauguidelines/2009/Full/Male_Sexual_Dysf.pdf. Updated March 2009.
73. Keefe FJ, Rumble ME, Scipio CD et al. Psychological aspects of persistent pain: current state of the science. J Pain 2004; 5 : 195–211.
74. Eccleston C, Crombez G. Pain demands attention: a cognitiveaffective model of the interruptive function of pain. Psychol Bull 1999; 125 : 356–366.
75. Sharpe M, Carson A. ‘Unexplained’ somatic symptoms, functional syndromes, and somatization: do we need a paradigm shift? Ann Intern Med 2001; 134 : 926–930.
76. Savidge CJ, Slade P. Psychological aspects of chronic pelvic pain. J Psychosom Res 1997; 42 : 433–444.
77. Latthe P, Mignini L, Gray R et al. Factors predisposing women to chronic pelvic pain: systematic review. BMJ 2006; 332 : 749–755.
78. Raphael KG,Widom CS, Lange G. Childhood victimization and pain in adulthood: a prospective investigation. Pain 2001; 92 : 283–293.
79. Poleshuck EL, Dworkin RH, Howard FM et al. Contributions of physical and sexual abuse to women’s experiences with chronic pelvic pain. J Reprod Med 2005; 50 : 91–100.
80. Fitzgerald MP, Link CL, Litman HJ et al. Beyond the lower urinary tract: the association of urologic and sexual symptoms with common illnesses. Eur Urol 2007; 52 : 407–415.
81. Tripp DA, Curtis Nickel J, Landis JR et al. Predictors of quality of life and pain in chronic prostatitis/ chronic pelvic pain syndrome: findings from the National Institutes of Health Chronic Prostatis Cohort Study. BJU Int 2004; 94 : 1279–1282.
82. Smith KB, Tripp D, Pukall C et al. Predictors of sexual and relationship functioning in couples with chronic prostatitis/chronic pelvic pain syndrome. J Sex Med 2007; 4 : 734–744.
83. Howard FM. Chronic pelvic pain. Obstet Gynecol 2003; 101 : 594–611.
84. Weijenborg PTM, Greeven A, Dekker FW et al. Clinical course of chronic pelvic pain in women. Pain 2007; 132 (Suppl 1): S117–123.
85. Morley SJ, Eccleston C, Williams A. Systematic review and metaanalysis of randomised controlled trials of cognitive behaviour therapy and behaviour therapy for chronic pain in adults, excluding headache. Pain 1999; 80 : 1–13.
86. Marjoribanks J, Proctor ML, Farquhar C. Nonsteroidal anti-inflammatory drugs for primary dysmenorrhoea. Cochrane Database Syst Rev 2003: CD001751.
87. Chew DJ, Buffington CA, Kendall MS et al. Amitriptyline treatment for severe recurrent idiopathic cystitis in cats. J Am Vet Med Assoc 1998; 213 : 1282–1286.
88. Saarto T, Wiffen PJ. Antidepressants for neuropathic pain. Cochrane Database Syst Rev 2007: CD005454.
89. Wiffen P, Collins S, McQuay H et al. Anticonvulsant drugs for acute and chronic pain. Cochrane Database Syst Rev 2005: CD001133.
90. Wiffen PJ, McQuay HJ, Edwards JE et al. Gabapentin for acute and chronic pain. Cochrane Database Syst Rev 2005: CD005452.
91. McQuay H. Opioids in pain management. Lancet 1999; 353 : 2229–2232.
92. Eisenberg E, McNicol E, Carr DB. Opioids for neuropathic pain. Cochrane Database Syst Rev 2006: CD006146.
93. Kemler MA, Barendse GA, van Kleef M et al. Spinal cord stimulation in patients with chronic reflex sympathetic dystrophy. N Engl J Med 2000; 343 : 618–624.
94. Giannantoni A, Costantini E, Di Stasi SM et al. Botulinum A toxin intravesical injections in the treatment of painful bladder syndrome: a pilot study. Eur Urol 2006; 49 : 704–709.
95. Liu HT, Kuo HC. Intravesical botulinum toxin A injections plus hydrodistension can reduce nerve growth factor production and control bladder pain in interstitial cystitis. Urology 2007; 70 : 463–468.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2010 Issue 3
-
All articles in this issue
- Role sakrální neuromodulace v urologické praxi
- Guidelines EAU pro léčbu chronické pánevní bolesti
- Změny v řešení chronické prostatitidy/syndromu chronické pánevní bolesti
- Chronická pánevní bolest (CPPS): anatomické parametry, patofyziologické mechanizmy, nejednoznačné onemocnění, fenomén chronického onemocnění. Syndrom bolestivého močového měchýře
- Syndrom chronické pánevní bolesti a současné možnosti léčby
- Bladder pain syndrome – současná terminologie, diagnostika a léčba
- Hyperaktivní močový měchýř u dětí a dospělých
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Syndrom chronické pánevní bolesti a současné možnosti léčby
- Změny v řešení chronické prostatitidy/syndromu chronické pánevní bolesti
- Hyperaktivní močový měchýř u dětí a dospělých
- Chronická pánevní bolest (CPPS): anatomické parametry, patofyziologické mechanizmy, nejednoznačné onemocnění, fenomén chronického onemocnění. Syndrom bolestivého močového měchýře
