EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
EAU Guidelines on non–muscle–invasive urothelial carcinoma of the bladder – the 2011 Update
Context and objective:
To present the 2011 European Association of Urology (EAU) Guidelines on non–muscle-invasive bladder cancer (NMIBC).
Evidence acquisition:
Literature published between 2004 and 2010 on the diagnosis and treatment of NMIBC was systematically reviewed. Previous guidelines were updated, and the level of evidence (LE) and grade of recommendation (GR) were assigned.
Evidence synthesis:
Tumours staged as Ta, T1, or carcinoma in situ (CIS) are grouped as NMIBC. Diagnosis depends on cystoscopy and histologic evaluation of the tissue obtained by transurethral resection (TUR) in papillary tumours or by multiple bladder biopsies in CIS. In papillary lesions, a complete TUR is essential for the patient’s prognosis. Where the initial resection is incomplete or where a high-grade or T1 tumour is detected, a second TUR should be performed within 2–6 wk. In papillary tumours, the risks of both recurrence and progression may be estimated for individual patients using the scoring system and risk tables. The stratification of patients into low-, intermediate-, and high-risk groups – separately for recurrence and progression – is pivotal to recommending adjuvant treatment. For patients with a low risk of tumour recurrence and progression, one immediate instillation of chemotherapy is recommended. Patients with an intermediate or high risk of recurrence and an intermediate risk of progression should receive one immediate instillation of chemotherapy followed by a minimum of 1 yr of bacillus Calmette-Guérin (BCG) intravesical immunotherapy or further instillations of chemotherapy. Papillary tumours with a high risk of progression and CIS should receive intravesical BCG for 1 yr. Cystectomy may be offered to the highest risk patients, and it is at least recommended in BCG failure patients. The long version of the guidelines is available from the EAU Web site (www.uroweb.org).
Conclusions:
These abridged EAU guidelines present updated information on the diagnosis and treatment of NMIBC for incorporation into clinical practice.
Key words:
Bacillus Calmette-Guérin (BCG), bladder cancer, cystectomy, cystoscopy, diagnosis, EAU Guidelines, follow-up, intravesical chemotherapy, prognosis, transurethral resection (TUR), urothelial carcinoma
Authors:
M. Babjuk 1; W. Oosterlinck 2; R. Sylvester 3; E. Kaasinen 4; A. Böhle 5; J. Palou-Redorta 6; M. Roupręt 7
Authors‘ workplace:
Faculty of Medicine Pierre et Marie Curie, University Paris VI, Paris, France
; Department of Urology, Hospital Motol, nd Faculty of Medicine, Charles University, Praha
1; Department of Urology, Ghent University Hospital, Ghent, Belgium
2; European Organisation for Research and Treatment of Cancer Headquarters, Department of Biostatistics, Brussels, Belgium
3; Department of Urology, Hyvinkää Hospital, Hyvinkää, Finland
4; Department of Urology, HELIOS Agnes Karll Hospital, Bad Schwartau, Germany
5; Department of Urology, Fundació Puigvert, Universitat Autónoma de Barcelona, Barcelona, Spain
6; Department of Urology of Pitié-Salpétriére Hospital, GHU Est, Assistance-Publique Hôpitaux de Paris
7
Published in:
Urol List 2011; 9(3): 63-74
Overview
Kontext a cíle:
Publikace aktualizované verze EAU (Evropské urologické asociace) Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu (NMIBC).
Sběr důkazů:
Autoři provedli systémové hodnocení publikací uveřejněných v letech 2004–2010, které se týkají diagnostiky a léčby NMIBC, na jejichž základě aktualizovali stávající verzi guidelines a informace klasifikovali podle úrovně důkazů (LE) a stupně doporučení (GR).
Syntéza důkazů:
Do kategorie NMIBC náleží tumory ve stadiu Ta, T1 a carcinoma in situ (CIS). Diagnóza je stanovena na základě cystoskopie a histologického vyšetření tkáně odebrané během transuretrální resekce (TUR) (v případě papilárního tumoru) nebo několikanásobné biopsie močového měchýře (v případě CIS). U pacientů s papilárními lézemi je nezbytné provedení kompletní TUR. V případě neúplné resekce nebo detekce tumoru vysokého grade nebo tumoru T1 se po 2–6 týdnech doporučuje opakované provedení TUR. U pacientů s papilárními tumory lze riziko recidivy a progrese u jednotlivých pacientů odhadnout na základě bodovacích systémů a rizikových tabulek. Klasifikace pacientů do skupin s nízkým, středním a vysokým rizikem (zvláště pro recidivu i progresi) je klíčová pro indikaci adjuvantní léčby. U pacientů s nízkým rizikem recidivy a progrese se doporučuje jedna okamžitá instilace chemoterapeutika. U pacientů se středním nebo vysokým rizikem recidivy a středním rizikem progrese se doporučuje jedna okamžitá instilace chemoterapeutika a intravezikální imunoterapie s aplikací BCG (bacillus Calmette-Guérin) po dobu minimálně jednoho roku nebo další chemoterapie. Pacienti s papilárnímí tumory s vysokým rizikem progrese a CIS by měli podstoupit intravezikální BCG terapii trvající po dobu jednoho roku. Pacientům s nejvyšším rizikem je vhodné nabídnout cystektomii. Tato modalita by měla být doporučena i pacientům, u nichž došlo k selhání BCG terapie. Kompletní verze EAU Guidelines je k dispozici na webových stránkách EAU (www.uroweb.org).
Závěr:
Tato zkrácená verze EAU Guidelines poskytuje aktualizované informace týkající se diagnostiky a léčby NMIBC pro klinickou praxi. EAU Guidelines pro léčbu karcinomu močového měchýře neinvadujícího svalovinu obsahují nejnovější poznatky v oblasti diagnostiky a léčby tohoto onemocnění. Nejnovější důkazy jsou prezentovány pro užití v běžné klinické praxi.
Klíčová slova:
Bacillus Calmette-Guérin (BCG), karcinom močového měchýře, cystektomie, cystoskopie, diagnostika EAU Guidelines, sledování, intravezikální chemoterapie, prognóza, transuretrální resekce (TUR), uroteliální karcinom
1. ÚVOD
První EAU (Evropské urologické asociace) Guidelines pro léčbu karcinomu močového měchýře byly publikovány v roce 2002 [1]. Od této doby jsou údaje neustále aktualizovány – nejnovější informace jsou k dispozici na webové stránce Evropské urologické společnosti www.uroweb.org. Tento dokument obsahuje přehled nejnovějších EAU Guidelines pro léčbu karcinomu močového měchýře neinvadujíciho svalovinu (NMIBC) (Ta, T1 a carcinoma in situ [CIS]) z roku 2011.
2. SBĚR DŮKAZŮ
Pro každou sekci tohoto dokumentu provedli členové panelu systematický průzkum literatury. V databázích Medline, Web of Science a Embase vyhledali autoři originální a přehledové články publikované v letech 2004–2010. Pro účely guidelines byly užity důkazy s nejvyšší úrovní (podle modifikovaného klasifikačního systému Oxford Centre for Evidence-Based Medicine) [2]. Doporučení byla klasifikována na základě úrovní důkazů.
3. EPIDEMIOLOGIE
Karcinom močového měchýře představuje nejčastější maligní onemocnění močových cest. Celosvětová věkově standardizovaná incidence (ASR) činí 10,1/100 000 mužů a 2,5/100 000 žen. V Evropě byla nejvyšší incidence karcinomu močového měchýře (ASR) zaznamenána v západních (23,6 u mužů a 5,4 u žen) a jižních státech (27,1 u mužů a 4,1 u žen) a následně v severní Evropě (16,9 u mužů a 4,9 u žen). Nejnižší incidence byla zaznamenána ve východní Evropě (14,7 u mužů a 2,2 u žen) [3].
Celosvětová morbidita činí 4/100 000 mužů a 1,1/100 000 žen. V Evropě došlo v uplynulém desetiletí k poklesu míry mortality na karcinom močového měchýře na přibližně 16 % u mužů a 12 % u žen [4]. Přibližně 75–85 % pacientů s karcinomem močového měchýře má onemocnění ohraničené na sliznici (Ta nebo CIS) nebo submukózu (T1).
4. RIZIKOVÉ FAKTORY
Urologové by si měli být vědomi skutečnosti, že pacienti v určitých profesích mohou být vystaveni nejrůznějším uroteliálním karcinogenům [5]. Jako první z rizikových karcinogenů byly identifikovány aromatické aminy. Profese v následujících odvětvích lze považovat za rizikové: tiskařství, zpracování železa a hliníku, výroba barviv, plynu a dehtu (úroveň důkazu: 3). Dalším významným rizikovým faktorem je kouření, jež ztrojnásobuje riziko onemocnění karcinomem močového měchýře a zvyšuje míru mortality [6] (úroveň důkazu: 3).
5. KLASIFIKACE
V tomto dokumentu je užívána aktualizovaná verze TNM klasifikace (The Tumour, Node, Metatasis) schválená společností the Union Internationale Contre le Cancer z roku 2009 (tab. 1) [7]. Světová zdravotnická organizace (WHO) v roce 2004 uveřejnila novou klasifikaci pro určování stadia NMIBC (podle návrhu WHO a International Society of Urological Pathology) (tab. 2) [8]. V rámci kategorie plochých a papilárních lézí byly stanoveny nové podkategorie. Papilární léze se dělí na papilární uroteliální neoplazmata o nízkém maligním potenciálu (PUNLMP) a uroteliální karcinomy nízkého a vysokého grade. PUNLMP léze nevykazují při cytologickém vyšetření znaky maligního onemocnění. Tento typ léze je tvořen normálními uroteliálními buňkami s papilární konfigurací. Riziko progrese je u tohoto typu léze zanedbatelné, PUNLMPs však mají tendenci recidivovat. Z klasifikačního systému byl vyřazen prostřední grade (grade 2), jehož existence v klasifikačním systému WHO z roku 1973 byla předmětem rozporů.

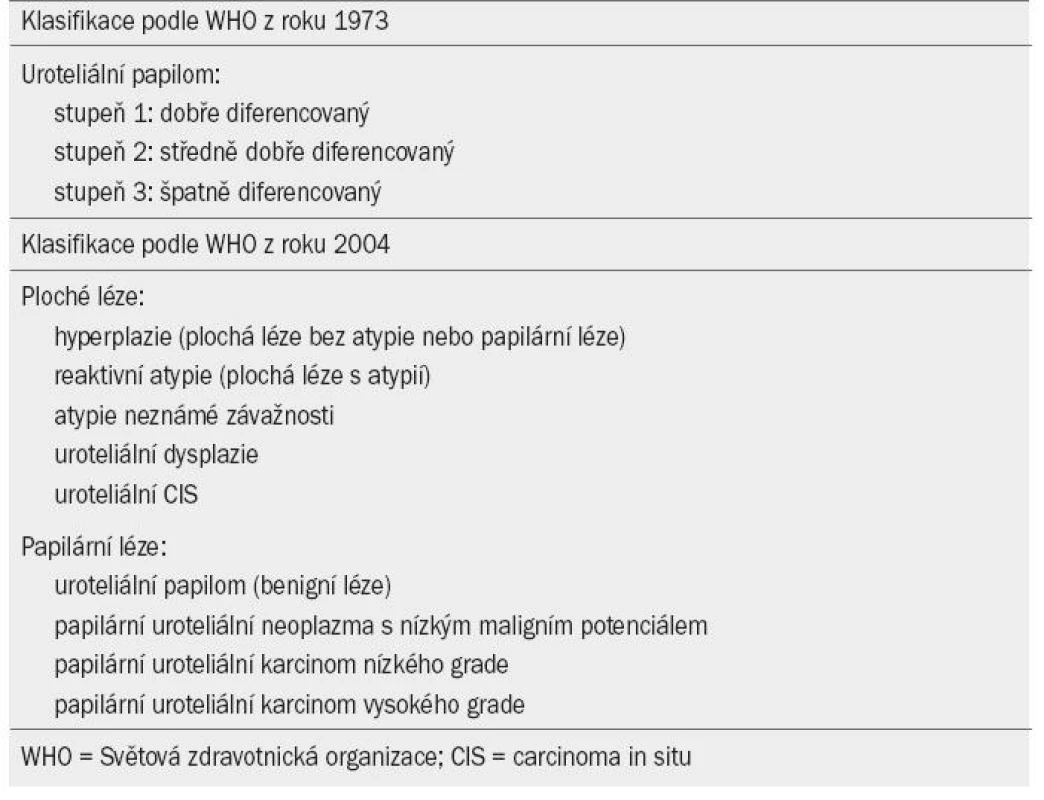
Bylo prokázáno, že oba klasifikační systémy (WHO 1973 i 2004) mají svou prognostickou hodnotu. Ve snaze dokázat, zda jeden klasifikační systém nemá lepší prognostickou hodnotu než druhý, byly zaznamenány protichůdné výsledky [9–11]. Většina dosud publikovaných studií, které se zabývají problematikou karcinomu močového měchýře ve stadiu TaT1, užívá WHO klasifikaci z roku 1973. Z tohoto důvodu užívají i naše guidelines daný systém. Do doby, než bude v nových prospektivních studiích prokázána prognostická hodnota WHO klasifikace z roku 2004, lze užívat systémy oba.
Navzdory jasně definovaným kritériím byly při rozlišování dysplazie vs CIS a tumorů ve stadiu T1 vs Ta a při určování stadia zaznamenány rozdíly mezi jednotlivými autory [12]. V případě tumorů ve stadiu T1, CIS a lézí vysokého grade se doporučuje opakované hodnocení vzorku biopsie.
5.1. Specifické znaky a klinická klasifikace carcinoma in situ
CIS je plochý, neinvazivní uroteliální karcinom vysokého grade. Může se vyskytovat v močovém měchýři, horních cestách močových, prostatických vývodech a močové trubici. CIS močového měchýře se dělí na tři různé klinické typy [13]: 1. primární, izolovaný CIS bez předchozího/ /současného výskytu exofytických tumorů; 2. sekundární CIS detekovaný během sledování pacientů, u nichž byl přítomen tumor a 3. CIS vyskytující se současně s dalšími exofytickými tumory.
6. DIAGNOSTIKA
Nejčastějším nálezem u pacientů s NMIBC je hematurie. U pacientů s CIS mohou být přítomny symptomy dolních cest močových.
6.1. Zobrazovací vyšetření
Intravenózní urografie (IVU) se užívá pro detekci defektů plnicí funkce a dilatace horních cest močových, jež může být známkou přítomnosti uroteliálního karcinomu. Velké exofytické tumory se mohou jevit jako defekt v náplni močového měchýře. Rutinní provádění IVU je v současné době vzhledem k nízké incidenci významných nálezů zpochybňováno [14,15] (úroveň důkazu: 3). Incidence současně se vyskytujících tumorů v horních cestách močových je nízká (1,8 %), incidence tumorů lokalizovaných v trigonu je však o něco vyšší – 7,5 % (14). Riziko recidivy tumoru v horních cestách močových během sledování je vyšší u pacientů s mnohočetnými tumory a tumory s vysokým rizikem [15].
Jako alternativu k běžné IVU lze užít rovněž počítačovou tomografii (CT). U tumorů močového měchýře, které invadují svalovinu, a tumorů lokalizovaných v horních cestách močových poskytuje CT urografie více informací než IVU (úroveň důkazu: 4).
Transabdominální ultrazvukové vyšetření (US) umožňuje charakterizovat renální neoplazma, detekovat případnou hydronefrózu a vizualizovat intraluminální rezistenci v močovém měchýři. U pacientů s hematurií může být US užitečnou pomůckou pro detekci obstrukce, neumožňuje však vyloučit přítomnost tumorů horních cest močových (úroveň důkazů: 3).
V rámci diagnostiky CIS nemají zobrazovací modality (IVU, CT urografie, US) žádný význam.
6.2. Cytologické vyšetření moči
Vyšetření vymočených nebo proplachových vzorků z močového měchýře na zjištění přítomnosti exfoliovaných nádorových buněk má vysokou senzitivitu u tumorů s vysokým grade, ale nízkou u tumorů s nízkým grade (úroveň důkazu: 2b) [16]. Toto vyšetření je tedy užitečné u pacientů s tumorem s vysokým grade nebo CIS, negativní výsledek však nutně nevylučuje přítomnost karcinomu o nízkém grade.
Pozitivní výsledek cytologického vyšetření může indikovat přítomnost uroteliálního tumoru (v jakékoli části močových cest). Interpretace cytologického nálezu závisí na individuálním vyšetřujícím [17]. Cytologické vyšetření může komplikovat malý počet odebraných buněk, přítomnost infekce močových cest, konkrementů či intravezikální instilace. Pokud vyšetření provádí zkušený lékař, je specifita cytologického vyšetření více než 90 % [16] (úroveň důkazu: 2b). Při cytologickém vyšetření by se měla užívat čerstvá moč fixovaná odpovídajícím způsobem. Užívání vzorku ranní moči se vzhledem k potenciální přítomnosti cytolýzy nedoporučuje.
6.3. Molekulární vyšetření moči
Byly vyvinuty nejrůznější metody vyšetření moči pro diagnostiku karcinomu močového měchýře, které jsou založeny na detekci rozpustných markerů vázaných na buňku [16,18]. Slibné výsledky byly prokázány zejména u těchto tří testů: NMP22, UroVysion a ImmunoCyt [19–21]. Ačkoli má většina testů vyšší sensitivitu než cytologie, jejich specifita je naopak nižší (úroveň důkazu: 2b). Žádný z výše uváděných testů není v současné době považován za standardní diagnostickou modalitu.
Provedení cytologického vyšetření moči a molekulárních testů je třeba zvážit v následujících případech:
6.3.1. Screening v populaci pacientů, u nichž existuje riziko vzniku karcinomu močového měchýře neinvadujícího svalovinu
V rámci screeningu karcinomu močového měchýře bylo u populace pacientů s vysokým rizikem vyzkoušeno vyšetření na přítomnost hematurie pomocí testovacího proužku, NMP22, a UroVysion [22]. Vzhledem k obavám týkajícím se proveditelnosti a cenové náročnosti testů se prozatím rutinní provádění screeningu nedoporučuje.
6.3.2. Vyšetření pacientů s hematurií a dalšími symptomy nasvědčujícími přítomnosti karcinomu močového měchýře
Žádné vyšetření moči nemůže nahradit cystoskopii. Cytologické vyšetření a vyšetření na přítomnost markerů však lze užít jako doplněk k cystoskopii, jenž umožní detekovat neviditelné tumory (zejména CIS). Tato kombinace by měla dosahovat vysoké senzitivity i specifity při detekci tumorů vysokého grade. Cytologické vyšetření dosahuje v této indikaci vysoké specifity i senzitivity. Vyšetření močových markerů dosahuje ještě vyšší senzitivity, ovšem za cenu nižší specifity [16,18].
6.3.3. Usnadnění pozorování pacientů s karcinomem močového měchýře neinvadujícím svalovinu s cílem snížit počet prováděných cystoskopií
Aby bylo možné snížit počet prováděných cystoskopií [16,23], měl by test umožňovat detekci recidivy před zvětšením velikosti a počtu tumorů. Nevýhodou cytologického vyšetření je jeho nízká senzitivita pro detekci recidivy tumorů nízkého grade. Několik močových markerů disponuje vyšší, avšak stále ne dostatečnou senzitivitou. Cytologické vyšetření ani vyšetření na přítomnost markerů není schopno v této indikaci bezpečně nahradit cystoskopii.
6.4. Cystoskopie
Diagnóza karcinomu močového měchýře závisí na cystoskopickém vyšetření a histologickém vyšetření resekované tkáně. CIS je diagnostikován na základě cystoskopie, cytologického vyšetření moči a histologického vyšetření několika vzorků biopsie [13].
První cystoskopie se provádí ambulantně, za pomoci flexibilních instrumentů. Pakliže byl tumor vizualizován již během předchozího zobrazovacího vyšetření, je možné cystoskopii s diagnostickým účelem vynechat.
Naprosto nezbytný je podrobný popis cystoskopického nálezu. Údaje by měly zahrnovat informace o lokalizaci, velikosti, počtu a vzhledu (papilární nebo pevný) tumoru a popis jakýchkoli abnormalit vyskytujících se na sliznici.
6.5. Transuretrální resekce
Cíl transuretrální resekce (TUR) u pacientů s karcinomem močového měchýře TaT1 spočívá ve stanovení správné diagnózy a odstranění všech viditelných lézí. Malé tumory (< 1 cm) lze odstranit en bloc. Vzorek by měl obsahovat rovněž část přilehlé stěny močového měchýře. Někteří odborníci se domnívají, že u malých lézí nízkého grade s předchozí anamnézou TaG1 není hluboká resekce nutná.
Větší tumory by měly být odstraněny v několika fázích. Jednotlivé frakce zahrnují exofytickou část tumoru, okolní stěnu močového měchýře spolu se svalovinou detruzoru a okraje resekované oblasti. Vzorky z různých frakcí musí být uloženy a odeslány patologovi v samostatných nádobách. Během resekce se doporučuje provádět kauterizaci co nejméně, abychom tak předešli poškození tkáně.
Patologická zpráva by měla obsahovat informace týkající se grade léze, hloubky invaze tumoru do stěny močového měchýře a informaci o tom, zda vzorek obsahuje lamina propria a svalovinu [24]. Správné a úplné provedení TUR je pro prognózu nezbytné [25].
6.6. Biopsie močového měchýře a prostatické části močové trubice
CIS se může manifestovat jako zarudlá oblast s povrchem připomínajícím samet, která je nerozeznatelná od zánětu, v některých případech nemusí být vůbec viditelná. Pokud jsou v urotelu přítomny abnormální oblasti, doporučuje se provádět studenou biopsii nebo biopsii s užitím resekční kličky. U pacientů s pozitivním výsledkem cytologického vyšetření moči bez viditelného tumoru v močovém měchýři se doporučuje provedení tzv. náhodné biopsie (R-biopsie) z normálně vyhlížející sliznice. U pacientů s tumory TaT1 se rutinní provádění R-biopsie nedoporučuje. Pravděpodobnost detekce CIS u pacientů s tumory s nízkým rizikem je extrémně nízká (< 2 %) [26] (úroveň důkazu: 2a). U pacientů s tumory TaT1 se doporučuje provedení R-biopsie pouze v případě pozitivního cytologického vyšetření, anebo pokud se exofytický tumor jeví jako nonpapilární. R-biopsii se doporučuje odebírat z trigona, vertexu močového měchýře a z pravé, levé, přední i zadní stěny močového měchýře. Materiál odebraný během náhodné a cílené biopsie je třeba odeslat na patologické vyšetření v samostatných nádobách na vzorky.
U pacientů s NMIBC byly popsány případy zasažení prostatické části močové trubice i prostatických vývodů. Riziko je zřejmě vyšší u tumorů lokalizovaných v trigonu nebo hrdle močového měchýře, v případě současného výskytu CIS močového měchýře nebo mnohočetných tumorů [27] (úroveň důkazu: 3). V těchto případech a v případě pozitivního cytologického vyšetření (bez známek tumoru v močovém měchýři) a v případě viditelných abnormalit v prostatické části močové trubice se doporučuje provedení biopsie prostatické uretry. Biopsie se odebírá z abnormálně vyhlížejících oblastí a z oblasti před semenným hrbolem na pozici 5. a 7. hodiny na ciferníku pomocí resekční smyčky.
6.7. Fotodynamická diagnostika (fluorescenční cystoskopie)
Fotodynamická diagnostika (PDD) využívá fialové světlo po intravezikální instilaci kyseliny 5-aminolevulové (5-ALA) nebo hexaminolevulové (HAL). Resekce a biopsie pod navigací fluorescence je senzitivnější než běžné metody detekce maligních tumorů (zejména CIS). Kumulativní analýza prospektivních studií ukázala, že PDD má 20% (všechny tumory) a 23% míru detekce (CIS) [28] (úroveň důkazu: 2a). Anamnéza zánětu, nedávná TUR a intravezikální instilace BCG (bacillus Calmette-Guérin) v průběhu posledních tří měsíců však může způsobovat falešně negativní výsledky.
Uvádí se, že TUR pod navigací fluorescence s 5-ALA může mít pozitivní vliv na dobu přežití bez recidivy. Kumulativní analýza tří studií prokázala, že doba přežití bez recidivy po 12 měsících je o 15,8–27 % vyšší u pacientů, kteří podstoupili TUR s fluorescenční navigací, než u pacientů, kteří podstoupili cystoskopii s užitím pouze bílého světla [28] (úroveň důkazu: 2a). Velká švédská studie však neprokázala při užívání TUR s fluorescenční navigací (5-ALA) žádný benefit [29]. Jiná studie srovnávající TUR s fluorescenční navigací (HAL) a standardní TUR prokázala ve skupině pacientů podstupujících HAL po devíti měsících ne více než 9% snížení míry recidivy [30].
Podíl fluorescenční cystoskopie na zlepšení míry progrese a doby přežití je tedy nutné teprve prokázat.
PDD je třeba vyhradit pro pacienty s podezřením na přítomnost tumoru s vysokým grade, zejména CIS (např. biopsie u pacientů s pozitivní cytologií nebo s anamnézou tumoru o vysokém grade).
6.8. Opakovaná resekce
U pacientů s lézemi TaT1 existuje významné riziko, že po první TUR zůstane přítomen reziduální tumor [25,31] (úroveň důkazu: 1b). Navíc může být na základě vzorku první resekce chybně určeno nižší stadium.
V případě podezření, že první resekce byla neúplná, je vhodné zvážit provedení opakované TUR (např. v případě mnohočetných nebo větších tumorů nebo v případě absence svalové tkáně ve vzorku). Opakovaná TUR se doporučuje rovněž v případě, že byl při první resekci detekován tumor neinvadující svalovinu vysokého grade nebo tumor T1. Opakovaná TUR může zvyšovat míru přežití bez recidivy [32] (úroveň důkazu: 2a).
Druhou resekci je vhodné provádět 2–6 týdnů po první TUR. Při výkonu by měl být odebrán vzorek rovněž z primárního místa výskytu tumoru.
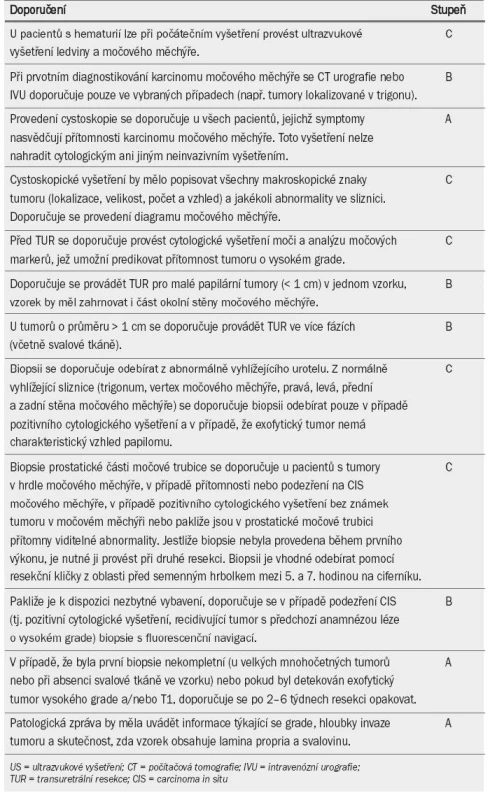
Tab. 3 uvádí přehled doporučení pro diagnostiku NMIBC.
7. PREDIKCE RECIDIVY A PROGRESE ONEMOCNĚNÍ
7.1. Prognóza tumorů TaT1
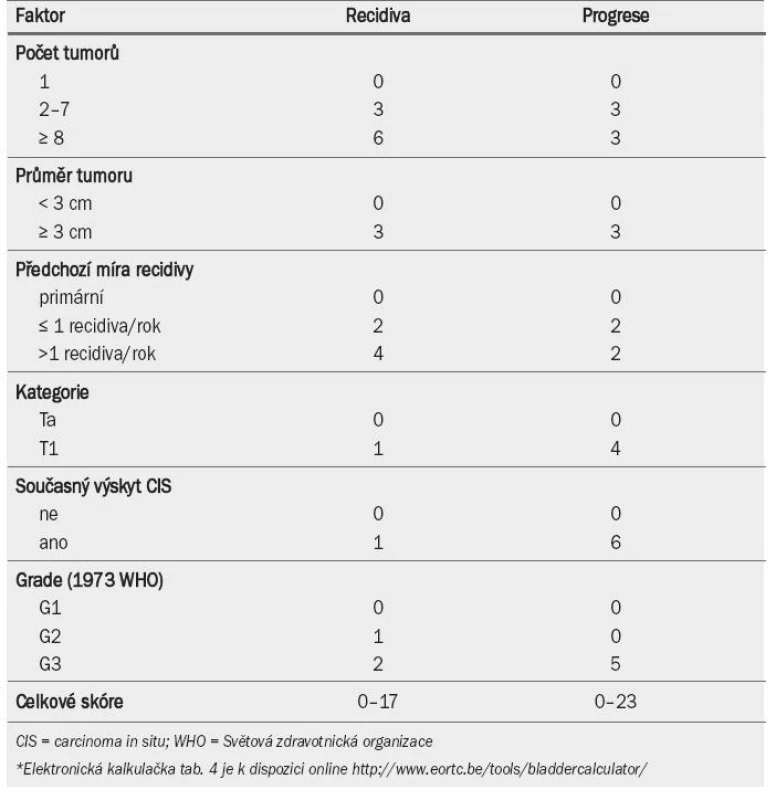
Klasickou metodou klasifikace pacientů s tumory TaT1 je dělení do rizikových skupin na základě prognostických faktorů (stanovených v multivariátních analýzách). Evropská organizace EORTC (European Organisation for Research and Treatment of Cancer) vyvinula bodovací systém a rizikové tabulky pro predikci krátko-dobého i dlouhodobého rizika recidivy a progrese u jednotlivých pacientů [33]. Pomocí databáze EORTC byly vyhledány údaje 2 596 pacientů s tumory TaT1, kteří nepodstoupili opakovanou TUR ani u nich nebyla indikována udržovací BCG terapie. EORTC bodovací systém je založen na šesti nejvýznamnějších klinických a patologických faktorech: počtu a velikosti tumorů, předchozí míře recidivy, kategorii T, současné přítomnosti CIS a grade tumoru.
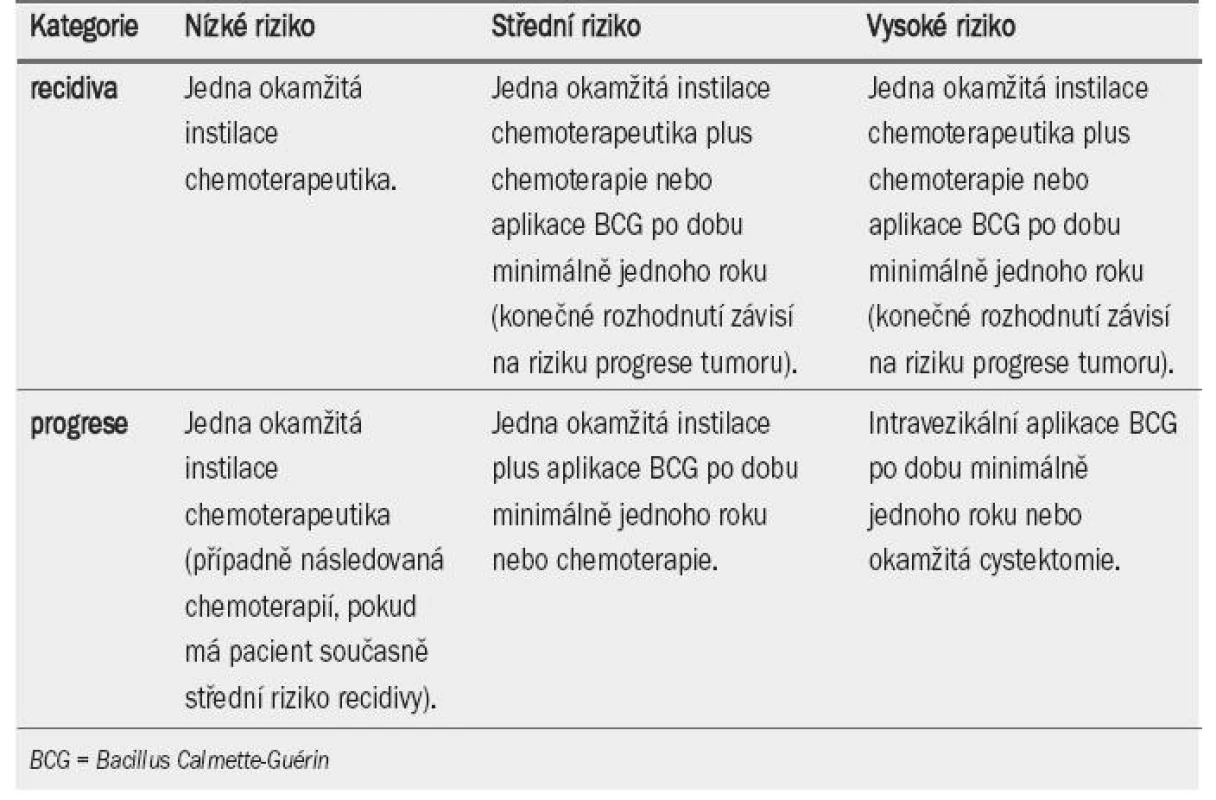
Tab. 4 ukazuje význam, který je přikládán jednotlivým faktorům při výpočtu celkového skóre recidivy a progrese. Tab. 5 zobrazuje celkové skóre rozdělené do čtyř kategorií, které odrážejí pravděpodobnost recidivy a progrese po jednom roce a pěti letech [33]. Pomocí kombinace dvou ze čtyř kategorií pro recidivu a progresi EAU navrhuje pracovní skupina klasifikační systém, který dělí onemocnění do tří skupin podle rizika: nízké, střední a vysoké (jak ukazuje pravý sloupec v tab. 5).
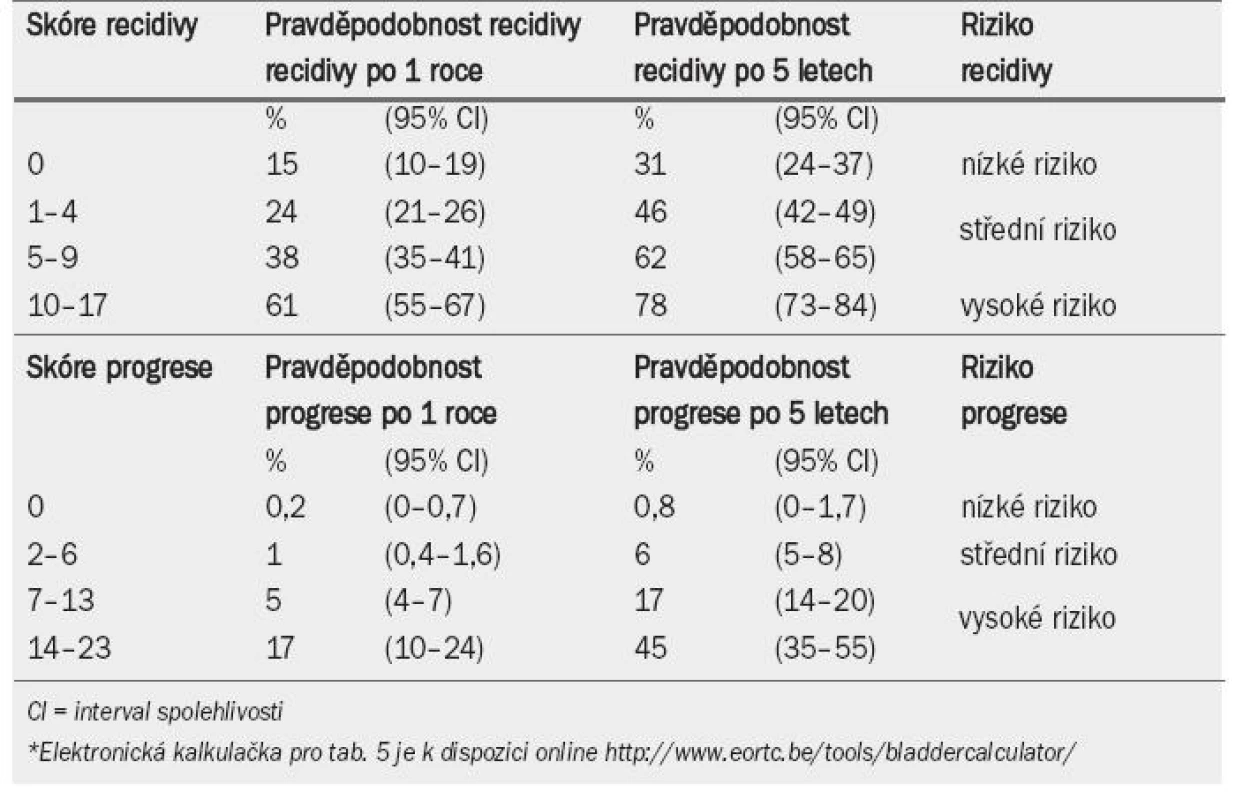
Španělská společnost Club Urológico Espańol de Tratamiento Oncológico (CUETO; Spanish Oncology Group) v nedávné době vytvořila klasifikační model pro predikci krátkodobého a dlouhodobého rizika recidivy a progrese u pacientů, kteří podstoupili BCG terapii. Riziko recidivy spočítané na základě těchto tabulek je však nižší než riziko stanovené na základě tabulky EORTC. Co se týče pravděpodobnosti progrese onemocnění, vykazuje nižší hodnoty pouze u pacientů s vyšším rizikem [34]. Nižší riziko podle CUETO tabulek lze pravděpodobně připisovat lepšímu účinku instilační terapie ve studiích, na jejichž základě byly tyto tabulky vytvořeny.
7.2. Prognóza carcinoma in situ
Pakliže není indikována žádná léčba, přibližně u 54 % pacientů progreduje CIS do stadia invaze svalové tkáně [13,35]. Doposud nebyly stanoveny žádné spolehlivé prognostické faktory, pomocí nichž by bylo možné predikovat průběh CIS. Některé studie uvádí horší prognózu u pacientů, u nichž se současně vyskytuje CIS a tumor T1, než u pacientů s primární CIS, rozšiřující se CIS a pacientů, kteří nereagují na BCG terapii [13,36] (úroveň důkazu: 3).
8. ADJUVANTNÍ INTRAVEZIKÁLNÍ CHEMOTERAPIE
8.1. Jediná instilace aplikovaná okamžitě po operaci
U tumorů TaT1 dochází velmi často k recidivě. V některých případech může dojít k rozšíření tumoru do svalové tkáně. U všech pacientů je tedy nutné zvážit indikaci adjuvantní terapie.
Výsledky metaanalýzy sedmi randomizovaných studií ukazují, že jediná instilace chemoterapeutika po TUR významně snižuje recidivu onemocnění (oproti samotné TUR) (úroveň důkazu: 1a) [37]. V absolutních číslech: pokles recidivy činil 11,7 %, což činí 24,2% pokles odpovídajícího relativního rizika. Účinnost jediné instilace potvrdily rovněž další dvě nejnovější studie [38,39]. V jedné ze studií byl tento benefit zaznamenán zejména u pacientů s primárním CIS a jediným tumorem. Po stratifikaci podle EORTC skóre recidivy byl tento benefit zaznamenán u pacientů se skóre 0–2, ale nikoli se skóre ≥ 3. Tato studie však neměla dostatečnou statistickou sílu pro analýzu podskupin pacientů [39].
Nemáme k dispozici žádné údaje prospektivních studií, které by prokazovaly, že jediná instilace významně snižuje u pacientů s recidivujícím onemocněním míru recidivy. Přesto existují dostatečné důkazy (z analýzy jedné podskupiny), že okamžitá instilace může mít vliv na další režim instilací při léčbě pacientů, kteří mají střední a vysoké riziko recidivy [40] (úroveň důkazu: 2a). Nemáme k dispozici žádné statisticky relevantní údaje týkající se role okamžité instilace chemoterapeutika před další intravezikální aplikací BCG u pacientů s tumory s vysokým rizikem.
Celkově lze říci, že jedna okamžitá instilace chemoterapeutika u pacientů s tumory TaT1 významně snižuje riziko recidivy. Pro definitivní posouzení role okamžité chemoterapie před BCG/další chemoterapií u pacientů se středním a vysokým rizikem však je nutné provedení dalších studií.
Předpokládá se, že efekt adjuvantní chemoterapie spočívá ve zničení cirkulujících buněk tumoru nebo ablaci reziduálních buněk v místě resekce. Již během prvních hodin po rozsevu buněk je nutné zabránit jejich implantaci. Ve všech studiích byla dávka aplikována během 24 hod. Analýza podskupiny pacientů v jedné studii prokázala, že pakliže nebyla první instilace podána v den provedení TUR, zvýšilo se relativní riziko recidivy dvoj-násobně [40] (úroveň důkazu: 2a). Jiná studie, v níž nebyla instilace podána v den provedení TUR, neprokázala žádný benefit [41].
Aplikace mitomycinu C (MMC), epirubicinu i doxorubicinu prokázala srovnatelný benefit [37] (LE: 1a).
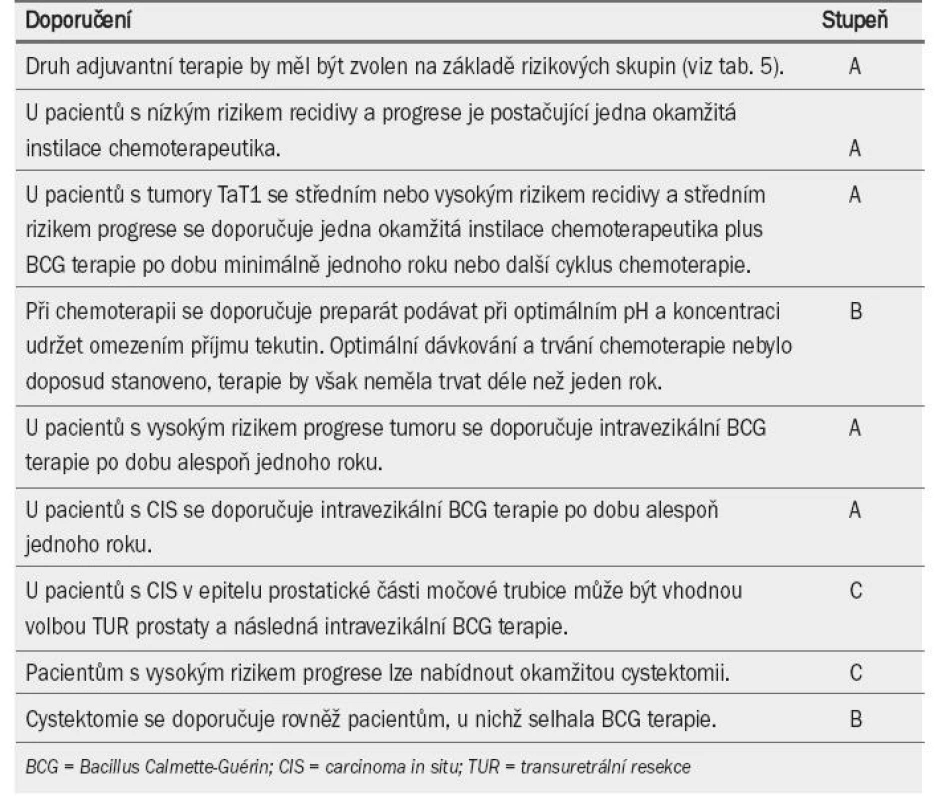
U pacientů s tumory s nízkým rizikem recidivy a progrese se časná okamžitá instilace chemoterapeutika doporučuje jako jediná forma intravezikální léčby. U pacientů se středním rizikem představuje jedna instilace chemoterapeutika první fázi další intravezikální terapie. U tumorů, u nichž předpokládáme vyšší riziko progrese (solidní léze, pozitivní cytologické vyšetření), je okamžitá instilace přijatelnou modalitou, protože může mít díky prevenci implantace karcinomatózních buněk pozitivní vliv na míru recidivy. Není však pochyb o tom, že následná intravezikální imunoterapie s aplikací BCG je u těchto pacientů nezbytná.
Chemoterapie není vhodná u pacientů s viditelnou intra - či extraperitoneální perforací (nebo podezřením na perforaci), k níž nejčastěji dochází při rozsáhlé TUR, a v případech, kdy vyžaduje závažné krvácení proplach močového měchýře. U pacientů, u nichž došlo k extravazaci látky, byly zaznamenány závažné komplikace [42]. Zdravotní sestry je nutné instruovat, aby na konci instilace zajistily volný průtok katétrem.
8.2. Následná intravezikální instilace chemoterapeutika
Další adjuvantní intravezikální terapie závisí na prognóze pacienta. U pacientů s nízkým rizikem recidivy (tab. 5) postačuje jediná okamžitá instilace chemoterapeutika [37] (úroveň důkazu: 1a). U ostatních pacientů je však tento postup vzhledem k pravděpodobnosti recidivy a/nebo progrese nedostatečný.
Volba mezi dalším cyklem chemo-terapie nebo imunoterapií s aplikací BCG závisí zejména na riziku, které je nutné eliminovat: recidivy nebo progrese. Metaanalýza srovnávající intravezikální chemoterapii se samotnou TUR prokázala, že chemoterapie slouží jako prevence proti recidivě, nikoli však proti progresi onemocnění [43] (úroveň důkazu: 1a). Vliv intravezikální chemoterapie na snížení rizika recidivy potvrdily další dvě metaanalýzy (zahrnující pacienty s primárním [43] i recidivujícím onemocněním).
S ohledem na délku a frekvenci intravezikální instilace chemoterapie panují protichůdné názory [46]. Dostupné důkazy nepodporují žádný cyklus, který by trval déle než jeden rok.
8.3. Optimalizace intravezikální chemoterapie
Míru recidivy lze snížit pomocí následujících metod: adaptace pH moči, snížení tvorby moči a pufrování intravezikálního roztoku [47] (úroveň důkazu: 1b). Koncentrace měla významnější roli než délka trvání léčby [48] (úroveň důkazu: 1b). Ve světle těchto důkazů se doporučuje rozpustit preparát v pufrovaném roztoku s optimálním pH a pacientovi doporučit nepřijímat ráno před instilací žádné tekutiny.
8.4. Adjuvantní intravezikální imunoterapie s aplikací BCG (Bacillus Calmette-Guérin)
Bylo prokázáno, že aplikace BCG po TUR dosahuje lepších výsledků v rámci prevence recidivy než samotná TUR i TUR v kombinaci s chemoterapií [49–56] (úroveň důkazu: 1a). Klinický účinek je dlouhodobý [54,55] a byl zaznamenán i v samostatné analýze pacientů s onemocněním se středním rizikem [55].
V nedávné době publikovaná metaanalýza [56] hodnotí údaje 2 820 pacientů, kteří byli zařazeni do celkem devíti randomizovaných studií srovnávajících účinek MMC a BCG. Studie užívající udržovací BCG terapii prokázala 32% pokles rizika recidivy u pacientů užívajících BCG (oproti MMC) (p < 0,0001), zatímco BCG bez udržovací terapie byla méně účinná než MMC.
Údaje ze dvou metaanalýz prokázaly, že BCG terapie zabraňuje (nebo alespoň oddaluje) progresi karcinomu [57,58] (úroveň důkazu: 1a). EORTC metaanalýza prokázala 27% snížení progrese tumoru u BCG udržovací terapie (p = 0,0001) [57]. V nedávné době provedená randomizovaná studie zahrnující dlouhodobé sledování prokázala u pacientů užívajících BCG (vs epirubicin) významně menší výskyt vzdálených metastáz a celkově vyšší míru celkové doby přežití a doby přežití specifické pro karcinom [55]. Naopak metaanalýza údajů jednotlivých pacientů nepotvrdila žádný statisticky signifikantní rozdíl mezi MMC a BCG s ohledem na progresi, dobu přežití ani příčinu úmrtí [56].
Navzdory těmto protichůdným výsledkům většina údajů nasvědčuje tomu, že aplikace BCG (včetně udržovací terapie) u pacientů s vysokým i středním rizikem snižuje riziko progrese tumoru.
8.5. Optimální protokol BCG
Pro dosažení optimálního výsledku by měl být BCG podáván v rámci udržovací léčby [52,56–58] (úroveň důkazu: 1a). EORTC metaanalýza prokázala benefit pouze u pacientů, kteří podstoupili udržovací léčbu. Ve čtyřech studiích, kdy pacienti nepodstoupili udržovací terapii, nebylo zaznamenáno žádné zmírnění progrese. Ve 20 studiích, v nichž pacienti podstoupili určitou formu udržovací BCG terapie, byl zaznamenán 37% pokles progrese (p = 0,0004). Metaanalýza těchto studií však neumožnila stanovit, který protokol BCG terapie byl nejúčinnější [57].
Výsledky dalších metaanalýz ukazují, že aby se projevil benefit BCG oproti MMC (v rámci prevence recidivy nebo progrese), musí být udržovací terapie užívána po dobu alespoň jednoho roku [52,58]. Úvodní instilace BCG se obvykle provádí podle empirického šestitýdenního protokolu. Pro udržovací terapii existují nejrůznější protokoly (až 30 instilací v průběhu tří let) [59]. Optimální počet úvodních instilací a nejvhodnější frekvence a délka trvání udržovací terapie dosud nebyla stanovena.
Pro snížení toxicity byla navrhována aplikace pouze třetiny nebo čtvrtiny dávky BCG. Srovnání třetinové dávky s normální dávkou BCG neprokázalo žádný rozdíl v účinnosti. Předpokládá se však, že při léčbě multifokálního onemocnění může být účinnější normální dávka BCG [60] (úroveň důkazu: 1b). Ačkoli při aplikaci snížené dávky se toxicita projevila u menšího počtu pacientů, incidence systémové toxicity byla srovnatelná. Při dalším snížení dávky BCG na jednu šestinu dávky byl zaznamenán nižší účinek při srovnatelné toxicitě [61].
8.6. Toxicita při aplikaci bacillus Calmette-Guérin
Užívání BCG komplikuje špatná snášenlivost (zejména úmrtí v důsledku sepse) a cystitida vyvolaná aplikací BCG. Díky větším zkušenostem s aplikací BCG jsou však v současné době vedlejší účinky méně významné. V současné době se závažné vedlejší účinky při aplikaci BCG vyskytují u méně než 5 % pacientů [62] (úroveň důkazu: 1b). K závažným komplikacím může dojít v důsledku systémové absorpce preparátu. BCG by neměl být podáván během prvních dvou týdnů po TUR, pacientům s hematurií nebo infekcí močových cest, po traumatické katetrizaci ani u imunokompromitovaných pacientů (úroveň důkazu: 2b). Léčba vedlejších účinků BCG terapie by měla být zvolena na základě jejich typu a stupně [63].
8.7. Indikace BCG terapie
Bylo dosaženo konsenzu, že vzhledem k riziku toxicity není BCG terapie vhodná pro všechny pacienty s NMIBC. BCG neovlivňuje přirozený průběh tumorů s nízkým rizikem recidivy (tab. 5), v tomto případě může být tato léčba nadbytečná. U pacientů s tumory s vysokým rizikem progrese se doporučuje aplikace BCG a udržovací terapie. BCG terapie včetně udržovací jednoroční léčby je u pacientů se středním i vysokým rizikem recidivy a středním rizikem progrese v rámci prevence recidivy účinnější než chemo-terapie, na druhou stranu je však spojenas větším výskytem vedlejších účinků. Z tohoto důvodu zůstávají nadále obě varianty (udržovací BCG terapie i intravezikální chemoterapie) léčbou volby. Volba léčby by měla záviset na riziku tumoru a rovněž účinnosti a snášenlivosti terapeutické modality. V tab. 6 a 7 je uveden přehled doporučení pro intravezikální terapii u tumorů TaT1.
8.8. Specifické aspekty léčby CIS
CIS nelze vyléčit pouze pomocí samotného endoskopického výkonu. Po diagnostikování CIS na základě histologického vyšetření je nutné indikovat další léčbu – intravezikální terapii nebo radikální cystektomii (úroveň důkazu: 2). Doposud nebylo dosaženo konsenzu v otázce, zda je lepší zvolit konzervativní (intravezikální instilaci BCG) nebo agresivní léčbu (cystektomii). Míra přežití specifická pro karcinom při časné indikaci cystektomie je vynikající, ovšem až u 40–50 % pacientů je tato léčba nadbytečná [13].
8.8.1. Intravezikální léčba CIS
Retrospektivní hodnocení uvádí 48% míru celkové odpovědi při léčbě pomocí chemoterapie a 72–93% míru při léčbě pomocí BCG (úroveň důkazu: 2a). Metaanalýza klinických studií zahrnujících pacienty s CIS, které srovnávaly intravezikální BCG terapii a chemoterapii, prokázala signifikantně vyšší míru odpovědi po BCG a 59% pokles míry selhání léčby ([OR]: 0,41; p = 0,0001). Klinické studie srovnávající BCG a MMC prokázaly, že BCG terapie poskytuje menší dlouhodobý benefit. V rámci udržovací terapie však BCG dosahuje lepšího výsledku než MMC (OR: 0,57; p = 0,04) [64].
EORTC metaanalýza progrese u skupiny 403 pacientů s CIS ukázala, že BCG snižuje ve srovnání s intravezikální chemo-terapií nebo jinou formou imunoterapie riziko progrese o 35 % [57] (úroveň důkazu: 1a).
Závěrem lze říci, že ve srovnání s chemoterapií zvyšuje BCG terapie míru úplné odpovědi, celkový počet pacientů bez recidivy a snižuje riziko progrese tumoru u pacientů s CIS (úroveň důkazu: 1a).
8.8.2. Léčba extravezikálního CIS
Pacienty s CIS epiteliální výstelky v prostatické části močové trubice lze léčit pomocí intravezikální aplikace BCG. Předchozí TUR prostaty může zlepšovat průnik BCG do prostatické části močové trubice [65] (úroveň důkazu: 3). U pacientů s karcinomem invadujícím do prostatického vývodu se doporučuje zvážit radikální operaci [65] (úroveň důkazu: 3). Tab. 7 uvádí přehled doporučení pro léčbu CIS.
8.9. Léčba po selhání intravezikální terapie
Pacienti, u nichž dojde po intravezikální chemoterapii k recidivě tumoru (bez invaze svalové tkáně), mohou mít benefit z BCG terapie (úroveň důkazu: 1a). Selhání léčby pomocí BCG lze definovat jako: 1. detekci tumoru invadujícího svalovinu během sledování; 2. detekci neinvadujícího karcinomu vysokého grade po třech i šesti měsících [66]. U jedinců, u nichž je tumor přítomen i po třech měsících, může další cyklus BCG vést k úplné odpovědi u > 50 % pacientů [13,66], zvyšuje však riziko progrese [67,68]; a 3. jakékoli zhoršení onemocnění během aplikace BCG jako např. větší počet případů recidivy, vyšší stadium T nebo vyšší grade, výskyt CIS navzdory počáteční odpovědi na léčbu (LE: 3).
U vybraných pacientů s neinvadujícím karcinomem močového měchýře, u nichž došlo k selhání BCG, může být účinná indikace intravezikální chemoterapie místo BCG nebo doplňující aplikace interferonu α-2b. Tyto strategie jsou však prozatím považovány za čistě experimentální. U jinak zdravých pacientů, u nichž dojde brzy k selhání BCG terapie, se vzhledem k zvýšenému riziku vzniku svalovinu invadujícího tumoru [66–68] (úroveň důkazu: 3) doporučuje ihned po selhání léčby provedení cystektomie.
U pacientů, u nichž dojde k recidivě více než jeden rok po ukončení BCG terapie, se doporučuje další léčba na základě klasifikace rizika (tab. 4–6).
9. CYSTEKTOMIE U PACIENTŮ S KARCINOMEM MOČOVÉHO MĚCHÝŘE NEINVADUJÍCÍM SVALOVINU (NMIBC)
U pacientů s vysokým rizikem progrese lze zvážit okamžité provedení cystektomie. Jak ukazují EORTC tabulky (tab. 4,5), mají tito pacienti mnohočetné recidivující tumory o vysokém grade, tumory T1 vysokého grade a tumory vysokého grade se současně se vyskytujícím CIS. Cystektomie se doporučuje rovněž u pacientů, u nichž selhala BCG terapie. Oddalování cystektomie může u těchto pacientů vést ke snížení doby přežití specifické pro karcinom [69].
10. SLEDOVÁNÍ
Pacienta je nutné vzhledem k riziku recidivy a progrese sledovat, frekvenci a délku trvání kontrolních vyšetření (cystoskopie a vyšetření horních cest močových) je však nutné přizpůsobit stupni rizika [33]. Při plánování sledovacího protokolu je nutné zvážit následující aspekty:
- Okamžitá detekce recidivy onemocnění (invadujícího svalovou tkáň nebo neinvadujícího onemocnění vysokého grade) má nesmírný význam, neboť zbytečné oddálení diagnostiky i léčby může ohrozit život pacienta.
- U pacientů s nízkým rizikem je recidivující tumor téměř vždy nízkého stadia a nízkého grade. Malé neinvadující (Ta) papilární léze nízkého grade nepředstavují okamžitou hrozbu pro pacienta. V tomto případě není úspěšná léčba podmíněna časnou diagnostikou onemocnění [70] (úroveň důkazu: 2b). U těchto pacientů je bezpečnou terapeutickou volbou ambulantní fulgurace malých papilárních recidivujících lézí [71] (úroveň důkazu: 3).
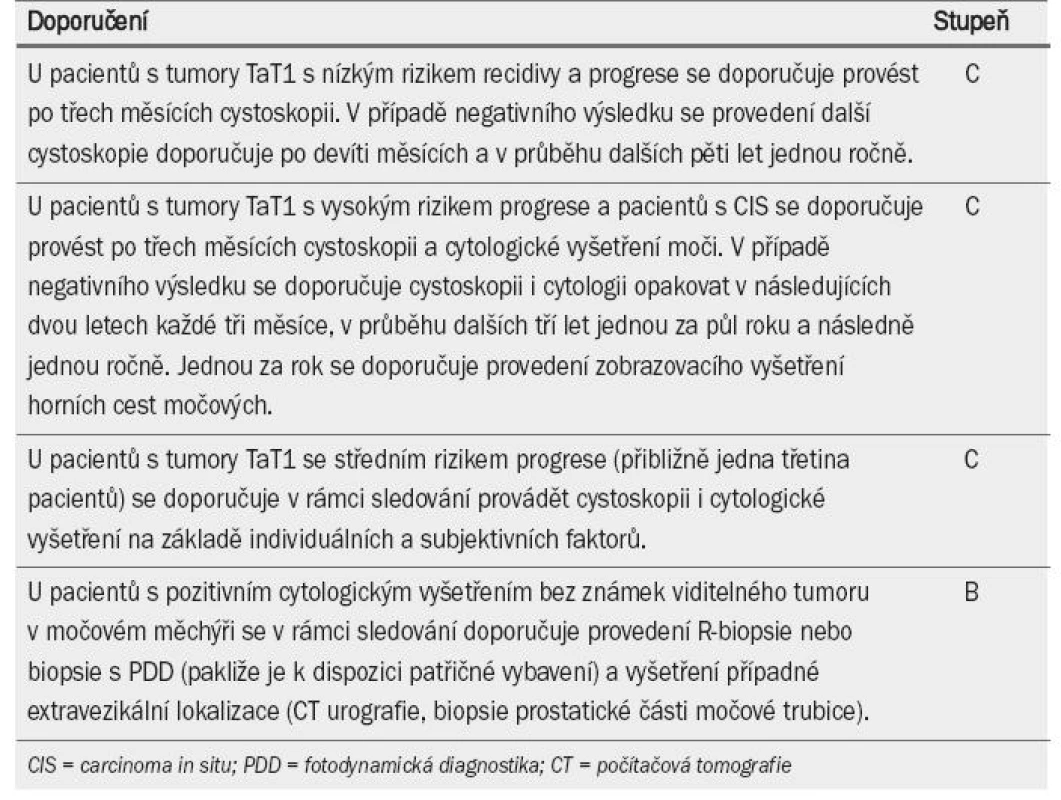
- Výsledky první cystoskopie tři měsíce po TUR lze považovat za významný prognostický faktor pro recidivu i progresi [33,67,72] (úroveň důkazu: 1a). První cystoskopii je třeba provést tři měsíce po TUR.
- Riziko recidivy tumoru v horních cestách močových se zvyšuje u pacientů s mnohočetnými tumory s vysokým rizikem [15] (úroveň důkazu: 3).
Tab. 8 uvádí seznam doporučení pro sledování pacientů s NMIBC.
Marko Babjuk1
Willem Oosterlinck2
Richard Sylvester3
Eero Kaasinen4
Andreas Böhle5
Juan Palou-Redorta6
Morgan Roupręt7
1Department of Urology, Hospital Motol, 2nd Faculty of Medicine, Charles University, Praha, V Úvalu 84, Praha 5, 150 00Czech Republic
marek.babjuk@lfmotol.cuni.cz
2Department of Urology, Ghent University Hospital, Ghent, Belgium
3European Organisation for Research and Treatment of Cancer Headquarters, Department of Biostatistics, Brussels, Belgium
4Department of Urology, Hyvinkää Hospital, Hyvinkää, Finland
5Department of Urology, HELIOS Agnes Karll Hospital, Bad Schwartau, Germany
6Department of Urology, Fundació Puigvert, Universitat Autónoma de Barcelona, Barcelona, Spain
7Department of Urology of Pitié-Salpétriére Hospital, GHU Est, Assistance-Publique Hôpitaux de Paris; Faculty of Medicine Pierre et Marie Curie, University Paris VI, Paris, France
Sources
1. Oosterlinck W, Lobel B, Jakse G et al. Guidelines on bladder cancer. Eur Urol 2002; 41(2): 105–112.
2. Oxford Centre for Evidence-based Medicine - levels of evidence (March 2009). Centre for Evidence-Based Medicine Web site.
http://www.cebm.net/index.aspx?o=1025.
3. Ferlay J, Bray F, Pisani P et al. Globcan 2002, cancer incidence, mortality and prevalence worldwide. IARC Cancer Base No. 5, v.2.0. Lyon, France: IARCC Press, 2004.
4. Ferlay J, Randi G, Bosetti C et al. Declining mortality from bladder cancer in Europe. BJU Int 2008; 101(1): 11–19.
5. Zeegers MPA, Swaen GMH, Kant I et al. Occupational risk factors for male bladder cancer: results from a population-based case cohort study in the Netherlands. Occup Environ Med 2001; 58(9): 590–596.
6. Zeegers MPA, Tan FE, Dorant E et al. The impact of characteristics of cigarette smoking on urinary tract cancer risk: a meta-analysis of epidemiologic studies. Cancer 2000; 89(3): 630–639.
7. Sobin LH, Gospodarowicz MK, Wittekind C (Eds.). TNM classification of malignant tumors (UICC International Union Against Cancer) ed 7. (Wiley--Blackwell, New York, NY, 2009): 262–265.
8. Sauter G, Algaba F, Amin M et al. Tumours of the urinary system: non-invasive urothelial neoplasias. Eble JN, Sauter G, Epstein JL et al (Eds.). WHO classification of tumours of the urinary system and male genital organs. IARCC Press, Lyon, France, 2004.
9. Burger M, van der Aa MNM, van Oers JMM et al. Prediction of progression of non-muscle-invasive bladder cancer by WHO 1973 and 2004 grading and by FGFR3 mutation status: a prospective study. Eur Urol 2008; 54(4): 835–844.
10. Pan CC, Chang YH, Chen KK et al. Prognostic significance of the 2004 WHO/ISUP classification for prediction of recurrence, progression, and cancer-specific mortality of non-muscle-invasive urothelial tumors of the urinary bladder: a clinicopathologic study of 1,515 cases. Am J Clin Pathol 2010; 133(5): 788–795.
11. May M, Brookman-Amissah S, Roigas S et al. Prognostic accuracy of individual uropathologists in noninvasive urinary bladder carcinoma: a multicentre study comparing the 1973 and 2004 World Health Organisation classifications. Eur Urol 2010; 57(5): 850–858.
12. van der Meijden A, Sylvester R, Collette L et al. The role and impact of pathology review on stage and grade assessment on stages Ta and T1 bladder tumors: a combined analysis of 5 European Organization for Research and Treatment of Cancer trials. J Urol 2000; 164(5): 1533–1537.
13. Sylvester R, van der Meijden A, Witjes JA et al. High-grade Ta urothelial carcinoma and carcinoma in situ of the bladder. Urology 2005; 66 (6 Suppl 1): 90–107.
14. Palou J, Rodriguez-Rubio F, Huguet J et al. Multivariate analysis of clinical parameters of synchronous primary superficial bladder cancer and upper urinary tract tumors. J Urol 2005; 174(3): 859–861.
15. Millan-Rodriguez F, Chechile-Toniolo G, Salvador-Bayarri J et al. Upper urinary tract tumors after primary superficial bladder tumors: prognostic factors and risk groups. J Urol 2000; 164(4): 1183–1187.
16. Lokeshwar VB, Habuchi T, Grossman HB et al. Bladder tumor markers beyond cytology: international consensus panel on bladder tumor markers. Urology 2005; 66 (6 Suppl 6A): 35–63.
17. Raitanen MP, Aine R, Rintala E et al. Differences between local and review urinary cytology and diagnosis of bladder cancer. An interobserver multicenter analysis. Eur Urol 2002; 41(3): 284–289.
18. van Rhijn BWG, van der Poel GH, van der Kwast TH. Cytology and urinary markers for the diagnosis of bladder cancer. Eur Urol 2009; Suppl 8 : 536–541.
19. Grossman HB, Messing E, Soloway M et al. Detection of bladder cancer using a point-of-care proteomic assay. JAMA 2005; 293(7): 810–816.
20. Hajdinjak T. UroVysion FISH test for detecting urothelial cancers: Meta-analysis of diagnostic accuracy and comparison with urinary cytology testing. Urol Oncol 2008; 26(6): 645–651.
21. Mowatt G, Zhu S, Kilonzo M et al. Systematic review of the clinical effectiveness and cost-effectiveness of photodynamic diagnosis and urine biomarkers (FISH, ImmunoCyt, NMP22) and cytology for the detection and follow-up of bladder cancer. Health Technol Assess 2010; 14(4): 1–331.
22. Lotan Y, Svatek RS, Malats N. Screening for bladder cancer: a perspective. World J Urol 2008; 26(1): 13–18.
23. Van Rhijn BWG, van der Poel HG, van der Kwast TH. Urine markers for bladder cancer surveillance: a systematic review. Eur Urol 2005; 47(6): 736–748.
24. Lopez-Beltran A, Bassi P, Pavone-Macaluso M et al. Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter, and renal pelvis. Eur Urol 2004; 45(3): 257–266.
25. Brausi M, Collette L, Kurth K et al. EORTC Genito-Urinary Tract Cancer Collaborative Group. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol 2002; 41(5): 523–531.
26. van der Meijden A, Oosterlinck W, Brausi M et al. Significance of bladder biopsies in Ta,T1 bladder tumors: a report of the EORTC Genito-Urinary Tract Cancer Cooperative Group. Eur Urol 1999; 35(4): 267–271.
27. Mungan MU, Canda AE, Tuzel E et al. Risk factors for mucosal prostatic urethral involvement in superficial transitional cell carcinoma of the bladder. Eur Urol 2005; 48(5): 760–763.
28. Kausch I, Sommerauer M, Montorsi F et al. Photodynamic diagnosis in non–muscle-invasive bladder cancer: a systematic review and cumulative analysis of prospective studies. Eur Urol 2010; 57(4): 595–606.
29. Schumacher MC, Holmäng S, Davidsson T et al. Transurethral resection of non–muscle-invasive bladder transitional cell cancers with or without 5-aminolevulinic acid under visible and fluorescent light: results of a prospective, randomised, multicentre study. Eur Urol 2010; 57(2): 293–299.
30. Stenzl A, Burger M, Fradet Y et al. Hexaminolevulinate guided fluorescence cystoscopy reduces recurrence in patients with nonmuscle invasive bladder cancer. J Urol 2010; 184(5): 1907–1913.
31. Jakse G, Algaba F, Malmström PU. A second-look TUR in T1 transitional cell carcinoma: why? Eur Urol 2004; 45(5): 539–546.
32. Divrik RT, Yildirim Ü, Zorlu F. The effect of repeat transurethral resection on recurrence and progression rates in patients with T1 tumors of the bladder who received intravesical mitomycin: a prospective, randomized clinical trial. J Urol 2006; 175(5): 1641–1644.
33. Sylvester RJ, van der Meijden APM, Oosterlinck W et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49(3): 466–477.
34. Fernandez-Gomez J, Madero R, Solsona E et al. Predicting nonmuscle invasive bladder cancer recurrence and progression in patients treated with bacillus Calmette-Guérin: the CUETO scoring model. J Urol 2009; 182(5): 2195–2203.
35. Lamm DL. Carcinoma in situ. Urol Clin North Am 1992; 19(3): 499–508.
36. Chade DC, Shariat SF, Godoy G et al. Clinical outcomes of primary bladder carcinoma in situ in a contemporary series. J Urol 2010; 184(1): 74–80.
37. Sylvester R, Oosterlinck Q, van der Meijden A. A single immediate postoperative instillation of chemotherapy decreases the risk of recurrence in patients with stage Ta T1 bladder cancer: a meta-analysis of published results of randomized clinical trials. J Urol 2004; 171 : 2186–2190.
38. Berrum-Svennung I, Granfors T, Jahnson S et al. A single instillation of epirubicin after transurethral resection of bladder tumors prevents only small recurrences. J Urol 2008; 179(1): 101–105.
39. Gudjónsson S, Adell L, Merdasa F et al. Should all patients with non–muscle-invasive bladder cancer receive early intravesical chemotherapy after transurethral resection? The results of a prospective randomised multicentre study. Eur Urol 2009; 55(4): 773–780.
40. Kaasinen E, Rintala E, Hellström P et al. Factors explaining recurrence in patients undergoing chemoimmunotherapy regimens for frequently recurring superficial bladder carcinoma. Eur Urol 2002; 42(2): 167–174.
41. Hendricksen K, Witjes WPJ, Idema JG et al. Comparison of three schedules of intravesical epirubicin in patients with non–muscle-invasive bladder cancer. Eur Urol 2008; 53(5): 984–991.
42. Oddens JR, van der Meijden APM, Sylvester R. One immediate postoperative instillation of chemotherapy in low risk Ta, T1 bladder cancer patients. Is it always safe? Eur Urol 2004; 46(3): 336–338.
43. Pawinski A, Sylvester R, Kurth KH et al. A combined analysis of European Organization for Research and Treatment of Cancer, and Medical Research Council randomized clinical trials for the prophylactic treatment of TaT1 bladder cancer. European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council Working Part on Superficial Bladder Cancer. J Urol 1996; 156(6): 1934–1941.
44. Huncharek M, Geschwind JF, Witherspoon B et al. Intravesical chemotherapy prophylaxis in primary superficial bladder cancer: a meta-analysis of 3703 patients from 11 randomized trials. J Clin Epidemiol 2000; 53(7): 676–680.
45. Huncharek M, McGarry R, Kupelnick B. Impact of intravesical chemotherapy on recurrence rate of recurrent superficial transitional cell carcinoma of the bladder: results of a meta-analysis. Anticancer Res 2001; 21(1B): 765–770.
46. Sylvester RJ, Oosterlinck W, Witjes JA. Theschedule and duration of intravesical chemotherapy in patients with non-muscle-invasive bladder cancer: a systematic review of the published results of randomized clinical trials. Eur Urol 2008; 53(4): 709–719.
47. Au JL, Badalament RA, Wientjes MG et al. International Mitomycin C Consortium. Methods to improve efficacy of intravesical mitomycin C: results of a randomized phase III trial. J Natl Cancer Inst 2001; 93(8): 597–604.
48. Kuroda M, Niijima T, Kotake T. Effect of prophylactic treatment with intravesical epirubicin on recurrence of superficial bladder cancer—the 6th trial of the Japanese Urological Cancer Research Group (JUCRG): a randomized trial of intravesical epirubicin at dose of 20 mg/40 ml, 30 mg/40 ml, 40 mg/40 ml. Eur Urol 2004; 45(5): 600–605.
49. Shelley MD, Kynaston H, Court J et al. A systematic review of intravesical bacillus Calmette-Guérin plus transurethral resection vs transurethral resection alone in Ta and T1 bladder cancer. BJU Int 2001; 88(3): 209–216.
50. Han RF, Pan JG. Can intravesical bacillus Calmette-Guérin reduce recurrence in patients with superficial bladder cancer? A meta-analysis of randomized trials. Urology 2006; 67(6): 1216–1223.
51. Shelley MD, Wilt TJ, Court J et al. Mason. Intravesical bacillus Calmette-Guerin is superior to mitomycin C in reducing tumour recurrence in high-risk superficial bladder cancer: a meta-analysis of randomized trials. BJU Int 2004; 93(4): 485–490.
52. Böhle A, Jocham D, Bock PR. Intravesical bacillus Calmette-Guerin versus mitomycin C for superficial bladder cancer: a formal meta-analysis of comparative studies on recurrence and toxicity. J Urol 2003; 169(1): 90–95.
53. Duchek M, Johansson R, Jahnson S et al. Bacillus Calmette-Guérin is superior to a combination of epirubicin and interferon-α2b in the intravesical treatment of patients with stage T1 urinary bladder cancer. A prospective, randomized, Nordic study. Eur Urol 2010; 57(1): 25–31.
54. Järvinen R, Kaasinen E, Sankila A et al. Long-term efficacy of maintenance bacillus Calmette-Guérin versus maintenance mitomycin C instillation therapy in frequently recurrent TaT1 tumours without carcinoma in situ: a subgroup analysis of the prospective, randomised FinnBladder I study with a 20-year follow-up. Eur Urol 2009; 56(2): 260–265.
55. Sylvester RJ, Brausi MA, Kirkels WJ et al. Long-term efficacy results of EORTC Genito-Urinary Group randomized phase 3 study 30911 comparing intravesical instillations of epirubicin, bacillus Calmette-Guérin, and bacillus Calmette-Guérin plus isoniazid in patients with intermediate - and high-risk stage Ta T1 urothelial carcinoma of the bladder. Eur Urol 2010; 57(5): 766–773.
56. Malmström PU, Sylvester RJ, Crawford DE et al. An individual patient data meta-analysis of the long-term outcome of randomised studies comparing intravesical mitomycin C versus bacillus Calmette-Guérin for non–muscle-invasive bladder cancer. Eur Urol 2009; 56(2): 247–256.
57. Sylvester RJ, van der Meijden, Lamm DL. Intravesical bacillus Calmette-Guerin reduces the risk of progression in patients with superficial bladder cancer: a combined analysis of the published results of randomized clinical trials. J Urol 2002; 168(5): 1964–1970.
58. Böhle A, Bock PR. Intravesical bacillus Calmette-Guerin versus mitomycin C in superficial bladder cancer: formal meta-analysis of comparative studies on tumor progression. Urology 2004; 63(4): 682–687.
59. Lamm DL, Blumenstein BA, Crissman JD et al. Maintenance bacillus Calmette-Guerin immunotherapy for recurrent Ta, T1 and carcinoma in situ transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group Study. J Urol 2000; 163(4): 1124–1129.
60. Martinez-Pineiro JA, Martinez-Pineiro L, Solsona E et al. Club Urológico Espańol de Tratamiento Oncológico (CUETO). Has a 3-fold decreased dose of bacillus Calmette-Guérin the same efficacy against recurrences and progression of T1G3 and Tis bladder tumors than the standard dose? Results of a prospective randomized trial. J Urol 2005; 174 : 1242–1247.
61. Ojea A, Nogueira JL, Solsona E et al. A multicentre, randomised prospective trial comparing three intravesical adjuvant therapies for intermediate-risk superficial bladder cancer: low-dose bacillus Calmette-Guérin (27 mg) versus very low-dose bacillus Calmette-Guérin (13.5 mg) versus mitomycin C. Eur Urol 2007; 52 : 1398–1406.
62. van der Meijden APM, Sylvester RJ, Oosterlinck W et al. Maintenance bacillus Calmette-Guerin for Ta T1 bladder tumors is not associated with increase toxicity: results from a European Organisation for Research and Treatment of Cancer Genito-Urinary Group Phase III Trial. Eur Urol 2003; 44(4): 429–434.
63. Witjes JA, Palou J, Soloway M et al. Clinical practice recommendations for the prevention and management of intravesical therapy–associated adverse events. Eur Urol 2008; Suppl 7 : 667–674.
64. Sylvester RJ, van der Meijden APM, Witjes JA et al. Bacillus Calmette-Guérin versus chemotherapy in the intravesical treatment of patients with carcinoma in situ of the bladder: a meta-analysis of the published results of randomized clinical trials. J Urol 2005; 174(1): 86–92.
65. Palou J, Baniel J, Klotz L et al. Urothelial carcinoma of the prostate. Urology 2007; 69 (1 Suppl): 50–61.
66. Herr H, Dalbagni G. Defining bacillus Calmette-Guérin refractory superficial bladder tumors. J Urol 2003; 169(5): 1706–1708.
67. Solsona E, Iborra I, Dumont R et al. The 3-month clinical response to intravesical therapy as a predictive factor for progression in patients with high risk superficial bladder cancer. J Urol 2000; 164 (3 Pt 1): 685–689.
68. Lerner SP, Tangen CM, Sucharew H et al. Failure to achieve a complete response to induction BCG therapy is associated with increased risk of disease worsening and death in patients with high risk non muscle invasive bladder cancer. Urol Oncol 2009; 27(2): 155–159.
69. Raj GV, Herr H, Serio AM et al. Treatment paradigm shift may improve survival of patients with high risk superficial bladder cancer. J Urol 2007; 177(4): 1283–1286.
70. Gofrit ON, Pode D, Lazar A et al. Watchful waiting policy in recurrent Ta G1 bladder tumors. Eur Urol 2006; 49(2): 303–307.
71. Herr HW, Donat SM, Reuter VE. Management of low grade papillary bladder tumors. J Urol 2007; 178 (4 Pt 1): 2201–2205.
72. Holmang A, Johansson SL. Stage Ta-T1 bladder cancer: the relationship between findings at first followup cystoscopy and subsequent recurrence and progression. J Urol 2002; 176 (4): 1634–1637.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2011 Issue 3
-
All articles in this issue
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
- Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Ileální neovezika a její varianty
- Karcinom močového měchýře – nejnovější poznatky v oblasti operační a medikamentózní léčby
- Chemoterapie u invazivního a metastatického nádoru močového měchýře
- Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
- EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ileální neovezika a její varianty
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
