-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Poškození lymfocytární DNA během anestezie: pilotní studie srovnávající celkovou a subarachnoideální anestezii
Damage to lymfocyte DNA during anaesthesia: a pilot study comparing general and subarachnoid anaesthesia
Objective: DNA damage due to general anesthesia (GA) has been described by various methods. Comparisons of different anesthesia techniques has not been found in the available literature. The primary aim of the study was to test the feasibility of the method. The secondary aim was to disprove the hypothesis that neuraxial anesthesia damages DNA just as much as GA in a pilot study.
Design: Prospective, non-randomized, monocentric, observational pilot study.
Setting: University Hospital.
Materials and methods: Patients (n = 34) undergoing orthopedic/traumatological lower limb surgery were divided into two groups: general anesthesia (GA group) and subarachnoid anesthesia (SAB group). In all enrolled patients, after informed consent was obtained, blood was taken before surgery and within 24 hours after the surgery. Lymphocyte DNA damage was assessed by comet assay, which can quantitatively detect damage to nuclear DNA. Using specific enzymes, oxidative DNA damage can be detected. Comet assay results are evaluated semi-automatically by Lucia software (Laboratory Imaging, CZ) in fluorescence microscopy, which allows quantification of oxidized DNA bases and single stranded DNA breaks. The Wilcoxon test at the statistical significance level of p = 0.05 was used to compare the results between both groups.
Results: The GA group consisted of 19 patients, the SAB group of 15 patients. There was a significantly higher DNA damage in the GA group compared to their preoperative values. Non-significant differences in DNA damage were observed in the SAB group.
Conclusion: We proved the feasibility of the comet assay method in quantification of DNA damage in patients after anesthesia and surgery. The results point at the possible relationship between the anesthesia technique and DNA changes associated with surgery and/or anesthesia. The chosen method brings reproducible results with a potential for its use in the investigation of the effects of anesthesia on DNA, and opens the way for testing protective concepts aimed at minimizing DNA damage due to surgical trauma and anesthesia.
Keywords:
General anesthesia – neuraxial anesthesia – DNA damage
Autori: D. Astapenko 1,2,3; V. Zubáňová 4,5; M. Koščáková 4,5; M. Kuchařová 3,5; R. Hyšpler 2,4; A. Tichá 4; V. Černý 2,3,6,7; R. Štětina 3; Z. Zadák 2,3,4
Pôsobisko autorov: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové 1; Lékařská fakulta v Hradci Králové, Univerzita Karlova 2; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 3; Ústav klinické biochemie a diagnostiky, Fakultní nemocnice Hradec Králové 4; Farmaceutická fakulta v Hradci Králové, Univerzita Karlova 5; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně, Masarykova nemocnice Ústí nad Labem 6; Department of Anaesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, NS, Kanada 7
Vyšlo v časopise: Anest. intenziv. Med., 30, 2019, č. 6, s. 302-310
Kategória: Celková anestezie - původní práce
Súhrn
Cíl studie: Poškození DNA vlivem celkové anestezie (CA) je popsáno použitím různých metod. Publikace porovnávající vliv rozdílných anesteziologických technik nebyly v dostupné odborné literatuře nalezeny. Primárním cílem práce bylo ověřit proveditelnost metody. Sekundárním cílem bylo vyvrátit hypotézu, že neuraxiální anestezie (SAB) poškozuje DNA stejně jako CA v pilotní studii.
Typ studie: Prospektivní nerandomizovaná monocentrická observační pilotní studie.
Typ pracoviště: Fakultní nemocnice.
Materiál a metoda: Pacienti (n = 34) podstupující ortopedicko-traumatologický výkon na dolní končetině byli rozděleni do dvou skupin: skupina CA a skupina SAB. U všech zařazených pacientů byl po podepsání informovaného souhlasu proveden odběr krve před operací a do 24 hodin po operaci. Poškození lymfocytární DNA bylo vyšetřeno metodou comet assay, která umí kvantitativně detekovat poškození nukleární DNA. Pomocí specifických enzymů lze stanovit poškození DNA způsobené oxidací bází. Výsledky comet assay byly dále hodnoceny semiautomaticky programem Lucia (Laboratory Imaging, CZ) ve fluorescenční mikroskopii, která umožňuje kvantifikaci oxidovaných bází DNA a zlomů jednošroubovicové DNA. Pro porovnání výsledků v obou skupinách byl použit Wilcoxonův test na hladině statistické významnosti pro p = 0,05.
Výsledky: Skupinu CA tvořilo 19 pacientů, skupinu SAB 15 pacientů. Ve skupině CA bylo nalezeno statisticky významně vyšší poškození DNA ve srovnání s předoperačními hodnotami, u pacientů skupiny SAB byly zaznamenány statisticky nevýznamné rozdíly v poškození DNA před a po operaci.
Závěr: Metoda comet assay se ukázala jako použitelná pro kvantifikaci změn DNA u pacientů po chirurgickém výkonu v anestezii. Výsledky poukazují na možný vztah mezi anesteziologickou technikou a změnami DNA asociovanými s operačním traumatem a/nebo anestezií. Zvolená metoda přináší reprodukovatelné výsledky s potenciálem jejího využití ve výzkumu vlivu anestezie na změny DNA a otevírá cestu k testování protektivních konceptů směřujících k minimalizaci poškození DNA v důsledku anestezie a operačního traumatu.
Klíčová slova:
celková anestezie – neuraxiální anestezie – poškození DNA
ÚVOD
Změny ve struktuře molekuly DNA vlivem anestetik byly v literatuře opakovaně popsány různými metodami [1–4]. Existují tedy důkazy o tom, že anestetika mění naší genetickou informaci. Změny byly popsány jak u pacientů, tak u personálu operačních sálů čili i při výrazně nižší koncentraci anestetik a při absenci operačního traumatu [5, 6]. Anestetika jsou tímto potenciálně kancerogenní agens. Do jaké míry jsou moderní používaná anestetika kancerogenní, nevíme. Spojitost s pooperační poruchou kognitivních funkcí a možným rozvojem Alzheimerovy choroby můžeme spíše tušit než přímo prokázat [7, 8]. Kvantifikace míry změny, potažmo poškození DNA vlivem anestetik, bylo v literatuře popsáno především na in vitro modelech a v animálních studiích [1, 2, 9].
Vhodnou metodou, která dovede kvantifikovat míru poškození DNA v humánní medicíně, je comet assay (single cell gel electrophoresis) [10]. Metoda byla vyvinuta v různých modifikacích, např. kvantifikace zlomů jednošroubovicové DNA, dvoušroubovicové DNA, oxidovaných pyrimidinových a purinových bází a dovede kvantifikovat nízkou hladinu změn DNA v jednotlivých eukaryontních buňkách [11]. Metoda hodnotí změny DNA periferních lymfocytů (obr. 1), které je možné stanovit po zafixování buněk na agarózovém gelu, po odstranění cytoplazmatické membrány pomocí lyzačního roztoku, rozvolnění struktury v alkalickém prostředí a vystavění tohoto nukleoidu („holého jádra“) elektrickému poli. Vlivem napětí a pH prostředí (může se lišit podle typu použité metody) pak dochází k relaxaci smyček (domén) DNA a k jejich pohybu směrem ke kladné elektrodě (anodě). Díky tomu vzniká typický tvar komety [12]. Comet assay se osvědčila především při kvantifikaci poškození DNA u pacientů po chemoterapii a radioterapii [13, 14]. Anestetika, jakožto poškozující agens, byla touto metodou již testována, ale změny vlivem neuroaxiální anestezie popsány dosud nebyly.
Obr. 1. Změny v organizaci DNA po denaturaci (alkalické rozplétání) a po elektroforéze 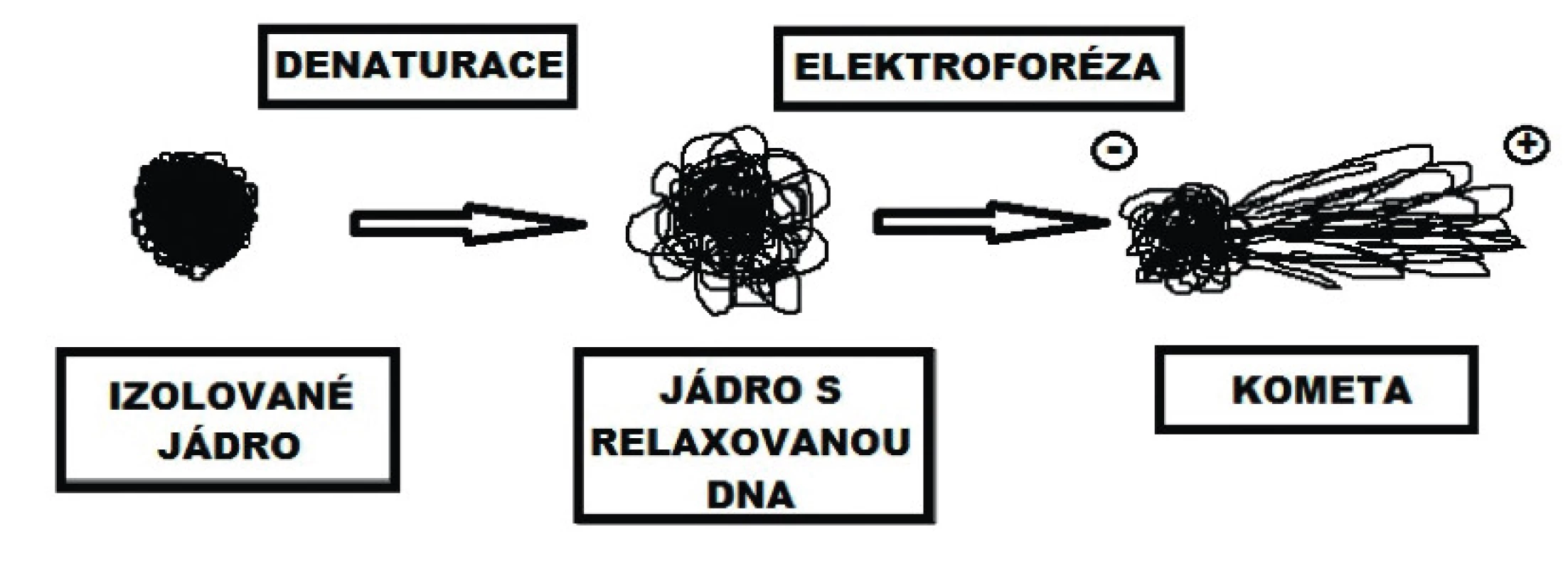
Primárním cílem naší pilotní studie bylo zhodnotit použitelnost metody comet assay pro kvantifikaci změn DNA u pacientů po chirurgickém výkonu v anestezii. Sekundárním cílem bylo popsat míru poškození DNA u pacientů v celkové anestezii a v neuroaxiální blokádě podstupujících ortopedický nebo traumatologický výkon na pánvi nebo dolní končetině. Nulová hypotéza byla, že celková anestezie poškozuje DNA stejně jako neuroaxiální anestezie.
SOUBOR A METODA
PACIENTI A TYPY ANESTEZIE
Prospektivní, monocentrická, nerandomizovaná studie byla schválena etickou komisí (Fakultní nemocnice Hradec Králové, jednací číslo 201511 S14P). Všichni pacienti podepsali informovaný souhlas s účastí ve studii. Byla dodržována Helsinská deklarace práv a svobod. Sběr dat probíhal v období od června 2016 do března 2018. Zařazovací kritéria byla souhlas se studií a podepsání informovaného souhlasu, věk nad 18 let, traumatologický operační výkon na dolní končetině nebo pánvi trvající minimálně 90 minut v celkové anestezii nebo ortopedický výkon na dolní končetině nebo velkém kloubu trvající minimálně 90 minut v neuroaxiální anestezii. Vyřazovací kritéria byla akutní povaha výkonu, anamnéza onkologického onemocnění s chemoterapií nebo radioterapií v posledních 12 měsících, imunosupresivní terapie v posledních 12 měsících, aktivní kuřák (více než 1 cigareta/den), vyšetření CT v posledním týdnu před operací a nesouhlas se studií.
Skupina pacientů s celkovou anestezií (CA) podstoupila traumatologický výkon na dolní končetině nebo na pánvi (otevřená repozice, vnitřní fixace, tzv. ORIF) v celkové anestezii s nebo bez peroperační fluoroskopie. Pacientům byla podána premedikace 1,5 mg bromazepamu (Lexaurin, Kabu Pharma, Praha, Česká republika) per os. CA byla indukována propofolem (Propofol, Fresenius Kabi, Bad Homburg, Německo) v dávce 2 mg/kg, analgezie byla vedena sufentanilem (Sufentanil Torrex, Chiesi Pharmaceuticals, Vídeň, Rakousko) v úvodní dávce 10 mg a dále podle monitorace hodnoty SPI (Surgical Plethysmography Index). Pokud byla nutná svalová relaxace, bylo použito atrakurium (Tracrium, Aspen Pharma, Dublin, Irsko) v úvodní dávce 0,5 mg/kg a dále podle monitoringu hloubky svalové relaxace (monitor byl integrální součástí anesteziologického přístroje Aisys) na hodnotu TOF 2 (train of four). CA byla po úvodu vedena inhalačně isofluranem (Forane, Abott Laboratories Ltd., Maidenhead Berkshire, Velká Británie) v nosné směsi kyslíku (FiO2 0,40) s oxidem dusným s minimální alveolární koncentrací 0,8–1,0. Pokud byla nutnost dekurarizace na konci výkonu, byl podán neostigmin (Syntostigmin, BB Pharma, Praha, Česká republika) v dávce 1,5 mg intravenózně a atropin (Atropin Biotika, BB Pharma, Praha, Česká repub-lika) v dávce 0,5 mg intravenózně. Pacientům byla zaznamenána demografická data a každých 5 minut v průběhu operace krevní tlak, pulz, saturace periferní krve kyslíkem, vydechovaná koncentrace oxidu uhličitého a tělesná teplota. Tekutinová terapie byla udržována balancovaným krystaloidním roztokem (Ringerfundin, BBraun, Melsungen, Německo) přes zavedený periferní žilní katétr (18 G, BBraun, Melsungen, Německo) v základním přívodu 100 ml/h a dále podle krevní ztráty a oběhové stability. Tělesná teplota byla udržována ve fyziologickém rozmezí mezi 36 a 37 °C vyhřívací podložkou (Astopad, Stihler electronic, Stuttgart, Německo) a fukarem (Warm Air, Polymed, Hradec Králové, Česká republika). Dýchací cesty byly zajištěny orotracheální intubací (SUMI, Sulejowek, Polsko) nebo laryngeální maskou (Teleflex, Dublin Road, Athlon, Westmeath, Irsko). Umělá plicní ventilace byla objemově řízená nebo tlakově řízená – objemově garantovaná na dechový objem 6 ml/kg s dechovou frekvencí 12–16 dechů/minutu (podle vydechované koncentrace oxidu uhličitého v rozmezí 35–45 mmHg) a s pozitivním tlakem na konci výdechu 4 cm H2O. Byl použit anesteziologický přístroj Aisys (GE Healthcare, Praha, Česká republika).
Skupina pacientů v neuroaxiální anestezii (SAB) podstoupila ortopedický výkon – náhradu kolenního nebo kyčelního kloubu totální endoprotézou v subarachnoidální anestezii. Subarachnoidální punkce byla provedena asepticky Quinkeho jehlou (25 G, 88 mm, BBraun, Melsungen, Německo) v meziobratlovém prostoru L2/3 nebo L3/4 paramediálním přístupem po předchozí infiltraci místa vpichu 1% mesokainem (Mesocaine, Zentiva, Praha). Intratekálně bylo podáno 2,2 ml 0,5% levobupivakainu (Chirocaine, AbbVie, Praha, Česká republika) a 2,5 mg sufentanilu (podání mimo SPC; Sufentanil Torrex, Chiesi Pharmaceuticals, Vídeň, Rakousko). Oběhová nestabilita po indukci subarachnoidální anestezie byla řešena titračně 10 mg dávkami efedrinu (Ephedrin biotika, BB Pharma, Praha, Česká republika). Během výkonu byla pacientům podávána titračně sedace midazolamem (Midazolam Accord, Accord Healthcare Polska, Varšava, Polsko). Pacientům byl podáván kyslík obličejovou maskou 5 l/min při poklesu saturace pod 93 %. Monitoring a záznam dat byl jinak obdobný jako u pacientů ve skupině s CA.
Všem pacientům byla odebrána nesrážlivá krev (zkumavka s citrátem) před podáním indukční dávky anestetika nebo před provedením subarachnoidální punkce a po skončení operace. Vzorky krve byly umístěny do chladničky se 4 °C do doby analýzy na maximálně 4 hodiny.
DETEKCE MÍRY POŠKOZENÍ DNA
Izolace lymfocytů z periferní krve
Lymfocyty byly z plné periferní krve izolovány již popsanou metodikou [15, 16]. Do zkumavky byly napipetovány 4 ml LSM (Lymphocyte Separated Mediu, Biotech, Austria) a převrstveny 4 ml nesrážlivé krve. Zkumavky byly centrifugovány (30 minut, 1 500 rpm, 20 °C). Vzniklý prstenec lymfocytů byl přenesen do centrifugační zkumavky (Sarstedt, Australia) a doplněn 10 ml PBS (Sigma Aldrich, USA). Zkumavky byly centrifugovány (10 minut, 1 500 rpm, 8 °C), sediment byl resuspendován 10 ml PBS. Ve vzorku byla spočítána koncentrace buněk (Bürkerova komůrka). Vzorky byly opět zcentrifugovány (10 minut, 1500 rpm, 8 °C). Sediment byl zředěný PBS na koncentraci 1 milion buněk/ml.
Alkalická verze comet assay
K měření poškození DNA byla použita alkalická verze kometového testu [12]. Pro sledování jednotlivých typů poškození (SSB zlomy, oxidované pyrimidinové a purinové báze) byly lymfocyty pipetovány po 35 µl do 1,5 ml mikrozkumavek (Eppendorf, Germany). 85 µl 1% roztoku vysokotuhnoucí agarózy (HMP agaróza, Sigma Aldrich, USA) v PBS bylo pipetováno na předpřipravené podložní sklo potažené 1% vodným roztokem agarózy na elektroforézu (Sigma Aldrich, USA), bylo přikryto krycím sklem a tuhlo při 4 °C 5 minut. Po sejmutí krycího skla byla na HMP agarózu pipetována směs 35 µl lymfocytů s 85 µl 1% nízkotuhnoucí agarózy (LMP agaróza, Sigma Aldrich, USA) v PBS o teplotě 37 °C. Gel byl překryt krycím sklem a 5 minut tuhnul při 4 °C.
Lýza buněk
Po sejmutí krycích skel byla na podložní skla vložena do lyzačního roztoku (2,5 M NaCl; 100 mM EDTA – kyselina etylendiamintetraoctová, Sigma Aldrich, USA; 10 mM TRIS – tris(hydroxymethyl)aminomethan, Sigma Aldrich, USA, pH 10) s 1% Tritonem X–100 (Sigma Aldrich, USA). V lyzačním roztoku byla skla ponechána 1 hodinu.
Ovlivnění enzymy
Sklíčka, na která byly pipetovány enzymy (pro detekci modifikovaných pyrimidinových bází enzym Endo III – endonukleáza III a modifikovaných purinových bází enzym FPG – formaminopyrimidin-DNA-glykosyláza), byla vyjmuta z lyzačního roztoku a třikrát promyta ENDO pufrem (0,1 M KCl, 40 mM HEPES – kyselina 4-(2-hydroxyethyl)-1-piperazineethansulfonová, Sigma Aldrich, USA; 0,5 mM EDTA, 200 µl/ml BSA – hovězí sérový albumin, Sigma Aldrich, USA, pH 8). Na gely na sklíčkách bylo pipetováno 30 µl příslušného enzymu, byly přikryty krycím sklem a sklíčka byla inkubována v termoboxu (30 minut, 37 °C). Sklíčka, na kterých nebyl použitý enzym, zůstávají v lyzačním roztoku.
Rozplétání, elektroforéza a barvení
Po inkubaci a sejmutí krycích skel byla všechna podložní skla (ovlivňovaná enzymy i neovlivněná) vyskládána do elektroforetického tanku (Model A5 – Owl separation systems, Inc. Thermo Scientific, USA) naplněného elektroforetickým pufrem o teplotě 4 °C (300 mM NaOH, 1 mM EDTA, pH 13). Alkalické rozplétání DNA probíhalo po dobu 40 minut, poté byl připojen laboratorní zdroj EPS 300 IIV (C.B.S. scientific comapny, Inc., Taiwan) a následovala 30minutová elektroforéza (25 V, 300 mA, 4 °C) [17]. Po elektroforéze byla sklíčka promyta třikrát po dobu 5 minut neutralizačním pufrem (0,4M Tris-HCl, pH 7,5) a poté jednou redestilovanou vodou. DNA byla nabarvena 20 µl ethidium bromidu.
Hodnocení komet
Míra poškození DNA byla hodnocena pomocí fluorescenčního mikroskopu (Nikon Instruments Inc., USA) s připojenou kamerou a analyzována byla programem Lucia comet assay (Laboratory Imaging, Česká republika). Byl použit objektiv se zvětšením 10× a režim zeleného světla pro ethdium bromid. Hodnoceno bylo 50 buněk pro každý typ poškození. Míra poškození byla hodnocena jako procento DNA, která zůstala v jádře k DNA, která se nachází v ocasu komety (% tail DNA).
Metoda se řadí k poměrně časově nenáročným (kolem 6 hodin) a námi prováděná varianta analýzy se pohybovala v časovém rozpětí 7–8 hodin. Další výhodou metody je její ekonomická nenáročnost a velmi dobrá citlivost a robustnost. V současné době se také rozvíjí možnost využití komerčně vyráběných kitů, které celý proces značně urychlují a dodávají metodě lepší reprodukovatelnost.
STATISTICKÉ ZPRACOVÁNÍ
Data byla testována na normalitu D’Agostino--Pearson omnibus testem. Výsledky comet assay byly počítány pro každou kometku zvlášť jako % tail DNA. Demografická data byla hodnocena testem one-way ANOVA a Chi-square testem (pro pohlaví). Porovnání výsledků v obou skupinách bylo pomocí dvouvýběrového nepárového Studentova t-testu, párového t-testu nebo Wilcoxonova a Mann-Whitneyova testu (pro data bez Gaussova rozložení). Data jsou ve tvaru průměr (± směrodatná odchylka) nebo medián (interkvartilové rozpětí) pro data bez Gaussova rozložení. Pro statistickou analýzu byl použit program GraphPad Prism v 6.0c (GraphPad Software, Inc., CA, USA). Hladina statistické významnosti byla p = 0,05.
VÝSLEDKY
Do studie bylo zařazeno 45 pacientů, ale kompletní data byla získána pouze od 34. Důvodem byla nepoužitelnost některých vzorků pro analýzu kvůli instrumentálnímu selhání. Ve skupině s CA bylo 19 pacientů a ve skupině se SAB 15 pacientů. Demografická data a výsledky předoperačního vyšetření shrnuje tabulka 1. Pacienti v SAB skupině byly statisticky významně starší. Pacienti ve skupině CA měli vyšší hmotnost a byli statisticky významně vyšší. Relevantní laboratorní výsledky před anestezií a údaje z peroperačního průběhu výkonu popisuje tabulka 2. Peroperační fluoroskopie byla použita ve skupině s CA u 7 pacientů, údaje o dávce záření jsou v tabulce 2. Pacienti v CA měli statisticky významně vyšší tepovou frekvenci a délku operace. Pacienti v SAB skupině měli statisticky významně vyšší předoperační hodnoty koncentrace hemoglobinu a vyšší hematokrit.
Tab. 1. Demografická data a výsledky předoperačního vyšetření pacientů v obou skupinách 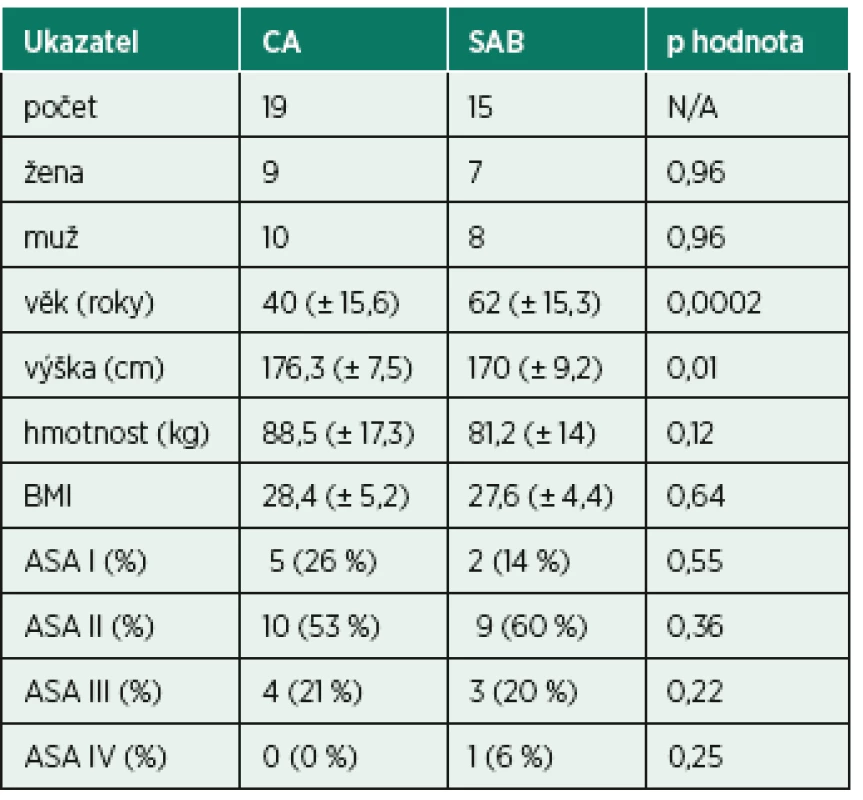
ASA – klasifikace American Society of Anesthesia physical status, BMI – body-mass index, CA – celková anestezie, SAB – neuroaxiální anestezie
Data jsou zobrazena jako absolutní čísla, procenta nebo průměr (± směrodatná odchylka). N/A – není použitelné.Tab. 2. Laboratorní výsledky z předoperačního vyšetření a údaje z peroperačního průběhu 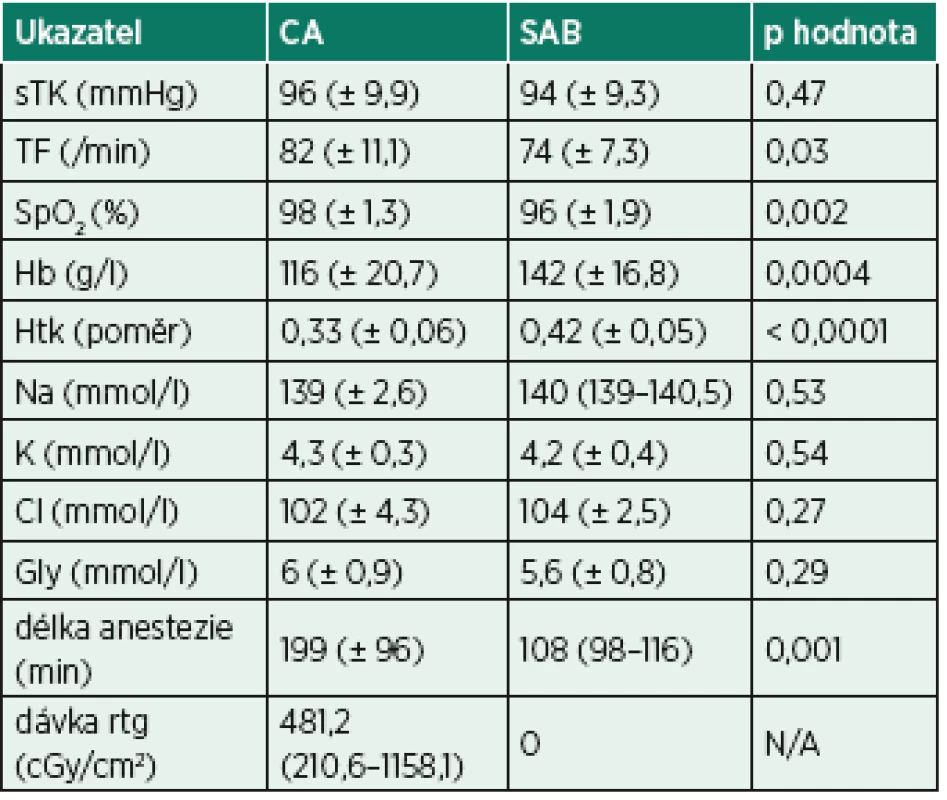
CA – celková anestezie, Cl – chloremie, Gly – glykemie, Hb – hemoglobin, Htk – hematokrit, K – kalcemie, Na – natremie, SAB – neuroaxiální anestezie, SpO2 – saturace periferní krve kyslíkem, sTK – střední krevní tlak, TF – tepová frekvence, rtg – rentgenové záření Data jsou zobrazena jako průměr (± směrodatná odchylka) nebo medián (interkvartilové rozpětí) u souborů hodnot, které neprošly testem normality dat. NA – není použitelné. Parametry poškození DNA shrnují tabulky 3 a 4 a znázorňují grafy 1–6. Procento zlomů DNA SSB bylo statisticky významně vyšší po celkové anestezii s peroperační fluoroskopií (grafy 1 a 2). Procenta oxidovaných pyrimidinových bází (ENDO – grafy 3 a 4) a purinových bází (FPG – grafy 5 a 6) byla rovněž statisticky významně vyšší po operaci ve skupině CA. Parametry poškození DNA mezi pacienty s a bez peroperační fluoroskopie ve skupině CA nebyly statisticky významně rozdílné, přestože vykazovaly trend k vyššímu poškození při použití fluoroskopie (tab. 5). Nulová hypotéza, že CA poškozuje DNA stejně jako SAB, byla vyvrácena.
Tab. 3. Hodnoty parametrů poškození DNA u pacientů v celkové anestezii 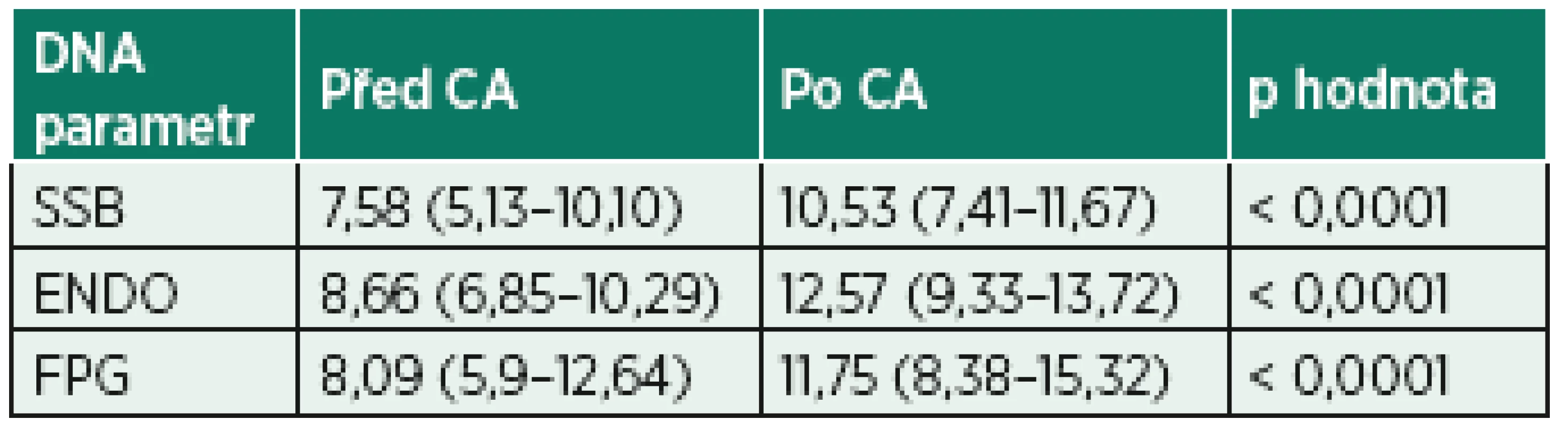
CA – celková anestezie
Procenta DNA v ohonu komety u buněk bez inkubace s enzymy (SSB), po inkubaci s endonukleázou III (ENDO) nebo s formamidopyrimidin glykosylázou (FPG). Data jsou ve tvaru medián (interkvartilové rozpětí), jelikož neprošla D’Agostino-Pearson omnibus testem normality. P hodnota udává výsledek Wilcoxonova testu.Tab. 4. Hodnoty parametrů poškození DNA u pacientů v subarachnoidální anestezii 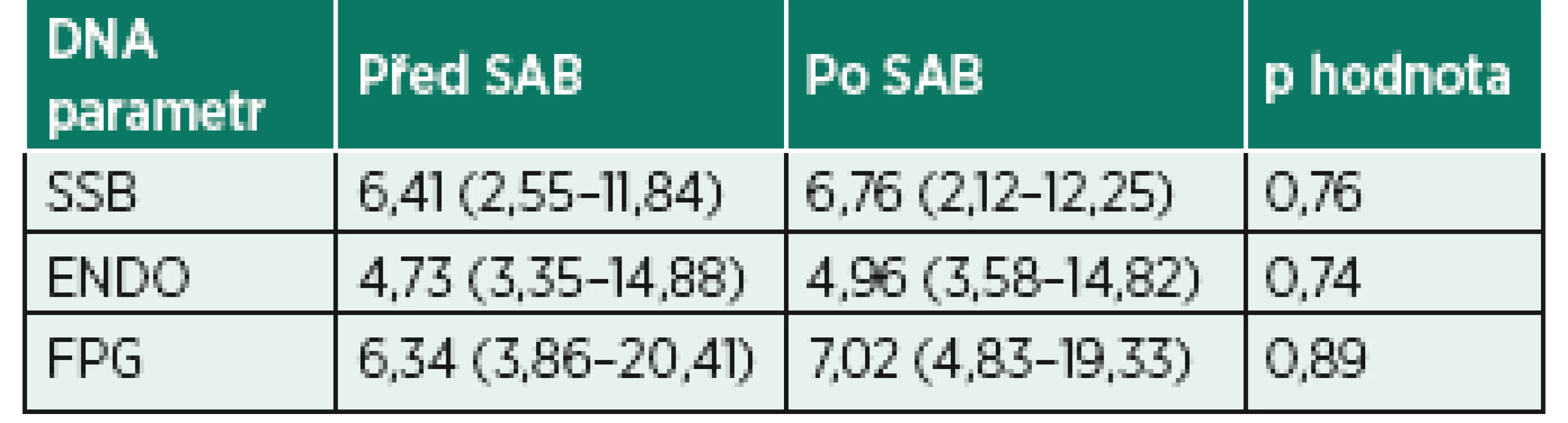
SAB – subarachnoidální anestezie
Procenta DNA v ohonu komety u buněk bez inkubace s enzymy (SSB), po inkubaci s endonukleázou III (ENDO) nebo s formamidopyrimidin glykosylázou (FPG). Data jsou ve tvaru medián (interkvartilové rozpětí), jelikož neprošla D’Agostino-Pearson omnibus testem normality. P hodnota udává výsledek Wilcoxonova testu.Tab. 5. Porovnání výsledků poškození DNA u pacientů ve skupině CA s a bez peroperační fluoroskopie 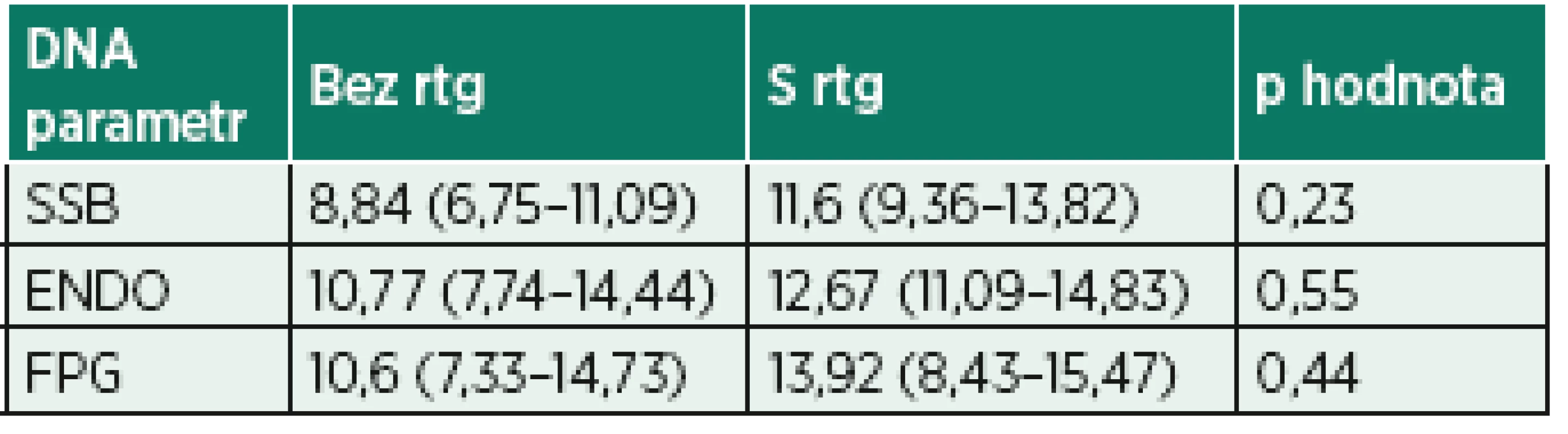
rtg – rentgenové záření
Procenta DNA v ohonu komety u buněk bez inkubace s enzymy (SSB), po inkubaci s endonukleázou III (ENDO) nebo s formamidopyrimidin glykosylázou (FPG). Data jsou ve tvaru medián (interkvartilové rozpětí), jelikož neprošla testem normality. Ve skupině pacientů s rtg zářením test normality nemohl být proveden pro nedostatečný počet pacientů ve skupině. P hodnota udává výsledek Mann-Whitneyova testu.Graf 1. Poškození DNA (% tail DNA) u pacientů v CA 
SSB – procenta DNA v ohonu komety u buněk bez inkubace s enzymy, CA – celková anestézie, hvězdička značí p < 0,0001. Graf 2. Poškození DNA (% tail DNA) u pacientů v SAB 
SSB – procenta DNA v ohonu komety u buněk bez inkubace s enzymy, SAB – subarachnoidální blokáda. Graf 3. Přítomnost oxidovaných pyrimidinových bází (% tail DNA) u pacientů v CA 
Procento DNA v ohonu komety u buněk po inkubaci s endonukleázou III (ENDO). CA – celková anestezie, hvězdička značí p < 0,0001. Graf 4. Přítomnost oxidovaných pyrimidinových bází (% tail DNA) u pacientů v SAB 
Procento DNA v ohonu komety u buněk po inkubaci s endonukleázou III (ENDO). SAB – subarachnoidální blokáda. Graf 5. Přítomnost oxidovaných purinových bází (% tail DNA) u pacientů v CA 
Procento DNA v ohonu komety u buněk po inkubaci s formamidopyrimidin glykosylázou (FPG). CA – celková anestezie, hvězdička značí p < 0,0001. Graf 6. Přítomnost oxidovaných purinových bází (% tail DNA) u pacientů v SAB 
Procento DNA v ohonu komety u buněk po inkubaci s formamidopyrimidin glykosylázou (FPG). SAB – subarachnoidální blokáda. DISKUSE
V naší pilotní studii jsme popsali poškození DNA v průběhu chirurgického výkonu srovnatelného typu u pacientů v CA a v SAB. Celkovou anestezií se již zabývala řada autorů. Sardas et al. popsali poškození DNA u pacientů po abdominální chirurgii v celkové anestezii isofluranem, přičemž zaznamenali statisticky signifikantní rozdíly v porovnání s kontrolní skupinou nebo se stavem DNA před anestezií [4]. Podobné výsledky na podobném souboru pacientů byly publikovány i jinými autory [18]. Kadioglu et al. se zabývali vlivem sevofluranu u pacientek indikovaných k mastektomii na poškození DNA s použitím dvou metod: comet assay a alkaline halo assay [19]. Popsali statisticky významné poškození DNA po dvouhodinovém výkonu oběma metodami. Nogueira et al. popsali statisticky významné poškození DNA druhý den po chirurgickém zákroku v anestezii desfluranem [20]. Braz et al. se zabývali sevofluranem a propofolem v rámci miniinvazivní otorinolaryngologické chirurgie, která trvala dvě hodiny [3]. Ani u jedné skupiny pacientů nezaznamenali statistický významné rozdíly v poškození DNA a jejich studie se tímto vymyká. Stran vlivu lokálních anestetik na integritu DNA jsme našli pouze animální studie, ve kterých byly navíc použity jiné metody.
Naše výsledky a výsledky výše uvedených studií nás staví před zásadní otázku genotoxicity anestetik a chirurgického výkonu jako iatrogenní poškození. Autoři citovaných studií sledovali kondici DNA i v prvních pooperačních dnech a shodují se na tom, že k plné reparaci DNA dojde až mezi 3. a 5. pooperačním dnem [4, 18, 19]. Tyto výsledky se shodují s daty naší výzkumné skupiny (dosud nepublikovaná data na jiném souboru pacientů). Jaký to má klinický dopad, tedy dopad na stonání pacientů a na zotavení z operačního traumatu zatím nevíme, podobně jako dopad statisticky významně vyššího poškození DNA u pacientů v CA v naší studii. Souvislost s neurotoxicitou a rozvojem pooperační kognitivní dysfunkce můžeme zatím pouze předpovídat [21]. Přímý kancerogenní vliv na lidský organismus byl dosud prokázán u halotanu [22], který byl z tohoto důvodu v humánní medicíně zakázán. Nicméně, přestože naše výsledky prokazují změnu DNA na subklinické úrovni, stále je to změna, která může vést k potenciálně vyššímu riziku kancerogeneze. Výsledky citovaných studií u pacientů podstupujících operační výkon i studií zabývajících se personálem operačního sálu (tedy anestetik samotných) [5, 6] otevírají další otázky směrem k zavedení prevence poškození DNA jak u pacientů, tak u personálu operačních sálů [23] a revizi hygienických norem [24]. V otázce izolovaného vlivu operačního traumatu na integritu DNA získáme odpověď pouze nepřímo. V našem souboru pacientů prezentujeme 2 skupiny, které mezi sebou lze jen velmi obtížně porovnávat. Nicméně u pacientů v SAB bylo poškození DNA na konci výkonu minimální. Důvodem může být deaferentace z operačního pole a menší centrálně vedená reakce, ovšem imunitní reakce SAB potlačena není.
Naše studie má několik limitací týkajících se jejího sekundárního cíle. Kohorty pacientů tvořily dvě nesourodé skupiny, i když jsme je vzájemně neporovnávali. Důvod jejich rozdílnosti byl ten, že skupina CA s peroperační fluoroskopií měla mít vyšší inzult vůči DNA a skupina SAB menší pro potřeby testování metodiky. Hlavní rozdíly u pacientů v CA byly delší čas operací, opakované operace (např. pacienti po polytrauma), opakované krevní převody mezi operacemi (nižší hemoglobin a hematokrit, hemodiluce z kumulativně vyšší pozitivní tekutinové bilance), probíhající systémová zánětlivá odpověď (vyšší předoperační tepové frekvence), průměrně mladší věk pacientů. Zásadní limitací, pokud bychom chtěli porovnávat izolovaně vliv typu anestezie, je kombinace noxy vůči DNA: inhalační anestetika a rtg záření. Porovnání výsledků poškození DNA u pacientů s a bez peroperační fluoroskopie sice neprokázalo významné rozdíly, ale pro malý počet pacientů byl použitý statistický test bez dostatečné síly. Nicméně, zjistili jsme trend k vyššímu poškození DNA u pacientů s kombinovanou noxou. Vliv oxidu dusného též nemůžeme přehlížet, a to ani u personálu operačních sálů [25]. Dále, obě skupiny nebyly randomizované. Pacienti byli do skupin zařazováni prospektivně na dvou klinikách.
ZÁVĚR
Prokázali jsme použitelnost metody comet assay pro kvantifikaci změn DNA u pacientů po chirurgickém výkonu v anestezii. Ve skupině pacientů, kteří podstoupili traumatologický operační výkon v CA (isofluran + oxid dusný) s nebo bez peroperační fluoroskopie jsme prokázali statisticky významné poškození DNA metodou comet assay. Ve skupině pacientů, kteří podstoupili ortopedický operační výkon významně kratšího trvání v SAB bylo poškození DNA po operaci minimální. Výsledky negativního působení anestetik na lidský genom zasluhují zavedení preventivních opatření a otevírají cestu k testování protektivních konceptů směřujících k minimalizaci poškození DNA v důsledku podání anestezie a operačního traumatu.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Předběžné výsledky byly prezentovány formou posteru na konferenci ČSARIM 2018 a formou přednášky na 14th International Medical Postgraduate Conference 2017 na Lékařské fakultě v Hradci Králové.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podíl autorů na vytvoření článku:
AD: napsal převážnou většinu rukopisu, byl zodpovědný za nábor pacientů a dodání vzorků.
KM: podílela se na analýzách.
ZV: podílela se na analýzách, napsala metodickou část analýzy rukopisu.
KM: byla zodpovědná za analýzy.
HR: podílel se na analýzách.
TA: podílela se na analýzách.
CV: podílel se na tvorbě rukopisu.
SR: vypracoval metodu analýzy.
ZZ: navrhl celý projekt, podílel se na jeho průběhu, podílel se na tvorbě rukopisu.
Institucionální podpora Fakultní nemocnice Hradec Králové: MH CZ – DRO (UHHK, 00179906), všechna práva vyhrazena.
Studie nebyla registrována.
Etická komise fakultní nemocnice Hradec Králové, jednací číslo 201511 S14P.
Do redakce došlo dne 8. 8. 2019.
Do tisku přijato dne 6. 11. 2019.
MUDr. David Astapenko, Ph.D.
Zdroje
1. Braz MG, Karahalil B. Genotoxicity of Anesthetics Evaluated In Vivo (Animals). Biomed Res Int. 2015;2015 : 1–8.
2. Kaymak C, Kadioglu E, Coskun E, et al. Determination of DNA damage after exposure to inhalation anesthetics in human peripheral lymphocytes and sperm cells in vitro by comet assay. Hum Exp Toxicol. 2012;31 : 1207–1213.
3. Braz MG, Braz LG, Barbosa BS, et al. DNA damage in patients who underwent minimally invasive surgery under inhalation or intravenous anesthesia. Mutat Res Toxicol Environ Mutagen. 2011;726::251–254.
4. Sardaş S, Karabiyik L, Aygün N, et al. DNA damage evaluated by the alkaline comet assay in lymphocytes of humans anaesthetized with isoflurane. Mutat Res. 1998;418 : 1–6.
5. Costa Paes ER da, Braz MG, Lima JT de, et al. DNA damage and antioxidant status in medical residents occupationally exposed to waste anesthetic gases. Acta Cir Bras. 2014;29 : 280–286.
6. Sardaş S, Cuhruk H, Karakaya AE, et al. Sister-chromatid exchanges in operating room personnel. Mutat Res. 1992;279 : 117–120.
7. Arora SS, Gooch JL, García PS. Postoperative cognitive dysfunction, Alzheimer’s disease, and anesthesia. Int J Neurosci. 2014;124 : 236–242.
8. Inan G, Özköse Satirlar Z. Alzheimer disease and anesthesia. Turkish J Med Sci. 2015;45 : 1026–1033.
9. Ni C, Li C, Dong Y, et al. Anesthetic Isoflurane Induces DNA Damage Through Oxidative Stress and p53 Pathway. Mol Neurobiol. 2017;54 : 3591–3605.
10. Neri M, Milazzo D, Ugolini D, et al. Worldwide interest in the comet assay: a bibliometric study. Mutagenesis. 2015;30 : 155–163.
11. Kuchařová M, Hronek M, Rybáková K, et al. Comet assay and its use for evaluating oxidative DNA damage in some pathological states. Physiol Res. 2019;68 : 1–15.
12. Tice R, Vasques M. Protocol for the application of the pH > 13 alkaline single cell gel (SCG) assay to the detection of DNA damamge in mammalian cells. 1999[Online] 1999.
13. Apostolou P, Toloudi M, Kourtidou E, et al. Use of the comet assay technique for quick and reliable prediction of in vitro response to chemotherapeutics in breast and colon cancer. J Biol Res. 2014;21 : 14.
14. Alapetite C, Thirion P, la Rochefordière A de, et al. Analysis by alkaline comet assay of cancer patients with severe reactions to radiotherapy: defective rejoining of radioinduced DNA strand breaks in lymphocytes of breast cancer patients. Int J Cancer. 1999;83 : 83–90.
15. Collins AR, Dobson VL, Dušinská M, et al. The comet assay: what can it really tell us? Mutat Res Mol Mech Mutagen. 1997;375 : 183–193.
16. Fikrová P, Štětina R, Hrnčiarik M, et al. DNA crosslinks, DNA damage and repair in peripheral blood lymphocytes of non-small cell lung cancer patients treated with platinum derivatives. Oncol Rep. 2014;31 : 391–396.
17. Fairbairn DW, Olive PL, O’Neill KL. The comet assay: a comprehensive review. Mutat Res. 1995;339 : 37–59.
18. Karabiyik L, Sardaş S, Polat U, et al. Comparison of genotoxicity of sevoflurane and isoflurane in human lymphocytes studied in vivo using the comet assay. Mutat Res. 2001;492 : 99–107.
19. Kadioglu E, Sardas S, Erturk S, et al. Determination of DNA damage by alkaline halo and comet assay in patients under sevoflurane anesthesia. Toxicol Ind Health. 2009;25 : 205–212.
20. Nogueira FR, Braz LG, Andrade LR de, et al. Evaluation of genotoxicity of general anesthesia maintained with desflurane in patients under minor surgery. Environ Mol Mutagen. 2016;57 : 312–316.
21. Edling C. Anesthetic gases as an occupational hazard--a review. Scand J Work Environ Health. 1980;6 : 85–93.
22. Needham MJ, Webb CE, Bryden DC. Postoperative cognitive dysfunction and dementia: what we need to know and do. Br J Anaesth. 2017;119(suppl_1):i115–i125.
23. Sardas S, Izdes S, Ozcagli E, et al. The role of antioxidant supplementation in occupational exposure to waste anaesthetic gases. Int Arch Occup Environ Health. 2006;80 : 154–159.
24. Lucio LMC, Braz MG, Nascimento Junior P do, et al. Riscos ocupacionais, danos no material genético e estresse oxidativo frente à exposição aos resíduos de gases anestésicos. Brazilian J Anesthesiol. 2018;68 : 33–41.
25. Wrońska-Nofer T, Nofer J-R, Jajte J, et al. Oxidative DNA damage and oxidative stress in subjects occupationally exposed to nitrous oxide (N2O). Mutat Res Mol Mech Mutagen. 2012;73 : 58–63.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Kam směřuje náš časopis?Článek Rok v přehledu
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2019 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Kam směřuje náš časopis?
- Rok v přehledu
- Anesteziologie a intenzivní péče v gynekologii a porodnictví
- Nejvýznamnější publikace v oblasti anesteziologie za rok 2019
- Neuroanestezie a neurointenzivní péče
- Důležité publikace v intenzivní medicíně v roce 2018/2019
- Infekční rizika pro anesteziology
- Etika a paliativní péče v intenzivní péči v roce 2019
- Perioperační neurokognitivní poruchy
- Roboticky asistovaná chirurgie v ČR – aktuální pohled
- Perioperační akutní selhávání funkcí ledvin (AKI)
- Rok 2019 v přehledu – urgentní medicína
- Centrální žilní přístupy – novinky 2020
- Poškození lymfocytární DNA během anestezie: pilotní studie srovnávající celkovou a subarachnoideální anestezii
- Akutní poranění laryngu po prodloužené umělé plicní ventilaci
- Doporučení pro intubaci při vědomí u dospělých pacientů
- Zemřela MUDr. Darina Nábělková (3. 2. 1923 – 10. 11. 2019)
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Anesteziologie a intenzivní péče v gynekologii a porodnictví
- Etika a paliativní péče v intenzivní péči v roce 2019
- Neuroanestezie a neurointenzivní péče
- Roboticky asistovaná chirurgie v ČR – aktuální pohled
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



