-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sekundární dyslipidemie
Secondary dyslipidemia
Secondary dyslipidemia (DLP) arises as a result of other diseases or various exogenous influences. However, genetic predisposition, as it is known in the case of primary DLP, plays an important role in the development secondary DLP, too. Typical examples are patients with hypothyroidism, when not all of these patients develop DLP. Another fact that supports genetic background is the individual sensitivity of lipid metabolism to exogenous influences and lifestyle. Secondary DLPs are most commonly observed in a variety of endocrinopathies (hypothyroidism, Cushing‘s syndrome), diabetes mellitus, chronic kidney disease, liver disease, autoimmune disease, alcohol abuse etc. Moreover, DLPs can be caused by drugs, e.g. diuretics, non-selective beta-blockers, immunosuppressants and others. Physiological secondary DLP can be observed during pregnancy. Secondary DLP exclusion is a logical first step of assessment of a patient with DLP. Treatment with lipid lowering drugs would not be indicated when causal therapy exists. The eventual initiation of hypolipidemic treatment is based the type of DLP and its inducing factors.
Key words:
alcohol, diabetes mellitus, drug dyslipidemia, endocrinopathy, chronic kidney disease, chronic liver disease, obesity, secondary dyslipidemia
Autoři: Martin Šatný; Michal Vrablík
Působiště autorů: III. interní klinika – klinika endokrinologie a metabolismu 1. LF a VFN v Praze
Vyšlo v časopise: AtheroRev 2017; 2(3): 162-168
Kategorie: Přehledové práce
Souhrn
Sekundární dyslipidemie (DLP), jak už z názvu vyplývá, vznikají jako následek jiného onemocnění či různých exogenních vlivů. Dnes již víme, že i genetická dispozice, stejně jako je tomu v případě DLP primárních, hraje důležitou roli při rozvoji DLP sekundárních. Typickým příkladem jsou pacienti s hypotyreózou: zdaleka ne všichni takto nemocní mají DLP. Dalším faktem podporujícím genetickou determinaci je evidentní individuální vnímavost metabolizmu lipidů k exogenním vlivům a životnímu stylu. Sekundární DLP jsou nejčastěji pozorovány při nejrůznějších endokrinopatiích (hypotyreóze, Cushingově syndromu), při diabetes mellitus, při onemocněních ledvin, jater, autoimunitních onemocněních, abúzu alkoholu a v řadě dalších případů. Výjimkou nejsou ani četné polékové DLP, např. po diureticích, neselektivních betablokátorech, imunosupresivech a dalších. „Fyziologicky“ je sekundární DLP pozorovatelná v těhotenství. Pokud vyšetřujeme pacienty s DLP, je vždy nasnadě, abychom v úvodu vyloučili možnou sekundární etiologii, jelikož následná léčby hypolipidemiky není indikována, pokud existuje léčba kauzální. Rozhodneme-li se pro farmakologickou léčba sekundární DLP, zohledňujeme její charakter a vyvolávající faktory.
Kľúčové slová/Klíčová slova:
alkohol, diabetes mellitus, endokrinopatie, chronické onemocnění jater, chronické onemocnění ledvin, obezita, polékové dyslipidemie, sekundární dyslipidemieÚvod
Sekundární dyslipidemie (DLP), jak už z názvu vyplývá, vznikají jako následek jiného onemocnění či různých exogenních vlivů prostředí. Dnes již víme, že i genetická dispozice, stejně jako je tomu v případě DLP primárních, hraje důležitou roli při DLP sekundárních. Typickým příkladem jsou pacienti s hypotyreózou: zdaleka ne všichni takto nemocní mají DLP. Dalším faktem podporujícím genetickou determinaci je evidentní individuální vnímavost metabolizmu lipidů k exogenním vlivům a životnímu stylu. Lze tedy konstatovat, že sekundární DLP vzniká spolupůsobením vlivů životního stylu, komorbidit a genetického pozadí jedince, výsledkem je pak individuální hladina krevních lipidů. Geny tedy určují schopnost organizmu udržet hladiny krevních lipidů a lipoproteinů v normálním rozmezí i při nepříznivých podmínkách vnějšího prostředí [1]. Díky rozdílné genetické výbavě jedinců často pozorujeme, že jedinci při stejné dietě a dalších režimových parametrech, tj. stejném životním stylu, mají rozdílné hladiny krevních lipidů a lipoproteinů.
Je důležité pomýšlet na fakt, že nově zjištěná DLP nás může upozornit na dosud nediagnostikované onemocnění, jak tomu bývá často například u onemocnění diabetes mellitus s doprovodnou DLP. V úvodu vyšetřovacího procesu všech pacientů s DLP by měla být v prvé řadě vyloučena možná sekundární etiologie.
Epidemiologie a rozdělení sekundárních dyslipidemií
Přesná epidemiologická data výskytu sekundárních DLP, jak u nás, tak celosvětově, jsou obtížně dohledatelná, avšak existuje celá řada prací, které demonstrují četnost výskytu tohoto typu DLP, byť ne v reprezentativních souborech pacientů.
Ve Spojených státech byla provedena studie s 824 novými nemocnými, kteří byli referováni ke konzultaci na kliniku k vyšetření DLP: 28 % z nich mělo právě DLP sekundární, ta byla z 10 % podmíněna abúzem alkoholu a v 8 % nekontrolovaným diabetes mellitus [2]. Ve studii s 268 pacienty s primární hypotyreózou byla přítomna DLP v 91,5 % souboru, u 56 % byla přítomna hypercholesterolemie, u 34 % hypercholesterolemie s hypertriglyceridemií a pouze u 1,5 % pacientů izolovaná hypertriglyceridemie. Pokud se autoři na problematiku podívali z druhé strany, došli k závěru, že hypotyreóza – jak manifestní, tak subklinická – je přítomna u pacientů s DLP s četností 2,8 %, resp. 4,4 % [3]. Nicméně jsou známy i práce, podle nichž byla incidence DLP u manifestní hypotyreózy 4 % a u subklinické až 20 %, a to hlavně u nemocných s celkovým cholesterolem > 8 mmol/l [4].
Dále existuje početná skupina pacientů s chronickým renálním či jaterním onemocněním, z nichž valná většina má nejrůznější typy DLP.
Neméně početnou skupinou jsou sekundární DLP navozené medikamenty – jedná se zejména o pacienty léčené diuretiky, neselektivními betablokátory, perorálními kontraceptivy, antipsychotiky či HIV-pozitivní pacienty na specifické léčbě.
V tab. 1 jsou pro přehlednost uvedeny možné příčiny sekundárních DLP.
Tab. 1. Příčiny sekundární DLP. 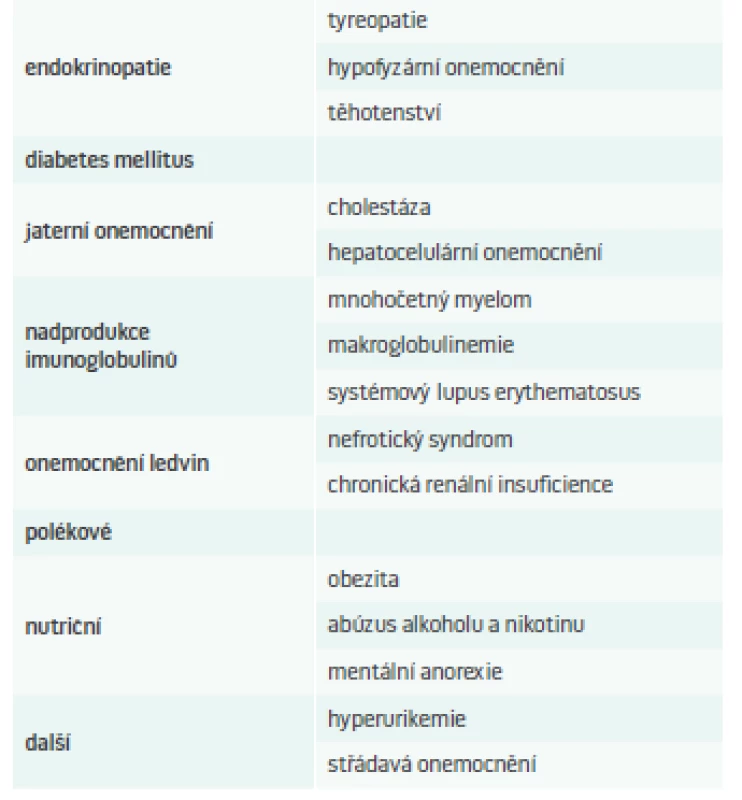
Upraveno podle [5,7] Dyslipidemie u tyreopatií
Jak hypotyreóza, tak i hypertyreóza je velmi častou příčinou sekundární DLP, proto je nutné na ně pomýšlet a vyšetřovat TSH v rámci vstupních vyšetření nových pacientů. Jak již bylo v úvodu řečeno, u pacientů s hypotyreózou se vyskytuje DLP ve valné většině případů, u nichž bývá typickým nálezem v jejich lipidogramu zvýšený celkový cholesterol, LDL-cholesterol, triglyceridy, IDL-cholesterol, apolipoprotein A1 a apolipoprotein B, dále pak vyšší hladina lipoproteinu (a) či nonHDL-cholesterolu [3]. V tab. 2 jsou uvedeny komplexní dopady sníženého působení tyroxinu na metabolizmus lipidů.
Tab. 2. Přehled mechanizmů ovlivňujících hladiny lipidů u hypotyreózy. 
Upraveno podle [3] Vztah mezi hypotyreózou a kardiovaskulárním onemocněním (KVO) je dobře znám a popsán v celé řadě publikací, etiologie KVO u těchto pacientů je jistě multifaktoriální – se spolupodílem diastolické dysfunkce, endoteliální dysfunkce a samozřejmě také abnormálního lipidogramu [3].
Pokud je diagnostikována DLP u hypotyreózy, je nutná kauzální léčba levotyroxinem. Vyšetření TSH je také důležité z důvodu vyloučení možné hypotyreózní myopatie, při které by v případě zahájení podávání hypolipidemik mohlo dojít k nevratnému poškození svalů [6].
U hypertyreózy jsou změny hladin krevních lipidů de facto opačné, jsou popisovány snížené hladiny celkového a LDL-cholesterolu či tendence k nárůstu koncentrace volných mastných kyselin v séru související s vystupňovanou lipolýzou [3].
Dyslipidemie u diabetes mellitus
Prevalence diabetu v naší populaci neustále narůstá. V současnosti se s touto diagnózou potýká bezmála desetina naší populace, přičemž je známo, že takřka u všech, zéjména u pacientů s diabetes mellitus (DM) 2. typu. lze očekávat změny hladin krevních lipidů [8]. DLP u diabetiků má jistě genetický základ a při jejich dekompenzaci může docházet k dramatické alteraci lipidogramu, kterou lze považovat za sekundární v návaznosti na kompenzaci DM. Častou laboratorní odchylkou je kolísající hladina triglyceridů, přičemž hladina celkového cholesterolu a LDL-cholesterolu se mění méně výrazně. U těchto nemocných je nutné opakovaně vyšetřovat lipidogram, jelikož v době nedostatečné kompenzace neodpovídá laboratorní nález situaci zlepšené kontroly základního onemocnění. Pro zhodnocení sekundárního podílu při DLP provázející diabetes je vhodné kompenzaci diabetu zlepšit a poté znovu zhodnotit lipoproteinový fenotyp. Často také vídáme primární DLP sdruženou s diabetem [9].
V tab. 3 je uvedeno několik dopadů působení inzulinu na lipidový metabolizmus.
Tab. 3. Výsledky působení inzulinu na lipidový metabolizmus. 
Upraveno podle [7] V patogenezi DLP jsou u různých typů diabetu významné rozdíly. Patogeneze DLP je u diabetiků 1. typu charakterizována závislostí kompenzace diabetu a krevních lipidů, při absolutním nedostatku inzulinu dochází k výraznému vzestupu triglyceridů v plazmě doprovázeném současně vystupňovanou lipolýzou v tukové tkání. Tím narůstá nabídka volných mastných kyselin játrům, která vede k eskalaci endogenní produkce triglyceridů a na triglyceridy bohatých částic (VLDL). Díky inhibici lipoproteinové lipázy je také snížena degradace na triglyceridy bohatých částic v plazmě. Platí pak přímá úměra: čím vyšší glykemie, tím vyšší triglyceridemie [7,9].
Hypertriglyceridemie může nabývat desítkových hodnot, zatímco hladina cholesterolu bývá sice také významně zvýšena, ale většinou se triglyceridemie pohybuje na hodnotách 2–3krát vyšších než cholesterolemie. Pokud je zahájena adekvátní léčba tohoto typu diabetu, dochází k úpravě hladin lipidogramu po několika dnech až týdnech.
U diabetiků 2. typu je patogeneze odlišná a závislost mezi kompenzací diabetu a DLP je méně těsná. Základním problémem je inzulinová rezistence s relativním nedostatkem inzulinu vedoucí k akcelerované lipolýze v adipocytech s následnou zvýšenou produkcí VLDL-částic v játrech. Dále klesá obdobně jako v předchozím případě aktivita lipoproteinové lipázy, která je zodpovědná za clearance triglyceridů z plazmy. Vystupňovanou aktivitou enzymu CETP (cholesterol ester tranfer protein) dochází ke kvalitativním změnám lipoproteinových částic: vznikají na cholesterol bohaté remnatní částice a malé denzní LDL-částice, které jsou velmi aterogenní. Tímto mechanizmem se také produkují na triglyceridy bohaté HDL-částice, jež jsou hydrolyzovány jaterní nebo lipoproteinovou lipázou, přičemž apolipoprotein A1 je poté degradován v ledvinách. Typickým nálezem je tedy tzv. aterogenní DLP s vyšší hladinou triglyceridů, nízkým HDL-cholesterolem a zvýšenou koncentrací malých denzních LDL-částic. Avšak i při dekompenzaci tohoto typu DM nacházíme podobně jako v předchozím případě významnou hypertriglyceridemii, eventuálně chylomikronemii.
Nicméně z hlediska kardiovaskulárního rizika je důležitý fakt, že se hyperglykemie podílí také na glykaci jak LDL-, tak i HDL-částic, čímž snižuje jejich afinitu k běžným receptorům, a naopak zvyšuje jejich vychytávání scavengerovými receptory makrofágů, což vede k akceleraci aterosklerotického procesu.
Dyslipidemie u diabetiků 2. typu je velmi komplexním problémem, který zásadně přispívá k vysokému kardiovaskulárnímu riziku, a není tedy divu, že 65 % pacientů s diabetem umírá na kardiovaskulární komplikace [7,10].
Základem léčby je opět dobrá kompenzace diabetu, která však ve většině případů nejspíše nepovede k dobré kompenzaci DLP a navíc nefarmakologická opatření nikdy nestačí ke snížení kardiovaskulárního rizika. Proto bude prakticky u všech diabetiků 2. typu nutná hypolipidemická farmakoterapie.
Dyslipidemie u viscerální obezity
Odchylky metabolizmu lipidů jsou u obézních pacientů velmi časté, udává se, že až 60–70 % z nich má DLP. Sekundární DLP je u obézních charakterizována zvýšenou hladinou triglyceridů, VLDL-částic, apolipoproteinu B, nonHDL-cholesterolu či sníženou hladinou HDL-cholesterolu. Naopak LDL-cholesterol může často být v normě, ale roste počet malých denzních LDL-částic, které se pak podílejí na akceleraci aterosklerózy. Patogeneze DLP u obezity je velmi komplexní, v popředí stojí opět výše popsaný mechanizmus inzulinové rezistence a produkce cytokinů v tukové tkáni. Vzhledem k nedostatečnému působení inzulinu dochází k nadprodukci VLDL-částic, respektive triglyceridů a volných mastných kyselin, které jsou potřebné pro jejich syntézu. Dalším mechanizmem podílejícím se na elevaci výše zmíněných laboratorních parametrů je nárůst apolipoproteinu CIII – inhibitoru lipoproteinové lipázy, která je zodpovědná za clearance právě částic bohatých na triglyceridy. Produkce malých denzních LDL-částic a na triglyceridy bohatých HDL-částic byla popsána v části o diabetu [11].
Obezita je prozánětlivým stavem, který je provázen produkcí četných cytokinů makrofágy či adipocyty tukové tkáně. Jedná se například o tumor necrosis factor α (TNFα), interleukin 1 (IL1), adiponektin či leptin. Prozánětlivé cytokiny – TNFα, respektive IL1 – stimulují lipolýzu v adipocytech, de novo syntézu volných mastných kyselin v játrech, dále snižují expresi lipoproteinové lipázy a naopak zvyšují expresi jejího inhibitoru – angiopoetin like proteinu 4 (ANGPTL4). To ve svém důsledku vyúsťuje ve snížení clearance na triglyceridy bohatých částic, ve zvýšení hladin triglyceridů se všemi výše popsanými důsledky. U obézních pozorujeme v séru vyšší hladiny leptinu, který stimuluje lipolýzu v adipocytech, a naopak snížené hladiny adiponektinu odpovědné za sníženou aktivitu lipoproteinové lipázy [11].
Vzhledem k velmi časté koincidenci obezity s metabolickým syndromem je nutná komplexní intervence těchto nemocných, která zahrnuje nejen režimová opatření, ale i medikamentózní, eventuálně bariatrické intervence.
Dyslipidemie při pravidelné konzumaci alkoholu
Téma alkoholu a kardiovaskulárního rizika diskutujeme velmi dlouho na odborných i laických fórech. Podle posledních poznatků a v souladu s posledními doporučeními managementu DLP se trvalá abstinence jeví jako nejvýhodnější i z hlediska kardiovaskulárního rizika [12].
Nicméně zpátky do reality: procento pravidelných konzumentů alkoholu je vysoké, a proto není divu, že právě alkoholem indukovaná DLP je jednou z těch nejčastějších. Alkohol se na vzniku sekundární DLP podílí několika mechanizmy (tab. 4).
Tab. 4. Mechanizmus podílu alkoholu na vzniku DLP. 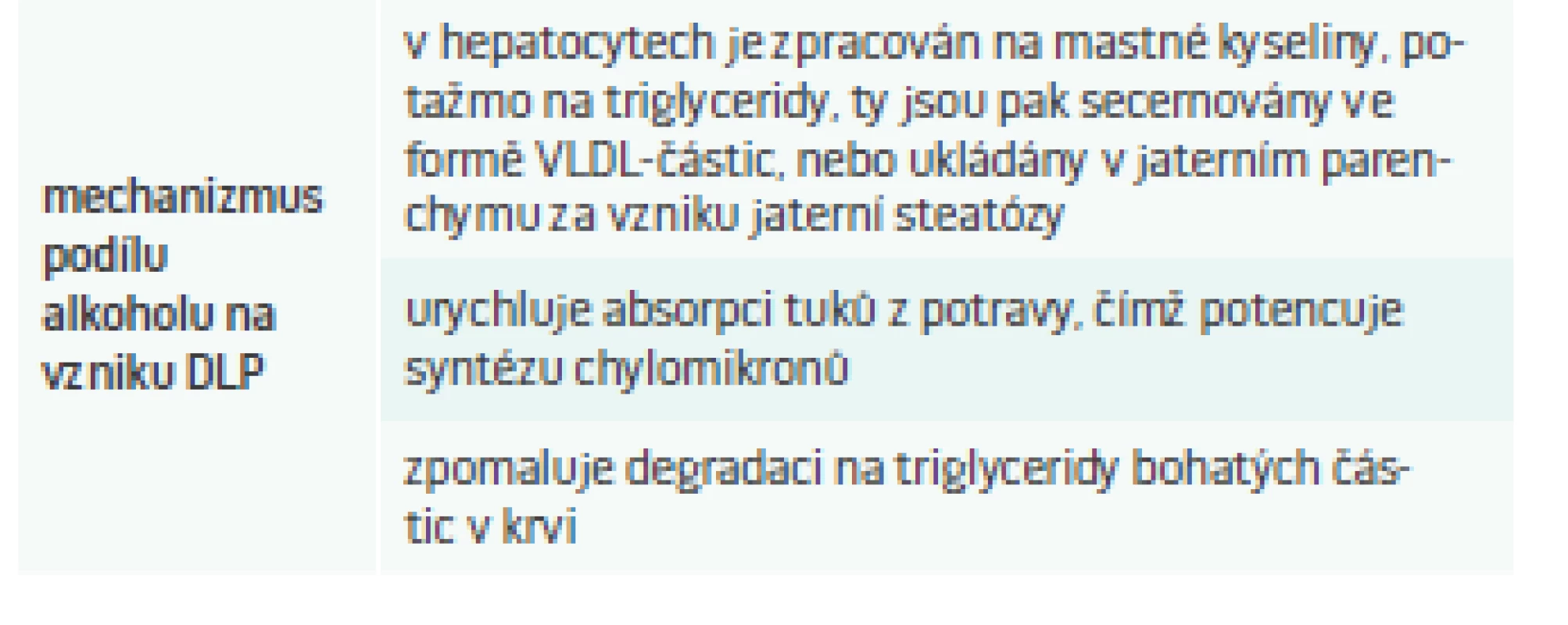
Upraveno podle [9] Laboratorním nálezem je pak vyšší hladina triglyceridů a později také cholesterolu v plazmě [13]. Tíže těchto změn závisí na vnímavosti jedince k alkoholu, ale hlavně na délce trvání abúzu a na dávce požitého alkoholu. Existují velké interindividuální rozdíly, může se jednat o mírnou hypertriglyceridemii, běžnou smíšenou DLP nebo až extrémní hodnoty triglyceridů > 100 mmol/l či cholesterolu > 30 mmol/l [9].
Nutná je vždy trvalá abstinence alkoholu, při níž lze očekávat výrazné snížení zejména triglyceridů a s odstupem času také cholesterolu.
Důležitým faktem je, že pacienti s hodnotami triglyceridů > 10 mmol/l jsou ohroženi vznikem iritace pankreatu či akutní pankreatitidy.
Konzumace alkoholu vede často k odkrytí dosud latentní primární DLP.
Dyslipidemie u kuřáků
Máme k dispozici celou řadu prací zabývajících se vlivem kouření na hladiny krevních lipidů. U kuřáků je v literatuře popisována nižší hladina HDL-cholesterolu, vyšší celkový i LDL-cholesterol, vyšší hladina triglyceridů či lipoproteinu (a) [14,15]. DLP nacházíme zejména u těch, kteří kouří více než 20 cigaret denně po dobu alespoň 5 let. Mechanizmus, jakým působí kouření na hladiny krevních lipidů, není dosud zcela pochopen, nicméně se předpokládá, že nikotin obsažený v cigaretách stimuluje sekreci katecholaminů, kortizolu či růstového hormonu, což má za následek zvýšenou koncentraci volných mastných kyselin, jakožto substrátu pro syntézu triglyceridů a na ně bohatých VLDL-částic. Nutno podotknout, že kuřáci ve srovnání s nekuřáky mají dle řady studií daleko horší stravovací návyky, respektive obecně horší životní styl [14].
Vzhledem k faktu, že je status kuřáctví samostatným rizikovým faktorem kardiovaskulárního onemocnění, musíme se vždy snažit naše pacienty motivovat k zanechání kouření. Je známo, že po 10–15 letech po zanechání kouření se kuřák dostává svým kardiovaskulárním rizikem na úroveň člověka, který nikdy nekouřil [12].
Dyslipidemie u pacientů s onemocněním ledvin
U pacientů s nefrotickým syndromem je DLP, a to zejména smíšená, velmi častým nálezem, přičemž se uvádí, že až 80 % z těchto pacientů má LDL-cholesterol > 3,4 mmol/l [16]. Tito nemocní mají zvýšenou plazmatickou koncentraci celkového cholesterolu, LDL-cholesterolu, triglyceridů, lipoproteinu (a), apolipoproteinu B, apolipoproteinu CII, apolipoproteinu E, zatímco hladiny HDL-cholesterolu či apolipoproteinu A jsou vesměs v mezích normy [17]. Patogenetickým vysvětlením DLP u nefrotického syndromu je pokles onkotického tlaku, který vede ke stimulaci transkripce genu pro apolipoprotein B100. Avšak přesný mechanizmus tohoto děje dosud není znám [18,19]. Tímto způsobem dochází k hypercholesterolemii, která je dále umocněna poklesem katabolizmu LDL-cholesterolu. Na myším modelu byl také popsán snížený počet LDL-receptorů při nefrotickém syndromu [17]. Další pozorovanou odchylkou je hypertriglyceridemie, ale mechanizmus jejího vzniku opět není plně objasněn, nicméně se předpokládá, že hlavní roli v něm hraje dosud neznámá látka, která se ve zvýšené míře ztrácí močí [20]. Jistý spolupodíl na vzniku hypertriglyceridemie je také připisován výše zmíněnému angiopoetin like proteinu 4, který se u pacientů s nefrotickým syndromem produkuje ve zvýšené míře [21]. Předpokládá se, že se tak děje v důsledku změny podílu volných mastných kyselin a albuminu.
Další velkou skupinu tvoří pacienti s chronickým renálním onemocněním (CKD – chronic kidney disease), u nichž podobně, jako je tomu u pacientů s nefrotickým syndromem, pozorujeme nejčastěji DLP smíšenou, s nižším HDL-cholesterolem a vyšší hladinou lipoproteinu (a), malých dezních LDL-částic, apolipoproteinu B či VLDL-částic. V tab. 5 jsou pro přehlednost uvedeny mechanizmy vzniku DLP u pacientů s CKD.
Tab. 5. Mechanizmy vzniku DLP u CHRI. 
Upraveno podle [22] Netřeba zdůrazňovat, že pacienti s renálním onemocněním spadají do kategorie vysokého či velmi vysokého kardiovaskulárního rizika, proto je nutné jejich DLP léčit razantně. Nutností je ale redukce dávek vybraných hypolipidemik vzhledem k aktuálním renálním parametrům (např. fibráty, rosuvastatin).
Dyslipidemie u onemocnění jater a žlučových cest
Poškození jaterního parenchymu nemusí být provázeno změnou lipidového spektra, často lze ale vysledovat vzestup hladiny triglyceridů v plazmě. Dochází k tomu z důvodu patologické produkce VLDL-, LDL - i HDL-částic za současného snížení aktivity LCAT a jaterní lipázy [23]. U jaterní cirhózy naopak pozorujeme pokles hladiny krevních lipidů. V klinické praxi se často setkáváme s koincidencí steatózy a DLP, etiologickým agens je v řadě případů konzumace alkoholu, která sama o sobě vede k sekundární DLP. V úvodu vyšetření nového pacienta bychom se proto měli snažit vyloučit možnou alkoholovou etiologii. Pokud je tato vyloučena, je třeba u nealkoholových jaterních lézí postupovat obezřetně, přičemž léčbu zahajujeme po rizika vypočteného dle tabulek SCORE. Nezbytná je pravidelná kontrola jaterních enzymů v závislosti na druhu a dávce hypolipidemik [9].
U pacientů s chronickou cholestázou nacházíme vyšší hladiny jak celkového, tak i LDL-cholesterolu. Reálně se však jedná o chybně stanovený patologický lipoprotein X (partikuli bohatou na albumin, neesterifikovaný cholesterol, fosfolipidy), který vzniká refluxem žluči do krve. Výhodné je proto stanovení apolipoproteinu B, který nám dává lepší představu o aterogenním potenciálu plazmy. Vypozorován byl také relativní nadbytek fosfolipidů vedoucí k uvolnění cholesterolu z membrán buněk. U části nemocných bývá přítomna elevace triglyceridů, přičemž patogeneze není zcela jasná, ale předpokládá se interakce lipoproteinu X s remnantními částicemi [23]. Léčba DLP u těchto pacientů bývá obtížná a velmi limitovaná základním onemocněním. U některých pacientů lze s výhodou využít sekvestranty žlučových kyselin, ty však většinou nebývají v redukci hladin krevních lipidů dostatečně účinné [9].
Polékové dyslipidemie
V každodenní praxi se setkáváme s celou řadou léků, které se větší či menší měrou podílejí na změně hladin krevních lipidů. Není však zcela jasné, do jaké míry se tato změna promítá do celkového kardiovaskulárního rizika.
V tab. 6 je uveden seznam nejznámnějších léků ovlivňujících lipidový metabolizmus.
Tab. 6. Seznam neznámějších léků ovlivňujících lipidový metabolizmus. 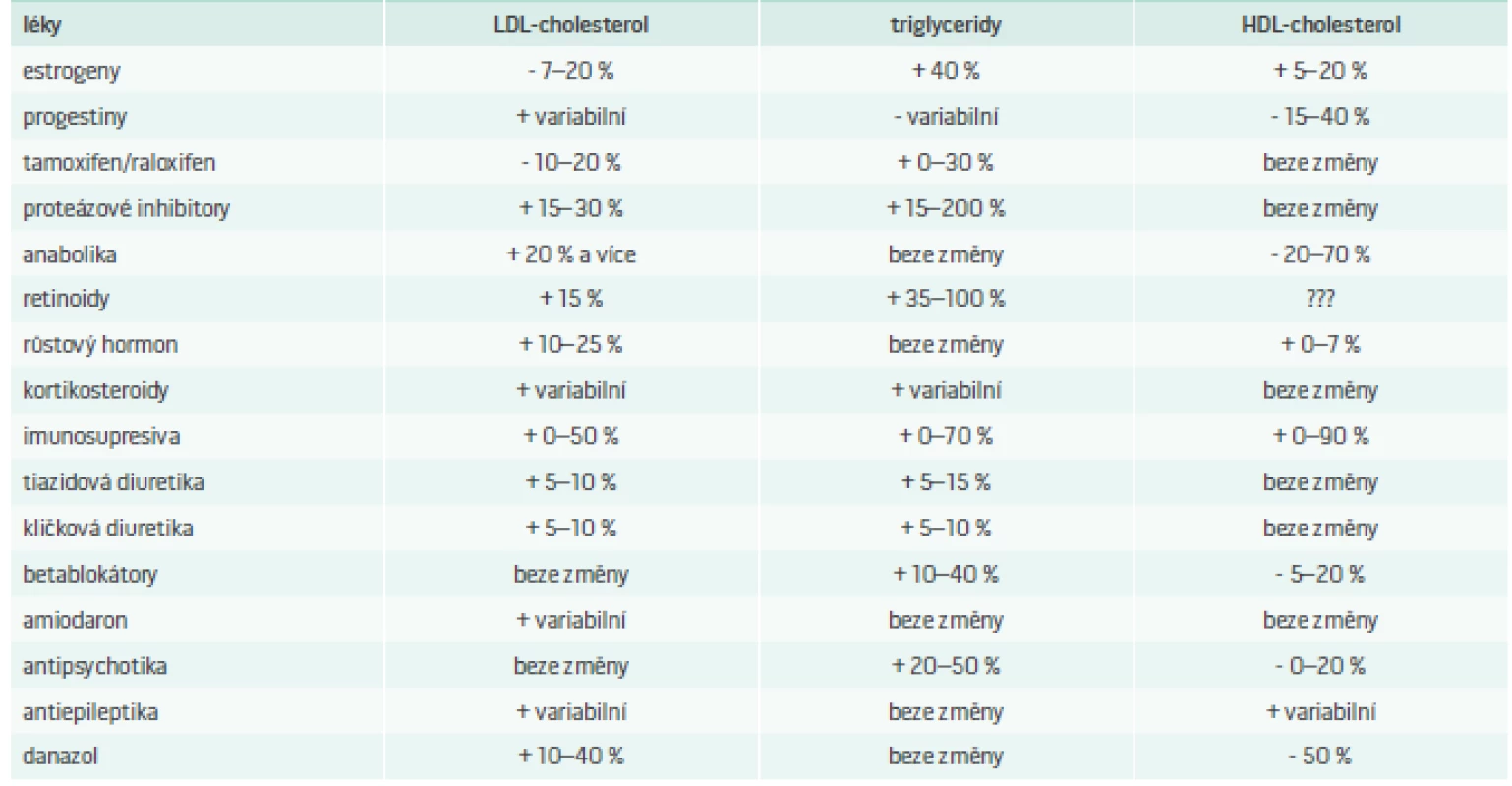
+ nárůst - pokles Upraveno podle [25] Problematika DLP navozených podávanou medikací je velmi obsáhlá a přesahuje rámec toho sdělení, nicméně je třeba brát v potaz fakt, že i běžně užívané „kardiologické“, „psychiatrické“ či „endokrinologické“ léky mohou vyvolat výše popsané změny lipidogramu. Další informace k léky indukovaným DLP jsou k dohledání v citované literatuře.
Dyslipidemie v těhotenství
V období těhotenství hovoříme o „fyziologické“ sekundární DLP, která je zapříčiněna zejména vysokou hladinou estrogenů vedoucí k elevaci jak triglyceridů, tak cholesterolu. Po porodu se hladiny krevních lipidů vracejí k normálním hodnotám. Tato DLP nijak neovlivňuje zdravotní stav těhotné, proto vyšetřovat lipidogram během těhotenství nedoporučujeme [9].
Vzácnější sekundární dyslipidemie
Mimo výše zmíněných existuje ještě řada dalších DLP, které se však vyskytují spíše vzácně, a proto zde budou jen v krátkosti vyjmenovány. Jedná se o DLP u pacientů s Cushingovým syndromem, nadprodukcí katecholaminů či hypofyzární patologií, dále pak o pacienty s poruchou příjmu potravy, jako je například mentální anorexie či vzácněji bulimie. Doprovodnou smíšenou DLP někdy nacházíme u pacientů s mnohočetným myelomem či střádavým onemocněním typu glykogenóz.
Pár slov závěrem
Při vyšetřování pacienta s DLP bychom v prvé řadě měli vyloučit možnou sekundární příčinu vedoucí k alteraci jeho lipidového profilu. Základem je proto důkladná anamnéza, klinické vyšetření a samozřejmě laboratorní vyšetření. To by mělo zahrnovat vyšetření krevního obrazu, glykemii, HbA1C, TSH, ureu, kreatinin, moč chemicky, AST, ALT, GMT, ALP, eventuálně karbohydrát-deficientní transferin k posouzení eventuálního abúzu alkoholu. Krev by měla být odebírána nalačno, v době bez zjevného infekčního onemocnění, případně při dobře kompenzovaném diabetu. Pokud zjistíme příčinnou souvislost mezi DLP a vyvolávajícím faktorem, je na místě léčba kauzální. Není-li taková léčba možná (jako např. u pacientů s chronickým renálním onemocněním, po transplantacích) a pacient je ve vysokém riziku vzniku fatální kardiovaskulární příhody dle tabulek SCORE nebo v důsledku přítomnosti komorbidit zvyšujících jeho riziko, je indikována léčba hypolipidemiky. Volba a dávka vhodného léku pak závisí na typu DLP, komorbiditách a aktuálním zdravotním stavu pacienta.
Doručené do redakcie/Doručeno do redakce/Received: 10. 9. 2017
Prijaté po recenzii/Přijato po recenzi/Accepted: 2. 10. 2017
MUDr. Martin Šatný
martin.satny@vfn.cz
www.vfn.cz
Zdroje
1. Soška V. Familiární hypercholesterolemie: Dovedeme ji správně diagnostikovat? Vnitř Lék 2000; 46(1): 19–23.
2. Vodnala D, Rubenfire M, Brook RD. Secondary causes of dyslipidemia. Am J Cardiol 2012; 110(6): 823–825. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2012.04.062>.
3. Ross DS. Lipid abnormalities in thyroid diseases. Cooper DS, Mulder JE (eds). UpToDate 2013. Dostupné z WWW: <https://www.uptodate.com/contents/lipid-abnormalities-in-thyroid-disease?source=search_result&search=lipid+abnormalities+in+thyroid+disease&selectedTitle=1~150>.
4. Duntas LH. Thyroid disease and lipids. Thyroid 2002; 12(4): 287–293.
5. Iyengar SS, Puri R, Narasingan SN. Lipid Association of India Expert Consensus Statement on Management of Dyslipidemia in Indians 2016: Part 1 – Executive summary. J Clin Prev Cardiol 2016; 5(2): 51–61. Dostupné DOI: <http://dx.doi.org/10.4103/2250–3528.186492>.
6. Jiskra J. Změny svalové tkáně u hypothyreózy. Vnitř Lék 2001; 47(9): 609–612.
7. Vrablík M, Češka R. Sekundární dyslipoproteinémie. Interní medicína pro praxi 2003; 5(6): 285–390. Dostupné z WWW: <https://www.internimedicina.cz/pdfs/int/2003/06/04.pdf>.
8. Zdravotnická ročenka České republiky 2015. Ústav zdravotnických informací a statistiky České republiky: Praha 2016. ISSN 1210–9991.
9. Soška V. Sekundární dyslipidemie a jejich léčba. Vnitř Lék 2007; 53(4): 396–400.
10. Chehade JM. Gladysz M, Mooradian AD. Dyslipidemia in Type 2 Diabetes: Prevalence, Pathophysiology, and Management. Drugs 2013; 73(4): 327–339. Dostupné z DOI: <http://dx.doi.org/10.1007/s40265–013–0023–5>.
11. Feingold KR, Grunfeld C. Obesity and Dyslipidemia. [Updated 2015 Jun 12]. In: De Groot LJ, Chrousos G, Dungan K et al (eds). Endotext [Internet]. MDText.com, Inc: South Dartmouth (MA) 2000. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK305895/.
12. Catapano AL, Graham I, De Backer G et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J 2016; 37(39), 2999–3058. Dostupné z DOI:
13. Hannuksela ML, Liisanantt MK, Savolainen MJ. Effect of alcohol on lipids and lipoproteins in relation to atherosclerosis. Crit Rev Clin Lab Sci 2002; 39(3): 225–283.
14. Haj Mouhamed D, Ezzarhar A, Neffati F et al. Association between cigarette smoking and dyslipidemia. Immuno-analyse et biologie spécialisée 2013; 28(4): 195–200. Dostupné z WWW: <http://linkinghub.elsevier.com/retrieve/pii/S0923253213000306>.
15. 15. Rosenson RS. Secondary causes of dyslipidemia. Wolters Kluwer N.V. UpToDate. Dostupné z WWW: <https://www.uptodate.com/contents/secondary-causes-of-dyslipidemia?>.
16. Weiner DE, Sarnak MJ. Managing dyslipidemia in chronic kidney disease. J Gen Intern Med 2004; 19(10):1045.
17. Radhakrishnan J (2015). Lipid abnormalities in nephrotic syndrome. In Glassock JG, Rovin BBH, Lam AQ (eds). UpToDate. Dostupné z WWW: <http://www.uptodate.com/contents/lipid-abnormalities-in-nephrotic-syndrome?source=search_result&search=lipid+abnormalities+in+nephrotic+syndrome&selectedTitle=1~150>.
18. Kronenberg F, Lingenhel A, Lhotta Ket al. Lipoprotein(a) - and low-density lipoprotein-derived cholesterol in nephrotic syndrome: Impact on lipid-lowering therapy? Kidney Int 2004; 66(1): 348–354.
19. Yamauchi A, Fukuhara Y, Yamamoto S et al. Oncotic pressure regulates gene transcriptions of albumin and apolipoprotein B in cultured rat hepatoma cells. Am J Physiol 1992; 263(2 Pt 1): C397-C404.
20. Joles JA, Bijleveld C, van Tol A et al. Plasma triglyceride levels are higher in nephrotic than in analbuminemic rats despite a similar increase in hepatic secretion. Kidney Int 1995; 47(2): 566–572.
21. Clement LC, Macé C, Avila-Casado C et al. Circulating angiopoietin-like 4 links proteinuria with hypertriglyceridemia in nephrotic syndrome. Kidney Int 1993; 44(3): 638.
22. Mikolasevic I, Žutelija M, Mavrinac V et al. Dyslipidemia in patients with chronic kidney disease: etiology and management. Int J Nephrol Renovasc Dis [online]. 2017; 10 : 35–45. Dostupné z DOI: <http://dx.doi.org/10.2147/IJNRD.S101808>.
23. Studeník P. Poruchy metabolismu lipidů u jaterních onemocnění. Vnitr Lek 2000; 46(9): 547–548.
24. Nemes K, Åberg F, Gylling H et al. Cholesterol metabolism in cholestatic liver disease and liver transplantation: From molecular mechanisms to clinical implications. World JHepatol [online] 2016; 8(22), 924–932. Dostupné z DOI: <http://dx.doi.org/10.4254/wjh.v8.i22.924>.
25. Herink M, Ito MK. Medication Induced Changes in Lipid and Lipoproteins. [Updated 2015 Jul 27]. In: De Groot LJ, Chrousos G, Dungan K et al (eds). Endotext [Internet]. MDText.com, Inc: South Dartmouth (MA) 2000. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK326739/>.
Štítky
Angiológia Diabetológia Interné lekárstvo Kardiológia Praktické lekárstvo pre dospelých
Článok vyšiel v časopiseAthero Review
Najčítanejšie tento týždeň
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Editorial
- Editorial
- Sekundární dyslipidemie
- Intenzívna liečba dyslipoproteinémií v regionálnej kardiologickej ambulancii
- Úloha funkčních potravin a potravinových doplňků v léčbě hypercholesterolemie
- Čo vieme a čo reálne môžeme spraviť pre rodinu s familiárnou hypercholesterolémiou: kazuistika
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
-
Kardiovaskulární onemocnění a nasycené tuky ve stravě
Polemický pohled na nová doporučení AHA.
Komentář ke článku N. Teicholzové a E. Thorna (Medscape, červenec 2017) - Polemika s doporučením American Heart Association o vlivu tuků na kardiovaskulární onemocnění
-
ESC Congress 2017
26. – 30. august 2017, Barcelona, Španielsko - Anotace zajímavých článků ze zahraniční literatury
- Athero Review
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Sekundární dyslipidemie
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
- Intenzívna liečba dyslipoproteinémií v regionálnej kardiologickej ambulancii
- Čo vieme a čo reálne môžeme spraviť pre rodinu s familiárnou hypercholesterolémiou: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



