-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diabetes mellitus a rezistencia na liečbu antagonistami ADP-receptorov: význam, možnosti detekcie a terapeutického ovplyvnenia
Diabetes mellitus and resistance to therapy with ADP-receptor antagonists: Importance, possibilities of detection and therapeutic influence
Diabetes mellitus is connected with clopidogrel resistance, an independent risk factor of future ischemic events in patients undergoing percutaneous coronary interventions, including stent thrombosis. On-treatment platelet reactivity assessment should be considered especially in clopidogrel-treated DM patients. Platelet function testing might be performed either with nonspecific methods, such as light transmission aggregometry as a golden standard, or with a specific method – VASP (vasodilator stimulated phosphoprotein) phosphorylation assessment. New ADP-receptor blockers – prasugrel and ticagrelor – seem to be more effective for overcoming clopidogrel resistance in diabetic patients. These agents both show rapid and consistent platelet inhibition. Tailored clopidogrel therapy may be considered in selected cases; however, this strategy has lower evidence from clinical trials. The therapeutic goal is to achieve sufficient inhibition of ADP-signaling pathway, which will reduce the risk of future serious ischemic events.
Key words:
ADP-receptor blockers, aggregometry, clopidogrel, clopidogrel resistance, diabetes mellitus, phosphorylation VASP, prasugrel, ticagrelorReceived:
30. 12. 2017Accepted:
29. 1. 2018
Autoři: Matej Samoš; Tomáš Bolek; František Kovář; Peter Galajda; Marián Mokáň
Působiště autorů: I. interná klinika, Jesseniova LF UK a UNM, Martin
Vyšlo v časopise: AtheroRev 2018; 3(1): 34-39
Kategorie: Přehledové práce
Souhrn
Diabetes mellitus (DM) je spojený s rezistenciou na liečbu klopidogrelom, ktorá je nezávislým rizikovým faktorom ischemických nežiaducich príhod u pacientov podstupujúcich perkutánne koronárne intervencie, vrátane trombózy stentu. Vyšetrenie reaktivity trombocytov na liečbe antagonistom ADP-receptorov je vhodné predovšetkým u pacientov s DM liečených klopidogrelom. Toto vyšetrenie je dnes možné pomocou nešpecifických metód, z nich zlatý štandard predstavuje optická agregometria, ako aj pomocou špecifickej metódy – meraním fosforylácie VASP (vasodilator stimulated phosphoprotein). Na prekonanie uvedenej rezistencie sa v súčasnosti zdá byť výhodnejšie použitie nových antagonistov ADP-receptorov, ako je prasugrel a tikagrelor, ktoré u diabetikov dosahujú rýchlu a konzistentnú inhibíciu funkcie trombocytov. V individualizovaných prípadoch je možné zvážiť aj stratégiu modifikovaného dávkovania liečby klopidogrelom, účinnosť tejto stratégie je však slabšie podporená dôkazmi z klinických štúdií. Cieľom liečby je dosiahnutie dostatočnej inhibície ADP-signálnej dráhy, čím sa signifikantne zníži riziko vzniku závažných ischemických príhod.
Kľúčové slová/Klíčová slova:
agregometria, antagonisti ADP-receptorov, diabetes mellitus, fosforylácia VASP, klopidogrel, prasugrel, rezistencia na liečbu klopidogrelom, tikagrelorÚvod
Trombóza stentu je závažnou a potencionálne fatálnou komplikáciou perkutánnej koronárnej intervencie (PCI). Duálna antiagregačná liečba (DAL) pozostávajúca z kyseliny acetylsalicylovej a antagonistu ADP-receptorov signifikantne znižuje riziko vzniku trombózy stentu. Tienopyridín klopidogrel je stále najčastejšie používaným antagonistom ADP-receptorov (ADP – adenozin difosfát) u pacientov podstupujúcich elektívne PCI a je stále indikovaný aj u časti pacientov podstupujúcich PCI pre akútne koronárne syndrómy (AKS). Fenomén tzv. vysokej reaktivity trombocytov na liečbe antagonistom ADP-receptorov alebo rezistencie na liečbu antagonistom ADP-receptorov je asociovaný práve s rizikom vzniku trombózy stentu napriek duálnej antiagregačnej liečbe [1].
Diabetes mellitus (DM) 2. typu je silný, nezávislý rizikový faktor koronárnej choroby srdca, vrátane jej akútnych foriem. Niekoľko publikovaných prác poukázalo na poruchu terapeutickej odpovede na klopidogrel, ktorá je priamo asociovaná s DM 2. typu [1–3]. Uvedená skutočnosť môže vysvetľovať vyššie riziko trombózy stentu práve u pacientov s DM 2. typu. Práca poskytuje prehľad súčasných poznatkov o poruche odpovede na liečbu antagonistom ADP-receptorov u pacientov s DM, o význame tejto poruchy v klinickej praxi, možnostiach jej detekcie a terapeutického ovplyvnenia.
Diabetes mellitus 2. typu – ochorenie asociované s rezistenciou na liečbu klopidogrelom
Počet prác ukazujúcich na poruchu antiagregačnej odpovede po podaní klopidogrelu, ktorá je špecificky spojená s inzulínovou rezistenciou a DM, rastie. Tieto správy sú založené tak na ex vivo meraniach reaktivity trombocytov pri liečbe klopidogrelom, ako aj na subanalýzach klinických štúdií s klopidogrelom u zaradených jedincov s DM, ktoré poukázali na zhoršený klinický priebeh a zvýšený výskyt trombózy stentu v tejto skupine pacientov. Angiolillo et al [3, 4] skúmali funkciu trombocytov u pacientov s DM a bez DM liečených klopidogrelom po podaní nasýcovacej dávky a pri užívaní chronickej liečby. Po podaní nasýcovacej dávky bola zistená signifikantne vyššia agregabilita trombocytov po stimulácií ADP v skupine pacientov s DM. Pri rozdelení pacientov na non–respondérov, slabých respondérov a dobrých respondérov bol zistený signifikantne vyšší počet non–respondérov v skupine pacientov s DM. Vyšetrenie vzorky pri užívaní chronickej liečby prinieslo podobné výsledky a pacienti s DM mali v porovnaní s pacientmi bez DM pri liečbe klopidogrelom signifikantne vyššiu agregabilitu trombocytov (p < 0,05), aktiváciu GP IIb/IIIa receptora (p < 0,05) a expresiu P–selektínu (p < 0,01). Vysoká reaktivita trombocytov napriek antiagregačnej liečbe bola pritom identifikovaná ako nezávislý prediktor vzniku kardiovaskulárnych príhod. Reaktivita trombocytov pri liečbe klopidogrelom > 50 % bola asociovaná s vyšším rizikom vzniku ischemických príhod po PCI.
Erlinge et al [2] skúmali prevalenciu a mechanizmus nedostatočnej odpovede na klopidogrel u pacientov s DM a nediabetických pacientov. Táto dvojito zaslepená štúdia randomizovala 110 pacientov liečených kyselinou acetylsalicylovou k liečbe klopidogrelom (nasýcovacia dávka 600 mg a následná udržiavacia dávka 75 mg denne) alebo prasugrelom (60 mg nasýcovacia dávka a následná denná udržiavacia dávka 10 mg) v trvaní 28 dní. Výsledky štúdie ukázali signifikantne vyšší výskyt nedostatočnej antiagregačnej odpovede v skupine pacientov liečených klopidogrelom v porovnaní s prasugrelom. Pacienti s DM boli častejšie zastúpení v skupine s nedostatočnou odpoveďou trombocytov, pričom nedostatočná odpoveď pacientov s DM bola viazaná na podanie klopidogrelu. Pri porovnaní s nediabetickými pacientmi mali pacienti s DM signifikantne nižšie koncentrácie aktívneho metabolitu klopidogrelu meraného 2 hodiny po podaní nasýcovacej dávky (p < 0,01) a 29. deň užívania udržiavacej dávky (p < 0,01). Je zaujímavé, že v tejto štúdii trombocyty pacientov s DM a nedostatočnou antiagregačnou odpoveďou po podaní klopidogrelu reagovali dobre na ex vivo podanie aktívneho metabolitu klopidogrelu, čo naznačuje nízky podiel rezistencie na úrovni samotného P2Y12 ADP-receptora trombocytov u pacientov s DM a podporuje potenciálnu interakciu DM s farmakokinetickými procesmi metabolizmu klopidogrelu.
Pacienti s DM zaradení do doteraz publikovaných štúdií s klopidogrelom mali zvýšené riziko vzniku nežiaducich kardiovaskulárnych príhod v porovnaní s pacientmi bez DM. Subanalýzy efektivity klopidogrelu v populácii pacientov s DM konzistentne poukázali na relatívne nižší klinický efekt tejto liečby v porovnaní s pacientmi bez DM, čo nepriamo podporuje popisovanú nekompletnú odpoveď pacientov s DM na liečbu klopidogrelom. V štúdii CURE u pacientov s AKS, ktorá zahŕňala 2840 pacientov s DM [5], bola pozorovaná nižšia efektivita pridania klopidogrelu ku kyseline acetylsalicylovej v skupine pacientov s DM. Podobne tak v štúdii CREDO [6], ktorá randomizovala viac ako 2 000 pacientov s koronárnou chorobou srdca podstupujúcich elektívnu PCI, bolo v skupine pacientov s DM liečených klopidogrelom pozorované nižšie zníženie relatívneho rizika nežiadúcich príhod v porovnaní so znížením pozorovaným v celom súbore (11,2 % vs 26,9 %).
Opakovane bolo popísané aj zvýšené riziko vzniku trombózy stentu u pacientov s DM liečených klopidogrelom, pričom dnes vieme, že práve pacienti s DM predstavujú vysoko rizikovú skupinu pre vznik trombózy stentu pri liečbe klopidogrelom [1]. Iakovou et al [7] analýzou dát z prospektívnej observačnej štúdie poukázali na skutočnosť, že DM je nezávislým prediktorom trombózy stentu (p < 0,05) napriek duálnej antiagregačnej liečbe u pacientov po úspešnej implantácií liekových stentov.
Možnosti detekcie rezistencie na liečbu antagonistom ADP-receptorov u pacientov s diabetes mellitus
Optická agregometria
Optická agregometria (light transmission aggregometry) predstavuje v súčasnosti zlatý štandard pri hodnotení funkcie trombocytov a ich odpovede na podávanú liečbu. Metóda je založená na meraní miery agregácie trombocytov v plazme bohatej na trombocyty po stimulácii rôznymi induktormi. Je možné použitie nešpecifických (adrenalín, kolagén), či špecifických induktorov (arachidónová kyselina pri hodnotení účinnosti kyseliny acetylcalicylovej, adenozíndifosfát – ADP pri hodnotení účinnosti inhibítorov ADP-receptorov), metóda sama o sebe je však nešpecifická. Optická agregometria je v súčasnosti najpoužívanejšou metódou pri monitorovaní účinnosti antiagregačnej liečby (obr. 1), vrátane monitorovania účinnosti podanej kyseliny acetylsalicylovej, klopidogrelu, iných inhibítorov ADP-receptorov a inhibítorov GP IIb/IIIa receptorov. Medzi potenciálne nevýhody tohto vyšetrenia patrí nevyhnutnosť skorého vykonania vyšetrenia po odbere vzorky (do 1–2 hodín po odbere), potreba väčšieho množstva biologického materiálu, dlhý čas vyšetrenia, potenciálne ťažšia reproducibilita výsledkov vyšetrenia pri jeho nešpecifickosti, finančné náklady na agregometer, reagencie a potreba školeného personálu.
Obr. 1. Protokol vyšetrenia funkcie trombocytov pomocou optickej agregometrie so špecifickým induktorom (kyselina arachidónová – čierna, ADP – modrá) u pacientov s akútnym infarktom myokardu – nedostatočná (A) a dostatočná (B) odpoveď na duálnu antiagregačnú liečbu 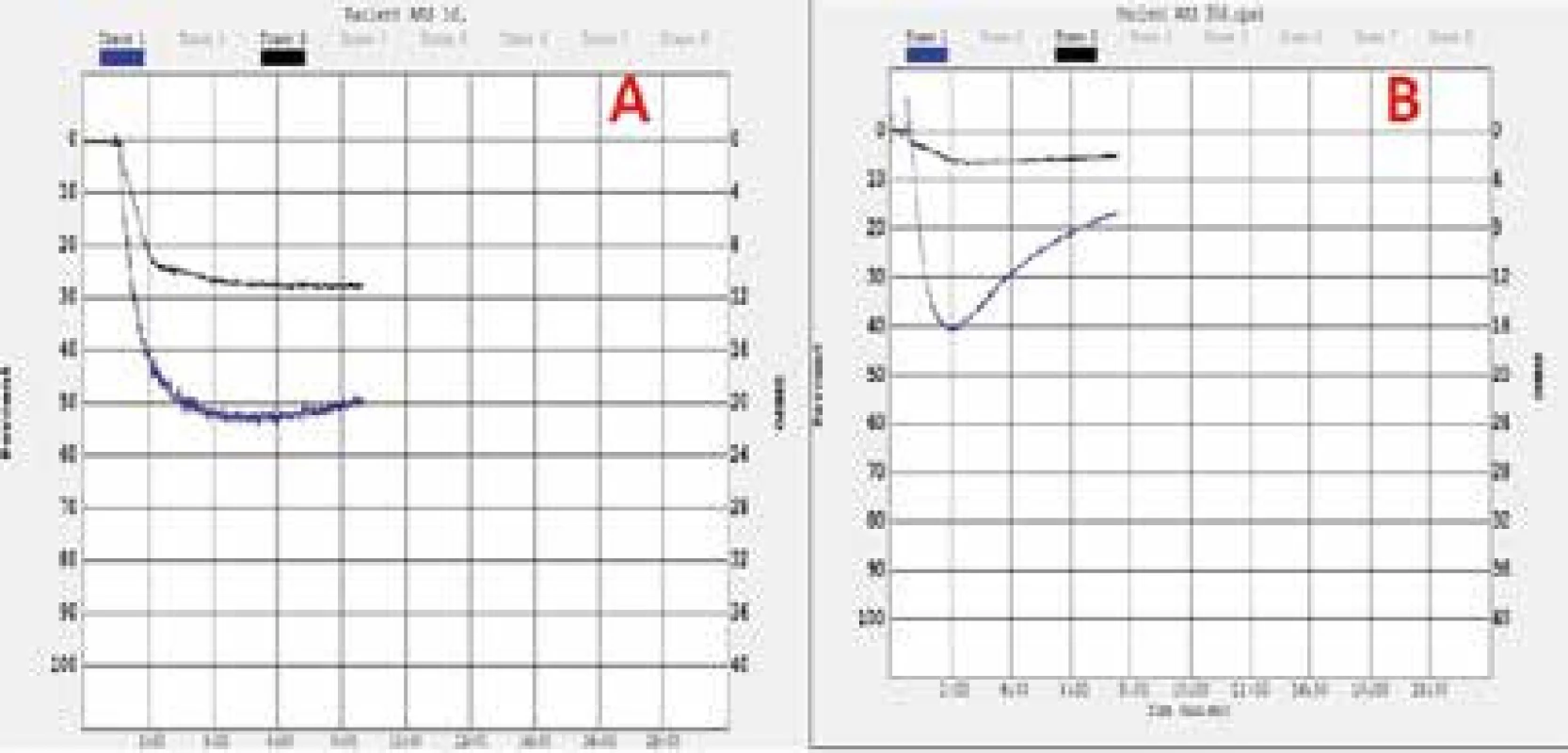
Meranie fosforylácie VASP
Meranie fosforylácie VASP (vasodilator stimulated phosphoprotein) predstavuje metódu, ktorá je špecifická na stanovenie miery inhibície ADP-signálnej dráhy [8]. Spojenie P2Y12 receptora s inhibíciou adenylátcyklázy cestou inhibičného G-proteínu sa dá využiť na meranie reaktivity tohto receptora v prítomnosti jeho inhibítorov. VASP je fosforylovaný proteínkinázami, ktoré sú aktivované cyklickým adenozínmonofosfátom (cAMP). S použitím prietokovej cytometrie a metód, ktoré ovplyvňujú permeabilitu trombocytovej membrány, je v súčasnosti možné kvantifikovať množstvo fosforylovaného VASP pomocou monoklonálnych protilátok, a tým merať množstvo neblokovaného receptora P2Y12. Vzorka citrátovej krvi sa pri analýze fosforylácie VASP inkubuje s prostaglandínom E1 (PGE1) a PGE1 + ADP (aktivované trombocyty). Po bunkovej permeabilizácii sa fosforylovaný VASP označí nepriamou imunofluorescenciou pomocou špecifickej monoklonovej protilátky. Analýza prietokovou cytometriou potom umožní zmerať mieru intenzity fluorescencie (MFI) a následne stanoviť mieru fosforylácie VASP vyjadrenú pomocou tzv. „indexu reaktivity trombocytov“ (platelet reactivity index – PRI) v % pomocou rovnice:
Ako už bolo spomenuté, výhodou vyšetrenia je jeho špecificita pre signálnu dráhu P2Y12 a stabilita vzorky v porovnaní s agregometriou. Nevýhodou je prístrojová a finančná náročnosť vyšetrenia. Presnosť a dobrú klinickú využiteľnosť pri detekcii rezistencie na liečbu ADP-receptormi v klinickej praxi (obr. 2) sme potvrdili aj v našom súbore diabetikov s akútnym infarktom myokardu s eleváciami ST segmentu [9].
Obr. 2. Protokol vyšetrenia účinnosti liečby antagonistom ADP-receptorov pomocou merania fosforylácie VASP trombocytov u pacienta s akútnym infarktom myokardu 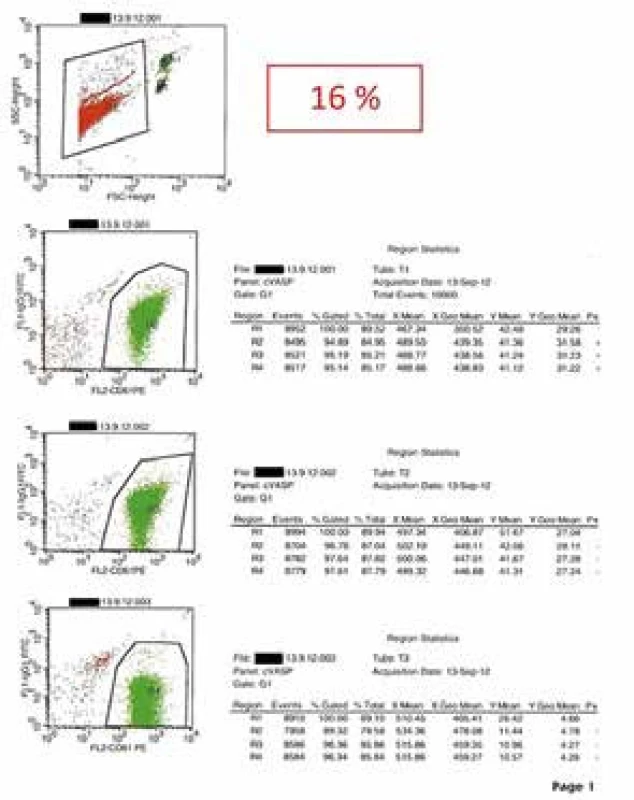
Impedančná agregometria
Impedančná agregometria (multiple electrode aggregometry) je metóda odvodená od optickej agregometrie. Je založená na meraní zmeny impedancie pri in vitro agregácii trombocytov stimulovanej buďto nešpecifickým, alebo špecifickým induktorom. Metóda využíva plnú krv namiesto plazmy bohatej na trombocyty, čo umožňuje vykonať vyšetrenie pri použití menšieho množstva biologického materiálu. Ďalšou výhodou tejto metódy je väčšia presnosť v porovnaní s optickou agregometriou, nevýhodou je jej väčšia finančná náročnosť.
Metódy založené na modifikovanej agregometrii
Metódy založené na modifikovanej agregometrii – platelet function analyzer 100 (PFA-100®) a systém VerifyNow® [10,11] predstavujú vyšetrenia schopné orientačne stanoviť odpoveď na podávanú antiagregačnú liečbu aj v podmienkach tzv. point of care testingu – POCT, t.j. analýzou priamo pri lôžku pacienta. PFA-100® je nešpecifická metóda stanovenia funkcie trombocytov, ktorej princípom je modifikované meranie agregability trombocytov po ich stimulácii kolagénom a adrenalínom. Vyšetrenie je rýchle, obsluha prístroja nevyžaduje školený personál a na jeho vykonanie stačí malé množstvo citrátovej krvi. Nevýhodou je finančná náročnosť vyšetrenia a obťažná reprodukovateľnosť výsledkov pri jeho nešpecificite. VerifyNow® je pomerne nová laboratórna metóda založená na princípe modifikovanej agregometrie s použitím špecifických induktorov arachidónovej kyseliny, ADP a peptidu aktivujúceho trombínový receptor (trombin receptor activating peptide – TRAP). Táto metóda umožňuje POCT stanovenie odpovede trombocytov na podanie kyseliny acetylsalicylovej, antagonistu ADP-receptorov a antagonistu glykoproteínových IIb/IIIa receptorov. Metóda využíva pri stanovení plnú krv a výsledky získané touto metódou dobre korelujú s výsledkami získanými pomocou optickej agregometrie.
Možnosti terapeutického ovplyvnenia rezistencie na liečbu klopidigrelom u pacientov s diabetes mellitus
Úprava dávkovania klopidogrelu
Individualizovanie dávkovania klopidogrelu (tzv. tailoring) predstavuje prvú skúšanú stratégiu na preklenutie vysokej reaktivity trombocytov. Ako prvá overovala efektivitu dvoch rôznych dávkovacích režimov kyseliny acetylsalicylovej a klopidogrelu v prevencii nežiadúcich kardiovaskulárnych príhod a trombózy stentu u pacientov s AKS štúdia CURRENT – OASIS 7 [12]. Výsledky tejto štúdie ukázali, že zvýšené dávkovanie klopidogrelu v porovnaní so štandardným dávkovaním neznížilo signifikantne mieru kardiovaskulárnych úmrtí, infarktu myokardu alebo cievnej mozgovej príhody počas 30-dňového sledovania, bolo však asociované so signifikantne zvýšeným rizikom krvácania (p < 0,01). Analýza subpopulácie 5 880 pacientov s DM zaradených do tejto štúdie však ukázala nesignifikantne lepšie výsledky pri použití vyššieho dávkovania klopidogrelu práve u pacientov s DM. Účinnosť stratégie modifikovaného dávkovania klopidogrelu u diabetikov s nedostatočnou odpoveďou na štandardné dávkovanie lieku overovala štúdia OPTIMUS [13]. V tejto štúdii bolo 40 pacientov s DM 2. typu, ktorí boli identifikovaní ako non-respondéri na štandardné dávkovanie klopidogrelu, randomizovaných buďto k intenzifikácii liečby (t.j. navýšeniu dávkovania na 150 mg denne) alebo k pokračovaniu v štandardnom režime (t.j. 75 mg denne). Štúdia preukázala zníženie reaktivity trombocytov v ramene s intenzifikovanou liečbou, avšak optimálna inhibícia trombocytov bola dosiahnutá len u 40 % pacientov v intenzifikovanom ramene štúdie. Nevýhodou stratégie modifikovanej liečby klopidogrelom je závislosť jej úspechu od genetickej predispozície pacienta [14], nakoľko existuje vysoká pravdepodobnosť jej zlyhania u tzv. pomalých metabolizérov klopidogrelu. Ďalším faktorom diskriminujúcim túto stratégiu je skutočnosť, že táto stratégia prakticky zlyhala v randomizovanej klinickej štúdii GRAVITAS [15]. V uvedenej štúdii bolo randomizovaných viac ako 2 000 pacientov podstupujúcich elektívnu PCI s implantáciou liekových stentov buď k štandardnej alebo intenzifikovanej liečbe klopidogrelom. Pacienti boli sledovaní 6 mesiacov, pričom v tomto období sa výskyt ischemických nežiaducich príhod medzi 2 ramenami štúdie nelíšil (ischemickú príhodu prekonalo 2,3 vs 2,3 % pacientov). Stratégia intenzifikovanej liečby klopidogrelom dosiahla len 22% redukciu počtu non-respondérov na klopidogrel.
Liečba novými antagonistami ADP receptorov
Nové antagonisti ADP receptorov, ako je prasugrel a tikagrelor (tab.), dosahujú rýchlejšiu, konzistentnejšiu a predpokladateľnejšiu inhibíciu ADP-signálnej dráhy, čo môže zvýhodňovať ich použitie práve v skupine pacientov s DM [16].
Tab. Nové perorálne antagonisti ADP receptorov v súčasnej klinickej praxi 
Prasugrel
Prasugrel je nový treťogeneračný tienopyridínový antagonista P2Y12 ADP-receptorov, nedávno zavedený do klinickej praxe u pacientov s AKS a plánovanou PCI. Prasugrel v porovnaní s klopidogrelom vykazuje konzistentnejšiu inhibíciu P2Y12 ADP-receptora a má nižšiu intraindividuálnu variabilitu účinnosti. Štúdia TRITON – TIMI 38 [17] randomizovala 13 608 pacientov s AKS podstupujúcich PCI na liečbu klopidogrelom alebo prasugrelom v trvaní 6–15 mesiacov. 3 146 z týchto pacientov malo DM, 776 bolo pri prijatí liečených inzulínovou terapiou. Primárny endpoint bol v tejto štúdii signifikantne znížený liečbou prasugrelom tak v skupine pacientov bez DM (9,2 % vs 10,6 %, p < 0,05), ako aj v skupine pacientov s DM (12,2 % vs 17,0 %, p < 0,001). Benefit podania prasugrelu bol pozorovaný zhodne u pacientov liečených inzulínom (14,3 % vs 22,2 %, p < 0,01), ako aj u pacientov s DM bez inzulínovej terapie (11,5 % vs 15,3 %, p < 0,01). Incidencia IM bola liečbou prasugrelom znížená o 18 % u jedincov bez DM (p < 0,01) a o 40 % u jedincov s DM (p < 0,001). Napriek tomu, že bola v štúdii pozorovaná zvýšená frekvencia závažného krvácania u pacientov s DM, miera krvácavých komplikácií sa signifikantne u pacientov s DM nelíšila v závislosti od použitia klopidogrelu alebo prasugrelu (2,6 % vs 2,5 %). Klinický benefit liečby prasugrelom bol väčší u pacientov s DM v porovnaní s nediabetickými pacientmi a dôležitým pozorovaním bola aj signifikantná redukcia trombózy stentu liečbou prasugrelom tak v celej sledovanej skupine (0,9 % vs 2,0 %), ako aj u pacientov s DM (2,0 % verzus 3,5 %). V celej štúdii bol najväčší benefit liečby prasugrelom pozorovaný preferenčne v prípade pacientov s DM, u ktorých liečba prasugrelom významne znížila riziko vzniku ischemických príhod, vrátane rizika vzniku rekurentného infarktu myokardu a riziko vzniku trombózy stentu, a to bez zvýšenia rizika vzniku závažných krvácavých komplikácií. Porovnanie vplyvu DM 2. typu na účinnosť prasugrelu u pacientov s akútnym infarktom myokardu s eleváciami ST-segmentu preukázalo jeho podobnú potentnú účinnosť v oboch skupinách pacientov [9]. Inhibícia ADP-signálnej dráhy dosiahnutá v tejto štúdii bola signifikantne lepšia v porovnaní s klopidogrelom tak u diabetikov, ako aj u jedincov bez DM. V ďalšej randomizovanej klinickej štúdii [18] dosiahla liečba prasugrelom u pacientov s DM 2. typu lepšiu inhibíciu funkcie trombocytov aj pri priamom porovnaní s intenzifikovanou liečbou klopidogrelom (nasýcovacia dávka 600 mg a denná udržiavacia dávka 150 mg). Prasugrel teda môže byť efektívne využitý na preklenutie rezistencie u pacientov s nedostatočnou odpoveďou na klopidogrel.
Tikagrelor
Tikagrelor je perorálny priamy reverzibilný antagonista P2Y12 ADP-receptorov, ktorý dosahuje vysokú mieru inhibície agregácie trombocytov v porovnaní s klopidogrelom u pacientov s AKS [19]. Štúdia PLATO [20] porovnávala účinnosť tikagreloru a klopidogrelu v prevencii kardiovaskulárnych príhod u pacientov s AKS (n = 18 624). Výskyt primárneho endpointu po 12 mesiacoch sledovania bol signifikantne nižší u pacientov liečených tikagrelorom (10,2 % vs 12,3 %, p < 0,001). V podskupine pacientov liečených PCI bol liečbou tikagrelorom signifikantne znížený aj výskyt kardiovaskulárnych úmrtí a trombózy stentu. Liečba tikagrelorom nebola asociovaná so zvýšenou frekvenciou závažného krvácania. V skupine pacientov s DM tikagrelor znížil výskyt primárneho endpointu, mortalitu z akýchkoľvek príčin a výskyt trombózy stentu. Podobný benefit liečby tikagrelorom bol pozorovaný tak u pacientov s DM liečených inzulínom, ako aj u pacientov bez inzulínovej terapie. Výskyt krvácavých komplikácií bol približne rovnaký u pacientov s DM liečených tikagrelorom aj klopidogrelom. Následne publikované štúdie preukázali, že tikagrelor dosahuje u diabetikov so stabilnou koronárnou chorobou srdca silnú a rýchlu inhibíciu funkcie trombocytov, ktorá je porovnateľná s inhibíciou dosiahnutou liečbou tikagrelorom u jedincov bez DM [21, 22]. Inhibícia trombocytov liečbou tikagrelorom zostáva u diabetikov signifikantne potentnejšia aj v porovnaní s intenzifikovanou liečbou klopidogrelom [23]. Priame randomizované porovnanie tikagreloru a prasugrelu [24] u diabetikov s koronárnou chorobou srdca dovtedy neliečených antagonistom ADP-receptorov preukázalo trend k silnejšej inhibícii ADP-signálnej dráhy u diabetikov liečených tikagrelorom (rozdiel však nebol štatisticky významný). Uvedené skutočnosti teda poukazujú na fakt, že tikagrelor dosahuje u diabetikov minimálne porovnateľnú účinnosť ako prasugrel a podstatne silnejšiu inhibíciu ADP-signálnej dráhy ako klopidogrel. Tento fakt potvrdila aj recentná metaanalýza 22 štúdií zahrňujúcich celkovo 35 004 pacientov [25], ktorá preukázala signifikantnú redukciu primárneho endpointu pozostávajúceho z kardiovaskulárnych úmrtí, infarktu myokardu a ischemickej cievnej mozgovej príhody u diabetikov liečených tikagrelorom oproti diabetikom liečených klopidogrelom; a to bez zvýšenia rizika krvácavých komplikácií. Uvedená metaanalýza ďalej preukázala signifikantne lepšiu inhibíciu trombocytov tikagrelorom v porovnaní s klopidogrelom a dokonca aj v porovnaní s prasugrelom. Vplyv liečby tikagrelorom a prasugrelom na výskyt primárneho endpointu bol porovnateľný. Tikagrelor teda určite predstavuje ďalšiu účinnú alternatívu na prekonanie klopidogrelovej rezistencie u diabetikov podstupujúcich PCI, pričom liečba tikagrelorom sa zdá byť bezpečná a prinajmenšom rovnako účinná ako liečba prasugrelom.
Záver
Diabetes mellitus je spojený s rezistenciou na liečbu klopidogrelom, ktorá je nezávislým rizikovým faktorom ischemických nežiaducich príhod u pacientov podstupujúcich perkutánne koronárne intervencie, vrátane trombózy stentu. Na základe doteraz publikovaných výsledkov sa zdá vyšetrenie reaktivity trombocytov na liečbe antagonistom ADP-receptorov byť vhodné predovšetkým u pacientov s diabetes mellitus liečených klopidogrelom. Na prekonanie uvedenej rezistencie sa v súčasnosti zdá byť výhodnejšie použitie nových antagonistov ADP-receptorov, ako je prasugrel a tikagrelor, ktoré u diabetikov dosahujú rýchlu a konzistentnú inhibíciu funkcie trombocytov. V individualizovaných prípadoch je možné zvážiť aj stratégiu modifikovaného dávkovania liečby klopidogrelom (napríklad v prípade prítomnosti kontraindikácie k podaniu nových preparátov), účinnosť tejto stratégie je však slabšie podporená dôkazmi z klinických štúdií. Cieľom liečby je dosiahnutie dostatočnej inhibície ADP-signálnej dráhy, čím sa signifikantne zníži riziko vzniku závažných ischemických príhod.
Autori článku nemajú konflikt záujmu.
Doručené do redakcie/Doručeno do redakce: 30. 12. 2017
Prijaté po recenzii/Přijato po recenzi: 29. 1. 2018
MUDr. Matej Samoš, PhD.
E-mail: matej.samos@gmail.com
Zdroje
1. Samoš M, Šimonová R, Kovář F et al. Clopidogrel resistance in diabetic patient with acute myocardial infarction due to stent thrombosis. Am J Emerg Med 2014; 32(5): 461–465. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajem.2014.01.006>.
2. Erlinge D, Varenhorst C, Braun OO et al. Patients with poor responsiveness to thienopyridine treatment or with diabetes have lower levels of circulating active metabolite, but their platelets respond normally to active metabolite added ex vivo. J Am Coll Cardiol 2008; 52(24): 1968–1977. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2008.07.068>.
3. Angiolillo DJ, Capranzano P, Desai B et al. Impact of P2Y(12) inhibitory effects induced by clopidogrel on platelet procoagulant activity in type 2 diabetes mellitus patients. Thromb Res 2009; 124(3): 318–322. Dostupné z DOI: <http://dx.doi.org/10.1016/j.thromres.2008.10.001>.
4. Angiolillo DJ, Fernandez-Ortiz A, Bernardo E et al. Platelet function profiles in patients with type 2 diabetes and coronary artery disease on combined aspirin and clopidogrel treatment. Diabetes 2005; 54(3): 2430–2435.
5. Budaj A, Yusuf S, Mehta SR et al. [Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) Trial Investigators]. Benefit of clopidogrel in patients with acute coronary syndromes without ST-segment elevation in various risk groups. Circulation 2002; 106(13): 1622–1626.
6. Steinhubl SR, Berger PB, Mann JT et al. [CREDO Investigators. Clopidogrel for the Reduction of Events During Observation]. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002; 288(19): 2411–2420. Erratum in JAMA 2003 Feb; 289(8): 987.
7. Iakovou I, Schmidt T, Bonizzoni E et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293(17): 2126–2130. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.293.17.2126>.
8. Fedor M, Šimonová R, Fedorová J et al. Role of VASP phosphorylation assay in monitoring the antiplatelet therapy. Acta Med Mart 2013; 13(1): 21–26. Dostupné z DOI: <https://doi.org/10.2478/acm-2013–0008>
9. Samoš M, Fedor M, Kovář F et al. The Impact of Type 2 Diabetes on the Efficacy of ADP Receptor Blockers in Patients with Acute ST Elevation Myocardial Infarction: A Pilot Prospective Study. J Diabetes Res 2016; 2016 : 2909436. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/2909436>.
10. Larsen PD, Holley AS, Sasse A et al. Comparison of Multiplate and VerifyNow platelet function tests in predicting clinical outcome in patients with acute coronary syndromes. Thromb Res 2017; 152 : 14–19. Dostupné z DOI: <http://dx.doi.org/10.1016/j.thromres.2017.02.006>.
11. Dalby MC, Davidson SJ, Burman JF et al. Diurnal variation in platelet aggregation iwth the PFA-100 platelet function analyser. Platelets 2000; 11(6): 320–324.
12. Mehta SR, Bassand JP, Chrolavicius S et al. [CURRENT-OASIS 7 Investigators]. Dose comparisons of clopidogrel and aspirin in acute coronary syndromes. N Engl J Med 2010; 363(10): 930–942. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0909475>. Erratum in N Engl J Med 2010; 363(16): 1585.
13. Angiolillo DJ, Shoemaker SB, Desai B et al. Randomized comparison of a high clopidogrel maintenance dose in patients with diabetes mellitus and coronary artery disease: results of the Optimizing Antiplatelet Therapy in Diabetes Mellitus (OPTIMUS) study. Circulation 2007; 115(6): 708–716. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.106.667741>.
14. Cui G, Zhang S, Zou J et al. P2Y12 receptor gene polymorphism and the risk of resistance to clopidogrel: A meta-analysis and review of the literature. Adv Clin Exp Med 2017; 26(2): 343–349. Dostupné z DOI: <http://dx.doi.org/10.17219/acem/63745>.
15. Price MJ, Berger PB, Teirstein PS et al. [GRAVITAS Investigators]. Standard - vs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial. JAMA 2011; 305(11): 1097–1105. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2011.290>. Erratum in JAMA 2011; 305(21); 2174. Stillablower ME.
16. Samoš M, Fedor M, Kovář F et al. Type 2 Diabetes and ADP Receptor Blocker Therapy. J Diabetes Res 2016; 2016 : 6760710. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/6760710>.
17. Wiviott SD, Braunwald E, McCabe CH et al. [TRITON-TIMI38 Investigators]. Prasugrel versus Clopidogrel in Patients with Acute Coronary Syndromes. N Engl J Med 2007(15); 357(20): 2001–2015. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0706482>.
18. Angiolillo DJ, Badimon JJ, Saucedo JF et al. A pharmacodynamic comparison of prasugrel vs. high-dose clopidogrel in patients with type 2 diabetes mellitus and coronary artery disease: results of the Optimizing anti-Platelet Therapy In diabetes MellitUS (OPTIMUS)-3 Trial. Eur Heart J 2011; 32(7): 838–846. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehq494>.
19. Samoš M, Fedor M, Kovář F et al. Ticagrelor: a safe and effective approach for overcoming clopidogrel resistance in patients with stent thrombosis? Blood Coagul Fibrinolysis 2016; 27(2): 117–120. Dostupné z DOI: <http://dx.doi.org/10.1097/MBC.0000000000000406>.
20. Wallentin L, Becker RC, Budaj A et al. [PLATO Investigators]. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361(11): 1045–1057. <http://dx.doi.org/10.1056/NEJMoa0904327>.
21. Clavijo LC, Maya J, Carlson G et al. Platelet inhibition with ticagrelor versus clopidogrel in Hispanic patients with stable coronary artery disease with or without diabetes mellitus. Cardiovasc Revasc Med 2015; 16(8): 450–454. <http://dx.doi.org/10.1016/j.carrev.2015.08.007>.
22. Zafar MU, Baber U, Smith DA et al. Antithrombotic potency of ticagrelor versus clopidogrel in type-2 diabetic patients with cardiovascular disease. Thromb Haemost 2017; 117(10): 1981–1988. Dostupné z DOI: <http://dx.doi.org/10.1160/TH17–04–0277>.
23. Mangiacapra F, Panaioli E, Colaiori I et al. Clopidogrel Versus Ticagrelor for Antiplatelet Maintenance in Diabetic Patients Treated With Percutaneous Coronary Intervention: Results of the CLOTILDIA Study (Clopidogrel High Dose Versus Ticagrelor for Antiplatelet Maintenance in Diabetic Patients). Circulation 2016; 134(11): 835–837. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.116.023743>.
24. Franchi F, Rollini F, Aggarwal N et al. Pharmacodynamic Comparison of Prasugrel Versus Ticagrelor in Patients With Type 2 Diabetes Mellitus and Coronary Artery Disease: The OPTIMUS (Optimizing Antiplatelet Therapy in Diabetes Mellitus)-4 Study. Circulation 2016; 134(11): 780–792. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.116.023402>.
25. Tan Q, Jiang X, Huang S et al. The clinical efficacy and safety evaluation of ticagrelor for acute coronary syndrome in general ACS patients and diabetic patients: A systematic review and meta-analysis. PLoS One 2017; 12(5): e0177872. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0177872>.
Štítky
Angiológia Diabetológia Interné lekárstvo Kardiológia Praktické lekárstvo pre dospelých
Článek EditorialČlánek AUTORSKÝ REJSTŘÍK
Článok vyšiel v časopiseAthero Review
Najčítanejšie tento týždeň
2018 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Vedlejší a nežádoucí účinky antihypertenziv
- Artériová hypertenzia – rizikový faktor cievnych mozgových príhod
- Periférne artériové ochorenie dolných končatín a globálne kardiovaskulárne riziko
- Má centrálny systolický tlak perspektívu pre klinickú prax?
- Diabetes mellitus a rezistencia na liečbu antagonistami ADP-receptorov: význam, možnosti detekcie a terapeutického ovplyvnenia
- Editorial
- Diabetes mellitus a srdeční selhání: úloha inhibitorů SGLT2
-
3. česko-slovenská lipidová akademie
20.–21. 10. 2017, Mikulov - Komentář k „Praktickému doporučení pro použití PCSK9-inhibitorů“ aneb Proč renomovaní autoři píší dokumenty, které si samy odporují?
-
Jaký byl 21. kongres o ateroskleróze?
7.–9. 11. 2017, Olomouc - XXI. kongres o ateroskleróze, 7.–9. prosince 2017, Olomouc - Sborník abstrakt
- Tuky v potravinách z pohledu zdraví
- AUTORSKÝ REJSTŘÍK
- Athero Review
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vedlejší a nežádoucí účinky antihypertenziv
- Tuky v potravinách z pohledu zdraví
- Periférne artériové ochorenie dolných končatín a globálne kardiovaskulárne riziko
- Diabetes mellitus a srdeční selhání: úloha inhibitorů SGLT2
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




