-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pooperační rekurence Crohnovy nemoci*
Postoperative recurrence of Crohn’s disease
Postoperative recurrence of Crohn’s disease of the bowel is the appearance of objective signs – defined endoscopically, radiologically or pathologically. New lesion can be visualized endoscopically within weeks to months after ileal resection and ileocolonic anastomosis in the neoterminal ileum. Risk factors are smoking, bacterial flora, environmental factors, immune response and genetic variants. Immunomodulators or biological agents are effective in the prophylaxis of postoperative recurrence.
Key words:
Crohn’s disease, recurrence, azathioprin, biological agents.
Autori: Karel Lukáš
Pôsobisko autorov: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 594-598
Kategória: Přehledové články
Súhrn
Pooperační rekurence Crohnovy choroby střeva je charakterizována objektivním nálezem definovaným endoskopicky, radiologicky nebo patologicky. Nové léze jsou prokazovány endoskopicky v neoterminálním ileu během týdnů až měsíců po ileální resekci a ileokolické anastomóze. Rizikovými faktory jsou kouření, bakteriální flóra, faktory zevního prostředí, imunitní reakce a genetické odchylky. Imunomodulační látky nebo biologická agens jsou v profylaxi pooperační rekurence účinné.
Klíčová slova:
Crohnova nemoc, rekurence, azathioprin, biologická agens.*Předneseno dne 18. 5. 2011 na pravidelném sympóziu Gastroenterologického oddělení IV. interní kliniky 1. LF UK a VFN Praha o idiopatických střevních zánětech na téma „Remise a riziko relapsu a rekurence u idiopatických střevních zánětů“
ÚVOD
Nejčastější oblastí postiženou Crohnovou nemocí (CN) je ileum, cékum a přilehlá část vzestupného tračníku. Nejčastější resekovanou oblastí CN je distální ileum a cékum (1). Vzhledem k tomu, že neznáme etiologii idiopatických střevních zánětů, je v současnosti definitivním cílem jejich léčby udržení remise (2, 3). V klinice jde v první řadě o odstranění symptomů (2), což ale nemusí být spojeno s aktivitou nemoci a střevním zánětem a s endoskopickým nálezem.
CN je chronický zánět, který často vyžaduje chirurgickou intervenci, nejčastěji resekci střeva. Důvodem je refrakterní aktivita nebo komplikace, ke kterým řadíme stenózu, absces, píštěl, malignitu a z akutních stavů krvácení a toxické megakolon.
DEFINICE
Recurrens (-entis) v latině znamená zpětný, zpět vedoucí, zpáteční, návratný (4).
Rekurence CN je přítomnost nové objektivně zjištěné střevní léze CN po radikální nebo kurativní resekci.
Resekce radikální (též kurativní) je kompletní excize s odstraněním celého postiženého úseku a lymfatických uzlin, s dostatečnou délkou od makroskopicky normálního okraje na obou koncích nemocného segmentu. Jako dostatečná délka od okrajů nemocného segmentu je počítáno 5–15 cm.
Jako segmentální resekce je označováno odstranění segmentu postiženého CN. Současně je definována i bypassová operace jako taková, která odvede fekální tok z nemocného segmentu pro zhojení zánětu v dysfunkčním střevě (5).
Relapsem se rozumí obnovený výskyt symptomů (6), kdežto, jak bylo již výše řečeno, je rekurence obnovený výskyt lézí po chirurgické resekci.
Pooperační rekurence je popisována jako:
- Morfologická, což jsou nové léze prokázané vyšetřovacími technikami. Bezpečněji ji prokáže endoskopie než radiodiagnostika (7).
- Endoskopická, kdy je endoskopicky prokázán výskyt nových slizničních lézí v neoterminálním ileu časně po chirurgické resekci (7). Nejčastěji jde o aftoidní léze, které vznikají disrupcí kapilární bazální membrány s hemoragiemi a s průnikem fibrinogenu do okolní lamina propria a s vyprázdněním do střevního lumen (8).
- Klinická je rekurence zhodnocená konvenčními indexy aktivity, jako např. CDAI. Do 5 let se objeví u 17–55 % operovaných, do 10 let u 32–76 % operovaných a do 20 let u 72–73 % operovaných (9).
- Chirurgická je stav, kdy pacient potřebuje reoperaci. Do 5 let nastane tato potřeba u 11–32 % nemocných, do 10 let u 20–44 % nemocných a do 20 let u 46–55 % nemocných (9).
VÝSKYT
V průběhu života potřebuje 80 % pacientů s CN střevní resekci (10). Ale resekční chirurgický zásah není při CN definitivně kurativní a nemoc často rekuruje buď v oblasti anastomózy, nebo proximálněji (7).
Po kompletní resekci postižené oblasti se znovu objeví endoskopický nález u 70–90 % pacientů do 1 roku po operaci, ale jen 10–20 % z nich je symptomatických! Symptomy se mohou projevit později (1, 3).
PATOFYZIOLOGIE
Patofyziologie pooperační rekurence je neznámá a je zcela nepředvídatelná. Předpokládá se, že je pravděpodobně stejná jako u CN před operací (11). Roli patrně hrají:
- Bakteriální flóra, která se dostává do tenkého střeva při ztrátě ileocékální chlopně, dochází k alteraci slizniční bariéry a pravděpodobná je nerovnováha mezi komenzálními a patogenními bakteriemi. Je zvažováno, zda určité patogenní bakterie mají vliv na rekurenci.
-
Faktory zevního prostředí, kam je řazeno v první řadě kouření, dále léky (zejména nesteroidní antirevmatika a orální antikonceptiva), hygiena a dieta. Příkladem velkého obratu je výměna prostředí při změně pobytu, např. při přestěhování z chladného do teplého klimatu, kdy hraje roli přijetí jiných hygienických pravidel, změna stravovacích zvyklostí a dokonce výměna některých léků (11).
Kouření cigaret zdvojnásobuje riziko rekurence a je nejen rizikovým faktorem rozvoje CN, ale má vliv i na aktivitu nemoci po resekci (12). Kouření je zvýšeně rizikové u žen (13). Ale dle další studie je riziko u obou pohlaví stejné. Za 1 rok se projeví rekurence makroskopických lézí v neoileu u 70 % kuřáků, u 35 % nekuřáků a u 27 % exkuřáků (14). Ukončení kouření je považováno za velmi užitečný faktor v léčbě. - Imunitní odpověď je porušena při změně rovnováhy mezi pro - a protizánětlivými faktory, je zřejmě porušena obrana proti luminálním patogenům a může být abnormálně aktivní lokální imunitní odpověď na faktory dietní a na komenzální mikrobiální agens. Zatím bylo věnováno málo pozornosti sérologickým markerům, které mohou predikovat pooperační rekurence (11).
- Genetika prokazuje zvýšený výskyt ISZ u kavkazské rasy a u Aškenáziů, je zjišťována familární agregace, zvýšení výskytu nemoci u monozygotních dvojčat ve srovnání s dizygotními a spojení CN se členem 15. (NOD2/CARD15) genu. Identifikace genových variant může být klinicky užitečná k identifikaci podskupin pacientů s CN, kteří mají těžké onemocnění a vysoké riziko pooperační rekurence (11). Gen NOD2/CARD15 má důležitou roli v náchylnosti ke CN, je spojen s ileální lokalizací, strikturami a s větším rizikem pooperační rekurence (15).
Kombinace genetických a sérologických bakteriálních markerů by mohla v budoucnu predikovat pooperační rekurence nemoci (11). - Fenotyp nemoci hraje důležitou roli v rekurenci. S vyšší pooperační rekurencí mohou být spojeny časný začátek nemoci a CN v rodinné anamnéze. S vyšší pooperační rekurencí jsou spojeny předoperační aktivita nemoci a lokalizace nemoci v době diagnózy. Je-li při rekurenci zapotřebí reoperace, je na tom hůře pacient, který má CN zasažen jen tračník než pacient s izolovaným postižením tenkého střeva nebo s kombinovaným postižením ilea a tračníku. Je-li zasaženo CN jejunum, je zde vyšší riziko časnější rekurence ve srovnání s postižením ileocékálním.
S vyšší pooperační rekurencí mohou být spojeny časný začátek nemoci a CN vyskytující se v rodinné anamnéze.
S vyšší pooperační rekurencí jsou spojeny předoperační aktivita nemoci a lokalizace nemoci v době diagnózy.
Je-li při rekurenci zapotřebí reoperace, je na tom hůře pacient, který má zasažen jen tračník než pacient s izolovaným postižením tenkého střeva nebo s kombinovanou nemocí v ileu a tračníku. Postižení jejuna má vyšší riziko časnější rekurence ve srovnání s postižením ileocékálním.
CN horní části trávicího traktu je nejdůležitějším prediktorem rekurence! Perforující nemoc je spojena s rychlou a agresivní pooperační rekurencí. Reoperace je u pacientů, kteří byli poprvé operováni pro nemoc perforující, časnější ve srovnání s poprvé operovanými pro nemoc ne-perforující (7). - Operační výkon. V pooperační rekurenci hraje roli i operační výkon. Side-to-side ileokolická anastomóza staplerem je spojena s menším rizikem rekurence (24 %) než anastomóza provedená klasickým způsobem (57 %) (1, 16).
Ileokolonická anastomóza je chráněna proximální ileostomií, protože proud stolice nedráždí, léze jsou pak jen výjimečně (17).
Délka resekovaného úseku není predisponujícím faktorem pooperační rekurence. V okamžiku operace je rozhodující postižení makroskopické! Předpokládá se, že lokální ischemické poškození v místě resekce by mohlo zvyšovat rekurenci (7).
Endoskopická rekurence se vyskytuje ve 42,5 % u end-to-end anastomózy a ve 37,9 % u side-to-side anastomózy. Symptomatická rekurence se vyskytuje u 21,9 % u end-to-end anastomózy a u 22,7 % u side-to-side anastomózy. Z těchto prací vyplývá, že technika anastomózy neovlivní pooperační rekurenci (9, 18). Ale dle jiné práce je typ anastomózy rozhodující, protože anastomóza end-to-end má jen polovinu pooperačních rekurencí proti ostatním typům anastomózy (7).
Laparoskopický výkon je výhodnější, protože nezanechá jizvu, je méně bolestivý, umožňuje dřívější příjem potravy po operaci a je důvodem kratšího pobytu v nemocnici. Ale dlouhodobé výsledky ukazují, že není rozdíl ve výskytu rekurence pooperační mezi operací laparoskopickou a klasickou. Protože nízká rekurence je dána agresivním užitím chemoprofylaxe (7, 19). - Léčba ve vztahu k chirurgickému výkonu. Přerušení léčby thiopuriny při chirurgickém výkonu je predikujícím faktorem klinické rekurence. Pacient užívající thiopuriny má pokračovat v léčbě i po operaci, protože azathioprin může vést ke hojení a zlepšení endoskopického nálezu u většiny pacientů s postoperační rekurencí (20).
- Histologické faktory. Myenterická plexitida v okraji resekovaného úseku může predikovat pooperační rekurenci (21). Pacienti s myenterickou plexitidou v proximální části resekovaného úseku mají signifikantně vyšší výskyt endoskopické pooperační rekurence po chirurgickém výkonu. Tíže plexitidy koreluje s tíží endoskopické rekurence (22).
Faktory s možným vlivem na pooperační rekurenci jsou uvedeny v tabulce 1.
Tab. 1. Faktory s možným vlivem na pooperační rekurenci 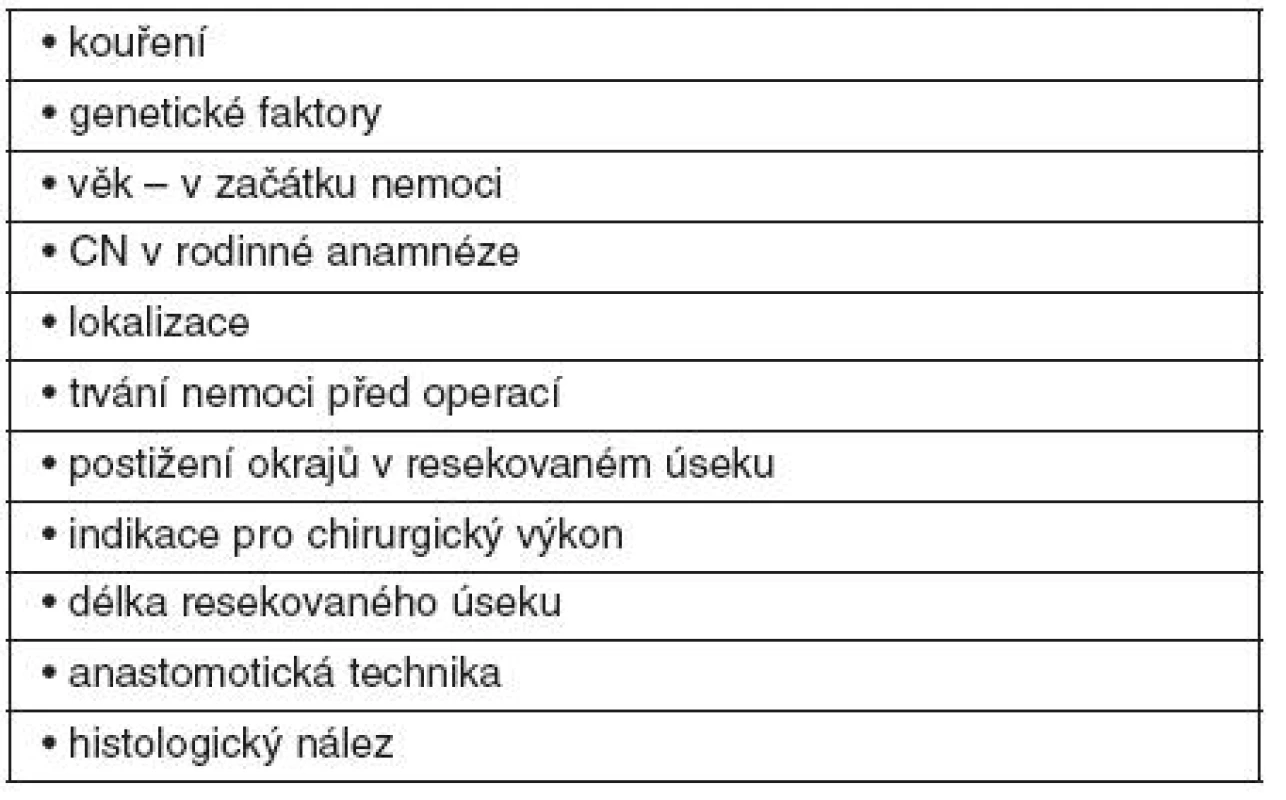
DIAGNÓZA
Stanovení diagnózy rekurence se děje pomocí: 1. kliniky; 2. endoskopického vyšetření – kolonoskopie s ileoskopií distálního ilea pomocí Rutgeersovy klasifikace – kdy tíže slizničních lézí koreluje s rozvojem klinické rekurence v ileu, resp. v tračníku (tab. 2 a 3); 3. histologie (je doporučováno vyšetření peroperační); 4. radiodiagnostika (enteroklýza, enterografie – klasické vyšetření pomocí barya, počítačová tomografie, magnetická rezonance); 5. kapslová enteroskopie – detekuje slizniční léze v 60–70 % do 1 roku po operaci; 6. leukocytární scan má nízkou specificitu; 7. z markerů zánětu jsou nejcitlivější markery ve stolici, méně významně v séru (CRP) a nejméně klasická klasifikace CDAI; 8. Poslední možností stanovení rekurence je její zjištění peroperačně.
Tab. 2. Detekce lézí při ileokolonoskopii a členění dle Rutgeertsova endoskopického indexu rekurence v ileu (23) 
Tab. 3. Detekce lézí při kolonoskopii a členění (stupně endoskopické rekurence) dle endoskopického indexu rekurence v tračníku (24) 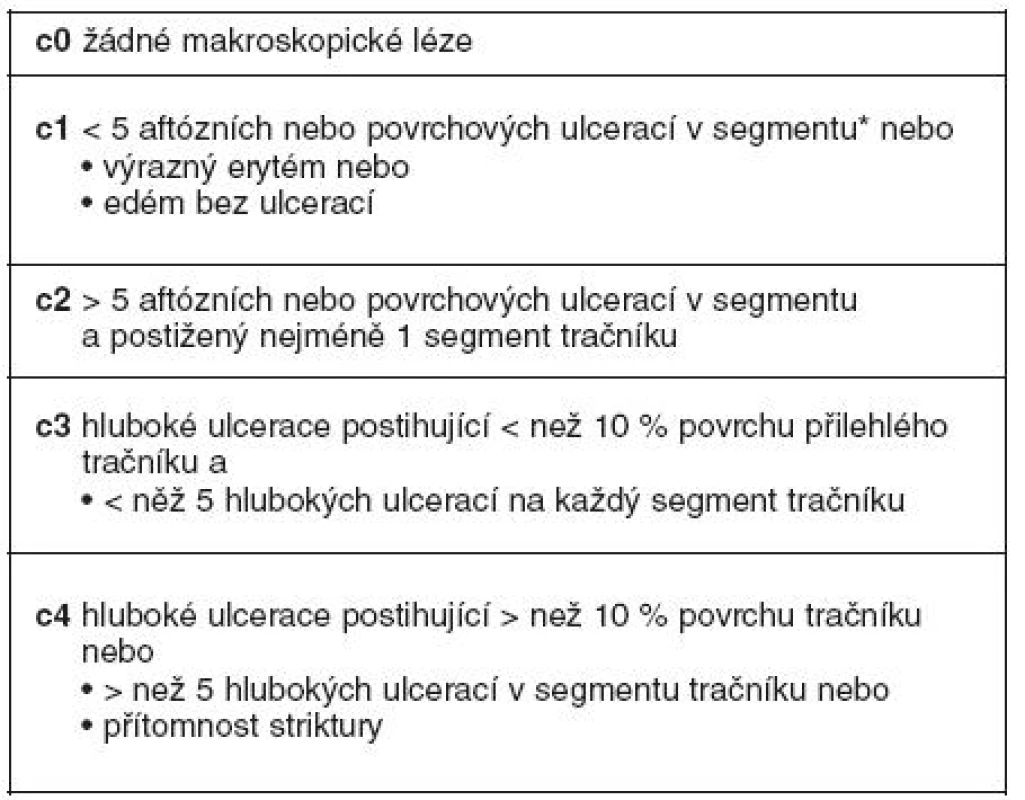
*cékum a vzestupný tračník, příčný tračník, tračník sestupný a sigmoideum, rektum Diferenciální diagnóza
Je nutné si uvědomit, že ileocékální resekce může být spojena s rozvojem břišních příznaků (zejména průjmem a křečemi v břiše), způsobenými sekundárně, tj. 1. malabsorpcí žlučových solí; 2. bakteriálním přerůstáním a 3. syndromem krátkého střeva. Při nich nejsou zjišťovány výrazné známky aktivity (je nízký CDAI a nízké CRP).
Sledování pooperační – detekce rekurence
Kolonoskopie je nejlepší možností pro zhodnocení slizniční rekurence CN v oblasti ileokolonické a v neoterminálním ileu (1).
Prevence rekurence
Prevence rekurence po střevní resekci je hlavním cílem v léčbě CN v této fázi onemocnění. Protože po kompletní resekci se endoskopické léze objeví do 1 roku u 70–90 % operovaných, ale jen 10–20 % má příznaky (3). Radikální resekce Crohnovy nemoci není prevencí rekurence (25)!
Ovlivnitelnými faktory pooperační rekurence jsou: kouření, hygiena (při nedostatečné hygieně dochází ke změně střevní mikroflóry), léky (zejména nesteroidní antiflogistika a pravděpodobně kontrakonceptiva), dieta a změna geografické lokality (za horší možnost je považována změna ze studeného do teplého klimatu, se kterou jde někdy ruku v ruce změna hygienických návyků a změna stravování (11).
Dlouhodobá aplikace udržovací léčby je profylaxí vzplanutí, a tím i možných následných operací. Dlouhodobá léčba je nutná, protože CN je chronický stav s různě dlouhými relapsy. Valná většina pacientů má do 5–10 let od stanovení diagnózy komplikace penetrující nebo stenózující, proto musí být udržovací léčba podávána již od stanovení diagnózy. Je známo, že časné zavedení dlouhodobé udržovací léčby je prospěšné jak pro pacienty dětské, tak dospělé (7, 26, 27).
V preventivní dlouhodobé léčbě nebyla prokázána účinnost při podávání budesonidu (1, 28, 29), kortikosteroidů (5), interleukinu 10 (30), probiotik (24), kombinace probiotik s prebiotiky (31) a rybího oleje (5).
Léky podávané v prevenci pooperační rekurence
Mesalazin je považován za bezpečně prospěšný, bez rizikových faktorů (7). Dle jiných názorů má mesalazin jen „marginální prospěch“ a je „podáván tam, kde není očekávána rekurence“, zejména u pacientů s klasifikací „i1-i2“ (5). Práce z roku 1997 (32) dokonce dle metaanalýzy tehdy dostupných studií ukazuje, že 5-ASA redukují pooperační rekurenci jen o 13 %. Rozumná je úvaha, že účinnost ASA není jednotně prokázána, což je dáno heterogenitou designu studií, různými preparáty a dávkami (1).
Nitroimidazolová antibiotika (metronidazol, ornidazol). Při jejich podávání se u poloviny pacientů rozvinou vedlejší účinky léků, a nejsou proto považována za vhodná k monoterapii k prevenci. Neměla by být podávána po operaci déle jak 3 měsíce (7). Jsou doporučována k aplikaci po operaci u rizikových pacientů, jak již bylo řečeno – ne déle než 3 měsíce (33). Vhodná je jejich kombinace s azathioprinem, při níž dojde k rekurenci do 1 roku po operaci „jen“ u 44 % pacientů, proti 69 % rekurencí při aplikaci metronidazolu samotného (34).
Thiopuriny (azathioprin, 6-merkaptopurin). Nízká dávka azathioprinu nemá převahu nad mesalazinem v dávce 3 g/den. Thiopuriny, zejména v kombinaci s metronidazolem jsou účinné zejména po druhé resekci a mají synergický účinek s ukončením kouření. Doporučováno je jejich podávání po operaci u vysoce rizikových pacientů (kuřáci, druhá resekce, penetrující nemoc) (7, 34, 35). Synergický účinek mají thiopuriny se současným ukončením kouření, což sníží riziko chirurgické rekurence, a tím i reoperace (36).
Kortikosteroidy a imunosupresiva v perioperačním užití. U pacientů s ISZ, kteří podstupují elektivní výkon, je perioperační užití kortikosteroidů spojeno se zvýšeným rizikem pooperačních infekčních komplikací. Užití samotného azathioprinu/6-merkaptopurinu nebo kombinace azathioprinu s kortikosteroidy není spojeno se zvýšeným výskytem pooperačních infekčních komplikací (37).
Třetina expertů považuje léčbu kortikosteroidy za rizikový faktor pooperačních komplikací. Nekontrolované retrospektivní studie ukazují, že pacienti užívající > 20 mg prednisolonu po dobu delší než 6 týdnů mají zvýšené riziko pro pooperační komplikace (38).
Enterální výživa
Enterální výživa indukuje remisi u více jak 50 % pacientů s aktivní CN (39). Pro „nutričně oslabené“ nemocné s velkou ztrátou na váze (> 10 % za 3 měsíce) je prospěšná etapa předoperační nutriční podpory (38).
Biologická léčba
Biologická léčba je kandidátem nové terapie pooperační rekurence, ale zatím chybí velké kontrolované studie (40). Dle „Doporučení American College of Rheumatology“ by tzv. biologické léky neměly být používány 1 týden před a 1 týden po operaci, a to s ohledem na jednotlivá biologická agens a ohledem na chirurgické infekční riziko (41). Dle konsenzu ECCO není shoda mezi experty, jaká je optimální doba mezi léčbou anti-TNF-α a břišním chirurgickým výkonem, je „zvažován 1 měsíc“ (38).
Praktický přístup v prevenci pooperační rekurence
Za léky účinné v udržení remise CN jsou považovány thiopuriny (azathioprin) (42), infliximab (43) a adalimumab (44).
Ve skutečnosti je v praxi v prevenci pooperační rekurence podáván často jako lék první linie mesalazin, a to navzdory kontroverzním názorům na účinnost. Jako lék druhé linie jsou aplikována imunosupresiva. Dostávají je pacienti s vysokým rizikem rekurence, pacienti s těžkými symptomy nebo ti, u kterých jsou nalezeny časné léze v neoterminálním ileu. Biologická léčba na široké uplatnění čeká, zatím chybí kontrolované studie (40). Jeden z algoritmů léčby pooperační rekurence založený převážně na sledování endoskopického nálezu ukazuje obrázek 1 (5, 18, 45).
Obr. 1. Algoritmus léčby pooperační rekurence založený zejména na endoskopickém nálezu v ileu 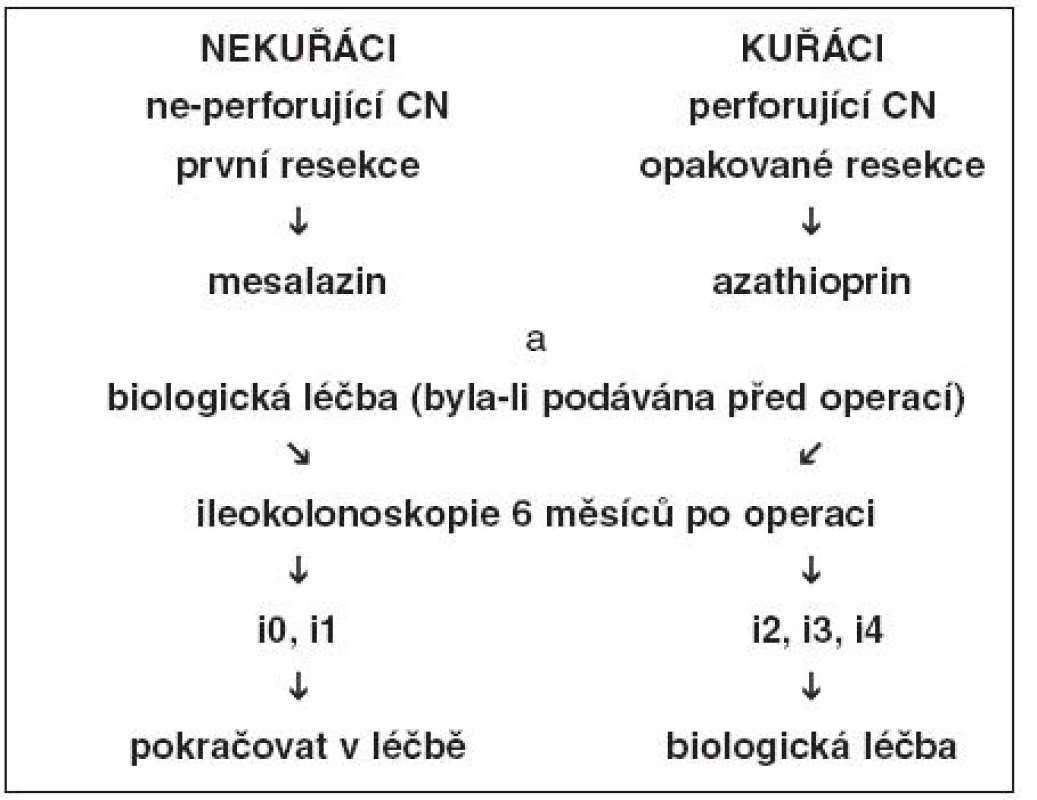
Nejlepší léčba pacientů operovaných pro CN je v současnosti neznámá a zůstává založena na subjektivních znalostech. Klinik musí rozvážit, jak pokračovat. Bez léčby – u pacientů s velmi nízkým rizikem rekurence, podáváním imunomodulancií – u pacientů se středním rizikem rekurence, anti-TNF-α – u nemocných s vysokým rizikem rekurence? Každá léčebná strategie vyžaduje kolonoskopii v odstupu 6–12 měsíců po operaci k identifikaci rekurence (46).Postup u pacientů s pooperačním rizikem rekurence je znázorněn na obrázku 2 (45, 46).
Obr. 2. Postup u pacienta s rizikem pooperační rekurence 
ZÁVĚR
Jako rekurence Crohnovy nemoci je hodnocena přítomnost nové objektivně zjištěné střevní léze Crohnovy nemoci po radikální nebo kurativní resekci. Radikální resekce je kompletní excize s odstraněním celého postiženého úseku a lymfatických uzlin, s dostatečnou délkou od makroskopicky normálního okraje na obou koncích nemocného segmentu. Pooperační rekurence je popisována jako morfologická, endoskopická, klinická a chirurgická. Po kompletní resekci postižené oblasti se znovu objeví endoskopický nález u 70–90 % pacientů do 1 roku po operaci, ale jen 10–20 % z nich je symptomatických. V patofyziologii pooperační roli pravděpodobně hrají důležitou roli bakteriální flóra, faktory zevního prostředí i faktory genetické a imunitní odpověď. Důležitý je fenotyp nemoci (oblast postižení) a operační výkon. Prevence rekurence po střevní resekci je při současných znalostech hlavním účelem v léčbě Crohnovy nemoci v této fázi onemocnění. Jako lék první linie je podáván často u „lehké formy“ Crohnovy nemoci mesalazin. Ale za léky účinné v udržení remise CN jsou považovány thiopuriny, infliximab a adalimumab. Zůstává zásadní názor, že každá léčebná pooperační strategie vyžaduje kolonoskopii v odstupu 6–12 měsíců po operaci k identifikaci rekurence.
Zkratky
- CDAI – index aktivity Crohnovy nemoci
- CN – Crohnova nemoc
- CRP – C-reaktivní protein
- ISZ – idiopatický střevní zánět
ADRESA PRO KORESPONDENCI:
MUDr. Karel Lukáš, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: klukas@vfn.cz
Zdroje
1. Cho SM, Cho SW, Regueiro M. Postoperative Management of Crohn Disease. In: Challenges in Inflammatory Bowel Disease. Med Clin N Amer 2010; 94(1): 179–188.
2. Peyrin-Biroulet L, Léman M. Review article: remission rates achievable by current therapies for inflammatory bowel disease. Aliment Pharmacol Ther 2011; 33(8): 870–879.
3. Prantera C, Scribano ML. Which Type of Treatment Is Advisable in the Prevention of Recurrence After Surgery in Crohn’s Disease? Inflamm Bowel Dis 2008; 14 (S2): S277–S278.
4. Valach V, Kábrt J. Lékařský slovník. Praha: SZN 1961; 402.
5. Rutgeerts P. Review article: recurrence of Crohn’s disease after surgery – the need for treatment of new lesions. Aliment Pharmacol Ther 2006; 24(Suppl 3): 29–32.
6. Stange EF, Travis SP, Vermeire S, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: definition and diagnosis. Gut 2006; 55(Suppl 1): i1–i15.
7. Nos P, DomŹnech E. Postoperative Crohn’s disease recurrence: A practical approach. World J Gastroenterol 2008; 14(36): 5540–5548.
8. Sankey EA, Dhillon AP, Anthony A, et al. Early mucosal changes in Crohn’s disease. Gut 1993; 34 : 375–381.
9. Yamamoto T. Factors affecting recurrence after surgery for Crohn’s disease. World J Gastroenterol 2005; 11 : 3971–3979.
10. Caprilli R, Gassul MA, Escher JC, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: a special situations. Gut 2006; 55(Suppl 1): i36–i58.
11. Ahmed T, Rieder F, Fiocchi C, Achkar JP. Pathogenesis of postoperative recurrence in Crohn’s disease. Gut 2011; 60(4): 553–562.
12. Lindberg E, Jarnerot G, Huidfeldt B. Smoking in Crohn’s disease: effects on localisation and clinical course. Gut 1992; 33 : 779–782.
13. Sutherland LR, Ramcharan S, Bryant H, Fick G. Effect of cigarette smoking on recurrence of Crohn’s disease. Gastroenterology 1990; 98 : 1123–1128
14. Breuer-Katschinski BD, Holländer N, Goebell H. Effect of cigarette smoking on the course of Crohn’s disease. Eur J Gastroenterol Hepatol 1996; 8(3): 225–228.
15. Alvarez-Lobos M, Arostegui JI, Sans M, et al. Crohn’s disease patients carrying NOD2/CARD15 gene variants have an increased and early need for first surgery due to stricturing disease and higher rate of surgical recurrence. Ann Surg 2005; 242(5): 693–700.
16. Munoz-Juarez M, Yamamoto T, Wolf BG, et al. Wide-lumen stapled anastomosis vs.conventional end-to-end anastomosis in the treatment of Crohn’s disease. Dis Colon Rectum 2001; 44 : 20–25.
17. Rutgeerts P, Geboes K, Peeters M, Hiele M, et al. Effect of faecal stream diversion on recurrence of Crohn’s disease in the neoterminal ileum. Lancet 1991; 338 : 771–774.
18. Yamamoto T. Prevention of recurrence after surgery for Crohn’s disease. World J Gastroenterol 2010; 16(43): 5405–5410.
19. Lowney JK, Dietz DW, Birnbaum EH, Kodner IJ, Mutch MG, Fleshman JW. Is there any difference in recurrence rates in laparoscopic ileocolic resection for Crohn’s disease compared with convenctional surgery? Dis Col Rectum 2006; 49 : 58–63.
20. D’Haens G, Geboes K, Ponette E, Penninckx F, Rutgeerts P. Healing of severe recurrent ileitis with azathioprine therapy in patients with Crohn’s disease. Gastroenterology 1997; 112 : 1475–1481.
21. Fazio WW, Marchetti F, Church M, et al. Effects of resection margins on the recurrence of Crohn’s disease in the small bowel. Ann Surg 1996; 224 : 563–573.
22. Ferrante M, deHertog G, Hlavaty T, et al. The value of myenteric plexitis to predict early postoperative Crohn’s disease recurrence. Gastroenterology 2006; 130 : 1595–1606.
23. Rutgeerts P, Geboes K, Vantrappen G, Beyls J, Kerremans R, Hiele M. Predictability of the postoperative course of Crohn’s disease. Gastroenterology 1990; 99 : 956–963.
24. Marteau P, Lemann M, Seksip P, et al. Ineffectiveness of Lactobacillus johnsonii LA1 for prophylaxis of postoperative recurrence in Crohn’s disease. Gut 2006; 55 : 842–847.
25. Williams RG, Wong WD, Rothenberg DA, Goldberg SM. Recurrence of Crohn’s disease after resection. Brit J Surg 1991; 78(1): 10–19.
26. Markowitz J, Grancher K, Kohn N, Lesser M, Daum F. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn’s disease. Gastroenterology 2000; 119 : 895–902.
27. D’Haens, Baert F, van Assche G, et al. Early combined immunosupression or conventional management in patients with newly diagnosed Crohn’s disease. Lancet 2008; 371 : 660–667.
28. Papi C, Luchetti R, Gili L, Montani S, Koch M, Capurso L. Budesonide in the treatment of Crohn’s disease: a metaanalysis. Aliment Pharmacol Ther 2000; 14 : 1419–1428.
29. Hellers G, Löfberg R, Rutgeerts P, et al. Oral budesonide for prevention of recurrence following ileocolonic resection of Crohn’s disease. A one year placebo-controlled study. Gastroenterology 1996; 110: A923.
30. Colombel JF, Rutgeerts P, Malchow H, et al. Interleukin 10 (Tenovil) in the prevention of postoperative recurrence of Crohn’s disease. Gut 2001; 49 : 42–46.
31. Chermesh I, Tamir A, Reshef R, et al. Failure of Synbiotic 2000 to prevent postoperative recurrence of Crohn’s disease. Dig Dis Sci 2007; 52 : 385–389.
32. Camma C, Giunta M, Rosseli M, et al. Mesalamine in the maintenance treatment of Crohn’s disease: a metaanalysis adjusted for confounding variables. Gastroenterology 1997; 113 : 1465–1473.
33. Rutgeerts P, Hiele M, Geboes K, et al. Controlled trial of metronidazole treatment for prevention of Crohn’s disease recurrence after ileal resection. Gastroenterology 1995; 108 : 1617–1621.
34. D’Haens, G, Noman M, van Assche G, et al. Severe postoperative recurrence of Crohn’s disease is significantly reduced with combination therapy metronidazole + azathioprine. J Crohn Colitis (Suppl) 2007; 1 : 4.
35. Cunningham MF, Docherty NG, Coffey JC, Burke JP, O’Connel PR. Postsurgical recurrence of ileal Crohn’s disease: An update on risk factors and intervention points to a central role for impaired host-microflora homeostasis. World Journal of Surgery 2010; 34(7): 1615–1626.
36. Papay P, Reinisch W, Miehsler W, et al. Maintenance therapy with azathioprine/6-mercaptopurine in Crohn’s disease reduces the risk of re-operation particulary in smokers. J Crohns Colitis (Suppl) 2008; 2 : 3.
37. Aberra FN, Lewis JD, Hass D, Rombeau JL, Osborne B, Lichtenstein GR. Corticosteroids and immunomodulators: postoperative infectious complication risk in inflammatory bowel disease patients. Gastroenterology 2003; 125(2): 320–327.
38. Dignass A, Van Assche G, Lindsay JO, et al. European Crohn’s and Colitis Organisation (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management. J Crohns Colitis 2010; 4(1): 28–62.
39. Zachos M, Tondeur M, Griffiths AM. Enteral nutrition therapy for induction of remission of Crohn’s disease. Cochrane Database Syst Rev 2007; 1: CD000542.
40. Renna S, Orlando A, Orlando R, Cottone M. Problems related to postoperative clinical relapse and endoscopic recurrence in Crohn’s disease. Recenti Prog Med 2009; 100(10): 469–478.
41. Saag KG, Teng GG,1 Patkar NM, et al. American College of Rheumatology 2008: Recommendations for the Use of Nonbiologic and Biologic Disease-Modifying Antirheumatic Drugs in Rheumatoid Arthritis. Arthritis & Rheumatism (Arthritis Care & Research) 2008; 59(6): 762–784.
42. Pearson DC, May GR, Fick G, Sutherland LR. Azathioprine for maintenance of remission in Crohn’s disease. Cochrane Database Rev 2000; 2: CD000067.
43. Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359 : 1541–1549.
44. Sandborn WJ, Hanauer SB, Rutgeerts P, et al. Adalimumab for maintenance treatment of Crohn’s disease: results of the CLASSIC II trial. Gut 2007; 56 : 1232–1239.
45. Doherty G, Bennett G, Patil S, Cheifetz A, Moss AC. Interventions for prevention of postoperative recurrence of Crohn’s disease. Cochrane Database Syst Rev 2009; CD006873.
46. Regueiro M. Management and Prevention of Postoperative Crohn’s Disease. Inflamm Bowel Dis 2009; 15 : 1583–1590.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Současný stav diagnostiky karcinomu pankreatu
- Pooperační rekurence Crohnovy nemoci*
- Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
- Sledování metabolismu v intenzivní péči pomocí mikrodialýzy
- Spolek českých lékařů v Praze
- Korelace intraatriálních elektrických potenciálů a tlaků s morfologickými a funkčními ukazateli přetížených síní stanovenými echokardiografií
- Babyboxy v České republice – jak dál?
- Opět je v módě boj o dlouhověkost
- Čtyřnásobné jubileum Bohumila Eiselta (1831–1908)
- Plánované akce odborných složek ČLS JEP
-
Hygiena ženy V
První republika -
Pediatrický den Kliniky dětského lékařství Fakultní nemocnice v Ostravě
Ostrava, 17. září 2011 -
IX. valtické kurzy abdominální a gastrointestinální radiologie
Valtice, 1. až 4. září 2011 -
Co nového ve výzkumu nikotinu a tabáku
Antalya, 8. až 11. září 2011 -
Krajský dermatovenerologický seminář
Rytířsko u Jihlavy, 9. září 2011 -
Biologická léčba IBD v roce 2011
Praha, 9. září 2011 -
8. kongres radiační onkologie
Nový Jičín, 16. až 17. září 2011 -
XIX. výroční sjezd České oftalmologické společnosti ČLS JEP
Ostrava, 22. až 24. září 2011 - Ľudovít M. Jurga a kol.: KLINICKÁ A RADIAČNÁ ONKOLÓGIA
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný stav diagnostiky karcinomu pankreatu
- Pooperační rekurence Crohnovy nemoci*
- Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
-
Hygiena ženy V
První republika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



