-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Thalidomidová epidemie – 50 let poté
Thalidomide epidemics – 50 years after
Thalidomide tragedy and the subsequent epidemics of congenital anomalies is one of the most tragic but also enlightening chapters in the history of modern medicine. Many thousands of children were born with various anomalies – especially with limb deformities – because of the mass usage of thalidomide by pregnant women. The numbers of the spontaneous abortions and fetal deaths will remain unknown forever. In year 2012 we have a sad 50th anniversary of final recognition of thalidomide teratogenous potential. The causes of this tragedy and subsequent actions are summarized in our text.
Key words:
thalidomide, teratogenesis, congenital anomalies.
Autori: Antonín Šípek jr. 1; Antonín Šípek 2,3,4; Eva Maňáková 5
Pôsobisko autorov: Ústav biologie a lékařské genetiky 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha 1; Ústav obecné biologie a genetiky, 3. lékařská fakulta Univerzity Karlovy, Praha 2; Sanatoriom Pronatal s. r. o., Praha 3; Oddělení lékařské genetiky, Thomayerova nemocnice s poliklinikou, Praha 4; Česká teratologická informační služba, Ústav histologie a embryologie, 3. lékařská fakulta Univerzity Karlovy, Praha 5
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 579-581
Kategória: Speciální sdělení
Súhrn
Thalidomidová aféra a s ní způsobená epidemie vývojových vad patří k jedné z nejsmutnějších, ale zároveň i nejpoučnějších kapitol moderního lékařství. V souvislosti s užíváním thalidomidu těhotnými ženami se na přelomu padesátých a šedesátých let 20. století po celém světě narodilo několik tisíc dětí s různými typy vývojových vad, především končetin. Počty spontánních potratů i intrauterinních úmrtí, která byla způsobena touto látkou, nebudou již nikdy vyčíslena. V roce 2012 si připomínáme smutné 50. výročí roku 1962, kdy došlo k definitivnímu rozpoznání etiologie této celosvětové tragédie. Jaké byly příčiny této události a jaká opatření byla následně přijata, je podrobně rozebráno v tomto článku.
Klíčová slova:
thalidomid, teratogeneze, vývojové vady.
Dvacáté století znamenalo pro rozvoj obecné i klinické teratologie obrovský pokrok. Během něho byly přineseny důkazy o účinku teratogenů jak fyzikální, tak i biologické a chemické povahy. Již počátkem 20. století byly prováděny četné pokusy s ionizujícím (rentgenovým) zářením u březích hlodavců, jejichž výsledkem bylo zvýšení četnosti určitých vývojových vad, zejména mikrocefalie, u potomků exponovaných samic. Právě tato vývojová vada byla také nejčastěji pozorována po atomových útocích na japonská města Hirošimu a Nagasaki v roce 1945 (1). Co se týká biologických teratogenů, nesmíme opomenout rozsáhlou epidemii zarděnek, z nichž ta australská z počátku čtyřicátých let 20. století vedla k rozpoznání teratogenního potenciálu rubiviru, jak jej popsal sir Norman McAlister Gregg (2). A nakonec je nutné zmínit i teratogen chemický, léčivo s názvem thalidomid.
PŘÍBĚH THALIDOMIDU
Thalidomid byl poprvé syntetizován v roce 1954 v továrně Chemie Grünenthal v západoněmeckém městě Cáchy (tehdejší SRN). Klinické studie prokázaly, že účinná látka je efektivním sedativem. Látka byla nabízena pod různými firemními názvy – v Německu jako Contergan (od roku 1957), ve Velké Británii jako Distavil (od roku 1958), v Kanadě jako Kevadon (rovněž 1958) apod. (1). Lék byl využíván nejen jako tišící a uklidňující prostředek, ale bohužel také k léčbě ranních nevolností těhotných žen (1, 3). Plíživý, avšak dramatický efekt na sebe nenechal dlouho čekat. V současné době se předpokládá, že se následkem užívání thalidomidu po celém světě narodilo přibližně 10 000 dětí s různými variantami vývojových vad (3, 4). Přesný počet malformovaných dětí, stejně jako počty spontánních potratů a mrtvě rozených dětí, ke kterým došlo vinou užívání thalidomidu v průběhu těhotenství, nejsou k dispozici, neboť v této době ve světě neexistovaly národní či nadnárodní organizace, které by četnost vrozených vývojových vad zkoumaly a analýze četností se věnovaly (5). Stejně tak nebyl sledován průběh a výsledek těhotenství po expozici léku v jeho průběhu. Typický komplex vývojových vad (tzv. thalidomidový syndrom) tvoří různé redukční vady končetin, především pak horních. Relativně typická je pro tento syndrom fokomelie (6). Thalidomidový syndrom ovšem dále zahrnuje celou řadu dalších vývojových vad, které zasahují prakticky všechny orgánové soustavy: oči, uši, svaly, srdce, plíce, urogenitální trakt a trávicí soustavu (7).
ODHALENÍ
V roce 2012 uplyne přesně 50 let od roku 1962, kdy byl thalidomid definitivně odhalen jako přímá příčina této teratologické epidemie. Od zahájení hromadného prodeje v roce 1957 tak uplynulo celých 5 let. V této souvislosti je zapotřebí zmínit především následující fakta:
- Na přelomu padesátých a šedesátých let 20. století neexistovaly národní, či nadnárodní struktury, které by se výskytem vývojových vad podrobněji zabývaly a jejich výskyt monitorovaly. Specializované registry vrozených vývojových vad začaly vznikat až v průběhu šedesátých let 20. století – často právě jako reakce na thalidomidovou epidemii (8) (tab. 1).
- Neexistovaly registry, které by exponovaná těhotenství prospektivně sledovaly a mohly včas odhalit malformaci jako nežádoucí účinek expozice konkrétnímu léku.
- Dostupnost informací byla o poznání horší než v současné době. Neexistoval internet, a tudíž ani internetové databáze, či online verze odborných biomedicínských periodik. Masovost neobvyklého výskytu redukčních vad končetin tak nebyla zprvu pro odbornou veřejnost vůbec patrná.
- Samotné užívání thalidomidu v těhotenství nevyústí vždy ve stejný fenotyp vývojové vady. Teratogenní účinek thalidomidu je (jako u řady jiných teratogenů) závislý na dávce a na době působení. Neplatí tedy přímá úměra, že z každého těhotenství s expozicí thalidomidu se narodilo dítě s typickou thalidomidovou embryopatií. Odhadovaný výskyt malformací při expozici během kritické periody dosahoval přibližně 20 % (1).
- Obvyklý protokol preklinických a klinických zkoušek nové účinné látky byl odlišný od dnešních (mnohem přísnějších) standardů.
Tab. 1. Přehled prvních oficiálních registrů vrozených vývojových vad ve světě (dle 5) 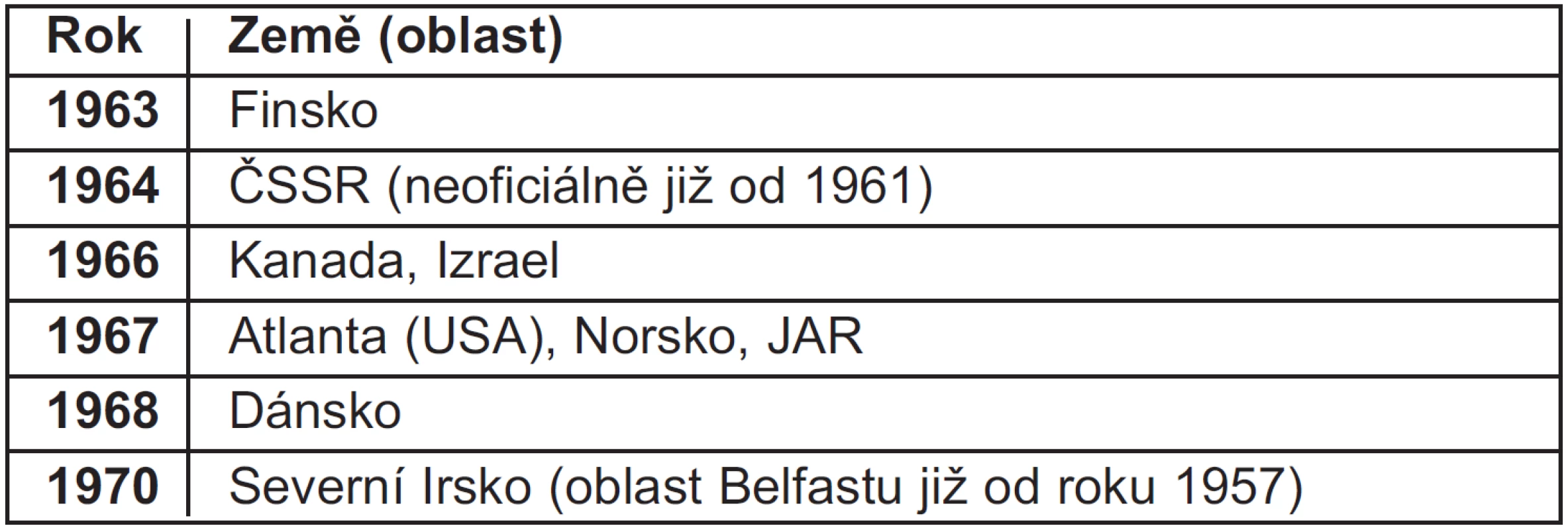
Dnes již těžko zjistíme, kdo opravdu jako první pomyslel na souvislost neobvykle vysoké četnosti nových případů vrozených vývojových vad končetin a nového léku, běžně užívaného i v průběhu těhotenství. Za první zmínku v literatuře je tak považován krátký článek o možné souvislosti užívání thalidomidu a vzniku vývojových vad končetin publikovaný koncem roku 1961 australským lékařem Williamem McBridem v časopisu Lancet (9). Odpověď na sebe nenechala dlouho čekat. Již v lednu 1962 na tento poznatek odpovídá německý lékař (a jeden z nejvýznamnějších teratologů 20. století) Widukind Lenz, neboť i v Německu byla takováto možná spojitost pozorována a Lenz sám o ní již v Německu hovořil na několika lokálních konferencích (10). Poté se již události daly konečně do pohybu. Následoval zákaz thalidomidu a jeho stažení z prodeje. Jeho užívání za sebou zanechalo přibližně 10 000 dětí s různě závažnými vrozenými vývojovými vadami (z nichž řada zemřela již v průběhu prvních let života) a blíže nespecifikované množství intrauterinních úmrtí a spontánních potratů (1).
Pokud mluvíme o odhalení – nesmíme zapomenout na zemi stojící mimo thalidomidovou epidemii, a to Spojené státy americké. V této zemi nebyl rozhodnutím FDA (Food and Drug Administration) prodej thalidomidu povolen. Rozhodnutí FDA měla na svědomí mladá úřednice Frances Oldham Kelseyová, která vstup thalidomidu na americký trh zamítla, především pro nedostatky v dokumentaci týkající se toxicity látky na zvířatech, podrobností o klinických studiích a detailech o chronické toxicitě (1). Přesně tyto „detaily“ budou v budoucnosti tvořit zcela nezbytnou součást veškeré dokumentace nutné k zaregistrování jakéhokoliv léčivého přípravku. V tu dobu však v řadě zemí stačilo k registraci mnohem méně a testování teratogenicity nebylo nutné vůbec…
NÁSLEDKY THALIDOMIDOVÉ EPIDEMIE
Thalidomidová epidemie zanechala mnoho stop v moderní historii medicíny a také mnoho stop v životě tisíců postižených rodin a jejich příbuzných.
V průběhu šedesátých let 20. století začaly postupně vznikat první registry vrozených vývojových vad – mezi prvními v roce 1964 i ten československý (5, 11). Vznik těchto organizací byl thalidomidovou epidemií více či méně ovlivněn. Jejich úkolem bylo (a je i dnes) monitorovat četnosti jednotlivých typů vrozených vývojových vad a hlavně změny četností v průběhu času, aby bylo možné jakýkoliv nový nárůst četnosti určitých vad včas identifikovat (11). Tyto registry včetně Národního registru vrozených vad České republiky fungují většinou dodnes, přičemž incidence vývojových vad je dále vyhodnocována i na celoevropské (organizace EUROCAT) či celosvětové úrovni (organizace ICBDSR). Čtvrtletní hlášení incidencí vrozených vývojových vad organizaci ICBDSR zůstává jednou z povinností Národního registru vrozených vad České republiky i v 21. století (11).
V roce 1990 byly založeny organizace ENTIS (European Network of Teratology Information Services) pro Evropu a OTIS (Organization of Teratology Information Specialists) pro USA a Kanadu, které se zabývají sběrem a vyhodnocováním dat získaných sledováním těhotenství náhodně exponovaných konkrétnímu léku. V rámci primární prevence rovněž poskytují přesné a na důkazu založené informace o vlivu expozice během těhotenství na vývoj plodu, a to buď pacientům, nebo poskytovatelům léčebné péče (12, 13).
Thalidomid představoval zářný příklad zákeřnosti chemického teratogenu. Jeho projevy byly různorodé, závislé na celé řadě proměnných, a hlavně na živočišném druhu. Díky thalidomidu byly stanoveny základní teratologické postuláty, ovlivňující fenotypové projevy po expozici teratogenu:
- Vliv dávky (výsledný projev teratogenu ve fenotypu je závislý na velikosti dávky; tento efekt je obvykle prahový),
- Vliv času (výsledný projev teratogenu ve fenotypu je závislý na časové fázi prenatálního vývoje, ve kterém teratogen začal působit a také na celkové délce jeho působení),
- Vliv genotypu (výsledný projev teratogenu ve fenotypu je závislý na genotypu jak matky, tak i plodu; markantní rozdíly v genotypu různých živočišných druhů mohou vést až ke zcela odlišným účinkům stejné dávky teratogenu).
Bylo také odhaleno množství molekulárně-biologických mechanismů, které jsou odpovědné za vlastní teratogenezi. Konkrétně v případě thalidomidu je zmíněna celá řada potenciálních mechanismů: například vazba na CG sekvence promotoru genu pro IGF-1 (Insulin-like growth factor 1), inhibice FGF2 proteinu (Fibroblast growth factor 2) (14), souvislost s oxidativním stresem (15) – a nyní také potenciální inaktivace proteinu Cereblon, který se podílí na tvorbě komplexu důležitého pro expresi genu FGF8 (Fibroblast growth factor 8), který se (podobně jako výše zmíněné) přímo podílí na prenatálním vývoji končetin (4, 16).
Jednou z příčin thalidomidové epidemie byla i druhově specifická teratogenita, neboť reprodukční toxicita thalidomidu byla u laboratorních hlodavců zcela zanedbatelná, zatímco u lidí (ale například i u primátů) se projevuje při mnohem nižších dávkách (1). Není divu, že se všeobecné podmínky pro preklinické testování i klinické studie nových léčiv celosvětově výrazně zpřísnily a studie na zvířatech musí již být prováděny na více živočišných druzích (1).
Thalidomidová epidemie po sobě nenechala pouze nové poznatky, ale především tzv. „thalidomidové děti“. Život mnoha tisíců dětí (ale i jejich rodin) byl nenávratně poznamenán, a to na celý život. V roce 2001 (tedy přibližně 40 let od tragédie) žilo stále dle odhadů okolo 5000 thalidomidových dětí (3). Přes veškerá odškodnění a speciální sociální dávky (lišící se dle jednotlivých zemí) není ani dnes jejich život jednoduchý, neboť zejména redukční deformity končetin jsou pro život velmi limitující (3, 17). Dle posledních studií se řada těchto lidí stále cítí být značně zranitelnými a navíc mají řadu bolestivých komplikací, často zaviněných netypickým používáním zdravých končetin (ať již horních či dolních) k náhradě funkce chybějícího/nefunkčního páru končetin (3, 17).
Na závěr nesmíme opominout fakt, že thalidomid je znovu zpět. Již od přelomu osmdesátých a devadesátých 20. století se objevovaly studie, poukazující na možné využití thalidomidu v léčbě některých onkologických onemocnění (18). Jako lék je nyní registrován v mnoha zemích světa v řadě indikací – například pro léčbu mnohočetného myelomu, samozřejmě za dodržení velice přísných opatření (19) – zejména z pohledu lidské reprodukce – a to pro pacienty ženského i mužského pohlaví (určité množství thalidomidu se totiž přenáší i spermatem) (20). Nedostatečná kontrola přístupu k tak účinnému teratogenu by mohla vyvolat novou vlnu výskytu malformací. Dostupnost thalidomidu a použití při léčbě lepry v Brazílii již bylo provázeno novým výskytem thalidomidové embryopatie. Sice výjimečně, ale účinná kontrola je v každém případě na místě (21, 22).
ZÁVĚR
Thalidomidová epidemie představovala nepochybně jednu z nejsmutnějších epizod moderní historie medicíny. Přestože přesné počty obětí již nikdy nebudou vyčísleny – zůstává tato událost varováním pro současnost i budoucnost farmakoterapie. Světlou stránkou pak zůstává pokrok a nové poznatky v oblasti teratologie, farmakologie i epidemiologie, které jsme si z této události odnesli. Veškeré kontrolní mechanismy by dnes již měly být nastaveny tak, aby se katastrofa podobného rozměru již nikdy neopakovala. Farmakoterapie tak dostala novou šanci a thalidomid … ten ji dostal také. I když obavy z možného opakování epidemie malformací brání užití nových, účinných a možná bezpečnějších léků, je strategie předběžné opatrnosti určitě na místě.
Adresa pro korespondenci:
MUDr. Antonín Šípek jr.
Ústav biologie a lékařské genetiky 1. LF UK a VFN
Albertov 4, 128 01 Praha 2
e-mail: antonin.sipek@lf1.cuni.cz
Zdroje
1. Kalter H. Teratology in the 20th century: environmental causes of congenital malformations in humans and how they were established. Neurotoxicol Teratol 2003; 25(2): 131–282.
2. Gregg NM. Congenital cataract following German measles in the mother. 1941. Aust N Z J Ophthalmol 1991; 19(4): 267–276.
3. Bent N, Tennant A, Neumann V, Chamberlain MA. Living with thalidomide: health status and quality of life at 40 years. Prosthet Orthot Int 2007; 31(2): 147–156.
4. Ito T, Handa H. Deciphering the mystery of thalidomide teratogenicity. Congenit Anom (Kyoto) 2012; 52(1): 1–7.
5. ICBDMS: Congenital malformations worldwide: a report from the International Clearinghouse for Birth Defects Monitoring Systems. Amsterdam: Elsevier 1991; 220 s.
6. Lenz W, Knapp K. Thalidomide embryopathy. Arch Environ Health. 1962; 5 : 100–105.
7. Smithells RW, Newman CG. Recognition of thalidomide defects. J Med Genet 1992; 29(10): 716–723.
8. Kučera J. Populační teratologie. Praha: Avicenum 1989; 325 s.
9. McBride WG. Thalidomide and congenital abnormalities. Lancet 1961; 2 : 358.
10. Lenz W. Thalidomide and congenital abnormalities. Lancet 1962; 1 : 45.
11. Šípek A, Gregor V, Horáček J, Mazánková V, Langhammer P, Šípek A. jr. Historie a současnost registrace vrozených vad v České republice. Čas. Lék. čes. 2009; 148 : 505–509.
12. Chambers C. The role of Teratology Information Services in screening for teratogenic exposures: Challenges and opportunities. Am J Med Gen Part C 2011; 157 : 195–200.
13. Clementi M, DiGianantonio E, Ornoy A. Teratology Information Services in Europe and their contribution to the prevention of congenital anomalies. Community Genet 2002; 5 : 8–12.
14. Stephens TD, Fillmore BJ. Hypothesis: Thalidomide embryopathy – proposed mechanism of action. Teratology 2000; 61 : 189–195.
15. Knobloch J, Rüther U. Shelding light on an old mystery. Cell Cycle 2008; 7 : 1121–1127.
16. Ito T, Ando T, Ogura T, Hotta K, Imamura Y, Yamaguchi Y, Handa H. Identification of a primary target of thalidomide teratogenicity. Science 2010; 327 : 1345–1350.
17. O’Carroll A, O’Reilly F, Whitford DL. What has happened to people affected by thalidomide 50 years on? Ir J Med Sci 2011; 180(2): 475–478.
18. Yang Q, Khoury MJ, James LM, et al. The return of thalidomide: are birth defects surveillance systems ready? Am J Med Genet 1997; 73 : 251–258.
19. Zeldis JB, Williams BA, Thomas SD, Elsayed ME. S.T.E.P.S. A comprehensive program for controlling and monitoring access to thalidomide. Clinical Therapeutics 1999; 21 : 319–330.
20. Celgane Europe Ltd. Thalidomide Celgene – Souhrn údajů o přípravku. 2009. Dostupné na: http://www.ema.europa.eu [cit. 7. 9. 2012].
21. Schuler-Faccini L, Soares RC, de Sousa AC, Maximino C, Luna E, Schwartz IV, Waldman C, Castilla EE. New cases of thalidomide embryopathy in Brazil. Birth Defects Res A Clin Mol Teratol 2007; 79 : 671–672.
22. Vianna FS, Lopez-Camelo JS, Leite JC, Sanseverino MT, Dutra Mda G, Castilla EE, Schüler-Faccini L. Epidemiological surveillance of birth defects compatible with thalidomide embryopathy in Brazil. PLoS One 2011; 6: e21735.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Serendipita v medicíně
- Úloha infekce v patogenezi obezity
- Akútne multiorgánové zlyhanie po kolonoskopii s polypektómiou
- Využívání diagnóz souvisejících s užíváním tabáku v České republice
- Plánované akce odborných složek ČLS JEP
- Thalidomidová epidemie – 50 let poté
- Exil československých lékařů do Švédska po roce 1968
- Nový pohled na střevní imunitu
- 7th International congress of miniinvasive and robotic surgery, 6th Interactive congress of the wound healing
- Abstrakta
- Spolek lékařů českých v Praze
- Pracovní konference „Metody a prostředky POCT“ Olomouc, 10. října 2012
- Celostátní sjezd České a Slovenské společnosti alergologie a klinické imunologie Liberec, 10. až 13. října 2012
- 12. konference Odborné společnosti vojenských lékařů, farmaceutů a veterinárních lékařů ČLS JEP Hradec Králové, 24. a 25. října 2012
- Den uveitid 2012, Průhonice, 26. října 2012
- 6. konference akné a obličejové dermatózy, Brno, 2. listopadu 2012
- XIV. hradecké pediatrické dny, Hradec Králové, 2. až 3. listopadu 2012
- Slavnostní předání cen České lékařské společnosti JEP za nejlepší knižní publikace za rok 2011
- Mareš J. : POSTTRAUMATICKÝ ROZVOJ ČLOVĚKA
- Pokyny pro autory Časopisu lékařů českých
- Laueráti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Thalidomidová epidemie – 50 let poté
- Akútne multiorgánové zlyhanie po kolonoskopii s polypektómiou
- Abstrakta
- Úloha infekce v patogenezi obezity
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



