-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
XV. celostátní konference DNA diagnostiky
Autoři: M. Turnovec; R. Brdička
Působiště autorů: Ústav hematologie a krevní transfuze 1. LF UK, Praha ; Ústav lékařské biologie a genetiky 2. LF UK, Praha
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 152-171
Kategorie: Abstrakta
Již XV. celostátní konference DNA diagnostiky se 24. až 25. listopadu 2011 tentokrát po několika letech vrátila opět do Prahy. Díky laskavosti vedení Ústavu molekulární genetiky Akademie věd České republiky jsme pro konferenci mohli využít auditorium Milana Haška včetně přilehlých prostor. Přednáškový sál pojme téměř 300 účastníků a počtem registrovaných účastníků (274) jsme se k tomuto počtu přiblížili. Sál je vybaven moderním technickým zázemím a je obhospodařován společností Czech-In, která zajišťuje všechny s pořádáním konferencí spojené služby. Tato společnost náročným úkolům spojeným s pořádáním konference spojených obstála na výbornou, jistě také díky tomu, že má již v těchto záležitostech dostatek zkušeností.
Dostatečné prostory umožnily rovněž prezentaci posterových sdělení (21) a také aktivní účast sponzorů (19), kteří zde mohli mít i vlastní stánky.
Počet přihlášených (registrace díky sponzorským příspěvkům nebyla zpoplatněna) dosáhl 274. V obou dnech zasedání se zúčastnili v počtu dosahujícím dvou set s tím, že někteří si pochopitelně vybrali jen jeden ze dnů programu podle svého zájmu.
Seminář převážně edukativního rázu se původně měl konat ve velké zasedací místnosti děkanátu 1. lékařské fakulty, ale později musel být vzhledem k velkému zájmu přesunut do auditoria Lékařského domu, které účastníci zcela zaplnili. Zabýval se moderními technologiemi sekvenování, které začínají pronikat i do České republiky, bohužel ve zcela nekoordinované a z tohoto hlediska značně neekonomické podobě. Přednášky přinesly kromě základních informací i kritický pohled na možnosti těchto technologií, který je z tohoto hlediska zvlášť cenným zdrojem informací pro ty, kteří o nákupu takových strojů uvažují.
Abstrakta přednášek z vlastní konference i předkonferenčního semináře jsou k dispozici zájemcům na www.dnakonference.cz; a později se přesunou na web Společnosti lékařské genetiky (www.slg.cz). Brzy na web doplníme i samotné přednášky z předkonferenčního semináře a snad se nám povede doplnit i přednášky z konference.
MUDr. Marek Turnovec
Ústav lékařské biologie a genetiky 2. LF UK, Praha
prof. MUDr. Radim Brdička, DrSc.
Ústav hematologie a krevní transfuze 1. LF UK, Praha
Přednášky
RNA diseases
David Staněk
Oddělení biologie RNA, Ústav molekulární genetiky AV ČR, v. v. i., Praha
Exprese naprosté většiny lidských genů zahrnuje krok nazývaný RNA sestřih, při kterém se vyštěpí nekódující úseky a spojí sekvence obsahující informaci pro syntézu bílkovin. Rozpoznání hranice mezi kódujícími a nekódujícími úseky je založeno na celé řadě vazeb mezi mRNA a sestřihovými proteiny či snRNA. Mutace, které ovlivňují tyto vazby, mohou mít negativní vliv na RNA sestřih i na vkládání jednotlivých kódujících sekvencí. Mutace v základních sestřihových proteinech způsobují dědičné onemocnění oka retinitis pigmentosa. Naše výsledky ukazují, že mutace v proteinu hPrp31 inhibuje správné formování aktivních sestřihových komplexů. Naopak mutace v hBrr2 nemá vliv na skládání sestřihových komplexů, ale ovlivňuje kinetiku sestřihové reakce a alternativní sestřih. Dále je diskutován vliv mutací SMN na formování sestřihových komplexů a mutace v regulačních mRNA sekvencích, které negativně ovlivňují RNA sestřih.
Non-kontinuální duplikace v DMD genu v rodině pacienta s Duchennovou svalovou dystrofií
Iveta Valášková1, 2, Václava Curtisová3, Jitka Kadlecová1, 2, Renata Gaillyová1, 2
1Oddělení lékařské genetiky FN, Brno
2Lékařská fakulta MU, Brno
3Ústav lékařské genetiky a fetální medicíny FN, Olomouc
Duchennova svalová dystrofie (DMD) onemocnění vázané na chromozom X, které postihuje přibližně jednoho z 3600 až 6000 živě narozených chlapců, patří rychlostí progrese a prognózou k nejzávažnějším svalovým chorobám. Typické pro ni jsou pseudohypertrofie lýtek, kolébavá chůze v hyperlordose a pro kontraktury Achillových šlach s chůzí po špičkách. Asi u 30 % dětí je popsána mentální retardace. Schopnost samostatného pohybu mizí mezi 8. až 13. rokem. Na vozíku se obvykle rychle rozvíjí skolióza, později i kardiomyopatie. Mezi 20. až 30. rokem se objevují ventilační obtíže, často pak s letálním koncem. Svalová biopsie ukazuje degenerativní změny, proliferaci tukové tkáně, ložiska nekrózy i regenerace. Jednoznačným diagnostickým průkazem je zjištění absence dystrofinu a určení typu mutace dystrofinového genu (DMD; locus Xp21.2).
Duchennova svalová dystrofie je ve většině případů způsobena frame-shift nebo in-frame delecemi a duplikacemi v DMD genu. Intragenové delece jsou nejfrekventovanější přestavbou u postižených chlapců (65 % pacientů), ale duplikace zahrnující až několik exonů se také vyskytují v signifikantním počtu případů (5–15 %).
Multiplex Ligation-dependent Probe Amplification (MLPA) je metoda aktuálně používaná k průkazu delecí a duplikací všech 79 exonů DMD genu. Pomocí této metody jsme detekovali u suspektní DMD přenašečky raritní komplex genové přestavby, a to dvě non-kontinuální duplikace zahrnující exony 55 a 58. Tento nález byl verifikován pomocí metody quantitatve High-Resolution Meeting Curve Analysis (qHRM), sekvenováním a vazebnou analýzou. Byla provedena analýza DMD genu u matky, zdravého bratra a plodu mužského pohlaví probandky. Výsledky těchto metodických postupů a zjištěné DMD genotypy členů rodiny probandky nám umožnily navrhnout teoretický model formování této genetické varianty.
Paralelný prístup v molekulárnej diagnostike pletencových muskulárnych dystrofií
Zoja Vlčková1, Peter Iglauer3, Arpád Nagy4, Juraj Mešťánek4, Martina Hikkelová2, Andrej Genčík2, Martin Genčík1
1Praxis für Humangenetik, Wien, Rakousko
2Medgene, Bratislava, Slovenská republika
3Diagenos, Osnabrück, Rakousko
4ADINIS, Trnava, , Slovenská republika
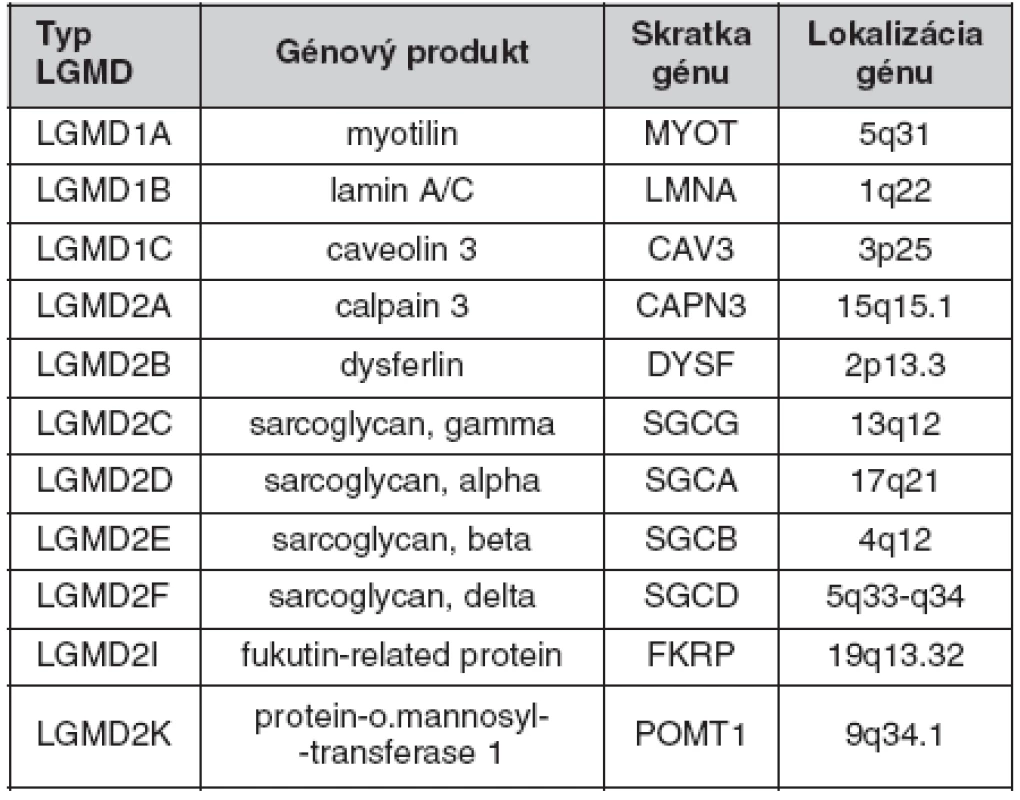
Progresívne muskulárne dystrofie zahŕňajú X-viazané dystrofínopatie, autozomálne recesívne a menej časté autozomálne dominantné pletencové muskulárne dystrofie, tzv. LGMD. Oboje sa u postihnutých jedincov prejavujú úbytkom svalovej hmoty v oblasti ramenného a panvového pletenca a postupným šírením svalovej slabosti aj na distálne svaly. V počiatočnom štádiu ich prakticky nie je možné od seba klinicky odlíšiť. Hlavnými diagnostickými nástrojmi sú ďalej analýza rodokmeňa, biopsia svalu a molekulárno-genetická analýza dystrofínového génu a skupiny génov zodpovedných za rôzne formy LGMD.
Tento príspevok stručne referuje o stave molekulárnej diagnostiky pletencových muskulárnych dystrofií na našom pracovisku. Doterajší prístup štandardne pozostával z priameho sekvenovania kódujúcich a splice-relevantných oblastí príslušného génu Sangerovou metódou v kombinácii s MLPA vyšetrením dotyčných oblastí na prípadné veľké delécie/duplikácie. Týmto spôsobom bolo vyšetrených 33 vzoriek pacientov s podozrením na LGMD, ktoré k nám boli v uplynulom období zaslané a u ktorých boli vylúčené dystrofínopatie, s nasledujúcimi výsledkami: 21 negatívnych nálezov, 12 pozitívnych nálezov; z toho u 7 pacientov (rodinných príslušníkov) bolo potvrdené prenášačstvo jednej z recesívnych foriem LGMD, u 5 pacientov bola diagnóza AR LGMD potvrdená nálezom dvoch kauzálnych mutácií. Nájdené boli tri v literatúre popísané mutácie v géne CAPN3: p.Thr184ArgfsX36, p.Phe200_Leu204del, p.Thr417Met; jedna v literatúre popísaná mutácia v géne SGCG: p.Phe175LeufsX20; jedna dosiaľ nepopísaná mutácia v géne SGCG: p.Thr251AspfsX68.
Súčasťou doterajšej diagnostickej stratégie v prípade negatívneho nálezu a pretrvávajúceho podozrenia na niektorú z foriem LGMD bolo sukcesívne vyšetrovanie ďalších zodpovedných génov. Vďaka zavedeniu metód sekvenovania druhej generácie pomocou prístroja Roche GS Junior v našom laboratóriu a ich úspešnej aplikácii v molekulárnej diagnostike napr. neurokutánnych ochorení (NF, TSC), generalizovanej epilepsie (GEFS+) a i., aj v prípade LGMD nahrádzame tento sukcesívny prístup paralelným vyšetrením vo forme génového panelu LGMD (tab. 1). V prípade pacienta, ktorý nemá vylúčenú dystrofínopatiu, je možné do panelu zahrnúť aj DMD. Z praktického hľadiska očakávame celkové zefektívnenie diagnostiky LGMD, a to predovšetkým zvýšenie záchytnosti. Pomerne nízke počet potvrdených pozitívnych pacientov (štatistiku skresľujú vyšetrovaní rodinní príslušníci) môže byť spôsobený nedovyšetrením ďalších génov z kategórie LGMD, a teda predčasným ukončením ďalšej finančne a časovo náročnej diagnostiky. Tento problém je možné eliminovať systematickým využívaním masívne paralelných metód sekvenovania druhej generácie, ktoré umožňujú výrazné zníženie celkových nákladov, ako aj dĺžky trvania vyšetrenia.
Identifikace nové mutace v genu OPA1 podmiňující autozomálně dominantní atrofii optiku, hluchotu, ptózu, oftalmoplegii, polyneuropatii a ataxii
Petra Lišková1,2, Markéta Tesařová3, Hana Melšová4, Pavel Diblík2, Petr Těšina5, Olga Ulmanová6, Marcela Votruba7
1Laboratoř biologie a patologie oka ÚDMP, 1. LF UK a VFN, Praha
2Oční klinika 1. LF UK a VFN, Praha
3Laboratoř pro studium mitochondriálních poruch KDDL, 1. LF UK a VFN, Praha
4Neurologická ambulance, Děčín
5Ústav molekulární genetiky AV ČR, v.v.i., Praha
6Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN, Praha
7School of Optometry and Vision Sciences, Cardiff University, Velká Británie
Úvod. Extraokulární neurologická symptomatologie u pacientů s autozomálně dominantní atrofií optiku podmíněnou mutacemi v opa1 genu byla nedávno popsána až u 20 % postižených jedinců. Gen OPA1 se nachází na chromozomu 3q29 a skládá se ze 30 exonů. Protein OPA1 je nezbytný pro fúzi vnitřní mitochondriální membrány.
Metodika. Osm členů jedné rodiny s multisystémovým postižením absolvovalo neurologické, oftalmologické a audiometrické vyšetření. Molekulárně genetická analýza byla provedena u šesti z nich. Sekvenovány byly všechny exony a přilehlé intronové oblasti genu OPA1.
Výsledky. U šesti vyšetřených členů rodiny byla zaznamenána značná fenotypová heterogenita s variabilní kombinací a stupněm zrakového, sluchového a neurologického postižení. Prvním příznakem byla u většiny jedinců porucha vizu s počátkem v první až třetí dekádě a variabilní stupeň ptózy a/nebo oftalmoplegie. Percepční hluchota, polyneuropatie a ataxie se rozvinuly později, typicky ve třetí a čtvrté dekádě. V genu OPA1 byla zjištěna nová mutace c.1345A>C v exonu 14 vedoucí na proteinové úrovni k záměně threoninu v pozici 449 za prolin (p.Thr449Pro). Tato změna segregovala v dané rodině s projevy onemocnění. In silico analýza podpořila patogenní úlohu této nově zjištěné varianty.
Závěr. Identifikace nové patogenní varianty v genu OPA1 u námi studované rodiny potvrzuje úlohu tohoto genu v mitochondriálním metabolismu. Naše práce rozšiřuje spektrum mutací OPA1, pro které lze provést korelaci genotypu s fenotypem. Molekulárně genetická příčina autozomálně dominantní atrofie optiku byla u českých pacientů popsána poprvé.
Práce byla podpořena výzkumnými záměry MSM0021620806 a MSM0021620849.
Analýza génu GJB2 u pacientov s bilaterálnou senzorineurálnou poruchou sluchu na Slovensku – úvod do štúdie
Ivica Mašindová1, Lukáš Varga1, 2, Miloslava Hučková1, Gabriela Pavlovčinová3, Martina Balogová1, Jana Jakubíková3, Iwar Klimeš1, Milan Profant2, Daniela Gašperiková1
1Laboratórium diabetu a porúch metabolizmu, Ústav experimentálnej endokrinológie SAV, Bratislava, Slovenská republika
2I. Otorinolaryngologická klinika LF UK, Bratislava, Slovenská republika
3Detská ORL klinika LF UK, Bratislava, Slovenská republika
Úvod. Prevalencia vrodenej senzorineurálnej straty sluchu sa celosvetovo pohybuje okolo 1 : 1000 živonarodených detí. Až u polovice prípadov vzniká v dôsledku genetických príčin v jednom z doposiaľ 50 známych génov. Zmeny v géne GJB2 (kódujúcom konexín 26) sú najčastejšou príčinou tejto poruchy sluchu, s rôznou frekvenciou výskytu v rámci etnických skupín. V súčasnosti je popísaných približne 100 patogénnych mutácií génu GJB2, ktoré sa vyznačujú najmä autozómovo recesívnym (80 %), ale aj autozómovo dominantným (20 %) spôsobom dedičnosti. Poškodenie sluchu sa u nositeľov recesívnych mutácií prejaví, ak je daná mutácia v homozygotnej forme alebo vo forme zloženého heterozygota, kedy každá alela génu GJB2 nesie inú mutáciu. Senzorineurálna porucha sluchu môže však vzniknúť aj dôsledkom mutácií prítomných v dvoch odlišných génoch (GJB2, GJB6).
Cieľ. Cieľom tejto práce bolo vykonanie DNA analýzy génu gjb2 a gjb6, určenie mutačného spektra a percenta najčastejších mutácií v študovanom súbore.
Metódy. Náš súbor tvorilo 150 probandov s bilaterálnou nesyndrómovou senzorineurálnou poruchou sluchu z I. ORL kliniky LF UK, detskej ORL kliniky LF UK a internátnych škôl pre deti so sluchovým postihnutím v Bratislave, vo veku 2–56 rokov. Všetci jedinci boli podrobení analýze oboch exónov génu GJB2 metódou priameho obojsmerného sekvenovania a 85 jedincov súboru bolo analyzovaných aj metódou MLPA. Metóda MLPA bola použitá na detekciu najčastejších „hot-spot“ mutácií a delécií v géne GJB2 a GJB6 ako aj delécií ďalších génov spôsobujúcich poruchy sluchu.
Výsledky. V géne gjb2 u 150 probandov súboru bolo identifikovaných 10 mutácií (c.35delg, c.101t>c, c.167delt, c.1 3201g>a, c.71g>a, c.109g>a, c.229t>a, c.313_326del, c.269t>c, c.224g>a), niekoľko polymorfizmov (c.79g>a, c.380g>a, c.457g>a, c.475g>a, c*84t>c) a jeden variant (c.*3C>A). Uvedené mutácie sa v homozygotnej forme vyskytovali u 26 % jedincov a vo forme zložených heterozygotov u 12 %. U týchto dvoch skupín bola potvrdená genetická príčina vzniku poruchy sluchu. Samotné heterozygotné mutácie boli prítomné u 8 % jedincov, ktorých prítomnosť však nie je dostačujúca na prejavenie sa poruchy sluchu. Podiel negatívnych probandov, bez nálezu aspoň jednej patogénnej mutácie dosahoval približne 52 %. Najfrekventovanejšou mutáciou nášho súboru bola delécia c.35delG (61 jedincov – 40,7 %), druhou intrónová substitúcia c.1-3201G>A (8 jedincov – 5 %) a treťou v poradí mutácia indického pôvodu c.71G>A (6 jedincov – 3,8 %). U jedného probanda s mutáciou v géne GJB2 (c.35delG) bola pomocou metódy MLPA identifikovaná aj delécia v géne GJB6 (delD13S1830), u ktorého kombinácia týchto dvoch mutácií spôsobila poruchu sluchu.
Záver. Výsledky dna analýzy našej štúdie podali nielen obraz o zastúpení jednotlivých mutácií tohto génu v študovanom súbore, ale umožnili aj potvrdiť genetickú príčinu poruchy sluchu u 57 pacientov, ktorá je kľúčovou informáciou pre genetické poradenstvo, klinickú prognózu a do budúcna i možnú personalizovanú terapiu.
Práca s podporou grantov APVV 0148-10, VEGA 1/0465/11 a UK/7/2011.
QIAGEN – kompletní řešení od vzorku po výsledky
Ludmila Lukeszová
BIO-CONSULT Laboratories s.r.o.
Představení nejzajímavějších produktů v rámci celého pracovního postupu od odběru vzorků až po výsledek. Firma QIAGEN v současnosti nabízí kompletní řešení od přístrojového vybavení, přes kompletní kity i jednotlivé reagencie až po intuitivní vyhodnocovací software, a to pro technologie jako PCR, RealTime PCR včetně HRM, pyrosekvenování.
Molekulárně genetická diagnostika u vzácných dědičných neurodegenerativních onemocnění – Niemann-Pickovy choroby typu C a X-vázané adrenoleukodystrofie
Lenka Dvořáková1, Hana Vlášková1, Gabriela Štorkánová1, Michaela Boučková-Hnízdová1, Larisa Stolnaya1, Helena Jahnová1, Jiří Zeman2, Milan Elleder1, Martin Hřebíček1
1Ústav dědičných metabolických poruch 1. LF UK a VFN, Praha
2Klinika dětského a dorostového lékařství 1. LF UK a VFN, Praha
Niemann-Pickova choroba typu C (NPC, OMIM #257220) je závažné autozomálně recesivní neuroviscerální onemocnění charakterizované hepatosplenomegalií a rozvojem neurologických příznaků. Nástup klinických příznaků může nastat od novorozeneckého věku až do pozdní dospělosti. Prevalence onemocnění v České republice je 0,9 na 100 000 živě narozených dětí.
Základním rysem onemocnění je lyzozomální střádání volného cholesterolu a glykolipidů v důsledku poruchy transportu lipidů. Příčinou onemocnění jsou mutace v jednom ze dvou genů – NPC1 (25 exonů) nebo NPC2 (5 exonů), které kódují funkčně kooperující proteiny neenzymové povahy lokalizované v pozdních endozomech/lyzozomech. Naprostá většina (95 %) pacientů náleží do skupiny NPC1, zbylých 5 % pak do skupiny NPC2.
Diagnózu jsme potvrdili u 33 pacientů. V jedné rodině byl v rámci genetického poradenství vyšetřen nepříbuzný partner přenašečky, který neměl rodinnou zátěž. U tohoto partnera byla identifikována z literatury známá rekurentní mutace p. Pro1007Ala (exon 20), která byla v souboru českých pacientů nalezena na dalších 9 alelách. Tento příklad ukazuje, že molekulárně genetické vyšetření nepříbuzných partnerů může mít význam i u velmi vzácných onemocnění.
X-vázaná adrenoleukodystrofie (X-ALD, OMIM #300100) je neurodegenerativní metabolické onemocnění s gonozomálně recesivním typem dědičnosti. Klinická manifestace onemocnění je velmi rozmanitá. Nejtěžší forma je způsobena zánětlivou demyelinizací bílé hmoty mozkových hemisfér a je téměř vždy doprovázena poruchou funkce kůry nadledvin. Onemocnění je vyvoláno poruchou peroxizomální ß-oxidace nasycených velmi dlouhých mastných kyselin (VLCFA; C > 22 : 0) a mutacemi v genu ABCD1 (Xq28), který kóduje peroxizomální membránový protein ALDP.
Molekulárně genetické vyšetření potvrdilo diagnosu u probandů ze 20 českých a slovenských rodin. Příklad pacienta s X-ALD ukazuje na problémy s vyhodnocením výsledků celogenomového sekvenování a svědčí pro význam Sangerovy metody v rámci diagnostického algoritmu.
Práce je podporována granty VZ MŠM ČR 0021620806, MZ0VFN2005 a IGA MZ ČR NT12239-5/2011.
Nález rozsáhlých delecí zahrnujících NF1 gen u pacientů s NF1 onemocněním
Jitka Kadlecová1,2, Silvie Dudová1,2, Martina Vaňásková1, Iveta Valášková1,2, Jana Šoukalová1,2, Zdeněk Kalina1,2, Renata Gaillyová1,2
1Oddělení lékařské genetiky FN, Brno
2Lékařská fakulta MU, Brno
U 5–10 % NF1 pacientů jsou příčinou vývoje onemocnění neurofibromatózou typu 1 mikrodelece, které zahrnují celý NF1 gen společně s variabilním počtem sousedních genů. Byly popsány tři subtypy těchto velkých delecí NF1genu: typ1, typ 2 a atypické NF1delece. U většiny NF1 pacientů se nejčastěji vyskytuje mikrodeleční typ1 – 1,4Mb mikrodelece, charakterizována bodem zlomu v proximální oblasti NF1-REPa a v distální oblasti NF1-REPc, zahrnuje 14 genů včetně NF1 genu a mikrodeleční typ 2 – 1,2Mb mikrodelece s bodem zlomu v oblasti genu SUZ12 a jeho pseudogenu SUZ12P, delece zahrnuje13 genů. Mikrodeleční typ 3 – atypické NF1 delece se vyskytují u pacientů s mnohem menší četností než předchozí dva typy mikrodelecí a jsou charakterizovány specifickými neopakujícími se body zlomu zahrnující NF1 gen.
Pacienti s NF1 mikrodelecí trpí výraznějšími projevy onemocnění než pacienti s detekovanou intragenovou mutací. Fenotyp asociovaný s NF1 mikrodelecí koreluje s projevy faciálního dysmorfismu, signifikantně zvýšeným výskytem mnohočetných neurofibromů, zvýšeným rizikem MPNSTs (malignant peripheral nerve sheath tumor) a jsou popisovány výrazné potíže s učením či snížená inteligence.
V souboru 60 nepříbuzných NF1 pacientů byly pomocí metody MLPA ( P081/P082 a P122 NF1 area, MRC Holland) detekovány velké delece NF1 genu (typ1/typ2) u 5 pacientů. Detekce delece NF1 genu byla u všech pacientů ověřována pomocí QF PCR (Light Cycler 480, Roche s.r.o). V současné době probíhá DNA analýza STR oblastí pro zjištění původu deletované alely genu NF1. Nález velké delece NF1 genu koreluje u všech pacientů s výraznějším fenotypovým projevem NF1 onemocnění.
Více někdy není lépe – kazuistika rodiny se SMA
Petra Hedvičáková, Markéta Vlčková
Ústav biologie a lékařské genetiky 2. LF UK a FN Motol, Praha
Spinální muskulární atrofie je druhou nejčastější letální autozomálně recesivní dětskou chorobou po cystické fibróze s incidencí 1 : 10 000 živě narozených dětí a frekvencí heterozygotů uváděnou pro kavkazskou populaci 1 : 35. Onemocnění je charakterizované progresivní svalovou slabostí, způsobenou degenerací a úbytkem buněk předních rohů míšních. Podle nástupu a průběhu onemocnění je nemoc klasifikována do tří nebo více klinických subtypů (SMA I Werdnig-Hoffmann, SMA II, SMA III Kugelberg-Welander, SMA IV adultní forma).
Molekulárně-genetická diagnostika je založena na stanovení přítomnosti exonu 7 SMN1 genu, protože 95–98 % pacientů se SMA s mutací v SMN1 genu má homozygotní deleci tohoto exonu. Asi 2–5 % pacientů jsou složení heterozygoti (delece/mutace). Zhruba 2 % postižených jedinců mají mutaci, která vznikla de novo.
Stanovením počtu kopií SMN1 genu je možné vyšetřit status přenašečství v případě, že se nejedná o bodovou mutaci.
Situaci zejména komplikuje skutečnost, že někteří přenašeči mohou mít obě zjištěné kopie genu na jednom chromozomu (v cis pozici). Test na přenašečství je proto nutné interpretovat v kontextu každého konkrétního případu.
Literární údaje se ve stanovení výpočtu rizika v případě přítomnosti dvou kopií SMN1 genu značně rozcházejí.
Na případu rodiny z naší ambulance chceme upozornit, že je třeba s možností komplexní situace počítat a že má smysl vyšetřovat i členy rodiny se zdánlivě jasnou genetickou prognózou.
Výsledky byly získány s podporou MZ0FNM2005.
Novinky v reagenciích New England BioLabs pro molekulární genetiku
Daniela Fulínová
BioTech
Jedním z nových produktů firmy New England BioLabs je kit s názvem Single Cell WGA Kit, který amplifikuje DNA už z jedné buňky. Další novinkou jsou reagencie na přípravu vzorků pro Next Genaration Sequencing, a to jak vzorků DNA, tak i RNA pro sekvenátory Roche 454 Junior, Ilumina, Solid a Iont Torrent.
Molekulárně genetická diagnostika Walker-Warburgova syndromu – kazuistika
Lucie Kalužová, Pavlína Plevová, Eva Šilhánová
Oddělení lékařské genetiky FN, Ostrava
Walker-Warburgův syndrom je vzácné autozomálně recesivní onemocnění, které je charakteristické kongenitální muskulární dystrofií, lysencefalií, hydrocefalem a malformacemi oka. Jedná se o nejzávažnější formu kongenitální muskulární dystrofie vedoucí k signifikantnímu zpoždění vývoje a předpokládanou délkou přežívání menší 3 let. Toto onemocnění bývá ve 40 % případů způsobeno mutacemi v šesti genech (POMT1, POMT2, POMGNT1, FKTN, FKRP a LARGE). Podstatou těchto mutací je porušení procesu glykosylace α-dystroglykanu. Dystroglykan je exprimován na povrchu svalových a neurálních buněk a interaguje s mnoha extracelulárními komponenty matrix. Porušení jeho přirozené funkce vede ke svalovým, mozkovým a očním defektům.
Prenatálně byl zjištěn u plodu romského etnika těžký hydrocefalus. Postnatálně byla patrná vrozená vývojová vada levého bulvu-buphthalmus a mikrophalmus bulvu pravého. Dodatečně byla zjištěna vysoká hladina sérové kreatinkinázy a neurologické vyšetření potvrdilo nález neuropatie. Neobvykle těžký hydrocefalus a atypický fenotyp novorozence nás přivedl k podezření na Walker-Warburgův syndrom. Byla provedena přímá sekvence celé kódující sekvence, tj. exonů 1–19, genu POMT1, jehož mutace jsou nejčastěji nacházeny u dětí s touto diagnózou. Byla nalezena sestřihová mutace c.280+1G>T v homozygotním stavu. Tato mutace již byla v literatuře popsána jako patogenní. U novorozence tedy byla potvrzena diagnóza Walker-Warburgova syndromu na molekulární úrovni.
Molekulárně biologická analýza pacientů s feochromocytomem a paragangliomem
Zdeněk Musil1, Aleš Vícha2, Tomáš Zelinka3, Lenka Foretová4, Anna Křepelová5, Jan Václavík6, Zdeněk Fryšák7, Alena Puchmajerová5, Martina Simandlová5, Jiří Widimský3, Milada Kohoutová1
1Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
2Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha
3III. interní klinika 1. LF UK a VFN, Praha
4Oddělení epidemiologie a genetiky nádorů MOÚ, Brno
5Ústav biologie a lékařské genetiky 2. LF UK a FN Motol, Praha
6I. interní klinika FN a LF, Olomouc
7III. interní klinika FN a LF, Olomouc
Feochromocytom je neuroendokrinní nádor vycházející z chromafinních buněk dřeně nadledvin, které mají schopnost nejen produkovat, ale také metabolizovat katecholaminy. Paragangliomy jsou pak tumory, které pocházejí z chromafinních buněk buď ze sympatického nervového systému břicha, pánve nebo hrudníku, jež produkují katecholaminy, nebo z chromafinních buněk parasympatického nervového systému, které se nacházejí nejčastěji v oblasti hlavy a krku a jsou většinou sekrečně němé. Pro výskyt feochromocytomu donedávna platilo pravidlo 10 % – v 10 % jako extraadrenální (tedy paragangliom, dnes však spíše 20–25 %), v 10 % maligní (i v tomto případě bývá výskyt vyšší), v 10 % u dětí (u nich se vyskytuje častěji extraadrenálně).
Feochromocytom může být součástí těchto genetických syndromů: mnohočetné endokrinní neoplazie 2. typu (multiple endocrine neoplasia type 2, MEN 2) se zárodečnými mutacemi v protoonkogenu RET, syndromu von Hippel-Lindau (VHL) se zárodečnými mutacemi v tumorsupresorovém genu VHL) a méně často neurofibromatózy 1. typu (choroba von Recklinhausen, NF1) se zárodečnými mutacemi genu NF1, dále syndromu mnohočetné familiární paragangliomatózy, kdy se může jednat o mutace B-podjednotky mitochondriálního enzymu sukcinátdehydrogenázy (tyto mutace jsou velmi často spojeny s maligním průběhem onemocnění) a dále mutaci D-podjednotky uvedeného enzymu, jež pacienta predisponuje spíše k mnohočetným paragangliomům.
Doposud se nám podařilo shromáždit 173 pacientů s feochromocytomem a paragangliomem (z toho 12 dětských pacientů). V tomto souboru jsme zachytili celkem 17 mutací v kandidátních genech.
Každému pacientovi s feochromocytomem nebo paragangliomem by mělo být nabídnuto genetické vyšetření. Molekulárně biologickou analýzu genů SDHB, SDHD, a RET zajištuje Mgr. Z. Musil v ÚBLG 1. LF UK a VFN, analýzu genu VHL provádí MUDr. A. Křepelová v ÚBLG 2. LF a FNM, CGH analýzu provádí MUDr. A. Vícha v KDHO FN Motol.
Studie byla podpořena výzkumným záměrem MŠMT ČR MSM0021620808 a SVV 262 511.
Molekulárna analýza génu COL1A1 u pacientov s osteogenesis imperfecta
Alžbeta Vážna1, Martina Tóthová1, Miroslava Krkavcová1, Miloslav Kuklík2, Ivo Mařík2, Alica Baxová3, Elsa Zemánková4, Marie Korabečná3, 5
1GENvia, s.r.o., laboratoř lékařské genetiky, Praha
2Ambulantní centrum pro vady pohybového aparátu, Praha
3Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
4Genetická ambulance, Benešov
5Ústav biologie LF UK, Plzeň
Dedičné ochorenie osteogenesis imperfecta (OI) patrí do heterogénnej skupiny tzv. kolagénopatií, ktorých spoločným rysom je porucha niektorého z 27 známych typov kolagénu, ktoré sú hlavnou zložkou spojivového tkaniva. V súčasnosti sa popisuje osem klinicky rozdielnych typov OI, s vysokou fenotypovou variabilitou od ľahkej až po veľmi ťažkú formu. Ochorenie sa dedí autozomálne dominantne, okrem typov VII a VIII, ktoré sú autozomálne recesívne. Zvýšená lámavosť kostí, charakteristická pre OI, je spôsobená poruchou hlavného proteínu spojivových tkanív, kolagénu typu I. Tento proteín je tvorený dvoma rôznymi peptidovými reťazcami, kódovanými génmi COL1A1 a COL1A2. Mutácie v génoch pre kolagén typu I boli nájdené len u prvých štyroch typov OI, avšak objasňujú až 90 % týchto prípadov. Kým u pacientov s ľahším postihnutím býva častejší familiárny výskyt mutácií v géne COL1A1 alebo COL1A2, ťažšie fenotypy sú zvyčajne výsledkom de novo zmien.
V rámci projektu bolo doteraz analyzovaných celkom 50 vzoriek s podozrením na osteogenesis imperfekta typu I–IV alebo inou kolagénopatiou s poruchou v géne COL1A1. Molekulárno-genetická analýza génu COL1A1 bola založená na sekvenačnej analýze PCR produktov pokrývajúcich celú kódujúcu oblasť, tzn. 51 exónov.
Z 50 pacientov zo 45 nepríbuzných rodín sa mutácia v géne COL1A1 našla v 33 prípadoch. Všetky mutácie, s jednou výnimkou, boli jedinečné a ležali po celej dĺžke génu, od exónu 2 až po intrón 49. U 17 pacientov sa žiadna patogénna zmena v géne COL1A1 neidentifikovala. U pacientov bez patologického nálezu je možnosť pokračovať ďalšou sekvenačnou analýzou kódujúcej oblasti génu COL1A2, regulačných oblastí oboch génov COL1A1 i COL1A2 alebo inými molekulárno-genetickými metódami.
Ion Torrent™ – personal genome machine – první sekvenátor DNA opravdu „nové generace“
Marco Pirotta, Ondřej Holeňa
Life Technologies
Možnost propojení téměř neomezených možností, které poskytuje digitální a polovodičová technologie s analýzou biologických látek – a v první řadě DNA – zaměstnává výzkumníky i vývojáře v mnoha laboratořích na celém světě. V systému Ion Torrent, který firma Life Technologies uvedla na trh v tomto roce, bylo toto úsilí poprvé úspěšně dovedeno k realitě. Nákladné a často komplikované hodnocení fluorescenčních nebo chemiluminscenčních signálů, které známe z tradičních kapilárních sekvenátorů nebo alternativních NGS systémů je u Ion Torrentu nahrazeno jednoduchým měřením vodíkových iontů uvolněných v průběhu polymerázové reakce. Jednoduchost ale zároveň spolehlivost a rychlost tohoto postupu je založena na polovodičovém čipu, který obsahuje deset miliónů submiskropických cell, ve kterých probíhá v reálném čase analýza lokálních změn pH. A právě skutečnost, že jediný limitující faktor celé technologie je kapacita polovodičového čipu, garantuje uživatelům, že i v budoucnu budou moci sekvenovat DNA i RNA se stále stoupající kapacitou, rychleji a v neposlední řadě i levněji.
Mutační analýza genů podmiňujících idiopatický nefrotický syndrom
Markéta Šafaříková1,2, Lena Obeidová1,2, Hana Šafránková2, Petr Lněnička1, Jana Reiterová1,2, Jitka Štekrová1, Vladimír Tesař2, Milada Kohoutová1
1Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
2Klinika nefrologie 1. LF UK a VFN, Praha
Mezi hlavní znaky nefrotického syndromu (NS) patří nefrotická protenurie, hypalbuminémie, hypercholesterolémie a otoky. Dědičnost je autozomálně dominatní i autozomálně recesivní. NS se vyskytuje u primárních i sekundárních glomerulopatií. K nejčastějším příčinám nefrotického syndromu z primárních forem patří fokální segmentální glomeruloskleróza (FSGS), membranózní glomerulonefritida (MGN) a minimální změny glomerulů (MCN), ze sekundárních forem pak amyloidóza ledvin, diabetická nefropatie a lupusová nefritida. Nefrotický syndrom lze rozdělit podle věku nástupu na kongenitální, juvenilní a adolescentní nebo podle příčiny na primární (též nazývaný idiopatický) a sekundární. Přibližně 18 % případů idiopatického nefrotického syndromu (INS) vzniká na základě genetického podkladu. Do dnešní doby bylo ve spojitosti s INS popsáno 7 genů, kterými jsou NPHS1, NPHS2, CD2AP, PLCE1, ACTN4, TRPC6 a INF2.
PLCE1 gen kóduje fosfolipázu C epsilon 1. CD2AP gen kóduje CD2 asociovaný protein, který v ledvinách hraje nezastupitelnou úlohu při správné funkci slit diapragm. INF2 gen kóduje tzv. inverted formin 2 protein patřící do forminové rodiny. Tento protein ovlivňuje funkci aktinového cytoskeletu v podocytech. TRPC6 je gen kódující iontový kanál pro vápenaté kationty. S nefrotickým syndromem finského typu je spojován NPHS1, jehož produktem je nefrin, který se specificky nachází ve slit diapragm podocytů. V podocytech je také exprimován gen NPHS2, který kóduje podocin a je spojován s nefrotickým syndromem rezistentním k léčbě steroidy. ACTN4 kóduje α-aktinin 4.Tento protein váže a spojuje F-aktinová vlákna.
V rámci mutační analýzy genů ACTN4, TRPC6 a NPHS2 provedené v Laboratoři molekulární diagnostiky Ústavu biologie a lékařské genetiky 1. LF UK a VFN, byla analyzována DNA pacientů s nefrotickým syndromem, jejichž histologický nález z biopsie ledvin prokázal FSGS nebo MCN. Analýza byla provedena pomocí High resolution melting (HRM) metody s následnou sekvenací suspektních vzorků. U pacientů byly ve všech zkoumaných genech nalezeny již známé polymorfismy a mutace, dosud nepopsané polymofismy, ale také jednobodová záměna, u které je možné předpokládat kauzální význam. Tato záměna c.NM_004924.3 : 2242A>G (p.Asn748Asp) v genu ACTN4 se vyskytla u jednoho pacienta, avšak nebyla nalezena u žádného testovaného zdravého kontrolního vzorku. Z výčtu nalezených popsaných změn je třeba také poukázat na záměnu c.NM_004924.3: c.1279C>A (p.Ala427Thr) v genu ACTN4, která je označována jako tolerovaná změna. V našem souboru pacientů s NS se vyskytla v jednom případě, avšak nebyla nalezena u žádné testované zdravé kontroly.
Práce je podporována grantovým projektem IGA MZČR č. NS9779-4.
Nové enzymy pro molekulární biologii od firem KAPA Biosystems a MOBIO
Radim Štaif, Dana Vargová
Elisabeth Pharmacon spol. s r.o.
Firemní přednáška na téma nových produktů KAPA Biosystems a MOBIO. Dle časových možností délka příspěvku v rozsahu 5–10 minut. V případě zájmu o uvedení abstraktu prosím kontaktujte autora příspěvku.
Význam RAGE polymorfizmov v progresii diabetickej nefropatie
Katarína Kuricová1, Veronika Tanhäuserová1, Vendula Bartáková1, Petra Linhartová1, Lukáš Pácal1, Jan Svojanovský2, Darja Krusová2, Jindřich Olšovský2, Jana Bělobrádková2, Jitka Řehořová3, Kateřina Kaňková1
1Ústav patologické fyziologie LF MU, Brno
2II. interní klinika FN u sv. Anny v Brně
3Interní gastroenterologická klinika FN, Brno
Úvod. Zvýšená tvorba neskorých produktov glykácie (advanced glycation end-products – AGE) je jedným z nežiaducich metabolických efektov dlhodobej hyperglykémie. AGE sú schopné priamo modifikovať makromolekuly (proteíny a lipidy), čo má za následok zmenu ich štruktúry a funkcie. Taktiež sa viažu na špecifické receptory RAGE (receptor for AGE) vyskytujúce sa na membránach rôznych buniek, čím ich aktivujú. Systém AGE/RAGE je jedným z kľúčových mechanizmov hyperglykémiou indukovaného poškodenia buniek u diabetu. Cieľom tejto štúdie bolo zistiť, či existuje vzťah medzi variabilitou v géne kódujúcom RAGE, progresiou diabetickej nefropatie (DN) a morbiditou a mortalitou asociovanou s diabetom.
Metóda. Do prierezovej štúdie bolo zaradených celkom 423 diabetikov 1. a 2. typu (trvanie 3–10 rokov) s rôznym stupňom postihnutia obličiek definovaným na základe množstva albumínu v moči: normoalbuminuria (n = 77), mikroalbuminuria (n = 126), proteinuria (n = 169) a terminálne zlyhanie obličiek (ESRD, n = 51). Kohorta (mimo ESRD pacientov) bola sledovaná po dobu 39 mesiacov. DNA bola izolovaná z leukocytov periférnej krvi. Genotypizácia variant RAGE ( 429T/C, -374T/A, G82S, 1704G/T, 2184A/G, 2245G/A) bola prevedená metódami založenými na polymerázovej reťazovej reakcii. Haplotypy sme rekonštruovali in silico pomocou software PHASE. Klinické end-points: 1. renálna udalosť (progresia DN o štádium ďalej alebo dosiahnutie ESRD), 2. kardiovaskulárna udalosť (MCVE: nefatálny infarkt myokardu), 3. kardiovaskulárna mortalita (CVM: fatálny infarkt myokardu alebo mozgová príhoda, náhla smrť) a (4) celková mortalita (ACM).
Výsledky. Progresie DN bolo dosiahnuté u 22,9 % subjektov, MCVE u 8,2 %, CVM u 10 % a ACM u 19,8 %. Našli sme rozdiel v alelových i genotypových frekvenciách polymorfizmu 2245G/A medzi diabetikmi bez DN a s DN (p = 0,001 a 0,0004). U ostatných polymorfizmov rozdiel zistený nebol. Pri rekonštrukcii haplotypov a následnom porovnaní medzi skupinami bola nájdená vyššia frekvenciae haplotypu RAGE2 u diabetikov s DN (p > 0,001, permutačný test). Vplyv RAGE polymorfizmov na dosiahnutie jednotlivých klinických end-points bol študovaný pomocou Kaplan-Meierovy analýzy. V jednolokusovej analýze nebol nájdený žiadny vzťah, pri haplotypovej analýze bol identifikovaný haplotyp RAGE2 ako rizikový vo vzťahu ku kardiovaskulárnej mortalite (p = 0,04, log-rank test).
Záver. Interindividuálna variabilita v géne kódujúcom RAGE predstavuje potenciálne významný genetický rizikový faktor kardiovaskulárnej mortality diabetikov.
Práca bola podporená grantom IGA MZ ČR (NT/11405-6).
Structurally-functional study of mutant proteins – misfolding of cystathionin beta-synthase as a model
Aleš Hnízda, Viktor Kožich
1. lékařská fakulta UK a VFN, Praha
Loss of protein stability due to missense mutation is the most common cause of monogenic diseases. Generally, aminoacid substitution in the protein does not often target key functional residues but rather leads to misfolded protein with disrupted native structure.
In our study, we focused on structural mechanisms underlying protein misfolding of cystathionine beta synthase mutant enzymes. We described conformational properties of nine pathogenic variants directly in crude cell extracts by proteolytic approaches using thermolysin. Other nine CBS mutants were successfully purified after expression in E.coli and subsequently characterized by common spectroscopic and biochemical techniques. We found that the altered degree of protein unfolding is a common structural mechanism for the major disease-causing mutation.General methological strategy for assessment of mutations pathogenicity will be discussed.
This work was supported by the Research Project from the Ministry of Education of the Czech Republic No. MSM0021620806, by the grant No. 7310 from Grant Agency of Charles University in Prague and by the grant SVV262502 from the Charles University in Prague.
Od RFLP po NGS – vývoj molekulárně-genetické analýzy u pacientů s polycystickou chorobou ledvin
Jitka Štekrová1, Jana Reiterová1,2, Veronika Elišáková1, Petr Lněnička1, Miroslav Merta1, Vladimír Tesař2, Milada Kohoutová1
1Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
2Klinika nefrologie 1. LF UK a VFN, Praha
Autozomálně dominantní polycystická choroba ledvin (ADPKD – autosomal dominant polycystic kidney disease) je nejčastějším dědičným onemocněním ledvin. Onemocnění je charakterizováno progresivním růstem renálních cyst a postupnou ztrátou renální funkce. Onemocnění může být způsobeno mutací genu PKD1 (MIM 601313; 85 % případů) nebo genu PKD2 (MIM 173910; 14 % případů). Proteinové produkty obou genů, polycystin-1 a polycystin-2, jsou membránové proteiny, které v komplexu s dalšími proteiny regulují růst a diferenciaci renálních buněk již v časné embryogenezi. Mutační analýza genu PKD1 je komplikována vysoce homologní duplikací 2/3 genu a jeho značnou variabilitou. V mezinárodní databázi mutací (PKD database: http:// pkdb.mayo.edu) je v současnosti uvedeno 864 sekvenčních variant genu PKD1 a 139 sekvenčních variant genu PKD2.
Presymptomatická DNA diagnostika se v naší laboratoři provádí již více než 20 let metodou vazebné analýzy; v první polovině devadesátých let 20. století se prováděla pouze analýza genu PKD1 s využitím metody RFLP (Restriction Fragment Length Polymorphism). Od druhé poloviny devadesátých let se vazebná analýza provádí v lokusech obou genů s využitím vysoce polymorfních mikrosatelitních markerů. Uvedenými metodami bylo vyšetřeno již více než 500 nepříbuzných rodin s výskytem ADPKD.
Přímá detekce mutací v genech PKD1, 2 je v naší laboratoři prováděna převážně v rámci výzkumných projektů. V genu PKD1 bylo dosud detekováno 54 různých mutací v 57 nepříbuzných rodinách. Pouze dvě mutace byly detekovány opakovaně. Ostatní identifikované mutace jsou unikátní pro jednotlivé rodiny; 42 z identifikovaných mutací nebylo dříve popsáno. V genu PKD2 bylo dosud detekováno 17 kauzálních mutací ve 36 nepříbuzných rodinách. Pět mutací bylo detekováno opakovaně; 14 identifikovaných mutací je unikátních pro naši populaci.
Technologie NGS (next generation sequencing) na analyzátoru GS Junior (Roche) byla využita k analýze genu PKD1 v šestičlenné rodině s velmi variabilním fenotypem ADPKD. V rodině bylo identifikováno velké množství substitucí a lze sestavit rizikový haplotyp; nelze však určit jednoznačně kauzální mutaci, která je odpovědná za onemocnění v rodině. Na základě současných znalostí lze obdobný výsledek s nejednoznačnou interpretací očekávat zhruba u 50 % rodin s ADPKD. Nové technologie mohou jednoznačně zrychlit a zlevnit identifikaci nových mutací, které přispějí k nalezení funkčně důležitých domén polycystinů a k objasnění molekulárního mechanismu vzniku tohoto závažného onemocnění. Do budoucnosti lze očekávat rozšíření mezinárodních databází sekvenčních variant, které mohou mít význam pro interpretaci výsledků, stanovení prognózy, prevence a léčebných zásahů u jejich nositelů.
Molekulárně-biologické metody, zejména vazebná analýza, v současnosti umožňují v rodinách s ADPKD presymptomatickou, prenatální a preimplantační diagnostiku.
Podporováno VZ MŠMT 0021620806.
Využití metod sekvenování nové generace na přístroji GS Junior v diagnostice
Jaroslav Vohánka
Roche s. s r.o.
V minulém roce firma Roche představila stolní sekvenátor GS Junior – „sekvenátor nové generace“. Ačkoliv se jedná o vysoko-kapacitní sekvenátor (v porovnání s kapilárními sekvenátory), je určen především pro běžné laboratoře, zabývající se molekulární biologií, ať již vědecké či diagnostícké. Tato velmi úspěšná platforma 454 sekvenování je dnes již rutinně využívána v mnoha českých laboratořích. Cílem tohoto sdělení proto bude ukázka hlavních aplikací a možností praktického využívání sekvenátoru GS Junior v diagnostice. Vzhledem k rostoucímu zájmu o diagnostické kity pro GS Junior vyvíjí nejen firma Roche tyto „ready to use“ soupravy. Usnadnění a zrychlení diagnostiky pomocí těchto souprav bude rovněž diskutováno.
Diagnostický potenciál volných nukleových kyselin
Aleš Hořínek, Marie Korabečná, Eva Pazourková, Pavel Škrha
1. lékařská fakulta UK a VFN, Praha
Kvantitativní a kvalitativní analýza volných nukleových kyselin (cfDNA, mRNA a miRNA) se v poslední době stala jedním ze slibným diagnostických přístupů. Volné nukleové kyseliny (VNK), a to především volně cirkulující DNA (cfDNA), jsou lehce izolovatelné jak krevního oběhu, tak i z ostatních tělních tekutin: Jejich analýza má vysokou výpovědní hodnotu, a tím se staly zajímavým prognostickým a diagnostickým neinvazivním epigenetickým markerem, především pak ve vztahu ke studiu karcinogeneze, detekce nádorů, monitorování jejich rozvoje či úspěšnosti terapie. Současnost je pak charakterizována snahou o využití kvantitativní analýzy VNK v krevním oběhu i jako prognostického markeru u pacientů s polytraumaty, mozkovou příhodou či akutním infarktem myokardu. Vedle analýzy VNK v krevním oběhu se dnes díky vysoké citlivosti detekčních metod stala i analýza VNK v moči důležitým diagnostickým nástrojem, zejména u onkologických pacientů, například u nádoru močového měchýře. I přes malé koncentrace VNK v moči, dnešní metody dovolují jejich kvalitativní i kvantitativní hodnocení v návaznosti na klinická data.
V oblastí neinvazivní fetální diagnostiky byl objev volné DNA fetálního původu v mateřské plazmě příčinou nástupu efektních diagnostických strategií umožňujících časnou neinvazivní prenatální diagnostiku, především pak detekci pohlaví plodu, rutinní stanovení RhD statusu plodu i diagnostiku nejzávažnějších chromozomálních aneuploidií, především pak trizomie 21. chromozomu – Downova syndromu. Kvantitativní analýza VNK se stala i nástrojem časné diagnostiky patologického průběhu těhotenství, především preeklampsie, fetomaternálního krvácení, polyhydramnionu, růstové retardace plodu či invazivní placentace.
Podpořeno grantem IGA MZ ČR NT12417-5.
Metylace promotorů genů imunitní odpovědi ve volné DNA hemodialyzovaných pacientů
Marie Korabečná1, Eva Pazourková1, Aleš Hořínek1, Magdalena Mokrejšová2, Vladimír Tesař3
1Ústav biologie a lékařské genetiky 1. LF UK, Praha
23. LF UK a FNKV, Praha
3Nefrologická klinika 1. LF UK, Praha
Úvod. DNA volně cirkulující v lidské plazmě (cfDNA) je v současné době intenzivně studována jak po stránce kvantitativní, tak kvalitativní ve vztahu k nejrůznějším patologickým procesům. Vyšetření fetální cfDNA cirkulující v mateřské krvi nachází uplatnění v prenatální diagnostice. Metylace genů majících vztah ke karcinogenezi je vyhodnocována jako potenciální biomarker u onkologických pacientů. U hemodialyzovaných pacientů byl opakovaně prokázán významný vzestup koncentrace celkové DNA během hemodialyzační procedury, kvalitativně však tato cfDNA studována nebyla. Předpokládá se, že významným zdrojem cfDNA při hemodialýze je apoptóza leukocytů na membráně dialyzátoru. Experimentálně bylo prokázáno uvolňování cfDNA i živými buňkami. V prezentované pilotní studii jsme se zaměřili na charakter metylace promotorů 24 genů majících vztah k imunitní odpovědi a analýzu změn metylačního profilu po hemodialyzační proceduře.
Metodika. Analyzovali jsme vzorky cfDNA získané z plazmy 22 pacientů odebrané bezprostředně před hemodialyzační procedurou a těsně po ní. K vyšetření metylace promotorů 24 genů jsme použili Immune Response Methyl-Profiler DNA Methylation PCR Array System (Qiagen). Výsledky jsme podrobili statistickému zpracování a klastrové analýze.
Výsledky. Nalezli jsme statisticky významné změny v metylaci promotorů genů IL-7, IL-13 a IL - 17C. Pro všechny tyto interleukiny jsou publikovány studie na proteomické úrovni potvrzující jejich význam u hemodialyzovaných pacientů: IL-7 podporuje udržení a vývoj populace T-lymfocytů, zvýšené hladiny IL-13 byly nalezeny u hemodialyzovaných pacientů špatně odpovídajících na léčbu erytropoetinem, zvýšené hladiny IL-17C byly nalezeny u pacientů s end-stage renal disease a nikoliv u kontrol. Klastrová analýza ukázala, že metylační profily jednotlivých pacientů nesou podobné rysy, provázání s klinickými daty je zatím vzhledem ke značné heterogenitě hemodialyzované populace obtížné.
Závěr. Na úrovni cfDNA izolované z plazmy je možné provádět analýzu metylace promotorů genů zahrnutých v imunitní odpovědi. U hemodialyzovaných pacientů dochází během hemodialyzační procedury ke statisticky signifikantním změnám metylace u jednotlivých genů. Vyhodnocení metylačních profilů v návaznosti na podrobná klinická data se může stát zdrojem nových biomarkerů se vztahem k ještě hlubší individualizaci léčebného postupu a predikci vývoje komorbidit u hemodialyzovaných pacientů.
Vyšetření volné nádorové DNA v plazmě pacientů s kolorektálním karcinomem: od výzkumu ke klinickému využití
Lucie Benešová1, Ludmila Lipská2, Barbora Belšánová1, Petra Mináriková3, Gabriela Vepřeková3, Miroslav Levý2, Vladimír Visokai2, Miroslav Zavoral3, Marek Minárik1
1Centrum aplikované genomiky solidních nádorů, Genomac, Praha
2Chirurgická klinika 1. LF UK a FTNsP, Praha
3Interní klinika 1. LF UK a UVN, Praha
Úvod. Sporadické formy kolorektálního karcinomu (KRCa) jsou provázeny řadou změn ve tkáňové morfologii doprovázených defekty na úrovni DNA. Součástí tohoto procesu je i nekrotizace nádorové tkáně v jejímž důsledku dochází k uvolňování DNA z nádorových buněk do krevního oběhu. Vzniklou volnou DNA (cell-free DNA – cfDNA), lze izolovat z krevní plazmy a je možné ji využít pro monitorování progrese onemocnění. V posledních 4 letech jsme se zabývali vývoje metodik pro záchyt cfDNA. Závěrečnou fází našeho projektu je představení možností využití vyvinutých postupů v klinické praxi.
Metodika. Ve studii bylo celkem 204 pacientů s verifikovaným KRCa ve stadiích I.–IV., někteří z nich podstupující chirurgickou léčbu. Zaznamenávali jsme lokalizaci nádoru, staging dle zobrazovacích technik, pooperacní staging, grading a průběžné hodnoty nádorových markeru. CFDNA byla vyšetřována pomocí detekce panelu mutací, který zahrnoval onkogeny KRAS, BRAF a PIK3CA a tumor supresory APC a TP53.Mutační analýzy byly prováděny s použitím kitu Genoscan.
Výsledky. U 71 % pacientů jsme v primární tkáni tumoru zachytili některou ze sledovaných mutací. Prokázali jsme korelaci výskytu cfDNA se stadiem mutace a dále souvislost s lokalizací nádoru (tračník proximální vs. distální vs. rektum). Dále jsme pozorovali jednoznačný vztah pooperačního výskytu cfDNA s radikalitou provedeného operačního zákroku. Procentuální záchyt cfDNA byl pro jednotlivá stadia plně srovnatelný s mírou pozitivity sledovaných tumor markerů.. CFDNA byla však často zachycena u pacientů s progredujícím onemocněním, kteří měli nízké hladiny CEA a CA19-9.
Závěr. Uvedená vyšetření mohou být snadno převedena do klinické praxe. Očekáváme, že sledování cfDNA může mít význam především v oblasti monitorování a detekce progrese u pacientů s KRCa. Tento projekt byl podpořen z grantu IGA MZ NS9809.
Somatic mutations in MLH1 gene and MSI status as molecular characteristics of sporadic colorectal cancer
Fabián Čaja1,2,3, Lucie Schwarzová1, Michaela Schneiderová1, 4, Petr Lněnička1, Jitka Štekrová1, Pavel Vodička1,2, Milada Kohoutová1
1Institute of Biology and Medical Genetics, First Faculty of Medicine and General Teaching Hospital, Charles University in Prague, Czech Republic
2Institute of Experimental Medicine, Academy of Sciences, Czech Republic
3Department of Cell Biology, Faculty of Science, Charles University in Prague, Prague, Czech Republic
41st Surgical Department, First Faculty of Medicine, Charles University in Prague and General Teaching Hospital in Prague, Czech Republic
Colorectal carcinoma (CRC) is one of the most prevalent malignancies in the Czech Republic. In general there are two molecular pathways leading to CRC. One pathway is characterized by chromosomal instability, the other by the deficiency in DNA mismatch repair (MMR) genes. MLH1 gene is one of the MMR gene-family members and represents a key component of the MMR system, responsible for recognition of nucleotide mismatches occurring during DNA replication, and for the recruitment of repair proteins to correct the replication errors. Germline mutations in MLH1 are responsible for Lynch syndrome or hereditary non-polyposis colorectal cancer (HNPCC) that accounts for 2–3% of all CRC. Somatic mutations in MLH1 gene hallmark sporadic, MMR deficient, CRC cases.
Our aim was to detect somatic mutations in MLH1 and therefore we have analysed MSI status and MLH1 gene mutations in DNA samples from 100 CRC patients from General teaching hospital in Prague. The mutations have been screened by high resolution melting (HRM) curve analysis. HRM involves precise monitoring of the change in fluorescence caused by the release of an intercalating DNA dye from a DNA duplex as it denatures at high temperatures. Positive cases in each run were subsequently controlled by automatic sequencing.
In summary, we have found only few mutations in MLH1 gene. The prevailing one represents polymorphism (c. 655 A>G, p. Ile219Val), located in exon 8 and detected in 50 patients. Its role in CRC risk has been recently discussed in literature. We have found three novel mutations, in exon 2 (c. 204 C>G, p. Ile68Met) and in exon 11 (c. 973 C>T, p. Arg325Trp). The third one is located in intronic region at position c. 1731+19 T>C. These findings require verification on a larger scale of CRC patients. Four previously described mutations in exon 16 (c. 1733 A>G, p. Glu578Gly), in exon 19 (c. 2146 G>A, p. Val716Met), in exon 17 (c. 1959 G>T, p. Leu653Leu) and c. 1558+14 G>A have been detected . All detected mutations are germ-line, except of that in exon 11 (c. 973 C>T, p. Arg325Trp) which seems to be sporadic. MSI-H status was determined in 9 cases, the other tumours (91 cases) were considered as MSI-stable. Further task will be the investigation of the role of epigenetic mechanisms, mainly methylation in promoter region of MMR genes, in relation to the development of CRC.
In conclusion, we have found three new mutations in MLH1 gene (c. 204C>G, p. Ile68Met in exon 2; c. 973C>T, p. Arg325Trp in exon 11 and intronic one c. 1731+19 T>C) on the cohort of 100 patients so far. It seems that somatic mutations play minor role in the development of sporadic form of CRC and different mechanisms play the main role, probably epigenetic changes or promoter polymorphisms.
Supported by the VZ MSM0021620808 and by GACR 310/07/1430 of the Czech Republic.
Genetické vyšetření toxicity 5-fluorouracilu
Monika Koudová, Martina Bittóová, Romana Vlčková, Renata Alánová, Ilona Slepičková, Eva Lavická, Monika Hlaváčová, Vanda Indráková
GHC Genetics, s. s r.o. – NZZ, Praha
Úvod. Analog pyrimidinu 5-fluorouracil (5-FU) je používán samostatně nebo v kombinaci k chemoterapii řady solidních nádorů. Pro jeho metabolismus je klíčová funkce enzymu DPD (dihydropyrimidin dehydrogenázy). Enzym DPD je kódován genem DPYD. Mutantní alela DPYD*2A je způsobena vrozenou mutací v sestřihové oblasti intronu 14 (IVS14+1 G>A) genu DPYD. Pacienti s mutantní alelou DPYD*2A produkují nefunkční enzym DPD, proto při terapii 5-FU dochází k hromadění toxických metabolitů v organismu, což může vést k závažným až letálním toxickým reakcím.
Metodika. Celkem bylo vyšetřeno 210 žen a 212 mužů české populace ve věku 18–69 let. Materiál pro izolaci DNA byl získán stěrem sliznice dutiny ústní odběrovou soupravou pro bukální stěr (Flocked Swabs) nebo odběrem periferní nesrážlivé žilní krve. DNA byla izolována použitím separačních kolonek Qiagen pomocí kitu QIAmp DNA Minikit dle modifikovaného protokolu a využitím přístroje pro semiautomatickou izolaci DNA QuickGene 810. Detekce mutace IVS14+1 G>A genu DPYD byla provedena použitím originální metody strip assay certifikovanou soupravou PGX-5FU a nově navržené metody “high resolution melting analysis” na přístroji LightScanner. Byly porovnány výsledky molekulárně genetického vyšetření oběma použitými metodami navzájem a vyhodnocena frekvence alely DPYD*2A v souboru české populace.
Výsledky. Alela DPYD*2A byla prokázána v heterozygotním stavu u 3/422 (0,7 %) kontrol, v homozygotním stavu prokázána nebyla. Frekvence výskytu DPYP*2A alely 0,36 % nekoreluje s daty evropské populace, je 2,5krát nižší oproti uváděné frekvenci 0,91 % v evropské populaci. Výsledky molekulárně genetického vyšetření oběma použitými metodami byly navzájem zcela shodné.
Závěr. Byla zavedena a zvalidována nová, méně nákladná metodika HRM detekce alely DPYD*2A.Testování DPYD*2A alely je doporučeno před zahájením onkologické léčby, neboť u heterozygotů jsou doporučeny nižší dávky při terapii 5-FU a u homozygotů je pro vysoké riziko toxické rekace nutné zvolit chemoterapii jinými preparáty. Současně je vhodné u pozitivních případů v rámci prevence doporučit genetické vyšetření této alely u pokrevních příbuzných v riziku. Vzhledem k nízké záchytnosti alely DPYD*2A předpokládáme přítomnost dalších mutací v DPYD genu v české populaci, včetně mutací dalších genů ovlivňujících metabolismus 5-FU (např. TYMS, MTHFR). Z tohoto důvodu nyní plánujeme provést sekvenování DPYD genu a molekulárně genetickou analýzu genu TYMS u českých kontrol (analýzu variant genu MTHFR u českých kontrol jsme provedli v uplynulém roce) a dle výsledku pak optimalizovat spektrum mutací a genů vhodných k vyšetření českých pacientů před zahájením onkologické léčby s 5-FU.
PNA based platform in diagnostics
Robert Fedič
PentaGen s.r.o., Kladno
In this presentation, we would like to present our Peptide Nucleic Acid (PNA) based platform and its possibility in the cancer, viral and gene therapy. Use of PNA probes in the FISH, PCR and microarray techniques will be described as well. At the end we outline new directions in the use of PNA technology.
Searching for mutations in the kinase domain (KD) of BCR-ABL causing drug resistance in patients with chronic myeloid leukemia by ultra-deep sequencing (UDS)
Adéla Broučková1, Hana Klamová1, Caterina De Benedittis2, Michele Baccarani2, Giovanni Martinelli2, Simona Soverini2, Kateřina Machová Poláková1
1Institute of Hematology and Blood Transfusion, Prague, Czech Republic
2Department of Hematology/Oncology L.e A. Seragnoli, University of Bologna, Bologna, Italy
Mutations in the KD of the fusion protein BCR-ABL are the most common mechanism of resistance to the treatment of chronic myeloid leukemia by tyrosinkinase inhibitors. An early knowledge of the type of mutation may have a crucial impact on the therapy modification. Until now more than 100 types of mutations in the BCR-ABL KD have been published in relation to the disease treatment.
Currently, the Sanger sequencing for mutation detection in the cDNA of BCR-ABL KD is used as the gold standard. The sensitivity of the Sanger sequencing is approximately 20% of mutation present in the sample with a minimum of 100 copies of BCR-ABL transcripts. UDS is based on the clonal amplification of each molecule and its subsequent sequencing on the principle of pyrosequencing. Thus, a huge amount of reads of every single molecule is achieved giving a higher sensitivity than Sanger sequencing.
Retrospectively, we analyzed altogether 40 samples from 4 patients who developed KD mutations in BCR-ABL during the first line treatment with imatinib. We followed the kinetics of mutations from diagnosis to the development of resistance to imatinib. In patients who were subsequently switched to the treatment with second-generation inhibitors, we monitored the rate of eradication of the mutant clone and the presence of other, hidden mutations. Interestingly, at the time of diagnosis, we detected a series of minor variants, similarly as we found in the kinase domain of non-fused ABL gene of healthy donors. Furthermore, we found that using UDS we are able to detect mutations causing resistance to the treatment much earlier (by more than 1 year) than with Sanger sequencing.
From our preliminary data it seems that UDS is a very capable tool for the detection of BCR-ABL KD mutations at ultra-low levels and to detect mutations in the samples with less than 100 copies of BCR-ABL transcript. UDS may provide very early information about a possible drug resistance development with an impact in the therapy individualization. To determine the impact of UDS of KD mutations in BCR-ABL into the clinical practice, as well as for understanding of mutations development in the leukemic clones we plan to retrospectively and prospectively analyze a broader set of patient samples.
Supported by MZČR IGA NT11555.
Vysokorozlišovací analýza křivek tání (HRM) jako nástroj moderní diagnostiky
Radek Blatný
KRD, Praha
Vysokorozlišovací analýza křivek tání (HRM) je vysoce citlivá a rychlá metoda, kterou lze využívat k záchytu jedno - i vícenukleotidových záměn a indelů v DNA v heterozygotním stavu. Vysokého rozlišení je dosahováno použitím tzv. DNA saturujících barviv, například barviva LCGreen (IdahoTechnology Inc., USA) nebo ResoLight (Roche, USA) atd., a pomocí přístrojů s vysoce přesnou a stabilní kontrolou časového teplotního gradientu (LightScanner 96 od firmy IdahoTechnology Inc., LightCycler 480 od firmy Roche atd.). Během postupného zahřívání dochází k tavení dvoušroubovice DNA, čímž se z ní barvivo uvolňuje a dochází k poklesu fluorescence. Přítomnost heteroduplexu v analyzovaném amplikonu DNA mění tvar křivky tání, který je charakteristický pro konkrétní záměnu na konkrétní pozici daného amplikonu a v některých případech umožňuje dokonce zachycení homozygotní varianty polymorfních oblastí. HRM lze v moderních diagnostických laboratořích využívat k detekci nádorových onemocnění, jelikož až 10 % z nich je způsobeno dědičnou dispozicí. V rodinách s opakovaným výskytem určitých nádorů je proto vhodné provádět preventivní genetická vyšetření.
Servisní laboratoř KRD, vybavená přístroji LightScanner a LighCycler 480, nabízí návrh esejí i komerční zpracování vzorků pomocí microarray analýzy, real-time kvantitativní PCR a vysokorozlišovací analýzy křivek tání (HRMA) pro akademické i komerční subjekty. V roce 2011 byl zahájen vývoj nových komerčních kitů, na bázi HRM, detekujících mutace, které jsou známými dědičnými nádorovými predispozicemi u relativně běžných (nádory prsou, kolorektální karcinom, karcinom vaječníků, karcinom plic) i vzácných dědičných variant některých onemocnění (dermopatie, myopatie, dystrofie, neurodegenerativní choroby, neuropatie, progerie). HRM eseje jsou navrhovány pomocí softwaru LightScanner Primer Design (Idaho Technology Inc., USA) a jejich specificita a nepřítomnost nežádoucích sekundárních struktur následně ověřena pomocí volně dostupných nástrojů funkční genomiky (UCSC genome browser, dbSNP, Beacon Designer od fi. Premier Biosoft). Po počátečním testování na kontrolních vzorcích je jejich funkce důkladně ověřena na větším počtu pacientských vzorků.
Nezanedbatelným aspektem HRM analýzy je možnost zlevnění současných běžných klinických diagnostických postupů, obvykle založených na přímém sekvenování. Kombinací pre-skenovací HRM analýzy a následného selektivního sekvenování lze náklady na tato vyšetření několikanásobně snížit.
Real Time PCR systém Eco (Illumina Inc.)
Boris Bartoš
Genetica s. s r. o.
V rámci přednášky bychom Vás rádi seznámili s inovativním systémem pro Real Time PCR Eco od americké společnosti Illumina(R), značkovým kompaktním přístrojem pro provádění kvantitativní PCR s vysokým výkonem a jednoduchou obsluhou za velmi nízkou cenu, vhodným pro všechny typy laboratoří.
Validace metod v molekulárně-genetické diagnostice
Alexandra Štambergová
Ústav biologie a lékařské genetiky 2. LF UK a FN Motol, Praha
V současné době stále více molekulárně genetických laboratoří zavádí systém managementu kvality dle mezinárodní normy ČSN EN ISO 15 189. Zmiňovaná norma řízení kvality požaduje, aby laboratoře používaly pouze metody vhodné pro dané použití. Vhodnost metody musí ověřit její validací. Norma ale dále nespecifikuje jak a v jakém rozsahu validaci metody provést. Tato prezentace je praktickou ukázkou třech různých přístupů při validaci molekulárně genetických metod v laboratoři Centra cystické fibrózy. Prvním příkladem je metoda vyvinutá v laboratoři, u které byla provedena plná validace. Dále zkrácená validace, tj., verifikace byla použita u metody využívající CE/IVD kit přesně dle pokynů výrobce. Na závěr retrospektivní přístup k validaci metody, která byla již dlouhodobě používaná v laboratoři a zařazena do programu Externí kontroly kvality (EQA).
Verifikace CE certifikovaných DNA diagnostických kitů dle norem ČSN EN ISO/IEC 17025 a 15189
Věra Šiffnerová, Renáta Macnerová, Milena Vraná, Marie Dobrovolná
Ústav hematologie a krevní transfuze, Praha
Oddělení HLA genotypizace NRL pro DNA diagnostiku se zabývá genotypizací HLA systému dospělých a dětských pacientů potenciálně indikovaných k transplantaci hematopoetických buněk, jejich příbuzných a nepříbuzných dárců a také pacientů s některými metabolickými či neurologickými onemocněními.
Genotypizace pěti lokusů HLA (HLA-A, -B, -C, DRB1, DQB1) je v naší laboratoři prováděno dvěma metodami, polymerázovou řetězovou reakcí se sekvenčně specifickými primery (PCR-SSP) a sekvenační analýzou. Ročně zpracujeme přibližně 1500 vzorků. Všechny námi používané kity mají CE certifikaci. Součástí akreditovaného režimu naší laboratoře je jejich verifikace dle norem 17025 a 15189 a dle požadavků Evropské federace pro imunogenetiku (EFI) a na základě doporučení Společnosti lékařské genetiky ČLS JEP.
V nedávné době jsme v rámci flexibility prováděli verifikace několika sekvenačních kitů pro HLA genotypizaci od různých výrobců (Conexio, Inno-train, Protrans, Rose). V prvním kroku jsme teoreticky zhodnotili vhodnost pro použití v naší laboratoři. U vybraných kitů jsme dále detailně ověřovali několik parametrů – opakovatelnost (zpracování vzorku v sérii během jednoho dne jedním pracovníkem), reprodukovatelnost (různí pracovníci v různé dny), meze detekce a robustnost (vnímavost metody k odchylkám – různá množství vstupních komponent, šarže enzymů, termocyklery). Z provedených validací jednoznačně vyplynulo, že kity různých výrobců se vzájemně liší nejen cenou, ale i svou robustností, pracností laboratorního zpracování a přesností získaných výsledků. Mezi testovanými kity nebyl žádný jednoznačně nejlepší. Po komplexním zhodnocení jsou do rutinního provozu zaváděny dva vybrané kity s nejlepším poměrem všech sledovaných ukazatelů.
Zavedení pravidelné kontroly kvality kitů má vliv na efektivitu práce, snížení provozních nákladů a rychlost zpracování vzorků.
Pilotní projekt vykazování nových výkonů molekulární genetiky
Ivan Šubrt
Společnost lékařské genetiky ČLS JEP
Přednáška pojednává o aktuálním stavu pilotního projektu, v rámci kterého jsou vybranými pracovišti v rámci odbornosti 816 kromě současných kódů pro molekulárně genetické výkony vykazovány i nově navrhované výkony.
Etika biobank zřízených za účelem výzkumu
Věra Franková
Ústav pro humanitní studia v lékařství 1. LF UK a Ústav dědičných metabolických poruch 1. LF UK, Praha
Biobanky jsou souborem biologických vzorků a k nim přidružených medicínských dat. Ve většině případů jsou zřizovány za účelem výzkumu a jeho následné aplikace v medicíně.
Mezi nejčastěji diskutované etické problémy spojené s provozem biobank patří ochrana soukromí a důvěrnosti informací a s nimi spojená anonymizace vzorků a dat. Úplná anonymizace, která se zdá být z hlediska ochrany soukromí jako nejvhodnější, může do značné míry narušit úroveň výzkumu. Hledají se proto možnosti kódování vzorků a dat, které by zaručily ochranu soukromí a zároveň by umožnily získávat a doplňovat všechna medicínská data potřebná ve výzkumu.
Druhým zásadním problémem, který v souvislosti s biobankami vyvstává, je informovaný souhlas. Jedním ze základních etických požadavků ve výzkumu je, aby udělený souhlas byl zcela specifický, tj. souhlas s konkrétním výzkumným projektem. Pouze takovýto souhlas lze považovat za informovaný. Většina biobank je zřizována za účelem dlouhodobého provozu. Vzhledem k tomuto faktu není možné v době udělení souhlasu veškerý budoucí výzkum předvídat. Za eticky přípustný je proto nyní považován i souhlas obecný, někdy nazývaný jako „otevřený“ souhlas.
Biobanky neumožňují jednotlivcům přímou individuální kontrolu nad jejich osobními údaji. Ta je svěřena do rukou instituce, která musí být pro všechny zainteresované strany důvěryhodná. Biobanky musí mít vyvinuté systémy a postupy zaručující ochranu důvěrnosti a soukromí osob, jejichž data shromažďují, uchovávají a zpřístupňují tak,aby bylo zajištěno etické využití těchto dat, která jim byla s tímto předpokladem svěřena.
Mezilaboratorní porovnávání zkoušek (MPZ) v oblasti diagnostiky a molekulárního monitorování BCR-ABL v ČR
Karla Zemanová, Adéla Broučková, Martina Součková, Kateřina Machová Poláková
Laboratoř diagnostiky a molekulárního monitoringu CML a Ph+ onemocnění, NRL pro DNA diagnostiku, Ústavu hematologie a krevní transfuze
Chronická myeloidní leukémie (CML) je charakterizována přítomností fúzního genu BCR-ABL. Jeho detekce v periferní krvi (PK) nebo kostní dřeni (KD) pacientů je potvrzením diagnózy CML. Hladina transkriptu BCR-ABL je spolehlivým markerem pro molekulární monitorování odpovědi pacienta na léčbu tyrozinkinázovými inhibitory (TKI) a pro kontrolu minimální reziduální choroby (uplatněno i u pacientů po transplantaci kostních buněk). U některých pacientů dochází k vývoji rezistence na léčbu TKI. Nejčastější příčinou této rezistence jsou bodové mutace vedoucí k aminokyselinové záměně v kinázové doméně (KD) chimerického proteinu BCR-ABL. Přítomnost mutací je u pacientů, kteří vykazují známky rezistence k léčbě, detekována v cDNA KD BCR-ABL.
Naše pracoviště, Laboratoř diagnostiky a molekulárního monitoringu CML a Ph+ onemocnění, NRL pro DNA diagnostiku, Ústavu hematologie a krevní transfuze, provádí následující akreditovaná vyšetření:
- diagnostické vyšetření genu BCR-ABL metodou multiplex RT-PCR,
- molekulární monitorování transkriptu BCR-ABL,
- detekce mutací v kinázové doméně BCR-ABL.
Naše laboratoř byla pověřena Českým institutem pro akreditaci (ČIA) k mezilaboratornímu porovnávání zkoušek pro tato tři vyšetření:
1. V MPZ pro diagnostické vyšetření genu BCR-ABL zúčastněné laboratoře určují přítomnost transkriptu BCR-ABL a charakterizují typ přestavby fúzního genu. Toto vyšetření zahrnuje izolaci RNA z buněk PK nebo KD, reverzní transkripci a multiplex PCR s použitím doporučené kombinace 2 primerových párů. V roce 2011 se této kontroly kvality zúčastnilo 10 laboratoří, které obdržely dva pozitivní vzorky a jeden negativní vzorek.
2. V MPZ pro oblast stanovení hladiny transkriptů BCR-ABL je zúčastněným laboratořím zasílána ředící řada BCR-ABL pozitivních vzorků (n = 4). Na základě stanovené hladiny transkriptů BCR-ABL jsou kontrolovány parametry metodik zúčastněných pracovišť zahrnující např. míru linearity výsledků stanovení a citlivost detekce. Stanovení hladiny transkriptů BCR-ABL zahrnuje izolaci leukocytů z periferní krve, izolaci celkové RNA, reverzní transkripci a kvantitativní real-time PCR. V letošním roce se MPZ v oblasti molekulárního monitorování transkriptů BCR-ABL účastnilo všech pět laboratoří, které toto vyšetření spolu s ÚHKT v České republice poskytují.
Naše laboratoř je rovněž pověřenou referenční laboratoří pro výpočet a validaci přepočtového koeficientu pro vydávání výsledku v mezinárodním měřítku (IS). Tato činnosti probíhá v rámci mezinárodního programu EUTOS for CML (ELN; European LeukemiaNet).
3. V roce 2010–2011 naše laboratoř organizovala 1. kolo mezilaboratorního porovnávání zkoušek pro detekci mutací v KD BCR-ABL pomocí Sangerova sekvenování. Tohoto preliminárního kola se zatím zúčastnily dvě laboratoře. Laboratořím bylo zasláno šest vzorků (čtyři pozitivní a dva negativní). Pozitivní vzorky nesly 1–2 různé typy mutací s různou úrovní zastoupení ve vzorku.
Pravidelné externí kontroly kvality zkoušek v oblasti diagnostiky a molekulárního monitorování BCR-ABL jsou pro laboratoře velmi významné v souvislosti se zajištěním vysoce kvalitního laboratorního servisu s přímým dopadem pro klinickou praxi. Na základě výsledků z molekulárního monitorování BCR-ABL u pacientů s diagnózou CML lékař – zadavatel rozhoduje o individuální léčbě pacienta.
Mezilaboratorní kontrola kvality vyšetření familiárního defektu apolipoproteinu B100, izoforem apolipoproteinu E a paternity
Aleš Hořínek
1. lékařská fakulta Univerzity Karlovy, Praha
Mezilaboratorní porovnání 2011 „Stanovení HLA znaků asociovaných s chorobami“
Milena Vraná, Hana Vondráčková, Marie Dobrovolná
NRL pro DNA diagnostiku ÚHKT, Praha
Kontrola kvality „Stanovení HLA znaků asociovaných s chorobami“ proběhla v červnu až září 2011. Testovány byly tyto HLA znaky: HLA-B*27 – asociace s reumatoidními artritidami (tři vzorky); alely DQB1 lokusu asociované s celiakií (pět vzorků) a DQB1*06 : 02 – asociace s narkolepsií (dva vzorky).
Kontroly kvality se účastnilo celkově osm laboratoří. Všechny provedly testování vzorků pro asociace HLA s celiakií, pět laboratoří testovalo i vzorky B*27 a jedna laboratoř testovala vzorky DQB1*06 : 02.
Oproti roku 2010 došlo k výraznému zlepšení. Celkově bylo letos dosaženo 100% správnosti všech výsledků všech zúčastněných laboratoří. V roce 2011 došlo i ke zvážení výpovědní hodnoty uvedených laboratorních zhodnocení o souvislosti testovaného znaku s asociovanou chorobou. Nicméně v mnoha případech toto zhodnocení stále není uvedeno.
V příštím roce plánujeme organizaci této kontroly kvality stejným způsobem jako v roce 2011.
Mezilaboratorní kontrola kvality v rámci soustavy DNA diagnostických laboratoří v ČR a SR
Zuzana Hrubá
Centrum molekulární biologie a genové terapie IHOK FN, Brno
V rámci mezilaboratorní kontroly kvality byly rozeslány testovací vzorky pro tato onemocnění: syndrom fragilního X-chromozómu (FRAXA), deficit alfa-1-antitrypsinu (AAT), fenylketonurie (PKU), Smith-Lemli-Opitz syndrom (SLOS).
Vzorky byly rozeslány do sedmi laboratoří v České republice a do jedné laboratoře na Slovensko. V přednášce zaznělo vyhodnocení výsledků jednotlivých laboratoří.
Mezilaboratorní kontrola kvality práce v rámci DNA laboratoří v ČR 2011 – stanovení pohlaví a vyšetření mikrodelecí azoospermatického faktoru (AZFa,b,c)
Iveta Valášková
Oddělení lékařské genetiky FN, Brno
4. ročník EQA QF-PCR 2011
Martina Putzová, Lucie Dohnalová
Gennet, Praha
Mezilaboratorní kontrola kvality molekulárně-genetické diagnostiky cystické fibrózy pro rok 2011
Tereza Piskáčková, Marek Turnovec
Ústav biologie a lékařské genetiky 2. LF UK a FN Motol, Praha
Mezilaboratorní kontroly kvality se letos zúčastnilo 27 laboratoří, z toho tři ze Slovenské republiky. Všechny laboratoře v rámci jimi používaných diagnostických metod identifikovaly mutace správně.
Modifikace fragmentační analýzy pro vyšetření genu PHOX2B v rodině s Ondininou kletbou
Jiří Drábek1,2, Eva Klásková1, Vratislav Smolka1, Josef Srovnal1,2, Jana Stránská1,2, Veronika Holinková1,2, Miroslava Rabčanová1,2, Marián Hajdúch1,2
1Dětská klinika LF UP a FN, Olomouc
2Ústav molekulární a translační medicíny LF UP, Olomouc
Podle germánské mytologie je Ondina (Undine) vodní víla, kterou podvedl smrtelník, do něhož se zamilovala. Potrestala nevěrníka prokletím, kvůli němuž ve snu zapomínal dýchat.
Kongenitální primární syndrom alveolární hypoventilace (CCHS MIM 209880) se projevuje jako spánková apnoe s hypoventilací, jako život ohrožující zástavy dechu zpravidla již v novorozeneckém věku, kdy si vyžádá ventilační podporu. Velmi vzácná je tzv. late onset forma, která se manifestuje v pozdějším věku, často pod obrazem akutního cor pulmonale. Na vině je chyba centrálního neurologického mechanismu, kdy postižený jedinec ztrácí ve spánku automatické řízení dechové aktivity. Tato podobnost reálné choroby s mytologií způsobila, že se pro nemoc vžil název Ondinina kletba.
Základem terapie je umělá (synchronizovaná intermitentní) plicní ventilace; v prvním roce života trvale, u více než 2/3 pacientů se daří odpojení od umělé plicní ventilace po prvním roce života. Jinak dochází k hypoventilaci a poklesu saturace s nárůstem parciálního tlaku oxidu uhličitého (pCO2). Nemoc je způsobena mutací v genu paired-like homeobox 2b (PHOX2b), manifestované jako polyalaninová expanze repetic.
Na Dětské klinice LF UP a FN Olomouc bylo hospitalizováno pětitýdenní děvče pro příznaky CCHS. V zahraniční laboratoři byla zjištěna u probandky kauzální mutace c.741_755dup15 ve 3. exonu genu PHOX2b v heterozygotní formě.
V tomto projektu jsme optimalizovali metodu fragmentační PCR analýzy polyalaninové expanze a analyzovali další členy rodiny probandky. GC obsah ve sledované sekvenci dosahuje 85–90 % (záleží na umístění primerů), proto bylo potřebné modifikovat PCR přídavky aditiv.
Mutaci jsme prokázali u probandky a jejího otce, u dalších suspektních členů rodiny mutace prokázána nebyla. Na elektroforeogramu nebyl rozdíl délky fragmentů očekávaných 15 nukleotidů, ale 11 nukleotidů. Pro rozlišení této diskrepance plánujeme sekvenování za použití deazaguaninu.
Projekt byl institucionálně podpořen z grantů CZ.1.05/2.1.00/01.0030, MPO TIP FR TI1 525.
Postery
Akú škálu genetických testov použiť pri diagnostike Angelmanovho syndrómu?
Lívia Lukáčková1,2, Robert Petrovič1, Ján Chandoga1
1Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Bratislava, Slovenská republika
2Katedra genetiky, Prírodovedecká fakulta Univerzity Komenského, Bratislava, Slovenská republika
Angelmanov syndróm (AS) patrí medzi neurogenetické ochorenia, ktorých podstata spočíva v chybách spôsobených pri epigenetickej regulácii génovej expresie. Jedná sa o poruchy pri zakladaní genómového imprintingu, reverzibilného procesu, kde funkčnosť génu závisí od pohlavia rodiča, od ktorého bol zdedený. Tento syndróm s prevalenciou 1 : 25 000 až 1 : 10 000 je spôsobený deficitom proteínov, ktorých produkcia je podmienená parentálnym pôvodom génov lokalizovaných na chromozóme 15 v oblasti q11-q13. Konkrétne ide o stratu expresie špecifických génov maternálneho pôvodu, čo sa klinicky prejaví v poruchách rovnováhy a chôdze, ataxiou, hypermotorikou, ťažkým poškodením reči, epileptickými záchvatmi a i.
Prvým krokom v laboratórnej diagnostike je odlíšenie rozdielneho vzoru metylácie parentálnych aliel vďaka chemickej reakcii premeny cytozínov na uracily, pričom metylované cytozíny ostávajú nezmenené. Následne pristupujeme k dvom nezávislým metódam, a to k metylačne špecifickej amplifikácii SNRPN génu (kandidátneho génu PWS/AS kritickej oblasti) spojenej s RFLP analýzou a alelovo špecifickej Real-time PCR. Po potvrdení diagnózy určujeme molekulárno-genetickú podstatu vzniku syndrómu (uniparentálna izodizómia/heterodizómia, delécia) pomocou multiplex-PCR zameranej na polymorfizmus dvojnukleotidových opakovaní na lokusoch PWS/AS kritickej oblasti a na kontrolných lokusoch lokalizovaných na dlhom ramene chromozómu 15 spojenej s fragmentačnou analýzou. Bodové mutácie v UBE3A géne, ktorých výsledkom je 10–15 % prípadov AS, diagnostikujeme pomocou amplifikácie desiatich translatovaných exónov a následnej sekvenačnej reakcie.
V súčasnosti je medzi odporúčané diagnostické postupy zaradená MS-MLPA (Methylation-Specific Multiplex Ligation-dependent Probe Amplification). Pre odhalenie menej frekventovaných príčin vzniku AS, akými sú duplikácie a poruchy v rámci ICR, je potrebné využiť aj túto metódu.
Kombináciou vyššie uvedených metód sa dosiahne spoľahlivejšia diagnostika a predikcia ochorenia.
Detection of CAG – repeat length in Huntington’s disease genetic testing
Iveta Boroňová1, Jarmila Bernasovská1, Ivan Bernasovský2, Lucia Kulíková1
1Excellence Centre of Animal and Human Ecology, FHPV, University of Prešov, Prešov, Slovakia
2Institute of Romany Studies, University of Prešov, Prešov, Slovakia
Huntington’s disease (HD) is an autosomal dominant neurodegenerative disorder due to a trinucleotide (CAG) repeat expansion in IT 15. It most commonly presents in the third or fourth decade of life with slowly progressive cognitive, behavioral and motoric dysfunction. Gross pathology of HD is limited to the brain, with atrophy most prominent in the caudate, putamen, and cerebral cortex. Brain weight may be reduded by as much as 25–30% in advanced cases HD is spread worldwide and it is generally accepted that few mutational events account for the origin of the pathogenic CAG expansion in most populations. The prevalence rate of HD in the most of Europe is 5 cases per 100 000 individuals. HD gene encodes the protein huntingtin of 3136 amino acids. The mutation of huntingtin produces an expanded stretch of glutamine (Gln) residues. The HD locus spans 180 kb and consists of 67 exons ranging in size from 48 bp to 341 bp with an average of 138 bp. The molecular basis of the disease is the expansion of the trinucleotide CAG in the first exon of the huntingtin gene in chromosome 4p16.3. Diagnosis of HD has been greatly simplified by the direct triplet repeat gene test. In the Prešov region (1998-2009) CAG repeat lenghts in the HD gene were tested in twelve patients with suspected diagnosis of HD. Genomic DNA was extracted from blood samples by standard extraction procedures. PCR products were resolved on capillary electrophoresis with ABI technology. In seven affected patients clinical diagnosis of HD was confirmed by molecular-genetic methods. The sex ratio in the cases, in which the diagnosis of HD has been confirmed was 4 : 3 in favor of female individuals. The mean age of patients in the time of diagnosis Huntington disease was 44.1 and ranged from 28 to 62 years. This confirms the affirmation of onset of symptoms typically in the third and fourth decade of life. Mapping the occurance of HD in the Prešov region is a part of population-genetic analyses and monitoring of Prešov region population health status.
Direct PCR – využití v rychlé prenatální diagnostice trizomie chromozomu 21
Kristína Kovačovicová1,3, Iveta Valášková1,2, Jitka Kadlecová1,2, Eva Makaturová1, Renata Gaillyová1,2
1Oddělení lékařské genetiky, Laboratoř molekulární diagnostiky FN, Brno
2Lékařská fakulta MU, Brno
3Přírodovědecká fakulta MU, Brno
Trizomie chromozomu 21 představuje nejčastější aneuploidii u člověka slučitelnou se životem. Udávaná frekvence výskytu je 1 : 600 novorozenců, přičemž více jak 60 % gravidit končí smrtí plodu ještě před porodem. Je nejčastější příčinou mentální retardace, zahrnuje téměř 25 % všech případů mírné a těžké formy mentální retardace dětí v předškolním věku.
Prenatální diagnostika založená na analýze buněk získaných z plodové vody je používaná od šedesátých let 20. století. Původní diagnostika byla založena na určení kompletního karyotypu plodu. Hlavní nevýhodou tohoto přístupu je délka doby vyšetření, která představuje 2–3 týdny. Rychlejší alternativou je fluorescenční in situ hybridizace (FISH), která umožňuje získaní výsledku pro analyzované chromozomy za 24–48 hodin. V roce 1993 byla poprvé za účelem prenatální diagnostiky trizomie chromozomu 21 použita kvantitativní fluorescenční PCR (QF-PCR). Tato technika je založena na amplifikaci vysoko polymorfních krátkých tandemových repetící (STRs), nacházejících se na vybraných chromozomech za použití fluorescenčně značených primerů v multiplexní PCR reakci. Přesnost této metody byla ověřena četnými studiemi, čas od přijetí vzorku po vydání výsledku je přibližně 24 hodin.
S cílem urychlit diagnostiku aneuploidie chromozomu 21 byla vytvořena sada pro QF-PCR umožňující zkrácení doby diagnostiky Downova syndromu. Za použití Phusion® polymerázy (Phusion® Human Specimen DNA Polymerase, Finnzymes), která nevyžaduje izolaci DNA a v kombinaci s technikou fast PCR, je doba od příjmu vzorku do stanovení diagnózy výrazně zkrácena. Polymeráza, odvozená od enzymu z Pyrrococcus furiosus s přidaným uměle vytvořeným vazebným proteinem Sso7d odvozeným od Sulfolobus solfataricus, má 5’-3’ polymerázovou a 3’-5’ exonukleázovou aktivitu. Díky uměle vytvořené vazebné doméně (Sso7d) se vyznačuje robustností, vysokou procesivitou a přesností.
Vytvořená sada sestávající ze dvou multiplexních reakcí obsahuje primery pro 6 polymorfních STRs lokalizovaných v kritické oblasti pro vznik Downova syndromu (DSCR), dva páry primerů pro odlišení maternální kontaminace od trizomie chromozomu 21 v mozaice (pro lokusy lokalizované na chromozomech 13 a 21) a dva páry primerů pro určení pohlaví plodu (AMEL, SRY).
Doposud bylo tímto přístupem analyzováno 100 vzorků, z toho bylo 91 vzorků plodové vody, pět vzorků periferní krve a pět vzorků kontrolní izolované DNA s potvrzenou trizomií chromozomu 21. 81 vzorků plodové vody pochází z banky OLG FN Brno, kde jsou uchovávány po odběru pro případ další analýzy. K těmto vzorkům je k dispozici vypracovaný karyotyp, který byl porovnaný s výsledky Direct QF-PCR.
Dôležitosť testovania tiopurín-S-metyltransferázy
Ľubica Krajčíová1,2, Robert Petrovič1, Ján Chandoga1, Peter Turčáni2, Andrea Pastoráková1
1Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Bratislava, Slovenská republika
2I. Neurologická klinika LF UK, Bratislava, Slovenská republika
Tiopurín-S-metyltransferáza (TPMT) je cytoplazmatický enzým podieľajúci sa na katalytickej S-metylácii sulfhydrilovej skupiny viažucej sa na aromatické a heterocyklické jadro, ktorá je súčasťou protinádorových liečiv 6-merkaptopurínu (6 MP), 6-tioguanínu (6-TG) a imunosupresíva azathioprinu (AZA).
Bodové mutácie v TPMT géne môžu byť spojené s nízkou (až žiadnou), strednou alebo vysokou aktivitou TPMT. U 95 % Kaukazoidov sú za deficit enzýmu TPMT najčastejšie zodpovedné iba štyri jednonukleotidové polymorfizmy. Alely znižujúce aktivitu tohto enzýmu sa označujú ako TPMT*2 (238G>C, Ala80Pro), TPMT*3A (460G>A, Ala154Thr a 719A>G, Tyr240Cys), TPMT*3B (460G>A, Ala154Thr) TPMT*3C (719A>G, Tyr240Cys).
V kaukazoidnej populácií má približne 90 % jedincov vysokú TPMT aktivitu a okolo 10 % ju má strednú. Jeden z tristo jedincov má nízku alebo nemerateľnú enzýmovú aktivitu TPMT. Tento vrodený nedostatok enzýmu TPMT u homozygotných mutantov môže viesť pri terapii bežnými dávkami 6 MP, 6-TG a AZA až k vážnej myelosupresií a fatálnej hematopoetickej toxicite. Tiopurínové preparáty sa používajú pri liečbe detskej akútnej lymfoblastickej leukémie, akútnej myeloidej leukémii, z veľkej časti sa používaný pri imunosupresii pri autoimúnnych ochoreniach, ako sú črevné zápaly, reumatoidná artritída, systémový lupus erythrematosus, Crohnovej chorobe, skleróze multiplex a pri transplantácií orgánov. Cytotoxický efekt tiopurínových liečiv 6-TG, 6-MP a AZA nastáva po inkorporácii tio-deoxyguanozíntrifosfátu do DNA a tioguanozíntrifosfátu do RNA.
Pacienti so zníženou aktivitou TPMT netolerujú bežné štandardné dávky chemoterapeutík 6-MP, 6-TG a AZA. Títo jedinci by mali mať upravenú dávku liečiva. V prípade mutantných homozygotov je štandardná dávka znížená len na 10–15 %. Týmto spôsobom sa u nich predchádza vzniku nežiaducich účinkov. Pokiaľ nie sú jedinci so zníženou TPMT aktivitou vystavení tiopurínovým liečivám nevyskytuje sa u nich žiadny prejav TPMT deficiencie.
Na základe populačnej analýzy kontrolnej skupiny (500 jedincov) sme zistili, že približne 4 % slovenskej populácie je v ohrození vzniku závažnej hematopoetickej toxicity po podaní tiopurínových preparátov. Takýmto jedincom je vhodné znížiť dávku liečiva alebo úplne zmeniť liečbu. Na našom pracovisku sme mali aj pacienta s homozygotnou mutáciou TPMT*3A/3A. U tohto pacienta sa vyskytli rôzne nežiaduce účinky až so život ohrozujúcim stavom po podaní štandardnej dávky AZA.
Aby sa zabránilo vzniku vedľajších účinkov pred terapiou 6 MP, 6-TG a AZA odporúča FDA (The Food and Drug Administration) genotypovanie TPMT ešte pred predpísaním tiopurínovej terapie.
Práca bola podporovaná Ministerstvom zdravotníctva Slovenskej republiky v rámci projektu Farmakogenetický prístup pri výbere terapie nádorov (MZ SR číslo 2007/39-FNSPBA-04).
Expression Profile of ABC Transporter Genes in Breast Carcinoma
Viktor Hlaváč1, Radka Václavíková1, Marie Ehrlichová1, Ivona Hlavatá1, Václav Pecha2, Markéta Trnková3, Ivan Gut1, Pavel Souček1
1Toxicogenomics Unit, National Institute of Public Health, Prague
2Department of Oncosurgery, Medicon, Prague
3Biolab Ltd., Prague
Background. Worldwide, breast cancer comprises the fifth most common cause of cancer-related deaths in women. Chemotherapeutic treatment is limited by the interindividual variability in drug response and by the development of resistance of cancer cells. ATP-binding cassette (ABC) transporters belong to a family of transporter proteins that contribute to drug resistance via ATP-dependent drug efflux pumps, e.g. P-glycoprotein. Gene expression–based assays have the potential to improve prognostic accuracy, treatment choice, and disease outcomes in women diagnosed with breast cancer. A major goal of our study is to search for candidate molecular markers with predictive potential in terms of chemotherapy outcome. We followed the expression and variability of ABC transporter genes and intended to evaluate their associations with clinico-pathological data including therapy outcome of individual patients.
Methods. Expression profile of all known forty nine human ABC transporter genes was evaluated in postoperative tissue samples from 65 breast cancer patients treated by FAC, FEC or taxane-based neoadjuvant chemotherapy regimens. Non-neoplastic adjacent tissue was available from 41 patients. Gene expression was assessed using real-time PCR with relative quantification. High Resolution Melting Analysis (HRM) was developed for the study of single nucleotide polymorphisms (SNPs) in ABCB1. HRM analysis was confirmed by direct sequencing.
Results. ABC transporters were expressed in the majority of samples (tumors and paired adjacent non-neoplastic tissues) with striking inter-individual variability. Thirteen ABC transporters were significantly downregulated in tumor tissues. On the other side, nineteen ABC transporters were significantly upregulated in tumors (ABCA2, ABCA3, ABCA7, ABCA12, ABCB2, ABCB8, ABCB9, ABCB10, ABCC1, ABCC4, ABCC5, ABCC10, ABCC11, ABCC12, ABCD3, ABCF1, ABCF2 and ABCG1). Finally, SNPs in ABCB1 gene coding a prototypical anticancer drug efflux pump P-glycoprotein (1236C>T, Gly412Gly, rs1128503; 2677G>T/A, Ala893Ser/Thr, rs2032582 and 3435C>T, Ile1145Ile, rs1045642; all in strong linkage disequilibrium) were assessed by HRM with sensitivity 97.1% and accuracy 97.6%. On the basis of the examined SNPs, one strong haplotype block containing rs2032582 and rs1128503 SNPs was identified. In addition, significant associations of rs2032582 SNP with stage, tumor size, expression of HER2, and family history of cancer were found. Significant associations of ABCC8 transcript level with tumor grade, estrogen receptor (ER) expression (both p < 0.001), Ki67 protein expression (p=0.032) and response to chemotherapy (p = 0.025) were found. ABCA13 level significantly associated with ER expression and tumor grade. ER expression also associated with ABCC10, ABCC13 and ABCD4 transcript levels.
Conclusions. Our results revealed new candidate genes potentially causing the multidrug resistance of mammary tumors. Validation study on these candidates will be performed by absolute quantification in an independent patient cohort. The association of expression profiles with therapy outcome and disease-free survival will also be analyzed. In addition, new HRM method that seems to be rapid, accurate and cost-effective as well as time-effective was developed for screening of functional ABCB1 SNPs and can analogously be applied to other ABC gene(s).
This work was supported by grants of Grant Agency of the Ministry of Health of the Czech Republic, grants no.: NS9803-3 and NS9799-4.
High-throughput SNPs genotyping analyzes in children diagnosed with asthma bronchiale
Nana Tabashidze, Pavel Rössner jr., Jan Topinka, Miroslav Dostál, Radim J. Šrám
Institute of Experimental Medicine, Czech Academy of Science, Prague
Asthma bronchiale likely results from a complex interplay between genetic and environmental factors. The purpose of this study was to evaluate a possible association of a group of single nucleotide polymorphisms (SNPs) with asthma bronchiale in children. We investigated 385 SNPs in samples from 354 children aged 6-15 years, from the polluted area of the City of Ostrava (Bartovice) and the rural towns of the Czech Republic: Prachatice, Vimperk, Vlachovo Brezi and Netolice. Air quality (PM2.5, c-PAHs) was continuously monitored in both regions. SNPs were selected from the Cancer Genome Anatomy Project SNP500 Cancer Database. The custom made panel contains representatives from 4 groups of genes: xenobiotic metabolism and detoxification genes, DNA repair genes, genes that mediate immune and inflammatory responses and genes that are involved in oxidative processes. The assay was performed on DNA samples extracted from children’s saliva; genetic polymorphisms were assessed using the Illumina BeadStation 500 System. The data were analyzed using the Illumina BeadStudio software. We found 45 SNPs statistically significantly associated with asthma.The statistically significant SNPs from rural towns and Ostrava are distinctive. Statistically significant SNPs were associated with asthma from Ostrava children group: CYP1A1-01 rs1048943, EPHX1-14 rs2671272, EPHX1-20 rs2854455, ERCC2-06 rs238406, ERCC2-09 1799787, IFNG -07 rs1861494, IL13-02 rs1881457, LIG1-29 rs156641, TOLLIP-04 rs5743867. Obtained results indicate there may be some specific SNPs associated with asthma bronchiale from air polluted area Ostrava.
Supported by the Czech Ministry of Environment SP/1b3/50/07 and Czech Academy of Sciences AVOZ50390512.
Interleukin-1 gene variations in post-orthodontic external root resorption
Petra Linhartová1,2, Pavlína Černochová2, Martina Raudenská1, Jolana Lipková1, Lydie Izakovičová Hollá1,2
1Department of Pathophysiology, Faculty of Medicine Masaryk University, Brno, Czech Republic
2Clinic of Stomatology, Institutions Shared with St. Anne’s Faculty Hospital, Faculty of Medicine Masaryk University, Brno, Czech Republic
External apical root resorption (EARR) is a permanent shortening of the end of the tooth root. EARR is a common clinical complication of orthodontic treatment and is known to occur after trauma and in response to inflammation. Polymorphisms in the interleukin-1 (IL-1) genes play a role in the inflammatory diseases through the modulation of cytokine levels. The aim of this study was to associate two single nucleotide polymorphisms (SNPs) and one variable number of tandem repeats (VNTR) polymorphism in IL-1 with EARR in the Czech population. In this case-control association study, 32 patients with EARR (age 15.3 ± 5.4 years) and 76 controls (age 15.1 ± 4.0 years) were genotyped using methods based on PCR for IL-1 gene polymorphisms [IL-1α (-889C/T), IL-1ß (+3953C/T), and IL-1RN (IL-1 receptor antagonist, VNTR)]. While no statistical significant association was found in the genotype and allele frequencies of IL-1α (-889C/T) and IL 1ß (+3953C/T) between patients with EARR and controls, marginally significant differences were observed in the genotype and allele frequencies of IL 1RN (p = 0.08 and p = 0.07, respectively). Highly significant differences of genotype and allele distributions were identified between patients with EARR and controls in the subgroup of women (p = 0.004 and p = 0.02, respectively). Although no significant role of IL-1α ( 889C/T) and IL-1ß (+3953C/T) variants in EARR was confirmed, our results suggest that IL-1RN VNTR may be associated with EARR, especially in women.
This study was supported by projects 1M0528 and IGA NT11405-6.
Komplexní genetická analýza u dětí s mentální retardací a opožděným PMR vývojem
Kateřina Hirschfeldová1, Věra Kebrdlová1, Romana Mihalová1, Jitka Štekrová1, Petr Lněnička1, Roman Šolc1, Vladimíra Vranová2, Alice Baxová1
1Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
2Oddělení lékařské genetiky, Dětská nemocnice FN, Brno
Chromozomální přestavby jsou nejčastější známou příčinou mentální retardace. Nicméně, rozsah takových přestaveb bývá většinou pod hranicí rozlišitelnosti standardních cytogenetických metod. V těchto případech nacházejí své uplatnění moderní metody molekulární cytogenetiky a molekulární genetiky.
Projekt zpracoval soubor pacientů s diagnostikovanou mentální retardací případně opožděným psychomotorickým vývojem v kombinaci s alespoň jedním z následujících symptomů: novorozenecká hypotonie, vrozené vývojové vady, dysmorfie obličeje. Soubor tvořilo 80 nepříbuzných probandů a 10 rodinných příslušníků. Proband byl zařazen do studie na základě genetické konzultace provedené zkušeným specialistou na Oddělení lékařské genetiky (OLG) ve spolupráci s Klinikou dětí a dorostu (KDDL) a Neurologickou klinikou 1. LF UK a VFN v Praze. U všech probandů byla provedena analýza pomocí metody MLPA, která zahrnovala detekci nejčastějších mikrodelečních syndromů a analýzu subtelomerických oblastí. Doplňujícím vyšetřením byla analýza HRT, CGH, arrayCGH a FISH, které byly provedeny jen u vybraného vzorku pacientů.
Kryptická přestavba byla nalezena u celkem 12 nepříbuzných probandů (15 %). Jednalo se o tři duplikace a devět delecí. S výjimkou probanda s delecí MD15, který byl detekován metodou HRT a arrayCGH (klasická CGH analýza byla nejednoznačná), byly všechny nalezené kryptické přestavby detekovatelné MLPA analýzou. Vedle dobře charakterizovaných syndromů byly zachyceny i méně časté přestavby, jejichž asociace s fenotypem probanda není jednoznačná. Žádná z použitých metod nebyla schopna zachytit všechny nalezené přestavby.
Ze studie vyplývá, že některé přestavby, především duplikace, jsou asociovány s nejasným fenotypem a jejich frekvence v populaci může být podhodnocena a současně stanovuje vyšetření metodou MLPA pro daný soubor jako nejefektivnější pro běžnou rutinní praxi.
Studie probíhala za podpory grantu IGA MZCR NS/103273/2009.
Korelace IgVH mutačního statusu a charakteristických chromozomových aberací u pacientů s B-CLL
Barbora Roszková1, Aneta Strnková1, Veronika Hodslavská1, Petra Cibulková1, Martina Stoklasová1, Radmila Richterová1, Martin Brejcha1, Marek Wróbel1, Drahomíra Klodová1, Jaromír Gumulec2, Cecília Bodzasová2, Vladimíra Heinzová3
1Komplexní onkologické centrum, Nový Jičín
2Fakultní nemocnice, Ostrava
3Slezská nemocnice, Opava
B-buněčná chronická lymfocytární leukémie (B-CLL) je nejčastěji se vyskytující leukémií v dospělé populaci západního světa. B-CLL je charakterizována značně proměnlivými klinickými příznaky a rozdílnou prognózou pro jednotlivé pacienty. V některých případech je průběh onemocnění mírný, u jiných pacientů naopak probíhá nemoc agresivně, rychle progreduje a výrazně zkracuje předpokládanou délku života. Pro posouzení, jak rychle bude nemoc postupovat a nakolik bude agresivní, je proto důležité stanovit u jednotlivých CLL pacientů individuální prognózu, na základě které se aplikuje příslušná léčba.
Existuje řada prognostických markerů, které se k tomuto účelu využívají, nicméně nezastupitelnou roli v tomto ohledu hrají molekulárně biologické a cytogenetické prognostické markery. K těm patří zejména stanovení mutačního statusu variabilní části těžkého řetězce imunoglobulinu (IgVH) a určení přítomnosti charakteristických chromozomových změn.
V rámci Komplexního onkologického centra Nový Jičín jsou tato prognostická kritéria stanovována nezávisle na sobě ve dvou laboratořích, a to v Laboratoři molekulární biologie a Cytogenetické laboratoři. Cílem této práce je v rámci našeho centra charakterizovat u vybrané skupiny 182 pacientů korelaci mezi IgVH mutačním statusem a chromozomovými aberacemi vzhledem k předpokladům pozitivní či negativní prognózy.
Molekulárně-genetická diagnostika genodermatóz
Marie Chovančíková1, Lenka Kopečková1, Lukáš Tichý1, Hana Bučková2, Renata Gaillyová3, Lenka Fajkusová1
1Centrum molekulární biologie a genové terapie FN, Brno
2Kožní oddělení 1. pediatrické kliniky FN, Brno
3Oddělení lékařské genetiky FN, Brno
Genodermatózy dětského věku jsou charakteristické velkou variabilitou a genetickou heterogenitou. V etiopatogenezi studovaných dermatóz se uplatňuje geneticky podmíněná porucha keratinizace a kornifikace, doprovázená abnormální epidermální diferenciací a deskvamací. Výzkum patologických mechanismů genodermatóz v nedávné době výrazně pokročil a vedl k identifikaci několika kauzálních genů.
Naše pracoviště úzce spolupracuje s dětskou klinikou FN Brno a patologicko-anatomickým ústavem Fakultní nemocnice u sv. Anny na problematice epidermolysis bullosa. V nedávné době byla tato spolupráce rozšířena o molekulárně-genetické vyšetření dalších genodermatóz. Byla zavedena diagnostika incontinentia pigmenti a tří typů ichtyóz: ichtyózy vulgaris, lamelární ichtyózy a X-vázané recesivní ichtyózy. Incontinentia pigmenti je neuroektodermální onemocnění způsobené mutací NEMO genu lokalizovaném na Xq28. Onemocnění má dominantní dědičnost s vazbou na pohlaví. Ichtyóza vulgaris je nejčastějším typem ichtyóz s autozomálně semidominantním typem dědičnosti, je podmíněna mutacemi v genu pro filaggrin (FLG). V současné době provádíme vyšetření dvou prevalentních mutací FLG genu popisovaných v evropské populaci (p. R501X a c.2282del4) sekvenační analýzou. X-vázaná recesivní ichtyóza je způsobena parciální nebo úplnou delecí genu pro steroidní sulfatázu, který je lokalizován na Xp22.3. Lamelární ichtyóza je podmíněna mutacemi v jednom ze šesti genů, dědičnost onemocnění je autozomálně recesivní. V současné době sledujeme mutace genu pro transglutaminázu 1 sekvenační analýzou.
Výsledky molekulárně-genetického vyšetření genodermatóz prohlubují naše znalosti v dětské dermatologii, přispívají k efektivní terapii a poskytují informace pro genetické poradenství postižených rodin.
Molekulárně-genetická diagnostika Prader-Williho syndromu – kazuistika
Jarmila Valečková1, Lucie Brychová1, Jana Zvolská2, Sylwia Walczysková1, Šárka Hilscherová1, Lucie Kalužová1, Eva Šilhánová1
1Oddělení lékařské genetiky FN, Ostrava
2Klinický genetik, Mephacentrum, Ostrava
Prader-Williho syndrom (PWS, MIM#176270) je způsoben ztrátou funkce paternálně exprimovaných genů v oblasti 15q11-q13 (o velikosti ~4 Mb). Incidence tohoto onemocnění se pohybuje od 1/12 000 až 15 000 (u obou pohlaví, všech ras). V klinickém obraze převažuje po narození výrazná hypotonie, neprospívání v útlém dětství, hypogonadismus, malé dlaně a chodidla, hyperfagie v dětství s následnou obezitou (patří k nejčastějším syndromologickým příčinám obezity u dětí) a mentální retardace různého stupně. Příčinou PWS je v 70 % případů intersticiální de novo delece, uniparentální disomie – 25 %, chybný imprint – méně než 5 % (v důsledku mutace nebo delece imprintingového centra) a vzácně může být příčinou chromozomová translokace (méně než 1 %). Byly popsány také duplikace této oblastí, obecně pacienti s duplikacemi maternálního původu trpí autismem nebo onemocněními spojenými s autismem (neúplná penetrance). Duplikace paternálního původu bývají spojovány s téměř normálním fenotypem. Riziko rekurence je zanedbatelné (< 1 %).
Prezentujeme kazuistiku 14leté dívky, která byla odeslána pediatrem ke klinickému genetikovi z důvodu malého vzrůstu, lehkého mentálního defektu a autoimunní tyreoiditidy. Pacientka po narození nebyla hypotonická a neměla poruchu sání; není obézní. Na základě cytogenetického vyšetření bylo vysloveno podezření na duplikaci v oblasti chromozomu 15q11-13 a dále bylo indikováno cílené vyšetření PWS. Pacientka nese de novo duplikaci oblasti 15q11-q12 maternálního původu.
Ačkoliv maternální duplikace oblasti 15q11.2-q13 jsou spojeny s opožděným vývojem a autistickým chováním, oproti téměř normálnímu fenotypu při duplikaci paternálního původu, naše pacientka má pouze mírné fenotypové znaky PWS. Klinická heterogenita mezi jedinci se stejnou duplikací naznačuje přítomnost jiných genetických nebo epigenetických faktorů, jež ovlivňují expresi genů v této oblasti.
Mutace v KRAS, BRAF a PIK3CA genu u pacientů s kolorektálním karcinomem
Jarmila Šimová1,2, Barbora Kubová1, Magdalena Uvírová1,2, Irena Urbanovská1, Michaela Jalůvková1, David Konvalinka1, Iveta Žebráková1, Jana Dvořáčková2
1CGB laboratoř a.s., Laboratoř molekulární genetiky a patologie, Ostrava
2Lékařská fakulta, Ostravská Univerzita, Ostrava
Úvod. Kolorektální karcinom (CRC) patří celosvětově k nejrozšířenějším nádorovým onemocněním. Až u jedné čtvrtiny nemocných jsou v okamžiku stanovení diagnózy přítomny metastázy. Léčebné možnosti zahrnují chirurgické odstranění nádoru, radioterapii, chemoterapii a také tzv. cílenou biologickou léčbu. Cílená biologická léčba vyžaduje identifikaci genetických změn, které mohou predikovat účinnost této cílené léčby a tak pomoci s výběrem pacientů, kteří mohou profitovat z této léčby. V současnosti je pro cílenou biologickou léčbu metastatického CRC (mCRC) monoklonálními protilátkami proti EGFR (cetuximab, resp. panitumumab) vyžadováno vyšetření mutačního statutu genu KRAS. Přesto 50–60 % pacientů s KRAS wild-type je rezistentních na léčbu pomocí anti-EGFR. Současné poznatky naznačují, že poškození dalších proteinů v EGFR signální dráze, jako například BRAF proteinu a deregulace PI3K/PTEN signální dráhy mohou vést k rezistenci na anti-EGFR terapii.
Metodika. Nádorová DNA pacientů s CRC byla izolována převážně z parafínových bloků s největším zastoupením nádorové tkáně a s přesným označením lokalizace nádoru, případně z nativní nebo fixované nádorové tkáně. Stanovení přítomnosti mutací v kodonu 12 a 13 K-ras genu provádíme zejména metodou PCR a reverzní hybridizace (KRAS Strip Assay, ViennaLab). Analýzu mutace V600E v BRAF genu a mutací v exonu 9 (E542K, E545G, E545K) a exonu 20 (H1047R) v PIK3CA genu provádíme pomocí sekvenčně specifické PCR, primer extension analýzy (SNaPshot assay), přímého sekvenování a real-time PCR.
Výsledky. Retrospektivně byl na přítomnost vybraných mutací v KRAS, BRAF a PIK3CA genu analyzován soubor 221 vzorků nádorových DNA pacientů s CRC. Mutace v KRAS genu byly detekovány u 79/221 pacientů (35,7 %). Mutace V600E v BRAF genu u 11/221 pacientů (5 %). Mutace v PIK3CA genu u 15/221 pacientů (6,8 %) – v exonu 9 u 8/221 pacientů (3,6 %) a v exonu 20 u 7/221 pacientů (3,2 %). Mutace v KRAS a BRAF genu se nevyskytovaly současně. U 8/221 (3,6 %) se vyskytovala mutace v KRAS a PIK3CA současně. V jednom případě (0,5 %) byla rovněž detekována přítomnost mutace BRAF současně s mutací v exonu 20 PIK3CA genu.
Závěr. Frekvence mutací v KRAS a BRAF genu korelují s publikovanými údaji. Stejně tak koreluje koexistence PIK3CA mutací s mutacemi v KRAS nebo BRAF genu a výlučnost současného výskytu mutací KRAS a BRAF genu. Frekvence výskytu mutací v PIK3CA genu je v našem analyzovaném souboru nižší (cca 7%), než je publikovaná frekvence uváděná v literatuře (10–30 %). V personalizované protinádorové terapii mCRC, s objevem řady nových potenciálně účinných inhibitorů proteinů signální dráhy EGFR receptoru (MAPK2K, BRAF, PI3K a mTOR inhibitory), nabývá na významu nejen stanovení mutačního statutu KRAS genu, ale i genetické profilování nádoru o další potenciální markery. Po ověření by mohly tyto markery v budoucnu poskytnout účinný nástroj nejen pro výběr pacientů, kteří mohou profitovat z cílené biologické léčby, ale i stanovení efektivní strategie a volby léčebného postupu u pacientů s CRC.
Mutační analýza genu NPHS2 u pacientů s nefrotickým syndromem
Lena Obeidová2, Hana Šafránková1, Jana Reiterová1,2, Petr Lněnička2, Jitka Štekrová2, Milada Kohoutová2, Vladimír Tesař1
1Klinika nefrologie 1. LF UK a VFN, Praha
2Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
Nefrotický syndrom (NS) je charakterizován únikem proteinů do moči, zvýšenou hladinou cholesterolu v těle a vznikem otoků. Přibližně 10 % dětských a 50 % dospělých pacientů s idiopatickým NS neodpovídá na imunosupresivní léčbu a během 7 let se u nich vyvine konečné selhání ledvin. V těchto případech bioptované ledviny typicky prezentují fokální segmentální glomerulosklerózu (FSGS) či minimální změny glomerulů (MCD). U pacientů bylo zatím identifikováno sedm genů kódujících podocytární proteiny, jejichž mutace způsobují NS. Mezi tyto geny patří i NPHS2, který kóduje s rafty asociovaný podocytární protein, jenž hraje roli mimo jiné v mechanosenzorické signalizaci, udržování polarity podocytu a organizaci cytoskeletu.
V rámci projektu byla provedena mutační analýza genu NPHS2 u 74 pacientů s NS, u kterých byla histologicky ověřena diagnóza FSGS či MCD z bioptovaných vzorků. Analýza se prováděla buďto metodou PCR, či analytickou metodou high resolution melting (HRM) s následnou přímou sekvenací. V souboru byly nalezeny čtyři záměny, které vyúsťují ve změnu aminokyseliny. Jsou to popsané záměny p.Val290Met, polymorfismy p.Pro20Ser a p.Arg229Gln a dále ještě nepopsaná záměna p.Gly97Ser. Pro 3 z nich (p.Pro20Ser, p.Gly97Ser, p.Arg229Gln) pak byla provedena analýza u 200–300 zdravých kontrol pro určení jejich kauzality. Nově popsaná mutace p.Gly97Ser nebyla nalezena u žádné zdravé kontroly, ovšem nachází se v místě genu, které není konzervativní.
Práce je podporována grantovým projektem IGA MZ ČR NS/9779-4.
Mutational Analysis of the TRPC6 Gene in Czech Adult Patients with Steroid-sensitive and Steroid-resistant Idiopathic Nephrotic Syndrome
Jana Reiterová1,2, Lena Obeidová2, Jitka Štekrová2, Petr Lněnička2, Vladimír Tesař1
1Klinika nefrologie 1. LF UK a VFN, Praha
2Laboratoř molekulární diagnostiky ÚBLG 1. LF UK a VFN, Praha
Background. Focal segmental glomerulosclerosis (FSGS) and minimal change disease (MCD) are frequent causes of nephrotic syndrome (NS). About 50% of patients are resistant to immunosuppresive therapy and progress to chronic renal insufficiency. TRPC6 mutations are the cause of idiopatic NS in about 2–7% of steroid-resistant patients. 11 different TRPC6 gene mutations were identified. These mutations lead to a late onset kidney disease and a variable rate of progression to end stage renal disease. The aim of the study was the identification of mutations/polymorphisms in adult patients with FSGS/MCD in the Czech Republic.
Methods. 40 patients (22 females, 18 males) with steroid - resistant FSGS/MCD and 44 patients (22 females, 22 males) with steroid-sensitive FSGS/MCD were studied. Renal biopsy with the histological finding of FSGS/MCD was performed in the years 2004-2008. The mean age of the onset of NS was 39 ± 20.7 years. Family history for proteinuria was positive in 3 patients. 300 healthy Czech individuals formed control group with mean age 58.4 ± 19.5 years. High resolution melting analysis (HRM) was established for all 13 exons and intron-exon boundaries of the TRPC6 gene. Suspected samples were analysed by direct sequencing on ABI Prism™ 3130 and by amplicon sequencing on Roche GS Junior.
Results. Two polymorphisms were described: in exon 1 C43T (P15S) with prevalence 32.5% of heterozygotes and in exon 4 C1211T (A404V) with prevalence 20% of heterozygotes (1% of T/T homozygotes) in patients with steroid-resistant FSGS/MCD. The prevalence of heterozygotes in steroid-sensitive patients was 13.9% for C43T polymorphism and 29.5% for C1211T polymorphism. The prevalence of heterozygotes in control group was 16.5% for C43T and 20.5% for C1211T (2.5% of T/T homozygotes). T allele of C43T polymorphism in exon 1 was significantly more frequent in patients with steroid-resistant FSGS/MCD (χ2, p < 0.05).
Conclusions. TRPC6 gene mutations are rare causes of FSGS/MCD in adult patients in Czech Republic. The C43T polymorphism could have some influence on the therapeutic response and progression of the disease.
Supported by grant project IGA NS 9779-4 and by research project ZZ MSMT 0021620806.
Pompeho choroba-možnosti diagnostiky v Slovenskej republike
Slavomíra Mattošová1, Anna Hlavatá2, Peter Špalek3, Danka Maceková1, Ján Chandoga1
1Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Bratislava, Slovenská republika
2II. Detská klinika LF UK a DFNsP, Bratislava, Slovenská republika
3Centrum pre neuromuskulárne ochorenia, Neurologická klinika SZU a FNsP Ružinov, Bratislava, Slovenská republika
Pompeho choroba (glykogenóza typu II) je autozómovo recesívne ochorenie spôsobené deficienciou enzýmu α-glukozidázy (kyslej maltázy). Deficit tohto enzýmu vedie k akumulácii glykogénu v rôznych tkanivách, najviac je však postihnuté kostrové svalstvo. Z hľadiska veku a klinických prejavov ochorenie delíme na infantilnú, juvenilnú a adultnú formu. Medzi jednotlivými formami sú však plynulé prechody. Klasická, infantilná forma je tiež najťažšou formou. Manifestuje sa v novorodeneckom, resp. včasnom dojčenskom veku, rýchlo progreduje a temer obligátne končí úmrtím ešte okolo 1. roku života v dôsledku kardiorespiračného zlyhania. Tieto deti majú výraznú svalovú hypotoniu a závažnú hypertrofickú kardiomyopatiu. Juvenilná forma sa manifestuje oneskorením psychomotorického vývoja, závažnou slabosťou proximálneho končatinového svalstva, trupového svalstva a respiračného svalstva. Priebeh myopatie je postupne progresívny a končí úmrtím – respiračným zlyhaním v 2. alebo 3. dekáde života. Adultná forma sa manifestuje v 2. až 6. dekáde života, tiež je obmedzená na svaly a je podobná iným myopatiám. Pomaly progresívna slabosť svalov panvového pletenca, paraspinálnych svalov a bránice imituje pletencové formy svalovej dystrofie alebo polymyozitídu. Spôsobuje závažné telesné postihnutie, ale postihnutie myokardu je nevýrazné alebo chýba. Gén pre α-glukozidázu sa nachádza na chromozóme 17. Obsahuje 20 exónov a bolo v ňom popísaných približne 300 rozličných mutácií. Najčastejšia mutácia u kaukazskej populácie je bázová substitúcia v intróne 1 c.-32-13T>G (IVS1-13T>G). Táto mutácia sa nachádza u približne 70 % pacientov s adultnou formou Pompeho choroby.
Na príklade dvoch pacientok s adultnou formou Pompeho choroby prezentujeme dostupné diagnostické možnosti u slovenských pacientov zachytených selektívnym skríningom metódou suchej kvapky krvi. U pozitívnych pacientov následná diagnostika spočíva v stanovení celkových enzýmových aktivít v izolovanej suspenzii leukocytov a po inhibícii akarbózou. Molekulárno-genetickým vyšetrením pomocou PCR-RFLP sme potvrdili prítomnosť najčastejšej mutácie IVS1-13T>G. Pomocou tejto metódy sme u jednej pacientky zistili prítomnosť danej mutácie v homozygotnom stave, u druhej pacientky v heterozygotnom stave. Danú mutáciu sme tiež potvrdili sekvenčnou analýzou.
Štandardná enzymologická diagnostika Pompeho choroby je v SR dostupná, pri požadovaní vyšetrenia je však nevyhnutné dodržiavať predanalytické zásady pre odber (množstvo krvi) a transport vzorky. Vzhľadom na vysoký podiel mutácie IVS1-13T>G, je indikované molekulárno-genetické vyšetrenie tejto mutácie ako prvý krok. Komplexná diagnostika ochorenia vyžaduje sekvenčnú analýzu génu, ktorá identifikuje možné mutácie v 20 exónoch.
Srovnání metod používaných při diagnostice mutací genu KRAS a EGFR u kolorektálního karcinomu (CRC) a nemalobuněčného karcinomu plic (NSCLC)
Monika Bajerová1, Blanka Robešová1, Lenka Ostřížková1, Dagmar Brančíková1, Jana Skřičková2, Marcela Tomíšková2, Jitka Kyclová3, Jitka Hausnerová3, Jiří Mayer1, Dana Dvořáková1
1Interní hematoonkologická klinika LF MU a FN, Brno
2Klinika nemocí plicních a tuberkulózy FN, Brno
3Ústav patologie FN, Brno
Úvod. Mutovaný stav genu KRAS je uváděn u 40 % CRC pacientů. Mutace jsou spojovány s negativní prognózou pacienta ve vztahu k cílené léčbě monoklonálními protilátkami. U NSCLC pacientů je analyzován mutační stav genu EGFR a tyto mutace jsou spojovány s predikcí lepší odpovědi na léčbu EGFR tyrozinkinázovými inhibitory. Frekvence mutací EGFR je kolem 10 %. Stanovení uvedených aktivačních mutací je nezbytným předpokladem zahájení individuální cílené terapie.
Cíl. Provést srovnání dostupných laboratorních technik pro stanovení aktivačních mutací KRAS a EGFR genu z hlediska senzitivity, metodické a finanční náročnosti.
Metody. Pro izolaci genomové DNA byl použit QIAamp DNA FFPE Tissue Kit (QIAGEN). Výchozím materiálem je formalínem fixovaná tkáň zalitá do parafinu (FFPE) po morfologické konfirmaci na pracovišti patologie. Pro detekci bodových záměn v kodonu 12 a 13 genu KRAS jsou zavedeny metody: HRM (high resolution melt), přímá sekvenace a StripAssay PGX K-ras (ViennaLab) (10 mutací v kodonu 12 a 13). Pro mutační analýzu genu EGFR metody: fragmentační analýza FA (exon 19), alelická diskriminace AD (L858R exon 21), přímá sekvenace (exon 19 a 21) a PNAClamp EGFR Mutation Detection Kit (PANAGENE) (29 somatických mutací v exonech 18-21). Metody jsou validovány externí kontrolou kvality (UK NEQAS).
Výsledky. Mutační analýza genu KRAS byla v období XI/2009-X/2011 provedena u 119 FFPE vzorků (85 pacientů) se záchytem 47 pozitivních vzorků (37 pacientů). Metodou HRM byla detekována mutace ve vzorcích 34 pacientů. U vzorků s více než 40% zastoupením nádorových buněk byl typ záměny specifikován přímou sekvenací. U vzorků tří pacientů byla záměna detekována pouze StripAssay PGX K-ras (ViennaLab). Bylo zachyceno pět typů bodových záměn v kodonu 12 a 1 v kodonu 13. Citlivost HRM dosahuje 10 %, přímé sekvenování 25 %, StripAssay PGX K-ras (ViennaLab) 2 %.
Mutační status genu EGFR byl v období X/2010-X/2011 analyzován u 105 FFPE vzorků (100 pacientů). Bylo detekováno 10 aktivačních mutací: 3/100 (delece v exonu 19), bodové záměny: 1/100 (exon 18), 1/100 (exon 20) a 5/100 (exon 21). Citlivost metod pro detekce delecí v exonu 19: FA 5 %, přímé sekvenování 10 %. Detekční limit pro záchyt L858R v exonu 21: AD 5 %, přímé sekvenování 25 %. Citlivost PNAClamp EGFR Mutation Detection Kit je 2,5 %. Frekvence zachycených mutací odpovídá očekávaným četnostem: 37/85 pacientů (43,5 %) u KRAS a 10/100 pacientů (10 %) u EGFR.
Závěr. Uvedené techniky jsou vhodné pro rutinní genetickou analýzu mutací genu KRAS i EGFR. Jsou dostatečně senzitivní i robustní. Zařazení kitů zvyšuje senzitivitu záchytu mutací. Výhodou StripAssay PGX K-ras (ViennaLab) kitu je vysoká citlivost, široké spektrum zachycených mutací a malé množství vstupní DNA. Nevýhodou je vyšší náročnost provedení. U PNAClamp EGFR Mutation Detection Kit (PANAGENE) je předností rychlost provedení a počet detekovatelných mutací, nevýhodou nutnost velkého množství testovaného materiálu. Použití kitů zvyšuje finanční náklady oproti standardním metodám.
Transcript levels of caspase-2 isoforms S and L in breast cancer patients
Veronika Brynychová1,2, Viktor Hlaváč1,2, Marie Ehrlichová1, Radka Václavíková1, Václav Pecha3, Markéta Trnková4, Martin Wald5, Marcela Mrhalová6, Kateřina Kubáčková7, Tomáš Pikus7, Roman Kodet6, Jan Kovář8, Pavel Souček1
1Toxicogenomics Unit, National Institute of Public Health in Prague, Prague
2Third Faculty of Medicine, Charles University, Prague
3Department of Oncosurgery, Medicon Inc., Prague
4Biolab Ltd., Prague
5Department of Surgery, Motol University Hospital, Prague
6Department of Pathology and Molecular Medicine, Motol University Hospital, Prague
7Department of Oncology and Radiotherapy, Motol University Hospital, Prague
8Department of Cell and Molecular Biology, Third Faculty of Medicine, Charles University, Prague
Caspase-2 (CASP2, OMIM: 600639) is a member of the cysteine-aspartic acid protease family involved in the apoptotic cascade. Alternative splicing of caspase-2 transcript leads to the formation of two mRNAs encoding a long caspase-2L and a short caspase-2S protein with antagonistic effects on apoptosis. An important role of caspase-2 in apoptosis induced by taxanes, used for treatment of breast cancer, was suggested. The aim of our study was to assess transcript levels of caspase-2L and S isoforms in tumor and control tissues from breast cancer patients and evaluate prognostic potential of caspase-2L, S and their ratio. Novel and specific methods for real-time PCR-based absolute quantification of caspase-2L and S transcripts were developed for this purpose.
The absolute level of caspase-2L transcript was significantly higher in tumors vs. control tissues of the general set (unselected patients, n = 50, p = 0.001) but not of the neoadjuvant set (neoadjuvantly treated patients, n = 33). Caspase-2S transcript level did not significantly differ between tumor and control tissues in both sets. However, the caspase-2S/L transcript ratio was significantly lower in tumors compared to the controls in both sets (p = 0.001). A significantly higher caspase-2S transcript level in premenopausal vs. postmenopausal patients was observed in both sets (p = 0.010, p = 0.043, respectively). Patients with high caspase-2S/L transcript ratio had significantly more frequently larger tumors in the general (p = 0.028) but not in the neoadjuvant set. Patients with the caspase-2S/L transcript ratio above or equal the cut off had worse progression-free survival than patients with the ratio below cut off (p = 0.058).
In conclusion, our data suggest that caspase-2S/L transcript ratio rather than individual transcript levels should be further studied in terms of prognosis of breast cancer patients.
This study was supported by the grant of the Czech Science Foundation, no.: GACR 301/09/0362.
Výskyt polymorfizmov A388G a C463A v géne SLCO1B1 u pacientov s diabetes mellitus
Michaela Jurkovičová1,2, Ján Chandoga1
1Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Bratislava, Slovenská republika
2Katedra genetiky, Prírodovedecká fakulta UK, Bratislava, Slovenská republika
SLCO1B1 gén je lokalizovaný na krátkom ramene 12 chromozómu a skladá sa z 15 exónov. Produktom spomínaného génu je transmembránový proteín OATP1B1 lokalizovaný na bazolaterálnej časti hepatocytov. Zabezpečuje vychytávanie širokej škály endogénnych substrátov, ako sú bilirubín, žlčové kyseliny, konjugáty steroidných hormónov, a taktiež niektorých liekov, ako sú napríklad statíny, fexofenadín, rifampicín, lopinavir, bosentan a irinotekan. V géne SLCO1B1 bolo popísaných niekoľko polymorfizmov, ktoré by mohli spôsobovať moduláciu transportnej aktivity OATP1B1 proteínu. V niektorých štúdiách sa uvádza, že polymorfizmy A388G a C521T v géne SLCO1B1 sú spojené so zvýšením rizika nežiadúcich účinkov statínov. Statíny patria medzi skupinu liekov, ktoré sú schopné inhibovať aktivitu ß-HMG-CoA reduktázy, enzýmu určujúceho rýchlosť syntézy cholesterolu. S inhibíciou HMG-CoA je spojená aj znížená tvorba koenzýmu Q10, ktorý je dôležitou zložkou bunkového metabolizmu a zabezpečuje stabilitu bunkových membrán. Pri jeho deficite sú myocyty náchylnejšie na poškodenie (myopatie).
V našej štúdií sa zaoberáme dvomi polymorfizmami A388G a C463A nachádzajúcimi sa v exóne 4 génu SLCO1B1. Analyzovali sme 103 pacientov s diabetes mellitus (DM) na prítomnosť spomínaných polymorfizmov. Pomocou PCR-RFLP analýzy sme zistili jednotlivé zastúpenie daných polymorfizmov u jedincov s diabetes melitus. Frekvencia polymorfizmu A388G bola 19 %. Frekvencia polymorfizmu C463A bola 1%. Vzhľadom na vysoký výskyt polymorfizmu spojeného s rizikami statínovej terapie (19%) a častou preskripciou týchto farmák u pacientov s DM by bolo vhodné pred podaním týchto liečiv uvažovať o indikácií molekulárno - genetického vyšetrenia polymorfizmov v géne SLCO1B1.
X-viazané adrenoleukodystrofie v SR
Robert Petrovič, Mária Fischerová, Janka Konkoľová, Ján Chandoga, Daniel Böhmer
Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Odd. molekulovej a biochemickej genetiky, Bratislava, Slovenská republika
Peroxizómy sú subcelulárne štruktúry, ktoré sa nachádzajú u eukaryotických mikroorganizmov a vo väčšine buniek živočíšneho alebo rastlinného pôvodu. Metabolické funkcie peroxizómov zahŕňajú oxidáciu širokého spektra látok za prítomnosti kyslíka. Z hľadiska bunkovej patológie sú najvýznamnejšie procesy α - a ß-oxidácie karboxylových kyselín, zvlášť významná je ß-oxidácia karboxylových kyselín s veľmi dlhým reťazcom (VLCFA), ktorá prebieha výlučne v peroxizómoch.
Mutácie peroxizómových génov spôsobujú závažné metabolické poruchy. V súčasnosti sú známe takmer dve desiatky peroxizómových dedičných ochorení. Najfrekventovanejším peroxizómovým ochorením je X-viazaná adrenoleukodystrofia s frekvenciou výskytu 1 : 10 000–20 000 chlapcov. Vyznačuje sa recesívnym typom dedičnosti viazaným na X-chromozóm. Toto ochorenie je spôsobené nefunkčnosťou génu ABCD1, ktorého produktom je transmembránový proteín (75kDa) patriaci k ATP-viažucim kazetovým (ABC – ATP binding cassete) transportérom.
X-adrenoleukodystrofia ma viacero klinických fenotypov s prejavmi v detskom, adolescentnom a adultnom veku. Existuje taktiež aj klinicky menej závažná forma, ktorá sa manifestuje až v dospelom veku – adrenomyeloneuropatia.
V diagnostike peroxizómových dedičných ochorení sa využívajú biochemické a molekulárno-genetické metódy, ktoré zachytia viaceré abnormality a zmeny prejavujúce sa na rôznych úrovniach postihnutého organizmu. Táto škála metód umožňuje nielen postnatálnu, ale aj prenatálnu diagnostiku.Na našom pracovisku, sa podarilo komplexnou diagnostikou v priebehu posledných desať rokov zachytiť 14 rodín s X ALD a odhaliť aj 4 nové, doposiaľ nepopísané mutácie v géne ABCD1. Taktiež sme uskutočnili genetické vyšetrenia u rodinných príslušníkov postihnutých a niekoľko prenatálnych diagnostík.
Práca bola podporovaná Ministerstvom zdravotníctva Slovenskej republiky v rámci projektu “Vypracovanie a translácia laboratórnych, klinicko-diferenciálno-diagnostických a terapeutických algoritmov pri peroxizómových dedičných metabolických poruchách” č. 2007/38-FNSPBA-03
Zastúpenie vybraných mutácií u pacientov so suspektnou Wilsonovou chorobou
Jana Lisyová, Mária Fischerová, Róbert Petrovič, Ján Chandoga
Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Bratislava, Slovenská republika
Wilsonova choroba (WD) je relatívne zriedkavé genetické ochorenie s celosvetovou prevalenciou 1 : 30 000 vyznačujúce sa autozómovo recesívnym typom dedičnosti. Je spôsobená mutáciami v géne ATP7B (13q14.3), ktorý kóduje meď-transportujúcu ATPázu typu P zúčastňujúcu sa jednej z posttranslačných modifikácií apoceruloplazmínu. Má funkciu biosyntetickú (podieľa sa na dodávaní medi do sekrečnej cesty pri tvorbe Cu-transportéra ceruloplazmínu) a homeostatickú (zúčastňuje sa exportu nadbytočnej medi z buniek). Pri ochorení dochádza k postupnému hromadeniu medi v tkanivách a jej toxickému pôsobeniu na organizmus. Ochorenie postihuje viacero funkčne zdanlivo na sebe nezávislých orgánov (najmä pečeň, mozog a obličky). Výnimočnosťou ochorenia je jeho liečiteľnosť, na druhej strane skutočnosť, že neliečené sa končí fatálne. Klinický obraz WD býva veľmi rôznorodý a podľa symptomatológie sa rozlišuje niekoľko foriem (hepatická, neurologická, psychiatrická). Liečba Wilsonovej choroby je celoživotná, využívajú sa chelatačné činidlá (D-penicilamín) a zinková terapia. Prítomnosť širokého mutačného spektra (viac ako 380 známych mutácií) podmieňuje rôzne fenotypové prejavy a značne sťažuje diagnostiku. V stredoeurópskej populácii je najfrekventovanejšou mutáciou H1069Q. Vo svete je zodpovedná za 60 % všetkých vyskytujúcich sa mutácií. Za účelom rýchleho hľadania tejto kauzálnej mutácie v súbore suspektných pacientov využívame na našom pracovisku diagnostickú PCR metódu BI-PASA (Poláková a kol., 2007). Ďalšie štyri rozšírené mutácie (3402delC, 1340del4, R778G, W779X) detekujeme pomocou RFLP (Vrábelová a kol., 2005) a fragmentačnej analýzy (Fischerová, nepublikované). Od roku 2006 sme vykonali molekulárno-genetickú DNA diagnostiku Wilsonovej choroby u 523 požadovaných osôb, z ktorých u 22 sme diagnózu WD potvrdili. Na základe dôkazu prítomnosti vyšetrovaných mutácií sme identifikovali 17 homozygotných pacientov (H1069Q – 14 pacientov, 3402delC – 1 pacient, 1340del4 – 2 pacienti), zvyšní piati sú kombinovaní heterozygoti pre H1069Q a jednu z menej častých mutácií (3402delC – 2 pacienti, 1340del4 – 1 pacient, W779X – 2 pacienti). Napriek tomu, že u 54 pacientov sa nám podarilo detekovať prítomnosť iba jednej vyšetrovanej mutácie, diagnózu WD u nich vylúčiť nemožno. Nakoľko u pacientov nesúcich iba jednu alebo žiadnu kauzálnu mutáciu sú popri klinickom náleze prítomné aj biochemické, resp. funkčné ukazovatele svedčiace o WD, je pre určenie definitívnej diagnózy nevyhnutná sekvenčná analýza, ktorá je na pracovisku zavedená. Vzhľadom na jej náročnosť a ekonomické náklady v prípade WD musí byť indikácia dôkladne zvážená.
První česká rodina s prokázanou dominantní mutací v genu pro Connexin 26
Radka Pourová1, 2, Marcela Malíková1, Petra Křenková1, Markéta Havlovicová1, Anna Křepelová1
1Ústav biologie a lékařské genetiky 2. LF UK a FN Motol, Praha
2DNA laboratoř Kliniky dětské neurologie 2. LF UK a FN Motol, Praha
Mutace v genu GJB2, který kóduje protein Connexin-26, jsou nejčastější příčinou (až 50 %) autozomálně recesivní nesyndromové ztráty sluchu (DFNB1, OMIM #220290). Vzácně jsou však jiné mutace v tomto genu příčinou autozomálně dominantní ztráty sluchu, a to jak nesyndromové (DFNA3A, OMIM #601544), tak i několika různých syndromů zahrnujících zejména současné postižení kůže – např. KID (#148210), Vohwinkelův (#124500) či Bart-Pumphreyův syndrom (#149200). Dosud bylo publikováno pouze pět rodin s projevy palmoplantárního keratoderma a ztráty sluchu (OMIM #148350) s prokázanými dominantními mutacemi v genu GJB2.
Prezentujeme intrafamiliární fenotypovou variabilitu v romské rodině, jejíž tři členové jsou postiženi ztrátou sluchu (ZS) a palmoplantární keratodermatózou (PK).
Probandem je 22letý chlapec, který kromě HL a PK trpí epilepsií s pozdním nástupem.
Matka a sestra probanda jsou postiženy stejným stupněm ZS, avšak nemají žádné známky záchvatového onemocnění. U matky je jsou projevy PK mnohem mírnější než u obou potomků. Probandův otec ztratil sluch po časné meningitidě a nemá žádné známky PK. Všichni prarodiče jsou slyšící a bez kožních příznaků.
Molekulárně genetická analýza odhalila u probanda, jeho sestry i matky mutaci p.Arg75Trp (c.223C>T) genu GJB2, která již byla popsána jako patogenní dominantní mutace. Matka je navíc nosičkou mutace p.Met34Thr (c.101T>C) na druhé alele. Role této mutace byla v literatuře opakovaně přehodnocována a zůstává nejasná. Její význam pro modifikaci fenotypu budeme diskutovat v této kazuistice.
Podpořeno MZ0FNM2005 a IGA NS 9913-4.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Respirační kaleidoskopČlánek Kniha
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Nádory štítné žlázy – molekulárně genetické příčiny a možnosti cílené léčby
- Autofagie a její úloha v obranné a poškozující zánětové reakci*
- Plánované akce odborných složek ČLS JEP
- Běžná dětská obezita a její metabolické následky
- Plánované akce odborných složek ČLS JEP
- Faktory ovlivňující experimentování s kouřením: výsledky studie ELSPAC
- Kurz koordinátorů HPH (Health Promoting Hospitals, Nemocnic podporujících zdraví) a podzimní škola WHO v Praze
- Zemřel prof. MUDr. Petr Zatloukal, CSc.
- XV. celostátní konference DNA diagnostiky
- Plánované akce odborných složek ČLS JEP
- Jedenáctá konference o menopauze na Seči
- World Medical Association (WMA) o sociálních determinantách zdraví
- 17. ročník onkologického sympózia na téma „Onkologie v gynekologii a mammologii“
- 10. sympozium Aktuality v dětské intenzivní péči v Ostravě
- Respirační kaleidoskop
- Kniha
- Spolek českých lékařů v Praze
- Ocenění České lékařské společnosti JEP prof. MUDr. Pavlu Bartákovi, CSc.
- Velikost endozomů je regulována p97
- EARL WILBUR SUTHERLAND (1915–1974)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Autofagie a její úloha v obranné a poškozující zánětové reakci*
- XV. celostátní konference DNA diagnostiky
- Běžná dětská obezita a její metabolické následky
- Zemřel prof. MUDr. Petr Zatloukal, CSc.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy