-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nové zobrazovací metody v endoskopické diagnostice nádorů trávicího ústrojí
Novel imaging methods in endoscopic diagnosis of gastrointestinal tumors
Advances in imaging, digitization and all kinds of technologies result in development of potentially efficient imaging modalities, which enable magnification to subcellular levels, color differentiation and observation of pathophysiological processes. NBI, FICE, I-scan and KFE are new commercially available modalities.
NBI is the most explored one. Its contribution has been shown in diagnosis of Barrett's neoplasia and esophageal squamous cell carcinoma and in characterization of early stomach cancer. It enables rather accurate characterization of changes in adenomatous colonic polyps; however it is not used for this purpose in clinical practice. It can demonstrate atrophy of small bowel mucosa in celiac disease, but it is not able to evaluate intraepithelial lymphocytosis. Its contribution in dysplasia detection in inflammatory bowel disease is not significant; chromoendoscopy remains the gold standard.
The use of CFE remains experimental; the routine use is limited also due to its high cost.Keywords:
imaging, new technologies, colonoscopy, NBI, FICE, i-scan, autofluorescence, confocal endomicroscopy, neoplasia
Autoři: prof. MUDr. CSc. Julius Špičák
Působiště autorů: Klinika hepatogastroenterologie IKEM Praha
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 13-22
Kategorie: Přehledové články
Souhrn
Pokroky ve zobrazení, digitalizaci a technologiích všeho druhu vedou ke vzniku potenciálně účinných zobrazovacích modalit, které umožňují zvětšení zobrazení až na subcelulární úroveň, barevné rozlišení i sledování patofyziologických pochodů. Z těchto nových metod jsou komerčně dostupné NBI, FICE, i-scan a KFE.
Nejvíce prozkoumaná je NBI. Její přínos byl prokázán v diagnostice neoplazií u Barrettova jícnu a skvamocelulárního karcinomu jícnu a ve zpřesnění charakteristiky časného karcinomu žaludku. Umožňuje poměrně přesně určení typu změn u adenomových polypů tlustého střeva, nicméně v praxi se takto nevyužívá. Demonstruje atrofii tenkého střeva u celiakie, ale není schopna posoudit intraepitelovou lymfocytózu. U nespecifických střevních zánětů v detekci dysplazií její přínos není významný a zlatým standardem zůstává přímá chromoendoskopie.
KFE je stále předmětem klinického výzkumu, rutinnímu využití brání i vysoká cena.Klíčová slova:
zobrazení, nové technologie, kolonoskopie, NBI, FICE, i-scan, autofluorescence, konfokální endomikroskopie, neoplazieÚvod
Endoskopie je průlomová a po všech stránkách kontinuálně se zdokonalující disciplína. Pokud jde o diagnostiku, je hlavním cílem spolehlivě rozpoznat patologické procesy a správně je určit jak po stránce biologické povahy, tak i co do rozsahu onemocnění. Protože oboru dominují nádorová onemocnění, je z povahy problému nanejvýš důležité včas diagnostikovat a správně interpretovat maligní onemocnění a jejich prekurzory.
Nevýhodou všech endoskopických metod je problematická tolerance, u kolonoskopie také nepříjemná příprava, v případě odběru bioptických vzorků časový odstup stanovení vyplývající z používaných technologií a omezené propustnosti patologických pracovišť, jež se musejí vypořádat se zvyšujícími se požadavky na vyšetření, a dále celkově poměrně vysoká cena.
Ideálem by bylo určit biologickou povahu procesu a jeho rozsah časně a průběžně během jednoho sezení. K tomuto ideálu míří níže popsané technické inovace.
Základní vlastností zobrazovacích systémů je rozlišovací schopnost, což je vzdálenost dvou bodů, které jsme schopni odlišit. U videoendoskopů je rozlišovací schopnost funkcí denzity pixelů, takže čím je vyšší, tím rozlišovací schopnost narůstá. U standardních endoskopů je jich 100 000–400 000, rozložených v poměru 4 : 3, tj. 640–700 pixelů na šířku a 480–525 pixelů vertikálně. Endoskopy o vysoké rozlišovací schopnosti (HD) obsahují 850 000–1 000 000 pixelů a jsou schopny detekovat objekty o průměru 10–71 μm, zatímco rozlišovací schopnost prostého oka je 125–165 μm. V poslední době se prosazuje zobrazení v poměru 5 : 4.
Pro dosažení HD zobrazení je nutné, aby všechny komponenty endoskopické jednotky, tedy endoskop s čipem, procesor, monitor a přenosové kabely, byly HD kompatibilní. Zvětšovací endoskopy využívající pohyblivé čočky mohou dosáhnout 150násobného zvětšení. Provádí vlastně přiblížení k objektu se zachováním počtu pixelů, a tedy rozlišovací schopnosti. Elektronické zvětšení přibližuje obraz na displeji 1,5–2× s následkem nižšího počtu pixelů na zobrazenou plochu. Další zlepšení zobrazení může spočívat obecně v dalším zvětšení, případně až na subcelulární úroveň, a zvýraznění povrchových struktur (1).
Virtuální chromoendoskopie – narrow-band imaging (NBI), FICE, i-scan
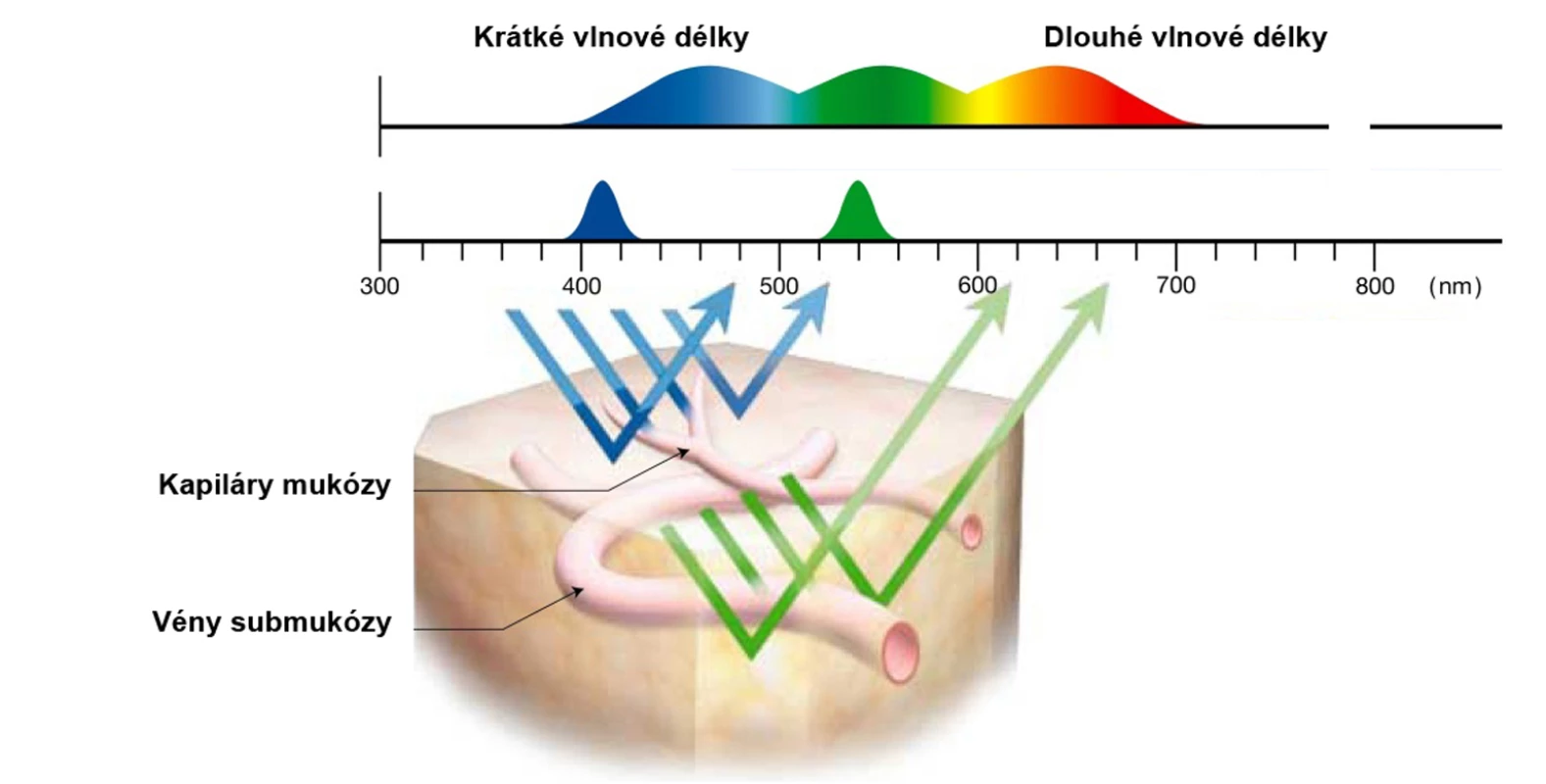
Metoda využívá spektroskopické charakteristiky videoendoskopů prostřednictvím sekvenční iluminace s výsledkem zvýrazněné vaskularizace a povrchových struktur, podobně jako tomu je u standardní chromoendoskopie. Standardní videoendoskop užívá celého spektra světla (400–700 nm). Metoda je založena na tkáňové penetraci světla v závislosti na koncentraci hemoglobinu, protože jednotlivé vlnové délky jsou jím absorbovány nestejnoměrně. Bílé světlo proniká pouze do sliznice, zatímco červená část spektra proniká hlouběji. NBI využívá sekvenční červeno-zeleno-modrou iluminaci se speciálním filtrem, který zvyšuje podíl modrého svazku vlnové délky 415 nm zabarvujícího hnědě kapiláry povrchu sliznice a filtru zvyšujícího podíl iluminace zeleným světlem o vlnové délce 540 nm s modrým zobrazením hlubších cév, což při integraci do jednoho obrazu vede ke zvýraznění povrchových barevných a tvarových a cévních kontur (2) (obr. 1, 2). Využití tohoto fenoménu umožňuje endoskopie se zvětšením obrazu.
Obr. 1. Zobrazení polypu pomocí NBI 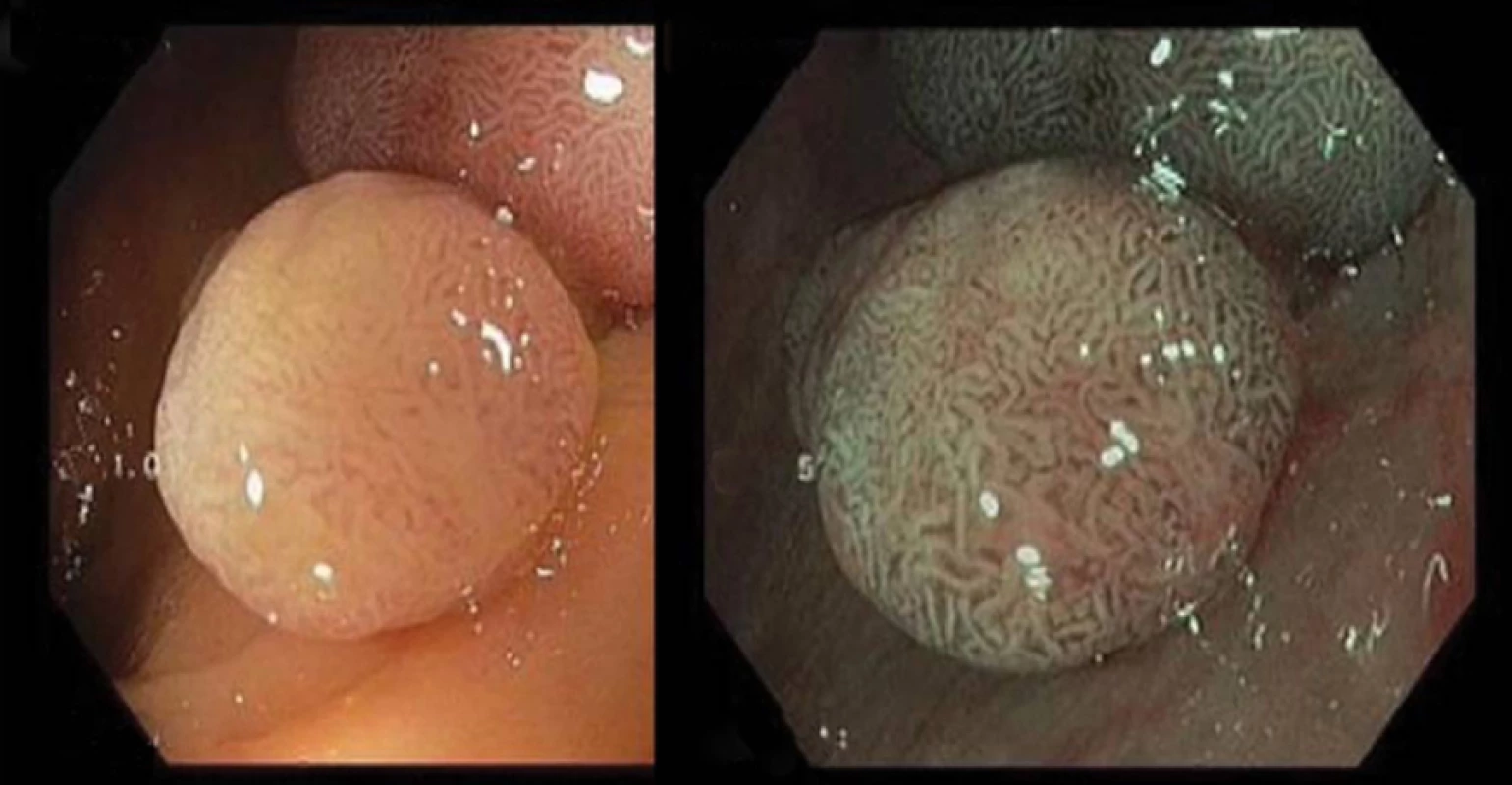
Další systémy nepracují s filtry, ale s počítačovou manipulací, která pomocí spektrální matrix selektuje vlnové délky jednotlivých pixelů. Toto zobrazení tedy není založeno na interakci světla a tkáně, nýbrž manipuluje jednotlivé komponenty s vytvořením virtuálního obrazu o výraznějších barevných a strukturálních konturách. Na tomto principu pracují systémy Fujinon intelligent chromoendoscopy (FICE, Fujinon, Japonsko) a i-scan (Pentax, Japonsko). Jak naznačuje název, přídatného barviva se neužívá. Systém umožňuje přepínat mezi různými moduly, které opět zvýrazňují strukturální odlišnosti (3).
Zobrazení s využitím autofluorescence (AF)
AF využívá rozdílu v různých koncentracích fluoreskujících biomolekul, jako jsou elastin, kolagen a NADH, mezi normální tkání a neoplastickou lézí. Biologicky odlišné tkáně se zvýrazňují při osvitu modrého světla o vlnové délce 400–475 nm. Neoplastické léze se ztluštěním mukózy a zvýšením obsahu hemoglobinu emitují autofluorescenci méně než okolí (4). Autofluorescence indukovaná laserem může být analyzována s automatizovaným výsledkem charakteristiky adenomové tkáně (ano/ne). Příslušně vybavená sonda se zavádí bioptickým kanálem k polypu (5).
Optická koherentní tomografie (OCT)
Tato technika byla jako první klinicky použita v oftalmologii ke zobrazení struktur uvnitř bulbu a následně byla aplikována i v dalších specializacích. OCT pracuje na podobném principu jako ultrazvukové vyšetření, avšak k dosažení zobrazení příčného řezu tkání do hloubky 2 mm využívá vlnové délky blízké infračervenému světlu. Na rozdíl od ultrazvuku OCT sonda nevyžaduje kontakt a poskytuje daleko vyšší rozlišovací schopnost 2–4 μm vs. 100 μm. V ojedinělé klinické studii OCT diagnostikovala neoplazii v Barrettově jícnu s 68% senzitivitou a 82% specificitou. V současné době žádný OCT přístroj není běžně k dispozici (6).
Spektroskopie
Podobně jako jiné metody je i tato založena na interakci světla s tkání. Spektroskopie zkoumá strukturu světelných odrazů, která je velmi variabilní. Světlo se může odrážet přímo i komplikovaně, může být absorbováno i odrazem měnit vlnovou délku. Tyto vlastnosti se mění v důsledku biologických pochodů.
Elastická rozptýlená spektroskopie (elastic scattering spectroscopy) analyzuje charakter rozptýlení odrazů ve vztahu k mikroarchitektuře nádorové tkáně. Podle recentní retrospektivní studie 218 polypů dosáhla tato metoda 91,5% senzitivity, 92,2% specificity a 91,9% přesnosti (7). In-elastická (Raman) rozptýlená spektroskopie vytváří tzv. Raman spektrum. Byly vytvořeny prototypy sond o různých vlastnostech, které se zasouvají do bioptického kanálu endoskopu a rotací mapují povrch jícnu v poněkud opožděném časovém modu. Jedna z posledních studií se zabývala in vitro vyšetřením vzorků odebraných při kolonoskopii. Při 10s a 1s akvizici dosahovala přesnost v rozlišení normální, adenomové a adenokarcinomové tkáně 74,1 % a 63,5 % (8).
Low-coherence enhanced backscattering spectroscopy podává informace o hlubších strukturách a nabízí tak potenciální využití ve stagingu. Inelastic (Raman) scattering spectroscopy analyzuje změny vlnových délek odraženého světla způsobené vibrací buněčných struktur. Tyto změny jsou velmi subtilní a instrumenty sofistikované, a proto náchylné k nesprávné interpretaci. Fluorescenční spektroskopie se zakládá na principu změněné vlnové délky re-emitovaného světla ve vztahu k emitované fluorescenci. Iluminuje se laserem, fluorofor může být endogenní (kolagen, flaviny) i exogenní (porfimer sodíku, protoporfyrin IX indukovaný kyselinou aminolevulovou). Informace může být podána formou kvantitativní i vizuální. Prototypy se podobně jako u konfokální mikroendoskopie mohou zavádět bioptickým kanálem konvenčních endoskopů nebo se integrují v jeden systém, případně se využívají samostatně (9).
Konfokální endomikroskopie (KFE)
První publikace o této technologii pochází z roku 2004. Využívá exogenních kontrastních látek a laserového světla s cílem zobrazit tkáň na subcelulární úrovni. Podobně jako jiné technologie hledá uplatnění ve všech systémových specializacích. Vysoká rozlišovací schopnost se dosahuje iluminací tkáně laserem s následnou reflexí fluorescence. Název konfokální odkazuje na uspořádání emitovaného laseru zaměřeného dle zvolené hloubky a detekovaného reflexu stejnou detekční čočkou. Využívá jen přímo směřující paprsky, což maximálně zvyšuje rozlišovací schopnost až na úroveň virtuální histologie (tzv. optická biopsie).
V gastroenterologii jsou v současné době k dispozici dva odlišné systémy. Mikroendoskop Pentax integruje konfokální technologii s konvenčním gastroskopem či kolonoskopem Pentax (EG-3870CIK, EC-3840CIK); (EKE). Zobrazuje buněčné vrstvy do hloubky 250 µm, takže poskytuje zobrazení analogická s histologickými řezy, ovšem v rovině lumen v zorném poli 475 × 475 μm. Horizontální rozlišovací schopnost na úrovni 0,7 µm a vertikální 7 μm je nejvyšší ze všech optických modalit. Frekvence jednotlivých scanů je 1,6 či 0,8/sec.
Systém Cellvizio-Gi (Mauna Kea Technologies, Paříž, Francie) využívá laserovou sondu, kterou lze zavést pracovním kanálem jakéhokoliv běžného endoskopu. Zahrnuje modely CholangioFlex, GastroFlex (standardní a UHD) a ColoFlex (standardní a UHD). Životnost sond nedovoluje o mnoho více než 20 použití. Hloubka zobrazení dosahuje 40–70 μm u CholangioFlexu, 70–130 μm u standardního GastroFlexu a ColonoFlexu a 55–65 μm u sond UHD. Rozsah zorného pole činí 325 μm, 600 μm a 240 μm u jednotlivých typů sond. Tento systém umožňuje endoskopistovi porovnávat obraz endoskopický i konfokální, protože sonda se zobrazuje v endoskopickém zorném poli. Systém však není schopen snímat prohlíženou tkáň po vrstvách, přičemž rozlišovací schopnost se pohybuje mezi 1 a 3,5 µm. Jednotlivé obrázky následují přibližně desetinásobně rychleji, než je tomu u přístroje Pentax.
Snímání obrazů oběma systémy je podmíněno kontaktem s vyšetřovanou tkání. Oba systémy jsou přibližně stejně drahé a zájemce musí počítat s více než 2 000 000 Kč (10). Udává se, že zacvičení do KFE vyžaduje 100 výkonů pod dohledem (11).
U obou systémů je k zobrazení buněčných struktur nezbytné exogenně dodávané barvivo. Používají se celkově podávaný fluorescein a topický akriflavin. Výhodou fluoresceinu je zobrazení hlubších struktur, například lamina propria, avšak neshromažďuje se v jádrech buněk. Akriflavin byl původně užíván jako antibakteriální agens a jeho kumulace v blízkosti jader navozuje úvahu o možném mutagenním potenciálu, nicméně vedlejší účinky nebyly zaznamenány. Do hlubších struktur neproniká. Pouze první látka je schválena FDA.
Je otázkou, jaká je spolehlivost interpretace těchto virtuálně histologických nálezů ve srovnání s klasickou patologií. Zdá se, že meziexpertní variabilita je ve všech lokalizacích trávicího traktu přijatelná a překvapivě krátká je i doba nutná ke zvládnutí metody (tzv. learning curve). Výše uvedené systémy mají v důsledku užité technologie omezenou hloubku tkáňového zobrazení. Hlubší struktury je možné zobrazit vlnovými délkami blízkými infračervenému světlu a dvoufotonovou či multifotonovou mikroskopií využívající indocyaninovou zeleň (12).
Endocytoskopie
Endocytoskopie dosahuje zobrazení na buněčné úrovni objektivem s vysoce zvětšující čočkou po standardním osvětlení. Vyzkoušeny byly tři prototypy firmy Olympus: Dva na principu sondy o délce 380 cm a průměru 3,2 mm poskytující zvětšení 450× při zorném poli 300 μm × 300 μm a 1125× při zorném poli 120 μm × 120 μm s výsledným zvětšením na 19 palcovém monitoru 570× a 1400×. V druhém je čočka integrovaná ve standardním gastroskopu a kolonoskopu a poskytuje 580násobné zvětšení. Na jeho konci je plastový nástavec, který umožňuje stabilizaci kontaktu endoskopu s pozorovanou tkání. Oba systémy poskytují zobrazení v horizontální ose po kontaktu, jemuž předchází aplikace mukolytického činidla a barviva (n-acetylcystein, methylenová a toluidinová modř s oplachem) (13).
Mikroendoskopie o vysokém rozlišení (high-resolution microendoscopy [HRME])
Zobrazení na buněčné úrovni se dosahuje aplikací fluorescence, na rozdíl od KFE však využívá iluminace LED, a zobrazení se tak dosahuje v reálném čase. Penetrace není tak hluboká jako u KFE, technologie je však potenciálně levnější (kolem 4000 USD), aniž by v současné době byla komerčně dostupná. Podobně jako u endocytózy se sonda zavádí bioptickým kanálem mateřského přístroje. V předběžných studiích byl identifikován Barrettův jícen a adenokarcinom jícnu se senzitivitou 87 % a specificitou 61 % (14).
Multifunkční mikroendoskopy
Rozvoj nových technologií se snahou integrovat jednotlivé fyzikální principy je fascinující. Objevil se multifunkční mikroendoskop o zevním průměru 200 μm a 5000 pixelech dosahující rozlišovací schopnost < 1 μm. Flexibilní instrument lze zasouvat i do cév a kromě zobrazení měří fyziologické parametry, například koncentraci hemoglobinu (15).
Molekulární zobrazení
Požadavek na nové technologie vyplývá zejména z podstaty kancerogeneze u Barrettova jícnu a částečně také u ulcerózní kolitidy a gastritidy, kdy premaligní prekurzory mohou být standardní endoskopií i při použití chromoendoskopie nezobrazeny. Sturm et al. jako první vyvinuli peptid specificky se vážící k pokročilé dysplazii a adenokarcinomu u Barrettova jícnu a prokázali 75% senzitivitu a 97% specificitu (16).
Další možnosti zobrazení vyplývají z konceptu kmenových buněk, kdy lze porovnat rozdíl v expresi unikátních buněčných struktur na povrchu barrettovských buněk, které mohou být rozpoznány cytotoxickými protilátkami (17). Technika fluorescenční KFE sondy umožňuje monitorovat expresi katepsinu E, která se zvyšuje souběžně s progredujícím maligním potenciálem prekurzorů karcinomu pankreatu (18). Těžko odhadnutelný potenciál skrývají proteomové technologie, jež směřují od identifikace spektra proteinů k jejich kvantifikaci (19).
Vizualizace fyziologických pochodů
Výhodou endomikroskopie oproti histologii je skutečnost, že prosta artefaktů zobrazuje struktury v reálném čase a zobrazením mikroskopických změn napomáhá poznání patofyziologických pochodů. Střevní sliznicí pronikají nepatrné otvůrky, které jsou dobře zobrazitelné u myšího modelu, kde jsou u experimentální kolitidy četnější dříve, než se objeví jakékoliv makroskopické zánětlivé změny. Podobné změny na tenkém střevě odpovídají bakteriální translokaci.
Fyziologické pochody se dále zvýrazňují imunohistochemickým barvením značením peptidů a protilátek. Je možné značit specifickými karboxy-fluoresceinovými ligandy somatostatinové receptory u myší, adenomy u člověka topickou aplikací specifického značeného peptidu a karcinom i protilátkami proti receptoru epidermálního růstového faktoru (EGFR) (20).
Využití jednotlivých metod u konkrétních diagnóz
Kolorektální karcinom
Účinnost jednotlivých systémů se zkoumá v relevantních klinických jednotkách se snahou nádorové změny klasifikovat. Kudo si jako první povšiml, že charakter a uspořádání krypt neoplastických lézí z endoskopického pohledu může predikovat biologickou povahu neoplastického procesu (21). Plné využití jeho podnětu bylo umožněno zvětšovací endoskopií s NBI a vyústilo v klasifikaci, která byla opakovaně přepracována Kudem i jeho následovníky.
Běžnou endoskopií zůstává dle metaanalýzy nezachyceno 22 % polypů (22). Důvody jsou špatná příprava, charakteristika léze (plochý polyp) a technika či nezkušenost endoskopisty. U 482 nemocných se zkoumal přínos NBI ve srovnání s konvenční koloskopií. Detekce polypů byla významně vyšší v kontrolní skupině než ve skupině NBI (102 vs. 72; RR 0,75), nicméně v určení pacientů s polypy a adenomy nebyl rozdíl statisticky významný. Podobně metaanalýza 5 studií a 2479 nemocných neshledala mezi NBI a kontrolami v žádném z obvyklých parametrů významné odlišnosti (23). Se stejným záměrem byly publikovány tři studie s FICE, aniž by prokázaly zvýšený ADR (24). Přehled studií hodnotících účinnost moderních zobrazovacích technik v detekci kolorektálních neoplazií je uveden v tab. 1 a 2.
Tab. 1. Diagnostika kolorektální neoplázie pomocí NBI, FICE a autofluorescence bez zvětšení 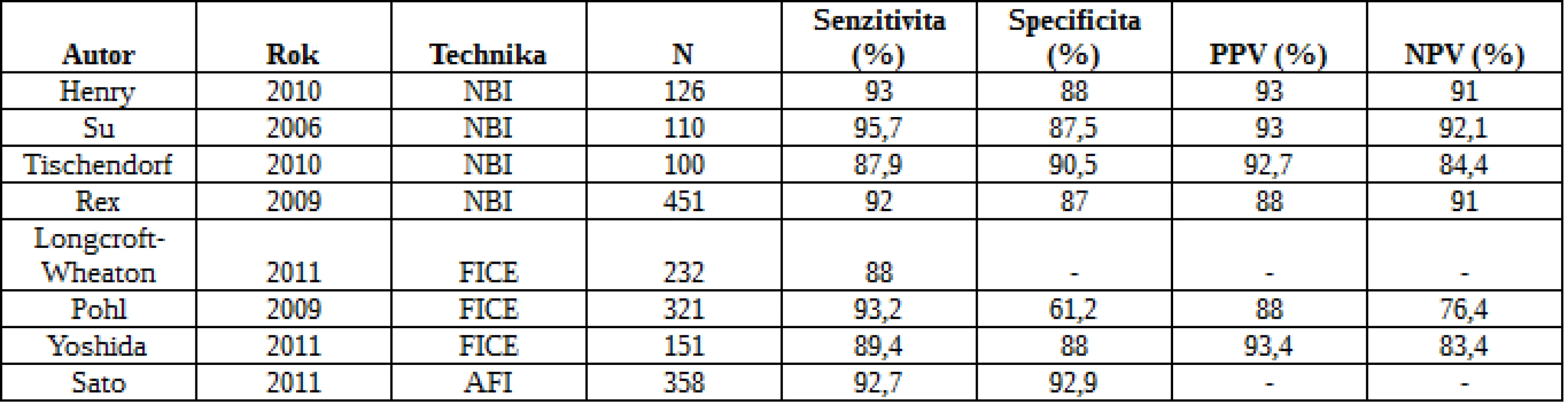
Tab. 2. Diagnostika kolorektální neoplazie pomocí NBI a FICE se zvětšením 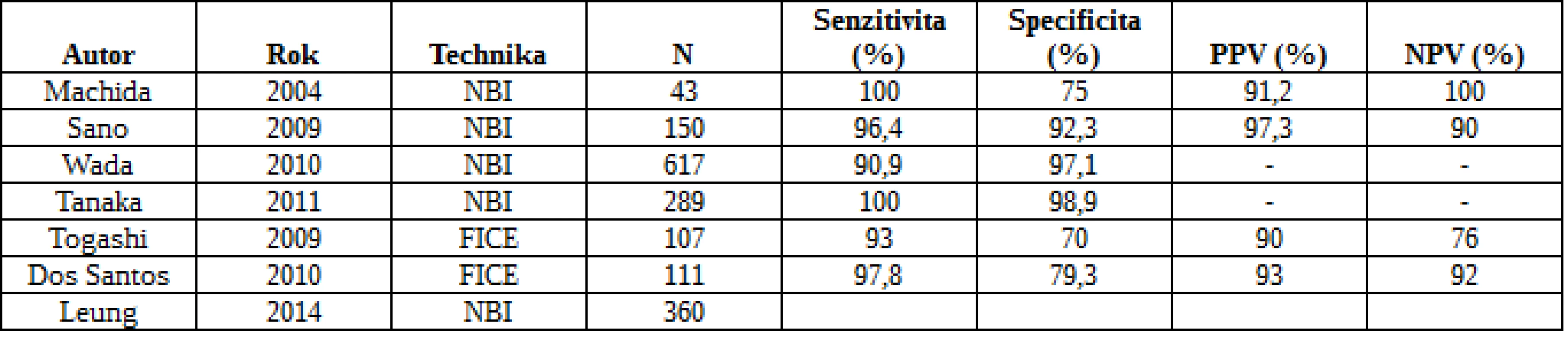
Velmi zajímavá recentní studie zkoumala přínos NBI v tandemové studii a jednotlivé skupiny byly postaveny takto: standardní kolonoskopie → NBI, NBI → standardní kolonoskopie, standardní kolonoskopie 2×. Mezi jednotlivými skupinami nebyl v záchytu adenomů významný rozdíl, rozhodujícím faktorem bylo tandemové uspořádání (25).
Vedle krypt (pit pattern) je důležitou charakteristikou neoplazií kapilární síť. Rastogi definoval celkem pět charakteristik odlišujících neoplastické léze (vedle povrchu také krypty a kapilární síť) (26).
Poměrně nedávno se ustanovila mezinárodní skupina (Colon Tumor NBI Interest Group; Japonsko, Spojené státy americké, Evropa) a vyvinula poměrně jednoduchá kritéria klasifikující kolorektální neoplazie pomocí NBI bez zvětšení na tři kategorie (27). Podle klasifikace Sana ve stadiu I (hyperplastický polyp) není kapilární struktura patrná. U adenomových polypů má kapilární struktura pravidelný charakter (stadium II). Stadium III charakteristické nepravidelnou strukturou se ještě dělí na podskupiny podle denzity, zakončení, větvení a podtyp B je pozorován většinově u invazivních nádorů (28). Také podle Hiroshimy lze jednotlivé vzorce uspořádání kapilár rozdělit do tří skupin (29). Showa naproti tomu klasifikoval slizniční změny podle vaskulární struktury do šesti skupin: normální, nezřetelná, síť, hustá, nepravidelná a rozptýlená (30).
Endocytóza umožňuje tak detailní pohled, že jsou rozpoznatelné jednotlivé erytrocyty putující kapilárami. Je možné diferencovat mezi normální a neoplastickou tkání stejně jako mezi adenomem a karcinomem. Nejčasnější známkou neoplazie jsou ložiska aberantních krypt. Jejich ústí je polygonální místo oválného, mají prodloužené jádro a lumen je lineární místo cirkulárního. Endocytoskopie vykázala v diagnostice dysplazie nízkého stupně 91,4% senzitivitu a 100% specificitu. Při interexpertní variabilitě byla mezi patologem a endoskopistou hodnota κ 0,68. Pozitivní predikční hodnota činila ve srovnání s patologií pro normální sliznici, hyperplastický polyp a invazivní karcinom 100 %, pro adenom s dysplazií lehkého stupně 93,1 % a pro adenom s dysplazií těžkého stupně 90,1 % (31). V jedné z prvních studií vykázala elastická rozptýlená spektroskopie v rozlišení hyperplastických a adenomových polypů 84% senzitivitu a stejnou specificitu (32).
Zajímavá je hypotéza, zda architektonika zdánlivě normální rektální sliznice může predikovat výskyt proximálně lokalizovaných neoplazií. Ve studii na 216 nemocných prokázala sonda s polarizační spektroskopií změny v mikrovaskulární perfuzi o senzitivitě 83 % a specificitě 82 % (33). AF podle některých autorů zvyšuje detekci adenomů a zpřesňuje jejich charakteristiku ve srovnání s NBI (34).
V jedné z prvních studií s KFE se ustanovila klasifikace změn odlišující normální, regenerující a nádorovou sliznici s velkou přesností na základě baze krypt a mikrovaskulatury a schopnost rozlišit tkáně dle rozdílných biologických procesů byla potvrzena dalšími studiemi (35). Protože fluorescein nebarví jádra, není možné alterovat s histologickým vyšetřením bez kombinace s povrchovým působením akriflavinu.
V rozlišení adenomových polypů dosáhla KFE 91% senzitivity (vs. 77% senzitivita u chromoendoskopie), specificita činila 76 %. V diagnostice malých adenomů byla senzitivita KFE vs. 64 % u NBI, avšak specificita byla o něco nižší (78 vs. 92 %). Zdá se, že systém lze použít k posouzení drobných lézí, které pak po odstranění není nutné odeslat k histologickému ověření (strategie resect and discard). Metoda byla dále zkoumána v hodnocení reziduálního tumoru po polypektomii se senzitivitou a specificitou 97 %, respektive 77 % (vs. 72% senzitivita a 77% specificita prosté endoskopie). Vyhnutí se biopsie u rekurentních lézí je výhodné s ohledem na další endoskopickou resekci, která je v případě fibrózních změn navozených biopsií svízelnější. Rozlišení neoplastických vs. ne-neoplastických lézí zkoumala nedávná metaanalýza 91 studií. Senzitivita, specificita a NPV u jednotlivých metod byla následující: NBI 91,0; 85,6; 82,5 %; i-scan 89,3; 88,2; 85,6 %; FICE 91,8; 83,5; 83,7 %; AF 86,7; 65,9; 81,5 %; KFE 93,3; 89,9 a 94,8 % (36).
Výtěžnost jednotlivých modalit v zachycení adenomových polypů zkoumala recentní metaanalýza 42 studií. U AF, FICE/i-scan, NBI a standardní chromoendoskopie jsou hodnoty RR u ADR následující: 1,04; 1,09; 1,03; 1,36. Jinými slovy statisticky významný rozdíl byl jen u klasické chromoendoskopie (37). European Society of Gastrointestinal Endoscopy (ESGE) ve svém doporučeném postupu doporučuje ve screeningu standardní kolonoskopii, NBI, FICE a i-scan u Lynchova syndromu, serátní polypózy a laterálně se šířících lézí. Jako náhradu histologie doporučuje NBI atd. jen v rámci striktně definovaných protokolů a po systematickém zaškolení (38).
Nespecifické střevní záněty
Přínos chromoendoskopie s indigokarmínem nebo methylenovou modří vyústil v její implementaci do všech doporučených postupů, přesto se u nás v běžné klinické praxi nevyužívá. Chromoendoskopii nehradí zdravotní pojišťovny a dalšími důvody jsou zdlouhavost a určitá komplikovanost metody. Přirozeně se vcelku automaticky předpokládaly podobné výsledky u virtuální endoskopie s NBI, případně FICE, i-scan či AFI, a tyto techniky byly zkoumány v přibližně 50 studiích. Ve většině případů se však předpoklady nenaplnily (viz tab. 3).
Tab. 3. Diagnostika dysplazie pomocí NBI/autofluorescence u pacientů s IBD 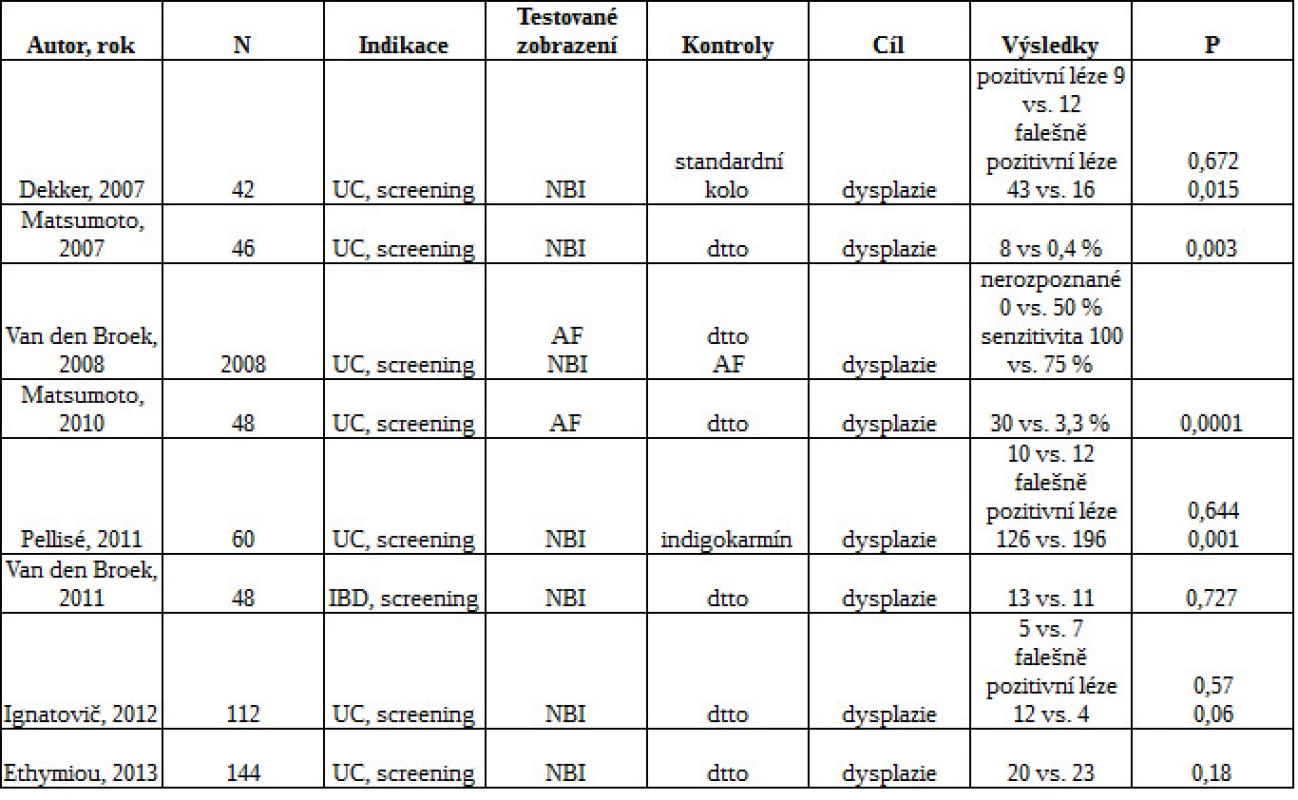
Dekker et al. detekoval 52 viditelných lézí u 17 nemocných vs. 28 lézí u 13 nemocných. Van den Broek et al. v tandemové studii nalezli 13 ze 16 (81 %) neoplastických lézí při NBI a 11 ze 16 (69 %) neoplastických lézí při standardní endoskopii (39, 40). Další studie prokázala nesignifikantní trend v častějším záchytu u chromoendoskopie vs. NBI (41). V poslední publikované studii se zkoumala NBI vs. standardní kolonoskopie. Vzorky se odebíraly v pravidelných intervalech a z viditelných lézí. Počet zachycených neoplazií se u obou technik významně nelišil, u NBI byl menší počet celkových biopsií a kratší čas vysouvání přístroje (42).
KFE spolehlivě vyhodnocuje aktivitu procesu. Typickými známkami jsou dilatace vyústění krypt, jejich nerovnoměrné uspořádání, zesílení prostoru mezi kryptami, jejich destrukce a fúze a abscesy s únikem fluoresceinu do jejich lumen, čímž se stává jasnějším proti okolnímu epitelu. Kromě buněčných struktur se hodnotí také bariérové defekty průnikem fluoresceinu přes epitel, což může být prediktivním markerem relapsu onemocnění. Cévní změny reprezentují dilatované a větvící se venuly. Pozorování těchto změn a snaha o systemizaci vyústila v klasifikační schéma (43).
Nabízí se možnost účinné detekce dysplazie v terénu ulcerózní kolitidy, nicméně studie přinášejí rozporné výsledky, což může být způsobeno selekcí nemocných a různou intenzitou zánětu. Kiesslich prokázal u KFE 94% senzitivitu a 98% specificitu, zatímco van den Broek při srovnání KFE s NBI dosáhl méně působivých čísel (přesnost 81 %) (44, 45). Neumann popsal charakteristické rysy aktivní Crohnovy nemoci (nepravidelné dilatované krypty, mikroeroze, zvýšená vaskularizace a zánětlivá infiltrace) a uspořádal je do skóre se snahou o predikci rekurence a odpovědi na léčbu (46).
Řada studií prokázala, že KFE je schopna účinně určit místo cílené biopsie bez nutnosti bioptovat etážově naslepo. Důležité je rozlišení léze dysplastické (dysplasia associated lesion or mass [DALM]) a adenomové polypoidní (adenoma-like mass [ALM]), protože v prvním případě je na místě totální kolektomie, zatímco druhá se odstraní polypektomií. U 36 nemocných s ulcerózní kolitidou byla stanovena biologická povaha polypoidní léze KFE s 97% přesností (47). V jiné studii Kiesslich prokázal, že fenomény úbytek buněk a narušení slizniční bariéry (mezery) mohou predikovat relaps se senzitivitou 62,5 %, specificitou 91,2 % a přesností 79 % (48). KFE také může být přínosem v diagnostice lymfocytární kolitidy, kde cílením následné biopsie eliminuje sampling error způsobený nerovnoměrnou distribucí patognomických změn (49).
Barrettův jícen a skvamocelulární karcinom
Stále častějším problémem jsou typické i atypické refluxní obtíže s negativním nálezem při standardní endoskopii. Sharma et al. prokázali při použití NBI častější výskyt mikroerozí a dilatovaných intrapapilárních kapilárních kliček (50).
Přes vysokou proendoskopovanost běžné populace incidence adenokarcinomu, jehož pra-prekurzorem je Barrettův jícen, stále narůstá, a tak se hledají rizikové faktory i možnosti časného záchytu relevantních premalignit. Podle jedné metaanalýzy dosahovala senzitivita a specificita NBI v detekci těžké dysplazie v Barrettově jícnu 96, resp. 94 % (51). Podobných výsledků dosáhla metoda FICE (52).
Žádný z pokusů o klasifikaci krypt nebyl na rozdíl od tlustého střeva univerzálně akceptován (Guelrudova, Endova, Karova, Sharmova a Anagnostopoulova klasifikace); (53). AF v prospektivní studii o jednom (amsterdamském) centru prokázala v diagnostice neoplazie v Barrettově jícnu 91% senzitivitu a 43% specificitu (54). Recentní studie posuzovala kombinaci AF a NBI a poměr falešně pozitivních nálezů poklesl ze 40,5 % u AF na 9,5 % u NBI-AF. PPV pak vzrostla z 59,5 % u AF na 84,8 % u NBI-AF (55). Zcela nedávno publikovaná metaanalýza 7 studií s NBI, jež zahrnula 3988 lézí (502 nemocných), prokázala senzitivitu a specificitu 0,91 a 0,95 vztaženo k pacientovi a 0,69 a 0,90 vztaženo k lézi (56).
Studie využívající rozptýlené spektroskopie srovnávané s biopsií vykázala detekci dysplazie s 90% senzitivitou (57). K podobně slibným výsledkům se přiblížily i další spektroskopické studie (58). OCT v prospektivní dvojitě slepé studii zahrnující 33 pacientů dosáhla v detekci těžké dysplazie 68% senzitivity a 85% specificity (59). OCT je svým příčným zobrazením schopna posoudit sílu Barrettovské sliznice a detekovat reziduální žlázy po radiofrekvenční ablaci a tím predikovat úspěch léčby (60). V jiné studii prokázala zanořené žlázky (buried glands) u 63 % nemocných po kompletní eradikaci a u 72 % před ní, a navodila tak otázku o relevanci tohoto fenoménu (61).
Epitel Barrettova jícnu je dle KFE charakteristický vilózním povrchem s tmavými inkluzemi podpovrchové vrstvě odpovídající mucinu obletových buněk. Síť kapilár se od dlaždicového epitelu liší a neoplazie jsou typické zcela nepravidelnou buněčnou strukturou. Více acidofilní maligní buňky jsou tmavé v důsledku fluorescenční intenzity, která je pH-dependentní. Na základě poměrně jednoduché klasifikace strukturálních změn včetně kapilární sítě převýšila senzitivita KFE v detekci Barrettova jícnu a asociovaných neoplazií 90 % (62). V jiné studii byla potřeba biopsií cílených endomikroskopií k detekci neoplazií výrazně snížena a u 2/3 vyšetřovaných se biopsiím bylo možné zcela vyhnout (63). Podobně v další studii se potřeba biopsií ve skupině s KFE snížila o 52 % (64).
V několika studiích byl zkoumán přínos HRME. Podle jedné bylo při zkoumání slizničních vzorků dvěma gastroenterology a dvěma patology dosaženo 87% senzitivity a 61% specificity. Ve stejné studii byly vzorky zkoumány prostřednictvím 59 charakteristik s dosažením senzitivity 87 % a specificity 85 % (65).
Sliznice jícnu s dlaždicovým epitelem má hladký povrch bez krypt a biologická povaha neoplastické léze se posuzuje podle sítě kapilár. Inoue klasifikoval kličky kapilár do pěti typů podle dilatace, zvlnění, nepravidelného kalibru a formovaných struktur a Arima do skupin čtyř, zdá se však, že endoskopickou ultrasonografii v určení invaze nenahrazují (66, 67).
Skvamocelulární karcinom lze diagnostikovat endocytoskopií podle dvou kritérií: abnormální zabarvení, tvar a velikost jádra a zvýšená buněčná denzita. Podle jedné studie byl průměrný počet jader u karcinomu v jednom obrazu 550 ± 66,5 vs. 129 ± 14,8 u normální sliznice (68).
Kapilární síť také zobrazuje KFE. Pilotní studie prováděná dvěma endoskopii prokázala abnormální cytologii s 89% a 96% přesností a abnormální vaskulární strukturu s 85% přesností (69).
Karcinom žaludku a gastritida
Podobně i u sliznice žaludku se několik autorů pokusilo o klasifikační schémata na základě mikrostrukturálních změn, v klinické praxi se ovšem nevyužívají. Obecně se v zemích západního světa s klesajícím, avšak stále významným výskytem karcinomu žaludku pečlivé diagnostice premaligních lézí pozornosti nedostává a gastritida se rutinně nebioptuje. Důvodem je také omezená prostupnost patologických oddělení.
Zejména v zemích s vysokým výskytem karcinomu žaludku a s významnou rolí endoskopické léčby je důležité přesně posoudit okraje léze s cílem dosažení kompletní resekce. Zdá se, že NBI v kombinaci se zoomem může být ve srovnání se standardní endoskopií přesnější (70). Někteří autoři popisují změny vaskularizace v souvislosti s hloubkou invaze, avšak predikční hodnota nenahrazuje endoskopickou ultrasonografii. Podle Yao et al. změněná struktura žaludeční sliznice pomocí NBI a zoom endoskopie u karcinomu zahrnuje narušení pravidelné sítě kapilár a demarkační zónu ohraničující lézi od zdravé tkáně (71).
Podobně jako v tlustém střevě je KFE schopna odlišit adenomové a hyperplastické polypy (72). Tato metoda je také zajímavým přínosem v diagnostice premaligních lézí a helikobakterové infekce. Leak fluoresceinu podobně jako u ulcerózní kolitidy signalizuje aktivní zánět. Naopak u normální žaludeční sliznice jsou epitelové buňky dobře ohraničené, s homogenní centrálně šedou cytoplazmou a tmavým okrajem; fluorescence je omezena subepiteliálně s rovnoměrnou distribucí. U helikobakterové infekce fluorescein snadno prochází na povrch epitelem s vysokou permeabilitou, takže regionálně je epitel jasnější. Nicméně známky poškození žaludeční sliznice pronikáním fluoresceinu na povrch jsou nespecifické.
Wang se pokusil klasifikovat helikobakterovou gastritidu v prospektivní studii na 118 nemocných. Na základě charakteru jamek a leaku fluoresceinu rozdělil gastritidu do tří skupin; dalšími kategoriemi pak byly normální nález, glandulární atrofie a intestinální metaplazie. Glandulární atrofie a intestinální metaplazie byly charakterizovány snížením počtu jamek s dilatovaným ústím, jamkami vilózního vzhledu a přítomností kartáčkového lemu a gobletovských či absorbtivních buněk. Jednotlivým skupinám adekvátně přiřadil histologické nálezy. Senzitivita a specificita pro jednotlivé kategorie KFE dosahovala 82,9 % a 90,9 % pro diagnózu helikobakterové infekce, 94,6 % a 97,4 % pro predikci normální sliznice, 98,5 % a 94,6 % pro aktivní zánět, 92,9 % a 95,2 % pro diagnózu glandulární atrofie a 98,6 % a 100 % pro diagnózu intestinální metaplazie (73).
Žlučovody a pankreas
Využívá se pouze KFE. Požadavkem je rozlišení benigních a maligních lézí žlučových cest se zásadně odlišnou prognózou a léčbou, kde je dosavadní diagnostika zahrnující použití endoskopické retrográdní cholangiopankreatografie, cholangioskopie a endoskopické ultrasonografie insuficientní.
KFE sonda (CholangioFlex) se zavádí pracovním kanálem lateroskopu. Rozlišovací schopnost je 3,5 μm. GastroFlex vykazuje vyšší rozlišovací schopnost (1 μm), ale průměr sondy činí 2,6 mm a do žlučovodu se zavádí obtížně podél vodicího drátu. Výsledky reprezentované tímto instrumentem jsou zatíženy technickou nevyzrálostí.
KFE charakteristika příznačná pro malignitu zahrnuje epitelové struktury, bílé pruhy, široké tmavé pruhy > 40 μm a tmavé shluky buněk. Miamská klasifikace zahrnující 18 parametrů byla založena na konsenzuálním setkání šesti expertů. Diagnostický přínos v rozlišení benigních a maligních stenóz analyzovaly tři studie (celkem 256 nemocných) s pozoruhodně podobnými výsledky: přesnost 79–82 %, senzitivita 89–98 %, specificita 67–77%. Výsledky byly negativně ovlivněny dříve zavedeným stentem a zánětem (přesnost 73 vs. 87 %). Dvě studie se zaměřily na interexpertní variabilitu a shledaly ji jednak nízkou (κ = 0,149), jednak výrazně vyšší po specializovaném zaškolení (74, 75, 76).
V multicentrické studii byl zkoumán přínos KFE v diagnostice cystických tumorů pankreatu. Sonda se zaváděla jehlou pomocí endosonografie. Vilózní struktury byly příznačné pro neoplazie a senzitivita KFE činila 59 %, specificita pak byla 100% (77). V další studii zaměřené na cystické neoplazie se zkoumal přínos KFE v kombinaci s cystoskopií a bylo dosaženo 100% senzitivity, ovšem u malého souboru nemocných (78).
Celiakie
U celiakie je v důsledku nerovnoměrného postižení běžná falešná negativita histologického vyšetření. Endomikroskopie zobrazuje vilózní atrofii a hyperplazii krypt s velkou přesností a monitoruje úspěšnost léčby (79). Rozlišuje tři různé typy sliznice. Normální sliznice je tenká, s dlouhými pravidelnými klky lemovaná vrstvou snadno rozpoznatelných epitelových buněk. Druhý typ je charakteristický silnými zkrácenými klky. Třetí typ odpovídá úplné vilózní atrofii – vyznačuje se absencí klků a přítomností rozšířených krypt.
Podle studie Venkateshe et al. dosáhla senzitivita, specificita a pozitivní predikční hodnota KFE u 9 nemocných (1384 KFE obrázků) 100, 80 a 81% (80). Podle studie na dospělých byla senzitivita dostatečná pro přítomnost intraepitelových lymfocytů, avšak slabší pro vilózní atrofii (74 %) a hyperplazii krypt (52 %) (81).
Další klinické aplikace
Zmíněné metody byly využity i v méně obvyklých klinických situacích. U akutní střevní reakce hostitele na příjemce (GvHD = graft versus host disease) dosahovala senzitivita KFE 74 % a specificita 100 %. Metoda může být cenná u vysokého rizika krvácení. Dalšími potenciálními možnostmi jsou všechny druhy kolitid včetně amébové a peroperační diagnostika nádorů (82).
Závěr
Endoskopie se průběžně zdokonaluje s obecným cílem maximální výtěžnosti jednotlivých výkonů. Konkrétním cílem je dosažení určení biologické povahy patologického procesu a jeho rozsahu během jednoho vyšetření pokud možno bez nutnosti tkáňového odběru.
Jednotlivé techniky (konkrétně NBI, FICE a i-Scan) k tomuto cíli jednoznačně směřují a do určité míry jej již dosahují, avšak pouze ve specializovaných centrech. V širší klinické praxi se dosud ve větší míře neuplatňují. Srovnávací studie nejsou vždy přesvědčivé – také proto, že se srovnávají vždy jen dvě následující generace. Kdyby byla podrobena srovnání generace historická, byly by rozdíly markantní.
Další metody mikroendoskopie dosud nepřesáhly etapu klinického výzkumu. Nejprobádanější a jediná komerčně dostupná je KFE, nicméně bližší dostupnosti brání vysoká cena a poměrně zdlouhavé zaškolování. Při hypotetickém uplatnění v širší klinické praxi by se patrně zvýraznila i interexpertní variabilita, vždyť ani patologové se při jednom čtení běžně neshodnou. Budoucnost patrně bude spočívat v integraci více technik, přičemž se údaje počítačově přemění do jednoduchého signálu spolehlivě určujícího například ne-nádorovou tkáň (vysoká specificita).
Kolonoskopie je ustálenou diagnostickou metodou po pět desetiletí. Detekce lézí je limitována mimo jiné zorným úhlem, který se pohybuje v rozmezí do 185 stupňů. Přehled zvyšuje aktivní flexibilita a naopak snižují příčné řasy a ohyby, takže adenomy nebývají zachyceny v jednotlivých tandemových studiích až v 41 % případů (83).
Možnosti zvýšení účinnosti detekce zahrnují zlepšení přípravy, pomalé vysouvání přístroje a inovace optiky, jež rozšiřuje pohled i za příčné řasy. Historicky první dostupnou metodou této kategorie byl dceřiný miniskop umožňující pohled o zorném úhlu 180˚ zpět a zaváděný bioptickým kanálem standardního kolonoskopu (Third Eye Retroscope [TER] Avantis Medical Systems Inc., Sunnyvale CA, USA). Poměr detekce adenomů (tzv. adenoma detection rate) se zvýšil až o 23,2 %, nicméně nevýhodou je blokace pracovního kanálu (84).
Další systém FUSE (Full Spectrum Endoscopy, EndoChoice Inc., Alapharetta, GA, USA) rozšiřuje endoskopický obraz implementací postranních kamer s iluminací LED ze 170 na 330˚. Jeho nevýhodou je vysoká cena. Nejnověji jiné „třetí oko“ spočívá v adaptéru s postranními kamerami, který může být upevněn ke konci jakéhokoliv standardního endoskopu. Podle recentní studie adaptér neovlivnil manipulaci s přístrojem a není důvod se domnívat, že nezvýší ADR v dalších studiích (85, 86).
Korespondenční adresa
prof. MUDr. Julius Špičák, CSc.
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 9
140 21 Praha 4
Tel.: 261 364 016
Fax: 261 362 615
Zdroje
1. Sharma P, Gupta N, Kuipers EJ et al. Advanced paging in colonoscopy and its impact on quality. Gastrointest Endosc 2014; 79 : 28–36.
2. Gono K, Oni T, Yamaguchi M et al. Appearence of enhanced tissue features in narrow-band endoscopic imaging. J Biomed Opt 2004; 9 : 568–577.
3. Yoshida N, Yagi N, Yanagisawa A et al. Image enhanced endoskopy for diagnosis of colorectal tumors in view of endoscopic treatment. World J Gastroenterol 2012; 4 : 545–555.
4. Matsuda T, Saito Y, Fu KI et al. Does autofluorescence imaging videoendoscopy system improve the colonoscopic polyp detection rate? A pilot study. Am J Gastroenterol 2008; 103 : 1926–1932.
5. Kuiper T, Aldelieste YA, Tytgat KMA et al. Automatic optical diagnosis of small colorectal lesions by laser induced autofluoroscence. Endoscopy 2015; 47 : 56–62.
6. Isenberg K, Sivak MV, Chak A et al. Accuracy of endoscopic optical coherence tomography in the detection of dysplasia in Barrett esophagus: a prospective double-blinded study. Gastrointest Endosc 2005; 62 : 826–831.
7. Rodriguez-Díaz E, Huang Q, Cerda SR et al. Endoscopic histological assessment of colonic polyps by using elastic scattering spectroscopy. Gastrointest Endosc 2015; 81 : 539–547.
8. Wood JJ, Kendall C, Hurchigs J et al. Evaluation of a confocal Raman probe for pathological diagnosis during colonoscopy. Colorectal Disease 2014; 16 : 732–738.
9. Roy HK, Backman V. Spectroscopic applications in gastrointestinal endoscopy. Clin Gastroenterol Hepatol 2012; 10 : 1335–1341.
10. Galloro G. High technology imaging in digestive endoscopy. World J Gastroenterol 2013; 4 : 22–27.
11. Dunbar KB, Montgomery EA, Canto MI. The learning curve of in vivo confocal laser endomicroscopy for prediction of Barrett´s esofagus. Gastroenterology 2008; 134: A62−A63.
12. Goetz M, Deris I, Vieth M et al. Near red confocal imaging during minilaparoscopy: a novel rigid endomicroscope with increased imaging plane depth. J Hepatol 2010; 53 : 84–90.
13. Eberl J, Jechart G, Probst A et al. Can an endocytoscope system (ECS) predict histology in neoplastic lesions? Endoscopy 2007; 39 : 497–501.
14. Vila PM, Thekkek N, Klortum-Richards R et al. The use of in vivo real-time optical imaging for esophageal neoplasia. Mt Sinai J Med 2011; 78 : 984–904.
15. Shavmoon A, Aharon S, Kruchik O et al. Scientific Reports 2013; 3 : 1–7.
16. Sturm MB, Joshi BP, Lu S et al. Targeted imaging of esophageal neoplasia with a fluorescently labeled peptide: First in human results. Sci Transl Med 2013; 5 : 184–191.
17. Xian V, McKeon F, Koy KY. Biomarkers and molecular imaging in gastrointestinal cancers. Clin Gastroenterol Hepatol 2014; 12 : 126–129.
18. Li H, Li Y, Cui L et al. Monitoring pancreatic cancerogenesis by the molecular imaging of cathepsin E in vivo using confocal laser endomicroscopy. PLoS One 2014; 9 : 1–12.
19. Ko KH, Han NY, Kwon CH II et al. Recent advances in molecular imaging of premalignant gastrointestinal leisions and future application for early detection of Barrett esofagus. Clin Endosc 2014; 47 : 7–14.
20. Goetz M, Kiesslich R. Advances of endomicroscopy for gastrointestinal physiology and diseases. Am J Physiol Gastrointest Liver Physiol 2010; 298: G797–G806.
21. Kudo S, Hirota S, Nakajima T et al. Colorectal tumours and pit pattern. J Clin Pathol 1994; 47 : 880–885.
22. van Rijn JC, Reitsma JB, Stoker J et al. Polyp miss-rate determined by tandem colonoscopy: A systematic review. Am J Gastroenterol 2006; 101 : 343–350.
23. Sabbagh LC, Reveiz L, Aponte D et al. Narrow-band ligation imaging does not improve detection of colorectal polyps when compared to conventional colonoscopy: A randomized controlled trial and meta-analysis of published studies. BMC Gastroenterology 2011; 11 : 100–113.
24. Yoshida N, Yagi N, Yanagisawa A et al. Image-emhanced endoscopy for diagnosis of colorectal cancer tumors in view of endoscopic treatment. World J Gasteroenterol 2012; 4 : 545–555.
25. Gilani N, Stipho S, Panetta JD et al. Polyp detection trates using magnification with narrow band imaging and white light. World J Gastrointest Endosc 2015; 7 : 555–562.
26. Rastogi A, Keighley J, Singh V et al. High accuracy of narrow band imaging without magnification for the real-time characterization of polyp histology and its comparison with high-definition white light endoscopy: a prospective study. Am J Gastroenterol 2009; 104 : 2422–2430.
27. Tanaka S, Sano Y. Aim to unify the narrow band imaging magnifying classification for colorectal tumors current status in Japan from a summary of the consensus symposium in the 79th Annual Meeting of the Japan Gastroenterological Endoscopy Society. Dig Endosc 2011; 23 Suppl 1 : 131–139.
28. Sano Y, Ikematsu H, Fu KI et al. Meshed capillary vessels by use of narrow-band imaging for differential diagnosis by use of narrow-band imaging for differential diagnosis of small colorectal polyps. Gastrointest Endosc 2009; 69 : 278–283.
29. Kanao H, Tanaka S, Oka S et al. Norrow-band imaging magnification predicts the histology and invasion depth of colorectal tumors. Gastrointest Endosc 2009; 69 : 631–636.
30. Wada Y, Kashida H, Kudo SE et al. Diagnostic accuracy of pitt pattern and vascular pattern analyses in colorectal lesions. Dig Endosc 2010; 22 : 192–199.
31. Cipoletta I, Bianco MA, Rotondano G et al. Endocytoscopy can identify dysplasia in aberrant crypt foci of the colorectum: A prospective in vivo study. Endoscopy 2009; 41 : 129–132.
32. Dhar A, Johnson KS, Novelli MR et al. Elastic scattering spectroscopy for the diagnosis of slonic lesions: initial results of a novel optical biopsy technique. Gastrointest Endosc 2006; 63 : 257–261.
33. Gomes AJ, Roy HK, Turzhitsky V et al. Rectal mucosal microvascular blood supply increase is associated with colonic neoplasia. Clin Cancer Res 2009; 15 : 3110–3117.
34. Takeuchi Y, Inoue T, Hanaoka N et al. Autofluorescence imaging with a transparent hood for detection of colorectal neoplasms: a prospective, randomized trial. Gastrointest Endosc 2010; 72 : 1006–1013.
35. Polglase AL, McLaren WJ, Skinner SA et al. A fluorescence confocal endomicroscope for in vivo microscopy of upper - and the lower-GI tract. Gastrointest Endosc 2005; 62 : 685–695.
36. Wanders LK, East JE, Uitentuis SE et al. Diagnostic performance of narrowed spectrum endoscopy, autofluorescence imaging, and confocal laser endomicroscopy for optical diagnosis of colonic polyps: a meta-analysis. Lancet Oncol 2013; 14 : 1337–1347.
37. Omata F, Ohde S, Deshpande GA et al. Image-enhanced, chromo, and cap-assisted colonoscopy for improving adenoma/neoplasia detection rate: A systematic review and metaanalysis. Scand J Gastroenterol 2014; 49 : 222–237.
38. Kamiňski MF, Hassan C, Bisschops R et al. Advanced imaging for detection and differentiation of colorectal neoplasia: ESGE guideline. Endoscopy 2014; 46 : 435–449.
39. Dekker E, van den Broek FJ, Reitsma JB et al. Narrow-band imaging compared with conventional colonoscopy for the detection of dysplasia in patiens with longstanding ulcerative colitis. Endoscopy 2007; 132 : 874–882.
40. van den Broek FJC. Fockens P, van Eeden S et al. Narrow-band imaging versus high-definition endoscopy for the diagnosis of neoplasia in ulcerative colitis. Endoscopy 2011; 43 : 108–115.
41. Pellisé M, Lopéz-Cerón M, Rodriguez de Miguel C et al. Narrow-band imaging as an alternative to chroendoscopy for the detection of dysplasia in long-standing inflammatory bowel disease: a prospective, randomized, crossover study. Gastrointest Endosc 2011; 74 : 840–848.
42. Leifeld L, Rogier G, Stallmach A et al. White-light or narrow-band imaging colonoscopy in surveillance of ulcerative colitis: a prospective multicenter study. Clin Gastroenterol Hepatol 2015; 13 : 1776–1781.
43. Watanabe O, Ando T, Maeda O et al. Confocal endomicroscopy in patiens with ulcerative colitis. J Gastroenterol Hepatol 2008; 23 Suppl 2: S286–S290.
44. Kiesslich R, Goetz M, Lammersdorf K et al. Chromoendoscopy guided endmicroscopy increases the diagnostic field of intraepithelial neoplasia in ulcerative colitis. Gastroenterology 2007; 132 : 874–884.
45. van den Broek FJ, van Eeden S, Stokkers PC et al. Pilot study of probe-based confocal endomicroscopy during colonoscopic surveillance of patients with longstanding ulcerative solitis. Endoscopy 2011; 43 : 116–122.
46. Neumann H, Vieth M, Arreya R et al. Assessment of Crohn disease activity by confocal laser endomicroscopy. Inflamm Bowel Dis 2012; 18 : 2261–2269.
47. Hurlestone DP, Thomson M, Brown S et al. Confocal endomicroscopy in ulcerative colitis: differentianting dyplasia associated lesional mass and adenoma-like mass. Clin Gastroenterol Hepatol 2007; 5 : 2535–1541.
48. Kiesslich R, Duckworth CA, Moussata D et al. Local barrier dysfunction identified by confocal laser endomicroscopy predicts relapse in inflammatory bowel disease. Gut 2012; 61 : 1146–1153.
49. Gabbani T, Manetti N, Bonanomi AG et al. New endoscopic paging techniques in surveillance of inflammatory bowel disease. World J Gastroenterol Endosc 2015; 7 : 230–236.
50. Sharma P, Wani S, Bansal A et al. A feasibility trial of narrow band uimaging endoscopoy in patiens with gastroesophageal reflux disease. Gastroenterology 2007; 133 : 454–464.
51. Mannath J, Subramanian V, Hawkey CJ et al. Narrow band imaging for characterization of high grade dysplasia and specialized intestinal metaplasia in Barretts esofagus: a metaanalysis. Endoscopy 2010; 42 : 351–359.
52. Vila PM, Thekkek N, Richards-Kortum R et al. The use in vivo real-time optical imaging for esophageal neoplasia. Mt Sinai J Med 2011; 78 : 894–904.
53. Kim KO, Ku YS. Is image-enhanced endoscopy useful for the diagnosis and treatment of gastrointestinal tumor? Clin Endosc 2013; 46 : 246–250.
54. Kara MA, Peters FP, Ten Kate FVW et al. Endoscopic video autofluorescence imaging may improve the detection of early neoplasia in patiens with Barrett´s neoplasia. Gastrointest Endosc 2005; 61 : 679–685.
55. Jin NY, Wang K, Wei SQ et al. Diagnostic value of autofluorescence imaging combined with narrow band paging in intraepithelial neoplasia of Barrett's esophagus. J Buon 2015; 20 : 399–405.
56. Song J, Zhang J, Wang J et al. Meta-anallysis of the effects of endoscopy with narrow band imaging in detecting dysplasia in Barrett´s esophagus. Dis Esophagus 2015; 28 : 560–566.
57. Qiu L, Pleskow D, Chuttani R et al. Multispectral scanning durin endoscopy guides biopsy of dysplasia in Barrett's esofagus. Nat Med 2010; 16 : 603–606.
58. Konda V, Banerjee S, Barth BA et al. Enhanced imaging in the GI tract: Spectroscopy and optical coherence tomography. Gastrointest Endosc 2013; 78 : 568–573.
59. Isenberg G, Sivak MV, Chak A et al. Accuracy of endoscopic optical coherence tomography in the detection of dysplasia in Barrett's esophagus: a prospective, double-blinded study. Gastrointest Endosc 2005; 62 : 825–831.
60. Tsai TH, Zhou C, Tao YK et al. Structural markers observed with endoscopic 3-dimensional optical coherence tomography correlating with Barrett's esofagus radiofrequency ablation response (with videos). Gastrointest Endosc 2012; 76 : 1104–1112.
61. Zhou C, Tsai TH, Lee HC et al. Characterization of buried glands before and after radiofrequency ablation by using 3-dimensional optical coherence tomography (with videos). Gastrointest Endosc 2012; 76 : 32–40.
62. Kiesslich R, Gossner L, Goetz M et al. In vivo histology of Barrett´s esofagus and associated neoplasia by confocal laser endomicroscopy. Clin Gastroenterol Hepatol 2006; 4 : 979–987.
63. Dunbar KB, Okolo P 3rd, Montgomery E et al. Confocal laser endomicroscopy in Barrett´s esofagus and endoscopically inapparent Barrett's neoplasia: a prospective, randomized, double-blind, controlled crossover trial. Gastrointest Endosc 2009; 70 : 645–654.
64. Nguyen VX, Nguyen CC, De Petris G et al. Confocal endomicrolscopy (CEM) improves efficiency of Barrett surveillance. J Interv Gastroenterol 2012; 2 : 61–65.
65. Muldoon TJ, Thekkek N, Roblyyer D et al. Evaluation of quantitative image analysis criterias for the high-resolution microsendoscopic detection of neoplasia in Barrett's esofagus. J Biomed Opt 2010; 15 : 026–027.
66. Inoue H, Honda T, Nagai K et al. Ultra-high magnification endoscopic observation of carcinoma in situ of he esofagus. Dig Endosc 1997; 9 : 16–18.
67. Arima M, Tada M, Arima H. Evaluation of microvascular patterns of superficial esophageal cancers by magnifying endoscopy. Esophagus 2005; 2 : 191–197.
68. Fujishiro M, Takubo K, Sato Y et al. Potential and present limitation of endocytoscopy in the diagnosis of esophageal squamous cell carcinoma: a multicenter ex vivo pilot study. Gastrointest Endosc 2007; 66 : 551–555.
69. Iguchi Y, Niwa Y, Miyahara R et al. Pilot study on confocal endomicroscopy for determination of the depth of squamous cell esophageal cancer in vivo. J Gastroenterol Hepatol 2009; 24 : 1733–1739.
70. Yokoyama A, Inoue H, Minami H et al. Novel narrow-band imaing magnifying endoscopic classification for early gastric cancer. Dig Liver Dis 2010; 42 : 704–708.
71. Yao K, Iwashita A, Kikuchi Y et al. Novel zoom endoscopy technics for visualising the microvascular architecture in gastric mucosa. Clin Gastroenterol Hepatol 2005; 3 (Suppl 1): S233–S236.
72. Li WB, Zuo XL, Gu XM et al. Characterization and identification of gastric hyperplastic polyps and adenomas by confocal laser endomicroscopy. Surg Endosc 2009; 24 : 517–524.
73. Wang P, Ji R, Yu T et al. Classification of histological severity of Helicobacter pylori. Associated gastritis by confocal laser endomicroscopy. World J Gastroenterol 2010; 16 : 5203–5210.
74. Meining A, Shah R, Slivka A et al. Classification of probe-based confocal laser endomicroscopy findings in pancreatobiliary strictures. Endoscopy 2012; 44 : 251–257.
75. Nakai Y, Isayama H, Shinoura S et al. Confocal laser endomicroscopy in gastrointestinal and pancreatobiliary diseases. Dig Endosc 2014; 26 Suppl 1 : 86–94.
76. Tringali A, Lemmers A, Meves V et al. Intraductal biliopancreatic imaging: European Society of Gastrointestinal Endoscopy (ESGE) technology review. Endoscopy 2015; 47 : 739–753.
77. Konda VA, Meining A, Jamil LH et al. A pilot study of in vivo identification of pancreatic cystic neoplasms with needle-based confocal laser endomicroscopy under endosonographic guidance. Endoscopy 2013; 45 : 1006–1013.
78. Nakai Y, Iwashita T, Park DH et al. Diagnosis of pancreatic cysts: EUS-guided, through-the-needle confocal laser induced endomicroscopy and cystoskopy trial: DETECT study. Gastrointest Endosc 2015; 81 : 1204–2015.
79. Leing RW, Nguyen NQ, Meredith CH et al. In vivo confocal endomicroscopy in the diagnosis and evaluation of coeliac disease. Gastroenterology 2008; 135 : 1870–1876.
80. Venkatesh K, Abou-Teleb A, Cohen M et al. Role of confocal endomicroscopy in the diagnosis of celiac disease. J Pediatr Gastroenterol Nutr 2010; 51 : 274–279.
81. Günther U, Daum S, Heller F et al. Diagnostic value of confocal endomicroscopy in celiac disease. Endoscopy 2010; 42 : 197–212.
82. Malard F, Mohty M. New insights for the diagnosis of gastrointestinal acute graft-versus-host disease. Mediators Inflamm 2014 : 701013. doi: 10.1155/2014/701013.
83. van Rijn JC, Rewitasima JB, Stoker J et al. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol 2006; 101 : 343–350.
84. Leufkens AM, DeMarco DC, Rastogi A et al. Effect of a retrograde-viewing device on adenoma detection rate during colonoscopy: The TERRACE study. Gastrointest Endosc 2011; 73 : 480–489.
85. Rubin M, Lurie L, Bose K et al. Expanding the view of a standard colonoscope with the Third Eye Panoramic Cap. World J Gastroenterol 2015; 21 : 10683–10687.
86. Gralnek IM. Emerging technological advancements in colonoscopy. Dig Endosc 2015; 27 : 223–231.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Na úvod nového ročníkuČlánek Jubilanti − leden 2016Článek Jubilanti − únor 2016Článek Maligní biliární obstrukce
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Nové zobrazovací metody v endoskopické diagnostice nádorů trávicího ústrojí
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Maligní biliární obstrukce
- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Časná detekce sporadického karcinomu pankreatu
- Vyšetření mutace KRAS v EUS-FNA preparátech pacientů s tumorem pankreatu
- Na úvod nového ročníku
- Prognostický význam ART skóre u pacientů s intermediárním hepatocelulárním karcinomem
- Jubilanti − leden 2016
- Za profesorem Vratislavem Schreiberem
- Jubilanti − únor 2016
- Prof. MUDr. Josef Marek, DrSc., osmdesátiletý
- Kalendář odborných akcí – únor/březen 2016
- Editorial: Gastrointestinální onkologie – prevence, diagnostika i léčba
- Populační screening kolorektálního karcinomu v České republice
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Maligní biliární obstrukce
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Populační screening kolorektálního karcinomu v České republice
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy