-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace tenkého střeva v České republice
Intestinal transplantation in Czech Republic
Intestinal transplantation represents a suitable treatment for patients with intestinal failure who then develop life-threatening complications of total parenteral nutrition and for some patients with complex abdominal disorders not suitable for conventional treatment.
Methods:
prior to launch of the clinical program, preparation started in 2006 initially with extensive experimentation carried out on pigs. The clinical phase involved a specialized, multidisciplinary team who examined 23 patients being considered for transplantation. Seven patients were put on a waiting list and one female, due to the improvement of her medical status, was unlisted. The first ever intestinal transplantation was done in 2014.Results:
three out of six transplanted patients are alive with 380 days of actual survival; median 131 days (63–763). Two patients are on a full oral diet and nutritionally independent with an excellent quality of life. One female is nutritionally independent but with the need for partial supplemental parenteral rehydration due to the stomal output.Conclusion:
intestinal transplantation is a suitable treatment for highly selected patients with intestinal failure who meet specific listing criteria.Keywords:
intestinal transplantation, multivisceral transplantation, intestinal failure, parenteral nutrition, short bowel syndrome
Autoři: Martin Oliverius 1,8; Libor Janoušek 1; Michal Kudla 1; Petr Wohl 2; Jan Kopecký 2; Eva Kieslichová 3; Dana Němcová 7; Pavel Trunečka 4; Pavel Drastich 4; Eva Honsová 5; Dana Kautznerová 6; Hana Baštová 2; Bohumila Heřmanová 1; Jiří Froněk 1
Působiště autorů: Klinika transplantační chirurgie IKEM, Praha 1; Centrum diabetologie IKEM, Praha 2; Klinika anestesiologie a resuscitace IKEM, Praha 3; Klinika hepatogastroenterologie IKEM, Praha 4; Pracoviště klinické a transplantační patologie IKEM, Praha 5; Pracoviště radiodiagnostiky a intervenční radiologie IKEM, Praha 6; Pracoviště laboratorních metod IKEM, Praha 7; Chirurgická klinika 3. LF UK a FNKV, Praha 8
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 349-354
Kategorie: Původní práce
Souhrn
Transplantace tenkého střeva je ustálenou léčebnou metodou pro nemocné se selháním střeva, u kterých dojde k závažným život ohrožujícím komplikacím v důsledku podávání parenterální výživy, nebo pro pacienty s komplexními onemocněními dutiny břišní, jež nelze řešit jinými konvenčními léčebnými postupy.
Od roku 2006 byla zahájena intenzivní příprava na spuštění programu. V průběhu přípravy byl proveden rozsáhlý experiment na prasatech, na který navazoval klinický experiment. Specializovaný tým v rámci předtransplantační přípravy vyšetřil 23 nemocných zvažovaných k transplantaci. 7 pacientů bylo zařazeno na transplantační listinu, 1 nemocná byla vyřazena pro stavu zlepšení. První transplantace byla provedena v prosinci 2014.
Z 6 transplantovaných nemocných žijí 3. Aktuální průměrná doba přežívání činí 380 dnů; medián 131 dnů (63–763). Dva nemocní jsou na plné perorální výživě a nutričně soběstační s velmi dobrou kvalitou života. Jeden pacient vyžaduje parenterální rehydrataci při enterostomii.
Transplantace střeva je v současné době fungující léčebná metoda pro přísně selektované nemocné se selháním střeva a pacienty, kteří splňují indikační kritéria.Klíčová slova:
transplantace tenkého střeva, multiviscerální transplantace, selhání tenkého střeva, parenterální výživa, syndrom krátkého střevaÚVOD
Transplantace tenkého střeva (TxS) je život zachraňující léčebná metoda pro nemocné, kteří trpí nezvratným selháním střeva, a pro úzkou skupinu pacientů s komplexní břišní symptomatologií, již nelze řešit jinými konvenčními léčebnými postupy. Metoda je ve své podstatě unikátní, protože představuje přenos orgánu s největším množstvím lymfatické tkáně, který nemá sterilní obsah. To činí tento výkon – na rozdíl od transplantace parenchymatózních orgánů – složitým nejen z technického, ale i z imunologického hlediska. Zákrok ovšem zároveň vytváří podmínky pro množství závažných komplikací. Dlouhodobé výsledky TxS jsou obtížně srovnatelné s výsledky transplantace jater či ledvin, ale v průběhu času se trvale zlepšují. Díky tomu se daří zlepšit kvalitu života a významně prodloužit přežívání u stále většího počtu nemocných.
Program TxS byl po obsáhlých přípravách zahájen v roce 2004 v České republice jako jediné zemi středoevropského regionu.
METODIKA PROGRAMU A ZAŘAZENÁ POPULACE PACIENTŮ
V letech 2006–2008 jsme provedli rozsáhlý experiment na 43 prasatech. Cílem práce bylo zvládnutí chirurgické techniky odběru, konzervace a vlastní transplantace orgánu společně s vytvořením optimálního imunosupresivního režimu (1–3). Důležitým bodem pro zahájení klinického programu bylo zvládnutí experimentální diagnostiky akutní celulární rejekce. Zároveň jsme se snažili najít vhodný neinvazivní marker pro diagnózu poškození střeva. V této souvislosti jsme vyšetřovali plasmatický citrulin, který se ukázal být vhodným markerem pro diagnostiku poškození střevní sliznice (4).
Úzká spolupráce pracovní skupiny zabývající se problematikou transplantace s pracovní skupinou pro domácí parenterální výživu při České společnosti klinické výživy a intenzivní metabolické péče ČLS JEP (SKVIMP) vedla k vytipování vhodných nemocných, kteří by byli kandidáty transplantace. V letech 2006–2017 bylo vyšetřeno celkem 23 dospělých se syndromem krátkého střeva, kteří byli zvažováni k transplantaci. Jedna nemocná z této skupiny byla přechodně zařazena jako inaktivní na čekací listinu pro syndrom krátkého střeva, kanylové sepse a jaterních lézí. Po adekvátní léčbě došlo k výraznému zlepšení nálezu na játrech s redukcí steatózy a tato pacientka byla vyřazena. V současné době je na domácí parenterální výživě s dobrou kvalitou života.
6 pacientů bylo zařazeno na čekací listinu a následně transplantováno. Další 4 nemocní nyní dokončují vyšetřovací proces před zařazením. 3 pacienti byli kontraindikovaní pro transplantaci kvůli pokročilému celkovému stavu (z toho 2 zemřeli před dokončením přípravy). 1 nemocný byl kontraindikován pro nedostatečnou spolupráci. Ostatní pacienti (8 nemocných), kteří byli odesláni ke zvážení transplantace, podstoupili chirurgickou intervenci, která vedla ke zlepšení jejich nutričního stavu a částečnému nebo plnému návratu k perorální výživě. Jsou ovšem nadále zařazeni do společného sledování multidisciplinárního týmu. Charakteristiku nemocných prezentuje tab. 1.
Tab. 1. Pacienti vyšetřovaní, léčení a zařazení v rámci programu transplantace střeva 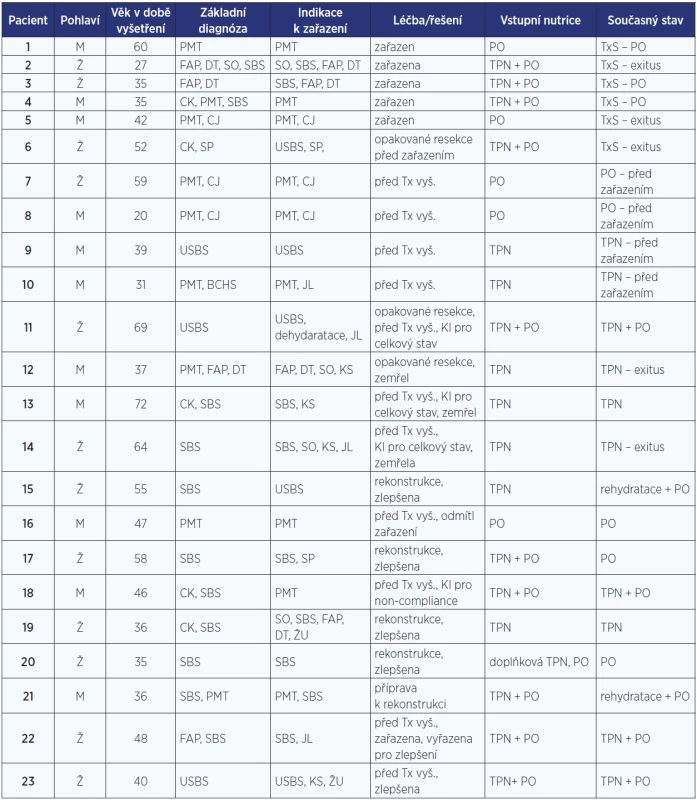
Pozn.: PMT – portomezenterická trombóza (4. stupně); FAP – familiární adenomatózní polypóza; DT – desmoidní tumor; SO – střevní obstrukce, ileosní stav; CK – cévní katastrofa; SBS – syndrom krátkého střeva; USBS – syndrom ultrakrátkého střeva; SP – střevní píštěl; CJ – cirhóza jater; BCHS – Buddův-Chiariho syndrom; KS – kanylové sepse, ŽU – žilní uzávěr, JL – jaterní léze; KI – kontraindikace; TPN – totální parenterální výživa; IV – intravenózní; PO – perorální příjem. V souvislosti s přípravou programu vzniklo specializované pracoviště zabývající se léčbou a rehabilitací syndromu krátkého střeva. To je založeno na úzké spolupráci chirurgů, gastroenterologů, nutricionistů a diabetologů, intervenčních radiologů a mnoha dalších specializací včetně klinického psychologa. Program má svou vyškolenou koordinátorku, která zajišťuje bezproblémovou logistiku.
Vlastní klinický program byl zahájen v prosinci 2014. Od té doby bylo transplantováno 6 nemocných (z toho 3 muži) průměrného věku 42 let, medián činil 39 let (27–60). Všichni nemocní podstoupili multiviscerální transplantaci. Diagnózy vedoucí k zařazení na čekací listinu shrnuje tab. 2. Střední doba strávená na čekací listině činila 52 dnů. Jedna nemocná zemřela při výkonu a byla vyřazena z dalšího hodnocení.
Tab. 2. Transplantovaní nemocní 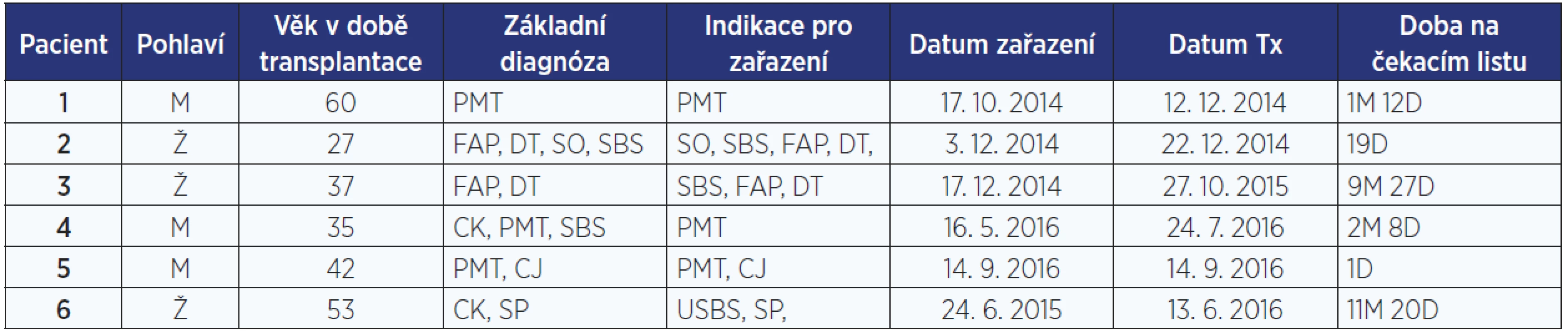
Pozn.: PMT – portomezenterická trombóza; FAP – familiární adenomatozní polypóza; DT – desmoidní nádor; SBS – syndrom krátkého střeva; USBS – syndrom ultrakrátkého střeva; SO – střevní obstrukce; CK – komplikace centrálního katetru; CJ – cirhóza jater; SP – střevní píštěle; M – měsíc; D – den. Imunosuprese u všech pacientů byla založena na indukční léčbě monoklonální protilátkou alemtuzumabem (30 mg i. v.) a následné monoterapii kalcineurinovým inhibitorem takrolimem. Cílová hladina takrolimu v séru byla 15–20 ng/ml pro první 2 týdny po výkonu, dále 8–12 ng/ml v průběhu prvních 2 měsíců a 6–10 ng/ml po dobu prvního roku po transplantaci. Všichni pacienti dostali iniciálně kortikoidy (mythylprednisolon/prednison). První dávka mythylprednisolonu v rámci premedikace s podáním alemtuzumabu a druhá po reperfuzi. V dalším průběhu byla léčba kortikosteroidy modifikována dle stavu nemocného s cílem minimalizovat jejich podávání, případně až vysadit je.
VÝSLEDKY
Průměrný čas studené ischemie u pacientů, kteří přežili transplantaci, byl 302 minut, medián 310 minut (258–360). Průměrný čas teplé ischemie byl 67 minut, medián 55 minut. Střední doba hospitalizace činila 63 dnů (33–86). Tři pacienti jsou naživu s aktuální průměrnou dobou přežívání 380 dnů, medián činí 131 dnů (63–763; údaje k datu vzniku článku). Všichni tři jsou doma na plné perorální výživě bez potřeby parenterální výživy s velmi dobrou kvalitou života. Dva nemocní zemřeli. Jedna pacientka v důsledku akutní celulární rejekce za 68 dnů po transplantaci a jeden nemocný v důsledku sepse za 63 dnů.
DISKUSE
Selhání tenkého střeva jako stav, kdy střevo není schopno plnit svoji základní funkci trávení a vstřebávání živin (5, 6), je velmi závažné onemocnění, které před zavedením parenterální výživy (PN) prakticky vždy končilo úmrtím. Příčiny selhání střeva jsou odlišné v dospělé a dětské populaci. Obecně je můžeme rozdělit na stavy, kdy střevo nebo jeho podstatná část zcela chybí v důsledku ztráty, a stavy, kdy je střevo sice přítomné, ale z různých příčin neplní svoji funkci. Ztráta tenkého střeva se označuje jako syndrom krátkého střeva. Tento stav, způsobený nejčastěji cévními a abdominálními katastrofami nebo traumaty (včetně poradiačních) a dále Crohnovou chorobou (7), lze při včasné a správné léčbě pozitivně ovlivnit vzhledem k vysoké adaptační schopnosti tenkého střeva. Naopak špatně zvolený léčebný postup může vést k nenávratnému poškození s minimální adaptací.
Při posuzování celkového stavu je také nezbytné posoudit, zda jde o přechodný stav, nebo o stav, který lze při správném léčebném postupu ovlivnit směrem ke zlepšení či návratu do normy.
Primární léčbou je téměř ve všech případech podávání parenterální výživy do centrálního řečiště cestou tunelizovaných katétrů. Po stabilizaci nemocného lze zajistit tuto léčbu formou domácí parenterální výživy s přijatelnou kvalitou života nemocných. Dlouhodobé podávání výživy do centrálního řečiště však s sebou přináší četné komplikace, z nichž některé mohou být pro nemocného život ohrožující. Jednou z nejčastějších je infekce spojená s podáváním PN. Vzhledem k přímému vstupu infekce do centrálního řečiště může jít o závažné infekce končící multiorgánovým selháním a syndromem akutní dechové tísně. Závažné jsou zejména infekce mykotické. Afinita infekčního agens ke katetru je vysoká a často je nutné jeho odstranění.
Další komplikací je trombotizace centrálních žil a uzávěr velké žíly a jejich postupná ztráta. Podávání tukových emulzí a dalších substrátů přímo do centrálního řečiště, aniž by šly fyziologickou cestou portální žíly, vede k hromadění tuku v játrech a jejich poškození. Zvýšením podílu omega-3 mastných kyselin na úkor omega-6 mastných kyselin se četnost těchto komplikací zmenšila, ale ztučnění jater vyvolané parenterální výživou (PNALD – parenteral nutrition associated liver disease) může progredovat až do stadia jaterní cirhózy se všemi jejími důsledky. Citlivá je zejména pediatrická populace, což je dáno také délkou podávání PN. Abnormality jaterních enzymů jsou v určitém období podávání PN popisovány u všech nemocných a u 15–40 % dochází k rozvoji selhávání jater (8, 9).
Mezi méně časté komplikace spojené se syndromem krátkého střeva patří velké ztráty tekutin a minerálů, které lze obtížně nahradit, což má ve svém důsledku negativní vliv na další orgány a vede zejména k poškození ledvin. Nesmíme pominout ani závažné postižení metabolismu kostí s rozvojem osteoporózy a osteomalacie v důsledku komplexní poruchy metabolismu iontů (zejména fosforu, vápníku a hořčíku).
Všechny zmíněné stavy spadají do skupiny závažných život ohrožujících komplikací PN a jsou indikací ke zvážení TxS. Existují však vzácná onemocnění, kdy je střevo přítomné, ale jeho funkce je závažně poškozena. Mezi tyto stavy patří poruchy motility střeva a vlastní poruchy funkce enterocytů. Mezi první zmíněné řadíme Hirschprungovu chorobu – úplnou nebo částečnou střevní aganglionózu a chronickou střevní pseudoobstrukci (CIPO). Druhou skupinu vzácných kongenitálních enteropatií představují onemocnění s poruchou diferenciace a polarizace enterocytů novorozenců (microvillus inclusion disease známá také jako microvillus atrophy a tufting enteropathy).
Ke komplexním onemocněním, jež většinou nelze řešit jinak než TxS, patří rozsáhlé postižení dutiny břišní desmoidním tumorem většinou v kombinaci s familiární adenomatózní polypózou (FAP). Tito nemocní jsou navíc – i pokud nemají vyvinut intraabdominální desmoid – ohroženi brzkým vznikem karcinomu v rozsahu celého zažívacího traktu. Zhoubné nádory tenkého střeva na podkladě FAP jsou obtížně včas diagnostikovatelné a při kobercovém pokrytí střeva polypy prakticky neléčitelné jinak než transplantací.
Poslední indikační skupinu představují pacienti s rozsáhlou portomezenterickou trombózou III. a IV. stupně. Tento stav na rozdíl od akutní ischemie vzniká pozvolna a bezprostředně se nemusí projevit jako náhlá příhoda břišní. Kurativním řešením je pouze multiviscerální transplantace (MVT) (10). Polovina z našich nemocných byla indikovaná k MVT právě pro rozsáhlou portomezenterickou trombózu a další pacienti jsou pro toto onemocnění vyšetřováni v rámci předtransplantační přípravy.
Existují ještě stavy, které jsou relativní indikací ke zvážení transplantace, jako je absolutní netolerance PN nemocným nebo jeho výrazně špatná kvalita života s častou morbiditou (11).
Transplantace střeva má tedy svoje jasně dané indikace, ale též absolutní kontraindikace, mezi které patří přítomnost závažných nevyléčitelných onemocnění (malignity, těžká neurologická poškození, nevyléčitelná infekční onemocnění) a pochopitelně únosnost zákroku ze strany nemocného. Jedna z našich pacientek, která splňovala kritéria k TxS vzhledem k ultrakrátkému střevu a dlouhodobě vysokým odpadům, nebyla zařazena vzhledem k závažným komorbiditám a biologickému věku. Z těchto důvodů by tento léčebný postup měl být zvažován nikoli až v době, kdy je nemocný v těžkém stavu, ale již v době, kdy splňuje kritéria a je předpoklad, že zákrok i náročné potransplantační období a jeho průběh pro něj budou únosné.
Včasné odeslání pacienta ke konzultaci navíc umožňuje využití všech způsobů multimodální léčby dostupných na specializovaném pracovišti, což často dovolí TxS oddálit nebo zlepšit pacientův stav natolik, že už ji nepotřebuje. Mezi tyto postupy řadíme jak komplexní medikamentózní, tak chirurgickou léčbu. V zahraničí je s úspěchem používán rekombinantní lidský růstový hormon a analog glukagonu podobného peptidu 2 (GLP-2) teduglutid. Četné práce v tomto směru dokazují výrazné zlepšení adaptace střeva se zlepšením absorpce živin (12). Mezi chirurgické metody řadíme kompletní adheziolýzu, zrušení všech slepých úseků, stenotických částí a odstranění všech infekčních fokusů. Operační postupy vedou k využití veškeré dostupné tkáně trávicí soustavy. Dobře adaptované střevo lze využít i k autologní rekonstrukci, jejímž cílem je prodloužení střeva, zpomalení pasáže a zlepšení vstřebávání. Tyto postupy reprezentuje Bianchiho prodlužovací operace nebo plastika STEP (serial transverse enteroplasty) (13, 14).
Dostatečné množství provedených výkonů ve světě a stále se zlepšující výsledky přežívání nemocných umožnily porovnání souborů nemocných splňujících indikační kritéria k TxS po výkonu s těmi, kteří pokračovali v léčbě PN. Přežívání transplantovaných bylo signifikantně lepší než těch, kteří sice splňovali kritéria, ale k transplantaci odesláni nebyli (6, 15, 16).
Pod pojmem transplantace tenkého střeva rozumíme vlastní transplantaci tenkého střeva (IT – intestinal transplantation), transplantaci tenkého střeva spolu s játry tam, kde došlo k jejich nezvratnému poškození v důsledku PNALD (LIT – liver intestinal transplantation), a transplantaci multiviscerální, při které se transplantuje žaludek, duodenum se slinivkou, tenké střevo a játra. Pokud játra nejsou součástí MVT a použijí se pro jiného příjemce, hovoříme o modifikované multiviscerální transplantaci (MMVT – modified multivisceral transplantation) (obr. 1a–c).
Obr. 1. Schéma transplantace střeva: a) izolovaná transplantace střeva b) transplantace střeva a jater c) multiviscerální transplantace 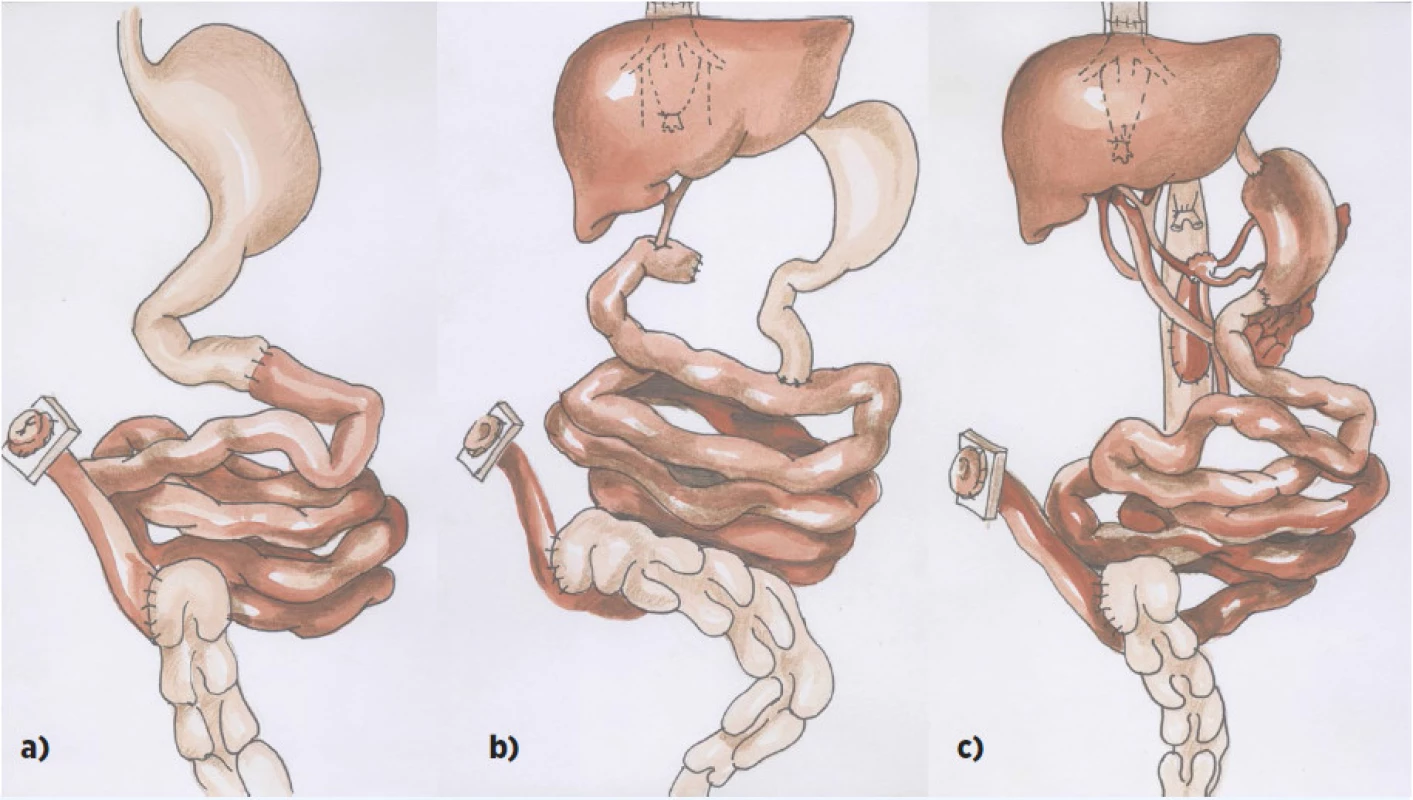
Zajímavá je tendence v nárůstu počtu transplantací i Bauhinovy chlopně a části tlustého střeva jako součásti štěpu za posledních 5 let. To vede k výrazně lepšímu vstřebávání vody a dosažení nutriční nezávislosti bez významného vlivu na infekční komplikace (17, 18). Do roku 2015 bylo ve světě 84 center, která provedla TxS. Aktivních center je však pouze 30, z toho žádné s výjimkou České republiky v zemích bývalého východního bloku.
Do roku 2015 bylo v mezinárodním registru vedeno 3067 provedených transplantací, po nichž žije 1631 nemocných. V celosvětové aktivitě převažuje IT 1531 (44,9 %), dále LIT 943 (30,7 %) a MVT včetně MMVT 593, resp. 151 (24,4 %). Dvě třetiny transplantační aktivity připadají na Spojené státy americké.
Převažující diagnózou je syndrom krátkého střeva jak v dospělém (64 %), tak i dětském (63 %) věku. Jeho příčiny se však liší. V dospělosti převažují cévní ischemie (23 %) a Crohnova choroba (11 %); u dětí je to gastroschíza (21 %), volvulus (16 %) a nekrotizující enterokolitida (12 %).
5leté přežívání dospělých nemocných dnes přesahuje 60 % a o něco lepších výsledků je dosahováno u dětské populace. Nejkritičtějším obdobím je první rok po transplantaci, kdy zemře největší počet nemocných v důsledku chirurgických, infekčních nebo imunologických komplikací. S akutní rejekcí se v tomto období setká více než polovina pacientů (19). Dlouhodobé přežívání těch, kteří přežijí první rok transplantace, zobrazuje graf 1.
Graf 1. Podmíněné 5leté přežívání nemocných po transplantaci. Hodnoceni byli pacienti, kteří přežili první rok po výkonu. (Převzato z: Intestinal Transplant Registry Report 2015.) 
Jednoznačně nejčastější příčinou úmrtí těchto nemocných je sepse, která představuje > 60 % všech příčin. V našem souboru zemřeli na septické komplikace 2 nemocní. Primární příčinou často bývá akutní rejekce, která způsobuje poruchu střevní bariéry s rychlým prostupem bakterií a toxinů do cévního řečiště. Antirejekční léčba, která má za cíl snížení imunitní odpovědi na dárcovské antigeny, pak nadále umocňuje náchylnost nemocného k infekci. Dalšími příčinami úmrtí jsou selhání štěpu, technické komplikace, lymfom a další.
Díky kvalitnímu monitorování transplantovaných orgánů a účinné antirejekční léčbě dnes akutní rejekce nepředstavuje tak významný problém jako dříve. Cesta ke zlepšení dlouhodobého přežívání těchto nemocných a dosažení podobných výsledků, jakých dosahujeme u parenchymových orgánů, vede přes zvládnutí chronické rejekce, na které se významně podílí protilátkami zprostředkovaná rejekce (20).
ZÁVĚR
Péče o nemocné se selháním střeva vyžaduje velmi komplexní a odborný přístup založený na úzké spolupráci mnoha specializací s dobře organizovanou logistikou. Při zajištění těchto podmínek lze u řady pacientů předejít závažným komplikacím a významně zredukovat jejich závislost na parenterální výživě, případně dosáhnout jejich nutriční soběstačnosti. Nemocní, u nichž se vyvinou život ohrožující komplikace parenterální výživy, a pacienti s některými komplexními onemocněními dutiny břišní, jež nelze řešit jinými způsoby, jsou indikovaní k transplantaci střeva – izolovaného nebo v kombinaci s dalšími orgány dutiny břišní.
Pro osud nemocného je rozhodující včasná konzultace s transplantačním centrem. Jak se ukázalo v našem souboru, většina nemocných se selháním střeva transplantaci nevyžadovala a při použití multimodální léčby u nich bylo dosaženo nutriční nezávislosti nebo zlepšení stavu. Na druhou stranu podrobná znalost celkového stavu těchto pacientů a jejich sledování v čase společně s odesílajícím nutričním oddělením umožňuje včasné načasování případné transplantace. Ze 6 nemocných, kterým byla provedena transplantace, polovina přežívá zcela nezávisle na parenterální výživě a s výbornou kvalitou života.
Seznam použitých zkratek
FAP familiární adenomatózní polypóza
IT transplantace tenkého střeva
LIT transplantace tenkého střeva a jater
MMVT modifikovaná multiviscerální transplantace
MVT multiviscerální transplantace
PN parenterální výživa
PNALD ztučnění jater vyvolané parenterální výživou
TxS transplantace tenkého střeva
Adresa pro korespondenci:
doc. MUDr. Martin Oliverius, Ph.D., FEBS
Chirurgická klinika 3. LF UK a FNKV
Šrobárova 1150/50
100 34 Praha 10
Tel.: 267 162 410
e-mail: martin.oliverius@fnkv.cz, martin.oliverius@gmail.com
Zdroje
1. Oliverius M, Baláž P, Kudla M et al. Small bowel graft revascularization in experiment. Bratislavské lekárske listy 2009; 110(2): 65–68.
2. Baláž P, Kudla M, Lodererová A et al. Preservation injury of the small bowel graft in clinical small bowel transplantation. Bratislavské lekárske listy 2007; 108(12): 516–8.
3. Oliverius M, Kudla M, Baláž P et al. Transplantatace tenkého střeva v experimentu. Rozhledy v chirurgii 2009; 88(11): 662–668.
4. Oliverius M, Kudla M, Baláž P, Valsamis A. Hladina plazmatického citrulinu - spolehlivý neinvazivní ukazatel množství funkčních enterocytů. Časopis lékařů českých 2010; 149(4): 160–162.
5. Scott NA, Irving MH. Intestinal failure – the clinical problem. Dig Dis 1992; 10(5): 249–257.
6. Pironi L, Arends J, Baxter J et al. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clin Nutr 2015; 34(2): 171–180.
7. Drastich P, Oliverius M. Crohn’s Disease and Intestinal Transplantation. Dig Dis 2017; 35(1–2): 127–133.
8. Salvino R, Ghanta R, Seidner DL et al. Liver failure is uncommon in adults receiving long-term parenteral nutrition. J Parenter Enteral Nutr 2006; 30(3): 202–208.
9. Cavicchi M, Beau P, Crenn P et al. Prevalence of liver disease and contributing factors in patients receiving home parenteral nutrition for permanent intestinal failure. Ann Intern Med 2000; 132(7): 525–532.
10. Vianna RM, Mangus RS, Kubal C et al. Multivisceral transplantation for diffuse portomesenteric thrombosis. Ann Surg 2012; 255(6): 1144–1150.
11. Garg M, Jones RM, Vaughan RB, Testro AG. Intestinal transplantation: current status and future directions. J Gastroenterol Hepatol 2011; 26(8): 122–128.
12. Jeppesen PB. Glucagon-like peptide-2: update of the recent clinical trials. Gastroenterology 2006; 130(2 Suppl. 1): S127–S131.
13. Kim HB, Fauza D, Garza J et al. Serial transverse enteroplasty (STEP): a novel bowel lengthening procedure. J Pediatr Surg 2003; 38(3): 425–429.
14. Bianchi A. Longitudinal intestinal lengthening and tailoring: results in 20 children. J R Soc Med 1997; 90(8): 429–432.
15. Pironi L, Hébuterne X, Van Gossum A et al. Candidates for intestinal transplantation: a multicenter survey in Europe. Am J Gastroenterol 2006; 101(7): 1633–1643.
16. Pironi L, Forbes A, Joly F et al. Survival of patients identified as candidates for intestinal transplantation: a 3-year prospective follow-up. Gastroenterology 2008; 135(1): 61–71.
17. Matsumoto CS, Kaufman SS, Fishbein TM. Inclusion of the colon in intestinal transplantation. Curr Opin Organ Transplant 2011; 16(3): 312–315.
18. Huard G, Schiano T, Moon J, Iyer K. Choice of Allograft in Patients Requiring Intestinal Transplantation: A Critical Review. Can J Gastroenterol Hepatol 2017 : 1069726.
19. Abu-Elmagd KM, Costa G, Bond GJ et al. Five hundred intestinal and multivisceral transplantations at a single center: major advances with new challenges. Ann Surg 2009; 250(4): 567–581.
20. Berger M, Zeevi A, Farmer DG, Abu-Elmagd KM. Immunologic challenges in small bowel transplantation. Am J Transplant 2012; 12(Suppl. 4): S2–S8.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Úvodem
- Editorial
- Transplantace tenkého střeva v České republice
- Indikace k transplantaci jater – kdy odeslat nemocného
- Klady a rizika duální transplantace ledvin
- Orgánové transplantace od dárců se selháním oběhu
- Psychologické hodnocení účastníků studie transplantace dělohy
- Psychologická problematika pacientů přeživších mimonemocniční srdeční zástavu
- Makrodiagnostické trendy současné soudnělékařské praxe v České republice
- Metodický pokyn Ministerstva zdravotnictví ČR o duchovní péči
-
Mezinárodní kongres Global Biobank Week 2017
K harmonii v biobankách - John Vane (1927–2004)
- 65 let brigádního generála v. v. doc. MUDr. Leo Kleina, CSc.
- Vzpomínka na prof. MUDr. Jaromíra Koláře, DrSc.
- 100 let od narození profesora Adolfa Žáčka
- Zemřel profesor Ivo Hána
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (LEDEN – ÚNOR 2018)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Indikace k transplantaci jater – kdy odeslat nemocného
- Transplantace tenkého střeva v České republice
- Orgánové transplantace od dárců se selháním oběhu
- Psychologická problematika pacientů přeživších mimonemocniční srdeční zástavu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



