-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Celiakie dětí a dospívajících
Celiac disease in children and adolescents
Celiac disease can be defined as a small bowel disorder characterized by mucosal inflammation, villous atrophy and crypt hyperplasia, which occurs upon exposure to dietary gluten and which demonstrates improvement after withdrawal of gluten from the diet.
Keywords:
celiac disease, children, adolescents
Autoři: Pavel Frühauf; N. Nabil El-Lababidi; Peter Szitányi
Působiště autorů: Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2018; 157: 117-121
Kategorie: Přehledové články
Souhrn
Celiakie je definována jako postižení tenkého střeva charakterizované slizničním zánětem, vilózní atrofií a hyperplazií krypt, které se vyskytují po expozici lepku v dietě a které se zlepší po jeho eliminaci ze stravy.
Klíčová slova:
celiakie, děti, adolescentiÚVOD
Celiakie je systémové autoimunitní onemocnění dětí i dospělých způsobené celoživotní nesnášenlivostí lepku (1). Nemoc je charakterizována imunitně podmíněnou enteropatií u geneticky predisponovaných individuí. Jedná se o nejčastější potravinovou intoleranci (2). Lepek je bílkovinný komplex (prolamin) obsažený v povrchní části obilných zrn pšenice a je používán jako synonymum i pro ostatní prolaminy (žita, ječmene a ovsa).
Lepek je v alkoholu rozpustná bílkovinná frakce pšeničné bílkoviny, která je konzumována v množství 10–20 g/den jako součást obvyklé stravy. Obsah lepku je nejvyšší v pšenici a v sestupném pořadí dle množství je obsažen i v žitě, ječmenu a ovsu.
EPIDEMIOLOGIE
Prevalence celiakie u dětí v Evropě a severní Americe je udávána 1 : 80 až 1 : 300 (3–13/1000 dětí) (3). Děvčata jsou jí postižena přibližně dvakrát častěji (4).
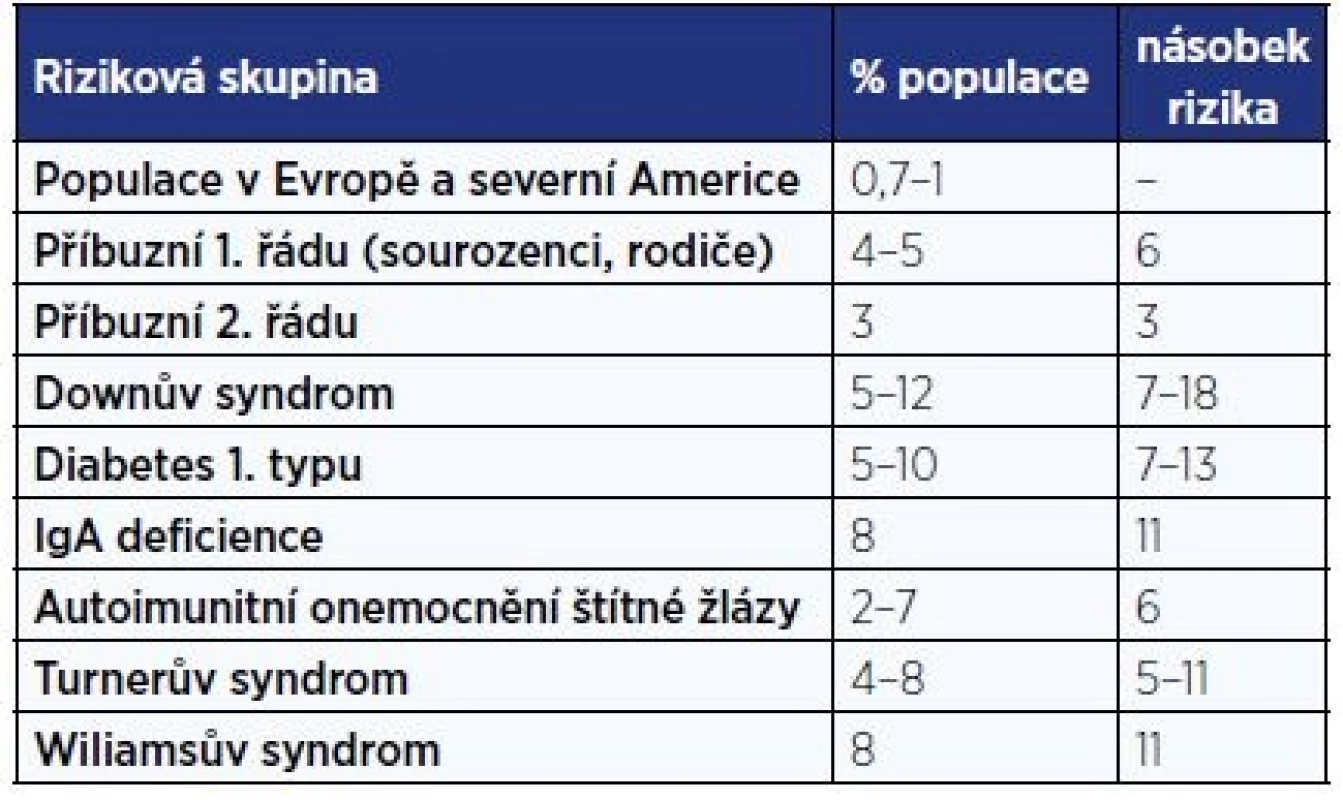
Největší screeningové vyšetření dětské populace (17201 školáků ve věku 6–15 let) bylo provedeno v Itálii, prevalence byla zjištěna v poměru 1 : 184 a poměr asymptomatických k symptomatickým celiakům byl zaznamenán jako 7 : 1 (5). Na základě těchto dat se soudí, že 3/4 celiaků nejsou diagnostikovány (6). Podle údajů VZP byl v roce 2014 poskytnut příspěvek na bezlepkovou dietu 4360 pojištěncům ve věku do 18 let, což odpovídá 0,47 % pojištěncům VZP ve věku 0–18 let. Rizikové skupiny pro rozvoj celiakie jsou uvedeny v tab. 1 (7).
CHARAKTERISTIKA ONEMOCNĚNÍ
Celiakie je charakterizována (8):
- genetickou predispozicí: HLA-DQ2 (cca 90 % nemocných) nebo HLA-DQ8 (cca 10 %), v české populaci je přítomno 20–30 % obyvatel s HLA-DQ2/8 (9);
- vyvolávajícím faktorem – lepkem;
- vysoce specifickou a senzitivní protilátkou proti tkáňové transglutamináze (antiTG2), která hraje centrální roli v patogenezi celiakie, protože potencuje imunogenitu lepkových peptidů v tenkém střevě cestou deaminace (10). Některé lepkové peptidy nejsou degradovány gastrointestinálními enzymy, přestupují epitelem sliznice, jsou prezentovány TG2 buňkám prezentujícím antigen u osob s HLA-DQ2/8 dispozicí a ty stimulují specifické T lymfocyty. Aktivované T lymfocyty ve sliznici tenkého střeva jsou cytotoxické a působí apoptózu enterocytů, atrofickou remodelaci sliznice, a tím vznik malabsorpce. Menší roli v patogenezi zřejmě hrají precipitační faktory zahrnující velikost expozice lepku, infekce, event. medikace. V poslední době je diskutována i otázka vlivu střevní mikrobioty (11).
V minulosti se obvykle celiakie manifestovala u kojenců a batolat chronickým průjmem vedoucím k malabsorpci a neprospívání. V současnosti je obvyklé, že se nemoc nejčastěji manifestuje mezi 10. a 40. rokem věku mírnějšími gastrointestinálními projevy nebo extraintestinální manifestací (12).
Měnící se prezentace celiakie (13) je připisována prodlužující se výživě kojení, pozdějšímu zavádění lepku do výživy kojenců a zlepšeným možnostem v sérologickém vyšetření, které vede k diagnostice subklinických forem (14). Klinické manifestace jsou uvedeny v tab. 2 (15): Je dokumentován i vyšší výskyt psychiatrické symptomatologie u dětí s celiakií. Ve švédské studii byl dokumentován 1,4× vyšší výskyt psychiatrické symptomatologie (věkový medián 9,6 let) zahrnující poruchy nálad, úzkosti, poruchy chování, příjmu potravy, soustředění a zvýšené aktivity i postižení intelektu (16).
Tab. 2. Klinická manifestace celiakie u dětí 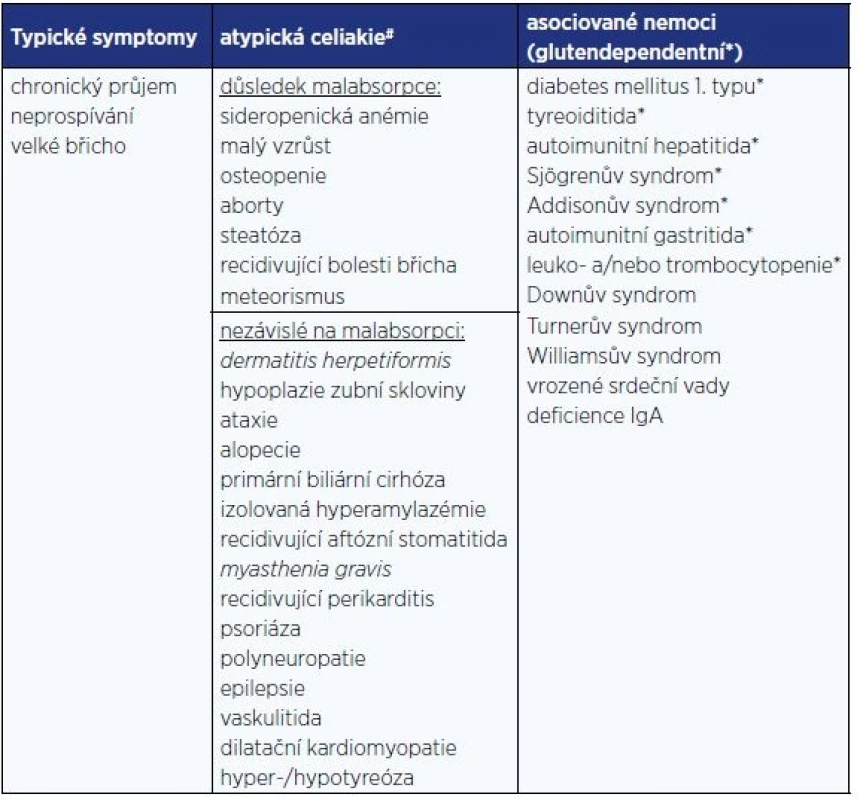
Pozn.: *) Gastrointestinální a negastrointestinání projevy se vyskytují v poměru 1:1. Silentní a potenciální formy (nejsou patrny klinické obtíže, je však zachycena pozitivita protilátek) jsou většinou rozpoznány při screeningu vysoce rizikových skupin (17). Termín silentní však není považován za korektní, protože po detekci onemocnění mnohdy dochází k ústupu symptomů, které před rozpoznáním diagnózy nebyly považovány za patologické.
DIAGNOSTIKA
(18, 19)Protilátky
Na základě metaanalýzy 16 studií lze konstatovat, že protilátky ve třídě IgA proti endomysiu (EmA) a transglutamináze 2 (TG2) dosahují největší přesnosti v diagnóze celiakie (tab. 3). Negativita protilátek ve třídě IgG proti deaminovanému gliadinu (DGP) pomáhá ve vyloučení celiakie, je uváděna vyšší senzitivita těchto protilátek u dětí mladších 2 let. Protilátky proti gliadinu (AGA) ve třídách IgA i IgG jsou méně spolehlivé, a není tedy důvod je v diagnostice celiakie užívat.
Tab. 3. Senzitivita a specificita protilátek 
Tab. 4. Klasifikace změn sliznice ( 20 ) 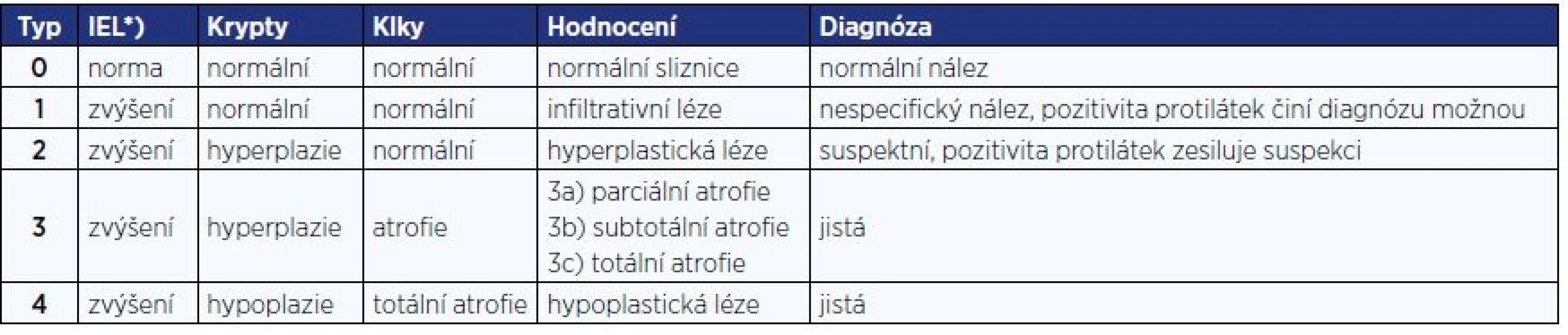
Pozn.: *) IEL = intraepitelové lymfocyty > 25/100 epitelových buněk Pro primární diagnostiku při podezření na celiakii je indikováno vyšetření protilátek proti transglutamináze ve třídě IgA a celkového IgA. Při jeho deficitu je indikováno vyšetření protilátek ve třídě IgG.
HLA-DQ2/8 Většina pacientů s celiakií je HLA-DQ2 - a/nebo HLA-DQ8-pozitivních. Negativita tohoto vyšetření s vysokou pravděpodobností (96 %) vylučuje celiakii.
Jestliže je celiakie diagnostikována bez provedení biopsie, zvyšuje pozitivita HLA-DQ2/8 jistotu diagnózy.
Toto vyšetření by se mělo provádět u pacientů s nejasnostmi v diagnóze (negativita protilátek, nález infiltrativní léze), protože negativita HLA-DQ2/8 činí diagnózu celiakie nepravděpodobnou.
Patologie
Bioptický vzorek lze získat sukční kapslí zavedenou pod rtg kontrolou, optimálně z místa duodenojejunálního přechodu, nebo endoskopicky (tento způsob v současné době dominuje) s tím, že je doporučeno odebrat z postpapilárního duodena 4 vzorky a z bulbu 2 vzorky. U 6–10 % dětí do 2 let mohou mít změny střevní sliznice i jinou příčinu než lepek, např. alergii na bílkovinu kravského mléka, střevní infekci nebo imunodeficience. Minimální změny odpovídající Marsh 1 mohou být u Crohnovy choroby, infekce Helicobacter pylori, bakteriálních a parazitárních infekcích, při užívání nesteroidních antirevmatik.
U jasně definované skupiny dětských pacientů (21) lze stanovit diagnózu celiakie bez provedení biopsie. Toto rozhodnutí může učinit pouze lékař s příslušným vzděláním v oboru dětské gastroenterologie, a to na základě následujících kritérií:
- Jsou přítomné klinické symptomy (tab. 2).
- Není přítomen IgA deficit.
- Pozitivita anti-TG2 nad desetinásobek normy.
- Pozitivita EMA z jiného vzorku a ověření desetinásobné pozitivity anti-TG2 v další laboratoři.
- Vyšetření HLA-DQ2 a HLA-DQ8 podle posledních poznatků není nutné.
- Symptomy onemocnění musejí ustoupit po bezlepkové dietě. Multicentrická studie (22), jíž se naše pracoviště účastnilo, upřesnila diagnostický postup tím, že k definitivní diagnóze celiakie bez biopsie není nutné vyšetřovat HLA typizaci, jestliže jsou naplněna diagnostická kritéria 1*–4.
* Alespoň jeden klinický příznak (chronický průjem, chronická zácpa, bolesti břicha, nauzea/zvracení, velké břicho, neprospívání, růstová retardace, pubertas tarda, chronická anémie, osteopenie/osteoporóza, hypoplazie zubní skloviny, iritabilita, chronická únava, neuropatie, artritida/artralgie, amenorea, zvýšení jaterních testů, recidivující aftózní stomatitida, dermatitis herpetiformis)
TERAPIE
Celoživotní bezlepková dieta je v současné době jedinou kauzální terapií celiakie. Stanovení diagnózy celiakie a vyslovení požadavku bezlepkové diety znamená pro pacienta velkou psychickou zátěž. Úspěšné zavedení tohoto dietního režimu vyžaduje týmový přístup, který zahrnuje kromě pacienta jeho rodinu, lékaře, nutriční terapeutku a zájmovou organizaci celiaků, kterou má celiak vždy vyhledat (34). Účinnost bezlepkové diety předpokládá úplné vyloučení surovin, potravin a nápojů s obsahem obilovin (žita, pšenice, ječmene a ovsa). Prolaminová frakce ovsa (aveniny) je menší a méně imunogenní než v ostatních obilovinách, ale oves je často kontaminován příměsí jiných obilovin (zejména ječmene) a k jeho kontaminaci může dojít také při výrobě, pokud strojní souprava nebyla dokonale vyčištěna před mletím ovsa. Jako bezlepkové suroviny se používají rýže, kukuřice, sója, pohanka, proso, jáhly, amarant a brambory.
Sója může vyvolat vzácně alergickou reakci. Laik příměs lepku v řadě potravin i jiných výrobků nepředpokládá (uzeniny, kečup, hořčice, kypřící prášky do pečiva, zmrzlina, pomocné látky v lécích a mnoho dalších výrobků). Hlavní produkt obsahující lepek a používaný jako přísada do řady výrobků je pšeničný škrob. Množství lepku schopné vyvolat autoimunitní odpověď a zánětlivé změny střevní sliznice je velmi rozdílné u jednotlivých nemocných. Doporučuje se, aby denní příjem lepku u celiaka byl nižší než 50 mg (23). U některých celiaků však již 10 mg lepku může být provázeno slizničními změnami (24), proto je třeba, aby celiak omezil příjem lepku v maximální míře.
Existují pro to i další důvody: Tíže zánětlivých změn sliznice tenkého střeva je úměrná zbytkovému množství lepku v potravě (25). Celiaci i při striktní bezlepkové dietě a v klinické remisi mají často růstový a váhový deficit, méně kostních minerálů, svalové hmoty a tělesného tuku (26). Celiaci mají snížený průtok krve mozkem, zejména čelními laloky a tento deficit se alespoň zčásti zlepšuje po bezlepkové dietě (27). Obsah některých vitaminů (B1, B2, B12, D), minerálů (železa, vápníku, zinku, hořčíku) a vlákniny v potravinách bezlepkové diety může být nižší, než jsou doporučená množství, a podobně je tomu s celkovou energetickou hodnotou. Dodržování bezlepkové diety klade na celiaky velké finanční nároky. Příznivý účinek bezlepkové diety se dostavuje většinou v průběhu několika týdnů. Význam bezlepkové diety je třeba zvlášť vysvětlit celiakům s lehkou formou choroby a při malých nebo chybějících subjektivních obtížích. Nejčastější příčinou neúspěchu bezlepkové diety je její neúplné dodržování.
KOMPLIKACE
U dospělých se řídce vyskytuje refrakterní celiakie, která nereaguje na bezlepkovou dietu, ulcerativní jejunoileitida a lymfom. U dětí jsou kazuisticky popisovány tyto diagnózy zcela ojediněle (28–30). Nediagnostikovaní a neléčení mají riziko dlouhodobých komplikací – infertility, osteoporózy a lymfomu (31). Hyposplenismus (atrofie sleziny) je projevem pokročilé hypofunkce imunitního systému při dlouhotrvající konzumaci lepku u nediagnostikovaného celiaka. Projevuje se změnami erytrocytů a nálezem malé sleziny při břišní sonografii.
MONITOROVÁNÍ PACIENTŮ S DIAGNOSTIKOVANOU CELIAKIÍ
Guidelines ESPGHAN (19), National Institute for Health and Care Excellence (NICE) (32) a North American Society for Pediatric Gastroenterology Hepatology and Nutrition (33) jednoznačně neurčují, co při dispenzarizaci sledovat z hlediska možných nutričních deficiencí. Někteří doporučují v rámci dispenzarizace testovat i přítomnost autoimunitní tyreoiditidy bez udání frekvence vyšetření (34). Bližší studium tohoto problému (35) ukazuje, že rutinní testování nutričních deficiencí a tyreoidálních hormonů není efektivní, pokud nejsou při klinických kontrolách zjištěny poruchy růstu a udávány stížnosti na únavu. Jako vhodné se zdá (po dosažení negativity autoprotilátek jako projevu dodržování bezlepkové diety) jedenkrát ročně nemocného s celiakií vyšetřit v rámci dispenzarizace u pediatrického gastroenterologa, včetně podrobné anamnézy, posouzení dynamiky somatických parametrů a testovat dodržování diety prostřednictvím IgA antiTG2 (v případě sníženého IgA i ve třídě IgG) s indikací dalších vyšetření až na základě subjektivních stesků a fyzikálního nálezu. Podle amerického doporučení je doporučeno rutinně monitorovat somatické parametry, IgA antiTG2, krevní obraz a TSH (36).
Literární údaje uvádějí, že compliance bezlepkové diety je lepší, pokud je dieta indikována ve věku pod čtyři roky (37), pacienti ve věku 12–14 let dodržují bezlepkovou dietu lépe než ve věku 15–17 let (38). Biopsie a další sledování zvyšuje compliance (39). Pacienti zachycení na základě screeningu mají horší compliance než pacienti s klinickými obtížemi (40). Naše nejnovější zjištění uvádí nižší compliance u dětí s non-biopsy diagnózou (41). Poslední publikace uvádějí compliance 58 % u řeckých dětí ve věku 5–14,5 let (42). U indických dětí je uváděna compliance 75 % – lepší u menších dětí (> 80 %) než adolescentů (44 %) (43). Kanadská práce uvádí compliance 95 % (1–15 let, v mediánu 3 roky) (44). Prediktorem dobré compliance bezlepkové diety je výborná školní integrace a fungující sociální zázemí (45).
LEGISLATIVA
Legislativně je obsah lepku v potravinách řešen v Prováděcím nařízení Evropské komise č. 828/2014 ze dne 30. 7. 2014 o požadavcích na poskytování informací o nepřítomnosti či sníženém obsahu lepku v potravinách spotřebitelům. Tvrzení „bez lepku“ lze použít pouze tehdy, neobsahuje-li potravina ve stavu, v němž je prodávána konečnému spotřebiteli, více než 20 mg/kg lepku.
ZAVÁDĚNÍ LEPKU DO VÝŽIVY KOJENCŮ
Kojení a čas zavedení lepku do výživy kojenců nemají podle posledních zjištění efekt na riziko rozvoje celiakie v dětském věku (46). Podle stávajících doporučení pro komplementární výživu kojenců je doporučeno zavádět lepek do výživy mezi koncem 4. měsíce a koncem prvního roku života (47).
Dodržování bezlepkové diety je ekonomicky náročné a může být příčinou obtížné sociální situace pro rodiny dětí s celiakií (48).
ZÁVĚR
Celiakie má různorodý klinický obraz, ale může být i asymptomatická. Je třeba na ni myslet a provádět selektivní screening, neboť je v populaci nedostatečně diagnostikovaná.
Poděkování
Podporováno projektem RVO VFN 64615.
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Pavel Frühauf, CSc.
Klinika dětského a dorostového lékařství
1. LF UK a VFN v Praze
Ke Karlovu 2, 121 00 Praha 2
Tel.: 224 967 801
e-mail: pavel.fruhauf@lf1.cuni.cz
Zdroje
1. Frič P, Keil R. Celiakie pro praxi. Medicína pro praxi 2011; 8 : 354–359.
2. Altobelli E, Paduano R, Petrocelli R, Di Orio F. Burden of celiac disease in Europe: A review of its childhood and adulthood prevalence and incidence as of September 2014. Ann Ig 2014; 26 : 485–498.
3. Hill ID, Dirks MH, Liptak GS et al. Guideline for the diagnosis and treatment of celiac disease in children: Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005; 40 : 1.
4. Lanzini A, Villanacci V, Apillan N et al. Epidemiological, clinical and histopathologic characteristics of celiac disease: results of a case-finding population-based program in an Italian community. Scand J Gastroenterol 2005; 40 : 950.
5. Catassi C, Fabiani E, Rätsch IM et al. The coeliac iceberg in Italy. A multicentre antigliadin antibodies screening for coeliac disease in school-age subjects. Acta Paediatr Suppl 1996; 412 : 29.
6. Greco L, Percopo S. The coeliac disease task force "Free from Gluten" "improved knowledge to cure coeliac disease". Acta Paediatr Suppl 1996; 412 : 25.
7. Fasano A, Berti I, Gerarduzzi T et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: A large multicenter study. Arch Intern Med 2003; 163 : 286.
8. Schuppan D, Zimmer KP. The Diagnosis and Treatment of Celiac Disease. Dtsch Arztebl Int 2013; 110 : 835–846.
9. Frič P, Zavoral M, Dvořáková T. Choroby způsobené lepkem. Vnitr Lek 2013; 59 : 376–82.
10. Cínová J, Palová-Jelínková L, Smythies LE et al. Gliadin peptides activate blood monocytes from patients with celiac disease. J Clin Immunol 200; 27(2): 201–209.
11. Kopečný J, Mrázek J, Fliegerová K, Frühauf P, Tučková L. The intestinal microflora of childhood patients with indicated celiac disease. Folia Microbiol 2008; 53(3): 214–216.
12. Khatib M, Baker RD, Ly EK et al. Presenting pattern of pediatric celiac disease. J Pediatr Gastroenterol Nutr 2016; 62 : 60.
13. Frühauf P, Lojda Z, Fabianová J, Sedláčková M. Měnící se obraz celiakie v dětském věku. Časopis lékařů českých 2006; 145(6): 470–4.
14. McGowan KE, Castiglione DA, Butzner JD. The changing face of childhood celiac disease in North America: impact of serological testing. Pediatrics 2009; 124 : 1572.
15. Fassano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology 2001; 120 : 636–651.
16. Smith LB, Lynch KF, Kurppa K et al. Psychological manifestations of celiac disease autoimmunity in young children. Pediatrics 2017; 139.
17. Cílený screening celiakie. Metodický pokyn MZ ČR. Věstník MZ ČR, 2011, částka 3.
18. Giersiepen K, Lelgemann M, Stuhldreher N et al.; ESPGHAN Working Group on Coeliac Disease Diagnosis. Accuracy of diagnostic antibody tests for coeliac disease in children: summary of an evidence report. J Pediatr Gastroenterol Nutr 2012; 54 : 229–241.
19. Husby S, Koletzko S, Korponay-Szabó IR et al.; ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012; 54 : 136–160.
20. Marsh MN. Gluten, major histocompatibility complex, and the small intestine: A molecular and immunobiologic approach to the spectrum of gluten sensitivity. Gastroenterology 102; 1992 : 330–354.
21. Frühauf P, Bronský J, Dědek P a kol. Celiakie – doporučený postup pro diagnostiku a terapii u dětí a dospívajících. Československá pediatrie 2016; 71(3): 175–183.
22. Werkstetter KJ, Korponay-Szabó IR, Popp A et al. Accuracy in diagnosis of celiac disease without biopsies in clinical practice. Gastroenterology 2017; 153 (4): 924–935.
23. Catassi C, Fabiani E, Lacono G et al. A prospective, double-blind, placebo-controlled trial to establish a safe threshold for patients with celiac disease. Am J Clin Nutr 2007; 85 : 160–166.
24. Akobeng AK, Thomas AG. Systematic review: Tolerable amount of gluten for people with celiac disease. Aliment Pharmacol Ther 2008; 27 : 1044–1052.
25. Catassi C, Rosini M, Ratsch IM et al. Dose dependent effects of protracted ingestion of small amounts of gliadin in celiac disease children: a clinical and jejunal morphometrical study. Gut 1993; 34 : 1515–1519.
26. Bardella M, Friedella C, Prampolini L. Body composition and dietary intakes in adult celiac disease patients consuming a strict gluten-free diet. Am J Clin Nutr 2000; 72 : 937–939.
27. Usai P, Serra A, Marini B et al. Frontal cortical perfusion abnormalities related to gluten intake and associated autoimmune disease in adult celiac disease: 99mTc-ECD brain SPECT study. Dig Liver Dis 2004; 36 : 513–518.
28. Mubarak A, Oudshoorn JH, Kneepkens CMF et al. A child with refractory coeliac disease. J Pediatr Gastroenterol Nutr 2011; 53 : 216–218.
29. Sigman T, Nguyen VH, Costea F et al. Ulcerative jejunitis in a child with celiac disease. BMC Gastroenterol 2014; 14: 29.
30. Kabíček P, Kabíčková E, Frühauf P a kol. Maligní lymfom jako závažná komplikace celiakie diagnostikované v dorostovém věku. Praktický lékař 2004; 84 : 5: 260–262.
31. Fasano A. Should we screen for coeliac disease? Yes. BMJ 2009; 339: b3592.
32. Downey L, Houten R, Murch S, Longson D; Guideline Development Group. Recognition, assessment, and management of coeliac disease: Summary of updated NICE guidance. BMJ 2015; 351: h4513.
33. Hill ID, Dirks MH, Liptak GS et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005; 40 : 1–19.
34. Ventura A, Magazu G, Gerarduzzi T, Greco L. Coeliac disease and the risk of autoimmune disorders. Gut 2002; 51 : 897–898.
35. Wessels MM, van Veen II, Vriezinga SL et al. Complementary serologic investigations in children with celiac disease is unnecessary during follow-up. J Pediatr 2016; 169 : 55–60.
36. Snyder J, Butzner JD, DeFelice AR et al. Evidence-informed expert recommendations for the management of celiac disease in children. Pediatrics 2016; 138(3), pii: e20153147.
37. Högberg L, Grodzinsky E, Stenhammar L. Better dietary compliance in patients with coeliac disease diagnosed in early childhood. Scand J Gastroenterol 2003; 38 : 751–754.
38. Ljungman G, Myrdal U. Compliance in teenagers with coeliac disease: A Swedish follow-up study. Acta Paediatr 1993; 82 : 235–238.
39. Bardella MT, Molteni N, Prampolini L et al. Need for follow up in coeliac disease. Arch Dis Child 1994; 70 : 211–213.
40. Fabiani E, Corrao G, Barbato M et al. Compliance with gluten-free diet in adolescents with screening-detected celiac disease: A 5-year follow-up study. J Pediatr 2000; 136 : 841–3.
41. El-Lababidi N, Běláček J, Szitányi P et al. Gluten free diet in children: a comparison of compliance rates and growth parameters between biopsy and non-biopsy diagnosed children. Programme Book ESPGHAN 50. Annual Meeting, Prague 2017, poster GeP, 002 : 72.
42. Roma E, Roubani A, Kolia E et al. Dietary compliance and life style of children with coeliac disease. J Hum Nutr Diet 2010; 23 : 176–182.
43. Chauhan JC, Kumar P, Dutta AK et al. Assessment of dietary compliance to gluten free diet and psychosocial problems in Indian children with celiac disease. Indian J Pediatr 2010; 77 : 649–654.
44. Rashid M, Cranney A, Zarkadas M et al. Celiac disease: evaluation of the diagnosis and dietary compliance in Canadian children. Pediatrics 2005; 116: e754–e759.
45. Errichiello S, Esposito O, Di Mase R et al. Celiac disease: predictors of compliance with a gluten-free diet in adolescents and young adults. www.ncbi.nlm.nih.gov/pubmed/19644397" title="Journal of pediatric gastroenterology and nutrition. J Pediatr Gastroenterol Nutr 2010; 50 : 54–60.
46. Szajewska H, Shamir R, Chmielewska A et al. (The PREVENTCD Study Group) Systematic review with meta-analysis: Early infant feeding and coeliac disease-update 2015. Aliment Pharmacol Ther 2015; 41 : 1038–1054.
47. Frič P, Hricová S, Dítě P a kol. Celiakální sprue (CS) – současný stav a sociální situace nemocných v České republice. Expertní skupina Ministerstva zdravotnictví pro celiakální sprue (ESCS). Československá pediatrie 2004; 51(12): 603–604.
48. Fewtrell M, Bronský J, Campoy C, et al. Complementary feeding: a position paper ESPGHAN. www.ncbi.nlm.nih.gov/pubmed/19644397" title="Journal of pediatric gastroenterology and nutrition. J Pediatr Gastroenterol Nutr 2017; 64 : 119–132
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Úvodem
- Děti a digitální média
- Pohled do historie zdravotní péče o děti v Praze
- Celiakie dětí a dospívajících
- Periodické horečky a jiná autoinflamatorní onemocnění
- Diagnostika a léčba dětí s akutními křečemi na pediatrické jednotce intenzivní péče
- Moderní metody v diagnostice a výzkumu genetických příčin vzácných onemocnění
- Prenatální diagnostika chromosomových aberací v České republice: Aktuální data a významné trendy
- Horizontální přenos genetické informace a jeho význam pro vznik antibiotické rezistence
- Uzlinový syndrom u nemoci z kočičího škrábnutí dětí a dospělých
- Elektronické vyvolávací systémy nejsou nezbytným opatřením k ochraně osobních údajů ve zdravotnictví
- Čeští lékaři a manifest 2000 slov
- Georges Jean Franz Köhler (1946–1995)
- Významné životní jubileum prof. MUDr. Zbyňka Hrnčíře, DrSc.
- K životnímu jubileu prof. MUDr. Lidky Lisé, DrSc.
- Prof. MUDr. Jindřich Mourek, DrSc., devadesátiletý
- Cena J. E. Purkyně pro profesora Pavla Pafka
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Periodické horečky a jiná autoinflamatorní onemocnění
- Uzlinový syndrom u nemoci z kočičího škrábnutí dětí a dospělých
- Celiakie dětí a dospívajících
- Horizontální přenos genetické informace a jeho význam pro vznik antibiotické rezistence
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy