-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Bartterův a Gitelmanův syndrom
Bartter and Gitelman syndromes
Bartter and Gitelman syndromes belong to salt-losing tubulopathies. These rare diseases may be associated with severe electrolyte disorders. Early identification of tubulopathies is essential for appropriate management. Progress in molecular genetics enabled the identification of genes and pathophysiologic mechanisms associated with these diseases. Here, we review etiology and diagnostics of these disorders from the light of current knowledge. Additionally, we discuss contemporary therapeutic approaches.
Keywords:
management – tubulopathy – Bartter syndrome – Gitelman syndrome
Autori: Jakub Zieg 1; Zdeněk Doležel 2
Pôsobisko autorov: Pediatrická klinika 2. LF UK a FN Motol, Praha 1; Pediatrická klinika LF MU a FN Brno 2
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 131-134
Kategória: Přehledový článek
Súhrn
Bartterův a Gitelmanův syndrom patří mezi tubulopatie spojené se solnými ztrátami. Tato vzácná onemocnění mohou být spojena se vznikem závažných elektrolytových abnormalit. Včasná diagnostika tubulopatií je zásadní pro zvolení adekvátní terapie. Pokroky v molekulární genetice umožnily identifikaci genů a patofyziologických mechanismů spojených se vznikem těchto chorob. Náš přehledový článek pojednává o etiologii a diagnostice těchto onemocnění z pohledu současných poznatků. Zároveň předkládáme aktuální léčebná doporučení.
Klíčová slova:
léčba – Bartterův syndrom – Gitelmanův syndrom – tubulopatie
ÚVOD
Správná funkce lidského těla je závislá na vodní a elektrolytové rovnováze. Hlavním orgánem zodpovědným za udržení této rovnováhy jsou ledviny. Mechanismem glomerulární filtrace ledviny dospělého člověka za jediný den profiltrují okolo 180 litrů plazmy, jež obsahuje značné množství organických i anorganických látek, které jsou z velké části následně zpětně resorbovány systémem renálních tubulů. Okolo 25 000 mmol sodíku, 4500 mmol bikarbonátu, 720 mmol draslíku a 900 mmol glukózy se denně dostává do tubulárního systému, jehož úkolem je navrátit tyto látky zpět do krevního oběhu. Ledviny proto představují energeticky nejnáročnější orgán v lidském těle. Pokud dojde kdekoli v průběhu tubulárního systému k poruše reabsorpce elektrolytů, naruší se homeostáza a dojde k projevům onemocnění. V tomto přehledovém článku se věnujeme dvěma vrozeným onemocněním, která jsou spojena s poruchou zpětného vstřebávání elektrolytů.
Na počátku 60. let 20. století popsali lékaři Pacita Pronoveová a Frederic Bartter na 2 pacientech s normálním krevním tlakem nový syndrom charakterizovaný hypertrofií juxtaglomerulárního aparátu a hyperaldosteronismem. Tato choroba dostala následně název Bartterův syndrom (BS) (1). V roce 1966 pak Hillel Gitelman publikoval kazuistiku dvou sester s novým onemocněním charakterizovaným hypokalemií a hypomagnezemií, které bylo po svém objeviteli pojmenováno Gitelmanův syndrom (GS) (2).
V obou případech onemocnění se jedná o tubulopatie spojené se solnými ztrátami, proto je pro ně typický kompenzatorní hyperaldosteronismus vedoucí ke zpětné resorpci natria na úkor ztrát kalia ve sběrném kanálku. Pozdější výzkum prokázal, že obě tato onemocnění jsou autozomálně recesivně dědičná a mají velmi nízkou prevalenci: 1/100 000 u BS a 25/100 000 u GS. Zatímco za vznik BS je zodpovědný genový defekt ústící v postižení transportních mechanismů v tlusté části vzestupného raménka Henleovy kličky, u pacientů s GS je příčinou nemoci porucha funkce iontového kanálu v distálním tubulu (3).
BARTTERŮV SYNDROM
V případě Bartterova syndromu se jedná o onemocnění charakterizované polyurií, hypokalemií, metabolickou alkalózou, hyperreninovým hyperaldosteronismem a normotenzí. Pro jedince s BS je dále typické růstové neprospívání, u některých typů BS diagnostikujeme hyperkalciurii a nefrokalcinózu. Solné ztráty vedou k aktivaci osy renin-angiotenzin-aldosteron (RAA) s následným zvýšeným vylučováním kalia a chloridů. Zároveň dochází k porušení mechanismu tubuloglomerulárního feedbacku s aktivací cyklooxygenázy 2 a produkcí velkého množství prostaglandinů, jež také aktivují s cílem udržení intravaskulárního objemu osu RAA (4).
Porucha reabsorpce solí ve vzestupném raménku Henleovy kličky má za následek sníženou resorpci kalcia vedoucí k hyperkalciurii a nefrokalcinóze a dále narušení osmotického gradientu ve dřeni ledvin, čímž dochází k poruše koncentrační schopnosti ledvin. V současné době rozeznáváme v závislosti na genovém defektu 5 typů BS a s ním asociované dysfunkci transportérů v Henleově kličce. Elektrolytový transport ve vzestupném raménku Henleovy kličky znázorňuje obr. 1. Přenos onemocnění je autozomálně recesivní, pouze BS typu 5 se přenáší gonosomálně recesivně (5, 6) (tab. 1).
Obr. 1. Transportní mechanismy ve vzestupné části Henleovy kličky 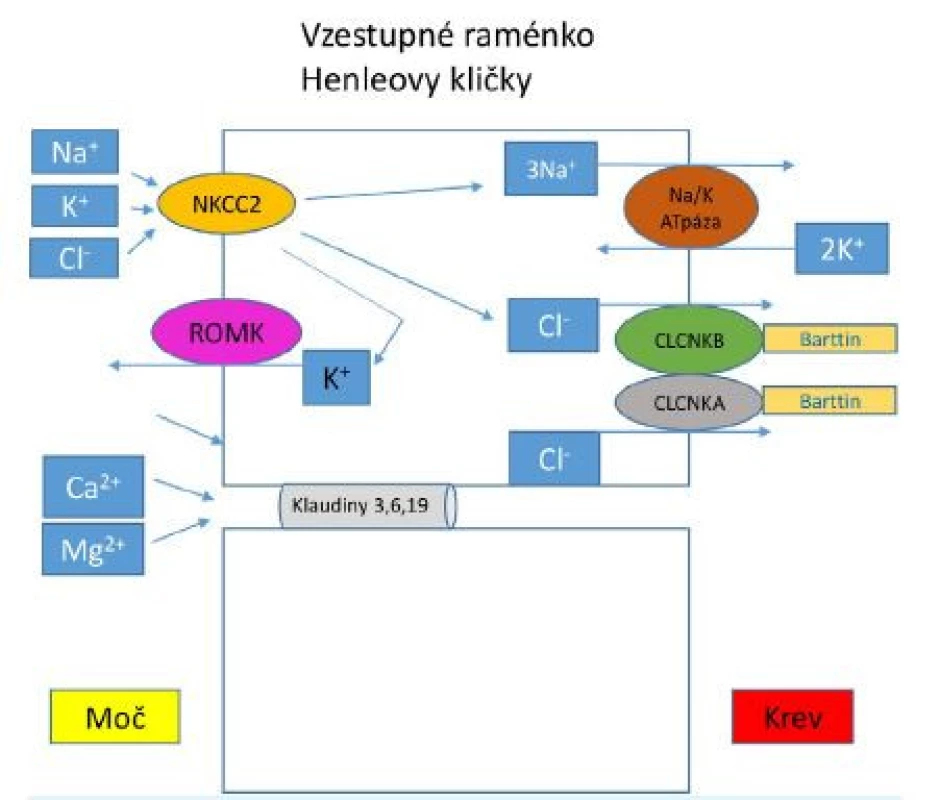
V apikální membráně epitelových buněk je lokalizován kotransportér NKCC2, který je zodpovědný za reabsorpci 20–25 % NaCl, které prošlo glomerulární filtrací. Vrozená dysfunkce tohoto transportéru podmiňuje vznik BS typ 1, tento kanál může být blokován také podáním furosemidu. Mutace v genu MAGED2 vedou k přechodné dysfunkci kanálu NKCC2 u pacientů s BS typu 5. Chloridy se dostávají zpět do krve přes transportéry bazolaterální membrány CLCNKB a CLCNKA, jejichž funkce je závislá na přítomnosti barttinu. Mutace v genu pro CLCNKB jsou zodpovědné za vnik BS typu 3 (klasický BS), mutace v genu pro tvorbu barttinu jsou asociované s BS typu 4a. Kombinovaná dysfunkce kanálu CLCNKB a CLCNKA podmiňuje vznik BS typu 4b. Porušená funkce kanálu ROMK je spojená s BS typu 2. Tento transportér zajišťuje homeostázu kalia recyklací draselných kationtů zpět do tubulárního lumen, čímž vytváří lumen pozitivní transepitelový potenciál nutný k paracelulární reabsorpci kalciových a magneziových iontů. Tab. 1. Typy Bartterova syndromu dle genetické příčiny a klinických projevů 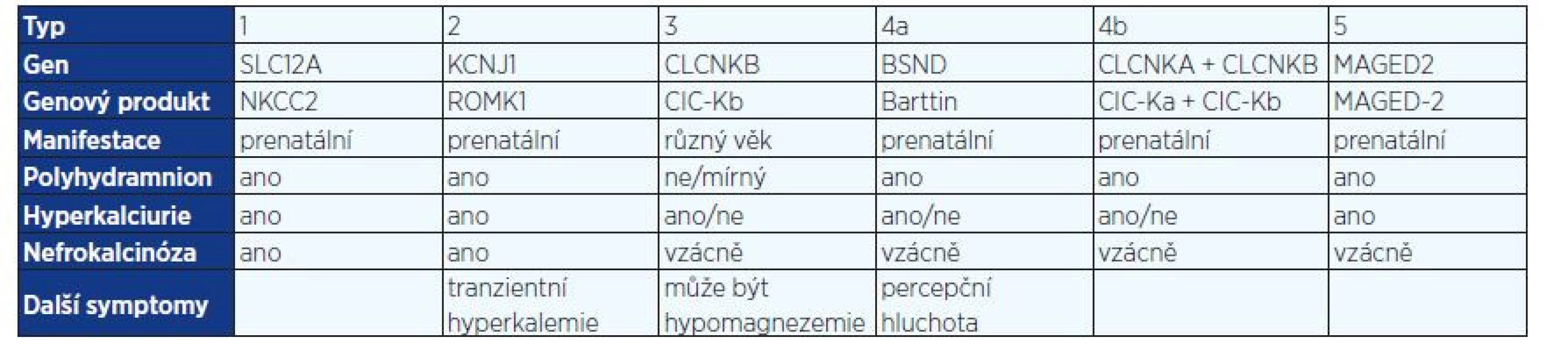
V apikální membráně epitelových buněk je lokalizován kotransportér NKCC2, který je zodpovědný za reabsorpci 20–25 % NaCl, které prošlo glomerulární filtrací. Vrozená dysfunkce tohoto transportéru podmiňuje vznik BS typ 1, tento kanál může být blokován také podáním furosemidu. Mutace v genu MAGED2 vedou k přechodné dysfunkci kanálu NKCC2 u pacientů s BS typu 5. Chloridy se dostávají zpět do krve přes transportéry bazolaterální membrány CLCNKB a CLCNKA, jejichž funkce je závislá na přítomnosti barttinu. Mutace v genu pro CLCNKB jsou zodpovědné za vnik BS typu 3 (klasický BS), mutace v genu pro tvorbu barttinu jsou asociované s BS typu 4a. Kombinovaná dysfunkce kanálu CLCNKB a CLCNKA podmiňuje vznik BS typu 4b. Porušená funkce kanálu ROMK je spojená s BS typu 2. Tento transportér zajišťuje homeostázu kalia recyklací draselných kationtů zpět do tubulárního lumen, čímž vytváří lumen pozitivní transepitelový potenciál nutný k paracelulární reabsorpci kalciových a magneziových iontů.
BS typy 1, 2, 4 a 5 se klasicky manifestují již před narozením polyhydramnionem matky, který se objevuje mezi 20. a 30. týdnem gravidity (7). Po porodu, který je obvykle předčasný, pozorujeme rychlý váhový úbytek při polyurii, metabolickou alkalózu s hypokalemií, vysoké hodnoty reninu a aldosteronu. Typická pro BS je dále zvýšená frakční exkrece chloridů (FECl) > 0.5% (8). U části pacientů nacházíme hyperkalciurii, příp. nefrokalcinózu. U pacientů s BS typu 2 často pozorujeme v novorozeneckém období přechodnou acidózu a hyperkalemii (9).
U většiny pacientů s BS typu 3 se nemoc obvykle manifestuje po prvním roce věku neprospíváním a polyurií, ale i u tohoto typu BS byla již popsána manifestace v prenatálním období (10). Mezi příznaky mladších dětí s manifestací BS typu 3 patří žízeň, obstipace, febrilie nejasné etiologie, hypotonie či opakované zvracení. V pozdějším věku se objevuje častěji svalová slabost, únava, v prepubertálním období je často patrné růstové neprospívání. U dětí s BS typu 3 je také typický preference slaných potravin. I když můžeme často na základě anamnézy, laboratorních a zobrazovacích vyšetření vyjádřit suspekci na BS, k potvrzení diagnózy je v současnosti vzhledem ke značné fenotypové variabilitě doporučeno provést molekulárně genetické vyšetření (3, 5, 11).
GITELMANŮV SYNDROM
Gitelmanův syndrom je podmíněn solnými ztrátami spojenými s poruchou funkce thiazid senzitivního Na-Cl symportéru v apikální membráně distálního tubulu, tento kanál je kódován genem SLC12A3 (12). Transportní mechanismy v distálním tubulu znázorňuje obr. 2. Mezi hlavní projevy GS patří dále hypokalemie, metabolická alkalóza jako důsledek aktivace osy RAA, typický je ovšem nález hypomagnezemie a hypokalciurie. Pacienti s GS jsou také normotenzní (13). Hypomagnezemie je způsobena zvýšenými ztrátami hořčíku do moči na podkladě snížené exprese luminálního kanálu TRPM6 v distálním tubulu, hypokalciurie vzniká následkem zvýšené pasivní reabsorpce kalciových iontů v proximálním tubulu (6).
Obr. 2. Transportní mechanismy v distálním tubulu 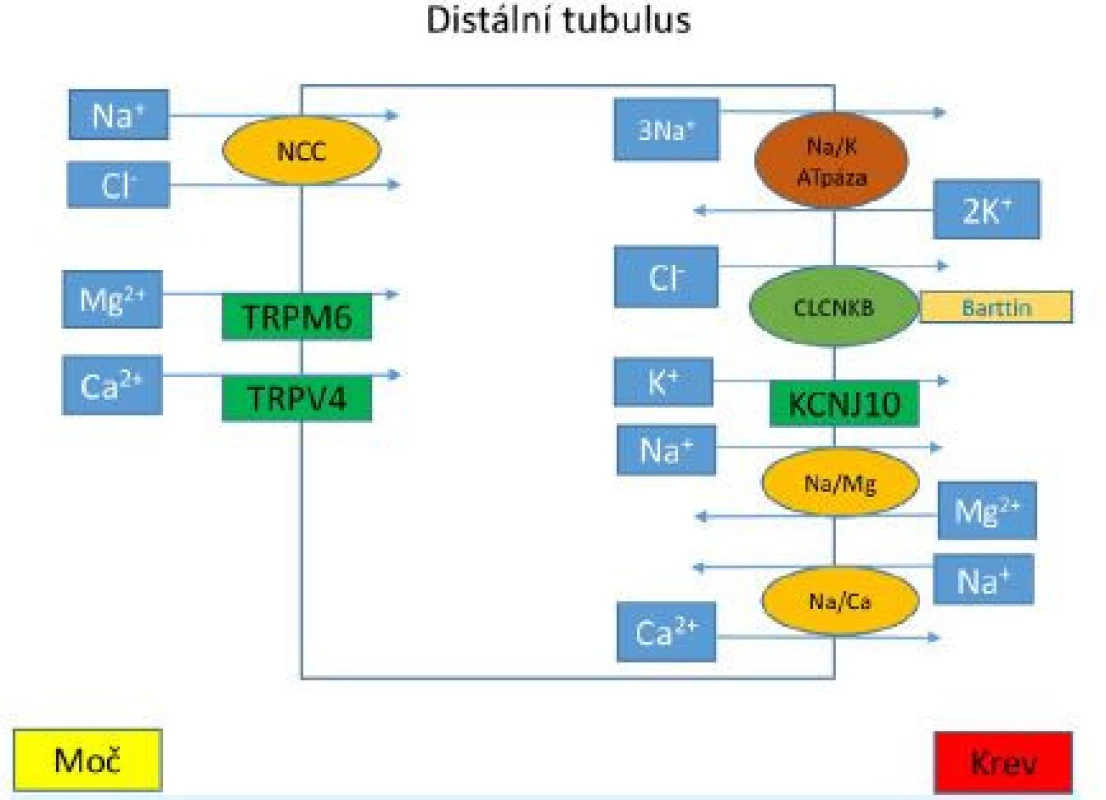
Kotransportér NCC v apikální membráně epitelových buněk je zodpovědný za reabsorpci natriových a chloridových iontů z lumen zpět do buňky. Mutace v genu, jenž kóduje NCC transportér, vedou ke vzniku GS. Kanál CLCNKB, jenž potřebuje ke své funkci membránový protein barttin je také přítomen v distálním tubulu. Snížená funkce těchto proteinů podmiňuje vznik BS typu 3 a 4a. Na bazolaterální membráně Na+/K+-ATPáza zajišťuje reabsorpci natriových iontů výměnou za kaliové kationty. Následně je kalium reabsorbováno kanálem KCNJ10, jehož dysfunkce je spojena se vznikem EAST syndromu. Epitelové kanály TRPM6a TRPV4 jsou zodpovědně za reabsorpci kaliových a magneziových iontů na epitelové membráně. Fenotyp GS může být přítomen i u pacientů s BS typu 3. GS se obvykle projevuje v adolescenci či dospělosti, ale byly popsány i případy její manifestace v neonatálním období (14). Mezi hlavní příznaky nemoci patří chuť na slané potraviny, polydipsie, nykturie, svalová slabost, únava, fyzická nevýkonnost, tetanie, parestezie, palpitace, hypotenze. U dětí s onemocněním je často patrné opoždění růstu a puberty (15).
Kotransportér NCC v apikální membráně epitelových buněk je zodpovědný za reabsorpci natriových a chloridových iontů z lumen zpět do buňky. Mutace v genu, jenž kóduje NCC transportér, vedou ke vzniku GS. Kanál CLCNKB, jenž potřebuje ke své funkci membránový protein barttin je také přítomen v distálním tubulu. Snížená funkce těchto proteinů podmiňuje vznik BS typu 3 a 4a. Na bazolaterální membráně Na+/K+-ATPáza zajišťuje reabsorpci natriových iontů výměnou za kaliové kationty. Následně je kalium reabsorbováno kanálem KCNJ10, jehož dysfunkce je spojena se vznikem EAST syndromu. Epitelové kanály TRPM6a TRPV4 jsou zodpovědně za reabsorpci kaliových a magneziových iontů na epitelové membráně.
DIFERENCIÁLNÍ DIAGNOSTIKA
V diferenciální diagnostice BS a GS musíme zvažovat kongenitální chloridoreu spojenou se sníženou resorpcí chloridů (Cl) v ileu a kolonu. Toto onemocnění se projevuje vodnatými průjmy s vysokým obsahem chloridových iontů (16). Sonograficky je při něm patrné rozšíření lumen střevních kliček.
Na rozdíl od BS u těchto pacientů nacházíme nízké odpady chloridů do moči a nízkou hladinu FECl (8). Ta je charakteristická také pro tzv. pseudobartterův syndrom. Jedná se o stavy spojené s opakovaným zvracením, zneužíváním laxativ a cystickou fibrózu. Příznaky i laboratorní obraz tubulopatie spojenými se solnými ztrátami může vyvolat také neužívání diuretik. Hodnota FECl u těchto jedinců závisí na tom, jestli pacient požil lék recentně (vysoká FECl), nebo již efekt diuretika vyprchal (nízká FECl). Pseudobartterův syndrom spojený se zneužíváním laxativ a diuretik představuje rizikový faktor rozvoje chronického onemocnění ledvin (17).
Fenotypem GS se může manifestovat také HNF1B nefropatie, pro toto onemocnění je ale typický nález renálních cyst, vrozených vad vývodného močového systému a rozvoj diabetu MODY5 (18). Hypokalemií, hypomagnezemií a metabolickou alkalózou se projevuje také syndrom epilepsie, ataxie, percepční nedoslýchavosti a tubulopatie (EAST), mezi jehož příznaky ale navíc patří ataxie, epilepsie, opoždění psychomotorického vývoje a percepční hluchota (5, 19).
LÉČBA BARTTEROVA SYNDROMU
Terapie je započata bez znalosti výsledku genetického vyšetření s cílem předejít rozvratu vnitřního prostředí (11). Recentně byla publikována nová doporučení pro léčbu BS i GS u dětí (5, 15). Základem léčby BS je úprava diety a substituce iontů, kterou je vhodné rozdělit alespoň do tří denních dávek.
Závažným projevem BS je hypokalemie, významný pokles hladiny sérového kalia může pacienta ohrozit hlavně fatálními arytmiemi (8). Kalium obvykle hradíme ve formě chloridu draselného (KCl) s cílem dosáhnout sérové koncentrace kalia alespoň 3 mmol/l. KCl nepodáváme nalačno, abychom dosáhli lepší tolerance.
V případě hypomagnezemie podáváme soli hořčíku, aspartát, citrát a laktát, v porovnání s anorganickými sloučeninami (oxidy, hydroxidy) totiž mají lepší biologickou dostupnost (20). Cílová hladina magnézia v séru je > 0,6 mmol/l. V léčbě se dále užívají nesteroidní protizánětlivé léky, inhibitory cyklooxygenázy (COX), které snižují produkci prostaglandinů, zmírňují symptomy a příznivě ovlivňuji iontogram i růst dětí s BS. V případě jejich podávání je nutno vzít v potaz možný rozvoj gastrointestinálních nežádoucích účinků, při podávání neselektivních COX inhibitorů se doporučuje s vědomím rizika hypomagnezemie současné užívání inhibitorů protonové pumpy. Seznam COX inhibitorů užívaných v léčbě BS shrnuje tab. 2.
Tab. 2. Nesteroidní protizánětlivé léky podávané dětem s Bartterovým syndromem 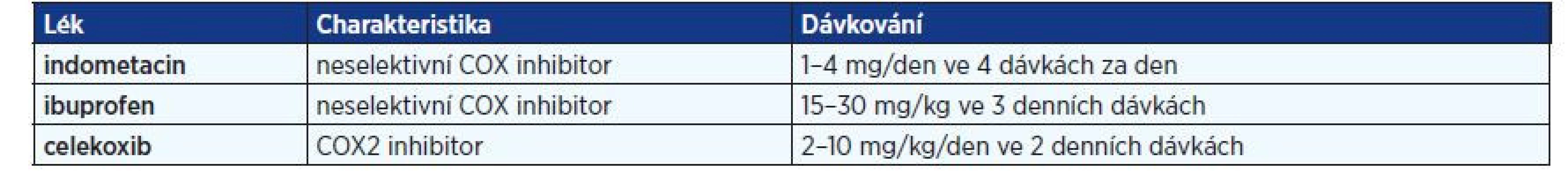
Pozn.: COX – cyklooxygenáza V současnosti není pacientům s BS obecně doporučováno podávání kalium šetřících diuretik, thiazidů a léků inhibujících osu renin – angiotenzin – aldosteron (RAA) vzhledem k riziku vzniku hypovolemie a potenciace solných ztrát. Jejich případné nasazení je na místě u jedinců s vážnými iontovými abnormalitami, které přetrvávají při maximální intenzitě léčby substitucí kalia a nesteroidními protizánětlivými léky u dětí s dobrou adherencí k užívání medikace (5). U některých pacientů s BS a růstovým neprospíváním je na místě podávání růstového hormonu, ale to až po adekvátní kompenzaci základního onemocnění výše zmíněnou konzervativní léčbou. Před nasazením této terapie je vhodné ve spolupráci s dětským endokrinologem vyšetření osy růstového hormonu (21).
LÉČBA GITELMANOVA SYNDROMU
Suplementace elektrolytů je hlavní léčebnou modalitou také v případě GS. Doporučená iniciální dávka elementárního magnézia je 5 mg/kg, 0,2 mmol/kg na den ve 2–4 denních dávkách. Iontová suplementace se podává obvykle s jídlem. Navyšování dávky magnézia je někdy limitováno rozvojem gastrointestinálních komplikací (průjmu). V případě závažné hypomagnezemie s rozvojem tetanie je vhodné podat magnézium intravenózně v dávce 0,1 mmol mg/kg v jedné dávce, tuto dávku lze opakovat v intervalu 6 hodin (12).
V případě přetrvávající hypokalemie, kterou nelze dostatečně hradit perorální substitucí, je možno dítěti s GS podat léky inhibující osu RAA, kalium šetřící diuretika nebo nesteroidní protizánětlivé léky, případně jejich kombinace. Podávání spironolaktonu může být spojeno s antiandrogenními nežádoucími účinky (gynekomastií, erektilní dysfunkcí, nepravidelností menstruačního cyklu), proto dáváme přednost nasazení eplerenonu, selektivního antagonisty aldosteronu. Stejně jako v případě BS, musíme brát v potaz rizika podávání diuretik vzhledem k možné potenciaci solných ztrát a hypovolemie. Gastrointestinální nežádoucí účinky mohou komplikovat také podávání COX inhibitorů, jejichž indikace je sporná, protože u pacientů s GS je koncentrace prostaglandinů v moči obvykle normální. I pacienti s GS jsou léčeni růstovým hormonem v případě, že je jejich onemocnění kompenzované a splní indikační kritéria.
PROGNÓZA
U významné část pacientů s BS v průběhu sledování dochází k poruše glomerulární filtrace. Příčina zhoršování funkce ledvin není zatím jasná. Může se na ní podílet chronická hypokalemie, dlouhodobě zvýšené hladiny prostaglandinů či aldosteronu v krvi. Vliv léčby COX inhibitory či nefrokalcinózy na progresi renálního selhání nebyl potvrzen (3, 22). Rozvoj chronického onemocnění ledvin spojeného s poklesem funkce ledvin zjišťujeme u pacientů s GS výrazně méně často. Popsán také nebyl vliv GS na dobu dožití. Obecně je vhodné děti s BS a GS pravidelně sledovat v ambulanci dětské nefrologie v rámci center pro vzácná onemocnění.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam použitých zkratek
BS Bartterův syndrom
COX cyklooxygenáza
EAST epilepsie, ataxie, percepční nedoslýchavost (sensorineural deafness), tubulopatie
FECl frakční exkrece chloridů
GS Gitelmanův syndrom
KCl chlorid draselný
MODY maturity onset diabetes of the young
RAA renin – angiotenzin – aldosteron
Adresa pro korespondenci:
doc. MUDr. Jakub Zieg, Ph.D.
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
Tel.: 224 432 001
e-mail: jakubzieg@hotmail.com
Zdroje
1. Bartter FC, Pronove P, Gill JR jr. et al. Hyperplasia of the juxtaglomerular complex with hyperaldosteronism and hypokalemic alkalosis. A new syndrome. Am J Med 1962; 33 : 811–828.
2. Gitelman HJ, Graham JB, Welt LG. A new familial disorder characterized by hypokalemia and hypomagnesemia. Trans Assoc Am Physicians 1966; 79 : 221–235.
3. Walsh PR, Tse Y, Ashton E et al. Clinical and diagnostic features of Bartter and Gitelman syndromes. Clin Kidney J 2018; 11 : 302–309.
4. Reinalter SC, Jeck N, Brochhausen C et al. Role of cyclooxygenase-2 in hyperprostaglandin E syndrome/antenatal Bartter syndrome. Kidney Int 2002; 62 : 253–260.
5. Konrad M, Nijenhuis T, Ariceta G et al. Diagnosis and management of Bartter syndrome: executive summary of the consensus and recommendations from the European Rare Kidney Disease Reference Network Working Group for Tubular Disorders. Kidney Int 2021; 99 : 324–335.
6. Besouw MTP, Kleta R, Bockenhauer D. Bartter and Gitelman syndromes: Questions of class. Pediatr Nephrol 2020; 35 : 1815–1824.
7. Laghmani K, Beck BB, Yang SS et al. Polyhydramnios, transient antenatal Bartter's syndrome, and MAGED2 mutations. N Engl J Med 2016; 374 : 1853–1863.
8. Zieg J, Gonsorčíková L, Landau D. Current views on the diagnosis and management of hypokalaemia in children. Acta Paediatr 2016; 105 : 762–772.
9. Finer G, Shalev H, Birk OS et al. Transient neonatal hyperkalemia in the antenatal (ROMK defective) Bartter syndrome. J Pediatr 2003; 142 : 318–323.
10. Yang X, Zhang G, Wang M et al. Bartter syndrome type 3: Phenotype-genotype correlation and favorable response to ibuprofen. Front Pediatr 2018; 6 : 153.
11. Doležel Z, Cheong HI, Holeszová A et al. Bartterův syndrom – klinicko-genetická analýza. Pediatrie pro praxi 2015; 16 : 179–182.
12. Knoers NV, Levtchenko EN. Gitelman syndrome. Orphanet J Rare Dis 2008; 3 : 22.
13. Doležel Z, Papež J, Jeřábek M. Gitelmanův syndrom. Pediatrie pro praxi 2021; 22 : 216–217.
14. Tammaro F, Bettinelli A, Cattarelli D et al. Early appearance of hypokalemia in Gitelman syndrome. Pediatr Nephrol 2010; 25 : 2179–2182.
15. Blanchard A, Bockenhauer D, Bolignano D et al. Gitelman syndrome: consensus and guidance from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int 2017; 91 : 24–33.
16. Di Meglio L, Castaldo G, Mosca C et al. Congenital chloride diarrhea clinical features and management: a systematic review. Pediatr Res 2021; 90 : 23-29.
17. Jdiaa SS, Walsh SB, Bockenhauer D et al. The hypokalemia mystery: distinguishing Gitelman and Bartter syndromes from 'pseudo-Bartter syndrome'. Nephrol Dial Transplant 2020; 37 : 29–30.
18. Adalat S, Hayes WN, Bryant WA et al. HNF1B mutations are associated with a Gitelman-like tubulopathy that develops during childhood. Kidney Int Rep 2019; 4 : 1304–1311.
19. Bockenhauer D, Feather S, Stanescu HC et al. Epilepsy, ataxia, sensorineural deafness, tubulopathy, and KCNJ10 mutations. N Engl J Med 2009; 360 : 1960–1970.
20. Ranade VV, Somberg JC. Bioavailability and pharmacokinetics of magnesium after administration of magnesium salts to humans. Am J Ther 2001; 8 : 345–357.
21. Buyukcelik M, Keskin M, Kilic BD et al. Bartter syndrome and growth hormone deficiency: three cases. Pediatr Nephrol 2012; 27 : 2145–2148.
22. Reinalter SC, Grone HJ, Konrad M et al. Evaluation of long-term treatment with indomethacin in hereditary hypokalemic salt-losing tubulopathies. J Pediatr 2001; 139 : 398–406.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek ÚvodemČlánek Harold Eliot Varmus (*1939)
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
2022 Číslo 3-4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Úvodem
- Současnost a perspektivy léčby obezity: Co již víme a co můžeme očekávat?
- Současná bariatrická/metabolická chirurgie
- Antiobezitika před bariatrickou operací a po ní – jak je využít co nejlépe
- Nutriční péče o bariatrické pacienty
- Doporučení k psychologickému vyšetření před bariatrickou operací
- Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
- Bartterův a Gitelmanův syndrom
- Myokarditida jako projev onemocnění COVID-19 a po očkování proti této nemoci
- Anesteziologická péče pro nekardiochirurgické výkony u pacientů po transplantaci srdce
- Torakoskopický přístup v terapii poranění hrudního mízovodu – kazuistiky a revize literatury
- Využití autonomních leteckých systémů ve zdravotnictví
- Současná problematika dárcovství těl pro výukové a výzkumné účely a jejich využití v Česku
- Islámská republika Írán – překvapivě progresivní centrum zdravotního turismu
- Horizont Evropa, rámcový program Evropské komise na období 2021–2027 – novinky ve srovnání s programem Horizont 2020
- Veřejné zdravotnictví v průběhu času – vývoj a současnost
- Jakub Hron Metánovský a jeho stopy v medicíně
- Harold Eliot Varmus (*1939)
- 64. Purkyňův den – rozloučení s prof. MUDr. Otto Hrodkem, DrSc.
- Karel Lukáš, Josef Kautzner, Jiří Hoch a kol. Bolest na hrudi (Grada Publishing, Praha, 2022, 642 s.)
- Přednáškové večery Spolku českých lékařů v Praze (září - říjen 2022)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Bartterův a Gitelmanův syndrom
- Současná bariatrická/metabolická chirurgie
- Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
- Doporučení k psychologickému vyšetření před bariatrickou operací
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



