-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam intervenční ultrasonografie v léčbě pokročilých abdomino-pelvických nádorů
Ultrasound-guided tru-cut biopsy in the treatment of abdomino-pelvic advanced tumors
Objective:
The goal of this study was to evaluate the accuracy and safety of ultrasound-guided tru-cut biopsy in advanced abdomino-pelvic tumors in a sufficiently large cohort.Design:
Prospective study.Setting:
Oncogynecological Center, Department of Obstetrics and Gynecology, General Faculty Hospital of Charles University, Prague.Methods:
Patients indicated for tru-cut biopsy were those with primarily inoperable tumors, with advanced tumors and compromised performance status preventing a primary surgical procedure, and with recurrent pelvic tumors requiring histological verification. All were referred to the Oncogynecological Center between January 2005 and June 2007. Tru-cut biopsy was taken either from pelvic tumor or from its metastatic sites transvaginally or transabdominally under ultrasound guidance. Sample adequacy was evaluated.Results:
Altogether, 119 patients were referred for tru-cut biopsy during a study period. Only 4 cases were found unsuitable for tru-cut biopsy and the patients were referred for laparoscopy instead. Samples were obtained transvaginally in 67 patients (58.3%) and transabdominally in 48 patients (41.7%). The biopsy was taken from pelvic tumor in 59 patients (51.3%), omental cake in 14 patients (12.2%), from peritoneal visceral or parietal carcinomatosis in 37 patients (32.2%) and from other localities in 5 patients (4.3 %). The diagnostic adequacy of ultrasound-guided tru-cut biopsy reached 94.8% (95% CI, 94,17–99,40%). There were only two tru-cut biopsy-related complications: The first case involved bleeding from tumor in a patient with mild thrombocytopenia that required laparotomy; in the second case, diagnostic laparoscopy was indicated after a minor bleeding occurred in the biopsy site on ultrasound, however, no significant pelvic bleeding was confirmed by the procedure.Conclusion:
Ultrasound-guided tru-cut biopsy is a safe, reliable, fast, and cost-effective diagnostic method for histological verification of both advanced primary and recurrent abdomino-pelvic tumors. It can be performed in an outpatient setting without the need for general anesthesia, causing a minimal discomfort to the patient in comparison with laparoscopy or laparotomy. The risk of complications is low and the main advantage is the acquirement of a sample adequate for further immunohistochemical examination, which is a necessary requirement for the choice of optimal oncological treatment.Key words:
advanced abdomino-pelvic tumor, ovarian cancer, extraovarian tumours, recurrent tumor, tru-cut biopsy, ultrasound, staging, prediction of operability.
Autori: D. Fischerová 1; D. Cibula 1; Michal Zikán 1
; P. Freitag 1; J. Sláma 1; N. Jančárková 1; I. Pinkavová 1; P. Dundr 2
Pôsobisko autorov: Onkogynekologické centrum, Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc. 1; Ústav patologie VFN a 1. LF UK, Praha, přednosta prof. MUDr. C. Povýšil, DrSc. 2
Vyšlo v časopise: Ceska Gynekol 2009; 74(5): 329-334
Súhrn
Cíl studie:
Cílem práce bylo ověřit přesnost a bezpečnost ultrazvukem navigované biopsie silnou jehlou (tru-cut biopsie) u pokročilých abdomino-pelvických nádorů na dostatečném počtu pacientů.Typ studie:
Prospektivní studie.Pracoviště:
Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha.Materiál a metodika:
K tru-cut biopsii byly indikovány pacientky s pokročilým nádorem se známkami inoperabilního nálezu, pacientky ve špatném stavu, který neumožňoval primární chirurgický výkon a pacientky s podezřením na recidivu pánevního nádoru, u kterých bylo indikováno histologické ověření a které byly referovány do Onkogynekologického centra VFN od ledna 2005 do června 2007. Tru-cut biopsie byla provedena z nádoru nebo jeho metastatických ložisek transvaginálním nebo transabdominálním přístupem pod ultrazvukovou kontrolou. Byla hodnocena adekvátnost vzorku.Výsledky:
Do studie bylo zahrnuto 119 pacientek indikovaných k provedení tru-cut biopsie během sledovaného období. U 4 pacientek nebylo technicky možné provést tru-cut biopsii a pacientky byly předány k laparoskopickému diagnostickému výkonu. Transvaginální odběr biopsie byl proveden u 67 (58,3 %) a transabdominální přístup u 48 (41,7 %) pacientek. Vzorky byly získány z vlastního nádoru u 59 pacientek (51,3 %), z infiltrovaného omenta ve 14 případech (12,2 %), z parietální nebo viscerální karcinomatózy u 37 žen (32,2 %) a z jiných lokalit v 5 případech (4,3 %). Celkový počet adekvátních vzorků dosáhl 94,8 % (95% CI, 94,17–99,40 %). Během sledovaného období byly zaznamenány dvě komplikace spojené s tru-cut biopsií. V prvém případě si krvácení z ovariálního nádoru u pacientky s mírnou trombocytopenií vyžádalo minilaparotomii. V druhém případě byla indikována diagnostická laparoskopie na základě drobného krvácení z místa odběru biopsie v pánvi dle ultrazvukové kontroly, které se již při laparoskopii neprokázalo.Závěr:
Ultrazvukem navigovaná biopsie silnou jehlou je bezpečná, rychlá a spolehlivá metoda k histologické verifikaci pokročilého nebo recidivujícího abdominopelvického nádoru. Výkon lze provést ambulantně, bez nutnosti celkové anestezie, při minimálním dyskomfortu pro pacienta ve srovnání s laparoskopií nebo laparotomií. Riziko komplikací je nízké a hlavní výhodou je získání adekvátního histologického vzorku s možností následného imunohistochemického vyšetření, které je nezbytným předpokladem pro volbu optimální onkologické léčby.Klíčová slova:
pokročilý abdomino-pelvický tumor, ovariální karcinom, extraovariální nádor, recidivující nádor, tru-cut biopsie, ultrazvuk, staging, predikce operability.ÚVOD
Diferenciální diagnostika benigních a maligních nádorů je doménou gynekologického ultrazvukového vyšetření [3]. Při použití pouze sonomorfologických kritérií je limitována možnost přesného odlišení benigních a časných maligních ovariálních nádorů vzhledem k překrývání jejich sonomorfologických charakteristik. Proto se současně využívá dopplerovské vyšetření (color Doppler sonography, CDS), které doplňuje informaci o biologickém chování nádoru. Kombinací sonomorfologických a dopplerovských kritérií dosahuje ultrazvuk v diferenciální diagnostice benigních a maligních ovariálních nádorů senzitivity 88 % a specificity 95 % [15]. Nadále nedořešeným problémem zůstávají tzv. obtížně hodnotitelné nádory (difficult tumors), kde je nižší přesnost stanovení správné diagnózy i zkušeným vyšetřujícím a pozornost se věnuje hledání doplňujících testů (matematické modely, proteomika, ultrazvukové kontrastní látky, nové nádorové markery, 3D doppler), které by upřesnily diagnózu [16]. Naopak stanovení přítomnosti pokročilého pánevního nádoru na základě ultrazvukového vyšetření nečiní většinou diagnostické obtíže. Ultrazvukovou zkušenost vyžaduje však upřesnění definitivního rozsahu nádoru v pánvi a břišní dutině (klinický staging) a vyjádření k operabilitě onemocnění na základě přítomnosti ultrazvukových markerů inoperability. Určení původu pokročilého pánevního nádoru na základě zobrazovacích metod je pouze orientační a vždy vyžaduje následné bioptické ověření minimálně invazivním nebo otevřeným přístupem.
Ultrazvukové vyšetření, skiagram hrudníku a stanovení nádorového markeru CA 125 patří u zhoubného nádoru vaječníku mezi obligatorní stagingová vyšetření [4]. Přesto je většinou onkogynekologických center akceptována role ultrazvuku pouze v diferenciální diagnostice maligních a benigních ovariálních lézí. U sporných případů ovariálních nádorů je doporučováno provedení magnetické rezonance a pro stanovení rozsahu onemocnění v břišní dutině vyšetření výpočetní tomografií (CT) s kontrastem [5]. Současné technické možnosti ultrazvukového vyšetření však umožňují jeho širší využití v klinickém stagingu. Kombinací transvaginálního a transabdominálního vyšetření lze získat kompletní informaci o rozsahu nádoru podobně jako u jiných malignit. V ultrazvukovém popisu je kromě přesné charakteristiky primárního ovariálního nádoru možné hodnotit přítomnost, lokalizaci, rozsah a šířku peritoneálních metastáz, stanovit tloušťku infiltrovaného infrakolického a suprakolického omenta, zhodnotit ingvinofemorální, pánevní a paraaortální lymfatické uzliny, postižení jater a sleziny, potvrdit nebo vyloučit dilataci kalichopánvičkového systému ledvin, přítomnost a množství ascitu a fluidotoraxu a další patologické nálezy v břišní a pleurální dutině [5]. Při podezření na infiltraci rektosigmoidea lze současně provést transrektální ultrazvukové vyšetření se zhodnocením anatomie stěny rekta [18].
Doposud bylo publikováno pouze několik studií, které srovnávaly možnosti ultrazvuku a dalších moderních zobrazovacích metod ve stanovení stagingu pokročilých ovariálních karcinomů. Podle prospektivní studie radiodiagnostické onkologické skupiny (RDOG – Radiological Diagnostic Oncology Group) srovnávající přesnost US, MR a CT v předoperačním stagingu u 180 následně operovaných pacientek měly uvedené zobrazovací metody podobnou přesnost (87 % – 95 %) pro stanovení šíření nádoru v pánvi a břišní dutině. Konvenční ultrazvuk dosáhl nejvyšší specificity (96 %) ve stagingu ve srovnání s MR (88 %) a CT (89 %), avšak nižší senzitivity (75 %) ve srovnání s MR (98 %) a CT (92 %) [11]. Druhá prospektivní studie radiodiagnostické onkologické skupiny (RDOG) u 280 následně operovaných pacientek s ovariálním karcinomem potvrdila vyšší specificitu ultrazvuku ve srovnání s MR a CT při stanovení peritoneálních metastáz (93 %), postižených lymfatických uzlin v retroperitoneu (93 %) a metastáz v jaterním parenchymu (98 %) [14].
Žádná práce se dosud nevěnovala využití ultrazvukového vyšetření v predikci operability pokročilých ovariálních nádorů. Ultrazvuk však může zhodnotit přítomnost definovaných markerů pro stanovení operability podobně jako MR nebo CT [6]. Mezi nejčastěji citované markery inoperability patří difuzní viscerální karcinomatóza na střevních kličkách, suprarenální lymfadenopatie, uložení nádoru znemožňující jeho odstranění, přítomnost intraparenchymatózních metastáz nebo nodularity v mezenteriu velikostí nad 2 cm.
Další možnou indikací pro využití ultrazvuku u pokročilých ovariálních nádorů jsou ultrazvukem navigované intervenční výkony, sloužící zejména k získání histologického vzorku. Doposud se k bioptické verifikaci využíval přístup laparotomický, laparoskopický nebo biopsie tenkou jehlou (fine needle aspiration biopsy, FNAB), pouze ojediněle se prováděla biopsie silnou jehlou (tru-cut biopsy). Nevýhodou laparotomie i laparoskopie je invazivita výkonu, s nutností celkové anestezie a hospitalizace, s rizikem perioperační a pooperační morbidity. Biopsie tenkou jehlou patří sice mezi minimálně invazivní metody, ale umožní získání pouze cytologického vzorku. Optimální metodou je biopsie silnou jehlou, umožňující nejen získání adekvátního histologického vzorku, ale zároveň splňující podmínky minimálně invazivního výkonu [7].
CÍLE PRÁCE
Cílem práce bylo ověřit přesnost a bezpečnost ultrazvukem navigované biopsie silnou jehlou (tru-cut biopsie) u pokročilých abdominopelvických nádorů na dostatečném počtu pacientů.
METODIKA
Do studie byly zahrnuty pacientky s pokročilým abdominopelvickým nádorem, vyšetřené v Onkogynekologickém centru VFN od ledna 2005 do června 2007. K tru-cut biopsii byly indikovány pacientky s pokročilým nádorem se známkami inoperabilního nálezu, pacientky ve špatném stavu, který neumožňoval primární chirurgický výkon a pacientky s podezřením na recidivu pánevního nádoru, u kterých bylo indikováno histologické ověření. Zhodnocení operability nálezu bylo provedeno na základě kombinace vyšetření ultrazvukem a počítačovou tomografií. Za známky inoperabilního nálezu byly považovány následující jevy: difuzní viscerální karcinomatóza na střevních kličkách, suprarenální lymfadenopatie větší než 2 cm, uložení nádoru znemožňující jeho odstranění, přítomnost intraparechymatózních metastáz nebo větší nodularity v mezenteriu (větší než 2 cm).
U všech pacientek byly nejprve ultrazvukem ověřeny podmínky pro transvaginální nebo transabdominální odběr biopsie. V případě, že nebylo možné bezpečně provést tru-cut biopsii nádoru, byly pacientky doporučenyny k diagnostické laparoskopii nebo minilaparotomii.
Tru-cut biopsie byla provedena transvaginálním nebo transabdominálním přístupem pod ultrazvukovou kontrolou. Bezprostředně po získání vzorku bylo místo odběru vzorku v pánvi a/nebo v břišní dutině pečlivě zkontrolováno ultrazvukem, aby se vyloučilo event. krvácení z místa vpichu. Pro transabdominální vpich byla použita lokální anestezie 1% Mesocainem, 2–5 ml, transvaginální odběr nevyžadoval lokální anestezii. Výkon byl proveden ambulantně a pacientky byly 30–60 minut po výkonu předány do domácí péče.
Biopsie byla odebírána z nádoru nebo jeho metastatických ložisek. K biopsii se využívalo automatické bioptické dělo (Fast Gun, firma Sterylab, Itálie) s jednorázovými jehlami a možností řízení hloubky „výstřelu“ 10–20 mm. Pro transvaginální výkon byla pacientka uložena ve stejné poloze jako při gynekologickém vyšetření. Na endovaginální sondu byl upevněn zavaděč a do něj následně umístěna jehla o délce 250 mm a průměru 16 gauge (Fast Cut jehly, firma Sterylab), která byla upevněna v bioptickém dělu. Transabdominální odběr byl proveden pod ultrazvukovou kontrolou abdominální sondou, na kterou nebyl upevněn zavaděč. Vlastní výkon byl prováděn z volné ruky. Pro transabdominální odběr byly využívány kratší jednorázové jehly o délce 150–200 mm a šíři 14–16 gauge. K výkonu byl využíván ultrazvukový přístroj General Electric 9 s endovaginální sondou (5–7,5 MHz) a transabdominální sondou (3–5 MHz).
Celkem byly odebírány 1–3 vzorky tkáně o délce 10–20 mm a šíři 1,6–2 mm, které byly následně vloženy do formaldehydu a odeslány na histopatologické vyšetření. Fixované vzorky zalité do parafínu byly nabarveny hematoxylin-eozinem a byla hodnocena adekvátnost vzorku, eventuálně doplněna imunohistochemická vyšetření pro upřesnění typu a původu nádoru.
V případě, že nebyl získán adekvátní vzorek k určení typu nádoru, byla biopsie zopakována.
Výsledky
Do studie bylo zahrnuto 119 pacientek indikovaných k provedení tru-cut biopsie během sledovaného období. Charakteristiky pacientek jsou shrnuty v tabulce1.
Tab. 1. Charakteristika skupiny 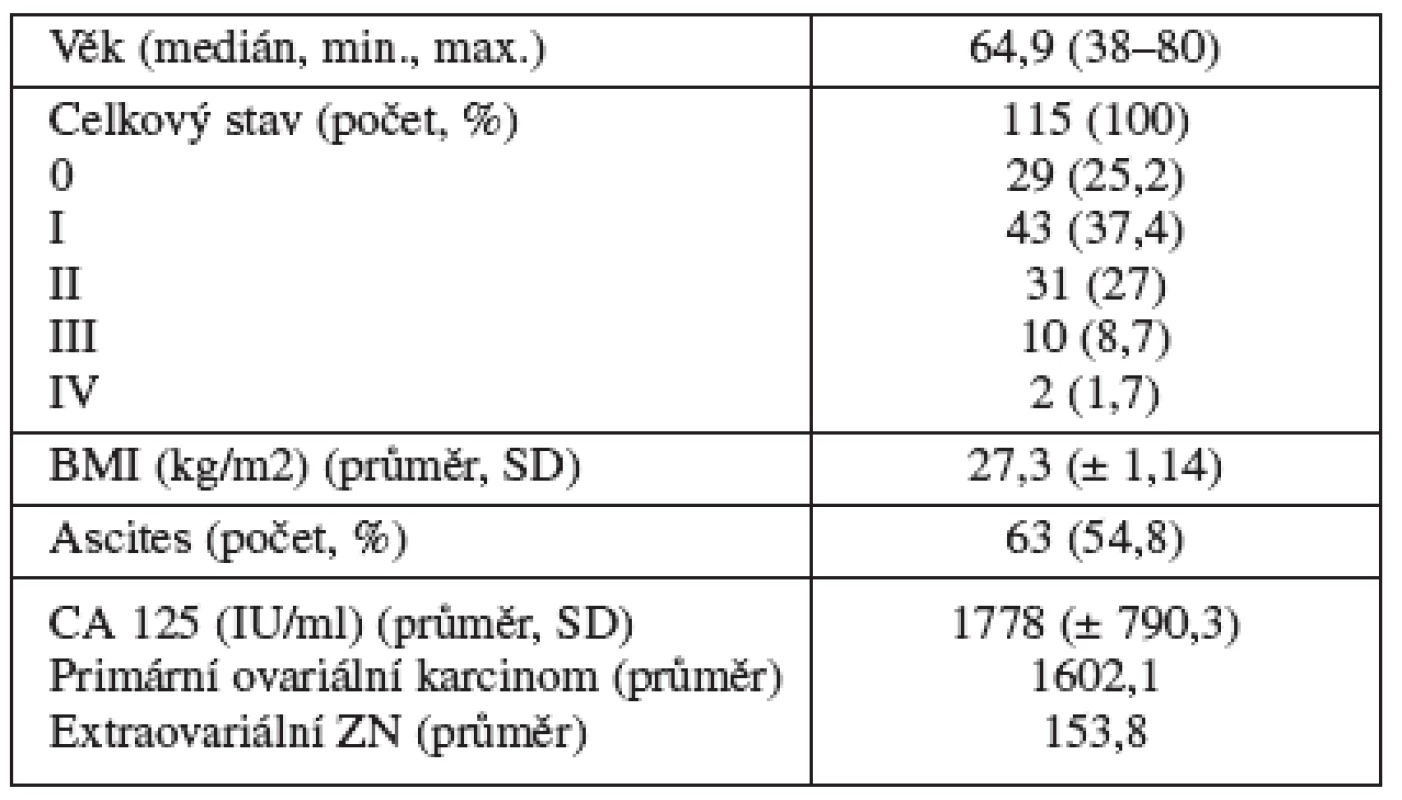
BMI – body mass index, CA 125 – cancer antigen 125, SD – směrodatná odchylka U 4 pacientek nebylo technicky možné provést tru-cut biopsii a pacientky byly referovány k laparoskopickému diagnostickému výkonu. Celkem byla tru-cut biopsie provedena u 115 pacientek. Z toho 92 (80 %) pacientek mělo známky inoperabilního onemocnění, v 18 (16 %) případech se jednalo o recidivující onemocnění a 5 (4 %) pacientek bylo ve špatném celkovém stavu. Ve skupině s recidivujícími nádory bylo u 5 ze 13 pacientek známé duplicitní nádorové onemocnění.
Transvaginální odběr biopsie byl proveden u 67 (58,3 %) a transabdominální přístup u 48 (41,7 %) pacientek. Vzorky byly získány z vlastního nádoru u 59 pacientek (51,3 %), z infiltrovaného omenta ve 14 případech (12,2 %), z parietální nebo viscerální karcinomatózy u 37 žen (32,2 %) a z dalších lokalit (lymfatické uzliny, sakrouterinní vaz, játra) v 5 případech (4,3 %). V průměru byly odebrány 2 vzorky. Doba potřebná k získání vzorků u jedné pacientky se pohybovala mezi 10–15 minutami.
V 6 případech byl získán inadekvátní vzorek, z toho ve 4 vzorcích byla pouze nekrotická blíže nehodnotitelná nádorová tkáň. U těchto 4 pacientek byla biopsie úspěšně zopakována a získán adekvátní vzorek pro histologické vyšetření. Ve zbylých 2 případech byla z technických důvodů (skirhotický nekrotický nádor, diskrétní karcinomatóza na střevní kličce) upřednostněna laparoskopie nebo minilaparotomie (graf 1). Celková diagnostická přesnost výkonu dosáhla 94,8 % (95% CI, 94,17 až 99,40 %).
Graf 1. Rozdělení pacientek v prospektivní studii 
Primární ovariální nádor byl histologicky potvrzen u 74 pacientek (64,35 %) pacientek. Sekundární ovariální postižení nebo extraovariální nádor byl detekován u 15 (13,04 %) a 26 (22,61 %) žen (tab. 2). U čtyř pacientek s podezřením na recidivu primárního onemocnění při anamnéze zhoubného nádoru (kolorektální karcinom, karcinom prsu a plic) byl získán vzorek benigního nádoru cervikální myom (1), peritoneální difuzní leiomyomatóza (2), ovariální teratom (1). Ovariální teratom byl následně odstraněn laparoskopickým přístupem a další 3 pacientky s benigním nálezem byly sledovány 6–24 měsíců bez známek progrese primárního onemocnění.
Tab. 2. Histologie pokročilých abdominopelvických nádorů 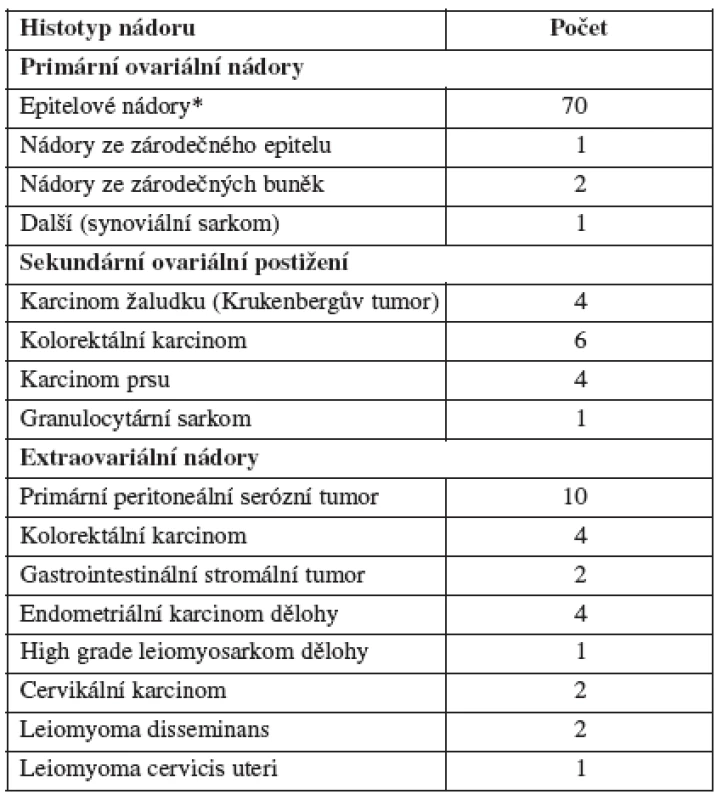
* včetně maligního mezodermálního smíšeného nádoru ve 2 případech Během sledovaného období byly zaznamenány dvě komplikace spojené s tru-cut biopsií. V prvním případě šlo o krvácení z ovariálního nádoru následně po provedení odběru u pacientky s mírnou trombocytopenií, u které byl následně verifikován generalizovaný Krukenbergův nádor. Komplikace si vyžádala minilaparotomii. V druhém případě byla indikována diagnostická laparoskopie bezprostředně po výkonu na základě ultrazvukem patrného krvácení z místa odběru biopsie z pánevního tumoru. Při laparoskopické exploraci nebylo již přítomné žádné krvácení z místa vpichu. V celém souboru nebyly popsány jiné komplikace (bolest, febrilie).
DISKUSE
V naší práci jsme ověřili spolehlivost a bezpečnost minimálně invazivní biopsie silnou jehlou navigované ultrazvukem u pacientek s pokročilým abdominopelvickým nádorem se známkami inoperability, u pacientek ve špatném celkovém stavu a u pacientek s podezřením na recidivu zhoubného nádoru (ZN).
Nejčastěji využívanou metodou k histologické verifikaci pánevního nádoru je v současnosti používána biopsie tenkou jehlou (FNAB – fine needle aspiration biopsy). Tenká jehla má průměr 19 gauge nebo více (≤ 0,9 mm) a nízké riziko komplikací spojených s odběrem biopsie. Tato technika byla poprvé popsána Guthriem v roce 1921 a postupně se zdokonalovala se zapojením moderních zobrazovacích metod, které sloužily k navigaci výkonu [9]. Jde o jednoduchou metodu s možností biopsie téměř ze všech lokalit, bez nutnosti využití celkové anestezie. Hlavní limitací výkonu je získání malého vzorku tkáně s chudým zastoupením buněk a vysokým počtem falešně negativních nálezů. Druhou nevýhodou je omezená možnost doplnění imunohistochemického vyšetření k upřesnění typu nádoru.
Doposud byly publikovány dvě práce, které srovnávaly přesnost biopsie získané tenkou a silnou jehlou. První, Malmströemova práce hodnotila přesnost obou metod u 85 gynekologických nádorů [12]. Výkon byl prováděn vždy v celkové anestezii. Hlavní limitací práce je provádění výkonů bez využití navigace zobrazovací metodou. Tento metodický nedostatek pravděpodobně vysvětluje zjištěné srovnatelné výsledky obou metod. V druhé, Chojniakově práci bylo provedeno 1300 biopsií pod kontrolou CT z hrudníku, břicha, retroperitonea, hlavy a krku [10]. Biopsie byly provedeny tenkou (22 gauge) nebo silnou jehlou (16–18 gauge). Adekvátní vzorky byly získány u biopsie tenkou jehlou v 70–92 %, naopak při odběru silnou jehlou v 93–100 %, specifická diagnóza byla stanovena při biopsii tenkou jehlou v 54,67 % a silnou jehlou v 82–100 %.
Vzhledem k tomu, že k tru-cut biopsii se využívá jehla o větším průměru, lze předpokládat vyšší riziko komplikací, zvláště krvácení. V naší práci nebyl zaznamenán významně vyšší počet komplikací tru-cut biopsie ve srovnání s publikovanými počty komplikací při biopsii tenkou jehlou (0,5–1 %) [13]. Závažnou komplikací bylo hemoperitoneum po biopsii bohatě perfundovaného solidního ovariálního nádoru, které vedlo k neprodlené minilaparotomii. Šlo o pacientku s mírnou trombocytopenií v důsledku infiltrace kostní dřeně generalizovaným nádorem žaludku (Krukenbergův tumor). Obecně lze očekávat krvácení z místa biopsie (nádor) nebo intraabdominálních orgánů a cév. Pokud se však nejedná o pacientku s predispozicí k hemoragickým komplikacím nebo o poraněnou větší cévu, dochází podle našich zkušeností na dostatečně velkém souboru odběrů provedených pod ultrazvukovou kontrolou pouze ke krátkodobému drobnému krvácení, které spontánně během několika minut odezní. K významnému snížení rizika lze využít kromě laboratorní kontroly koagulace (počet trombocytů, INR - International Normalized Ratio, APTT - Activated Partial Thromboplastin Time), vizualizaci cévního zásobení během výkonu dopplerovským mapováním.
Někteří autoři upřednostňují využití otevřené laparoskopie k získání biopsie pokročilých ovariálních nádorů [17]. Anwer srovnával výsledky tru-cut biopsie u 47 pacientů a biopsie při otevřené laparoskopii u 41 pacientů [2]. Skupina indikovaná k tru-cut biopsii byla významně starší (P < 0,01) a pacientky byly v horším celkovém stavu (P < 0,001). Adekvátní vzorek byl pomocí tru-cut biopsie získán bez komplikací u všech žen, ve srovnání s otevřenou laparoskopií, kde se vyskytly 3 komplikace (hematom v místě portu, perforace dělohy, anesteziologická komplikace).
K navigaci biopsie silnou jehlou lze využít ultrazvuku, počítačové tomografie, magnetické rezonance nebo palpační kontroly. Výpočetní tomografie je vhodnou metodou k navigaci abdominálních a retroperitoneálních nádorů, ale u nádorů uložených hluboce v pánvi není transabdominální přístup vhodný; také se nedosahuje vyhovujícího tkáňového rozlišení. Magnetická rezonance se zatím využívá v navigaci tru-cut biopsie výjimečně, jelikož vyžaduje speciální titanové instrumentárium, k dispozici jsou pouze ojedinělé práce, které využívaly MR v navigaci biopsií prsu nebo prostaty [1, 8]. Nespornou výhodou ultrazvuku je absence radiační zátěže a zatěžující přípravy u pacienta. Vzhledem ke krátkému trvání výkonu se s pacientem lépe spolupracuje, výhodou je možnost kombinace přístupů transvaginálních, transrektálních a transabdominálních. Ultrazvuk je běžně dostupnou metodou, zvláště pro gynekologa. Volba přístupu (transvaginální, transrektální, transabdominální) závisí na uložení nádoru a jeho dosažitelnosti (virgo pacientka, zkrácení pochvy po radioterapii a jiné). Transvaginální přístup je optimální cestou k získání biopsie pánevních nádorů. Využití zavaděče upevněného na endovaginální sondu umožňuje přesné cílení a odběr biopsie. V naší studii bylo 67 biopsií (58,3 %) provedeno transvaginálním přístupem a 48 biopsií (41,7 %) transabdominálním přístupem. Dosud byl v gynekologické onkologii transabdominální přístup k získání histologického vzorku podceňován, zvláště pro riziko poranění střeva. Podle našich zkušeností je výhodou ultrazvukového vyšetření dynamické zobrazení střevní motility, které bezpečně odliší střevní kličky od infiltrovaného omenta nebo parietální karcinomatózy a umožní biopsie z těchto míst provést bezpečně.
Potenciálním rizikem tru-cut biopsie je chybný odběr, který by vedl k falešně negativní diagnóze. Navíc vzorky s insuficientním množstvím materiálu nebo špatnou kvalitou neumožňují další imunohistochemické dovyšetření. Obtížné je získání reprezentativního vzorku z převážně cystických nádorů nebo nekrotických nádorů. Optimální výběr viabilní tkáně pro biopsii umožňuje využití dopplerovského vyšetření.
ZÁVĚR
Ultrazvukem navigovaná biopsie silnou jehlou je bezpečná, rychlá a spolehlivá metoda k histologické verifikaci pokročilého nebo recidivujícího abdominopelvického nádoru. Výkon lze provést ambulantně, bez nutnosti celkové anestezie, při minimálním dyskomfortu pro pacienta ve srovnání s laparoskopií nebo laparotomií. Riziko komplikací je nízké a hlavní výhodou je získání adekvátního histologického vzorku s možností následného imunohistochemického vyšetření, které je nezbytným předpokladem pro volbu optimální onkologické léčby.
MUDr. Fischerová Daniela, Ph.D.
Gynekologicko-porodnická klinika VFN a 1. LF UK
Apolinářská 18
128 00 Praha 2
e-mail: daniela.fischerova@seznam.cz
Zdroje
1. Anastasiadis, AG., Lichy, MP., Nagele, U., et al. MRI-guided biopsy of the prostate increases diagnostic performance in men with elevated or increasing PSA levels after previous negative TRUS biopsies. Eur Urol, 2006, 50, p. 738-748.
2. Anwer, A., Naik, R., Athavale, R., et al. Laparoscopic biopsy versus image guided biopsy in diagnosis of suspected ovarian cancer [abstract]. Int J Gynecol Cancer, 2005, 15, 103. Abstract 000187.
3. Fischerová, D. Ultrazvukové vyšetření benigních a maligních ovariálních nádorů. Moderní Gynek Porod, 2007, 16, 4, s. 740-758.
4. Fischerová, D. Diagnostika a staging v onkogynekologii. Moderní Gynek Porod, 2007, 16, 3, s. 517-533.
5. Fischerová, D., Burgetová, A., Seidl, Z., Bělohlávek, O. Diagnostika. In Cibula, D. Onkogynekologie, 1.vyd. Praha: Grada publishing, 2009, s. 101-131.
6. Fischerová, D. The role of ultrasound in prediction of optimal vs suboptimal cytoreductive surgery in advanced ovarian cancers [abstract]. Ultrasound Obstet Gynec, 2008, 32, 3, p. 286. Abstract OC 132.
7. Fischerová, D., Zikán, M. Sonohysterografie a minimálně invazivní výkony pod ultrazvukovou kontrolou. Moderní Gynek Porod, 2007, 16, 4, s. 758-764.
8. Floery, D., Helbich, TH. MRI-guided percutaneous biopsy of breast lesions: materials, techniques, success rate, and management in patients with suspected radiologic-pathologic mismatch. Magn Reson Imaging Clin N Am, 2006, 14, p. 411-425.
9. Guthrie, CG. Gland puncture as a diagnostic measure. Johns Hopkins Hosp Bull, 1921, 366, p. 269.
10. Chojniak, R., Isberner, RK., Viana, LM. et al. Computed tomography guided needle biopsy: experience from 1.300 procedures. Sao Paulo Med J, 2006, 124, p. 10-14.
11. Kurtz, AB., et al. Diagnosis and staging of ovarian cancer: comparative values of doppler and conventional US, CT a MR imaging correlated with surgery and histopathologic analysis – report of the Radiology Diagnostic Oncology Group. Radiology, 1999, 212, p. 19-27.
12. Malmström, H. Fine - needle aspiration cytology versus core biopsies in the evaluation of recurrent gynecologic malignancies. Gynecol Oncol, 1997, 65, p. 69-73.
13. Sauthier, PG., Bélanger, R., Provencher, DM., et al. Clinical value of image-guided fine needle aspiration of retroperitoneal masses and lymph nodes in gynecologic oncology. Gynecol Oncol, 2006, 103, p. 75-80.
14. Tempany, CMC., et al. Staging of advance ovarian cancer: comparison of imaging modalities – report from Radiological Diagnostic Oncology Group. Radiology, 2000, 215, p. 761-767.
15. Timmerman, D., Testa, AC., Bourne, T., et al. Logistic regression model to distinguish between the benign and malignant adnexal mass before surgery: a multicenter study by the International Ovarian Tumor Analysis Group. J Clin Oncol, 2005, 23, p. 8794-8801.
16. Valentin, L., Ameye, L., Jurkovic, D., et al. Which extrauterine pelvic masses are difficult to correctly classify as benign or malignant on the basis of ultrasound findings and is there a way of making a correct diagnosis? UOG, 2006, 27, p. 438-444.
17. Vergote, I., Marquette, S., Amant, F., et al. Port-site metastases after open laparoscopy: a study in 173 patients with advanced ovarian carcinoma. Int J Gynecol Cancer, 2005, 15, p. 776-779.
18. Votrubová, J., Hořejš, J., Sojáková, M., et al. Transrektální ultrasonografie a MR vyšetření rekta I.transrektální ultrasonografie. Čs Radiol, 2002, s. 25-26.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2009 Číslo 5- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Využití transrektálního ultrazvukového vyšetření a magnetické rezonance ve stagingu časných stadií zhoubného nádoru děložního hrdla
- Význam intervenční ultrasonografie v léčbě pokročilých abdomino-pelvických nádorů
- Proteomika a biomarkery karcinomu děložního hrdla
- Současný pohled na duktální karcinom in situ
- Sledování hemokoagulačních změn v průběhu těhotenství žen s opakovaným potrácením v závislosti na podávání nízkomolekulárního heparinu
- Trendy vývoje operačních porodů
- Časné těhotenské ztráty a vrozené trombofilní stavy
- Riziko kouření pro vznik kardiovaskulárních nemocí začíná už před narozením
- Incidence vrozených vad u dětí z jednočetných a dvojčetných gravidit v České republice – aktuální data
- Karcinom děložního těla - raritní varianta vzdálené metastázy
- Akutní hysterektomie pro prolaps velkého submukózního myomu do pochvy
- Využití nehormonálních účinků kombinované hormonální kontracepce u pacientky s recidivujícím výskytem ovariálních cyst – kazuistika
- Osmdesáté narozeninyprofesora MUDr. Jaromíra Boudy, CSc.
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na duktální karcinom in situ
- Akutní hysterektomie pro prolaps velkého submukózního myomu do pochvy
- Karcinom děložního těla - raritní varianta vzdálené metastázy
- Časné těhotenské ztráty a vrozené trombofilní stavy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



