-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Primární rezistence/senzitivita in vitro a klinický průběh onemocnění u pacientek s karcinomem ovaria
Primary drug resistance/sensitivity in vitro and clininical outcome in ovarian cancer patients
Objective:
To assay correlation between primary resistance/sensitivity in vitro by MTT test in solid tumor and ascitic fluid and clininical outcome in ovarian cancer patients.Design:
Prospective study.Setting:
Department of Gynecology and Obstetrics, Medical Faculty Charles University, Prague and University Hospital, Hradec Králové.Methods:
MTT – (3-(4,5 – Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) chemosensitivity assay was performed in 45 samples of ovarian cancer tissue and 26 samples of ascitic fluid in ovarian cancer patients. We studied the in vitro drug resistance profiles of ovarian cancer specimens exposed to cisplatin, carboplatin, paclitaxel, topotecan, gemcitabin, etoposid.Results:
The highest incidence of primary drug resistance in vitro had gemcitabin and carboplatin and the lowest incidence of primary drug resistance had cisplatin and topotecan. Cisplatin had lower incidence of primary drug resistance in vitro than carboplatin. Grade and stage of epithelial ovarian cancer did not correlate to the primary drug resistance/sensitivity in vitro in ovarian cancer patients. The histological subtype of epithelial ovarian cancer correlated to the resistance and sensitivity to chemotherapeutic agents in vitro. Ovarian cancer patients with primary drug resistance to paclitaxel and carboplatin in vitro had more complications during primary chemotherapy, shorter progression free interval and worse prognosis of the disease.Conclusion:
The lowest incidence of primary drug resistance in vitro had cisplatin. Ovarian cancer patients with in vitro resistance to paclitaxel and carboplatin had significantly higher risk for progression of disease when treated with standard platinum-paclitaxel based regimens. The primary resistance/sensitivity assay would contribute to the targeted treatment and better prognosis of ovarian cancer patients.Key words:
ovarian cancer, resistance, sensitivity, chemotherapeutic agent, MTT assay, targeted treatment.
Autori: I. Sedláková 1; J. Tošner 1; M. Červinka 2; K. Brigulová 2; A. Řezáč 1; J. Špaček 1; J. Laco 3; P. Škapinec 1
Pôsobisko autorov: Porodnická a gynekologická klinika LF UK a Fakultní nemocnice Hradec Králové, přednosta doc. MUDr. J. Tošner, CSc. 1; Ústav biologie a lékařské genetiky, Lékařská fakulta Hradec Králové UK v Praze, přednosta prof. MUDr. RNDr. M. Červinka, CSc. 2; Fingerlandův ústav patologie Fakultní nemocnice Hradec Králové, přednosta prof. MUDr. A. Ryška, PhD. 3
Vyšlo v časopise: Ceska Gynekol 2011; 76(3): 184-189
Súhrn
Cíl studie:
Zhodnocení vztahu primární rezistence/senzitivity in vitro ze solidního nádoru a ascitu s klinickým průběhem onemocnění u pacientek s karcinomem ovaria.Typ studie:
Prospektivní klinická studie.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, LF UK a FN Hradec Králové.Metodika:
Pomocí tetrazoliového (MTT) testu jsme stanovili rezistenci/senzitivitu in vitro u 45 vzorků ovariální nádorové tkáně a 26 vzorků ascitu pacientek s karcinomem ovaria. Testovali jsme paklitaxel, cisplatinu, karboplatinu, topotekan, gemcitabin a etoposid.Výsledky:
Nejvyšší zastoupení primární rezistence in vitro jsme zjistili u gemcitabinu a karboplatiny. Nejnižší výskyt primární rezistence in vitro jsme zaznamenali u cisplatiny a topotekanu. Primární rezistence in vitro se vyskytla častěji u cisplatiny než u karboplatiny. Primární rezistence/senzitivita in vitro nekorelovala se stadiem onemocnění a stupněm diferenciace, ale byla ovlivněna histologickým typem ovariálního karcinomu. Pacientky rezistentní in vitro na paklitaxel a karboplatinu měly v průběhu chemoterapie první linie častěji trombocytopenii a recidivu základního onemocnění.Závěr:
Nejnižší primární rezistenci jsme prokázali u cisplatiny. Primární rezistence in vitro korelovala s horším klinickým průběhem onemocnění u pacientek s karcinomem ovaria. Testování primární rezistence/senzitivity by mělo přispět k individualizaci současné standardní primární chemoterapie a následně ke zlepšení prognózy pacientek s karcinomem ovaria.Klíčová slova:
karcinom ovaria, rezistence, senzitivita, cytostatika, MTT test, cílená léčba.ÚVOD
Karcinom ovaria je nejčastější příčinou úmrtí na gynekologické malignity (47 %). Ročně je v ČR příčinou 700 úmrtí. Přestože byla léčbě zhoubných nádorů ovaria věnována velká pozornost, výsledky přežití pacientek se za posledních 20 let zlepšily minimálně, a to spíše v důsledku centralizace péče do center [1]. Chemoterapie první linie (paklitaxel a platinový preparát) podle doporučených standardů vede k léčebné odpovědi přibližně u 75 % pacientek s karcinomem ovaria, nicméně pětileté přežití je pouze 20–25 % pacientek s pokročilým ovariálním karcinomem [15]. Statistika posledních 20 let ukazuje, že chemoterapie dosáhla v současnosti určitého maxima a nová cytostatika neovlivňují přežití nemocných s nejfrekventovanějšími nádory [8]. Léčba v onkologii směřuje k individualizaci léčebných postupů. Jedním z přístupů individualizované chemoterapie je snaha o výběr cytostatik s maximální účinností pro daný nádor za současné eliminace těch, k nimž je nádor vysoce rezistentní, a to na základě hodnocení citlivosti nádorové populace k cytostatikům v ex vivo podmínkách. Nejrozšířenější metodou ex vivo stanovení citlivosti k chemoterapeutikům je tetrazoliový test (jinak zvaný MTT test) [9]. Maligní buněčné populace mohou být vůči chemoterapii rezistentní již v primární léčbě. V tomto případě jde o tzv. přirozenou (primární) rezistenci. Získaná (sekundární) rezistence vzniká až v průběhu cytostatické léčby, kdy se původně citlivé buňky stávají rezistentními a účinnost cytostatické léčby se snižuje [11]. Cílem této práce je zhodnocení vztahu primární rezistence/senzitivity in vitro ze vzorků solidní tkáně či ascitu bez jakékoli předchozí léčby s klinickým průběhem onemocnění u pacientek s karcinomem ovaria.
METODIKA
Vzorek nádorové ovariální tkáně či ascitu odebraného peroperačně na Gynekologicko-porodnické klinice Fakultní nemocnice v Hradci Králové byl neprodleně (max. do 1 hodiny) zpracován v Ústavu lékařské biologie a genetiky Lékařské fakulty v Hradci Králové. Suspenzi nádorových buněk jsme získali z dodaných vzorků použitím enzymatického trávení a gradientovou centrifugací na hustotním gradientu Ficoll-Metatrizoát. Na začátku studie byl ověřován způsob enzymatického rozvolňování a optimální složení kultivačního média. Buňky byly dvakrát promyty v RPMI 1640 [2mM glutamin, bikarbonát sodný, penicilin (100 U/ml) a streptomycin (100 mg/ml)]. Po druhém promytí byla buněčná paleta suspendována v kultivačním médiu [RPMI 1640 s 2mM glutaminem bikarbonátem sodným, penicilinem (100 U/ml) a streptomycinem (100 mg/ml), 15% fetální hovězí sérum, 5 mg/ml inzulinu a 5 mg/ml transferinu] v konečné koncentraci 1–2 miliony buněk na mililitr. Na začátku studie byla také ověřována heterogenita buněčné populace. Buňky byly nasazeny 6 hodin v kultivační lahvi. Po 6 hodinách bylo médium odsáto, neadherované buňky byly shromážděny centrifugací při 500 ot/min a využity pro pararelní stanovení. Při hodnocení senzitivity bylo použito třídenního MTT (WST-1) testu. Buněčná suspenze byla pipetována do 96jamkových destiček v koncentraci 6000–10 000 buněk na jamku a ponechána přes noc v inkubátoru. Druhý den bylo k buňkám přidáno médium s naředěným cytostatikem. Rezistence/senzitivita byla testována u cisplatiny, paklitaxelu, karboplatiny, topotekanu, gemcitabinu a etoposidu. Aby bylo možné stanovit inhibiční koncentraci IC50, byly nádorové buňky vystaveny působení každého cytostatika v šesti různých koncentracích po dobu tří dnů při 37 °C, 5% CO2 a pokusy byly nejméně dvakrát opakovány. Kontrolní nádorové buňky byly kultivovány bez použití cytostatik. Na závěr kultivace bylo ke každé jamce přidáno 100 mikrolitrů WST-1 rozpuštěného v kultivačním médiu a bylo inkubováno další dvě hodiny. V případě živých buněk je tetrazoliová sůl redukována mitochondriálními dehydrogenázami na formazan. Tato kolorimetrická reakce byla sledována fotometrickým měřením při 450 nm s referenční vlnovou délkou 690 nm. Přežívání nádorových buněk (tumor cell survival, TCS) jsme vypočítali pomocí následujícího vzorce:
absorbance v jamkách s cytostatiky
TCS = -------------------------------------------- - x 100
absorbance v kontrolních jamkáchTCS50 (EC50) hodnota je koncentrace daného cytostatika, která je letální pro 50 % nádorových buněk a byla vypočítána ze získaných křivek dávkové závislosti (tabulka 1).
Tab. 1. Hodnoty EC 50 pro jednotlivá cytostatika 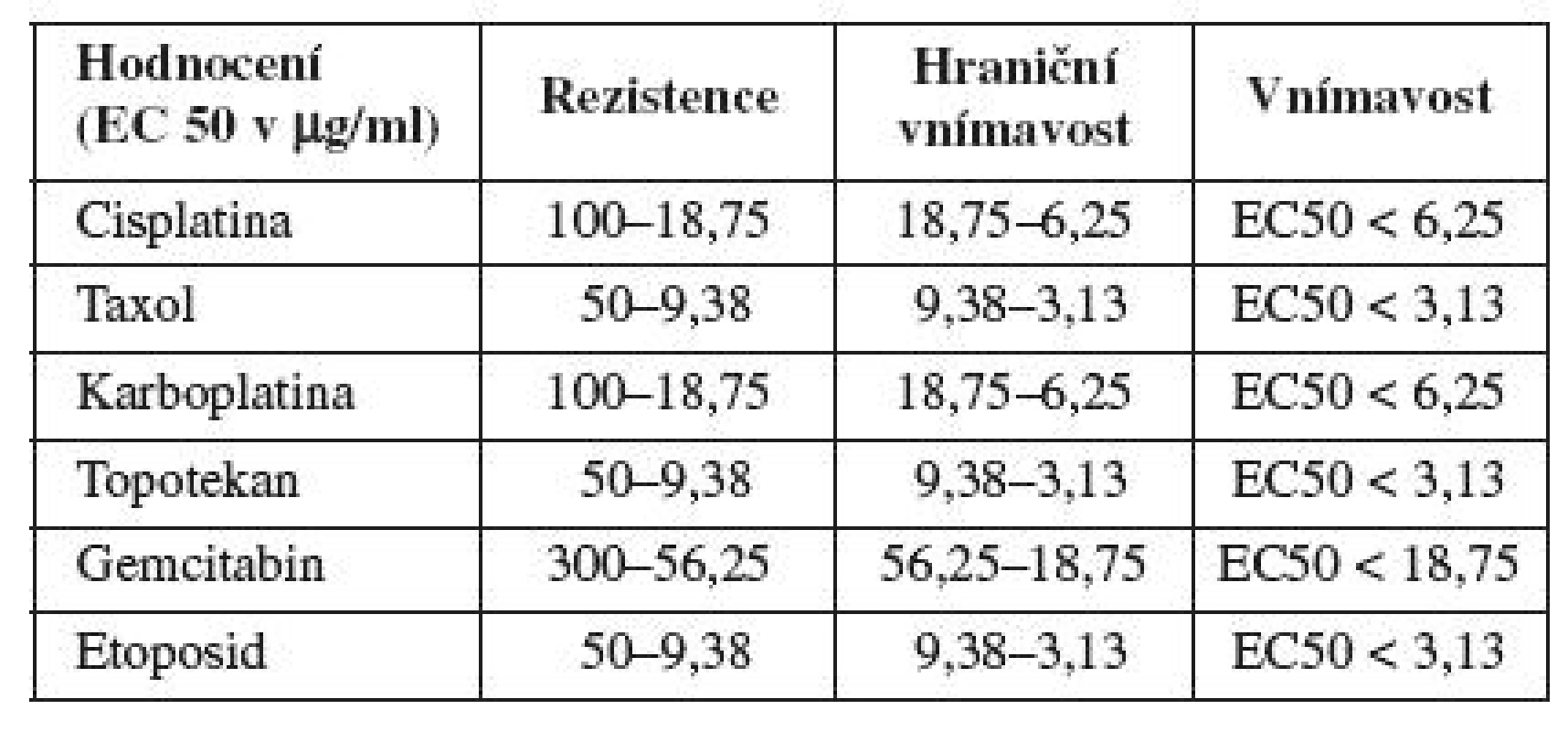
SOUBOR PACIENTEK
Primární rezistenci/senzitivitu in vitro pomocí MTT testu jsme stanovili celkem u 71 vzorků v letech 2006–2010 u pacientek s karcinomem ovaria operovaných na Porodnické a gynekologické klinice FNHK. Z toho u 45 vzorků ovariální nádorové tkáně a 26 vzorků ascitu pacientek s epiteliálním ovariálním karcinomem. U 7 pacientek jsme měli odebranou ovariální nádorovou tkáň a zároveň i ascites při primární operaci.
Bylo to 8 pacientek se stadiem I, 1 pacientka se stadiem II, 45 pacientek se stadiem III a 10 pacientek se stadiem IV. Dobře diferencovaný ovariální karcinom v tomto souboru mělo 6 pacientek, 14 pacientek středně diferencovaný ovariální karcinom a 41 pacientek špatně diferencovaný karcinom ovaria. U 3 pacientek nebyl stupeň diferenciace určen. Serózní ovariální karcinom mělo 45 žen, mucinózní ovariální karcinom 5 pacientek, endometroidní ovariální karcinom mělo 8 pacientek, světlobuněčný ovariální karcinom 2 pacientky a nediferencovaný ovariální karcinom měly 2 pacientky. Pacientky s jinými histologickými typy ovariálního karcinomu ani borderline tumory jsme do této práce nezahrnuli (tab. 2).
Tab. 2. Charakteristika souboru pacientek 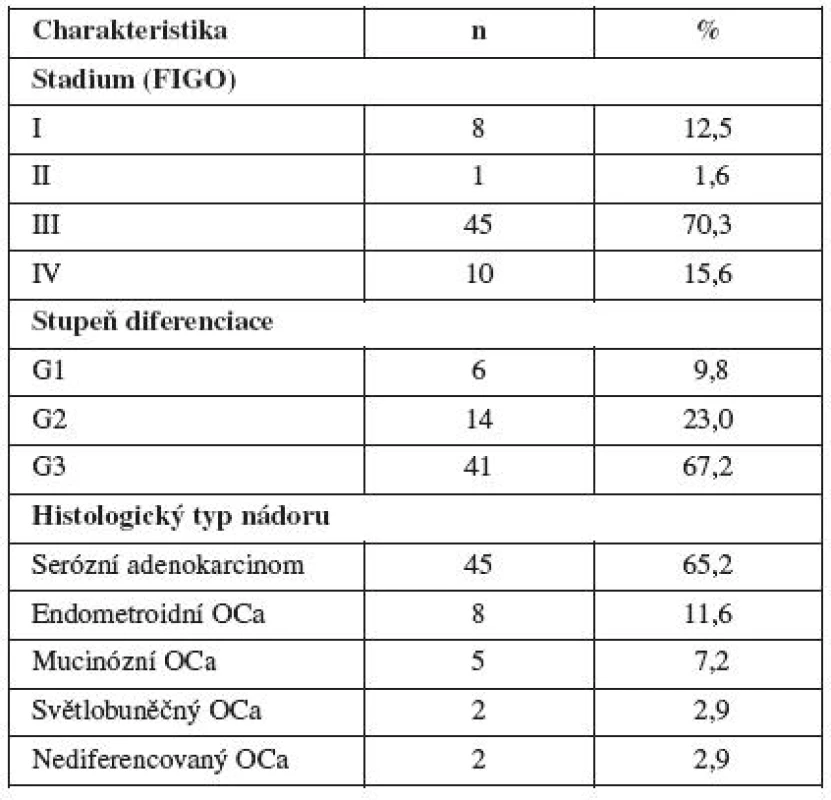
Odběry vzorků na stanovení MTT testu byly odebírány během primární operace pro karcinom ovaria u pacientek, které před danou operací a testováním MTT testem neprodělaly chemoterapii ani žádnou jinou léčbu pro ovariální karcinom. Šlo o pacientky s nově zjištěným karcinomem ovaria. Žádná z těchto pacientek nebyla v minulosti léčena pro jiný karcinom. Všechny pacientky měly před operací podepsaný informovaný souhlas s odběrem vzorků tkáně – schválený Etickou komisí FNHK. Průměrný věk testovaných pacientek byl 63 let. Všechny pacientky z tohoto souboru dostaly podle současných doporučených standardů v rámci chemoterapie první linie kombinaci paklitaxelu a karboplatiny.
VÝSLEDKY
Při vynechání etoposidu, který se v současnosti užívá u ovariálního karcinomu zcela výjimečně, jsme nejvyšší zastoupení primární rezistence in vitro zjistili u gemcitabinu a karboplatiny. Paklitaxel byl uprostřed a nejnižší výskyt rezistence in vitro jsme zaznamenali u cisplatiny a topotekanu. Prokázali jsme častější výskyt primární rezistence in vitro u karboplatiny v porovnání s cisplatinou (tab. 3).
Tab. 3. Výsledky testování primární rezistence/senzitivity MTT testem in vitro u vybraných cytostatik 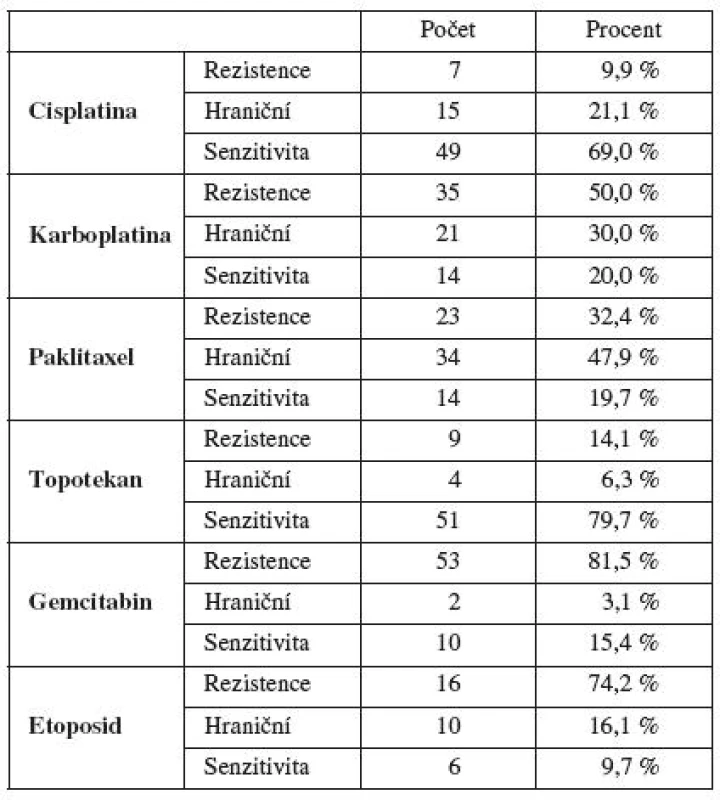
Nezaznamenali jsme významnější vztah mezi primární rezistencí/senzitivitou in vitro a stupněm diferenciace. Stejně tak jsme v tomto souboru neprokázali vztah mezi primární rezistencí/senzitivitou in vitro a stadiem onemocnění. Pro získání většího souboru pacientek jsme sloučili pacientky se stadiem I+II (označeno jako časné onemocnění) a pacientky s stadiem III+IV (pokročilé onemocnění). Ani při tomto rozdělení jsme nezaznamenali vztah mezi pokročilostí onemocnění a primární rezistencí/senzitivitou in vitro stanovenou MTT testem.
Zajímavá data jsme získali porovnáním primární rezistence/senzitivity in vitro na jednotlivá cytostatika a histologickým typem ovariálního karcinomu. Pacientky se serózním ovariálním karcinomem byly častěji senzitivní in vitro na cisplatinu a rezistentní na cisplatinu byly minimálně. Stejně tak pacientky s mucinózním ovariálním karcinomem. U endometroidního ovariálního karcinomu jsme prokázali stoprocentní primární senzitivitu na cisplatinu a žádnou rezistenci na toto cytostatikum. Pacientky se serózním ovariálním karcinomem byly na karboplatinu častěji rezistentní než senzitivní. Při zhodnocení primární rezistence/senzitivity in vitro na ostatní testovaná cytostatika jsme nezaznamenali výraznější rozdíly v závislosti na histologickém typu ovariálního karcinomu (tab. 4).
Tab. 4. Primární rezistence/senzitivita in vitro stanovená MTT testem a histologický typ ovariálního karcinomu 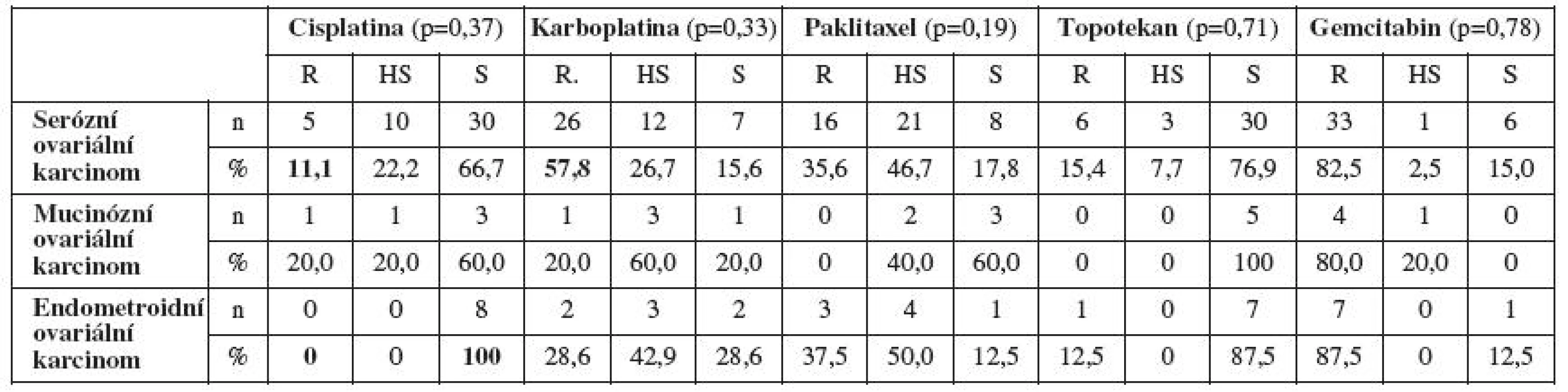
R – rezistence, HS – hraniční senzitivita, S – senzitivita V další části jsme sledovali vztah primární rezistence/senzitivity in vitro již pouze na paklitaxel a karboplatinu a její vliv na klinický průběh onemocnění, protože všechny pacientky ze souboru dostaly v rámci chemoterapie první linie právě paklitaxel a karboplatinu. Pacientky primárně rezistentní na paklitaxel a karboplatinu in vitro měly častěji při podání standardní chemoterapie první linie ve složení paklitaxel a karboplatina trombocytopenii (méně než 80x109/l) (tab. 5). Prokázali jsme častější výskyt recidivy základního onemocnění u pacientek s in vitro prokázanou primární rezistencí na paklitaxel a karboplatinu (tab. 6). Testování rezistence/senzitivity in vitro jsme začali za podpory grantu IGA MZ ČR v roce 2006. Dostatečné „follow-up“ (min. 12 měsíců od ukončení primární léčby), a tedy možnost zhodnocení výskytu recidivy základního onemocnění máme v současnosti u 37 pacientek. U těchto testovaných pacientek s dostatečným „follow-up“ pro stanovení výskytu recidivy a délky bezpříznakového období (DFI, disease free interval) máme zatím první výsledky, které jsou podstatným ukazatelem pro korelaci výsledků primární rezistence/senzitivity in vitro s klinickou odpovědí pacientek na danou léčbu. Ze 13 pacientek primárně rezistentních in vitro na karboplatinu mělo do této doby recidivu 8 pacientek (61,5 %). Z 12 pacientek rezistentních in vitro na paklitaxel měly 4 pacientky recidivu základního onemocnění (33,3 %), 4 pacientky vůbec nedosáhly remise onemocnění po skončení chemoterapie první linie (33,3 %) a pouze 4 pacientky (33,3 %) ze skupiny rezistentních in vitro na paklitaxel v našem souboru do této doby recidivu zatím neměly. Z těchto předběžných výsledků vyplývá, že většina pacientek rezistentních in vitro na paklitaxel neměla úspěšnou klinickou odpověď na současnou standardy doporučovanou primární léčbu v kombinaci paklitaxel a karboplatina. Tedy korelace mezi rezistencí na daná cytostatika stanovenou in vitro a horším průběhem onemocnění. Alarmující je také průměrná délka bezpříznakového období a celkové doby přežití (interval přežití – IP) u pacientek primárně rezistentních in vitro na paklitaxel a karboplatinu (tab. 7).
Tab. 5. Výskyt trombocytopenie v průběhu chemoterapie první linie v závislosti na primární rezistenci/senzitivitě in vitro na karboplatinu a paklitaxel 
Tab. 6. Výskyt recidivy základního onemocnění v závislosti na primární rezistenci/senzitivitě in vitro na karboplatinu a paklitaxel 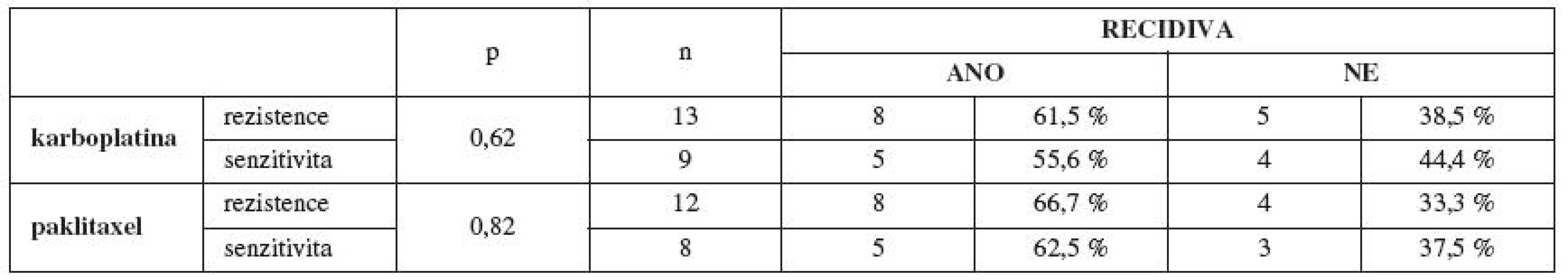
Tab. 7. Průměrná délka bezpříznakového období a doby přežití u pacientek rezistentních in vitro na karboplatinu a paklitaxel 
DFI (disease free interval) bezpříznakové období¨; IP – interval přežití DISKUSE
V této práci jsme zpracovali pouze primární odběry odebrané při primární operaci při nově diagnostikovaném karcinomu ovaria u pacientek bez jakékoli předchozí léčby. Domníváme se, že pro stanovení korelace s klinickým průběhem onemocnění je nejvhodnější právě stanovení primární rezistence/senzitivity in vitro u primárních odběrů.
Z klinických parametrů ovariálního karcinomu jsme zaznamenali nejvýznamnější korelaci primární rezistence/senzitivity in vitro s histologickým typem nádoru. Prokázali jsme výrazný rozdíl výskytu rezistence u cisplatiny a karboplatiny. I když GOG 158 prokázala stejný efekt karboplatiny a cisplatiny u ovariálního karcinomu [12], byly již publikovány práce, které prokázaly větší účinnost cisplatiny a podstatně nižší výskyt rezistence u cisplatiny v porovnání s karboplatinou [2, 4]. V naší práci jsme již dříve prokázali podstatně nižší výskyt rezistence u cisplatiny v porovnání s karboplatinou u pacientek s karcinomem ovaria [13, 17]. Vzhledem k tomu, že ze dvou užívaných cytostatik v první linii chemoterapie hraje platinový preparát mnohem důležitější roli než paklitaxel (ICON-3, GOG 132) [10, 16], mělo by být zohledněno, jaký platinový preparát je pro konkrétní pacientku přínosnější.
Naše výsledky potvrzují hypotézu korelace mezi primární rezistencí/senzitivitou a histologickým typem nádoru. Už nyní bychom mohli zohlednit při volbě primární chemoterapie alespoň tuto informaci, kterou známe u každé pacientky několik dnů po operaci bez dalších finančních výdajů. A dále pak pokračovat na rozdělení do dalších případných podskupin podle jednotlivých morfologických charakteristik včetně rezistence ovariálních karcinomů. I na IGCS 2010 (13th Biennial Meeting of the International Gynecologic Cancer Society) v Praze opakovaně zaznělo, že původ i chování jednotlivých histologických typů ovariálního karcinomu včetně reakce na primární chemoterapii jsou zcela odlišné. Prof. Kurman zde prezentoval tabulku jednotlivých histologických typů, kde reakce na chemoterapii první linie byla zcela odlišná. Nejvyšší citlivost na současnou standardní chemoterapii první linie (paklitaxel + karboplatina) vykazoval „high grade“ serózní ovariální karcinom asi kolem 70 % a ostatní histologické typy včetně „low grade“ serózního karcinomu ovaria pouze kolem 15 %.
Zajímavé bylo zhodnocení výskytu trombocytopenie u pacientek s primární rezistencí in vitro na paklitaxel a karboplatinu. Prokázali jsme výrazně vyšší výskyt trombocytopenie v průběhu podávání chemoterapie první linie v porovnání s pacientkami bez zjištěné rezistence in vitro na tato cytostatika. Podání chemoterapie „naslepo“ tak, jak ji v současné době běžně podáváme, může vést k výraznějším nežádoucím účinkům u pacientek rezistentních in vitro na danou léčbu. Je to další faktor projevující se v klinickém průběhu onemocnění, který koreluje s primární rezistencí/senzitivitou stanovenou in vitro. Tento fakt podporuje důležitost výběru pacientek primárně rezistentních na daná cytostatika ještě před zahájením chemoterapie první linie a zvolení jiného typu primární léčby u těchto žen. Je-li daný nádor vůči podávanému cytostatiku rezistentní, pak bez ohledu na statistické výsledky randomizovaných studií nelze u daného jednotlivce očekávat léčebný efekt. Průběh onemocnění může být i zhoršen oslabením metabolismu a přirozených obranných mechanismů, případně vznikem dalších mutací nádoru [14]. Pacientky, které dostanou cytostatika, na něž je jejich nádor rezistentní in vitro, progredují mnohem rychleji a mají kratší dobu přežití [3, 6, 7]. Tomu nasvědčují i další námi získaná data. Zhodnocení výskytu recidivy ve vztahu k primární rezistenci/senzitivitě in vitro. Jde zatím o předběžná, nicméně velmi zajímavá a zásadní data. Z těchto výsledků vyplývá korelace mezi rezistencí in vitro na podávanou chemoterapii první linie a špatnou klinickou odpovědí pacientek s karcinomem ovaria na současnou standardní chemoterapii první linie. Holloway et al. publikovali, že ženy léčené cytostatiky spadajícími do skupiny extrémní lékové rezistence při testování in vitro měly signifikantně kratší přežití ve srovnání s ženami, které dostaly cytostatika s nízkou rezistencí zjištěnou in vitro. Tato studie 119 vzorků epiteliálních ovariálních karcinomů nalezla extrémní lékovou rezistenci v 89 % případů [7].
Stanovení rezistence in vitro se ukazuje směrodatnější v porovnání se stanovením senzitivity in vitro [5]. Použitím MTT testu ke stanovení rezistence/senzitivity in vitro by se mohla vybrat skupina pacientek primárně rezistentních in vitro na dané cytostatikum. Tyto pacientky by pak nedostávaly chemoterapii, která je pro ně neúčinná. Prospektivních prací sledujících korelaci primární rezistence/senzitivity in vitro stanovené na jednom pracovišti s klinickým průběhem onemocnění není celosvětově mnoho. V naprosté většině je rezistence/senzitivita in vitro zkoumána na vyselektovaných buněčných liniích. Je však možné, že primární rezistence/senzitivita in vitro stanovená ihned ze vzorků odebraných peroperačně, má své specifické vlastnosti, které nelze nasimulovat na vyselektovaných buněčných liniích. A i když stanovení rezistence/senzitivity in vitro z konkrétních peroperačních vzorků získaných od jednotlivých pacientek je podstatně náročnější než na vyselektovaných buněčných liniích ovariálních nádorových buněk, pro správné zhodnocení klinického významu testování rezistence/senzitivity in vitro je třeba právě těchto klinických prací, protože rezistence nádorových buněk na protinádorovu léčbu vzniká mechanismy komplexní povahy a je vázána na více faktorů.
ZÁVĚR
Nejnižší primární rezistenci a nejvyšší primární senzitivitu in vitro jsme prokázali u cisplatiny. Primární rezistence stanovená in vitro korelovala s horším klinickým průběhem onemocnění u pacientek s karcinomem ovaria. Testování primární rezistence/senzitivity in vitro by mělo přispět ke změně současné standardní primární chemoterapie ovariálního karcinomu, k její individualizaci a následně zlepšení prognózy pacientek s karcinomem ovaria.
Tato práce vznikla za podpory grantu IGA MZ NS 9737-3.
MUDr. Iva Sedláková, Ph.D.
Porodnická a gynekologická klinika
Sokolská 58
500 05 Hradec Králové
sedlakiva@seznam.cz
Zdroje
1. Cibula, D., Petruželka, L., a kol. Onkogynekologie. Praha: Grada Publishing, 2009, 508 s.
2. Cloven, NG., Kyshtoobayeva, A., Burger, AR., et al. In vitro chemoresistance and biomarker profiles are unique for histologic subtypes of epithelial ovarian cancer. Gynecol Oncol, 2004, 92, p. 160-166.
3. Cortazar, P., Johnson, BE. Review of the efficacy of individualized chemotherapy selected by in vitro drug senzitivity testing for patients with cancer. J Clin Oncol, 1999, 17, p. 1625-1631.
4. Cwiertka, K., Hajduch, M., Pilka, R., et al. Chemoterapie ovariálního karcinomu s ohledem na stanovení in vitro chemosenzitivity – vybrané kasuistiky. Klin Onkol, 2000, 13, s. 58-59.
5. Fruehauf, PJ., Alberts, DS. In vitro drug resistance versus chemosenzitivity: two sides of different coins. J Clin Oncol, 2005, 23, p. 3641-3643.
6. Freuhauf, JP., Maneta, A. Use of the extreme drug resistance assay to evaluate mechanisms of resistance in ovarian cancer: taxol resistance and MDR-1 expression. Contrib Gynaecol Obstet, 1994, 19, p. 39-52.
7. Holloway, RW., Mehta, RS., Finkler, NJ., et al. Association between in vitro platinum resistance in the EDR assay and clinical outcomes for ovarian cancer patients. Gynecol Oncol, 2002, 87, p. 8-16.
8. Chumchalová, J., Kovařík, J. Metodiky testování chemosenzitivity/chemorezistence nádorů in vitro. Klin Onkol, 2000, 13, s. 18-21.
9. Michalová, E., Poprach, A., Němečková, I., et al. Predikce citlivosti nádorových buněk k chemoterapeutikům ex vivo – úskalí a limitace vlastní metody. Klin Onkol, 2008, 21, s. 93-97.
10. Muggia, FM., Braly, PS., Brady, MF., et al. Phase III randomized study of cisplatin versus paclitaxel in patients with suboptimal stage III or IV ovarian cancer. A Gynecologic Oncology Group study. J Clin Oncol, 2000, 18, p. 106-115.
11. Nosková, V., Hajduch, M., Mihál, V., Cwiertka, K. Mechanismy mnohočetné lékové rezistence a jejich význam pro klinickou praxi I. typická MDR. Klin Onkol, 2000, 13, s. 4-9.
12. Ozols, FR. Paclitaxel (Taxol)/Carboplatin combination chemotherapy in the treatment of advanced ovarian cancer. Seminars in Oncology, 2000, 3, s. 3-7.
13. Sedláková, I., Tošner, J., Řezáč, A., et al. Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria. Čes Gynek, 2010, 75, s. 186-191.
14. Talač, R., Žaloudík, J., Hajdúch, M., et al. Hodnocení lékové rezistence in vitro a její klinické implikace. Klin Onkol, 2000, 13, s. 2-3.
15. Tewari, SK., Mehta, SR., Burger, AR., et al. Conservation of in vitro drug resistance patterns in epithelial ovarian carcinoma. Gynecol Oncol, 2005, 98, s. 360-368.
16. The ICON Group: Paclitaxel plus carboplatin versus standard chemotherapy with either single agent carboplatin or cyclophosphamide, doxorubicin and cisplatin in women with ovarian cancer. Lancet, 2002, 360, p. 505-515.
17. Tošner, J., Červinka, M., Sedláková, I., et al. Testování účinnosti cytostatik s využitím zmražených buněk karcinomu ovaria. Slov Gynek Porod, 2010, 17, s. 121-124.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Editorial
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2011 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Editorial
- Dědičná dispozice ke vzniku karcinomu endometria
- Úloha hysterektomie v managementu prekanceróz děložního hrdla
- Primární rezistence/senzitivita in vitro a klinický průběh onemocnění u pacientek s karcinomem ovaria
- Prognostický význam vybraných molekulárně-genetických imunohistochemických markerů a DNA ploidity u karcinomu endometria
- Psychosociální faktory ovlivňující spokojenost rodiček s perinatální péčí
- Spontánní předčasný porod u rodičky v umělém spánku na ECMO při závažné formě infekce H1N1
-
Guideline gynekologických zhoubných nádorů 2010
Primární chirurgická léčba zhoubných nádorů endometria - Profylaktické operace u žen s hereditární dispozicí ke vzniku gynekologických malignit
- Biofyzikálne metódy diagnostiky intrapartálnej fetálnej hypoxie
- Pokročilý věk matky jako indikace k provedení amniocentézy – zhodnocení karyotypu u 418 vyšetřených plodů
- Vysoká rezistence Streptococcus agalactiae na antibiotickou terapii druhé linie u časných a pozdních forem infekcí novorozence
- Optimalizace vyšetření protilátek proti trombocytům u těhotných a žen po porodu
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vysoká rezistence Streptococcus agalactiae na antibiotickou terapii druhé linie u časných a pozdních forem infekcí novorozence
- Optimalizace vyšetření protilátek proti trombocytům u těhotných a žen po porodu
- Biofyzikálne metódy diagnostiky intrapartálnej fetálnej hypoxie
- Úloha hysterektomie v managementu prekanceróz děložního hrdla
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



