-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prognostický význam vybraných molekulárně-genetických imunohistochemických markerů a DNA ploidity u karcinomu endometria
Prognostic importance of selected molecular genetic immunohistochemical markers and DNA ploidy in endometrial cancer
Objective:
The aim of the study was the analysis of the new molecular genetic immunomarkers (p53, c‑erbB-2, Ki 67, bcl-2) hormonal receptors (ER, PR) and ploidy disturbances and their relation to the most important prognostic factors for endometrial cancer.Design:
Prospective study.Setting:
Dept. of Gynaecology and Obsterics, Laboratory of Experimental Medicine, Institute of Pathology, Institute of Molecular and Transplational Medicine, Medical Faculty and University Hospital, Olomouc.Methods:
The study group consisted of 88 endometrial cancer patients. The biopsies of the tumours obtained at operations were routinely histopathologically examined. Subsequently, the immunohistochemical tumormarkers were determined. The same biopsies were examined by microdissection and flow cytometric ploidy analysis and karyotyping. The findings were compared with the most important prognostic factors for endometrial cancer, mainly with clinical stage of the disease, grade and histopathological type.Results:
Aneuploidy was found in 71% in the group of poorly differentiated endometrial cancers (G3) in contrast to 47% in the group of G1 and G2 tumours. High expression of p53, Ki 67, c-erbB-2 and low rate of sex hormone receptors was found in the prognostically unfavourable group (G3).Conclusions:
Aneuploidy seems to be an important prognostical factor for endometrial cancer patients. Identification of p53, Ki 67, c-erbB-2, ER a PR is a useful tool to specify a group of prognostically unfavourable patients.Key words:
endometrial cancer, DNA ploidy, molecular immunomarkers, prognostic factors.
Autori: Milan Kudela 1
; R. Pilka 1; M. Lubušký 1; P. Hejtmánek 1; P. Džubák 2
; S. Brychtová 3
Pôsobisko autorov: Porodnicko-gynekologická klinika LF UP a FN Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D. 1; Laboratoř experimentální medicíny, Ústav molekulární a transplantační medicíny, LF UP a FN Olomouc 2; Ústav patologie LF UP a FN Olomouc 3
Vyšlo v časopise: Ceska Gynekol 2011; 76(3): 194-199
Súhrn
Cíl studie:
Studium nových vybraných molekulárně genetických imunomarkerů (p53, c-erbB-2, Ki 67, bcl-2), hormonálních receptorů (ER, PR) a změn v buněčné ploiditě nádorových buněk endometriálního karcinomu a jejich komparace s hlavními prognostickými faktory.Typ studie:
Prospektivní studie.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF UP a FN Olomouc, Laboratoř experimentální medicíny, Ústav molekulární a transplantační medicíny LF UP a FN Olomouc, Ústav patologie LF UP a FN Olomouc.Metodika:
Studovaný soubor tvoří 88 nemocných operovaných primárně pro karcinom endometria. Peroperačně získaný bioptický materiál z tumoru byl klasicky histopatologicky zpracován a následně vyšetřen imunohistochemicky ke stanovení vybraných molekulárních markerů. Stejný materiál byl po mikrodisekci nádorové tkáně vyšetřen průtokovou cytometrií ke stanovení změn v buněčné ploiditě. Výsledky byly komparovány s hlavními prognostickými faktory, zejména klinickým stadiem onemocnění, gradingem a histopatologickým typem nádoru.Výsledky:
U 71 % biologicky nezralých endometriálních tumorů (G3) se špatnou prognózou jsme prokázali přítomnost aneuploidních karyotypů, zatímco u nádorů G1 a G2 jen ve 47 %. Ze studovaných imunomarkerů měly nejvyšší expresi u prognosticky nepříznivých případů p53, Ki 67 a c-erbB-2. U stejné skupiny tumorů jsme prokázali přítomnost steroidních receptorů jen v 58 %.Závěr:
Stanovení DNA ploidity je významným prognostickým faktorem. Ze sledovaných histopatologických imunomarkerů jsme prokázali zvýšenou expresi p53, Ki 67 a c-erbB-2 u prognosticky nepříznivých tumorů. Snížená přítomnost steroidních receptorů pak byla prokázána u stejné skupiny nádorů.Klíčová slova:
karcinom endometria, DNA ploidita, molekulární imunomarkery, prognostické faktory.ÚVOD
Karcinom endometria je po karcinomu prsu v současné době nejčastějším ze zhoubných nádorů postihujících reprodukční orgány žen. Trvalý nárůst incidence zejména v ekonomicky rozvinutých zemích je evidentně podmíněn prohlubujícím se komplexním vlivem civilizačních faktorů, a to zejména prodlužujícím se věkem, reprodukčním chováním a způsobem života současné populace. Přes relativně nízkou mortalitu umírá v České republice v důsledku vyšší incidence na toto onemocnění téměř stejný počet žen jako na karcinom děložního hrdla.
Podmínkou dobrých terapeutických výsledků je adekvátní, komplexní a včasně zahájená léčba. Stejně jako při léčbě jiných zhoubných tumorů adekvátní znamená, že léčba má přinést maximální terapeutický efekt, ale současně musí představovat i minimální zátěž pro pacienta. Jak undertreatment, tak overtreatment pacienta poškozují.
Pro zvolení správné terapeutické strategie je nutno brát v úvahu celou řadu faktorů, mezi nimiž jsou zejména významné faktory prognostické. I když nejdůležitějšími prognostickými faktory jsou stále klinicko-patologické parametry, zejména stadium onemocnění, grade a histopatologický typ nádoru, existuje celá řada dalších faktorů, které mohou ovlivňovat a predikovat průběh onemocnění, a proto jsou důležité pro stanovení rozsahu operačního výkonu a případně nutnosti následné radiační nebo jiné adjuvantní terapie. Mezi takto významné prognostické faktory patří i molekulární imunomarkery a DNA ploidita nádorových buněk.
Výzkum v oblasti molekulárně genetických biomarkerů zažívá v současné době v celé onkologii mohutný rozmach a platí to i pro obor onkogynekologie. Nové biomarkery jsou významné nejen po stránce teoretické, neboť přispívají k zodpovězení základních otázek průběhu karcinogeneze, ale promítají se i do vlastní klinické medicíny. Dnes je již zřejmé, že iniciace nádorového procesu se odehrává v důsledku změn v genetické informaci nenádorových buněk. Hlavní událostí iniciální fáze karcinogeneze je aktivace proonkogenů, inaktivace tumor supresorových genů, mikrosatelitová nestabilita a celá řada dalších geneticky podmíněných změn. V oblasti chromozomálního genomu dochází velmi často k významným změnám, a to nejen na úrovni jednoho nukleotidu, ale také na úrovni celých chromozomů, což je často dokumentováno ztrátou heterozygocie a aneuploidií, v některých případech i polyploidií. Rozsah a charakter těchto poruch se pak přímo promítá do biologického chování tumoru, a tím determinuje i klinický průběh maligního nádorového onemocnění.
Cílem naší studie bylo sledovat vybrané imunomarkery (p53, c-erbB-2, Ki 67, bcl-2) hormonální receptory (ER,PR) a změny v buněčné ploiditě nádorových buněk a komparovat je s nejdůležitějšími prognostickými faktory, zejména s klinickým stadiem onemocnění, gradem tumoru a případně histopatologickým typem nádoru.
MATERIÁL A METODIKA
Klinický soubor tvoří 88 pacientek s histopatologicky prokázaným karcinomem endometria. Po stanovení diagnózy, obvykle na podkladě vyšetření bioptického materiálu získaného při diagnostické hysteroskopii nebo probatorní kyretáži, byly pacientky indikovány k operační léčbě, nejčastěji hysterektomii s oboustrannou adnexetomií doplněnou v indikovaných případech lymfadenektomií v oblasti pánevní a paraaortální. Operační výkon byl prováděn z abdominálního, vaginálního, laparoskopického nebo kombinovaného přístupu.
Vzorky peroperačně získaného tumoru byly standardně zpracovány po 24hodinové fixaci 10% formaldehydem, zality do parafinových bločků s následným barvením pro světelnou mikroskopii a stanovení histopatologické diagnózy. Po potvrzení diagnózy endometriálního karcinomu byly vzorky s dostatečným množstvím dobře zachované nádorové struktury zpracovány v tkáňových řezech o síle 5–8 μm na podložních sklech potažených Vectabondem (Vector). Pro detekci jednotlivých markerů byla použita standardní nepřímá imunohistochemická technika se souborem králičích nebo myších protilátek pro p53, c-erbB-2, Ki 67, bcl 2, PR a ER. Kvantifikace pozitivity značení byla vyjadřována v procentech. Jako hranice pozitivity pro p53, c-erbB-2, Ki 67 a bcl-2 byla stanovena hodnota mediánu. Jako p53 a bcl-2 pozitivní byla hodnoceny vzorky s jaderným barvením 20 % nádorových buněk a více, pro Ki-67 pak pozitivita barvení nad 40 %. Vzorky s membránovou pozitivitou c erbB-2 byly hodnoceny jako pozitivní s více než 10 %. Hranice pozitivity pro ER a PR byla zvolena na 5 %.
DNA ploidita byla stanovena opět ze vzorků mikrodisekované parafinizované nádorové tkáně metodou průtokové cytometrie. Barvená jádra byla měřena na průtokovém cytometru FACS Calibur a získaná data analyzována pomocí programu ModFit-LT. DNA histogramy byly klasifikovány jako diploidní nebo aneuploidní vzhledem k jejich obsahu DNA v oblasti G0/Gl peaku. Nálezy byly srovnávány s vnitřním standardem v podobě jader izolovaných z normálních diploidních buněk. Pokud to kvalita vzorku dovolila, byly hodnoceny i proliferující buňky v a G2/M fázi buněčného cyklu.
Klinický soubor pacientek jsme rozdělili podle chirurgického stagingu na skupinu nemocných s dobrou a špatnou prognózou. Do skupiny 59 nemocných s dobrou prognózou byly zařazeny pacientky s FIGO klasifikací I. Do skupiny se špatnou prognózou pak 29 nemocných s pokročilým onemocněním FIGO II.-IV.
Podle stupně biologické zralosti tumoru jsme nemocné rozdělili do skupiny 74 prognosticky příznivých nemocných (G1 a G2) a skupiny 14 prognosticky nepříznivých (G3).
Po stránce histopatologické klasifikace byl nádor stanoven jako endometroidní karcinom u 84 nemocných, u 4 šlo o serózně papilární, resp. smíšené typy nádorů. Vzhledem k malému zastoupení těchto prognosticky nepříznivých typů jsme je samostatně nevyhodnocovali.
Stanovením karyotypu byly tumory rozděleny na euploidní a aneuploidní. Do skupiny nádorů aneuploidních byly zařazeny nálezy jader hypoploidních i polyploidních.
Výsledky stanovení imunomarkerů, estrogenových a progesteronových receptorů a buněčné ploidity jsme vyhodnotili ve vztahu k předpokládané prognóze onemocnění stanovené podle zařazení nemocných do skupin s dobrou a špatnou prognózou, ať již podle FIGO stadia, nebo grade tumoru.
Statistické vyhodnocení výsledků bylo provedeno uspořádáním dat do kontingenčních tabulek (Crosstabulation) a spočítáním Fischerových testů, hodnotících homogenitu porovnávaných skupin pacientek. Testy byly provedeny na hladině významnosti p=0,05. Ke zpracování byl použit statistický software SPSS v.15,SPSS Inc Chicago,USA. Za statisticky významné byly považovány výsledky s oboustrannou exaktní signifikancí menší než 0,05.
VÝSLEDKY
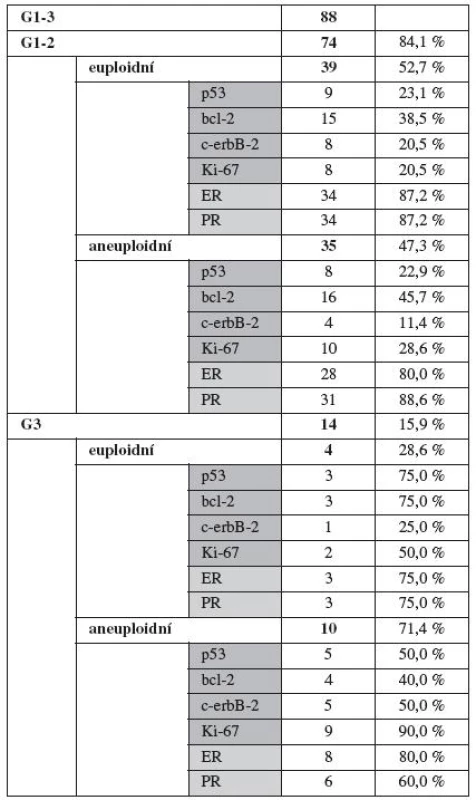
Rozdělení souboru dle grade tumoru udává tabulka l.
Ve skupině 74 nemocných s prognosticky příznivým gradem (G1 + G2) bylo 39 tumorů (53 %) s euploidním karyotypem, zatímco u 35 nádorů (47 %) byl nález jader hypo - nebo polyploidních. Expresi studovaných imunomarkerů a steroidních receptorů, resp. jejich zastoupení ve skupině euploidních a aneuploidních tumorů udává tabulka l.
Ve skupině 14 biologicky nevyzrálých tumorů (G3) byl euploidní karyotyp zjištěn u 4 nemocných (28 %), zatímco aneuplidita byla prokázána u 10 (71 %) tumorů. Přestože procentuální rozdíl obou skupin je relativně vysoký, nemá statistickou validitu, zřejmě v důsledku malého zastoupení biologicky nezralých tumorů.
Srovnáme-li expresi p53 ve skupině prognosticky příznivých tumorů (G1 + G2) se skupinou G3, pak exprese p53 byla pozitivní v 23 % u prvé skupiny, zatímco v 64 % ve skupině druhé. Výsledek má statistickou významnost. Totéž platí i pro Ki 67 (25 versus 64 %) a rovněž pro c-erbB-2 (17 versus 46 %) U ostatních imunomarkerů nedosáhly rozdíly statistické významnosti.
U steroidních receptorů jsme prokázali statistickou významnost mezi oběma skupinami jen u progesteronových receptorů, kde pozitivita u dobře diferencovaných tumorů byla v 89 %, zatímco u špatně diferencovaných jen v 64 %.
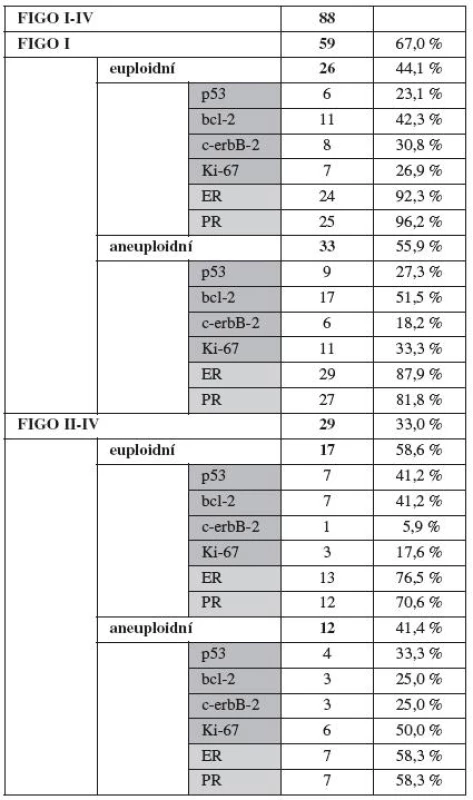
Rozdělení souboru podle FIGO stadia udává tabulka 2.
Ve skupině nemocných v klinickém stadiu FIGO I (I a - c) bylo 59 nemocných. U 26 z nich (44 %) byl nález buněk euploidních, u 33 (60 %) byl karyotyp aneuploidní. Expresi studovaných imunomarkerů a steroidních receptorů, resp. jejich zastoupení ve stejné skupině euploidních a aneuploidních tumorů udává tabulka 2.
Do prognosticky nepříznivého stadia FIGO II–IV bylo zařazeno 29 nemocných (33 %). Euploidních tumorů bylo 17 (58 %), zatímco aneuploidních bylo 12 (41 %). Statisticky významný rozdíl zjištěn nebyl.
Srovnání sledovaných imunomarkerů mezi prognosticky příznivým stadiem FIGO I a stadii II–IV neprokázalo statisticky významné rozdíly. Signifikantní rozdíly mezi uvedenými skupinami jsme však prokázali jak pro E, tak P receptory, které byly výrazně častěji pozitivní u iniciálních, prognosticky příznivých onemocnění.
DISKUSE
V současné době je již všeobecně akceptován názor, že vznik maligního tumoru je podmíněn primárně genetickou poruchou, ať již vzniklou sporadicky, nebo na podkladě dědičně podmíněné dispozice. Kancerogeneze je mnohastupňový proces, který vzniká jako nerovnováha mezi normální buněčnou proliferací a apoptózou, tj. plánovanou buněčnou smrtí. Na vzniku nádorů se může podílet velké množství genů. Hlavními událostmi podílejícími se na iniciální fázi kancerogeneze jsou změny zahrnující aktivaci proonkogenů, inaktivaci tumor supresorových genů, mikrosatelitovou instabilitu, aneuploidii, bodové mutace, translokace, amplifikace, ztrátu heterozygozity a další.
Onkogeny vznikající poruchou – mutací – proonkogenu jsou patologické geny, které kódují proteiny, které, jsou-li v patologickém množství nebo abnormní formě, mohou vést k nádorové transformaci buňky. Mezi nejznámější onkogeny patří gen c-erbB-2 jinak známý jako HER2/neu a bcl-2. Onkogeny mohou též vytvářet komplexy s produkty tumor supresorových genů, a tím způsobit jejich inaktivaci.
Amplifikace a zvýšená exprese c-erbB-2 u karcinomu endometria byla popsána v 10–40 % [13, 20]. C-erbB-2 onkogen kóduje podobně jako EGRF (epidermal growth factor receptor) růstový faktor, a proto se vyskytuje u agresivních typů nádorů a měl by proto korelovat s horší prognózou. Nicméně výsledky klinických studii nejsou jednoznačné [13, 20,22, 24, 26]. Naše výsledky prokázaly zvýšenou expresi tohoto markeru u prognosticky nepříznivých případů podle grade, ne však FIGO stadia.
Bcl-2 je onkogen, který inhibuje apoptózu a prodlužuje přežití buňky. Jeho exprese se mění během menstruačního cyklu, je vysoká v proliferační fázi a nízká v období menstruace. Vysoké hodnoty jsou rovněž nacházeny u hyperplazie endometria. U endometriálního karcinomu je zvýšená exprese popisována zejména u karcinomu typu I a je dávána do souvislosti s větší hloubkou myometriální invaze, stagingem, gradingem a horší prognózou [1, 24]. U karcinomu typu II, a zejména u nepříznivých histopatologických typů nádorů je jeho exprese naopak nízká [9, 27]. U naší sestavy nemocných byly vyšší hodnoty proteinu bcl-2 zjištěny u skupiny prognosticky nepříznivých nemocných z hlediska gradingu, ne však stagingu. Výsledky však nemají statistickou validitu.
Tumor supresorové geny hrají důležitou roli v kontrole buněčného dělení tím, že kódují proteiny, které inhibují / regulují buněčné dělení. Dokážou kontrolovat buněčné dělení a vzniklé chyby buď opraví, nebo buňky zastaví v dalším dělení. Fungují tedy jako tzv. pojistky, které vypnou buněčný cyklus v případě abnormní proliferace nebo poškození genetické informace. Porucha tumor supresorového genu např. mutací může mít za následek únik poškozených buněk z kontrolních mechanismů, a přispívat tím ke vzniku a růstu zhoubného nádoru. Snad nejznámějším tumor supresorovým genem je p53. Vzhledem k jeho významné roli v procesu apoptózy bývá též nazýván „strážcem genomu“. Kóduje nukleární fosfoprotein a jako transkripční faktor ovlivňuje expresi dalších genů regulujících růst a dělení buňky. Gen p53 je však poměrně často mutován a jeho specifická regulační role se tímto mění nebo je inhibována. Proteinový produkt mutovaného genu je pak degradován v buňce velmi pomalu, jeho regulace neodpovídá dynamickým změnám v buňce, je proto detekovatelný imunohistochemickými metodami. U karcinomu endometria je prokazován velmi často a jeho zvýšená exprese koreluje s klinickým stadiem onemocnění, zhoršenou prognózou a agresivními histopatologickými typy nádoru [6, 8, 9, 13, 18, 31]. Naše výsledky prokázaly jeho téměř trojnásobné hodnoty u nádorů špatně diferencovaných ve srovnání s nádory dobře diferencovanými. Rozdíl má vysokou statistickou validitu (p=0,004). Rovněž srovnání exprese p53 podle stagingu prokázalo zvýšené hodnoty u skupiny FIGO II–IV ve srovnání s prognosticky příznivou skupinou I. Rozdíl však nemá statistickou významnost.
Ki-67 je marker spojený s buněčnou proliferací, která je výrazným rysem všech zhoubných nádorů. Tento protein je kódován genem MK167 a je detekovatelný v jádře buněk ve všech fázích buněčného cyklu s výjimkou klidové fáze buňky (G0). Většina endometriálních karcinomů exprimuje nízký proliferační index, zvýšená exprese obvykle koreluje s nepříznivým gradem, klinickým stadiem a znamená zhoršenou prognózu. Vysokou expresi vykazují rovněž nepříznivé histopatologické typy karcinomu endometria [7, 28, 29]. V naší studii jsme prokázali zvýšenou expresi u prognosticky nepřízných nádorů podle grade. Vysokou pozitivitu jsme zjistili zejména u aneuploidních a nezralých tumorů (90 %). Výsledky jsou statisticky významné. Význam Ki-67 u non-endometroidních karcinomů nemůžeme pro malý počet pacientek hodnotit.
Cyklické změny na endometriu v průběhu menstruačního cyklu jsou podmíněny ovariální produkcí pohlavních steroidů, tj. estrogenů a progesteronu. Estrogenové a progesteronové receptory se vážou po své aktivaci na specifická cílová místa v DNA, kde modulují expresi příslušných genů. Kromě přímé aktivace cílových genů byl popsán i nepřímý mechanismus účinku přes vazbu na transkripční faktory [23]. Kromě své fyziologické funkce ve zdravém endometriu hrají steroidní receptory i důležitou roli v rozvoji endometriální karcinogeneze. Absence steroidních receptorů je považována za negativní prognostický faktor a je nejčastěji nalézána u nepříznivých histopatologických typů a agresivních endometriálních tumorů [3, 9, 10]. V naší studii jsme prokázali ve shodě s literárními údaji sníženou přítomnost P-receptorů u biologicky nezralých endometroidních tumorů. Nízkou pozitivitu obou steroidních receptorů jsme prokázali u pokročilých stadií tumorů (Figo II–IV).
Typickým karyotypem je 46 chromozomů složených do 23 párů u zdravých lidských buněk. Genetický materiál v nádorových buňkách je naproti tomu charakterizován určitou mírou genetické nestability, která může v důsledku mitotických poruch vyústit ve výrazné změny genomu.Výrazným prvkem nádorové progrese jsou defekty v genech spjatých s udržováním chromozomové stability a integrity. Přebytek nebo ztráta jednoho nebo více chromozomů vede ke genetické nestabilitě v nádorových buňkách. Bylo prokázáno, že tato nestabilita je častým projevem maligní transformace a je typická zejména pro určité druhy maligních nádorů. U karcinomu endometria jsou aneuploidní změny popisovány v širokém rozmezí 15–40 % [4, 11, 12, 25, 33]. Obecně platí, že dobře diferencované tumory prognosticky příznivé mají převahu diploidních buněk, zatímco pro agresivní tumory je typický aneuploidní karyotyp [14, 29, 30, 32]. Z klinického pohledu je důležité, že většina autorů považuje ploiditu za nezávislý prognostický faktor [5, 15, 18, 19, 34]. U prognosticky hraničních případů (FIGO I c, Gl – G2) pak výsledek stanovení ploidity může přispívat k rozhodnutí o eventuální adjuvantní terapii [16].
V naší sestavě nemocných byly aneuploidní formy karyotypů častěji zastoupeny u biologicky nezralých tumorů (G3). Rozdíl mezi prognosticky příznivými stadii G1 a G 2 a nepříznivým gradem G3 však nebyl statisticky významný. Domníváme se, že je to dáno malým početním zastoupením tumorů G3 v celém souboru.
Nepodařilo se nám rovněž prokázat vyšší zastoupení aneuploidity u onemocnění ve stadiu FIGO II–IV. Vysvětlením může být složení obou srovnávaných skupin. Do skupiny prognosticky příznivého stadia FIGO I jsou zařazeny rovněž pacientky stadia Ic, které je z hlediska prognózy zcela odlišné od stadia Ia a Ib. Do skupiny FIGO III pak spadají i nemocné s pozitivní peritoneální laváží, i když podle stupně myometriální invaze mohlo jít o incipientní karcinomy. Nová FIGO klasifikace tyto diskrepance již zohledňuje [2].
ZÁVĚR
Stanovení DNA ploidity, steroidních hormonálních receptorů a některých imunohistochemických markerů, zejména p53 a Ki 67 a c-erbB-2, pomáhá specifikovat skupinu prognosticky příznivých a nepříznivých endometriálních karcinomů. Přesné rozlišení má význam pro stanovení optimální terapeutické strategie.
Práce je podporována výzkumným grantem IGA MZ ČR NS 10272.
Infrastrukturní část tohoto projektu (Ústav molekulární a transplantační medicíny) byla podpořena z operačního programu Výzkum a vývoj pro inovace (projekt VZ.1.05/2.1.00/01.0030).
Prof. MUDr. Milan Kudela, CSc.
Porodnicko-gynekologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: kudelam@fnol.cz
Zdroje
1. Erdem O., Erdem M., Dursum A., et al. Angiogenesis, p 53 and bcl-2 expression as prognostic indicators in endometrial cancer: Comparison with traditional clinicopathological variables. Int J Gynecol Pathol, 2003, 22, p. 254-260.
2. FIGO committee on gynecologic oncology. Revised FIGO staging for carcinoma of the vulva, cervix and endometrium. Int J Gyn Obstet, 105, 2009, p. 103-104.
3. Ferrandina, G., Ranelletti, FO., Gallotta, V., et al. Expression of cyclooxygenase-2 (COX-2), receptors for estrogen (ER) and progesteron (PR), p 53, Ki-67, and neu protein in endometrial cancer. Gynecol Oncol, 2005, 98, p. 383-389.
4. Freiberg, LG., Norén, H., Delle, U. Prognostic value of DNA ploidy and S-phase fraction in endometrial cancer stage I and II: a prospective 5-year survival study. Gynecol Oncol, 1994, 53, 1, p. 64-69.
5. Fu, YS., Gambone, JC., Berek, JS. Pathophysiology and management of endometrial hyperplasia and carcinoma. West J Med, 1990, 153, 1, p. 50-61.
6. Cherchi, PM., Madras, V., Capobiano, G., et al. Prognostic value of p53, c-erb-B2 and MIB-1 in endometrial carcinoma. Eur J Gynaecol Oncol, 2001, 22, p. 451-453.
7. Gassel, A., Backe, J., Krebs, S., et al. Endometrial carcinoma: immunohiostochemically detected proliferation index is a prognosticator of long-term outcome. J Clin Pathol, 1998, 51, p. 25-29.
8. Graesslin, O., Chanát-Bastaraud, S., Lorenzato, M., et al. Fluorescence in situ hybridization and immunohistochemical analysis of p53 expression in endometrial cancer: prognostic value and relation to ploidity. Ann Surg Oncol, 2008, 15, p. 484-492.
9. Halperin, R., Zehavi, S., Hamer, L., et al. Comaparative immunohistochemical study of endometritid and serous papillary carcinoma of endometrium. Eur J Gynecol Oncol, 2001, 22, p. 122-126.
10. Jazaeri, AA., Nunes, KJ., Dalton, MS., et al. Well – differentiated endometrial adenocarcinomas and poorly differentiated mixed Mullerian tumors have altered ER and PR isoform expression. Oncogene, 2001, 20, p. 6965-6969.
11. Larson, DM., Berg, R., Show, G., Krawisz, BR. Prognostic significance of DNA ploidy in endometrial cancer. Gynecol Oncol, 1999, 74, 3, p. 356-360.
12. Lindahl, B., Alm, P., Ferno, M., et al Prognostic value of flow cytometrical DNA measurements in stage I-II endometrial carcinoma: Correlations with steroid receptor concentration, tumor myometrial invasion and degrese of differentiation. Anticancer Res, 1987, 7, p. 791-798.
13. Lukes, AS., Kohler, MF., Pieper, CF., et al. Multivariable analysis od DNA ploidity, p53 and HER-2/neu as prognostic factors in endometrial cancer. Cancer, 1994, 73, 9, p. 2380-2385.
14. Lundgren, C., Lahmann, J., Beder, S., Roblick, U. 2-DE protein expression in endometrial carcinoma. Acta Oncol, 2006, 45, p. 685-694.
15. Mangili, G., De Marzi, P., Viganň, R., et al. Identification of high risk patients with endometrial carcinoma. Prognostic assesment of endometrial cancer. Eur J Gynaecol Oncol, 2002, 23, 3, p. 216-220.
15. Mangili, G., Montoli, S., De Marzi, P., et al. The role of DNA ploidy in postoperative managenemnt of stage I endometrial cancer. Ann Oncol, 2008, 19, p. 1278-1283.
16. Marková, I., Pilka, R., Dušková, M., et al. Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria. Čes Gynek, 2010, 75, 3, s. 193-199.
17. Mariani, A., Sebo, TJ., Katzmann, JA., Keeney, GL. Pretreatment assessment of prognostic indicators in endometrial cancer. Am J Obstet Gynecol, 2000, 182, p. 1535-1544.
18. Mariani, A., Conti, L., Antenucci, A., Vecillo, M. Predictive value of cell kinetics in endometrial adenocarcinoma. Anticancer Res, 2000, 20, p. 3569-3574.
19. Mariani, A., Sebo, TJ., Webb, MJ., Riehle, D. Molecular and histopatologic predictors of distant failure in endometrial cancer. Cancer Detect Prev, 2003, 27, p. 434-441.
20. Melchiorri, C., Chieco, P., Lisignoli, G., et al. Ploidy disturbances as an early indicator of intrinsic malignancy in endometrial carcinoma. Cancer, 1993, 72, 1, p. 165-172.
21. Mičková, I., Pilka, R., Lubušký, M., Kudela, M. Molekulární prognostické faktory a patogeneze endometriáního karcinomu. Čes Gynek, 2006, 71, s. 355-360.
22. Oehler, MK., Rees, MC., Bicknell, R. Steroids and the endometrium. Curr Med Chem, 2000, p. 543-560.
23. Owen, P., Duncan, ID. Is there any value in long term follow up of women treated for endometrial cancer? Br J Obstet Gynaecol, 1996, 103, p. 710-713.
24. Pfisterer, J., Kommoss, F., Sauerbrei, W., et al. Prognostic value of DNA ploidy and S-phase fraction in stage I endometrial carcinoma. Gynecol Oncol, 1995, 58, 2, p. 149-156.
25. Riben, MW., Malfetano, JH., Nazeer, T., et al. Identification of HER-2/neu oncogene amplification by fluorescence in situ hybridization in stage I endometrial carcinoma. Mod Pathol, 1997, 10, p. 823-831.
26. Sakuragi, N., Ohkouchi, T., Hareyama, H., et al. Bcl-2 expression and prognosis of patients with endometrial carcinoma. Int J Cancer, 1998, 79, p. 153-158.
27. Salvesen, HB., Iversen, OE., Allen, LA. Identification of high-risk patients by assessment of nuclear Ki-67 exprassion in aprospective study of endometrial carcinomas. Clin Cancer Res, 1998, 4, p. 2779-2785.
28. Salvesen, HB., Iversen, OE, Allen, LA. Prognostic signifikance of angiogenesis and Ki-67, p53 and p21 expression: apopulation-based endometrial carcinoma study. J Clin Oncol, 1999, 17, p. 1382-1390.
29. Shimizu, K. Prognostic evaluation of endometrial carcinoma by DNA content and histologic factors. Nippon Sanka Fininka gakkai Zasshi, 1995, 47, 4, p.413-418.
30. Skirnisdóttir, I., Sorbe, B., Karisson, M., Seidal, T. Prognostic importace of DNA ploidy and p53 in early stages of epithelial ovarian carcinoma. Int J Oncol, 19, 2001, p. 1295-1302.
31. Susini, T., Amunni, G., Molino, C., et al. Ten-year results of a prospective study on the prognostic role of ploidy in endometrial carcinoma: DNA aneuploidy identifies high-risk cases among the so–called „low – risk“ patients with well and moderately differentiated tumors. Cancer, 2007, 109, 5, p. 882‑890.
32. Thornton, JG., Ali, S., O’Donovan, P., et al. Flow cytometric studie of ploidy and proliferative indicies in the Yorkshire trial of adjuvant progesteron treatment of endometrial cancer. Br J Obstet Gynaecol, 1993, 100, p. 253-261.
33. von Minckwitz, G., Kun, W., Kaufmann, M., et al. Prognostic importace of DNA-ploidy and S-phase fractio in endometrial cancer. Int J Gynecol Cancer, 1994, 4, p. 250-256.
34. Wimberger, P., Hillemanns, P., Kapsner, T., et al. Evaluation of prognostic factors following flow-cytometric DNA analysis after cytokeratin labelling: II. Cervical and endometrial cancer. Anal Cell Pathol, 2002, 24, p. 147-148.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Editorial
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2011 Číslo 3- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Editorial
- Dědičná dispozice ke vzniku karcinomu endometria
- Úloha hysterektomie v managementu prekanceróz děložního hrdla
- Primární rezistence/senzitivita in vitro a klinický průběh onemocnění u pacientek s karcinomem ovaria
- Prognostický význam vybraných molekulárně-genetických imunohistochemických markerů a DNA ploidity u karcinomu endometria
- Psychosociální faktory ovlivňující spokojenost rodiček s perinatální péčí
- Spontánní předčasný porod u rodičky v umělém spánku na ECMO při závažné formě infekce H1N1
-
Guideline gynekologických zhoubných nádorů 2010
Primární chirurgická léčba zhoubných nádorů endometria - Profylaktické operace u žen s hereditární dispozicí ke vzniku gynekologických malignit
- Biofyzikálne metódy diagnostiky intrapartálnej fetálnej hypoxie
- Pokročilý věk matky jako indikace k provedení amniocentézy – zhodnocení karyotypu u 418 vyšetřených plodů
- Vysoká rezistence Streptococcus agalactiae na antibiotickou terapii druhé linie u časných a pozdních forem infekcí novorozence
- Optimalizace vyšetření protilátek proti trombocytům u těhotných a žen po porodu
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vysoká rezistence Streptococcus agalactiae na antibiotickou terapii druhé linie u časných a pozdních forem infekcí novorozence
- Optimalizace vyšetření protilátek proti trombocytům u těhotných a žen po porodu
- Biofyzikálne metódy diagnostiky intrapartálnej fetálnej hypoxie
- Úloha hysterektomie v managementu prekanceróz děložního hrdla
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy