-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fetomaternální hemoragie při porodu císařským řezem
Fetomaternal haemorrhage in delivery by cesarean section
Objective:
To determine the incidence and volume of fetomaternal haemorrhage (FMH) in normal vaginal delivery and in delivery by cesarean section. Determination of these parameters would enable optimalization of guidelines for RhD alloimmunization prophylaxis.Design:
A prospective cohort study.Setting:
Palacky University Hospital, Olomouc, Czech Republic; University Hospital, Ostrava, Czech Rebublic.Methods:
A total of 4862 examinations were performed. The volume of fetal red blood cell (RBC) entering maternal circulation in normal vaginal delivery (control group, n = 3295) and in delivery by cesarean section (risk group, n = 1567) was assessed by flow cytometry. FMH = fetal RBC volume; fetal blood volume si double (expected fetal hematocrit is 50%).Results:
The fetal RBC volume diagnosed in maternal circulation after delivery ranged from insignificant FMH < 0.1 ml to excessive FMH = 65.9 ml (median 0.7; mean 0.79; SD 1.38). High values of FMH > 1.7 ml were observed in 5.8% cases (280/4862), FMH > 2.0 ml in 3.2% (157/4862), FMH > 2.0 ml in 1.4% (69/4862) and excessive FMH > 5ml (IgG anti-D insufficient dose 100 μg) in 0.25% (15/4862). Delivery by cesarean section presented a higher risk of incidence of high values of FMH > 1.7 ml (OR 1.6; p 0.0002), FMH > 2.0 ml (OR 2.2; p <0.0001) and FMH > 2.5 ml (OR 2.2; p 0.002) when compared with normal vaginal delivery. It did not, however, present a statistically significant risk factor for the incidence of excessive FMH > 5ml.Conclusion:
In normal vaginal delivery as well as in delivery by cesarean section, FMH less than 5 ml (10 ml of whole blood) occurs in the great majority of cases, and thus for the prevention of RhD alloimmunization, an IgG anti-D dose of 100 μg should be sufficient. Contrarily, only rarely does greater FMH occur and delivery by cesarean section does not present a risk factor.Key words:
fetomaternal haemorrhage, cesarean section, RhD alloimmunization, anti-D immunoglobulin.
Autoři: M. Lubušký 1,2; O. Šimetka 3
; M. Studničková 1
; M. Procházka 1; L. Feketevíziová 3; M. Ordeltová 4; K. Langová 5
Působiště autorů: Porodnicko-gynekologická klinika LF UP a FN Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; Ústav lékařské genetiky a fetální medicíny LF UP a FN Olomouc, přednosta prof. MUDr. J. Šantavý, CSc. 2; Porodnicko-gynekologická klinika FN Ostrava, přednosta MUDr. O. Šimetka, Ph. D. 3; Ústav imunologie LF UP a FN Olomouc, přednosta prof. MUDr. E. Weigl, CSc. 4; Ústav lékařské biofyziky LF UP Olomouc, přednostka prof. RNDr. H. Kolářová, CSc. 5
Vyšlo v časopise: Ceska Gynekol 2012; 77(2): 156-162
Kategorie: Původní práce
Souhrn
Cíl studie:
Zjistit incidenci a objem fetomaternální hemoragie (FMH) při normálním vaginálním porodu a při porodu císařským řezem. Určení těchto parametrů umožní optimalizovat doporučení k provádění prevence RhD aloimunizace.Typ studie:
Prospektivní kohortová studie.Název a sídlo pracoviště:
Fakultní nemocnice Olomouc, Fakultní nemocnice Ostrava.Metodika:
Celkem bylo provedeno 4862 vyšetření. Množství fetálních erytrocytů proniklých do oběhu matky po normálním vaginálním porodu (kontrolní skupina, n = 3295) a po porodu císařským řezem (riziková skupina, n = 11567) bylo stanoveno průtokovou cytometrií. FMH = objem fetálních erytrocytů (ml), objem plné fetální krve je dvojnásobný (předpokládaný fetální hematokrit 50 %).Výsledky:
Objem fetálních erytrocytů diagnostikovaný v oběhu matky po porodu se pohyboval v rozmezí od nevýznamné FMH < 0,1 ml až po excesivní FMH = 65,9 ml (medián 0,7; průměr 0,79; SD 1,38). Vysoké hodnoty FMH > 1,7 ml se vyskytly v 5,8 % případů (280/4862), FMH > 2,0 ml v 3,2% (157/4862), FMH > 2,5 ml v 1,4 % (69/4862) a excesivní FMH > 5 ml (nepostačující dávka IgG anti-D 100 μg) v 0,25% (15/4862). Porod císařským řezem představoval oproti normálnímu vaginálnímu porodu zvýšené riziko pro výskyt vysokých hodnot FMH > 1,7 ml (OR 1,6; p 0,0002), FMH > 2,0 ml (OR 2,2; p <0,0001) a FMH > 2,5 ml (OR 2,2; p 0,002). Nepředstavoval však statisticky významný rizikový faktor pro výskyt excesivní FMH > 5 ml.Závěr:
Při normálním vaginálním porodu i při porodu císařským řezem dochází v naprosté většině případů k FMH menší než 5 ml (10 ml plné fetální krve), a při prevenci RhD aloimunizace je tudíž postačující dávka IgG anti-D 100 μg. Naopak jen ojediněle dochází k větší FMH a porod císařským řezem nepředstavuje rizikový faktor.Klíčová slova:
fetomaternální hemoragie, císsařský řez, RhD aloimunizace, anti-D imunoglobulin.ÚVOD
Při provádění prevence RhD aloimunizace u RhD negativních žen po porodu RhD pozitivního plodu je anti-D imunoglobulin často podáván paušálně v mnohem větších dávkách, než je skutečně potřeba. K upřesnění dávky IgG anti-D potřebné k prevenci RhD aloimunizace je však nutné stanovit objem inkompatibilních fetálních erytrocytů, které pronikly do mateřského oběhu. Není-li stanoven objem fetomaternální hemoragie (FMH), podává se obvykle dávka 100–300 μg intramuskulárně. Efektivita paušálního podávání dávky větší než 100 μg však nebyla prokázána [1, 3, 7, 8, 9, 10, 12, 16, 17, 22]. Cílem dalšího výzkumu by proto mělo být stanovení optimální dávky anti-D imunoglobulinu. Efektivita bezprostředního podání menší dávky IgG anti-D v kombinaci se screeningem množství fetomaternální hemoragie a následným doplněním IgG anti-D v případě potřeby by měla být porovnána s efektivitou podávání jednorázově větší dávky IgG anti-D paušálně [3, 12].
Pracovní hypotéza: IgG anti-D v dávce 10 μg podané nitrosvalově by mělo pokrýt 0,5 ml fetálních RhD pozitivních erytrocytů nebo 1ml celé krve [3, 4]. FMH = objem fetálních erytrocytů (ml), objem plné fetální krve je dvojnásobný (předpokládaný fetální hematokrit 50 %). U naprosté většiny porodů proniká do mateřské krve méně než 2,5 ml fetálních erytrocytů (5 ml plné krve, postačující dávka IgG anti-D 50 μg). Naopak jen ojediněle dochází při porodu k FMH, která přesahuje 5 ml (10 ml plné fetální krve, postačující dávka IgG anti-D 100 μg). Zvýšené nebezpečí prostupu červených krvinek plodu do krve matky je při porodu císařským řezem.
Cílem práce bylo zjistit incidenci a objem fetomaternální hemoragie při normálním vaginálním porodu a při porodu císařským řezem. Určení těchto parametrů umožní optimalizovat doporučení k provádění prevence RhD aloimunizace.
MATERIÁL A METODIKA
V prospektivní kohortové studii bylo provedeno celkem 4862 vyšetření. Množství fetálních erytrocytů proniklých do oběhu matky po normálním vaginálním porodu (kontrolní skupina, n = 3295) a po porodu císařským řezem (riziková skupina, n = 1567) bylo stanoveno průtokovou cytometrií na přístrojích: BDFACSCanto (Becton Dickinson International) a CYTOMICS-FC500 (Beckman Coulter).
Z kontrolní skupiny (normální vaginální porod) byly vyloučeny operativní porody (císařský řez, vakuumextrakce, klešťový porod), porody mrtvého plodu, vícečetná těhotenství a porody s manuálním vybavením placenty a/nebo instrumentální revizí dutiny děložní.
Riziková skupina (porod císařským řezem) byla ještě dále rozdělena na podskupiny: abrupce placenty (n = 17), jednočetná těhotenství (n = 1384) a dvojčetná těhotenství (n = 164).
Odběr vzorku
Vyšetření fetomaternální hemoragie (FMH) byla prováděna ze vzorku mateřské žilní krve odebrané venepunkcí za 1–2 hodiny po porodu do zkumavky s antikoagulační látkou (EDTA, Heparin). Bylo odebráno 0,5–1,0 ml žilní krve, vzorky byly skladovány v lednici při teplotě 2–8 °C a vyšetření bylo provedeno do 24 hodin po odběru krve.
Laboratorní zpracování
Fetal Cell Count kit (Diagnosis of Feto-maternal Transfusion by flow cytometry), IQ Products, IQP-379. Kit je určen k rozlišení a kvantitativnímu stanovení lidských fetálních erytrocytů v mateřské krvi. Je založen na senzitivní a přesné průtokové cytometrické metodě, která nabízí duální fluorescenční detekci dvou intracelulárních antigenů, hemoglobinu F (HbF) a Carbonic Anhydrase (CA). Metodika se zakládá na použití kombinace dvou protilátek. První je namířena proti fetálnímu hemoglobinu (HbF), který se nachází ve fetálních erytrocytech a v malém procentu je přítomen i v adultních erytrocytech (F-cells). Druhá protilátka je namířena proti Carbonic Anhydrase (CA), enzymu přítomnému v adultních erytrocytech a ve velmi pozdních stadiích fetálních buněk. Fetální erytrocyty jsou rozpoznány podle jasné exprese HbF v kombinaci s kompletní nepřítomností exprese CA. Naproti tomu mateřské erytrocyty nemají žádný HbF signál v kombinaci s jasnou expresí CA.
Pracovní postup metody byl proveden podle doporučení výrobce uvedených v příbalovém letáku kitu. Pro kontrolu kvality vyšetření byl použit k tomuto účelu komerčně dodávaný kit (FETALtrol, IQ Products), jehož součástí jsou tři kontroly s definovaným rozpětím měřených hodnot. Každý vyšetřovaný vzorek byl měřen oproti negativní kontrole (neznačený vzorek). V rámci standardizace vyšetření byla prováděna externí kontrola kvality společným vzorkem.
Výpočet celkového objemu fetálních erytrocytů proniklých do oběhu matky
Scientific Subcommittee of the Australian and New Zealand Society of Blood Transfusion. Guidelines for laboratory assessment of fetomaternal haemorrhage. 1st ed. Sydney: ANZSBT, 2002 : 3-12 [18].
FMH (ml) = (1800 x 1,22 x EF) / 100.000
- FMH objem fetálních erytrocytů proniklých do oběhu matky (ml) objem plné fetální krve je dvojnásobný (předpokládaný fetální hematokrit 50 %)
- 1800 průměrný objem mateřských erytrocytů (ml)
- 1,22 fetální erytrocyt je v průměru o 22 % větší než mateřský
- EF počet fetálních erytrocytů (HbF pozitivních) z celkového počtu 100 000 hodnocených erytrocytů
Statistické zpracování
Testy Shapiro-Wilk bylo zjištěno, že data nemají normální distribuci, proto byly pro zpracování použity neparametrické metody. Rozdíly mezi kontrolní a experimentální skupinou ve veličinách numerického charakteru (věk matky, gestační stáří, FMH) byly porovnány Mannovým-Whitneyho U-testem. Vzájemná korelace těchto veličin byla ověřena výpočtem Spearmanova korelačního koeficientu. Porovnání kontrolní a experimentální skupiny ve výskytu vysokých hodnot FMH (> 1,7 ml, > 2,0 ml, > 2,5 ml, > 5 ml) bylo provedeno Fisherovým přesným testem a bylo spočítáno odds ratio. Všechny testy byly provedeny na hladině významnosti 0,05. Distribuce veličiny byla graficky znázorněna histogramy a box grafy. Ke statistickému zpracování byl použit statistický software SPSS v 15, SPSS Inc. Chicago, USA.
VÝSLEDKY
Porovnání věku matky v termínu porodu a délky trvání těhotenství (gestační stáří) u kontrolní (normální vaginání porod, n = 3295) a rizikové skupiny (porod císařským řezem, n = 1567) uvádí tabulka 1. Vzhledem k velikosti souboru se jeví i malé rozdíly statisticky významné, klinicky však významné nejsou.
Tab. 1. Porovnání kontrolní (normální vaginální porod) a rizikové skupiny (porod císařským řezem) ve veličinách numerického charakteru: věk matky v termínu porodu, délka trvání těhotenství (gestační stáří, GA), objem fetomaternální hemoragie po porodu (FMH). FMH = objem fetálních erytrocytů (ml), objem plné fetální krve je dvojnásobný (předpokládaný fetální hematokrit 50%). 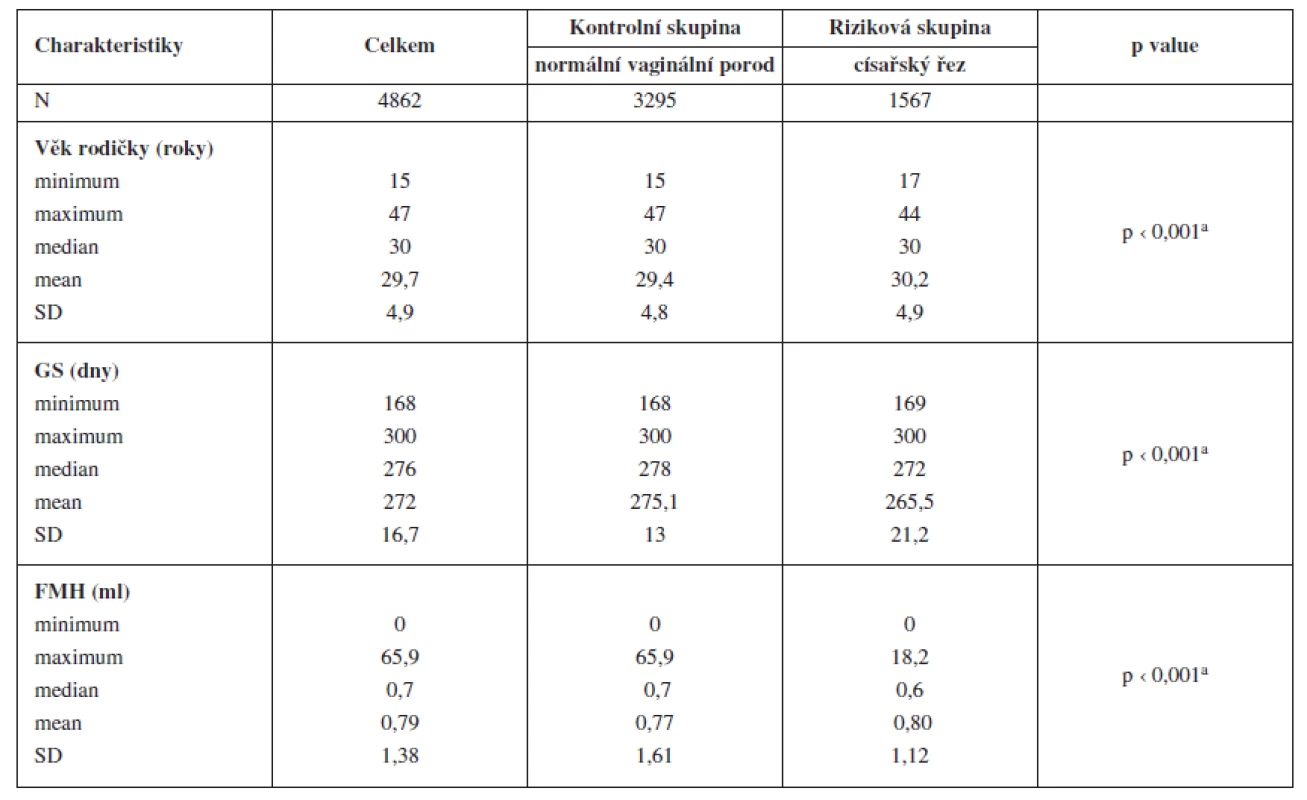
aMannův-Whitneyho U-test Objem fetálních erytrocytů, diagnostikovaný v oběhu matky po porodu, se pohyboval v rozmezí od nevýznamné FMH ≤ 0,1 ml až po excesivní FMH = 65,9 ml (medián 0,7; průměr 0,79; SD 1,38). Porovnání hodnot FMH u kontrolní a rizikové skupiny je uvedeno v tabulce 1.
V kontrolní skupině (normální vaginání porod) byly vypočteny hodnoty FMH = 1,7 ml (95. percentil) a FMH = 2,0 ml (97,5. percentil). Dále byly stanoveny hodnoty FMH = 2,5 ml (postačující dávka IgG anti-D 50 μg) a FMH = 5ml (postačující dávka IgG anti-D 100 μg). Výskyt vysokých hodnot fetomaternální hemoragie (FMH > 1,7 ml, > 2,0 ml, > 2,5 ml) a excesivních hodnot (FMH > 5 ml) byl následně porovnán v kontrolní a rizikové skupině (porod císařským řezem) (obr. 1).
Obr. 1. Distribuce objemu fetomaternální hemoragie (FMH) zjištěné po porodu v kontrolní (normální vaginální porod) a rizikové skupině. Riziková skupina (porod císařským řezem) je ještě dále rozdělena na podskupiny: abrupce placenty, jednočetná a dvojčetná těhotenství. Při FMH ≤ 5 ml je postačující dávka IgG anti-D 100 μg (tlustá čára). Hodnoty excesivní FMH > 5 ml jsou uvedeny v absolutních hodnotách (ml) v kroužcích vedle grafu. 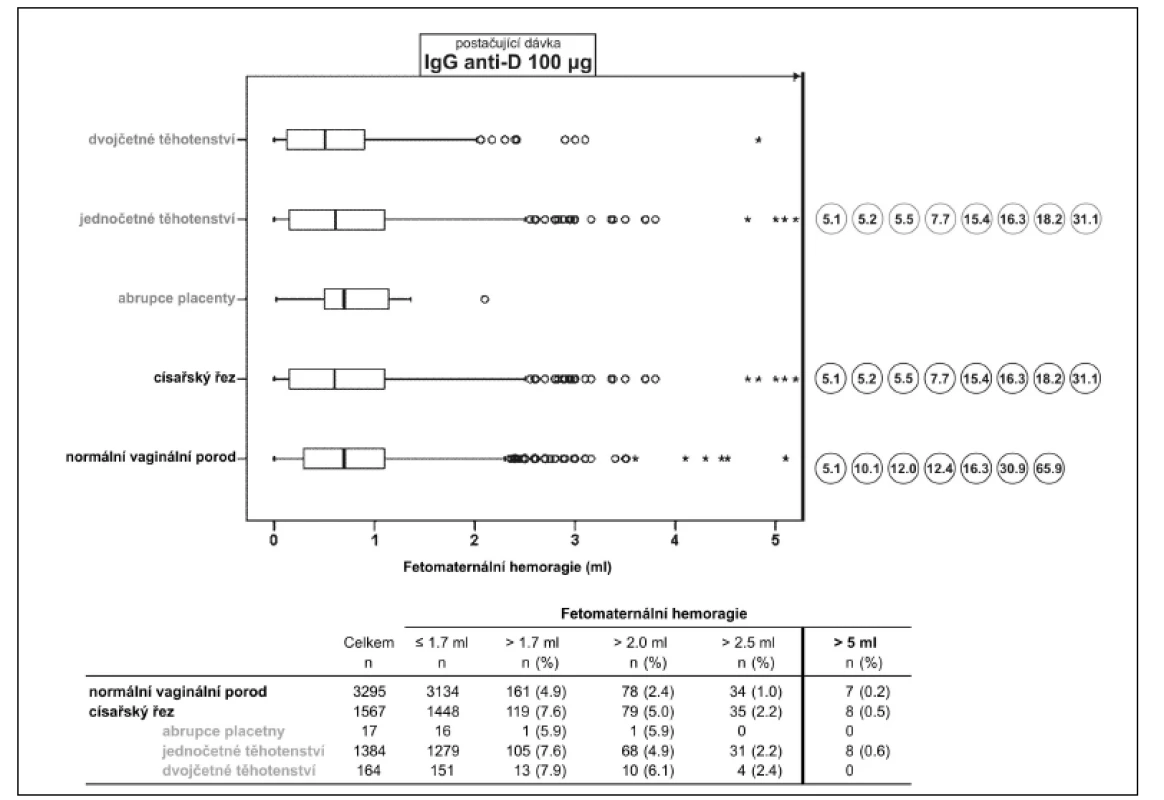
Z našich výsledků vyplývá, že porod císařským řezem představuje zvýšené riziko pro výskyt vysokých hodnot FMH > 1,7 ml (OR 1,6; p 0,0002), FMH > 2,0 ml (OR 2,2; p <0,0001) a FMH > 2,5 ml (OR 2,2; p 0,002). Nepředstavuje však statisticky významný rizikový faktor pro výskyt excesivní FMH > 5ml (tab. 2–5).
Tab. 2. -5. Porovnání kontrolní (normální vaginální porod) a rizikové skupiny ve výskytu vysokých hodnot fetomaternální hemoragie (FMH > 1,7 m, > 2,0 ml, > 2,5 ml a > 5 ml). Riziková skupina (porod císařským řezem) je ještě dále rozdělena na podskupiny: abrupce placenty, jednočetná a dvojčetná těhotenství. Při FMH ≤ 5 ml je postačující dávka IgG anti-D 100 μg (tlustá čára) 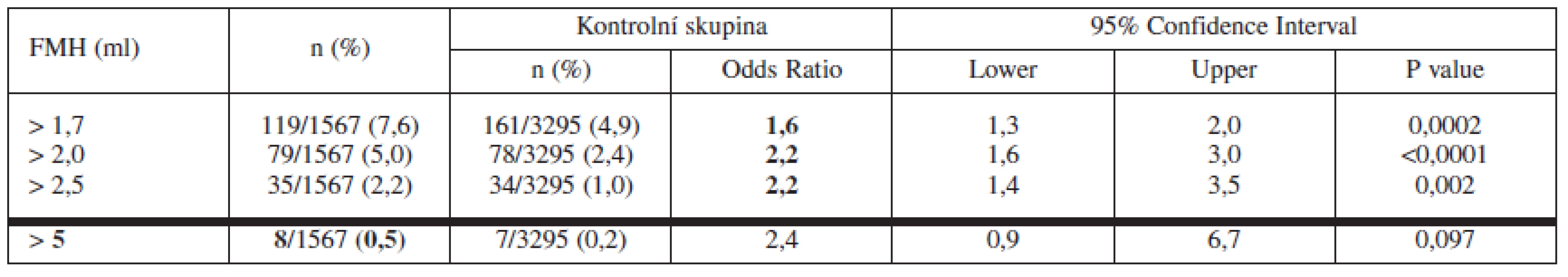
Císařský řez (SC) FMH ≤ 2,5 ml (5 ml celé krve), byla přítomna při normálním vaginálním porodu v 99,0 % případů (3261/3295), postačující dávka IgG anti-D 50 μg. FMH < 5 ml (10 ml celé krve) v 99,8 % případů (3288/3295), postačující dávka IgG anti-D 100 μg. Ve zbylých sedmi případech byla FMH = 5,1 ml, 10,1 ml, 12,0 ml, 12,4 ml, 16,3 ml, 30,9 ml a 65,9 ml (11 ml, 21 ml, 24 ml, 25 ml, 33 ml, 62 ml a 132 ml plné krve), postačující dávka IgG anti-D = 110 μg, 210 μg, 240 μg, 250 μg, 330 μg, 620 μg a 1320 μg (obr. 1).
FMH ≤ 2,5 ml (5 ml celé krve), byla přítomna při porodu císařským řezem v 97,8% případů (1532/1567), postačující dávka IgG anti-D 50 μg. FMH ≤ 5 ml (10 ml celé krve) v 99,5 % případů (1559/1567), postačující dávka IgG anti-D 100 μg. Ve zbylých osmi případech byla FMH = 5,1 ml, 5,2 ml, 5,5 ml, 7,7 ml, 15,4 ml, 16,3 ml, 18,2 ml a 31 ml (11ml (3x), 16 ml, 31 ml, 33ml, 37 ml a 62 ml plné krve), postačující dávka IgG anti-D = 110 μg (3x), 160 μg, 310 μg, 330 μg, 370 μg a 620 μg. Ve všech případech šlo o císařský řez při jednočetném těhotenství bez abrupce placenty (obr. 1).
DISKUSE
IgG anti-D v dávce 10 μg podané nitrosvalově by mělo pokrýt 0,5 ml fetálních RhD pozitivních erytrocytů nebo 1 ml celé krve [3, 4]. Z toho vyplývá, že 50 μg (125 μg, 250 μg) IgG anti-D by mělo zabránit aloimunizaci při fetomaternální hemoragii 5 ml (12,5 ml, 25 ml) plné fetální krve.
Přibližně u 1,5% porodů dochází k fetomaternální hemoragii přesahující 5 ml plné fetální krve, jen u 1% porodů dochází k fetomaternální hemoragii přesahující 12,5 ml a jen u 0,5 % porodů přesahuje fetomaternální hemoragie 25 ml [2, 13, 14, 19]. U téměř 50 % všech případů však není přítomen žádný rizikový faktor [14, 19, 20].
V řadě zemí je proto doporučeno po porodu stanovit objem fetomaternální hemoragie (FMH) k upřesnění dávky IgG anti-D potřebné k prevenci RhD aloimunizace matky (Austrálie, Kanada, USA, Velká Británie, Francie, Irsko, Česká republika) [1, 7, 8, 9, 16, 17].
Zvýšené nebezpečí prostupu červených krvinek plodu do krve matky je při porodu císařským řezem [6, 23], mrtvorozeném plodu [19], traumatickém vaginálním porodu, porodu vícečetného těhotenství, porodu s příznaky předčasného odlučování lůžka, porodu s patologií ve III. době porodní atd.
V naší studii byla po porodu diagnostikována fetomaternální hemoragie přesahující 5 ml plné fetální krve (nepostačující dávka IgG anti-D 50 μg) v 1,4 % případů (69/4862), po normálním vaginálním porodu v 1,0 % (34/3295), po porodu císařským řezem v 2,2 % (35/1567) a porod císařským řezem představoval významný rizikový faktor. Fetomaternální hemoragie přesahující 12,5 ml (nepostačující dávka IgG anti-D 125 μg) byla po porodu přítomna jen v 0,22 % případů (11/4862), po normálním vagináním porodu v 0,18 % (6/3295), po porodu císařským řezem v 0,31 % (5/1567) a porod císařským řezem již nepředstavoval významný rizikový faktor. Fetomaternální hemoragie přesahující 25 ml (nepostačující dávka IgG anti-D 250 μg) byla po porodu přítomna v 0,14 % případů (7/4862), po normálním vaginálním porodu v 0,09 % (3/3295), po porodu císařským řezem v 0,26 % (4/1567) a porod císařským řezem rovněž nepředstavoval významný rizikový faktor. V naší studii jsme po porodu zaznamenali menší výskyt vysokých hodnot FMH (> 12,5 ml i > 25 ml). V předchozích studiích však bylo množství FMH stanovováno Kleihauerovým-Betkeovým testem, který je v porovnání s průtokovou cytometrií méně přesný a umožňuje jen semikvantitativní stanovení objemu FMH [5, 21, 24].
Pomocí průtokové cytometrie zjišťovali objem fetomaternální hemoragie při porodu v recentní prospektivní studii Uriel et al. [15, 23], popisují však relativně malý soubor pacientek (n = 346), který dále rozdělují do tří skupin: vaginální porod (n = 196), vakumextrakce nebo klešťový porod (n = 59) a porod císařským řezem (n = 55). Objem FMH při porodu se pohyboval v rozmezí od ≤ 0,1 ml do 25,2 ml (průměr 0,25 ml; SD = 1,58), vaginální porod (průměr 0,12 ml; SD = 0,51; medián 0,03 ml), porod císařským řezem (průměr 0,67 ml; SD 3,44; medián 0,03), rozdíl byl statisticky významný (p 0,001). Při porodu císařským řezem rovněž nebylo zjištěno větší riziko výskytu FMH > 2,5 ml, šlo však o malý soubor a od FMH stanovené po porodu byl ve studii odečten objem fetálních erytrocytů zjištěný v mateřském oběhu těsně před porodem. Z hlediska prevence RhD aloimunizace a výpočtu potřebné dávky IgG anti-D však takový postup nemá klinický význam.
ZÁVĚR
Při normálním vaginálním porodu i při porodu císařským řezem dochází v naprosté většině případů k fetomaternální hemoragii menší než 5 ml (10 ml plné fetální krve), a při prevenci RhD aloimunizace je tudíž postačující dávka IgG anti-D 100 μg. Naopak jen ojediněle dochází k větší FMH a porod císařským řezem nepředstavuje rizikový faktor.
Efektivní se jeví bezprostřední podání menší dávky IgG anti-D (50 μg) v kombinaci se screeningem množství FMH a následným doplněním IgG anti-D v případě potřeby, nikoliv samostatné paušální podávání dávky větší než 100 μg.
Zavedení metody, která spolehlivě detekuje FMH a přesně určí její objem, umožní provádět prevenci RhD aloimunizace lépe a levněji, IgG anti-D je podáváno RhD negativním ženám po porodu RhD pozitivního plodu jen v dávce nezbytně nutné pro prevenci RhD aloimunizace a současně lze diagnostikovat i případy, kdy je nutné podat dávku větší.
Optimální a ekonomicky efektivní by však bylo RhD negativním ženám, nebyla-li v jejich séru prokázána přítomnost anti-D protilátek, aplikovat ve 28. týdnu IgG anti-D v dávce 250 μg. Po porodu RhD pozitivního dítěte následně stanovit objem fetálních erytrocytů, které pronikly do oběhu matky, a jen v indikovaných případech podat potřebnou dávku IgG anti-D i postpartálně.
Na začátku těhotenství je rovněž možné u RhD negativních žen stanovit RHD genotyp plodu z volné fetální DNA cirkulující v mateřské periferní krvi. Tento postup představuje další možnost jak zvýšit efektivitu provádění prevence RhD aloimunizace, protože je-li plod RHD negativní, není nutné RhD negativním ženám podávat IgG anti-D ve 28. týdnu těhotenství ani provádět prevenci RhD aloimunizace v případě jiných potenciálně senzibilizujících událostí v průběhu těhotenství. Navíc již není nutné vyšetřovat RhD status novorozence po porodu ani prováděd screening množství FMH.
Ve Fakultní nemocnici Olomouc i Ostrava je v současné klinické praxi u všech RhD negativních žen po porodu vyšetřen RhD status novorozence a stanoveno množství FMH, které umožní upřesnit dávku IgG anti-D potřebnou k prevenci RhD aloimunizace matky. IgG anti-D v dávce minimálně 125 μg je však po porodu RhD pozitivního dítěte podán vždy, protože v České republice není v současnosti k dispozici přípravek IgG anti-D v dávce menší než 125 μg. Postup lze event. modifikovat i tak, že je u všech RhD negativních žen po porodu vyšetřen RhD status dítěte a současně proveden odběr vzorku mateřské krve pro stanovení množství FMH, vlastní vyšetření je indikováno až následně, jen po porodu RhD pozitivního dítěte a umožňuje upřesnit dávku IgG anti-D potřebnou k prevenci RhD aloimunizace matky. IgG anti-D v dávce minimálně 125 μg je ale podán vždy ihned po zjištění RhD pozitivního statusu dítěte, následně lze dávku v případě potřeby doplnit ve druhé době podle zjištěného množství FMH. Tato varianta je ekonomicky efektivnější, ale organizačně náročnější a méně výhodná pro pacientku.
Podpořeno grantem IGA MZ ČR NS 10311-3/2009, NT 11004-3/2010, NT 12225-4/2011.
Doc. MUDr. Marek Ľubušký, Ph.D.
Porodnicko-gynekologická klinika
Ústav lékařské genetiky a fetální medicíny
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: marek@lubusky.com
Web: www.lubusky.com
Zdroje
1. ACOG – American College of Obstetricians and Gynecologists. Prevention of RhD alloimmunization. ACOG practice bulletin no.4. Washington, DC, 1999.
2. Augustson, BM., Fong, EA., Grey, DE., et al. Postpartum anti-D: can we safely reduce the dose? Med J Aust, 2006, 184 (12), p. 611–613.
3. Crowther, C., Middleton, P. Anti-D administration after childbirth for preventing Rhesus alloimmunisation. The Cochrane Database of Systematic Reviews, 2010, 7 (updated May 2010).
4. Crowther, C., Middleton, P. Anti-D administration in pregnancy for preventing Rhesus alloimmunisation. The Cochrane Database of Systematic Reviews, 2009, 1 (updated Jauary 2009).
5. Dziegiel, MH., Nielsen, LK., Berkowicz, A. Detecting fetomaternal hemorrhage by flow cytometry. Curr Opin Hematol, 2006, 13 (6), p. 490–495.
6. Feldman, N., Skoll, A., Sibai, B. The incidence of significant fetomaternal haemorrhage in patients undergoing cesarean section. Am J Obstet Gynecol, 1990, 163 (3), p. 855–858.
7. Fung Kee Fung, K., Eason, E., Crane, J., et al. Maternal-Fetal Medicine Committee, Genetics Committee. Prevention of Rh alloimmunization. J Obstet Gynaecol Can, 2003, 25 (9), p. 765–773.
8. International Forum: Engelfriet CP, Reesink HW, Judd WJ, Ulander VM, Kuosmanen M, Koskinen S, Rouger P, Morelati F, Tantalo V, Fujii T, de Haas M, van der Schoot CE, Overbeeke M, Koelewijn J, Bonsel G, Vrijkotte T, Zupańska B, Martin-Vega C, Parra Lopez R, de Silva M, Contreras M, Panzer S, Ulm B, Mayr WR. Current status of immunoprophylaxis with anti-D immunoglobulin. Vox Sang, 2003, 85 (4), p. 328–337.
9 Lubusky, M. Prevention of RhD alloimmunization in RhD negative women. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2010, 154 (1), p. 3–8.
10. Lubusky, M., Prochazka, M., Simetka, O., Holuskova, I. Guideline for prevention of RhD alloimmunization in RhD negative women. Ces Gynek, 2010, 75 (4), p. 323–324.
11. Lubusky, M., Simetka, O., Studnickova, M., Ordeltova M. Fetomaternal hemorrhage in normal vaginal delivery and in delivery by cesarean section. Transfusion, 2012, doi: 10.1111/j.1537–2995.2011.03536.x.
12. Moise, KJ. Jr. Prevention of Rh (D) alloimmunization. The UpToDate Database of Systematic Reviews 2011 (updated January 2011). Available from: www.uptodate.com
13. Moise, KJ. Jr. Management of rhesus alloimunization in pregnancy. Obstet Gynecol, 2002, 100 (3), p. 600–611.
14. Ness, PM., Baldwin, ML., Niebyl, JR. Clinical high-risk designation does not predict excess fetal-maternal haemorrhage. Am J Obstet Gynecol, 1987, 156 (1), p. 154–158.
15. Perslev, A., Jorgensen, FS., Nielsen, LK., et al. Fetomaternal hemorrhage in women undergoing elective cesarea section. Acta Obstet Gynecol Scand, in press.
16. RANZCOG – Royal Australian and New Zealand College of Obstetricians and Gynaecologists. Guidelines for the use of RH D Immunoglobulin (Anti-D) in obstetrics in Australia 2007. Available from: www.ranzcog.edu.au/publications/statements/C-obs6.pdf
17. RCOG – Royal College of Obstetrics and Gynaecology. United Kingdom. Green Top Guidelines (Green-top 22). Anti-D Immunoglobulin for Rh Prophylaxis 2002. Available from: http://www.rcog.org.uk/womens-health/clinical-guidance/use-anti-d-immunoglobulin-rh-prophylaxis-green-top-22
18. Scientific Subcommittee of the Australian and New Zealand Society of Blood Transfusion. Guidelines for laboratory assessment of fetomaternal haemorrhage. 1st ed. Sydney: ANZSBT, 2002, p. 3–12.
19. Sebring, E., Polesky, H. Fetomaternal hemorrhage: incidence, risk factors, time of occurence and clinical effects. Transfusion, 1990, 30 (4), p. 344–357.
20. Stedman, CM., Baudin, JC., White, CA., Cooper, ES. Use of the erythrocyte rosette test to screen for excessive fetomaternal hemorrhage in Rh negative women. Am J Obstet Gynecol, 1986, 154 (6), p. 1363–1369.
21. Studnickova, M., Lubusky, M., Ordeltova, M., Prochazka, M. Possibility to identify fetomaternal haemorrgahe. Ces Gynek, 2010, 75 (5), p. 443–446.
22. Urbaniak, S. The clinical application of anti-D prophylaxis. In: Hadley A, Soothill P. Alloimmune disorders of pregnancy: anaemia, thrombocytopenia and neutropenia in the fetus and newborn. Cambridge, UK: Cambridge University Press; 2002. p. 97–120.
23. Uriel, M., Subira, D., Plaza, J., et al. Identification of feto-maternal haemorrhage around labour using flow cytometry immunophenotyping. Eur J Obstet Gynecol Reprod Biol, 2010, 151 (1), p. 20–25.
24. Wylie, BJ., D’Alton, ME. Fetomaternal hemorrhage. Obstet Gynecol, 2010, 115 (5), p. 1039–1051.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Editorial
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2012 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Laparoskopicky asistovaná neoplastika pochvy podle Vecchiettiho
- Vliv aplikace GnRH analog na peroperační a postoperační výsledky myomektomie u žen v reprodukčním věku
- Kryokonzervace ovariální tkáně u onkologických pacientek – 6 let klinických zkušeností
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Nové metody zvyšující úspěšnost asistované reprodukce
- Kortikotropin-releasing hormon a adrenokortikotropní hormon – možné markery některých těhotenských patologií
- Imunoterapie karcinomu ovaria
- Těhotenství a porod zdravého dítěte komplikované koincidencí heterotopické gravidity po IVF a placenty perkrety s následnou hysterektomií
- Fetomaternální hemoragie při porodu císařským řezem
- Medicínské, právní a etické aspekty zachování fertility u onkologických pacientek
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Výskyt trombofilních mutací u žen se závažnými těhotenskými komplikacemi
- Možnosti IVF v nativním cyklu
- Editorial
- Historie a současnost Gynekologicko-porodnické kliniky v Brně
- Screening v 11.–13.+6 týdnu těhotenství
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Možnosti IVF v nativním cyklu
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy






