-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunoterapie karcinomu ovaria
Immunotherapy in ovarian cancer
In the last decade we have witnessed a stormy development in the field of molecular biology, immunology and genetics. Dramatic advances in laboratory and clinical procedures in cellular immunotherapy, along with the development of powerful immunomodulatory agents, created new conditions and opportunities in the treatment of ovarian cancer. The review article provides an overview of the current state of immunotherapy, outlines modern trends in the development of vaccines and immunomodulatory therapies available for immediate clinical testing in cases of advanced ovaria cancer.
Key words:
immunotherapy, vaccines, ovarian cancer.
Autoři: Vít Weinberger
; Luboš Minář
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN Brno, přednosta prof. MUDr. P. Ventruba, DrSc.
Vyšlo v časopise: Ceska Gynekol 2012; 77(2): 145-152
Kategorie: Původní práce
Souhrn
V posledních deseti letech jsme svědky bouřlivého rozvoje na poli molekulární biologie, imunologie a genetiky. Dramatický pokrok v laboratorních a klinických postupech v buněčné imunoterapii spolu s vývojem silných imunomodulačních látek vytvořil nové podmínky a příležitosti v léčbě ovariálního karcinomu. V přehledovém článku je uveden stav současné imunoterapie, jsou nastíněny moderní trendy vývoje očkovacích látek a imunomodulační terapie dostupné k okamžitému klinickému testování v případech pokročilého karcinomu ovaria.
Klíčová slova:
imunoterapie, očkovací látky, karcinom ovaria.ÚVOD
Karcinom ovaria je třetím nejčastějším zhoubným gynekologickým tumorem, má vysokou letalitu a představuje asi 5 % všech nádorů u žen. I přes významné pokroky v chirurgické i nechirurgické léčbě karcinomu ovaria se celkové pětileté přežití zvedlo pouze z 37 % v sedmdesátých letech na 45 % v současnosti [8]. V Evropské unii je incidence ovariálního karcinomu přes 48 000 případů za rok. Ročně umře na tuto diagnózu v zemích EU přes 31 tisíc žen. Vzhledem k intrabdominálnímu umístění obou adnex nepůsobí dlouho jejich případné zvětšení nijaké klinické obtíže a 80 % případů žen s karcinomem ovaria je diagnostikováno ve III. nebo IV. stadiu onemocnění. Většinou jde o náhodný nález zachycený při preventivní rutinní kontrole u ošetřujícího gynekologa. V léčbě karcinomu ovaria je primárně maximální snaha o co nejvíce radikální chirurgický výkon (snaha o nulové makroskopické reziduum nemoci) s následnou chemoterapií založenou na kombinaci platiny a taxanu. Pooperačně je s tímto režimem chemoterapie dosaženo remise v 50–80 % případů. Navzdory velice příznivým výsledkům první linie terapie (chirurgie + I. linie chemoterapie) se dříve nebo později objeví u 60–80 % pacientek recidiva onemocnění. Druhá kompletní remise onemocnění je možná, ale téměř nikdy není trvalá. Míra pravděpodobnosti relapsu se blíží 100 % [9]. Skupina pacientek s velice nepříznivou až infaustní prognózou je charakterizována tím, že onemocnění progreduje během podávání první linie chemoterapie, dále tím, že se recidiva objeví do 6 měsíců od podání poslední chemoterapie založené na platinovém derivátu nebo tím, že celkovou odpověď onemocnění na chemoterapii první linie lze charakterizovat pouze jako „stabilní onemocnění“ („stable desease“).
Imunoterapie nádoru je novým typem léčby a z epidemiologických i klinických dat přibývá poznatků, že ovariální karcinom je možné řadit k imunogenním tumorům. Hlavním smyslem imunoterapie je vybudit imunitní systém pacienta k odpovědi na nádorové buňky, což může být vyvoláno jednak přímou imunizací pacientky – podáním vakcíny, která stimuluje imunitní systém k produkci specifických protilátek proti nádorovým buňkám nebo v podání specifických terapeutických protilátek, které samy o sobě ničí nádorové buňky. Imunitní systém má schopnost rozpoznat antigeny asociované s maligním nádorem a vyvolat specifickou odpověď humorální i buněčné imunity cílenou proti nádorovým buňkám [22].
IMUNOTERAPIE OVARIÁLNÍHO KARCINOMU: HYPOTÉZY
Imunoterapie má za úkol nastartovat imunitní odpověď organismu k eradikaci tumoru včetně mikrometastáz, a mohla by tedy působit i jako prevence relapsu, pokud by byla podávána dlouhodobě jako konsolidační terapie. Imunoterapie jako možnost léčby u ovariálního karcinomu se zakládá na následujících hypotézách:
- buňky ovariálního karcinomu exprimují na svém povrchu antigeny asociované s nádorem, jako jsou HER2/neu [13, 14], MUC-1 [15], OA3 [16], membránový folátový receptor [39], TAG-72 [35], mesothein [19], NY-ESO-1 [30], sialyl-TN [37] a další. Tyto antigeny mohou sloužit potenciálně jako cíle humorální a buněčné imunitní odpovědi;
- přítomnost lymfocytů infiltrujících tumor (TIL) jednoznačně koreluje s délkou přežití [49];
- ovariální karcinom resp. jeho buňky exprimují prostřednictvím hlavního histokompatibilního komplexu (MHC komplex) peptidy a ty jsou nabízeny ke kontrole buňkám imunitního systému – CD8+ T lymfocyty;
- dynamická interakce mezi imunitou pacienta a nádorem ukazuje, že rovnováha mezi těmito dvěma silami může být vykloněna ve prospěch imunity pacientky.
HISTORICKÝ PŘEHLED – SOUČASNOST, PERSPEKTIVY, JE KARCINOM OVARIA IMUNOGENNÍ?
Imunogennost je schopnost antigenu vyvolat imunitní odpověď organismu. Příkladem tradiční klasické vakcíny je očkování proti pravým neštovicím, které vyvolá silnou imunitní reakci organismu, a je tedy prevencí před nákazou. Téměř před 100 lety Paul Ehrlich formuloval svoji teorii o imunitním dozoru, ve které vyslovil domněnku, že nádorové buňky vznikají a jsou eliminovány v organismu denně činností imunitního systému člověka. Tento koncept však nemohl být ve své době ověřen a vědecky prozkoumán, neboť chyběly adekvátní in vitro modely [7]. William Coley v roce 1893 popsal, že někteří pacienti s karcinomem profitovali z bakteriální infekce v tom smyslu, že po jejím odeznění bylo pozorováno zmenšení tumoru [9]. Tento neotřelý a nový poznatek ukázal to, že imunitní systém dokáže rozpoznat antigeny asociované s tumorem. V padesátých letech minulého století vedly další objevy k formulaci hypotézy tzv. protinádorového dohledu – imunosurveillance. Rozhodující důkaz o roli imunitního systému v obraně proti nádorům však poskytly až studie na imunodeficientních myších s afunkčními geny pro přestavbu buněčných receptorů T a B (RAG-/-). Tyto myši, které v důsledku poruch rekombinačních genů RAG1 a RAG2 neměly lymfocyty T a B, vyvinuly chemicky indukované nádory s vyšší frekvencí než jejich imunokompetentní kontroly a také tvořily mnohem více spontánních tumorů. Podobně i množství studií u lidí poskytlo důkazy o asociaci mezi zvýšeným výskytem nádorů a deficitem jednotlivých složek imunitního systému [45]. Na základě poznatků získaných během posledních let při pokusech s RAG deficientními modely myší byl původní koncept imunologického dohledu Dunnem rozvinut a formulován do mnohem komplexnější teorie, tzv. editace nádorů imunitním systémem – cancer immune editing [16]. Imunitní systém se podílí jak na eliminaci nádorových buněk, tak i na postupném tvarování imunogenního fenotypu tumorů, který vede k selekci variant transformovaných buněk schopných uniknout efektorovým mechanismům imunitního systému. Dunn navrhuje rozlišovat tři odlišné úrovně procesu boje imunitního systému proti nádorovým buňkám (obr. 1). Stadium eliminace se překrývá s imunologickým dohledem a vede k aktivaci a indukci efektorových mechanismů imunitního systému, které jsou schopny eradikace nádorově transformovaných buněk. Celý proces zde může skončit nebo přejít do dalších fází. Stadium ekvilibria představuje dynamický rovnovážný proces, kdy imunitní systém kontroluje růst nádoru, nicméně se vlastním selekčním tlakem podílí na postupné tvorbě variant nádorových buněk se zvyšující se schopností přežít útoky efektorových mechanismů. Fáze ustanovení rovnováhy je nejdelší z těchto tří procesů a klinicky se shoduje s preneoplastickým onemocněním, které nejčastěji zůstává nediagnostikované. Výsledkem stadia rovnováhy mohou být tři různé situace: 1. kompletní eliminace nádorových buněk, 2. dlouhodobé, možná stálé udržení dynamické rovnováhy mezi aktivní imunitní odpovědí a vymezenou populací nádorových buněk, 3. únik před kontrolou imunitní reakce a rozvoj klinického onemocnění. Stadium úniku představuje již terminální proces editace, ve kterém imunitním systémem modelované nádorové buňky unikají imunitnímu dohledu a začínají nekontrolovaně expandovat, což vede ke klinické manifestaci. Tato teorie ukazuje, že imunitní systém jen nebrání vývoji primárního karcinomu, ale modeluje a vytváří imunogenicitu tumoru.
Obr. 1. Teorie protinádorového dohledu, editace nádoru imunitním systémem a klinický korelát jednotlivých stadií. Převzato a upraveno podle Dunn a kol. 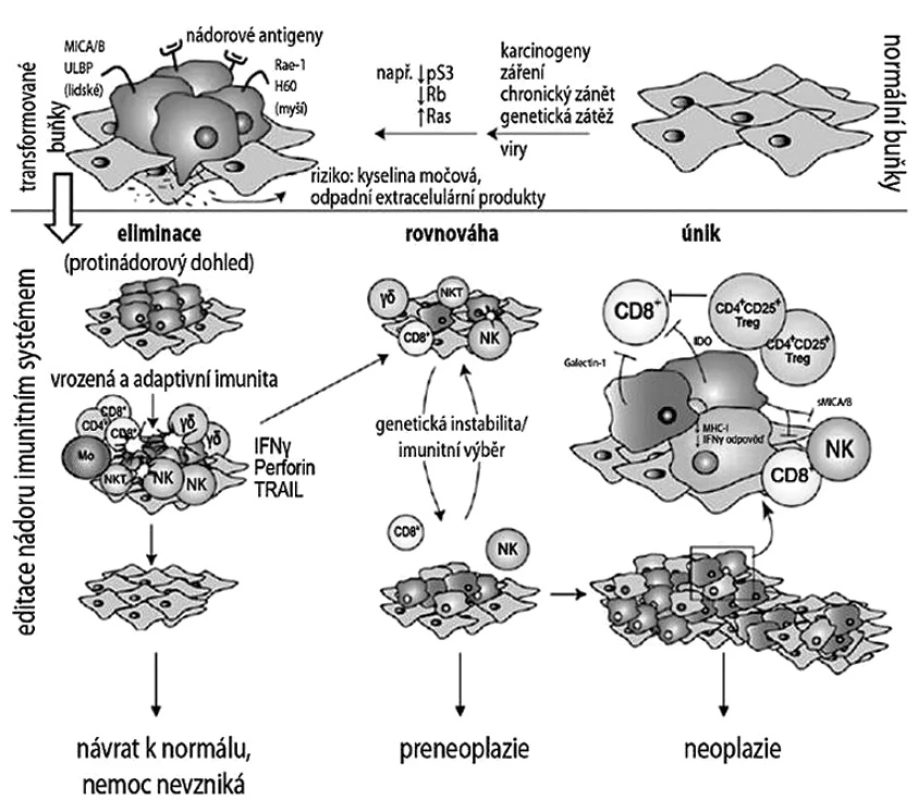
Tumor specifické antigeny (TSA) jsou přítomny pouze na buňkách tumoru, ale ne na žádných jiných buňkách v organismu. S tumorem asociované antigeny (TAA) se vyskytují na povrchu jak normálních buněk organismu, tak i na buňkách tumoru. Moderní klasifikace antigenů je založena na jejich molekulární struktuře a jejich původu.
V současnosti se hledají vhodné antigeny karcinomu ovaria, které by byly dostatečně specifické a imunogenní a vyvolaly by v organismu in vivo nebo v laboratoři in vitro významnou imunitní odpověď ve smyslu masivní produkce na antigen tumoru specifických CD8+ a CD4+ T lymfocytů potřebných k dosažení a zachování remise pacientek. I když se většina studií zaměřených na vakcinaci nádorů zabývala vyvoláním produkce na antigen tumoru specifických CD8+ T-buněk, je nyní popisována vrůstající role CD4+ T-buněk, které hrají zcela zásadní roli v organizaci imunitní odpovědi. Pestrost rolí antigen specifických CD4+ T-buněk zahrnuje obstarání pomoci CD8+ T-buňkám během primární a sekundární imunitní odpovědi, přímou cytolýzu tumoru a aktivaci lymfocytů B k produkci proti tumoru specifických protilátek [38].
ROLE IMUNITNÍHO SYSTÉMU V BOJI PROTI KARCINOMU OVARIA A JEJÍ KLINICKÝ DOPAD
U některých pacientek s diagnostikovaným ovariálním karcinomem byla prokázána spontánní imunitní odpověď na rakovinné bujení. V periferní krvi těchto pacientek byly detekovány tumorem aktivované T-lymfocyty a specifické protilátky [10, 11]. Z tumoru a ascitu byly izolovány oligoklonální tumorem aktivované T-lymfocyty. Dosud nebyly charakterizovány specifické antigeny ovariálního karcinomu, které by vyvolaly imunitní odpověď organismu ve smyslu úplného potlačení tumoru, ale je známo velké množství s tumorem asociovaných antigenů, které byly detekovány v periferní krvi a bylo popsáno množství s tumorem asociovaných lymfocytů. Recentně publikované práce poukazují i na korelaci celkové prognózy pacientů s množstvím tumor infiltrujících lymfocytů (TIL) nebo frekvencí T-regulačních buněk (Treg) [31].
Antigeny asociované s karcinomem ovaria
Jsou následující: s mozečkovou degenerací asociovaný protein cdr2; p53; HER2/neu mesothelin; folátový receptor alfa; antigeny tesikulárního karcinomu, jako je NY-ESO-1, MAGE člen rodiny melanomových antigenů, protein povrchu spermií Sp-17; muciny nebo glykoproteidy jako Lewis; tumor antigen CA-125 (MUC-16) a MUC-1; univerzální antigeny tumoru, jako jsou survivin a lidské telomerázové reverzní transkriptázy a další [23].
Antigeny karcinomu varlat (cancer testis antigen) jsou jedinečnou třídou antigenů, které představují vysokou úroveň exprese fyziologicky pouze v mužských testikulárních buňkách. Nevyskytují se v jiných buňkách tkání dospělého jedince. Z výsledků molekulárních výzkumů byla detekována různě významná exprese antigenů rakoviny varlat u velkého množství typů zhoubných nádorů, a tato skupina je tedy dobrým kandidátem i pro imunoterapii karcinomu ovaria. U karcinomu ovaria je mezi cancer testis antigeny jako nevíce slibný popisován antigen „NY-ESO-1“. Je z nich nejvíce imunogenní, a proto se jeví jako slibný cíl imunoterapie u serózního ovariálního karcinomu. Je exprimován u více než 40 % pokročilého epiteliálního ovariálního nádoru. Diefenbach a kolektiv uskutečnili studii fáze I a zkoumali efekt vakcinace antigenem NY-ESO-1b u pacientek s vysokou pravděpodobností remise ovariálního karcinomu. Vakcína založená na NY ESO-1 peptidu se ukázala bezpečnou a indukovala T buněčnou specifickou odpověď jak u NY-ESO-1 pozitivních, tak u NY-ESO-1 negativních pacientek [13].
NY-ESO-1 je v dobrém slova smyslu antigen, který je dostatečně imunogenní, nicméně je exprimován pouze ve 30 % ovariálních karcinomů, což ukazuje na limitaci a nedostatečnost monovalentních vakcín. U jedné pacientky byla popsána kompletní remise po podání NY ESO-1 vakcíny, ale objevila se recidiva, kde se již na povrchu nádorových buněk antigen NY-ESO-1 nevyskytoval, což dokumentuje flexibilitu nádoru, schopnost nádorových buněk se přizpůsobit a i po iniciální dobré protinádorové odpovědi na terapii způsobit recidivu.
Lymfocyty asociované s tumorem
První studie užívající lymfocyty infiltrující tumor (TIL) byly publikovány v 80. a na začátku 90. let (melanom) výsledky ukazovaly dobrou protinádorovou odpověď, i když bez významnějšího efektu na délku přežití. V současných pilotních klinických studiích bylo prokázáno, že skupiny pacientek, které dostaly adjuvantní imunoterapii po standardní debulking chirurgii a standardní chemoterapii založené na cisplatině, vykazovaly delší přežití [40, 41]. Ve studii s pacientkami ve III. stadiu karcinomu ovaria byla ustanovena skupina pacientek (n=13), která po ukončení chemoterapii dostala expandované TIL. Celkové přežití po 3 letech bylo v této skupině 100 %. Druhá skupina pacientek (n=10) nedostala adjuvantní imunoterapii a celkové přežití ve skupině bylo 67,5 %. Po třech letech bylo ve skupině s imunoterapií bez projevů nemoci 82,1 % a 54,5 % ve skupině bez adjuvantní imunoterapie. Tyto výsledky jsou limitovány velikostí souboru, ale přesto podporují vhodnost tohoto typu imunoterapie. Část pacientů není vhodná k terapii adoptivními TIL, neboť buď nelze získat vzorek nádoru (pacientky jsou inoperabilní), nebo neobsahuje žádné TIL.
Výzvou inženýrství je uměle přinutit T-lymfocyty, aby získaly protinádorovou specifitu. To může být provedeno nasměrováním lymfocytů k expresi klonovaného T-buněčného receptoru (TCR), který bude mít vysokou afinitou k epitopům asociovaným s tumorem [47].
T-lymfocyty infiltrující tumor (TIL)
Přítomnost T-lymfocytů infiltrujících nádor koreluje s klinickým výstupem resp. celkovým přežitím pacientek [2]. Zhan a kolektiv (2003) provedli imunohistochemickou analýzu a zkoumali přítomnost TIL v 186 vzorcích karcinomu ovaria ve stadiu III a IV a zjišťovali klinický výstup této informace. V této studii byly TIL detekovány ve 102 ze 186 vzorků (54,8 %), přičemž TIL nebyly detekovány v 72 případech (38,7 %), 12 tumorů nemohlo být zhodnoceno. Data z imunohistochemie ukazují, že CD 4+ a CD 8+ T-lymfocyty jsou v tumoru obsaženy vždy společně, nebo naopak chybí zcela. U pacientů s prokázanou přítomností TIL je 5leté přežití 38 %, naopak u těch, kde nejsou lymfocyty přítomny, klesá přežití na 4,5 %. Pětiletý interval bez nemoci je u pacientek s TIL 31 %, u druhé skupiny 8,7 %. V analýze se ukázalo, že přítomnost TIL a velikost reziduálního tumoru korelují s celkovým přežitím a intervalem do progrese. Naopak grade tumoru a typ první linie chemoterapie nemění výsledky těchto ukazatelů [2]. Jiné studie potvrdily, že počet TIL je signifikantní prognostický faktor v celkovém přežití. Tomšová a kolektiv toto dokumentovaly na souboru 1056 pacientek s TIL [46]. T-buňky se paradoxně nacházely více a častěji v tumoru s vysokou proliferací, což dokumentuje, že lepší výsledek není dán indolentním chováním nádorových buněk [3–7].
T-regulátorové buňky (Treg)
Byly učiněny významné kroky v porozumění imunitní odpovědi a reakci organismu na nádorové bujení. Byly objeveny specifické subpopulace buněk T, které odpovídají za imunosupresi, a tím zhoršují prognózu pacientky s ovariálním karcinomem. Treg (T-regulátorové) buňky byly jako první objeveny právě v tkáni karcinomu ovaria. Zvýšená incidence Treg buněk předpovídá špatnou odpověď nádoru na léčbu [19]. Je popsána spousta receptorů, jejichž přítomnost či nepřítomnost v nádoru znamená ve skutečnosti snížení či zvýšení specifické imunitní odpovědi na nádorové bujení v organismu [47, 48]. Vzájemná regulace imunitní odpovědi má mnoho rovin a jejich propojení je neustále součástí základního výzkumu v této oblasti.
Adoptivní T-buněčná terapie (adoptive T cell therapy)
Efektivní imunoterapie nádoru je závislá na přítomnosti vysokého počtu lymfocytů s adekvátním navedením na cíl a vysokou funkčností, která jim umožní najít a zničit nádorové buňky in vivo. „Adoptive T cell therapy“ je léčebná strategie umožňující aktivaci a expanzi protinádorově reaktivních specifických lymfocytů ex vivo (bez přítomnosti endogenních regulačních mechanismů) a jejich následnou autologní infuzi [17]. Tento nový přístup pro léčbu pacientů s nádorovými chorobami se rozvíjí díky velkému pokroku a novým znalostem o imunitní odpovědi, efektorové buněčné funkci a novým informacím v oblasti molekulární biologie a buněčné imunologie. Klíčovým pokrokem je objasnění antigenního základu, nádorového rozpoznání a následné destrukce nádorových buněk. U adoptivní terapie existuje obecně přímý vztah mezi množstvím transferovaných nádorově specifických CD 8+ T-lymfocytů a účinností léčby [15] . Efekt terapie lze zvýšit navozením imunosuprese pacienta před podáním T-lymfocytů a současně s T-lymfocyty lze podávat také IL-2. V porovnání s lymfocyty periferní krve se již prokázala větší účinnost TIL v adoptivní imunoterapii. K expanzi se používá vysoká koncentrace IL-2, který je růstovým faktorem T-lymfocytů a jehož přítomnost prodlužuje délku trvání buněčné odpovědi a pozitivně ovlivňuje efektivitu adoptivní terapie.
Možnosti imunitní manipulace využívané adoptivní T buněčnou terapií
Obecně existují tři způsoby využívané adoptivní terapií pro ovlivnění imunitního systému. Tyto metody mohou být teoreticky použity pro léčbu pacienta s jakoukoliv nádorovou charakteristikou a mohou být kombinovány.
- a) Selekce vysoce afinitních reaktivních TIL s optimální charakteristikou, produkujících vysoké hladiny IFN-γ. TIL jsou získány založením několika nezávislých TIL linií a zkoušeny na rozpoznání nádorových buněk. Nejaktivnější TIL jsou identifikovány metodou ELISA, selektovány a dále expandovány.
- b) Rychlá expanze lymfocytů ex vivo umožňuje obejít imunitní regulační mechanismy a vyhnout se možnému supresivnímu vlivu nádorového prostředí. TIL pro léčbu pacientů s nádorem jsou rychle expandovány anti-CD3 protilátkami s přídavkem exogenně podávaného IL-2 a ozářených alogenních mononukleárů z periferní krve (feeder cells).
- c) Pacienti mohou podstoupit systémovou imunosupresi (např. radiační a cytostatická léčba).
KLINICKÉ STUDIE ZABÝVAJÍCÍ SE IMUNOTERAPIÍ OVARIÁLNÍHO KARCINOMU – AKTUÁLNÍ PŘEHLED, MOŽNOSTI
Dnešní imunologická léčba karcinomu ovaria mimo jiné zahrnuje léčbu protilátkami. Příkladem jsou protilátky proti CA125 a idiotopickým antigenům, peptidové a cytokinové vakcíny, vakcíny z denritických buněk, vakcíny proteinů tepelného šoku a aktivní imunizace geny resp. antigeny celého tumoru, Tyto všechny modality jsou v různých stadiích klinických studií, zatím nejsou součástí standardní léčby (tab. 1).
Tab. 1. Přehled aktuálních možností imunoterapie v rámci klinických studií 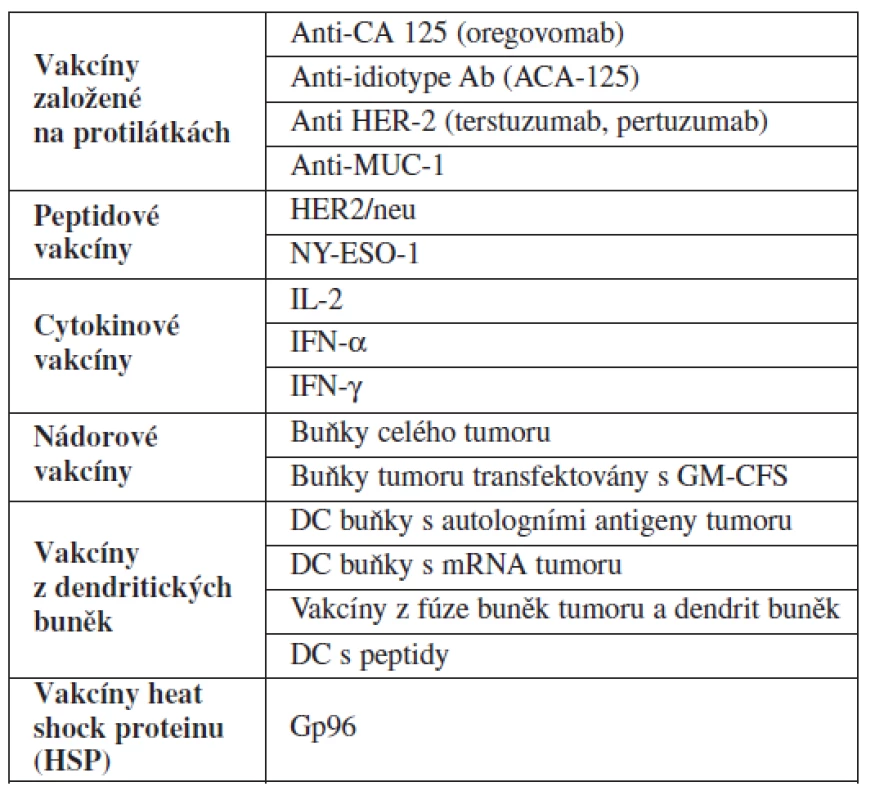
Stejně jako u dalších zhoubných nádorů se ukázalo i u ovariálního karcinomu, že u pacientek s pokročilým karcinomem je efekt vakcín v monoterapii limitovaný. Aktuálně se hledají optimální antigeny, které budou dostatečně kvalitativně i kvantitativně imunogenní, což bude prokázáno i in vivo. Celosvětově existují studie (tab. 2), které poukazují na delší přežití pacientek léčených experimentálně specifickými protilátkami proti různým antigenům tumoru. Některé výsledky v této oblasti jsou povzbudivé. Hlavní limitací vakcín u ovariálního karcinomu je nedostatek charakteristických antigenů a molekulární heterogenita nádoru.
Tab. 2. Tabulka shrnující výsledky a limitace imunoterapie ovariálního karcinomu 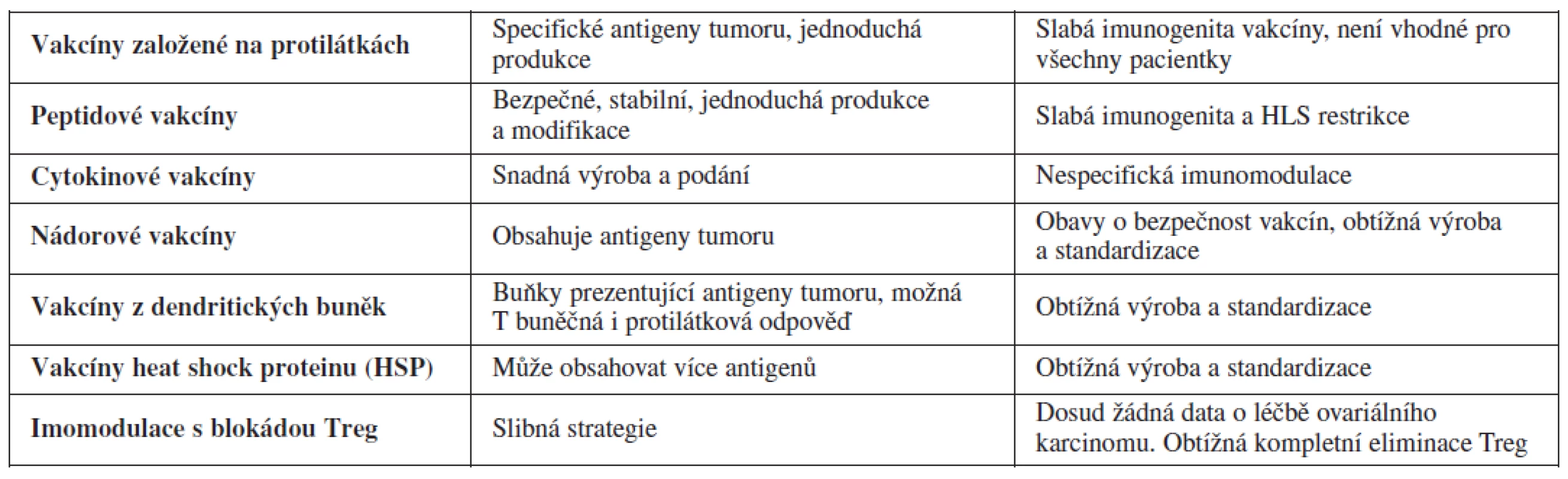
Vakcíny založené na protilátkách
Tento způsob léčby zhoubných nádorů je standardem v léčbě lymfomů a jiných nádorů. Bas a jeho kolektiv v roce 1981 poprvé popsali a identifikovali antigen CA 125. Je znám i jako MUC-16, patří mezi nejvíce zkoumaný antigen [3]. CA 125 je povrchový glykoproteinový antigen, který je elevovaný u 79 % všech pacientek s ovariálním karcinomem [34] a v 95 % u pacientek ve stadiu III a IV [4].
Oregovomab je myší monoklonální protilátka, která se váže na glykoprotein CA 125 s vysokou afinitou a může indukovat jak odpověď humorální, tak buněčné imunity. Ehlen a kolektiv provedli pilotní studii fáze II zkoumající imunologický a klinický efekt léčby Oregovomabem u pacientek s rekurentním ovariálním karcinomem [25]. U více než 50 % pacientek bylo dosaženo imunitní odpovědi ve smyslu produkce protilátek proti CA 125 a produkce T specifických lymfocytů. U tří pacientek ze 13 se nemoc stabilizovala a celkové přežití bylo delší než 2 roky. V další studii fáze II u 20 pacientek s rekurentním ovariálním karcinomem byla podána standardní chemoterapie v kombinaci s Oregovomabem.
Výsledkem bylo dosažení humorální odpovědi včetně tvorby protilátek proti oregovomabu u 15 z 19 pacientek (79 %). Pacientky, u nichž byla prokázána T-lymfocytární imunitní odpověď, vykazovaly statisticky významně delší přežití.
Abagovomab (dříve ACA 125) je myší anti-idiotopická monoklonální protilátka, jejíž variabilní epitop odráží antigen CA 125, který se vyskytuje s vysokou expresí u karcinomu ovaria. Abagovomab se neváže přímo na CA 125, ale funguje jako tzv. náhradní antigen, který umožňuje, aby imunitní systém rozpoznal a zničil buňky, jež na svém povrchu nesou antigen CA 125 [32]. Do studie fáze II bylo zahrnuto 119 pacientek s pokročilým ovariálním karcinomem, které byly léčeny Abagovomabem [33]. U 70 % pacientek byla prokázána imunitní odpověď. V této skupině žen vedla léčba k prodloužení celkového přežití (23,4 měsíce oproti 4,9 měsíce). Vakcína nevykazovala během terapie žádné zásadní vedlejší účinky.
HMFG1 je myší monoklonální protilátka se specifitou k MUC-1. MUC-1 je buněčný povrchový glykoprotein exprimován u více než 90 % epiteliálních nádorů ovaria a jiných tumorů. Do studie fáze II bylo zahrnuto 52 pacientek s pokročilým ovariálním karcinomem, kde byla ke standardní léčbě spočívající v chirurgii a následné chemoterapii podána monoklonální protilátka HMFG1 intraperitoneálně. Po ukončení takovéto léčby vykazovalo 21 pacientek z 52 kompletní léčebnou odpověď bez známek reziduální choroby [21].
Peptidové vakcíny
Užití peptidů jako imunogenů pro imunoterapii má mnoho výhod. Peptidy jsou výborně popsanou a definovanou skupinou proteinů. Možnost záměny či ovlivnění normálních proteinů vyskytujících se v buňkách je minimální. Navíc peptidové antigeny jsou lehce vyrobitelné, stabilní, a mohou být lehce modifikovány ke zvýšení jejich imunogennosti. Peptidové vakcíny mají bohužel samy o sobě malou imunogennost a je nutné je podávat společně s adjuvantními látkami, jako je GM-CFS (granulocyty-makrofágy-kolonie stimulující faktor). GM-CFS je secernován makrofágy, mastocyty, endoteliálními buňkami a fibroblasty. Jde o vytokan, působí jako růstový faktor bílých krvinek a jeho hlavní funkcí je stimulace kmenových buněk k produkci granulocytů (neutrolily, eozinofily a bazofily a monocyty). Disis a její kolegové uskutečnili studii fáze I a II užívající HER2 derivované peptidy pro léčbu pacientek s tumorem s overexpresí HER2. Podařila se vygenerovat konzistentní odpověď HER2 specifických T-lymfocytů. Rozsah imunitní odpovědi T-lymfocytů se zdá být v korelaci s klinickou odpovědí pacientek [13].
Cytokinové vakcíny
Exogenně dodané cytokiny regulují imunitní reakci. Dokážou maximalizovat indukci a amplifikaci imunitní odpovědi. Byly testovány kombinace cytokinů a chemoterapeutických agens proti ovariálnímu karcinomu. Schmeler a kolektiv publikovali výsledky dokončené studie fáze II, kdy hodnotili efekt a toxicitu léčby spočívající v podání karboplatiny, granulocyty-makrofágy-kolonie stimulujícího faktoru (GM-CFS) a rekombinantního interferonu gama 1b (IFN-γ 1b) s rekurentním a platina senzitivním nádorem vaječníku, tuby nebo primárním peritoenálním karcinomem [40]. Vhodné pacientky byly léčeny GM-CFS nebo interferonem gama 1b před aplikací i po aplikaci karboplatiny, a to do doby progrese nebo objevení se toxických příznaků léčby. Všechny pacientky zařazené do studie měly nález recidivy tumoru verifikovaný zobrazovací metodou a interval bez chemoterapie byl delší než 6 měsíců. Celkově bylo zařazeno 59 pacientek. Medián počtu cyklů chemoterapií byl 6. Průměrný věk pacientek v době zahájení studie byl 61 let. Medián času progrese choroby před zařazením do studie byl 11 měsíců. Z 54 hodnocených pacientek se jich 9 dostalo do kompletní remise (17 %), u 21 (39 %) pacientek byla léčba hodnocena jako parciální odpověď, u 24 (44 %) byla progrese při léčbě. Medián „folow up“ byl 6,4 měsíce, medián času do progrese 6 měsíců. Nejčastějším nežádoucím účinkem byla suprese hematopoezy, alergie na karboplatinu a celková slabost. Je obtížné zhodnotit efekt léčby této klinické studie fáze II, k jasných závěrům jsou nutné další studie a výzkum.
Nádorové vakcíny
V případech, kdy nejsou známé specifické antigeny tumoru, je variantou volby tvorba vakcín z buněk celého tumoru. Tím je zajištěno velké množství antigenů, proti nimž může organismus zamířit svoji imunitní odpověď. Nevýhodou ovšem je, že buňky nádoru jsou jen málo imunogenní, a to díky neschopnosti vytvořit dostatečně silné signály, které by mohly stimulovat imunitu. Za účelem zvýšení imunogennosti je nutné vakcínu z buněk tumoru přidružit ke specifickému „adjuvans“. Berd a kolektiv zkoumali ve studii fázi I hapten, dinitrophenyl (DNP) navázaný na autologní buňky tumoru. Po aplikaci této vakcíny byly pozorovány zánětlivé změny metastáz. Histologicky byla prokázána infiltrace tumoru T-lymfocyty CD8+ [5]. Další skupiny vědců se pokoušely zmodifikovat vakcínu buněk nádoru tím, že dodali GM-CFS přímo do buněk tumoru. Vakcíny s vysokým podílem tvorby GM-CFS měly významně větší účinek resp. pacientky delší celkové přežití, medián 17 měsíců oproti 7 měsícům [29].
Alternativou pro tvorbu protilátek proti tumoru jsou vakcíny specificky namířené proti antigenům celého tumoru, vytvořené z buněk tumoru, autologního lyzátu tumoru nebo z RNA tumoru. Výhodou těchto vakcín je možnost indukovat imunitní odpověď na omezený a osobou specifikovaný počet antigenů, a tím se minimalizuje možnost, že si tumor vytvoří jiné varianty antigenů, které uniknou imunitnímu systému před jejich zničením [36].
Metanalýza 173 publikovaných imunoterapeutických studií (melanom, hepatocelulární karcinom, ca plic, prostaty, děložního hrdla a ovaria), které užívaly buď molekulárně definované syntetické antigeny (1711 pacientů), nebo antigeny celého tumoru (autologní nebo alogenní buňky tumoru, dendritické buňky aktivované extraktem tumoru nebo jeho mRNA), ukázala, že 8,1 % pacientů vakcinovaných antigeny celého tumoru a 3,6 % pacientů vakcinovaných molekulárně definovanými antigeny mělo klinicky prokazatelnou odpověď na imunoterapii.
Některé pracovní skupiny a výsledky studií ukazují, že je možné zvýšit imunogennost vakcíny tím, že vakcína je infikovaná virem, např. chřipky nebo herpes simplex virem. Tyto vakcíny vyvolají mocnou imunitní odpověď (bylo prokázáno na myších modelech).
Jiným alternativním přístupem, jak dodat do organismu antigeny celého tumoru, je užití dendritických buněk. Dendritické buňky se do budoucna mohou stát významným prostředkem k protinádorové léčbě, neboť by se speciálním způsobem aktivované dendritické buňky vložily do pacienta a spustily by zde boj proti nádorovým buňkám. V pilotní studii, kde byly použity dendritické buňky aktivované autologním lyzátem antigenů tumoru, dosáhly 3 pacientky ze 6 kompletní remise a jejich „progresion free interval“ postvakcinačně byl delší než interval, který dosáhly po první linii chemoterapie do progrese. Principem je fúze autologních dendritických buňek s buňkami tumoru, což umožní, že celý antigenní repertoár tumoru je předložen CD4+ CD8+ lymfocytům a je indukována cytotoxická protinádorová imunitní reakce. I když vakcíny z celého tumoru nabízejí mnoho výhod, vyskytují se některé problémy. U některých pacientek může být problém se získáním dostatečného množství tkáně tumoru kvůli kontraindikaci k chirurgickému výkonu. Alternativou pro tyto případy je užití alogenních buněčných linií nebo mRNA tumoru. Další obavou je, že s vakcinací z buněk celého tumoru bude zároveň podáno množství antigenů, které však mohou vyvolat naopak slabou imunitní odpověď, nebo dokonce vyvolají imunitní toleranci k tumoru místo cytotoxické odpovědi lymfocytů.
Vakcíny z dendritických buněk
Dendritické buňky tvoří malou část bílých krvinek v krvi a tkáních. Představují čekající „strážce“ v různých tkáních. Vznikají jako ostatní imunitní buňky z hematopoetické kmenové buňky. Dendritické buňky jsou charakteristické tím, že na svém povrchu prezentují antigeny, které jsou důležité pro kontrolu primární i sekundární imunitní odpovědi na různé exogenní antigeny [2, 43]. Hrají významnou roli ve vytvoření protinádorové imunity a autoimunity [12, 26, 44]. Dendritické buňky mají potenciál indukovat antigen specifickou protinádorovou imunitu, proto byly zkoumány v několika klinických studiích. Gong a kolektiv studoval dendritické buňky, které fúzovaly s buňkami ovariálního karcinomu [18]. Výsledkem studie bylo zjištění, že takto fúzované buňky byly funkční a vyvolaly díky hlavnímu histokompatibilnímu komplexu (MHC) proliferaci autologních T-lymfocytů, indukovaly cytolytickou aktivitu T-lymfocytů a lýzu autologních buněk nádoru) [1]. Brossart a kolektiv léčili pacientky s pokročilým karcinomem ovaria a prsu dendritickými buňkami, které fúzovaly s HER2/neu nebo MUC-1 derivovanými peptidy. V 5 případech z 10 (50 %) byly vygenerovány specifické cytotoxické T-lymfocyty (CTLs). Dendritické buňky se do budoucna mohou stát významným prostředkem k protinádorové léčbě, neboť by se speciálním způsobem aktivované dendritické buňky vložily do pacienta a spustily zde boj proti nádorovým buňkám. Vakcíny z dendritických buněk jsou dobře tolerovány a vykazují minimum nežádoucích účinků [7].
Vakcíny heat shock proteinu (HSP)
Protein teplotní šok je označení pro skupinu proteinů, které zajišťují univerzální stresovou odpověď buňky, např. při vysoké teplotě, extrémním pH, proti chemikáliím. Vážou se na nesbalené proteiny, chrání je či pomáhají jejich sbalení (chaperonová aktivita) [25]. U člověka se obvykle dělí do tří skupin, HSP60, HSP70 a HSP90, a to podle jejich velikosti. Mnoho savčích proteinů tepelného šoku je možno izolovat cíleně z tumoru, potom vyvolávají specifickou imunitní odpověď. Stejný princip funguje při napadení organismu jakoukoliv infekcí, např. virem [24, 46]. Imunitní odpověď je v každém případě specifická pro daného pacienta. Bylo provedeno mnoho klinických studií za účelem zjištění, zda jsou HSP schopny vyvolat specifickou protinádorovou odpověď. Efekt HSP proti širokému spektru karcinomů jak u lidí tak u zvířat je podmíněn následujícími vlastnostmi:
1. HSP izolované z buněk tumoru, i když jsou samy o sobě imunologicky chudé a homogenní, jsou navázány na široké spektrum peptidů, které zahrnují i antigeny specifické pro daný tumor. HSP izolované z buňky tumoru mohou tedy obsahovat celý soubor antigenních peptidů tumoru [42]
2. HSP-peptidový komplex může reagovat s receptorovou molekulou CD91 na povrchu dendritické buňky [51]. Tyto komplexy jsou rozpoznány dendritickými buňkami, ty je díky spojení s hlavním histokompatibilním komplexem dále nabízejí imunitnímu systému k akci. MHC-I peptidové komplexy stimulují naivní CD8+ T-buňky, které zprostředkují antitumorózní imunitní odpověď
3. HSP-DC interakce rovněž vede k aktivaci dendritických buněk. Díky jejich aktivaci vzniká celá řada proinflamatorních cytokinů, které jsou důležité k aktivaci T buněčné imunitní odpovědi [42]. Uskutečnila se studie, kdy byla zkoumána v konsolidační fázi terapie role proteinu teplotního šoku pg96-peptidového komplexu z autologních buněk karcinomu ovaria v léčbě pacientek ve III. a IV. stadiu onemocnění. Pacientkám, které ukončily standardní terapii bez známek progrese choroby, byla podána vakcína. Celkem 7 pacientek (6 se stadiem III a 1 se stadiem IV) obdrželo gp96 injekci v intervalu 1x týdně po dobu 8 týdnů. Grade II nebo vyšší toxicita nebyla pozorována. Známky autoimunity nebyly pozorovány. U 5 pacientek byla nalezena vyšší produkce INF gama v periferní krvi a 6 ze 7 pacientek mělo vzestup NK buněk
ZÁVĚR A PERSPEKTIVY A VÝZVY
I když bylo zkoušeno a zkoumáno mnoho imunoterapeutických přístupů a modalit v imunologické léčbě ovariálního karcinomu, žádný není dosud standardní klinickou terapeutickou praxí. Největší limitace vakcinace ovariálního karcinomu nyní pochází z neschopnosti vyvolat rychlou a drtivou T buněčnou odpověď, která je nutná k odstranění celého již existujícího tumoru. Potenciálním řešením do budoucna je kombinace s imunomodulačními látkami, které způsobí to, že nebude nutná aktivace tak velkého počtu T-lymfocytů k odstranění tumoru. Například bylo prokázáno, že imunomodulací – blokádou genu pro endotelin B-receptor, se výrazně zvýšila účinnost slabých vakcín, tím že se oslabila inhibiční funkce endotelu nádoru a navedením T-buněk do tumoru. Do budoucna bude důležité odstranění T regulačních lymfocytů (Treg) k potenciaci účinku vakcíny. Diagnóza karcinomu v jakémkoliv, byť nejnižším stadiu, znamená, že nádorové buňky již unikly imunitnímu systému kontroly a v organismu proběhly fáze „eliminace“ a „rovnováhy“. Další imunitní reakce je neefektivní. Tumor vyvolá neadekvátnost a bezzubost imunitního systému organismu proti nádoru a jeho imunologickou toleranci. Tento stav je dán mimo jiné přítomností Treg buněk v tumoru, celkovou imunosupresí při nádorovém onemocněním způsobenou cytokiny produkovanými tumorem, down regulací MHC komplexu třídy I na buňkách tumoru. Myeloidní supresorové buňky a s tumorem asociované makrofágy rovněž vytvářejí celkově imunosupresivní prostředí, které vede k potlačení T buněčné odpovědi [27, 41, 28]. Pokud chceme najít lék, jak imunologickou terapii uvést ze základního výzkumu do běžné denní klinické praxe, musíme nejprve zničit tyto imunologické průlomy a nastartovat účinnou imunitní odpověď organismu. Musí být zvažovány kombinované imunoterapuetické přístupy, jednotlivé samostatné modality nejsou dostatečně efektivní a v léčbě karcinomu ovaria jsou neúčelné. Další důležitou otázkou je, v jakém schématu má být imunoterapie zakomponována do standardní léčby. Chirurgie a chemoterapie jsou totiž rovněž modality léčby, které jsou za určitých okolností samy o sobě imunosupresivní [6, 20], a tudíž velice obtížně zkombinovatelné s imunoterapií. Nasazení imunoterapie bude nejspíše vhodné až po ukončení standardního léčebného protokolu. Otázkou je, zda imunoterapii nezařadit ještě před standardní léčbu. Tato idea a úvaha je založena na premise, že antigen specifické paměťové buňky mohou dobře přečkat konvenční podání chemoterapie. Dále je třeba se soustředit na hledání biomarkerů, které by se staly detektorem časných stadií karcinomu ovaria, které by mohly určit jeho prognózu a které by ukazovaly na možnost individuální léčby. Sérová proteomika mohou nalézt časné biomarkery v krvi pacientek, tkáňová proteomika mohou pomoci nalézt individuální cíle léčby. Vše bude záležet na úzké spolupráci kliniků a vědců celosvětově a na rozhodnutí národních ústavů kontrolující léčiva v povolování novinek do klinických zkoušek.
MUDr. Vít Weinberger
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
625 00 Brno
e-mail: vweinberger@fnbrno.cz
Zdroje
1. Aoki, Y., Takakuwa, K., Kodama, S., et al. Use of adoptive transfer of tumor-infiltrating lymphocytes alone or in combination with cisplatin-containing chemotherapy in patients with epithelial ovaria cancer. Cancer Res, 1991, 51, p. 1934–1939.
2. Banchereau, J., Steinman, RM. Dendritic cells and the control of immunity. Nature, 1998, 392, p. 245–252.
3. Bast, RC. Jr, Feeney, M., Lazarus, H., et al. Reaktivity of a monoclonal antibody with human ovarian carcinoma. J Clin Incest, 1981, 68, p. 1331–1337.
4. Bast, RC. Jr, Siegal, FP., Runowicz, C., et al. Elevation of serum CA 125 prior to diagnosis of an epithelial ovarian carcinoma. Gynecol Oncol, 1985, 22, p. 115–120.
5. Berd, D., Kairys, J., Dunton, C., et al. Autologous, hapten-modified vaccine as a treatment for human cancers. Semin Oncol, 1998, 25, p. 646–653.
6. Brune, IB., Wilke, W., Hensler, T., et al. Downregulation of T helper type 1 immune response and altered pro-inflammatory and antiinflammatory T cell cytokine balance following conventional but not laparoscopic surgery. Am J Surg, 1999, 177, p. 55–60.
7. Brossart, P., Wirths, S., Stuhler, G., et al. Induction of cytotoxic T-lymphocyte responses in vivo after vaccinations with peptide-pulsed dendritic cells. Blood, 2000, 96, p. 3102–3108.
8. Bukowski, RM., Ozols, RF., Markman, M. The management of recurrent ovarian cancer. Semin Oncol, 2007, 34, p. S1–15.
9. Coley, WB. The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. 1893. Clin Orthop Relat Res, 1991, 3–11.
10. Coliva, A., Zacchetti, A., Luison, E., et al. 90Y Labeling of monoclonal antibody MOv18 and preclinical validation for radioimmunotherapy of human ovarian carcinomas. Cancer Immunol.
11. Curiel, TJ., Coukos, G., Zou, L., et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med, 2004, 10, p. 942–949.
12. Dhodapkar, MV., Dhodapkar, KM., Palucka, AK. Interactions of tumor cells with dendritic cells: balancing immunity and tolerance. Cell Death Digger, 2008, 15, p. 39–50.
13. Diefenbach, CS., Gnjatic, S., Sabbatini, P., et al. Safety and immunogenicity study of NY-ESO-1b peptide and montanide ISA-51 vaccination of patients with epithelial ovarian cancer in high-risk first remission. Clin Cancer Res, 2008, 14, p. 2740–2748.
14. Disis, ML., Gooley, TA., Rinn, K., et al. Generation of T-cell immunity to the HER2/neu protein after active immunization with HER2/neu peptide-based vaccines. J Clin Oncol, 2002, 20, p. 2624–2632.
15. Dudley, ME., Wunderlich, JR., Yang, JC., et al. Adoptive cell transfer therapy following nonmyeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J Clin Oncol, 2005, 23, p. 2346–2357.
16. Kenemans, P. CA 125 and OA 3 as target antigens for immunodiagnosis and immunotherapy in ovarian cancer. Eur J Obstet Gynecol Reprod Biol, 1990, 36, p. 221-228.
17. Fujita, K., Ikarashi, H., Takakuwa, K., et al. Prolonged disease-free period in patients with advanced epithelial ovarian cancer after adoptive transfer of tumor-infiltrating lymphocytes. Clin Cancer Res, 1995, 1, p. 501–507.
18. Gong, J., Nikrui, N., Chen, D., et al. Fusions of human ovarian carcinoma cells with autologous or allogeneic dendritic cells induce antitumor immunity. J Immunol, 2000, 165, p. 1705–1711.
19. Goodell, V., Salazar, LG., Urban, N., et al. Antipody immunity to the p53 oncogenic protein is a prognostic indicator in ovarian cancer. J Clin Oncol, 2006, 24, p. 762–768.
20. Hensler, T., Hecker, H., Heeg, K., et al. Distinct mechanisms of immunosuppression as a consequence of major surgery. Infect Immun, 1997, 65, p. 2283–2291.
21. Hird, V., Maraveyas, A., Snook, D., et al. Adjuvant therapy of ovarian cancer with radioactive monoclonal antibody. Br J Cancer, 1993, 68, p. 403–406.
22. Chu, CS., Kim, SH., June, CH., Coukos, G. Immunotherapy opportunities in ovarian cancer. Expert Rev Anticancer Ther, 2008, 8, p. 243–257.
23. Chu, CS., Kim, SH., June, CH., et al. Immunotherapy opportunities in ovarian cancer. Expert Rev Anticancer Ther, 2008, 8, p. 243–257.
24. Li, Z. Priming of T cells by heat shock protein-peptide complexes as the basis of tumor vaccines. Semin Immunol, 1997, 9, p. 315–322.
25. Lindquist, S., Craig, EA. The heat-shock proteins. Ann Rev Genet, 1988, 22, p. 631–677.
26. Ludewig, B., Odermatt, B., Landmann, S., et al. Dendritic cells induce autoimmune diabetes and maintain disease via de novo formation of local lymphoid tissue. J Exp Med, 1998, 188, p. 1493–1501.
27. Nagaraj, S., Gabrilovich, DI. Tumor escape mechanism governed by myeloid-derived suppressor cells. Cancer Res, 2008, 68, p. 2561–2563.
28. Nagaraj, S., Gabrilovich, DI. Myeloid-derived suppressor cells. Adv Exp Med Biol, 2007, 601, p. 213–223.
29. Nemunaitis, J., Sterman, D., Jablons, D., et al. Granulocyte-macrophage colonystimulating factor gene-modified autologous tumor vaccines in nonsmall-cell lung cancer. J Natl Cancer Inst, 2004, 96, p. 326–331.
30. Odunsi, K., Jungbluth, AA., Stockert, E., et al. NY-ESO-1 and LAGE-1 cancer-testis antigens are potential targets for immunotherapy in epithelial ovarian cancer. Cancer Res, 2003, 63, p. 6076–6083.
31. Ozols, RF. Systemic therapy for ovarian cancer: Current status and new treatments. Semin Oncol, 2006, 33, p. S3–11.
32. Pfisterer, J., du Bois, A., Sehouli, J., et al. The anti-idiotypic antipody abagovomab in patients with recurrent ovarian cancer. A phase I trial of the AGO-OVAR. Ann Oncol, 2006, 17, p. 1568–1577.
33. Reinartz, S., Kohler, S., Schlebusch, H., et al. Vaccination of patients with advanced ovarian carcinoma with the anti-idiotype ACA125: immunological response and survival (phase Ib/II). Clin Cancer Res, 2004, 10, p. 1580–1587.
34. Rosen, DG., Wang, L., Atkinson, JN., et al. Potential markers that complement expression of CA125 in epithelial ovarian cancer. Gynecol Oncol, 2005, 99, p. 267–277.
35. Rosenblum, MG., Verschraegen, CF., Murray, JL., et al. Phase I study of 90Y-labeled B72.3 intraperitoneal administration in patients with ovarian cancer: effect of dose and EDTA coadministration on pharmacokinetics and toxicity. Clin Cancer Res, 1999, 5, p. 953–961.
36. Sadelain, M., Riviere, I., Brentjens, R. Targeting tumours with genetically enhanced T lymphocytes. Nat Rev Cancer, 2003, 3, p. 35–45.
37. Sandmaier, BM., Oparin, DV., Holmberg, LA., et al. Evidence of a cellular immune response against sialyl-Tn in breast and ovarian cancer patients after high-dose chemotherapy, stem cell rescue, and immunization with Theratope STn-KLH cancer vaccine. J Immunother, 1999, 22, p. 54–66.
38. Sato, E., Olson, SH., Ahn, J., et al. Intraepithelial CD8+ tumorinfiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci USA, 2005, 102, p. 18538–18543.
39. Schlienger, K., Chu, CS., Woo, EY., et al. TRANCE – and CD40 ligand-matured dendritic cells reveal MHC class I-restricted T cells specific for autologous tumor in late-stage ovarian cancer patients. Clin Cancer Res, 2003, 9, p. 1517–1527.
40. Schmeler, KM., Vadhan-Raj, S., Ramirez, PT., et al. A phase II study of GM-CSF and rIFN-gamma1b plus carboplatin for the treatment of recurrent, platinum-sensitive ovarian, fallopian tube and primary peritoneal cancer. Gynecol Oncol, 2009, 113, p. 210–215.
41. Sica, A., Bronte, V. Altered macrophage differentiation and immune dysfunction in tumor development. J Clin Invest, 2007, 117, p. 1155–1166.
42. Srivastava, P. Interaction of heat shock proteins with peptides and antigen presenting cells: chaperoning of the innate and adaptive immune responses. Ann Rev Immunol 2002, 20, p. 395–425.
43. Steinman, RM. The dendritic cell system and its role in immunogenicity. Ann Rev Immunol, 1991, 9, p. 271–296.
44. Steinman, RM., Banchereau, J. Taking dendritic cells into medicine. Nature, 2007, 449, p. 419–426.
45. Špíšek, R., Horváth, R., Kayserová, J., Bartůňková, J. Možnosti protinádorové terapie u karcinomu prostaty, Lék Listy, 2010, 6, p. 9–13.
46. Tomšova, M., Melichar, B., Sedlakova, I., Steiner, I. Prognostic significance of CD3+ tumor-infiltrating lymphocytes in ovarian carcinoma. Gynecol Oncol, 2008, 108, p. 415–420.
47. Vlad, AM., Kettel, JC., Alajez, NM., et al. MUC1 immunobiology: from discovery to clinical applications. Adv Immunol 2004, 82, p. 249–293.
48. Wolf, D., Wolf, AM., Rumpold, H., Fiegl, H., et al. The expression of the regulatory T cell-specific forkhead box transcription factor FoxP3 is associated with poor prognosis in ovarian cancer. Clin Cancer Res, 2005, 11, p. 8326–8331.
49. Zhang, L., Conejo-Garcia, JR., Katsaros, D., et al. Intratumoral T cells, recurrence, and survival in epithelial ovarian cancer. N Engl J Med, 2003, 348, p. 203–213.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Editorial
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2012 Číslo 2- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Laparoskopicky asistovaná neoplastika pochvy podle Vecchiettiho
- Vliv aplikace GnRH analog na peroperační a postoperační výsledky myomektomie u žen v reprodukčním věku
- Kryokonzervace ovariální tkáně u onkologických pacientek – 6 let klinických zkušeností
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Nové metody zvyšující úspěšnost asistované reprodukce
- Kortikotropin-releasing hormon a adrenokortikotropní hormon – možné markery některých těhotenských patologií
- Imunoterapie karcinomu ovaria
- Těhotenství a porod zdravého dítěte komplikované koincidencí heterotopické gravidity po IVF a placenty perkrety s následnou hysterektomií
- Fetomaternální hemoragie při porodu císařským řezem
- Medicínské, právní a etické aspekty zachování fertility u onkologických pacientek
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Výskyt trombofilních mutací u žen se závažnými těhotenskými komplikacemi
- Možnosti IVF v nativním cyklu
- Editorial
- Historie a současnost Gynekologicko-porodnické kliniky v Brně
- Screening v 11.–13.+6 týdnu těhotenství
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Možnosti IVF v nativním cyklu
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



