-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
Sheep as an experimental model in the reaserch of effects of pregnancy, delivery and surgical procedures on the pelvic floor
Objective:
A short literature review of ewe as an experimental model in research of effects of pregnancy, delivery and urogynecological surgical procedures on the pelvic floor.Design:
Literature overview.Setting:
Institute for the Care of Mother and Child, Third Faculty of Medicine, Prague.Methods:
This is an overview of recent literature on experiments using ewes as a model for biomechanical and morphological changes of the vagina induced by pregnancy, delivery and transvaginal graft implantation.Results and conclusion:
The ovine pelvic floor and vagina have comparable morphology to human. It’s biomechanical and biochemical properties get changed during the pregnancy and postpartum similarly to clinical findings. Sheep could be used for testing of urogynaecological implants vaginally and simultaneously implanted in the abdominal wall to provide better understanding of anatomical environment differences. The size of the ovine vagina gives the opportunity to perform comprehensive biomechanical, histological and biochemical testing. Experiments and observation may improve our understanding of pathology and physiology of vaginal wall changes induced by hormones, prolapse or surgery.Keywords:
pelvic floor, sheep, effects of pregnancy and delivery
Autori: I. Urbánková; L. Hympánová; L. Krofta
Pôsobisko autorov: Ústav pro péči o matku a dítě a 3. LF UK, Praha, ředitel doc. MUDr. J. Feyereisl, CSc.
Vyšlo v časopise: Ceska Gynekol 2017; 82(1): 54-58
Súhrn
Cíl studie:
Využití ovce jako experimentálního modelu, při studiu vlivu těhotenství, porodu a urogynekologických operačních výkonů na orgány pánevního dna.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Ústav pro péči o matku a dítě, 3. LF UK, Praha.Metodika:
Přehled recentní literatury publikované na téma změny biomechanických vlastností a histologické skladby poševní stěny v průběhu gestace a implantace experimentálních materiálů včetně výuky operačních výkonů na ovčím modelu.Výsledky a závěry:
Ovce, ač kvadrupední živočich, má morfologicky srovnatelné pánevní dno a pochvu s člověkem. Stejně jako u žen vykazuje mechanické a biochemické změny v průběhu gestace a postpartálně. Je možné ji využít k testování materiálů pro transvaginální urogynekologickou operativu, kterou lze doplnit o simultánní implantaci do břišní stěny. Vzhledem k velikosti modelu je možné provádět celou řadu biomechanických, biochemických a histologických testů, které mohou obohatit naše znalosti o patologických i fyziologických procesech vyvolaných hormonálními změnami či operacemi. Ovce se jeví vhodným velkým zvířecím modelem pro studium vlivu životních milníků pánevních orgánů a je praktická z hlediska vaginální operativy.Klíčová slova:
pochva, poševní stěna, zvířecí model, urogynekologická operace, pánevní dnoVLIV PORODU A TĚHOTENSTVÍ NA PÁNEVNÍ DNO ŽENY
Těhotenství a porod ovlivňují morfologii a fyziologické funkce pánevního dna ženy. V průběhu těhotenství dochází ke změnám vlastností a složení měkkých tkání, jejichž cílem je usnadnit porod plodu přirozenou cestou [1, 35].
Během vlastního vaginálního porodu pak dochází až k 4,5násobnému prodloužení struktur pánevního dna, zejména m. levator ani [19], které vede až u 20 % rodiček k jednostranné nebo oboustranné avulzi v oblasti úponu jeho puborektální části [10]. Kromě poranění svalu může také dojít k porušení veziko - či rektovaginální fascie. Extrémní natažení tkání a tlak hlavičky plodu způsobují částečnou ischemicko-traumatickou denervaci pánevního dna, která se v dlouhodobém horizontu projeví atrofizací postižených struktur [22]. Míra poranění v průběhu porodu je závislá na velkém množství faktorů. Mezi klíčové rizikové faktory patří např. klešťový porod, prodloužená 2. doba porodní nebo poranění hráze třetího stupně [5]. Dalším významným faktorem je věk rodičky v době prvního porodu. Po 30. roce věku dochází k poklesu pevnosti pojivových tkání, a ty pak mohou být náchylnější ke vzniku poranění [4]. Důsledky byly popsány v několika dlouhodobých studiích, kde ženy rodící poprvé po 30. roce věku měly dvakrát vyšší riziko vzniku prolapsu pánevních orgánů než mladší ženy [2].
V průběhu poporodního období dochází k postupnému návratu tkání pánevního dna do původního stavu, nikdy však nedojde k úplné regeneraci. Následky porodu lze pozorovat u všech vaginálně rodících žen [10]. V horizontu měsíců až desetiletí po porodu se u poloviny z nich projeví dysfunkce pánevního dna zahrnující inkontinenci moči a stolice, sestup pánevních orgánů a bolestivost při pohlavním styku [16].
Ženy, které utrpěly výrazná poškození pánevního dna, mají dvakrát vyšší pravděpodobnost sestupu pánevních orgánů či rozvoje stresové nebo urgentní inkontinence [8].
Ty, u nichž došlo k poranění m. levator ani, mají až čtyřikrát vyšší riziko, že po operační korekci sestouplých pánevních orgánů dojde k recidivě jejich obtíží [9]. Vznik inkontinence a sestup pánevních orgánů urychluje nevhodný životní styl, menopauza a stárnutí [4].
LÉČBA PORUCH PÁNEVNÍHO DNA, IMPLANTÁTY A JEJICH TESTOVÁNÍ
Vedle neinvazivní fyzioterapie a režimových opatření je základem léčby stresové inkontinence a sestupu pánevních orgánů operační zákrok. V současné době se při léčbě stresové inkontinence používá transobturátorová či retropubická páska [26]. V případě sestupu pánevních orgánů se lze na základě klinického stavu a preferencí pacientky rozhodnout buď pro výkon využívající pouze nativní tkáně, či jeden z typů syntetických implantátů. U prolapsu se odborníci podle doporučení evropské komise SCENIHR (Scientific Committee on Emerging and Newly Identified Health Risks) od použití implantátů v primární operativě spíše odklánějí a zavádějí je až v případě opakujících se sestupů [28]. Většina v současné době používaných pásek a implantátů je vyrobena z polypropylenu (Amid-I). Jedná se o vysoko porézní textilní tkané materiály s nízkou či velmi nízkou specifickou hmotností [18]. Polypropylen by měl mít vysokou odolnost, dlouhou trvanlivost a vyvolávat relativně nízkou imunitní odpověď. Jak se ale v posledních letech ukazuje, ne všechny pacientky implantáty dobře tolerují. I zdánlivě jednoduché vložení implantátu pomocí prefabrikovaných trokarů může skončit komplikacemi a dlouhodobými následky [17, 20, 27]. Vzhledem k historické zkušenosti s vysokou mírou recidiv po klasických operačních výkonech, pokračuje výzkum v oblasti nových materiálů, které by mohly nahradit ty stávající, a zajistit tak dlouhodobý efekt s minimem komplikací [7].
Výzkum a testování nových materiálů zahrnuje preklinické testování in vitro (tkáňové kultury) a posléze in vivo s využitím různých modelů (experimentální zvířata). V minulosti se standardně testovaly materiály pouze v břišní stěně drobných hlodavců. Problémem tohoto způsobu testování jsou odlišné mechanické a biologické vlastnosti a rychlá regenerace tkáně hlodavců oproti lidské tkáni [15]. Mezinárodní urogynekologická společnost (IUGA) proto požaduje testování nových materiálů na odpovídajících zvířecích modelech před jejich uvedením do klinické praxe [33].
ZVÍŘECÍ MODELY V UROGYNEKOLOGII
Ideální model napodobuje jak imunitní prostředí člověka, tak jeho anatomii. Výzkumníci v současné době používají různé experimentální zvířecí modely, zahrnující myši, krysy, králíky, primáty a v posledních několika letech také ovce. Výhodou větších zvířat je možnost provedení urogynekologických výkonů a implantace do prostředí, které je morfologicky a funkčně podobné ženské pochvě [3]. Králičí pochva se od lidské liší nejen morfologicky, ale také na úrovni imunitní odpovědi. Nicméně díky jejich dostupnosti a relativní nenáročnosti jsou králíci ve výzkumu často využíváni [21]. Na primátech jsou prováděny transabdominální výkony s implantací sítě na poševní stěnu či abdominální sakrokolpopexe [23]. Studie na primátech nejsou v současné době v Evropské unii právně ani eticky možné. Většina experimentů tak probíhá v Asii a Americe. V nedávné době se začaly ve výzkumu využívat ovce, které jsou v porovnání s primáty méně náročné na chov a dostupné v dostatečném množství z farem. U ovcí je možné provádět transvaginální operační výkony, protože jejich pochva má jak srovnatelnou velikost, tak podobnou histologickou stavbu (obr. 1) [34]. Dále je možné provést simultánní implantaci do břišní stěny, a porovnávat tak vliv anatomických lokalit s rozdílnými mechanickými a biologickými vlastnostmi.
Obr. 1. Histologická stavba poševní stěny u ženy (A) a u ovce (B) 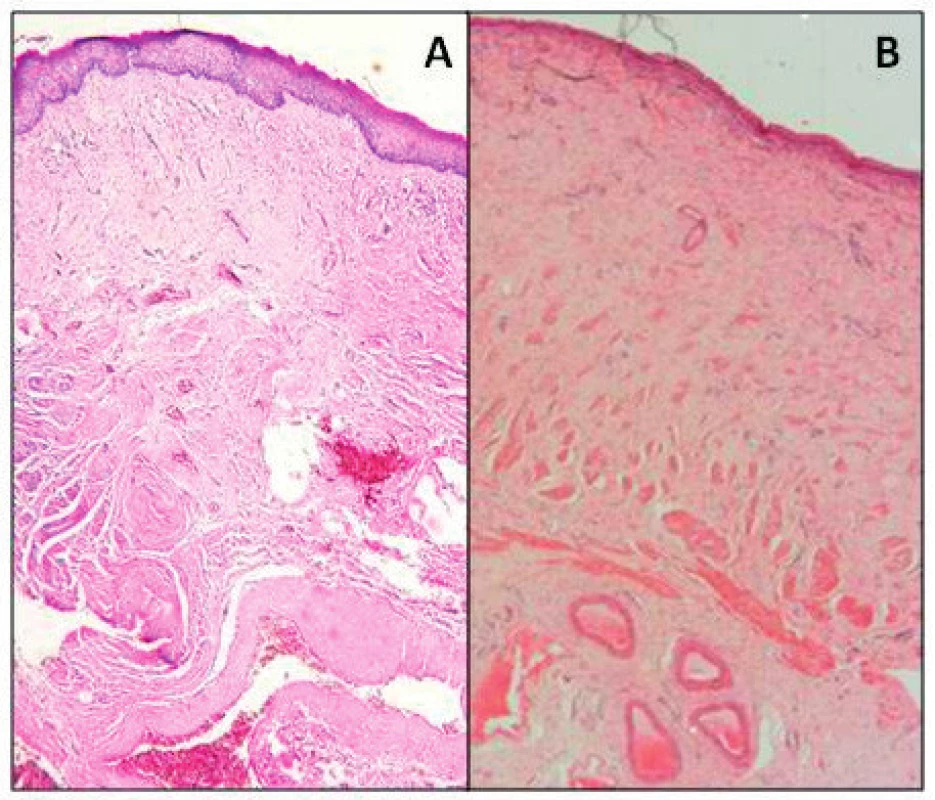
OVCE JAKO ZVÍŘECÍ MODEL ŽIVOTNÍCH ZMĚN A ONEMOCNĚNÍ PÁNEVNÍHO DNA
Ovce domácí (Ovis ovis) je savec, který v dospělosti váží v závislosti na druhu 45–90 kg. Jejich reprodukční období začíná po prvním roce života a rodí zpravidla jedno až tři jehňata. Z hlediska podobnosti lidským zdravotním obtížím mají ovce porody komplikované uterocervikální dystokií, která může mít za následek úmrtí jehněte. V závěru těhotenství se může rozvinout tzv. antenatální uterovaginální prolaps, který se u některých druhů může vyskytovat až v 15 % [3]. Rizikovými faktory jsou zvýšený nitrobřišní tlak, multiparita a anamnéza antenatálního prolapsu. Prolaps je častěji pozorován u zvířat pasoucích se v hornaté krajině, kde vlivem nadmořské výšky dochází k vzestupu nitrobřišního tlaku. Antenatální prolaps nejčastěji zahrnuje poševní stěnu, močový měchýř, děložní hrdlo či část dělohy [32]. Může k němu vzácně docházet i u negravidních ovcí při nadměrném příjmu fytoestrogenů [12]. Výzkum ukázal, že změny proteinů v extracelulární matrix postižených ovcí odpovídají změnám, které byly popsány u žen se sestupem pánevních orgánů [3].
Základním rozdílem je tvar a postavení pánve; ovce jakožto kvadrupední živočich má kranio-kaudální osu pánve horizontální. Pánevní dno, které nese většinu tíhy, je tvořeno pubickými a sedacími kostmi. Fibro-muskulární pánevní dno, tak jak ho známe u lidí, je u ovcí vertikální, a tedy výrazně méně ovlivněné gravitací a nitrobřišním tlakem [3].
Anatomie ovčí pochvy a její vnitřní prostředí jsou srovnatelné s lidskou pochvou. Ovčí pochva je 9–12 cm dlouhá a v proximální části přední poševní stěny se nachází děložní hrdlo, které protruduje do pochvy a vytváří poševní klenby [21]. Sliznice je tvořena vícevrstevným nerohovějícím epitelem, subepiteliální vazivovou vrstvou a muscularis obsahující hladkou svalovinu [38, 39].
V současné době je dostupných několik studií o mechanických vlastnostech a složení ovčí poševní stěny [31, 36, 37]. Ovčí pochva je anizotropická s větší poddajností cirkumferenciálně než longitudinálně, stejně jako je tomu u lidí [30, 31]. V průběhu gestace dochází ke zvýšení podílu elastinu v ovčí poševní stěně, jehož důsledkem je snížení její poddajnosti. Následně se biomechanické vlastnosti vracejí k hodnotám srovnatelným s nerodivšími ovcemi. Biochemické složení tkáně se ale nevratně mění, pravděpodobně v důsledku reparativních postpartálních procesů. U rodivších ovcí byl popsán výrazný nárůst celkového kolagenu a pokles elastinu v porovnání s těhotnými a nerodivšími [36]. V případě převedení ovce do artificiální menopauzy (bilaterální ovariektomie) vykazuje ovčí poševní stěna regionální rozdíly, její kaudální část pochvy je poddajnější a snadněji dojde k jejímu roztržení. V porovnání s lidmi obsahuje kraniální část vyšší podíl kolagenu a glykózaminoglykanů, což se odráží v její nízké poddajnosti [37]. Vzhledem k nedostupnosti vhodných lidských tkání zatím neproběhlo porovnání vlastností ovčí a lidské tkáně v jiných životních stadiích.
VYUŽITÍ OVCE PŘI TESTOVÁNÍ NOVÝCH MATERIÁLŮ PRO OPERAČNÍ VÝKONY V UROGYNEKOLOGII
Ovce jsou díky své dostupnosti využívány k testování transvaginálních implantátů několika evropskými centry. Implantační technika je velmi podobná výkonům běžně prováděným u pacientek se sestupem pochvy. Podle publikovaných prací je možné provádět implantace v předním i zadním kompartmentu včetně nácviku antiinkontinenčních výkonů (transobturátorová či retropubická páska) [14, 29, 34].
U ovcí je možné vyvolat obdobný typ a frekvenci lokálních komplikací po implantaci cizorodých materiálů, především erozí, jako u žen. U ovcí vede vložení stejného typu implantátu do přední poševní stěny k dvakrát vyššímu výskytu erozí než do stěny zadní (33 % vs. 17 %, resp.) [34]. Důvodem vyšší frekvence lokálních komplikací v předním kompartmentu jsou anatomické rozdíly. Močová trubice a přední poševní stěna jsou pevně spojeny vazivem, což vede ke ztížené disekci. Kromě lokality hraje roli i velikost implantátu. Manodoro a kol. implantovali do zadní poševní stěny polypropylenové implantáty dvou různých velikostí (5×5 cm vs. 3,5×3,5 cm) [25]. Studie odhalila dvakrát větší míru retrakce implantátu a eroze u 30 % zvířat s většími implantáty. Toto pozorování je v souladu s klinickými zkušenostmi, kdy byly relativně velké implantáty Prolift spojeny s velkým množstvím lokálních komplikací [13]. V současné době se operatéři při korekci sestupu snaží využít co nejmenší možné množství materiálu a upravit velikost implantátu podle aktuálních anatomických podmínek během operačního výkonu.
Další dvě studie provedené týmem profesora Depresta se zaměřily na porovnání střednědobých změn biomechanických vlastností poševní stěny po inzerci čtyř různých typů implantátů [11, 14]. Tři z nich byly založeny na polypropylenovém základě, jeden čistě polypropylenový, druhý krytý cross-link kolagenem a třetí s vlákny obalenými amorfním kolagenem [14]. Čtvrtým implantátem byl xenograft cross-link kolagen bovinního původu běžně používaný při rekonstrukcích vrozených vývojových vad srdce [11]. Hlavním poznatkem studií je negativní vliv obou typů kolagenu obklopujícího implantát na kontraktilitu hladkých svalových buněk v muscularis poševní stěny a narušení její fyziologické funkce. Jak lze očekávat u všech typů polypropylenových implantátů, došlo i v této studii k poklesu poddajnosti poševní stěny v porovnání s kontrolními vzorky neoperovaných zvířat. Po implantaci čistě kolagenního bovinního implantátu se poddajnost poševní stěny nezměnila, u jednoho zvířete však byla detekována kalcifikace v graftovaném materiálu a většina graftů vykazovala vysokou míru degradace v době explantace [11]. V posledních třech citovaných studiích byl současně implantován identický materiál do břišní stěny ovce [11, 14, 25]. Po abdominální inzerci polypropylenových implantátů nebyly pozorovány žádné lokální komplikace. Retrakce materiálu dosahovala pouze 10 % oproti až 37% retrakci v pochvě [14]. Po vložení kolagenního implantátů do břišní stěny byly v porovnání s pochvou výrazně častěji pozorovány kalcifikace (3/10 vs. 1/10), avšak stupeň rozkladu implantátu byl nižší [11]. Pozorovaný rozdíl lze vysvětlit odlišnými anatomickými, mechanickými, reparativními a imunologickými rozdíly mezi břišní a poševní stěnou. Tyto odlišnosti je třeba mít na paměti především ve chvílích, kdy materiály běžně užívané k rekonstrukci defektů v jiných částech těla jsou přenášeny do urogynekologické operativy, aniž by byly dostatečně testovány [6].
Komplexní klinické důsledky biomechanických změn poševní stěny vyvolaných implanáty se posuzují obtížně. Experimentální studie provedená na makacích ukázala, že implantace materiálu s vysokou specifickou hmotností a nízkou poddajností vede k fenoménu zvanému „stress shielding“ [24], kdy tuhý materiál, který je výrazně méně poddajný než poševní stěna, kompletně nahradí pasivní zatížení pojivové tkáně, což vede k její atrofizaci (ztenčení), a může tak přispívat ke snadnějšímu vzniku erozí či dyspareunii.
ZÁVĚR
Publikované studie demonstrují, že ovci je možné použít jako experimentální model s přihlédnutím k základním rozdílům (kvadrupední vs. bipední živočich). Výhodou tohoto modelu je možnost simultánních abdominálních a transvaginálních výkonů, inzerce relativně velkých implantátů, simulace lokálních komplikací popisovaných u žen a rozsáhlého testování. Pozorované změny vlastností a složení poševní stěny po implantaci jsou základem pro pochopení patofyziologie vzniku lokálních komplikací. Proto, aby byl model plně použitelný, je dále potřeba charakterizovat, jakými změnami ovčí poševní stěna prochází v poporodním období, v době dospívání a ve stáří. Dále je potřeba podrobněji porovnat pánevní dna a struktury, které jsou běžně užívané jako orientační či fixační body při transvaginálních urogynekologických výkonech.
MUDr. Iva Urbánková
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4
e-mail: Iva.urbankova@upmd.eu
Zdroje
1. Ashton-Miller, JA., Delancey, JOL. On the biomechanics of vaginal birth and common sequelae. Anl Revi biomed Engineering, 2009, 11, 20, p. 163–176.
2. Callewaert, G., Albersen, M., Janssen, K., et al. The impact of vaginal delivery on pelvic floor function - delivery as a time point for secondary prevention: A commentary. BJOG, 2015, 123, 5, p. 678–681.
3. Couri, B., Lenis, A., Borazjani, A., et al. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev Obstet Gynecol, 2012, 7, 3, p. 249–260.
4. DeLancey, JOL., Kane Low, L., Miller, JM., et al. Graphic integration of causal factors of pelvic floor disorders: an integrated life span model. AJOG, 2008, 199, 6, p. 610.e1–5.
5. van Delft, K., Thakar, R., Sultan, A., et al. Levator ani muscle avulsion during childbirth: a risk prediction model. BJOG, 2014, 121, 9, p. 1–10.
6. Deprest, J., Zheng, F., Konstantinovic, M., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Intern Urogynecol J pelvic Floor Dysfunct, 2006, 17 Suppl 1, p. S16-25.
7. Deprest, J., Feola, A. The need for preclinical research on pelvic floor reconstruction. BJOG, 2013, 120, 2, p. 141–143.
8. Dietz, H., Simpson, J. Levator trauma is associated with pelvic organ prolapse. BJOG, 2008, 115, 8, p. 979–984.
9. Dietz, HP., Chantarasorn, V., Shek, KL. Levator avulsion is a risk factor for cystocele recurrence. Ultrasound Obstet Gynecol, 2010, 36, 1, p. 76–80.
10. Dietz, HP., Lanzarone, V. Levator trauma after vaginal delivery. Obstet Gynec, 2005, 106, 4, p. 707–712.
11. Endo, M., Urbankova, I., Vlacil, J., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol Surg, 2015, 12, 2, p. 113–122.
12. Ennen, S., Kloss, S., Scheiner-Bobis, G., et al. Histological, hormonal and biomolecular analysis of the pathogenesis of ovine Prolapsus vaginae ante partum. Theriogenology, 2011, 75, 2, p. 212–219.
13. FDA [online]. 2011. Dostupné na internetu: http://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/PublicHealthNotifications/ucm061976.htm http://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm262435.htm>.
14. Feola, A., Endo, M., Urbankova, I., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Amer J Obstet Gynecol, 2015, 212, 4, p. 474.e1–474.e8.
15. Gabriel, B., Rubod, C., Brieu, M. Vagina, Abdominal skin, and aponeurosis: do they have similar biomechanical properties? Int Urogynecology J, 2011, 22, 1, p. 23–27.
16. Gyhagen, M., Akervall, S., Milsom, I. Clustering of pelvic floor disorders 20 years after one vaginal or one cesarean birth. I Urogynecol J, 2015, 26, 8, p. 1118-1121.
17. Hayen, B., Freeman, R., Lee, J., et al. International Urogynecological Association (IUGA)/International Continence Society (ICS) joint terminology and classification of the complications related to native tissue female pelvic floor surgery. Int Urogynecol J, 2012, 23, 5, p. 515–526.
18. Herschorn, S. The use of biological and synthetic materials in vaginal surgery for prolapse. Curr Opin Urol, 2007, 17, 6, p. 408–414.
19. Jing, D., Ashton-Miller, JA., DeLancey, JOL. A subject-specific anisotropic visco-hyperelastic finite element model of female pelvic floor stress and strain during the second stage of labor. J Biomechanics, 2012, 45, 3, p. 455–460.
20. Keys, T., Campeau, L., Badlani, G. Synthetic mesh in the surgical repair of pelvic organ prolapse: current status and future directions. Urology, 2012, 80, 2, p. 237–243.
21. Krause, H., Goh, J. Sheep and rabbit genital tracts and abdominal wall as an implantation model for the study of surgical mesh. J Obstet Gynaecol Res, 2009, 35, 2, p. 219–224.
22. Law, YM. Fielding, JR. MRI of pelvic floor dysfunction: Review. Amer J Roentgenol, 2008, 191, 6 suppl., p. 45–53.
23. Liang, R., Zong, W., Palcsey, S., et al. Impact of prolapse meshes on the metabolism of vaginal extracellular matrix in rhesus macaque. AJOG, 2014, 212, 2, p. 174.e1–174.e7.
24. Liang, R., Abramowitch, S., Knight, K., et al. Vaginal degeneration following implantation of synthetic mesh with increased stiffness. BJOG, 2013, 120, 2, p. 233–243.
25. Manodoro, S., Endo, M., Uvin, P., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG, 2013, 120, 2, p. 244–250.
26. Medina, CA., Costantini, E., Petri, E., et al. Evaluation and surgery for stress urinary incontinence: A FIGO working group report. Neurourol Urodynamics, 2016, 34, 3, p. n/a-n/ad
27. Ostergard, DR. Degradation, infection and heat effects on polypropylene mesh for pelvic implantation: What was known and when it was known. Int Urogynecol J Pelvic Floor Dysfunct, 2011, 22, 7, p. 771–774.
28. Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery (SCENIHR - European Commission), 2016, doi ISBN 9789279439179.
29. Riccetto, CLZ., Palma, PCR., Thiel, M., et al. Experimental animal model for training transobturator and retropubic sling techniques. Urologia Internation, 2007, 78, 2, p. 130–134.
30. Rubod, C., Brieu, M., Cosson, M., et al. Biomechanical properties of human pelvic organs. Urology, 2012, 79, 4, p. 968.e17-22.
31. Rubod, C., Boukerrou, M., Brieu, M., et al. Biomechanical properties of vaginal tissue. Part 1: new experimental protocol. J Urol, 2007, 178, 1, p. 320–325; discussion 325.
32. Scott, PR., Gessert, ME. Ultrasonographic examination of 12 ovine vaginal prolapses. Veterinary J., 1998, Table I, p. 323–324.
33. Slack, M., Ostergard, D., Cervigni, M., et al. A standardized description of graft-containing meshes and recommended steps before the introduction of medical devices for prolapse surgery. Int Urogynecology J, 2012, 23, suppl. 1, p. S15–26.
34. de Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Intern Urogynecol J pelvic Floor Gysfunc, 2007, 18, 5, p. 513–520.
35. Tunn, R., DeLancey, JOL., Howard, D., et al. Anatomic variations in the levator ani muscle, endopelvic fascia, and urethra in nulliparas evaluated by magnetic resonance imaging. AJOG, 2003, 188, 1, p. 116–121.
36. Ulrich, D., Edwards, SL., Su, K., et al. Influence of reproductive status on tissue composition and biomechanical properties of ovine vagina. PloS one, 2014, 9, 4, p. e93172.
37. Ulrich, D., Edwards, SL., Letouzey, V., et al. Regional variation in tissue composition and biomechanical properties of postmenopausal ovine and human vagina. PLoS one, 2014, 9, 8, p. e104972.
38. Vincent, KL., Bourne, N., Bell, AB., et al. High resolution imaging of epithelial injury in the sheep cervicovaginal tract: a promising model for testing safety of candidate micorobicedes. Sex Transm Dis, 2009, 36, 5, p. 312–318.
39. Vincent, KL., Vargas, G., Wei, J., et al. Monitoring vaginal epithelial thickness changes noninvasively in sheep using optical coherence tomography. AJOG, 2013, 208, 4, p. 282.e1-282.e7.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Stupeň spokojenosti pacientů pokračujících v léčbě hyperaktivního močového měchýře mirabegronemČlánek EditorialČlánek Management recidivující stresové inkontinence moči po selhání efektu anti-inkontinentních operacíČlánek MANAGEMENT TĚHOTENSTVÍ S RIZIKEM ROZVOJE HEMOLYTICKÉ NEMOCI PLODU A NOVOROZENCEDoporučený postupČlánek Dopis redakci
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2017 Číslo 1- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Pacientky s obezitou, hypertenzí a nutností aplikace inzulinu při diagnóze gestační diabetes mellitus vyžadují zvýšenou porodnickou péči
- Jsou rizikové faktory v prenatálním a perinatálním období důležité pro vznik schizofrenie?
-
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8% - Úspěšná transplantace ovariální tkáně u pacientky s ovariálním selháním po onkologické léčbě
- Vliv glykosylace hCG na jeho funkce v ženské reprodukci
- Stupeň spokojenosti pacientů pokračujících v léčbě hyperaktivního močového měchýře mirabegronem
- Editorial
- Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
- Management recidivující stresové inkontinence moči po selhání efektu anti-inkontinentních operací
- Analýza materskej morbidity a mortality v Slovenskej republike v rokoch 2007–2012
- Chirurgická léčba stresové inkontinence moči u žen – od jehel až k (mini)pásce
- Současné postavení vaginálních implantátů při řešení sestupu pánevních orgánů
-
GESTAČNÍ DIABETES MELLITUS
Doporučený postup -
MANAGEMENT TĚHOTENSTVÍ S RIZIKEM ROZVOJE HEMOLYTICKÉ NEMOCI PLODU A NOVOROZENCE
Doporučený postup - Dopis redakci
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8% - Jsou rizikové faktory v prenatálním a perinatálním období důležité pro vznik schizofrenie?
- Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
- Chirurgická léčba stresové inkontinence moči u žen – od jehel až k (mini)pásce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



