-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8%
Comparison of vaginal use of micronized progesterone for the luteal support.
Randomized study comparison of Utrogestan and Crinone 8%Objective:
The study was focused on comparison of efficiency, safety and tolerance of vaginal use of micronized progesterone in preparations Utrogestan and Crinone 8%.Design:
Prospective randomized study.Setting:
Department of Gynecology and Obstetric, University Hospital, Olomouc, Faculty of Medicine and Dentistry, Palacky University, Olomouc.Material and methodology:
Into a prospective randomized study was, after calculation of 80% of the power of the study, α = 0,05, included 111 women in age between 18–40 with a basal value FSH < 10 IU/l and a normal finding in uteral cavity. After evaluation of efficiency of both preparations there was selected a fertilization rate, an implantation rate, a pregnancy rate and a take-home baby rate. Comparison of tolerance was made from evaluation of 21 parameters which were obtained through a questionnaire.Results:
There were not been proven any significant differences in efficiency between both preparations. Crinone 8% was in patients better tolerated.Conclusion:
Luteal support within the IVF/ICSI-ET remains an integral part of the treatment. According to the outcomes of the study it seems to be more suitable to use a vaginal gel for the luteal support with micronized progesterone.Keywords:
luteal phase support, IVF/ET
Autoři: Ľ. Michnová 1
; J. Dostál 2
; K. Langová 3
; T. Rumpíková 4; Milan Kudela 2
Působiště autorů: IVF Clinic, Olomouc, vedoucí lékař MUDr. Š. Machač, Ph. D. 1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 2; Ústav lékařské biofyziky FN a LF UP, Olomouc, přednostka prof. RNDr. H. Kolářová, CSc. 3; Klinika reprodukční medicíny a gynekologie IVF, Zlín, odborný zástupce a ředitel kliniky MUDr. D. Rumpík 4
Vyšlo v časopise: Ceska Gynekol 2017; 82(1): 28-37
Souhrn
Cíl:
V naší studii jsme se zaměřili na porovnání účinnosti a snášenlivosti vaginálního užití mikronizovaného progesteronu v preparátech Utrogestan a Crinone 8%.Typ studie:
Prospektivní randomizovaná studie.Název a sídlo pracoviště:
Centrum asistované reprodukce FN Olomouc.Metodika:
Do prospektivní randomizované studie bylo po výpočtu 80% síly studie při α = 0,05 zařazeno 111 žen ve věku 18–40 let s bazální hodnotou FSH < 10 IU/l a normálním nálezem v děložní dutině. Pro vyhodnocení účinnosti obou preparátů jsme zvolili fertilization rate, implantation rate, pregnancy rate a take home baby rate. Porovnání snášenlivosti jsme provedli formou vyhodnocení 21 parametrů získaných formou dotazníku.Výsledky:
V naší studii jsme neprokázali statisticky významné rozdíly v účinnosti mezi oběma preparáty. Crinone 8% byl pacientkami lépe snášen.Závěr:
Luteální podpora v programu IVF/ICSI-ET zůstává nedílnou součástí léčby. Pro luteální podporu mikronizovaným progesteronem se jeví podle výsledků naší studie výhodnější užití vaginálního gelu.Klíčová slova:
podpora luteální fáze, IVF/ETÚVOD
Podle Národního registru reprodukčního zdraví, resp. Národního registru asistované reprodukce (NRAR) stále více vzrůstá potřeba využití metod asistované reprodukce (ART), jako je in vitro fertilizace (IVF) a intracytoplazmatická injekce spermie (ICSI) v léčbě sterilních párů. V roce 2013 bylo v České republice zahájeno 32 245 cyklů asistované reprodukce [52]. V Belgii, České republice, Dánsku, Estonsku, na Islandu, v Norsku, Slovinsku a Švédsku byla více než 3,0 % všech narozených dětí počata metodami asistované reprodukce. Podle odhadů se ročně ve světě provádí přibližně 1,5 milionu cyklů AR, z nichž se narodí asi 350 tisíc dětí [53].
Pro úspěšnou implantaci embrya je důležitá správná příprava endometria. Tento proces začíná v proliferační fázi menstruačního cyklu (od menstruace do ovulace) a trvá i během luteální fáze cyklu (od ovulace do menstruace). Pro správnou přípravu endometria jsou potřebné dva základní hormony, a to estradiol (E) a progesteron (P). Ve folikulární fázi přirozeného cyklu stimuluje hypofyzární folikulostimulační hormon (FSH) granulózové buňky Graafova folikulu k produkci E. Jeho hladina postupně narůstá, přičemž dosahuje vrcholu těsně před prudkým vzestupem luteinizačního hormonu (LH), který spouští ovulační děj. Po ovulaci dochází k vaskularizaci reziduálních granulózových buněk kolabovaného folikulu a vzniká corpus luteum. Steroidní produkce v luteální fázi je závislá na pokračující produkci LH [12, 47]. Tvorba E a P vrcholí čtyři dny po ovulaci, pokračuje přibližně jeden týden a poklesne asi čtyři dny před následující menstruací. Oba hormony synergicky připravují endometrium na implantaci a během těhotenství ho stabilizují [47]. Endometrium je hlavní cílovou tkání pohlavních hormonů. Progesteron vyvolává sekreční transformaci estrogeny připraveného endometria, způsobuje lokální vazodilataci a snižuje kontraktilitu myometria. Endometriální cyklus je odrazem ovariálního cyklu a odpovídá jeho dvěma fázím odděleným ovulací. Hlavní vliv na zrání endometria, implantaci a udržení těhotenství má optimální souhra E a P [29]. Během endometriální sekreční fáze je popsáno poměrně krátké období, kdy může dojít k implantaci, a toto období je označováno jako implantační okno [19, 33]. Pokud dojde k otěhotnění, produkce P pokračuje díky stimulaci corpus luteum lidským choriovým gonadotropinem (hCG) [37]. Normální luteální funkce je předpokladem nejen úspěšné implantace embrya, ale i následného udržení těhotenství. Steroidogenezi žlutého tělíska začíná od pátého týdne těhotenství přebírat placenta [43] a plně ji převezme po sedmém týdnu těhotenství [9].
Již od počátků AR se předpokládá, že luteální fáze v rámci užití ART je nedostatečná. Zpočátku byla teorie, že samotný odběr oocytů způsobuje nedostatečnost luteální fáze, a tudíž nedostatečnou steroidní produkci. Poté ale bylo prokázáno, že odběr pouze jednoho folikulu nezpůsobí narušení luteální fáze [27]. Ve stimulovaných cyklech, které jsou typické pro IVF/ET a ve kterých je k dosažení multifolikulárního vývoje užívána kontrolovaná ovariální hyperstimulace (COH) gonadotropiny, je luteální fáze odlišná od luteální fáze v přirozeném cyklu. Bylo prokázáno, že multifolikulární vývoj má sám o sobě vliv na délku luteální fáze [21]. Stimulace způsobuje po odběru oocytů tvorbu mnohočetných žlutých tělísek, takže hladiny E a P jsou v časné luteální fázi suprafyziologické. Relativní hyperestrinismus, který v negativní zpětné vazbě tlumí produkci LH v hypofýze, je pak považován za možný spouštěcí mechanismus předčasné luteolýzy [17]. Přesný mechanismus předčasné luteolýzy dosud nebyl detailně popsán a některé studie poukazují na nepřímý vliv E na corpus luteum [5, 20]. Každopádně trvání ovariální steroidní produkce po COH je o dva až tři dny kratší než v cyklech přirozených [47]. Časný pokles steroidní produkce byl proto důvodem k přijetí luteální podpory v léčbě neplodnosti metodami asistované reprodukce [14, 26]. Po zavedení agonistů gonadotrophin-releasing hormonu (GnRH-a) a antagonistů gonadotrophin-releasing hormonu (GnRH-ant.) do stimulačních protokolů, v nichž zabraňují nežádoucímu předčasnému vzestupu LH, se stal problém krátké luteální fáze ještě významnější, takže luteální podpora je standardní součástí léčby po odběru oocytů a ET [4].
Nejdůležitějším faktorem pro udržení dostatečné produkce endogenního P ve stimulovaných cyklech je přítomnost hCG. Po indukci maturace oocytů aplikací exogenního hCG přetrvávají pod jeho vlivem corpora lutea do šestého dne po odběru oocytů a poté dochází k prudkému poklesu hladiny P [3]. Dojde-li po ET k otěhotnění, dochází od osmého dne po odběru oocytů k vzestupu hladiny endogenního hCG, a tím jsou corpora lutea opět stimulována k produkci P [4]. Z uvedeného vyplývá, že existuje přibližně třídenní interval, kdy je hladina progesteronu nedostatečná pro udržení těhotenství.
Kontrolovaná ovariální hyperstimulace způsobuje insuficienci luteální fáze, takže luteální podpora se stala nezbytnou součástí programu IVF/ICSI-ET. Luteální podpora se může provádět v zásadě dvěma způsoby. P lze podávat přímo exogenně (s E nebo bez E) nebo žlutá tělíska vzniklá po odběru oocytů mohou být podporována ve vlastní dostatečné produkci P. Běžně je pro luteální podporu používán progesteron. Progesteron k luteální podpoře po IVF/ET lze podávat perorálně, intramuskulárně, subkutánně, vaginálně, rektálně, sublingválně, transdermálně a nazálně. Z těchto možností jsou široce užívány pouze tři, a to perorální, intramuskulární a vaginální.
Cílem naší prospektivní randomizované studie bylo porovnat účinnost, bezpečnost a snášenlivost vaginálního užití mikronizovaného P pro luteální podporu v programu IVF/ICSI-ET ve dvou skupinách pacientek: skupina 1. – pacientky užívající Utrogestan a skupina 2. – pacientky užívající Crinone 8%. Dále pak popsat změny poševní mikroflóry a známek zánětu pochvy v souvislosti s luteální podporou mikronizovaným progesteronem ve výše jmenovaných dvou skupinách pacientek a stanovit jejich vliv na bezpečnost a snášenlivost příslušné formy podání.
MATERIÁL A METODIKA
Vstupní kritéria a etické aspekty
Studie probíhala v Centru asistované reprodukce FN Olomouc a Centru reprodukční medicíny Zlín. Vstupními kritérii pro zařazení do studie byl věk 18–40 let, bazální hodnota FSH méně než 10 IU/l a normální nález v dutině děložní prokázaný hysterosalpingografií nebo hysteroskopií. Byla provedena power analýza, v rámci níž se zjistilo, že k průkazu 15% rozdílu mezi skupinami je třeba do obou ramen studie randomizovat minimálně 51 pacientek, přičemž je počítáno s 16 % pacientek, které studii po randomizaci nedokončí. Do naší studie bylo zahrnuto celkem 111 pacientek, které podstoupily kontrolovanou ovariální stimulaci za účelem IVF/ICSI, s následnou punkcí oocytů a embryotransferem (ET). Po splnění vstupních kritérii byla pacientce navržena účast ve studii. A po podpisu informovaného souhlasu, který byl schválen Etickou komisí FN Olomouc, byla pacientka zařazena do naší prospektivní randomizované studie. Kritériem pro pokračování ve studii a randomizaci byla hladina estradiolu v den aplikace hCG minimálně 1000 pg/ml (3671 pmol/l) a maximálně 5000 pg/ml (18 355 pmol/l), abychom předešli zařazení pacientek s nízkou ovariální odpovědí (low responders) a naopak s nadměrnou ovariální odpovědí (high responders), u nichž je vysoké riziko rozvoje ovariálního hyperstimulačního syndromu (OHSS) a u kterých většinou z tohoto důvodu všechna embrya kryokonzervujeme, takže studii nedokončí. Do skupiny s Utrogestanem bylo randomizováno 58 pacientek, do skupiny Crinone 8% 53 pacientek.
Kontrolovaná ovariální hyperstimulace
Pro kontrolovanou ovariální stimulaci (COH) byl u pacientek použit dlouhý depotní folikulární protokol s GnRH-a/rFSH (gonadotrophin - releasing hormone agonist/ recombinant FSH) (Zoladex, Decapeptyl, Diphereline/ Gonal F, Puregon ). Ve chvíli, kdy největší folikuly dosáhly průměru 20 mm, jsme aplikovali hCG. U všech pacientek, u kterých byla provedena punkce oocytů, bylo naplánováno, a pokud bylo možné, provedeno ICSI. Embryotransfer byl proveden vždy po třídenní kultivaci embryí.
Luteální podpora
V den odběru oocytů byly vyhodnoceny hladiny E, v den aplikace hCG a po odběru oocytů, pokud jich bylo získáno minimálně pět, byly pacientky randomizovány podle počítačem generovaného pořadí v zaslepených obálkách, a to do skupiny, kdy užívaly Utrogestan vaginálně dvě tobolky třikrát denně (600 mg), nebo do skupiny, kdy užívaly Crinone 8% vaginální gel jednou denně (90 mg). Medikaci mikronizovaného progesteronu (P) začaly pacientky užívat dva dny po odběru oocytů až do stanovení hCG (za 12–14 dní). Pokud došlo k otěhotnění, pokračovaly ženy v medikaci minimálně do 10. týdne gravidity.
Výstupy
K porovnání účinnosti obou sledovaných metod bylo využito stanovení „fertilization rate“ (FR) – počet oplozených oocytů na oplozované, „implantation rate“ (IR) – podíl počtu gestačních váčků viditelných ultrazvukovým vyšetřením v děloze a počtu transferovaných embryí, „pregnancy rate“ (PR) podíl žen, které otěhotněly (klinických gravidit), ze všech žen, u nichž byl proveden embryotransfer. „Take home baby rate“ (THBR) – podíl žen, které porodily (bez ohledu na počet porozených plodů), ze všech žen, u nichž byl proveden embryotransfer, počet kryokonzervovaných embryí, poměr těhotenských ztrát, poměr těhotenství pokračujících po 12. týdnu gravidity, výskyt OHSS, způsob vedení porodu, délka těhotenství a hmotnost novorozence, četnost těhotenství a pohlaví plodů.
Ke zhodnocení snášenlivosti obou sledovaných metod pacientky obdržely dotazník, ve kterém byly dotázány na obtíže, které ohodnotily na stupnici 1–4 (potíže žádné, mírné, střední, závažné). Jednalo se o dotazy na problémy při zavádění preparátu do pochvy, nepříjemné pocity při zavádění preparátu do pochvy, pocit vytékání preparátu z pochvy, pocit na zvracení, pocit nevolnosti, zácpa, průjem, bolesti žaludku, bolesti hlavy, napětí v prsou, bolesti kloubů, celková podrážděnost, spavost, nepříjemný pocit v oblasti rodidel, pocit zmnoženého výtoku, podráždění zevních rodidel způsobené výtokem, pocit častějšího nucení na močení přes den, pocit častějšího nucení na močení v noci, snížení zájmu o pohlavní styk, nepříjemné pocity při pohlavním styku.
Statistická analýza
Data byla vyhodnocena pomocí popisné statistiky (medián, minimální, maximální hodnota, průměr a směrodatná odchylka) a testována Shapirovými-Wilkovými testy normality. Vzhledem k tomu, že většina dat neměla normální distribuci, byly skupiny porovnány neparametrickým Mannovým-Whitneyho U-testem. Všechny testy byly provedeny na hladině statistické významnosti p < 0,05. Ke zpracování byl použit program IBM SPSS Statistics 22.
Pacientky byly porovnány i ve věku. Věk měl normální distribuci, proto byly skupiny porovnány dvouvýběrovým t-testem.
VÝSLEDKY
Do skupiny s Utrogestanem bylo randomizováno 58 pacientek, do skupiny Crinone 8% 53 pacientek.
Popisná data, jako je doba trvání sterility, faktor sterility, počet předchozích cyklů, procento provedených ICSI, AH, OHSS, procento potratů, jsou srovnaná v obou skupinách (tab. 1).
Tab. 1. Demografické údaje (t-test, Mannův-Whitneyho test, Fischerův test) 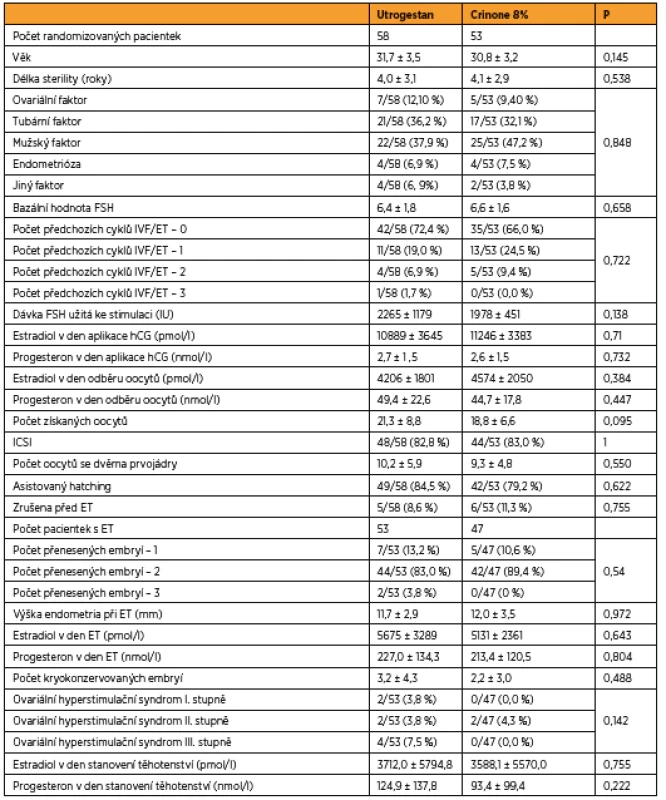
V kvantitativních veličinách byly skupiny srovnány Mannovým-Whitneyho U-testem. V kvalitativních znacích byly skupiny srovnány pomocí přesného Fisherova testu.
Ženy s Utrogestanem a ženy s Crinonem se v uvedených parametrech statisticky významně nelišily, p > 0,05 ve všech parametrech.
Vyhodnocení účinnosti
Pro vyhodnocení účinnosti obou preparátů jsme zvolili fertilization rate, implantation rate, pregnancy rate a take home baby rate. V kvantitativních veličinách byly skupiny srovnány Mannovým-Whitneyho U-testem. V kvalitativních znacích byly skupiny srovnány pomocí přesného Fisherova testu.
Srovnali jsme počet získaných oocytů (21,3 versus 18,8) a počet oplozených oocytů s dvěma pronukleáry (10,2 versus 9,3) ve skupině s Utrogestanem a skupině s Crinonem 8%. Fertilization rate 52,2 % versus 50,2 %. Porovnali jsme počet klinických gravidit (36 versus 27) a počet embryotransferů (53 versus 47) v obou sledovaných skupinách. Pregnancy rate 67,0 % versus 57,0 %. Dále jsme srovnali počet gestačních váčků viditelných ultrazvukem (46 versus 37) a počet transferovaných embryí (101 versus 89) ve skupině pacientek užívajících Utrogestan vaginálně a užívajících Crinone 8% vaginální gel. Implantation rate 48,1 % versus 41,5 %. Take-home baby rate (THBR) je nejkomplexnějším ukazatelem výsledku léčby neplodnosti, který zohledňuje i všechny těhotenské ztráty až do porodu, proto jsme srovnali počet žen, které porodily (bez ohledu na počet porozených plodů) (28 versus 20), a počet žen, u nichž byl proveden embryotransfer (53 versus 47). THBR 52,8 % versus 42,6 %.
Skupina žen užívajících Utrogestan respektive Crinone 8% se v uvedených parametrech statisticky významně nelišila, p > 0,05 ve všech parametrech (tab. 2).
Tab. 2. Výsledky účinnosti preparátů 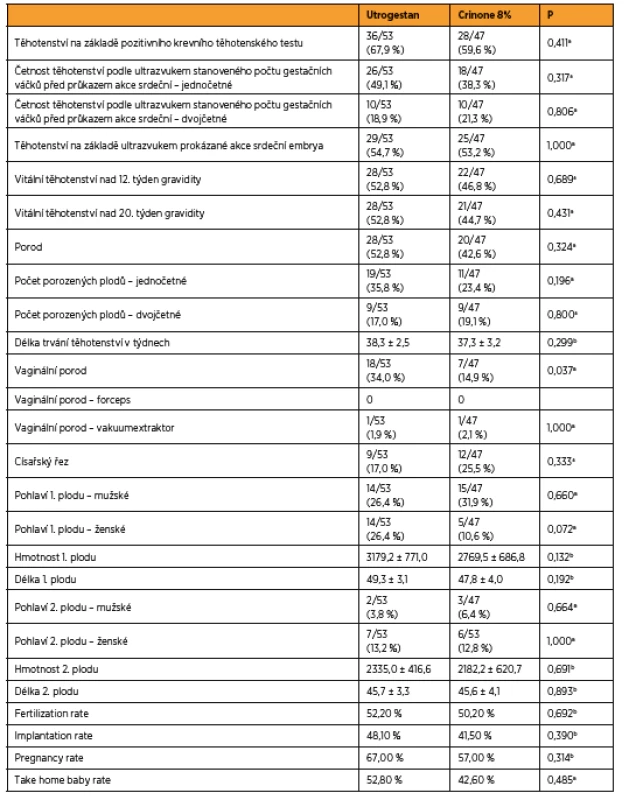
aFisherův přesný test (Fisher exact test) bMannův-Whitneyho U-test Vyhodnocení snášenlivosti
Porovnání snášenlivosti jsme provedli vyhodnocením 21 parametrů získaných formou dotazníku. Ženy ve skupině užívající Crinone 8% lépe hodnotily subjektivní obtíže než pacientky ve skupině s Utrogestanem. Ženy ve skupině zavádějící Crinone 8% udávaly méně problémů při aplikaci preparátu, méně obtěžujícího vaginálního výtoku a také méně trávicích problémů (průjem). Ženy ve skupině s Crinonem 8% ohodnotily lépe i dotaz na přítomnost celkové podrážděnosti. Porovnání bylo provedeno Mannovým-Wnitneyho U-testem (tab. 3).
Tab. 3. Výsledky snášenlivosti (Mannův-Whitneyho test) 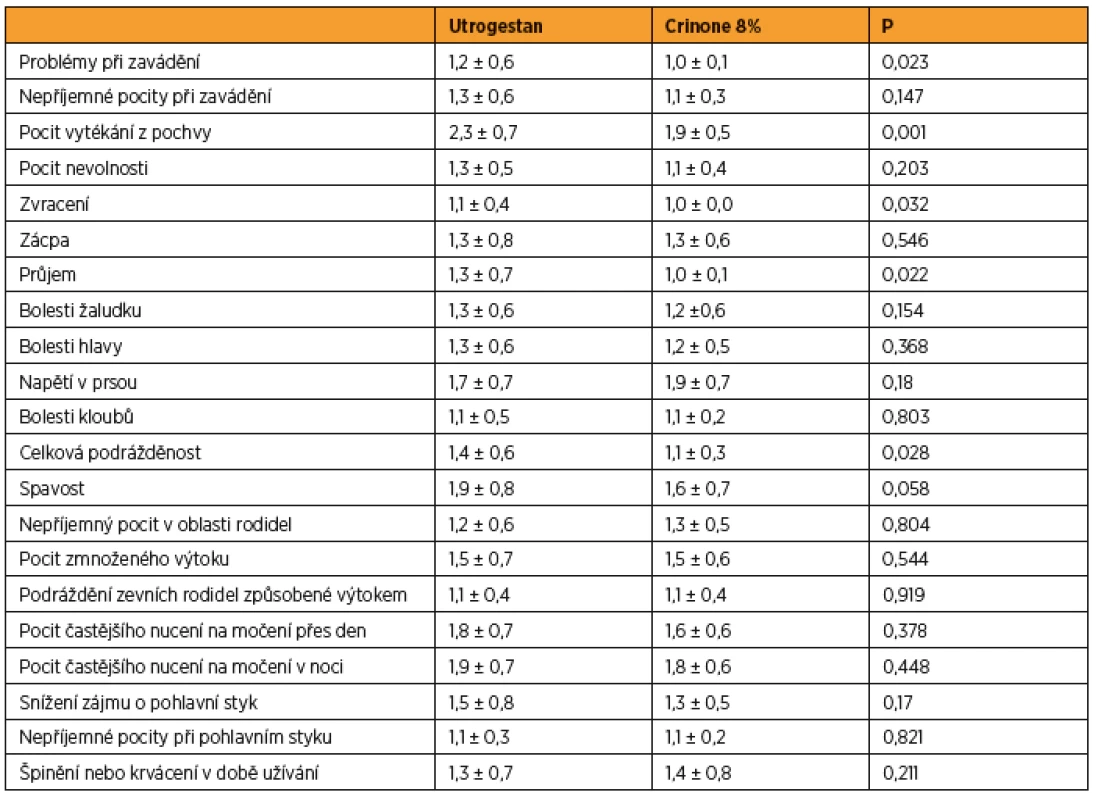
DISKUSE
Příčinou insuficience luteální fáze po COH jsou suprafyziologické hladiny hormonů. Luteální podpora pomocí hCG nebo P ve stimulovaných cyklech za účelem IVF/ET je nezbytnou součástí léčby.
Vývoj mikronizačního procesu umožnil lepší absorpci perorálně podávaného progesteronu (Utrogestan). Primární průchod progesteronu játry po perorálním podání i tak vede k jeho významné degradaci, takže v oběhu cirkuluje nejvýše 10 % jako bioaktivní substance. Snaha navýšit perorálně podanou dávku P tak, aby bylo dosaženo požadované sérové hladiny k adekvátní podpoře endometria, vede u většiny pacientek ke známkám únavy a spavosti [47]. Ani po navýšení perorální dávky P však nedochází k sekreční transformaci endometria [7]. K překonání tohoto nedostatku byl do luteální podpory zaveden dydrogesteron (Duphaston). Jedná se o retroprogesteron s dobrou perorální dostupností, který nemá estrogenní ani androgenní účinky a zajišťuje sekreční transformaci endometria. I když klinické výsledky s luteální podporou dydrogesteronem jsou srovnatelné s vaginálním užitím P [23], při užití dydrogesteronu je popisována neadekvátní sekreční transformace endometria [16].
Při intramuskulárním podání je P aplikován s vysokou efektivitou a bez ztrát, s nimiž se setkáváme při perorálním podávání. Používané dávky se liší a pohybují se mezi 25–100 mg denně. Účinnost intramuskulárního podání P vyjádřená klinickými a probíhajícími těhotenstvími je minimálně srovnatelná [30] nebo i výhodnější než vaginální aplikace [39]. Intramuskulární způsob podání P je ovšem pro pacientky méně komfortní, neboť vyžaduje denní injekční podání a ne zcela vzácně způsobuje závažné vedlejší účinky, jako alergické reakce v místě vpichu a tvorbu sterilních abscesů [41]. U jinak zdravých pacientek byl popsán i rozvoj eozinofilní pneumonie [6]. Z těchto důvodů není intramuskulární podání P k luteální podpoře doporučováno jako metoda první volby [16].
Po aplikaci P vaginálně byl zjištěn přímý přestup P z pochvy do dělohy, který obchází jaterní metabolismus [11]. Byly zjištěny vysoké hladiny P v děloze a nízké v séru, což vedlo k poznání protiproudového výměnného mechanismu v cévách pochvy a dělohy [8]. V současné době jsou na trhu k dispozici dva preparáty mikronizovaného P určené pro vaginální aplikaci (Utrogestan, Crinone 8%). Utrogestan (Laboratoires Besins Iscovesco, Paříž, Francie) je užíván k luteální podpoře vaginální cestou, i když původně byl vyvinut pro perorální užití. Podává se dvakrát až třikrát denně (600–800 mg/den). Crinone 8% progesteronový gel (Merck Serono Ltd, Feltham, UK) je první preparát specificky určený pro vaginální užití. Podává se jedenkrát denně (90 mg/den). Vaginální podání poskytuje řadu důležitých výhod, přičemž je minimálně tak efektivní jako intramuskulární podání [30], je přijatelnější pro pacientky, nevyžaduje speciální pomůcky a vzácně způsobuje alergické reakce. Pokud byly porovnány Utrogestan a Crinone 8%, nebyl mezi nimi zjištěn rozdíl v účinnosti, ale pacientky lépe snášely Crinone 8% [31, 44]. Z těchto důvodů je vaginální podání P k luteální podpoře metodou první volby.
Podobně jako při náhradě LH vzestupu k indukci finální maturace oocytů před jejich odběrem pomocí hCG lze stimulovat žlutá tělíska pomocí opakovaných injekcí hCG. Tato možnost je do značné míry korigována zásadní nevýhodou užití hCG k luteální podpoře, a to zvýšeným rizikem rozvoje ovariálního hyperstimulačního syndromu (OHSS) [2]. Existují dva typy hCG, humánní a rekombinantní [34]. HCG může být podáváno intramuskulárně nebo podkožně. Bylo prokázáno, že dostupnost hCG po podkožní aplikaci je nižší než po aplikaci intramuskulární [24, 32, 42, 50]. V roce 2005 byly jako nová možnost luteální podpory zavedeny GnRh. Předpokládá se, že GnRh agonisté by mohli během luteální fáze obnovit hladiny LH, a tím zajistit dostatečnou transormaci endometria [38]. V roce 2004 Tesarik publikoval užití GnRh agonistů šest dní po ICSI v programu darovaných oocytů. Tato studie prokázala růst implantation rate a zlepšení birth rate [46].
Pro podporu luteální fáze lze také použít progesteron v kombinaci s estradiolem podaným perorálně. Corpus luteum produkuje dva základní hormony, progesteron a estradiol. Úloha P v luteální podpoře je jasně potvrzena. Nebylo však dosud potvrzeno, že přidání E k luteální podpoře po COH by zvyšovalo pravděpodobnost otěhotnění. Farhi sice v roce 2000 prokázal, že přidání E by mohlo být přínosné po COH v dlouhém protokolu s GnRH-a [15], přesto metaanalýza z roku 2008 uvádí, že přidání E k P k luteální podpoře nezvyšuje pravděpodobnost dosažení těhotenství po IVF/ET ani v cyklech s GnRH-a, ani s GnRH-ant. [28].
Do současné doby nebyl všeobecně přijat konsenzus, do kdy je nezbytně nutné pokračovat v luteální podpoře během těhotenství po COH. Studie z roku 2002 vyhodnotila, zda prodloužení luteální podpory během časné gravidity má dopad na počet porodů po IVF/ET. Výsledky ukázaly na to, že luteální podpora by mohla být dostačující do stanovení hCG a její prodloužení v časné graviditě nemá vliv na potratovost a počet porodů [36]. Zdá se, že podávání P v časné graviditě po IVF pouze oddálí potrat, ale nezvýší poměr živě narozených dětí [40]. Přes tato fakta je luteální podpora běžně podávána od 10. dne až do 12. týdne gravidity [39].
Ostatní metody nezlepšují výsledky léčby IVF-ICSI, ET. Podání samotného hCG jako luteální podpory je spojeno s rozvojem OHSS, a proto se mu dnes již vyhýbáme.
Mikronizovaný progesteron užívaný perorálně je omezeně účinný, vaginální a intramuskulární aplikace P má srovnatelnou účinnost.
ZÁVĚR
V naší studii jsme neprokázali statisticky významné rozdíly v účinnosti a bezpečnosti mezi oběma preparáty. Crinone 8% byl pacientkami lépe snášen. Luteální podpora v programu IVF/ICSI-ET zůstává nedílnou součástí léčby. Pro luteální podporu mikronizovaným progesteronem se jeví podle výsledků naší studie výhodnější užití vaginálního gelu.
MUDr. Lucie Michnová
IVF Clinic, a.s.
Horní Lán 1328/6
779 00 Olomouc
e-mail: lucka.m@centrum.cz
Zdroje
1. Anthony, FW., Smith, EM., Gadd, SC., et al. Placental protein 14 secretion during in vitro fertilization cycles with and without human chorionic gonadotropin for luteal support. Fertil Steril, 1993, 59, 1, p. 187–191.
2. Araujo, E. Jr., Bernardini, L., Frederick, JL., et al. Prospective randomized comparison of human chorionic gonadotropin versus intramuscular progesterone for luteal-phase support in assisted reproduction. J Assist Reprod Genet, 1994, 11, 2, p. 74–78.
3. Beckers, NG., Laven, JS., Eijkemans, MJ., Fauser, BC. Follicular and luteal phase characteristics following early cessation of gonadotrophin-releasing hormone agonist during ovarian stimulation for in-vitro fertilization. Hum Reprod, 2000, 15, 1, p. 43–49.
4. Beckers, NG., Macklon, NS., Eijkemans, MJ., et al. Nonsupplemented luteal phase characteristics after the administration of recombinant human chorionic gonadotropin, recombinant luteinizing hormone, or gonadotropin-releasing hormone (GnRH) agonist to induce final oocyte maturation in in vitro fertilization patients after ovarian stimulation with recombinant follicle-stimulating hormone and GnRH antagonist cotreatment. J Clin Endocrinol Metab, 2003, 88, 9, p. 4186–4192.
5. Beckers, NG., Platteau, P., Eijkemans, MJ., et al. The early luteal phase administration of estrogen and progesterone does not induce premature luteolysis in normo-ovulatory women. Eur J Endocrinol, 2006, 155, 2, p. 355–363.
6. Bouckaert, Y., Robert, F., Englert, Y., et al. Acute eosinophilic pneumonia associated with intramuscular administration of progesterone as luteal phase support after IVF: case report. Hum Reprod, 2004, 19, 8, p. 1806–1810.
7. Bourgain, C., Devroey, P., Van Waesberghe, L., et al. Effects of natural progesterone on the morphology of the endometrium in patients with primary ovarian failure. Hum Reprod, 1990, 5, 5, p. 537–543.
8. Cicinelli, E., de Ziegler, D., Bulletti, C., et al. Direct transport of progesterone from vagina to uterus. Obstet Gynecol, 2000, 95, 3, p. 403–406.
9. Csapo, AI., Pulkkinen, MO., Ruttner, B., et al. The significance of the human corpus luteum in pregnancy maintenance. I. Preliminary studies. Am J Obstet Gynecol, 1972, 112, 8, p. 1061–1067.
10. Csapo, AI., Pulkkinen, MO., Wiest, WG. Effects of luteectomy and progesterone replacement therapy in early pregnant patients. Am J Obstet Gynecol, 1973, 115, 6, p. 759–765.
11. de Ziegler, D., Seidler, L., Schärer, E., et al. Non-oral administration of progesterone: experiences and possibilities of the transvaginal route. Praxis, 1995, 84, 5, p. 127–133.
12. Devoto, L., Vega, M., Kohen, P., et al. Endocrine and paracrine-autocrine regulation of the human corpus luteum during the mid-luteal phase. J Reprod Fertil, 2000, suppl., 55, p. 13–20.
13. Edwards, RG. An introduction to Bourn Hall: the biomedical backround of the Bourn Hall Clinic. In Brinsden, P. (ed.) Textbook of in vitro fertilization and assisted reproduction. 3rd ed. London: Informa Healthcare, 2007, p. 1–7.
14. Edwards, RG., Steptoe, PC., Purdy, JM. Establishing full-term human pregnancies using cleaving embryos grown in vitro. Br J Obstet Gynaecol, 1980, 87, 9, p. 737–756.
15. Farhi, J., Weissman, A., Steinfeld, Z., et al. Estradiol supplementation during the luteal phase may improve the pregnancy rate in patients undergoing in vitro fertilization-embryo transfer cycles. Fertil Steril, 2000, 73, 4, p. 761–766.
16. Fatemi, HM., Popovic-Todorovic, B., Papanikolaou, E., et al. An update of luteal phase support in stimulated IVF cycles. Hum Reprod Update, 2007, 13, 6, p. 581–590.
17. Fauser, BC., Devroey, P. Reproductive biology and IVF: ovarian stimulation and luteal phase consequences. Trends Endocrinol Metab, 2003, 14, 5, p. 236–242.
18. Ghosh, D., Stewart, DR., Nayak, NR., et al. Serum concentrations of oestradiol-17beta, progesterone, relaxin and chorionic gonadotrophin during blastocyst implantation in natural pregnancy cycle and in embryo transfer cycle in the rhesus monkey. Hum Reprod, 1997, 12, 5, p. 914–920.
19. Harper, MJ. The implantation window. Baillieres Clin Obstet Gynaecol, 1992, 6, 2, p. 351–371.
20. Hild-Petito, S., Fazleabas, AT. Expression of steroid receptors and steroidogenic enzymes in the baboon (Papio anubis) corpus luteum during the menstrual cycle and early pregnancy. J Clin Endocrinol Metab, 1997, 82, 3, p. 955–962.
21. Hohmann, FP., Laven, JS., de Jong, FH., et al. Low-dose exogenous FSH initiated during the early, mid or late follicular phase can induce multiple dominant follicle development. Hum Reprod, 2001, 16, 5, p. 846–854.
22. Honda, T., Fujiwara, H., Yamada, S., et al. Integrin alpha5 is expressed on human luteinizing granulosa cells during corpus luteum formation, and its expression is enhanced by human chorionic gonadotrophin in vitro. Mol Hum Reprod, 1997, 3, 11, p. 979–984.
23. Chakravarty, BN., Shirazee, HH., Dam, P., et al. Oral dydrogesterone versus intravaginal micronised progesterone as luteal phase support in assisted reproductive technology (ART) cycles: results of a randomised study. J Steroid Biochem Mol Biol, 2005, 97, 5, p. 416–420.
24. Chan, CC., Ng, EH., Chan, MM., et al. Bioavailability of hCG after intramuscular or subcutaneous injection in obese and non-obese women. Human Reprod, 2003, 18(11), p. 2294–2297.
25. Choavaratana, R., Manoch, D. Efficacy of oral micronized progesterone when applied via vaginal route. J Med Ass Thailand, 2004, 87(5), p. 455–458.
26. Jones, HW. Jr., Jones, GS., Hodgen GD., Rosenwaks, Z. (eds.) IVF-Norfolk. 1st ed. Baltimore: Williams & Wilkins, 1986, 232 p.
27. Kerin, JF., Broom, TJ., Ralph, MM., et al. Human luteal phase function following oocyte aspiration from the immediately preovular graafian follicle of spontaneous ovular cycles. Brit J Obstet Gynaec, 1981, 88(10), p. 1021–1028.
28. Kolibianakis, EM., Venetis, CA., Papanikolaou, EG., et al. Estrogen addition to progesterone for luteal phase support in cycles stimulated with GnRH analogues and gonadotrophins for IVF: a systematic review and meta-analysis. Hum Reprod, 2008, 23, 6, p. 1346–1354.
29. Lejeune, B., Camus, M., Deschacht, J., Leroy, F. Differences in the luteal phases after failed or successful in vitro fertilization and embryo replacement. J In Vitro Fert Embryo Transf, 1986, 3, 6, p. 358–365.
30. Levine, H. Luteal support in IVF using the novel vaginal progesterone gel Crinone 8%: results of an open-label trial in 1184 women from 16 US centers. Fertil Steril, 2000, 74, 4, p. 836–837.
31. Ludwig, M., Schwartz, P., Babahan, B., et al. Luteal phase support using either Crinone 8% or Utrogest: results of a prospective, randomized study. Eur J Obstet Gynecol Reprod Biol, 2002, 103, 1, p. 48–52.
32. Mannaerts, BM, Geurts, TB, Odink, J. A randomized three-way cross-over study in healthy pituitary-suppressed women to compare the bioavailability of human chorionic gonadotrophin (Pregnyl) after intramuscular and subcutaneous administration. Human Reproduction 1998; 13(6):1461–4.
33. Minas, V., Loutradis, D., Makrigiannakis, A. Factors controlling blastocyst implantation. Reprod Biomed Online, 2005, 10, 2, p. 205–216.
34. Mochtar, MH., Van der Veen, F., Ziech, M., et al. Recombinant luteinizing hormone (rLH) for controlled ovarian hyperstimulation in assisted reproductive cycles. Cochrane Database of Systematic Reviews 2007, Issue 2. [DOI: 10.1002/14651858.CD005070.pub2.]
35. Nosarka, S., Kruger, T., Siebert, I., Grové, D. Luteal phase support in in vitro fertilization: meta-analysis of randomized trials. Gynecol Obstet Invest, 2005, 60, 2, p. 67–74.
36. Nyboe Andersen, A., Popovic-Todorovic, B., Schmidt, KT., et al. Progesterone supplementation during early gestations after IVF or ICSI has no effect on the delivery rates: a randomized controlled trial. Hum Reprod, 2002, 17, 2, p. 357–361.
37. Penzias, AS. Luteal phase support. Fertil Steril, 2002, 77, 2, p. 318–323.
38. Pirard, C., Donnez, J., Loumaye, E. GnRH agonist as novel luteal support: results of a randomized, parallel group, feasibility study using intranasal administration of buserelin. Hum Reprod 2005, 20(7), p. 1798–1804.
39. Pritts, EA., Atwood, AK. Luteal phase support in infertility treatment: a meta-analysis of the randomized trials. Hum Reprod, 2002, 17, 9, p. 2287–2299.
40. Proctor, A., Hurst, BS., Marshburn, PB., et al. Effect of progesterone supplementation in early pregnancy on the pregnancy outcome after in vitro fertilization. Fertil Steril, 2006, 85, 5, p. 1550–1552.
41. Propst, AM., Hill, JA., Ginsburg, ES., et al. A randomized study comparing Crinone 8% and intramuscular progesterone supplementation in in vitro fertilization-embryo transfer cycles. Fertil Steril, 2001, 76, 6, p. 1144–1149.
42. Saal, W., Glowania, HJ., Hengst, W., Happ, J. Pharmacodynamics and pharmacokinetics after subcutaneous and intramuscular injection of human chorionic gonadotropin. Fertil Steril, 1991, 56(2), p. 225–229.
43. Scott, R., Navot, D., Liu HC., Rosenwaks, Z. A human in vivo model for the luteoplacental shift. Fertil Steril, 1991, 56, 3, p. 481–484.
44. Simunic, V., Tomic, V., Tomic, J., Nizic D. Comparative study of the efficacy and tolerability of two vaginal progesterone formulations, Crinone 8% gel and Utrogestan capsules, used for luteal support. Fertil Steril, 2007, 87, 1, p. 83–87.
45. Smitz, J., Devroey, P., Camus, M., et al. The luteal phase and early pregnancy after combined GnRH-agonist/HMG treatment for superovulation in IVF or GIFT. Hum Reprod, 1988, 3, 5, p. 585–590.
46. Tesarik, J., Hazout, A., Mendoza, C. Enhancement of embryo developmental potential by a single administration of GnRH agonist at the time of implantation. Human Reprod, 2004, 19(5), p. 1176–1180.
47. Toner, JP. The luteal phase: luteal support protocols. In Gardner, DK., Weissman, A., Howles, CM. et al. (eds.) Textbook of assisted reproductive techniques. 2nd ed. London: Tailor & Francis, 2004, p. 639–650.
48. Vande Wiele, RL., Bogumil, J., Dyrenfurth, I., et al. Mechanisms regulating the menstrual cycle in women. Recent Prog Horm Res, 1970, 26, p. 63–103.
49. Whelan, JG. 3rd, Vlahos, NF. The ovarian hyperstimulation syndrome. Fertil Steril, 2000, 73, 5, p. 883–896.
50. Wikland, M., Borg, J., Forsberg, AS., et al. Human chorionic-gonadotropin self-administered by the subcutaneous route to induce oocyte maturation in an in-vitro fertilization and embryo - transfer program. Human Reprod, 1995, 10(7), p. 1667–1670.
51. van der Linden, M., Buckingham, K., Farquhar, C., et al. Luteal phase support for assisted reproduction cycles. Cochrane Database of Systematic Reviews 2011, Issue 10. Art. No.: CD009154. doi: 10.1002/ 14651858.CD009154.pub2.
52. www.uzis.cz. (data zde uvedená se vztahují ke stavu registru ze dne 29. června 2015, www.uzis.cz )
53. www eshre (mezinárodní data vychází z evropského registru asistované reprodukce - EIM, fungujícího pod správou Evropské společnosti lidské reprodukce a embryologie -ESHRE) ESHRE, 2014 b. ART fact sheet. ESHRE. European Society of Human Reproduction and Embryology [online]. 2014 [cit. 2015-07-01]. Dostupné z: http://www.eshre.eu/Guidelines-and-Legal/ART-fact-sheet.aspx
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Stupeň spokojenosti pacientů pokračujících v léčbě hyperaktivního močového měchýře mirabegronemČlánek EditorialČlánek Management recidivující stresové inkontinence moči po selhání efektu anti-inkontinentních operacíČlánek MANAGEMENT TĚHOTENSTVÍ S RIZIKEM ROZVOJE HEMOLYTICKÉ NEMOCI PLODU A NOVOROZENCEDoporučený postupČlánek Dopis redakci
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2017 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Pacientky s obezitou, hypertenzí a nutností aplikace inzulinu při diagnóze gestační diabetes mellitus vyžadují zvýšenou porodnickou péči
- Jsou rizikové faktory v prenatálním a perinatálním období důležité pro vznik schizofrenie?
-
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8% - Úspěšná transplantace ovariální tkáně u pacientky s ovariálním selháním po onkologické léčbě
- Vliv glykosylace hCG na jeho funkce v ženské reprodukci
- Stupeň spokojenosti pacientů pokračujících v léčbě hyperaktivního močového měchýře mirabegronem
- Editorial
- Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
- Management recidivující stresové inkontinence moči po selhání efektu anti-inkontinentních operací
- Analýza materskej morbidity a mortality v Slovenskej republike v rokoch 2007–2012
- Chirurgická léčba stresové inkontinence moči u žen – od jehel až k (mini)pásce
- Současné postavení vaginálních implantátů při řešení sestupu pánevních orgánů
-
GESTAČNÍ DIABETES MELLITUS
Doporučený postup -
MANAGEMENT TĚHOTENSTVÍ S RIZIKEM ROZVOJE HEMOLYTICKÉ NEMOCI PLODU A NOVOROZENCE
Doporučený postup - Dopis redakci
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8% - Jsou rizikové faktory v prenatálním a perinatálním období důležité pro vznik schizofrenie?
- Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
- Chirurgická léčba stresové inkontinence moči u žen – od jehel až k (mini)pásce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



