-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Úspěšná transplantace ovariální tkáně u pacientky s ovariálním selháním po onkologické léčbě
Successful ovarian tissue transplantation in woman with premature ovarian failure after gonadotoxic treatment
Objective:
To demonstrate successful restoration of ovarian function after ovarian transplantation in young woman with premature ovarian failure after gonadotoxic treatment of breast carcinoma and to discuss its possibilities.Design:
Case report.Setting:
Sanatorium Pronatal, Prague.Case report:
We demonstrate successful ovarian transplantation and restoration of ovarian function in 33 years old woman after cryopreservation of ovarian tissue performed before chemotherapy and radiotherapy of breast carcinoma and discuss possibilities of this approach in women diagnosed with cancer and subsequent risk of ovarian silure.Conclusion:
Cryopreservation of ovarian tissue is one of efficient options to preserve fertility in young patients facing gonadotoxic treatment.Keywords:
ovarian tissue, cryopreservation, oncofertility
Autoři: T. Mardešić; L. Jelínková; L. Melicharová
Působiště autorů: Sanatorium Pronatal, Praha, vedoucí lékař doc. MUDr. T. Mardešić, CSc.
Vyšlo v časopise: Ceska Gynekol 2017; 82(1): 38-41
Souhrn
Cíl studie:
Na případu úspěšné transplantace rozmražené ovariální tkáně u mladé ženy s ovariálním selháním po gonadotoxické léčbě karcinomu prsu demonstrovat a diskutovat možnosti tohoto postupu.Typ práce:
Kazuistika.Název a sídlo pracoviště:
Sanatorium Pronatal, Praha.Vlastní pozorování:
Na případu úspěšné transplantace u 33leté pacientky po zamražení ovariální tkáně před zahájením chemoterapie a radioterapie pro karcinom prsu demonstrujeme možnosti tohoto postupu u mladých žen s onkologickou diagnózou a rizikem předčasného ovariálního selhání.Závěr:
Kryokonzervace ovariální tkáně je jeden z účinných postupů zachování budoucí fertility pacientek před gonadotoxickou léčbou.Klíčová slova:
ovariální tkáň, kryokonzervace, onkofertilitaÚVOD
Z údajů mezinárodních registrů vyplývá, že více než 10 % zhoubných nádorových onemocnění je diagnostikováno u mladých pacientů, často ještě před tím, než stačili založit vlastní rodinu. Dokumentován je nárůst incidence těchto onemocnění, ale stejně tak se zvyšuje i procento vyléčených pacientů. Zajištění optimální kvality života vyléčených pacientů – včetně zachování budoucí fertility – se tak stává jedním z významných úkolů onkologických týmů [12]. Nezbytná chemoterapie a radioterapie však často významně poškodí reprodukční funkce s následkem trvalé poruchy plodnosti [13], předčasné ovariální selhání (v závislosti na léčebném protokolu a dávce ) je diagnostikováno u 20–80 % pacientek. Ani pokračující ovariální funkce po onkologické léčbě však není zárukou normální plodnosti – naděje na spontánní koncepci u žen ve věku vyšším než 25 let se udává pouze v 5 % [15]. Dalšími indikacemi mohou být nemoci na podkladě autoimunity, geneticky podmíněná onemocnění spojená s předčasným ovariálním selháním či benigní onemocnění vyžadující ovarektomii [17].
Jednou z možností ochrany reprodukčních funkcí je odběr a kryokonzervace ovariální tkáně, které lze provést bez oddalování potřebné onkologické léčby, či dokonce po jejím zahájení [5]. Jako experimentální práce byl tento postup uplatňován již od konce tisíciletí a první těhotenství po ortotopické transplantaci bylo popsáno v roce 2004 [7], v současné době jsou již publikovány soubory s desítkami narozených dětí. I přes veškeré pokroky v této oblasti je však stále nutno počítat pouze s omezenou dobou funkčnosti transplantovaných štěpů a intenzivně řešeným tématem je riziko transplantace tkáně s metastatickými buňkami původního onkologického onemocnění [10].
V České republice některá pracoviště reprodukční medicíny spolupracující s onkologickými pracovišti tento postup pacientkám zajišťují, domácí zkušenosti s transplantací kryokonzervované tkáně doposud publikovány nebyly. Naše kazuistika popisuje pacientku s předčasným ovariálním selháním po léčbě karcinomu prsu, u které jsme po transplantaci dosáhli normalizace hormonálních parametrů a obnovy menstruačního cyklu.
VLASTNÍ POZOROVÁNÍ
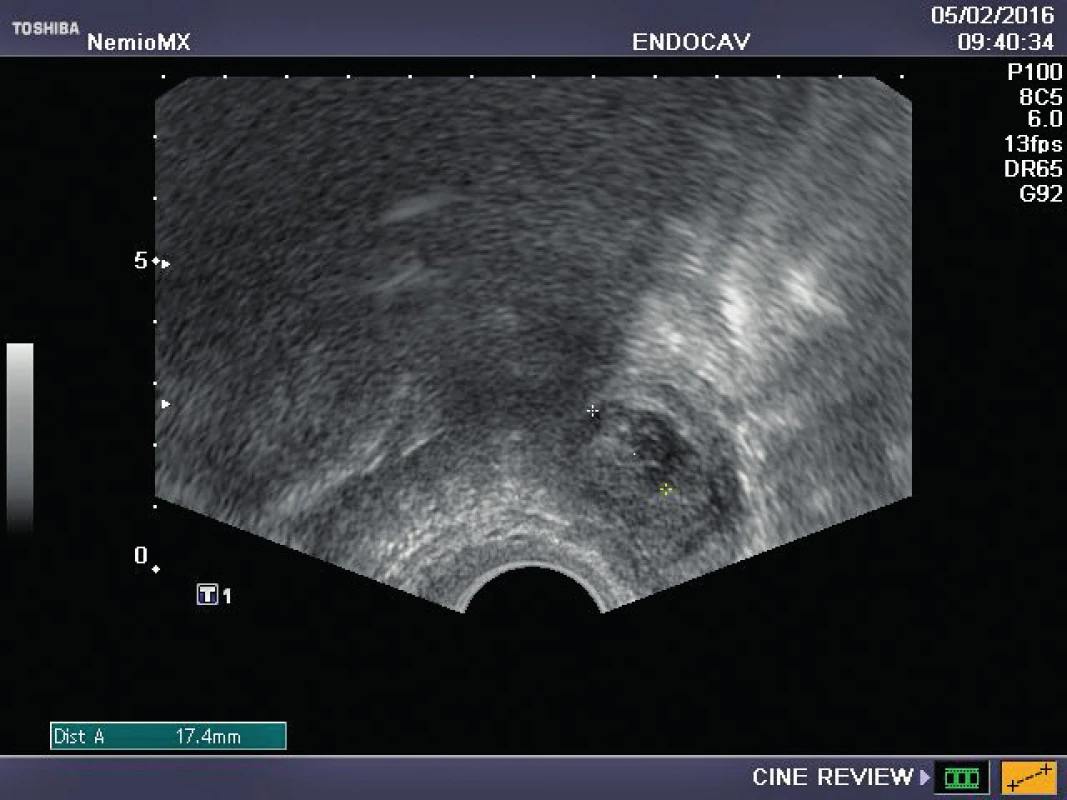
Referujeme o pacientce s negativní rodinnou onkologickou anamnézou, u které byl ve věku 29 let diagnostikován karcinom prsu. Před zahájením onkologické léčby (tumorectomia mammae l. sin., exenteratio axillae l. sin. s následnou chemoterapií a radioterapií) byla provedena resekce ovarií a zamražen ovariální kortex. Ovariální tkáň byla kryokonzervována a následně rozmražena v komerčně dostupných médiích používaných pro embrya (Embryo Freezing Pack a Embryo Thawing Pack (Origio), obsahující propandiol a sacharózu jako kryoprotektivum. Po onkologické léčbě byla dokumentována sekundární amenorea, dva roky po léčbě byla potvrzena dlouhodobá remise, následně onkolog souhlasí s případnou graviditou. Při vstupním vyšetření byla zjištěna děloha v anteverzi-flexi, podélně 60 mm, v děloze atrofické čárkovité endometrium, ovaria velmi malá, homogenní, bez patrných antrálních folikulů, špatně zobrazitelná. Vyšetření ovariální rezervy (FSH 62,7, LH 19,9, AMH méně než 0,1) potvrzuje ovariální selhání. Během následujícího roku FSH postupně stoupá až na hodnotu 139 U/l, LH 62,8 U/l. Rozhodnuto bylo o transplantaci poloviny zamražených vzorků kryokonzervované ovariální tkáně. Dne 16. 10. 2015 byla provedena laparoskopie: pravé ovarium po resekci má podobu „streak“ gonády, transplantace do tohoto ovaria je proto technicky nemožná. Levé ovarium je jen mírně zmenšeno, bez známek folikulární aktivity, v něm byl vypreparován pod tunica albuginea prostor, do kterého bylo vloženo pět proužků rozmražené ovariální tkáně. Po laparoskopii je pacientka zcela bez obtíží, v měsíčních intervalech je monitorována funkce transplantovaných ovariálních štěpů. Při kontrole 2. 2. 2016 byl nalezen v levém ovariu dominantní folikul 18,5 mm v průmětu, následující den 20,5 mm a za 48 hodin byla prokázána ovulace a přítomnost žlutého tělíska s následnou adekvátní sekreční transformací endometria (obr. 1–3). Celý ovulační cyklus byl dokumentován i monitorováním hormonálních hladin (graf 1–3). Snaha o koncepci je komplikována sníženou plodností partnera pacientky. Proto byla v březnu a květnu 2016 provedena stimulace ovaria pro mimotělní oplodnění, pokaždé i přes maximální dávky gonadotropinů pouze monofolikulární vývoj bez zisku oocytu. Pacientka má však od února 2016 pravidelné spontánní menstruační cykly, 26.7. 2016 hladina FSH 11 IU/l, hladina AMH 0,04 ng/ml.
Obr. 1. Preovulační folikul v ovariu po transplantaci rozmražené tkáně 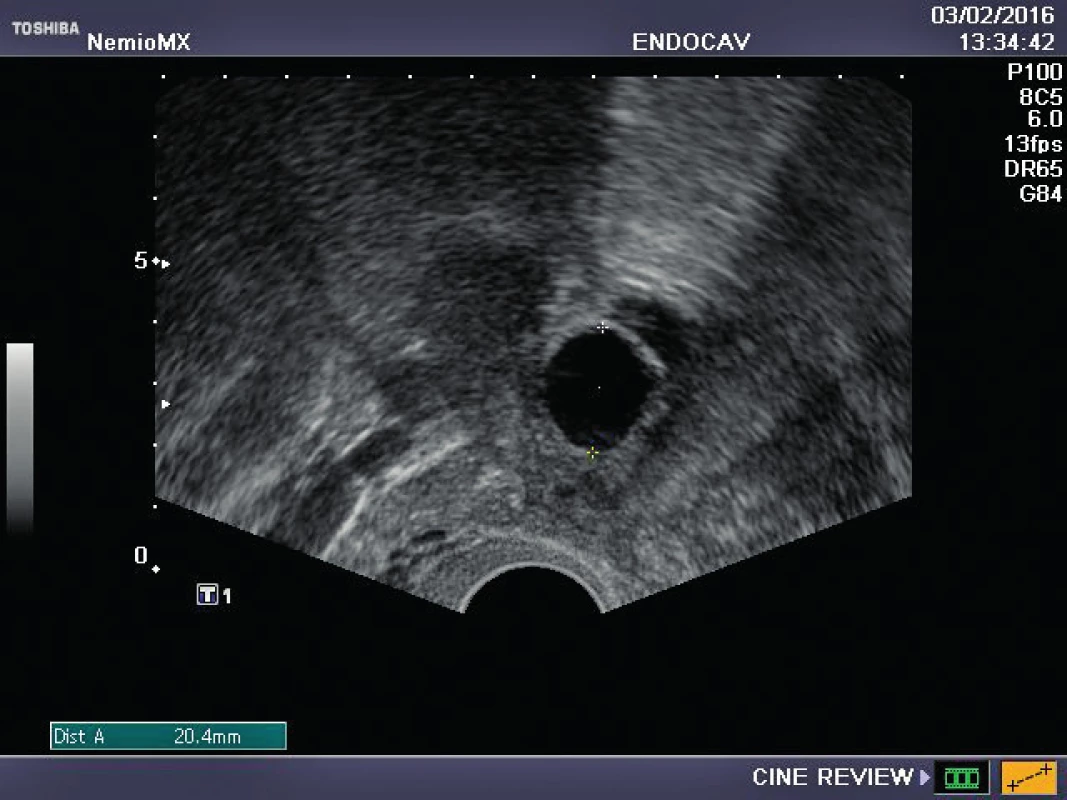
Obr. 3. Sekrečně transformované endometrium 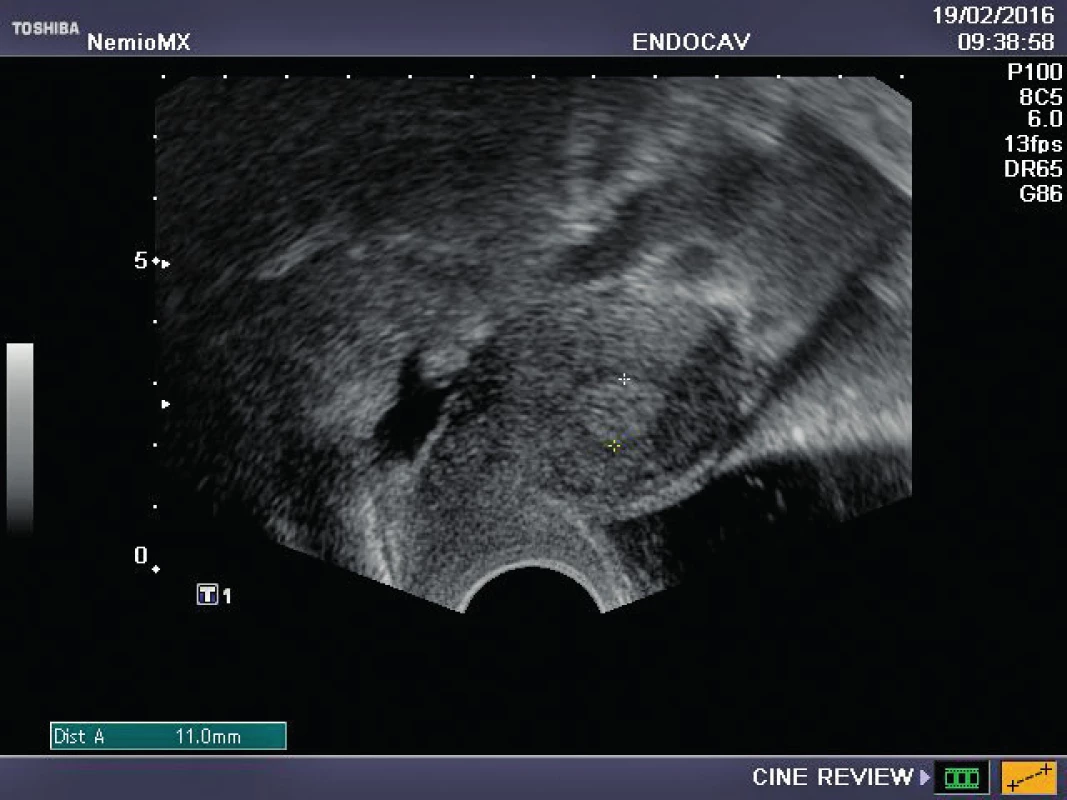
Graf 1. Průběh hladin FSH po transplantaci 
Graf 2. Estradiol v dokumentovaném ovulačním cyklu po transplantaci 
Graf 3. Progesteron v dokumentovaném ovulačním cyklu po transplantaci 
DISKUSE
Kryokonzervace ovariální tkáně u žen s plánovanou gonadotoxickou léčbou a nedokončenými reprodukčními plány se stává rutinním postupem v dobře fungujících centrech reprodukční medicíny [11, 21]. Zamražení ovariální tkáně se uplatňuje především u adolescentních, prepubertálních, či dokonce dětských pacientek, kde žádný jiný z existujících postupů použít nelze [18]. Možnosti tohoto postupu jsou nejlépe doloženy dokumentovanými porody po autotransplantacích [2, 8]. Kritickým časovým úsekem je revaskularizace transplantované tkáně, ke které dochází na podkladě prorůstání novotvořenými cévami. Tato ischemická fáze způsobuje ztrátu 25–95 % přítomných primordiálních folikulů, jejímž důsledkem je redukce objemu štěpu, jeho fibróza a následně pouze omezené funkční přežití [14, 16]. Doba přežití štěpu dále závisí zejména na věku pacientky při odběru tkáně, objemu transplantované tkáně a případné předchozí gonadotoxické léčbě. Hlavní předností po úspěšné transplantaci je obnovení endokrinních i reprodukčních funkcí ovariální tkáně. Obnovení ovariální funkce po úspěšné transplantaci lze očekávat za čtyři až pět měsíců, neboť více než 120 dnů je zapotřebí k zahájení růstu folikulů a přibližně 85 dnů potřebuje folikul k vývoji od preantrálního stadia do zralého folikulu [9]. Imbert ve své práci [10] popisuje průměrnou dobu potřebnou k obnovení funkce štěpu pět měsíců – obnovení funkce štěpu je spojeno s návratem hladin gonadotropinů do premenopauzálních hodnost, hladina AMH zůstala nízká u všech pacientek. Tyto údaje přesně odpovídají naší zkušenosti s výše popsanou pacientkou. Ani přes veškeré pokroky nejsou sjednoceny indikace, zejména věkový limit: zatímco některá centra dodržují horní věkovou hranici 30 let [1, 2], jiná provádějí kryokonzervaci ovariální tkáně až do věku ženy 39 let [6, 17]. K většině publikovaných těhotenství po transplantaci ovariální tkáně došlo však u žen, kterým v době zamražení tkáně bylo méně než 30 let [8].
Rizikem tohoto postupu je především nebezpečí transplantace tkáně obsahující metastatické buňky původního nádoru [3, 20]. Toto riziko závisí především na typu a rozsahu nádoru. S ohledem na riziko metastáz do ovarií byla maligní onemocnění rozdělena do tří kategorií (nízké, střední a vysoké riziko), i tak však údaje o skutečném riziku možných metastáz jsou velmi neúplné. S ohledem na vysoké riziko se kryokonzervace ovariální tkáně s následnou transplantací nedoporučuje u žen po úspěšné léčbě leukemií [4]. Velký důraz je proto kladen na vypracování alternativních strategií – u žen s estrogen-dependentními nádory (především karcinom prsu) lze u velké části pacientek provést stimulaci ovarií s následnou kryokonzervací zralých oocytů či embryí protokolem, který nezvyšuje hladiny estrogenů (gonadotropiny v kombinaci s letrozolem). Dalším nadějným postupem se může v budoucnu stát in vitro maturace primordiálních folikulů – v roce 2014 bylo popsáno první úspěšné těhotenství po použití in vitro maturovaných oocytů [19].
ZÁVĚR
Popsali jsme úspěšnou ortotopickou transplantaci zamražené ovariální tkáně, která vedla k obnovení ovariální funkce u mladé ženy s ovariálním selháním po úspěšné léčbě karcinomu prsu. Kryokonzervace ovariální tkáně je jeden z účinných postupů zachování budoucí fertility pacientek před gonadotoxickou léčbou. S ohledem na prognostický význam věku pacientky je tento postup indikován především u prepubertálních dívek a u mladých dospělých.
Doc. MUDr. Tonko Mardešić, CSc.
Sanatorium Pronatal
Na dlouhé mezi 4/12
147 00 Praha 4
e-mail: sanatorium@pronatal.cz
Zdroje
1. Abir, R., Ben-Haroush, A., Felz, C. Selection of patients before and after anticancer treatment for ovarian cryopreservation. Hum Reprod, 2008, 23, p. 869–877.
2. Anderson, RA., Wallace, WH., Baird, DT. Ovarian cryopreservation for fertility preservation: indications and outcomes. Reproduction, 2008, 136, p. 681–689.
3. Azem, F., Hasson, J., Ben-Yosef, D. Histologic evaluation of fresh human ovarian tissue efore cryopreservation. Int J Gynecol Pathol, 2010, 29, p. 19–23.
4. Bastings, L., Beerendonk, CC., Westphal, JR., et al. Autotransplantation of cryopreserved ovarian tissue in cancer survivors and the risk of reintroducing malignancy: a systematic review. Hum Reprod Update, 2013, 19, p. 483–506.
5. Demeestere, I., Simon, P., Englert, Y., et al. Preliminary experience of ovarian tissue cyropreservation procedure: alternatives, perspectives and feasibility. Reprod Biomed Online, 2003, 7, p. 572–579.
6. Dolmans, MM., Jadoul, P., Gilliaux, S., et al. A review of 15 years of ovarian tissue bank activities. J Assist Reprod Genet, 2013, 30, p. 305–314.
7. Donnez, J., Dolmans, MM., Demylle, D., Jadoul, P. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet, 2004, 364, p. 1405–1410.
8. Donnez, J., Dolmans, MM., Pellicer, A., et al. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation. Fertil Steril., 2013, 99, p. 1503–1513.
9. Gougeon, A. Regulation of ovarian follicular development in primates: facts and hypotheses. Endocr Rev, 1996, 17, p. 121–155.
10. Imbert, R., Moffa, F., Tsepelidis, S., et al. Safety and usefulness of cryopreservation of ovarian tissue to preserve fertility: a 12-year retrospective analysis. Hum Reprod, 2014, 29, p. 1931–1940.
11. Jeruss, JS., Woodruff, TK. Preservation of fertility in patients with cancer. N Engl J Med, 2009, 360, p. 902–911.
12. Lee, SJ., Schover, LR., Partridge, AH. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol, 2006, 24, p. 2917–2931.
13. Levine, J., Canada, A., Stern, CJ. Fertility preservation in adolescents and young adults with cancer. J Clin Oncol, 2010, 28, p. 4831–4841.
14. Liu, L., Wood, GA., Morikawa, L., et al. Restoration of fertility by orthotopic transplantation of frozen adult mouse ovaries. Hum Reprod, 2008, 23, p. 122–128.
15. Lobo, RA. Potential options for preservativation of fertility in women. N Engl J Med, 2005, 353, p. 64–73.
16. Nisolle, M., Casanas-Roux, F., Qu, J., Donnez, J. Histologic and ultrastructural evaluation of fresh and frozen-thawed human ovarian xenografts in nude mice. Fertil Steril, 2000, 74, p. 122–129.
17. Oktay, K., Oktem, O. Ovarian cryopreservation and transplantation for fertility preservation for medical indications: report of an ongoing experience. Fertil Steril, 2008, 82, p. 515–524.
18. Oktay, K., Sonmezer, M. Ovarian tissue banking for cancer patients: fertility preservation, not just ovarian cryopreservation. Hum Reprod, 2004, 19, p. 477–480.
19. Prasath, EB., Chan, ML., Wong, WH., et al. First pregnancy and live birth resulting from cryopreserved embryos obtained from in vitro matured oocytes after oohorectomy in an ovarian cancer patient. Hum Reprod, 2014, 29, p. 276–278.
20. Sanchez-Serrano, M., Novella-Maestre, E., Rosello-Sastre, E., Pellicer, A. Malignant cells are not found in ovarian cortex from breast cancer patiens undergoing ovarian cortex cryopreservation. Hum Reprod, 2009, 24, p. 2238–2243.
21. Silber, S., Kagawa, N., Kuwayama, M., Gosden, R. Duration of fertility after fresh and frozen ovarian transplantation. Fertil Steril, 2010, 94, p. 2191–2196.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Stupeň spokojenosti pacientů pokračujících v léčbě hyperaktivního močového měchýře mirabegronemČlánek EditorialČlánek Management recidivující stresové inkontinence moči po selhání efektu anti-inkontinentních operacíČlánek MANAGEMENT TĚHOTENSTVÍ S RIZIKEM ROZVOJE HEMOLYTICKÉ NEMOCI PLODU A NOVOROZENCEDoporučený postupČlánek Dopis redakci
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2017 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Pacientky s obezitou, hypertenzí a nutností aplikace inzulinu při diagnóze gestační diabetes mellitus vyžadují zvýšenou porodnickou péči
- Jsou rizikové faktory v prenatálním a perinatálním období důležité pro vznik schizofrenie?
-
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8% - Úspěšná transplantace ovariální tkáně u pacientky s ovariálním selháním po onkologické léčbě
- Vliv glykosylace hCG na jeho funkce v ženské reprodukci
- Stupeň spokojenosti pacientů pokračujících v léčbě hyperaktivního močového měchýře mirabegronem
- Editorial
- Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
- Management recidivující stresové inkontinence moči po selhání efektu anti-inkontinentních operací
- Analýza materskej morbidity a mortality v Slovenskej republike v rokoch 2007–2012
- Chirurgická léčba stresové inkontinence moči u žen – od jehel až k (mini)pásce
- Současné postavení vaginálních implantátů při řešení sestupu pánevních orgánů
-
GESTAČNÍ DIABETES MELLITUS
Doporučený postup -
MANAGEMENT TĚHOTENSTVÍ S RIZIKEM ROZVOJE HEMOLYTICKÉ NEMOCI PLODU A NOVOROZENCE
Doporučený postup - Dopis redakci
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Srovnání vaginálního užití mikronizovaného progesteronu k luteální podpoře.
Randomizovaná studie porovnávající Utrogestan a Crinone 8% - Jsou rizikové faktory v prenatálním a perinatálním období důležité pro vznik schizofrenie?
- Ovce jako experimentální model pro studium vlivu těhotenství, porodu a operačních technik na pánevní dno
- Chirurgická léčba stresové inkontinence moči u žen – od jehel až k (mini)pásce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy