-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam hladin bazického fibroblastového růstového faktoru u pacientek s tumorem ovaria
Importance of basal fibroblast growth factor levels in patients with ovarian tumor
Objective:
Evaluation of importance of serum levels of basic fibroblast growth factor (bFGF) in patients with ovarian cancer, patients with border-line ovarian tumor, patients with benign ovarian cyst and women with normal ovarian tissue.
Design:
Prospective clinical study.
Setting:
Department of Gynecology and Obstetrics, Charles University, Faculty of Medicine in Hradec Kralove and University Hospital Hradec Kralove.
Methods:
Measurement of serum levels of bFGF by ELISA using reagents of company R&D Systems prior to treatment in a total of 74 consecutive coming women.
Results:
Serum level of bFGF from peripheral blood before treatment was significantly higher (p < 0.05) in patients with newly diagnosed ovarian cancer (n = 22), Med = 10.35 pg/ml (1.2–46.2 pg/ml) compared to patients with a border-line ovarian tumor (n = 9), Med = 5.4 pg/ml (1.6–6.8 pg/ml), patients with benign ovarian cyst (n = 24), Med = 5.2 pg/ml (0.1–67.2 pg/ml), and to women with normal ovarian tissue (n = 19) Med = 4.3 pg/ml (0.9–13.4 pg/ml). There isn‘t strong linear correlation (Spearman‘s rank correlation coefficient = 0.208791) between the serum level of bFGF and CA125 collected from peripheral blood before primary surgery or neoadjuvant chemotherapy in a group of patients with ovarian cancer (n = 14). We have not found significance correlation between age and serum levels of bFGF in patients with ovarian cancer, with border-line ovarian tumor, with benign ovarian cyst and in women with normal ovarian tissue.
Conclusion:
Serum levels of bFGF in patients with ovarian cancer are significantly higher than in patients with a border-line ovarian tumor, with benign ovarian cyst and in women with normal ovarian tissue regardless of age of patients.
Keywords:
ovarian cancer, basic fibroblast growth factor (bFGF), angiogenesis
Autoři: V. Študent 1; C. Andrýs 2
; O. Souček 2
; J. Špaček 1; J. Tošner 1; I. Sedláková 1
Působiště autorů: Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D. 1; Ústav klinické imunologie a alergologie FN, Hradec Králové, přednosta prof. RNDr. J. Krejsek, CSc. 2
Vyšlo v časopise: Ceska Gynekol 2018; 83(3): 169-176
Souhrn
Cíl studie:
Zhodnocení významu sérových hladin bazického fibroblastového růstového faktoru (bFGF) u pacientek s karcinomem ovaria, pacientek s borderline tumorem ovaria, pacientek s benigní cystou vaječníku a žen s normální tkání vaječníku.
Typ studie:
Prospektivní klinická studie.
Název a sídlo pracoviště:
Porodnická a gynekologická klinika Lékařské fakulty Univerzity Karlovy v Hradci Králové a Fakultní nemocnice Hradec Králové. Ústav klinické imunologie a alergologie Fakultní nemocnice Hradec Králové.
Metodika:
Stanovení koncentrací bFGF v séru metodou ELISA pomocí reagencií firmy R&D Systems před léčbou u celkem 74 konsekutivně přicházejících žen.
Výsledky:
Sérová hladina bFGF z periferní krve před léčbou byla signifikantně vyšší (p < 0,05) u pacientek s nově diagnostikovaným karcinomem ovaria (n = 22), medián = 10,35 pg/ml (1,2–46,2 pg/ml) než u pacientek s borderline tumorem ovaria (n = 9), med. = 5,4 pg/ml (1,6–6,8 pg/ml), u pacientek s benigní cystou vaječníku (n = 24), med. = 5,2 pg/ml (0,1–67,2 pg/ml) a u žen s normální tkání vaječníku (n = 19), med. = 4,3 pg/ml (0,9–13,4 pg/ml). Mezi sérovou hladinou bFGF a Ca125 odebraných z periferní krve před primární operační léčbou nebo neoadjuvantní chemoterapií ve skupině pacientek s karcinomem ovaria (n = 14) není silná lineární souvislost (Spearmanův koeficient pořadové korelace = 0,208791). Nenalezli jsme významnou souvislost hodnot sérového bFGF s věkem pacientek s karcinomem ovaria, s borderline tumorem ovaria, s benigní cystou vaječníku a žen s normální tkání vaječníku.
Závěr:
Hladiny bFGF v séru pacientek s karcinomem ovaria jsou signifikantně vyšší než u pacientek s borderline tumorem ovaria, s benigní cystou vaječníku a u žen s normální tkání vaječníku nezávisle na věku pacientek.
klíčová slova
karcinom ovaria, bazický fibroblastový růstový faktor, bFGF, angiogeneze
ÚVOD
V roce 2015 bylo v České republice hlášeno 1023 nových případů pacientek se zhoubným nádorem vaječníku, zemřelo na něj 734 pacientek. Tři čtvrtiny případů ovariálních malignit jsou zachyceny v pokročilých stadiích onemocnění. Ženám je v době stanovení diagnózy nejčastěji od 75 do 79 let. Mortalita onemocnění je dlouhodobě téměř stacionární [3]. Nejčastějším tumorem a zároveň i tumorem s největší mortalitou je nízce diferencovaný epiteliální ovariální karcinom (HGS-OvCa). Doba přežití pacientky je závislá na velikosti rezidua neodstraněné nádorové tkáně při chirurgickém výkonu, chemosenzitivitě onemocnění, celkovém zdravotním stavu a věku pacientky. Udává se pětileté přežití 7–52 % u pokročilých a 61–84 % u časně zachycených HGS-OvCa [2]. Z nádorových markerů v séru je nejčastěji užívaný carcinoma antigen 125 (Ca125), který pro svou vysokou falešnou pozitivitu není vhodný pro populační screening ovariálního karcinomu, využívá se zejména v jeho follow-up. Doposud se nenalezla vhodná metoda populačního screeningu HGS-OvCa [19].
Pro vývoj ovariálního karcinomu je velmi důležitá angiogeneze. Jedná se o mnohakaskádový dynamický děj, kterého se účastní řada faktorů včetně imunitního systému. Nádorová angiogeneze je ve srovnání s fyziologickou bouřlivý deregulovaný proces. Tkáň velikosti více než 2 mm ke svému růstu a k zajištění dostatečného přísunu kyslíku potřebuje cévy. Od roku 2014 se v ČR pacientkám s karcinomem ovaria v indikovaných případech podává bevacizumab. Tato protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF) podle studie ICON7 přináší při aplikaci s první linií standardní léčby prodloužení celkového přežití z 30,3 na 39,7 měsíců (p = 0,0072) u pacientek s pokročilým nízce diferencovaným HGS-OvCa s pooperačním nádorovým reziduem nad 1 cm. Jsou publikována pozitivní data klinických studií fáze III i z jiných než antiVEGF-dependentní cesty blokace. Důležité je si uvědomit, že zejména synergické (agonistické i antagonistické) působení více faktorů má potřebný vliv na karcinogenezi. Blokování signálních drah na více úrovních může přispět k posunu v léčbě ovariálních malignit. Problematická je toxicita biologické terapie. S množstvím blokovaných faktorů vždy neroste efekt terapie, naopak často narůstají vedlejší účinky [4].
Mezi hlavní proangiogenní regulátory vedle VEGF patří bazický růstový faktor fibroblastů(bFGF). Tyto mitogeny endoteliálních buněk se přímo podílejí na neovaskularizaci a proliferaci tkání [7, 11]. Postnatálně bFGF napomáhá folikulogenezi, rychlému vývoji corpus luteum a ovariální hormonální produkci, jeho dysregulace vede až k rozvoji syndromu polycystických vaječníků [10, 17]. Dimery FGF se typicky vážou na specifické receptory FGFR, které ve zvýšené míře v tkáni exprimuje řada epiteliálních zhoubných nádorů [6, 20]. Cílená léčba zaměřená na inhibici osy bFGF-FGFR prokazatelně zvyšuje apoptózu buněk karcinomu ovaria, v nádorové tkáni i v cirkulaci se projeví potlačením angiogeneze tumoru a může redukovat objem tumoru [8, 14, 21]. Naopak bFGF s VEGF zvyšují kvalitu a schopnost přežití transplantované ovariální tkáně [9, 24]. Jednoznačné závěry o koncentracích bFGF v lidské krvi chybí. Hladiny faktorů v plazmě se standardně stanovují pomocí ELISA (fotometrická enzymoimunoanalýza).
Cílem této práce je porovnání hodnot bFGF u pacientek s karcinomem ovaria, s borderline tumorem ovaria, s benigní cystou vaječníku a žen s normální tkání vaječníku a zjištění vztahu hodnot bFGF s jednotlivými histopatologickými parametry u pacientek s karcinomem ovaria.
MATERIÁL A METODIKA
Soubor pacientek
V období od září 2014 do dubna 2016 jsme na Porodnické a gynekologické klinice Fakultní nemocnice Hradec Králové prospektivně sledovali hladiny bFGF v krevním séru 55 konsekutivně přicházejících pacientek k primární léčbě pro nález ovariálního tumoru podle vyšetření ultrazvukem (UZ) nebo počítačovou tomografií (CT). Současně s bFGF byly u pacientek s vysokým rizikem karcinomu ovaria podle předchozích zobrazovacích vyšetření sledovány sérové hladiny Ca125. Za skupinu kontrol s normální tkání vaječníku jsme určili 19 žen, které byly operovány pro prolaps dělohy a byla jim současně provedena profylaktická adnexektomie. Soubor zahrnoval celkem 74 žen. Žádná ze zařazených pacientek neměla v anamnéze jakoukoli proběhlou léčbu malignity a v době odběru bFGF nebyla těhotná. Standardní histopatologické vyšetření adnex probíhalo ve Fingerlandově ústavu patologie Fakultní nemocnice Hradec Králové. Pacientky jsme podle definitivní histologie rozdělili na skupinu s karcinomem ovaria (OvCa), s borderline tumorem ovaria (BOT), s benigní cystou vaječníku a ženy s normální tkání vaječníku. Ve skupině s karcinomem ovaria jsme sledovali stadium onemocnění (FIGO 2014) [18], stupeň diferenciace a histologický typ nádoru (WHO 2014) [15]. Všechny pacientky před léčbou podepsaly informovaný souhlas s odběrem vzorku krve k účelům studie schválené Etickou komisí FN HK.
Metodika
Ke stanovení bFGF bylo využito 5 ml periferní krve odebrané z kubitální žíly pacientek. Jednu hodinu po odběru byla krev centrifugována při 3000 rpm po dobu deseti minut, sérum zamraženo na teplotu minus 70 stupňů Celsia a takto uschováno až do okamžiku zpracování. Koncentrace bFGF v pg/ml v periferní krvi byla stanovena sendvičovým ELISA testem pomocí soupravy na stanovení bFGF (ELISA kit for Human FGFbasic – high sensitivity, R&D Systems, Inc., Minneapolis, MN, USA) podle instrukcí výrobce. Detekční limit bFGF činil 0,313 pg/ml. Vzorky nebyly ředěny. Výsledná absorbance byla měřena při vlnové délce 450 nm za použití readeru Multiskan RC ELISA (Thermo Fisher Scientific, USA)
Statistické zpracování
Pro popis souboru byly použity deskriptivní metody statistiky. Zjištěné hodnoty byly testovány na normalitu rozložení. Podle výsledků byla pro porovnání mezi skupinami použita Kruskalova-Wallisova neparametrická analýza rozptylu s následným mnohonásobným porovnáním Dunnovým testem s Bonferroni modifikací. Vztahy zjišťovaných parametrů byly vyhodnoceny korelační analýzou pomocí bodových grafů a Spearmanových koeficientů pořadové korelace. Zvolená hladina významnosti byla α = 0,05. Statistické vyhodnocení bylo provedeno standardními postupy statistickým software ve spolupráci se statistikem. Plná citace software je: NCSS 10 Statistical Software (2015). NCSS, LLC. Kaysville, Utah, USA, ncss.com/software/ncss.
VÝSLEDKY
V období od září 2014 do dubna 2016 jsme prospektivně stanovili hladiny bFGF v krevním séru celkem 74 žen před léčbou. Z uvedeného souboru se jednalo o 22 pacientek s nově diagnostikovaným ovariálním karcinomem před primární operační léčbou nebo neoadjuvantní chemoterapií první linie. Bližší charakteristiku této skupiny viz v tabulce 1. Dále bylo bFGF stanoveno u devíti pacientek s nově diagnostikovaným borderline tumorem ovaria (u tří mucinózní BOT, u šesti serózní BOT), u 24 žen s benigní cystou vaječníku a u 19 žen s normální tkání vaječníku. Věkové rozložení souboru pacientek viz v tabulce 2. Vzhledem k zamítnuté normalitě získaných dat jsme k porovnání jednotlivých skupin použili medián a jako míru variability 1. až 3. kvartil (graf 1). Za statisticky významné jsme považovali hodnoty p < 0,05. Prokázali jsme signifikantně vyšší sérové hladiny bFGF ve skupině pacientek s karcinomem ovaria, med. = 10,35 pg/ml (1,2–46,2 pg/ml), než u pacientek s borderline tumorem ovaria (p < 0,05), med. = 5,4 pg/ml (1,6–6,8 pg/ml), než u pacientek s benigní cystou vaječníku (p < 0,05), med. = 5,2 pg/ml (0,1–67,2 pg/ml), a proti ženám s normální tkání vaječníku (p < 0,05), med. = 4,3 pg/ml(0,9–13,4 pg/ml). Signifikantní rozdíl v sérové hladině bFGF mezi uvedenými skupinami pacientek s borderline tumorem ovaria, s benigní cystou vaječníku a u žen s normální tkání vaječníku jsme nezaznamenali.
Graf 1. Hladiny bFGF (pg/ml) před primární léčbou u pacientek rozdělených do skupin podle definitivní histologie 
Tab. 1. Charakteristika souboru pacientek s nově diagnostikovaným karcinomem ovaria 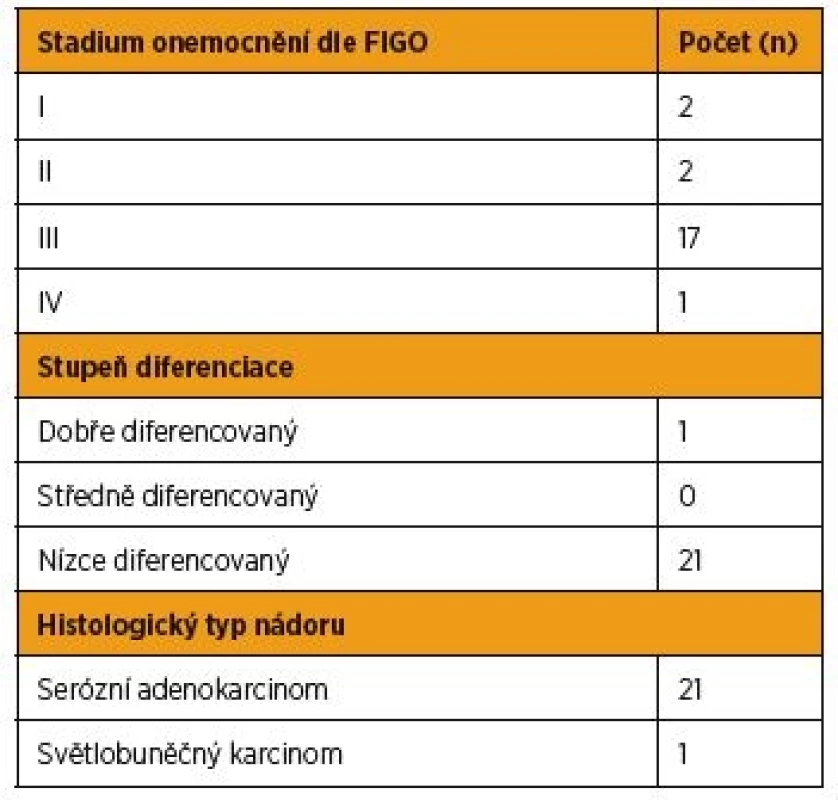
Tab. 2. Věkové rozložení souboru zařazených pacientek 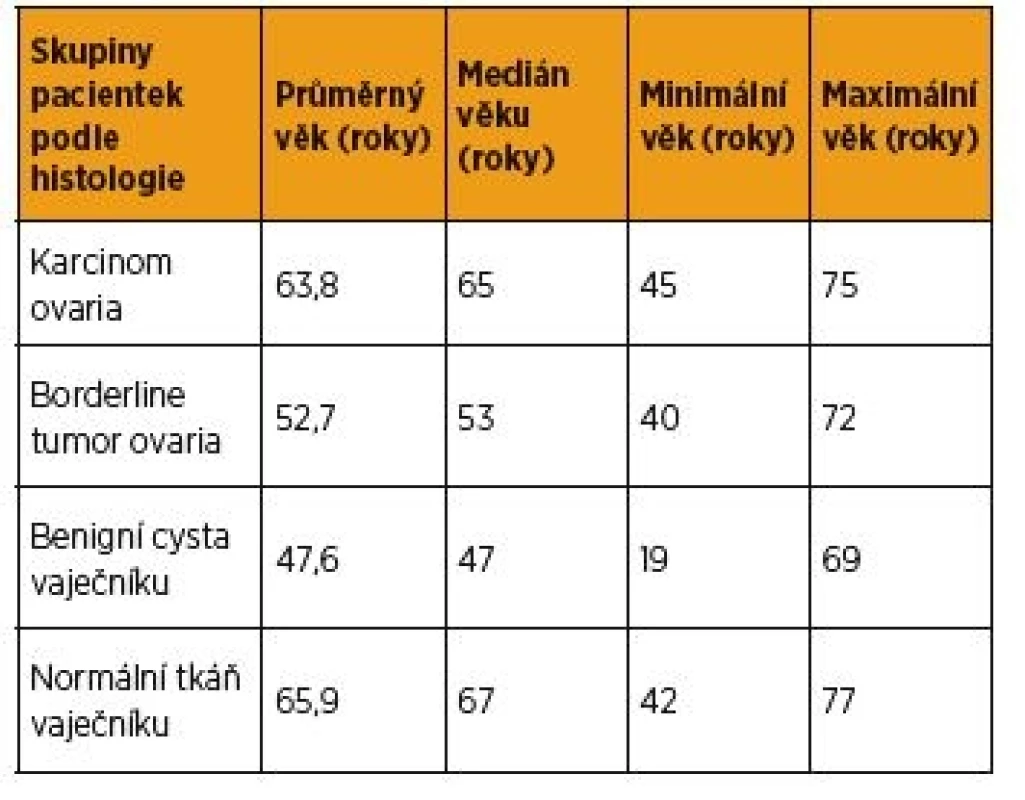
Pro sledování korelace mezi sérovou hladinou bFGF a Ca125 odebraných z periferní krve před primární operační léčbou nebo neoadjuvantní chemoterapií ve skupině pacientek s karcinomem ovaria (n = 14) jsme vytvořili bodový graf (graf 2), kde je patrná nízká souvislost mezi parametry vzhledem k odlehlým hodnotám, které nevadí při hodnocení Spearmanovými koeficienty. Z dosažené hodnoty Spearmanova koeficientu pořadové korelace (rs = 0,208791) pro uvedené parametry na hladině významnosti testu nulovosti korelačního koeficientu (0,473779) plyne, že mezi hladinami Ca125 a bFGF v krevním séru pacientek s karcinomem ovaria není silná lineární souvislost.
Graf 2. Sledování souvislostí mezi sérovými hladinami bFGF a Ca125 u pacientek s nově diagnostikovaným karcinomem ovaria před jejich léčbou 
Sérové hladiny bFGF před léčbou v rámci skupiny pacientek s karcinomem ovaria a borderline tumorem vaječníku shrnuje tabulka 3. V periferní krvi pacientek v časných stadiích (I + II podle FIGO) karcinomu ovaria jsme zaznamenali analogické hladiny bFGF, med. = 10,3 pg/ml (1,2–25,7 pg/ml), proti ženám v pokročilé fázi (III + IV podle FIGO) ovariálního karcinomu, med. = 10,35 pg/ml(2,6–46,2 pg/ml). Na hladině statistické významnosti porovnávat získané hodnoty bFGF podle rozsahu onemocnění, diferenciace a histologického typu nádoru nelze vzhledem k nízkým četnostem sledovaných parametrů.
Tab. 3. Hodnoty bFGF z periferní krve odebrané před primární terapií pacientek s karcinomem ovaria a borderline tumorem ovaria 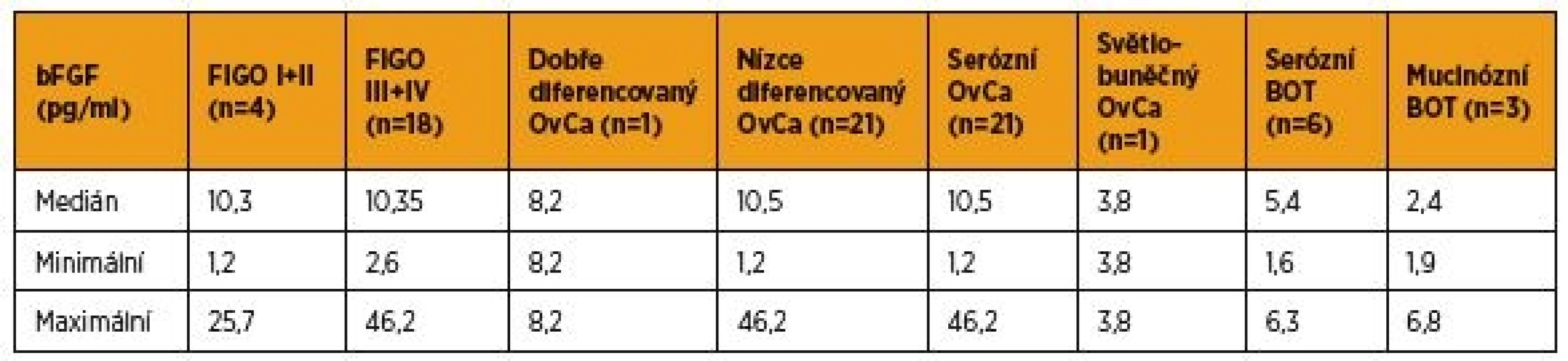
Skupina benigních cyst vaječníku zahrnovala folikulární cystu (n = 4, med. = 9,2 pg/ml (1,9–67,2 pg/ml)), endometroidní cystu (n = 3, med. = 3,2 pg/ml (1,5–4,8 pg/ml)), inkluzní cystu (n = 2, med. = 15,5 pg/ml (0,1–30,9 pg/ml)), fibrom (n = 3, med. = 6,1 pg/ml (4,4–14,7 pg/ml)), serózní cystadenom (n = 7, med. = 3,8 pg/ml (1,4–13,9 pg/ml)), serózní cystadenofibrom (n = 3, med. = 0,1 pg/ml, (0,1–6,9 pg/ml)), mucinózní cystadenofibrom (n = 1, 12,9 pg/ml), smíšený seromucinózní cystadenofibrom (n = 1, 18,7 pg/ml). Na hladině statistické významnosti porovnávat získané hodnoty bFGF v rámci skupiny benigních cyst ovaria nelze, vzhledem k nízkým četnostem jednotlivých histopatologických nálezů.
Neparametrický Spearmanův koeficient a bodový graf (graf 3) jsme použili i pro sledování souvislostí sérových hladin bFGF s věkem všech zařazených pacientek (n = 74), pacientek s nově diagnostikovaným karcinomem ovaria (n = 22), s borderline tumorem ovaria (n = 9), s benigní cystou vaječníku (n = 24) a žen s normální tkání vaječníku (n = 19). Nenalezli jsme významnou souvislost hladin sérového bFGF s věkem všech zařazených pacientek (rs = 0,075071, hladina významnosti testu nulovosti korelačního koeficientu 0,524978), pacientek s nově diagnostikovaným karcinomem ovaria (rs = -0,301985, hladina významnosti testu nulovosti korelačního koeficientu 0,171972), s borderline tumorem ovaria(rs = 0,176471, hladina významnosti testu nulovosti korelačního koeficientu 0,649696), s benigní cystou vaječníku (rs = 0,019608, hladina významnosti testu nulovosti korelačního koeficientu 0,927541) a žen s normální tkání vaječníku (rs = 0,067782, hladina významnosti testu nulovosti korelačního koeficientu 0,782769). Nulovost nebyla zamítnuta ani pro skupinu s OvCa.
Graf 3. Sledování souvislostí mezi sérovými hladinami bFGF a věkem všech zařazených pacientek rozdělených do skupin 
DISKUSE
V současné době stoupá význam sledování nádorové angiogeneze u pacientek s karcinomem ovaria prostřednictvím stanovení jednotlivých angiogenních faktorů z důvodu individualizace léčby a zavádění nových antiangiogenních preparátů. Zajímavým výsledkem naší práce jsou signifikantně vyšší mediány sérových hladin bFGF u pacientek s karcinomem ovaria v porovnání s pacientkami s borderline tumorem ovaria, benigní cystou vaječníku a ženami s normální tkání vaječníku.
Madsen et al. v souboru 213 žen prokázali, že mediány předoperačních sérových hladin bFGF jsou statisticky významně vyšší u pacientek s nově zjištěným zhoubným nádorem vaječníku, vejcovodu nebo primárně peritoneálním karcinomem (n = 96, med. = 53 pg/ml) než u pacientek operovaných se serózním nebo mucinózním BOT (n = 21, med. = 40,5 pg/ml, p = 0,01), s benigním tumorem vaječníku (n = 54, med. = 46,5 pg/ml, p = 0,05) a proti zdravým kontrolám (n = 42, med. = 33 pg/ml, p = 0,000005). Řádově odlišné hodnoty hladin bFGF mezi naší prací a prací Madsena si vysvětlujeme použitím jiné metody stanovení (multiplexové analýzy) bFGF ve vzorcích. Námi použitý „high sensitivity“ kit podle výrobce precizně detekuje skutečné koncentrace bFGF a dosažené hodnoty kontrolní skupiny jsou v souladu se získanými daty od kontrolní skupiny v rámci jiné studie hodnocení sérového bFGF [1]. Za signifikantní byly v celé práci považovány hodnoty p ≤ 0,05. Soubory pacientek s benigní cystou a zdravých kontrol se v porovnávaných studiích lišily. V práci Madsena se mezi benigními cystami navíc objevuje fibrothekom a dermoid, a zejména se v ní mezi zdravými kontrolami nacházejí i ženy s endometroidní cystou. V naší práci byly ženy s endometriózou ovaria, inkluzní cystou a perzistující folikulární cystou naopak zařazeny do skupiny benigních cyst, tím jsme zcela odlišili ženy s normální ovariální tkání od žen s jakoukoliv benigní cystou vaječníku. Madsenův soubor je rozsáhlejší, autoři tedy mohli na hladině statistické významnosti hodnotit další klinickopatologické proměnné [16].
Vztah hladin bFGF k prognóze nově diagnostikovaného ovariálního karcinomu před zahájením léčby lze nepřímo vyvozovat z obdobných hodnot v periferní krvi pacientek v časných a v pozdních stadiích OvCa. Ke zhodnocení korelace bFGF s dobou přežití bez progrese onemocnění a celkovým přežitím pacientek s karcinomem ovaria, s histologickým typem nádoru a s reziduálním tumorem po debulking operaci zatím nemáme dostatek dat. Madsen et al. nalezli pouze nesignifikantní tendenci k vyšším hodnotám bFGF v séru u pacientek s pokročilou malignitou (n = 71, med. = 58 pg/ml) proti časným stadiím nově zachycených zhoubných nádorů vaječníku, vejcovodu nebo peritonea (n = 29, med. = 52 pg/ml, p = 0,27) a tendenci k vyšší hladině sérového bFGF u nízce a středně diferencovaných (n = 65, med. = 60 pg/ml) než u dobře diferencovaných malignit (n = 19, med. = 53 pg/ml, p = 0,30). Bazický FGF ve stejném souboru nekoreloval s velikostí reziduálního tumoru po proběhlé primární operaci ani s histologickým typem nádoru a neměl prokazatelný vztah k době přežití bez progrese onemocnění a s celkovým přežitím pacientek. Byla nalezena tendence k nižší hladině sérového bFGF u žen ve věku vyšším než 60 let (n = 66, med. = 53 pg/ml) proti ženám mladším (n = 30, med. = 60 pg/ml, p = 0,31) [16]. Náš soubor jsme arbitrálně nedělili na starší a mladší ženy. V grafu věku a hladiny bFGF všech zařazených pacientek jsme mezi proměnnými nevypozorovali žádnou jasnou souvislost v kterémkoli věku žen ani po rozčlenění na zkoumané podskupiny, upustili jsme tedy i od členění na premenopauzální a postmenopauzální status.
Spearmanovy koeficienty jsou kromě skupiny s ovariálním karcinomem velmi nízké, skupina s OvCa vybočuje i zápornou orientací (nepřímá souvislost). Tento údaj je ve shodě se souborem Madsena a potvrzuje statisticky nevýznamnou tendenci, že ve skupině s OvCa se stoupajícím věkem klesá hladina bFGF [16]. Žádná práce včetně naší při zkoumání bFGF nezohledňuje velikost adnexální masy nebo poměr zdravé ovariální tkáně k objemu patologicky změněné tkáně, což by mohlo mít zásadní vliv na sérovou hladinu faktoru. Ani jedna z prací nezohledňuje tělesnou hmotnost, případně body mass index žen [22]. Na základě publikovaných dat o VEGF se můžeme u bFGF zatím jen domnívat o vlivu nutrice (deplece sérových proteinů, adipozita, kachektizace) na hladiny faktorů v plazmě [25, 26].
He et al. stanovovali sérové hladiny biomarkerů v rámci pilotní studie s cílem nalezení optimálního modelu diferenciace mezi benigním a maligním onemocněním adnex v době jeho primárního záchytu. Nejvýznamnějším samostatným biomarkerem podle ROC křivky byl Ca125 (AUC = 0,937), na druhém místě lidský epididymální protein 4 (HE 4) (AUC = 0,811), naopak bFGF (AUC = 0,651) nepatřil mezi silné prediktory. Nejsilnějšími samostatnými markery byly modely založené na ultrazvukové diagnostice. Vedlejším výsledkem práce bylo mj. nalezení vyšších hladin bFGF u pacientek s karcinomem ovaria proti ženám s benigním tumorem adnex (autoři neuvedli hladinu významnosti). Hodnoty bFGF ve skupině s karcinomem a ve skupině s benigním tumorem ovaria jsou ve shodě s našimi výsledky (odečteno z grafu) [12]. Primárním cílem naší práce nebylo nalezení vztahu mezi bFGF a Ca125 nebo zjištění přidané hodnoty bFGF k Ca125 při diagnostice ovariálních lézí. Ca125 jsme nenabírali u všech pacientek, ale pouze ve skupině silně podezřelé z malignity podle zobrazovacích vyšetření. Hodnoty Ca125 a bFGF v krevním séru pacientek s OvCa spolu v naší práci lineárně nesouvisí, ale ze souboru nemůžeme jednoznačně vyvozovat, že mezi Ca125 a bFGF není žádná jiná souvislost, a tedy že jsou na sobě oba parametry zcela nezávislé.
Zajímavým výsledkem naší práce jsou podobné hodnoty bFGF v séru pacientek s borderline tumorem ovaria (n = 9, med. = 5,4 pg/ml) a u pacientek s benigní cystou vaječníku (n = 24, med. = 5,2 pg/ml). V práci Madsena se dokonce objevila pozoruhodná tendence k vyšším hladinám bFGF u pacientek s benigní cystou (n = 54, med. = 46,5 pg/ml) než u pacientek s BOT (n = 21, med. = 40,5 pg/ml). Zde se otevírá diskuse nad novou cestou malignizace původně benigních cyst. Práce Madsena ani jiné studie bohužel neuvádějí rozdíly v hodnotách bFGF mezi jednotlivými benigními lézemi [16]. Za předpokladu genotoxicity bFGF mohou být teoreticky dlouhodobě zvýšené sérové hladiny bFGF dalším důvodem vzniku karcinomu z původně benigního tumoru ovaria [13]. Nicméně je třeba upozornit na malý počet pacientek v našem pilotním souboru a na celkově minimální množství prací, které se zabývají sérovou hladinou bFGF ve vztahu k OvCa.
Získaná data bude v budoucnu navíc potřeba revidovat. Zatím nemůžeme jistě prohlásit, že hladiny bFGF odpovídají závažnosti onemocnění. Do budoucna může mít význam sledovat nejen hladiny bFGF a ostatních faktorů v krvi, ale i ve tkáni, a to včetně jejich receptorů. Zde se nabízí otázka existence pozitivní či negativní zpětné vazby a zda vůbec lze vysvětlovat hladiny bFGF v krvi pacientek histologickými nálezy.
Feng et al. ve tkáni 31 žen s epiteliálním karcinomem vaječníku zaznamenali signifikantně vyšší expresi bFGF než v 18 případech benigních epiteliálních ovariálních tumorů a v deseti případech normální ovariální tkáně (p < 0,001) [5]. Szubert et al. porovnali tkáň 58 případů epiteliálních ovariálních karcinomů, 35 případů s benigním nádorem vaječníku a 21 vzorků normální ovariální tkáně a nalezli zcela opačnou souvislost v expresibFGF. Signifikantně méně bFGF se nachází ve tkáni epiteliálního ovariálního karcinomu proti tkáni benigního nádoru vaječníku a normálního ovaria (p < 0,0001) [23]. Vzhledem k zařazení antiangiogenní terapie do léčby ovariálního karcinomu jsou vhodné další studie ke sledování hodnot bFGF a dalších angiogenních faktorů, a to i ve vztahu k odpovědi na tuto léčbu.
ZÁVĚR
Prokázali jsme statisticky významný rozdíl hodnot bFGF u pacientek s nově diagnostikovaným karcinomem ovaria bez jakékoliv předchozí léčby v porovnání s pacientkami s borderline tumorem ovaria, s benigní cystou vaječníku a ženami s normální tkání vaječníku. Nenalezli jsme významnou souvislost hladin sérového bFGF s věkem pacientek s nově diagnostikovaným karcinomem ovaria, s borderline tumorem ovaria, s benigní cystou vaječníku a žen s normální tkání vaječníku.
Tato práce vznikla za podporyMZ ČR – RVO (FNHK, 00179906).
MUDr. Vladimír Študent
Porodnická a gynekologická klinika
LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: student.vlada@gmail.com
Zdroje
1. Andrýs, C., Borská, L., Pohl, D., et al. Angiogenic activity in patients with psoriasis is significantly decreased by Goeckerman’s therapy. Arch Dermatol Res, 2007, 298(10), p. 479–483.
2. Cibula, D., Petruželka, L., a kol. Onkogynekologie. 1. ed. Praha: Grada Publishing, 2009, 616 s.
3. Dušek, L., Mužík, J., Kubásek, M., et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2017-2-22]. Dostupný z http://www.svod.cz. Verze 7.0 [2007], ISSN 1802-8861.
4. Eskander, RN., Tewari, KS. Incorporation of anti-angiogenesis therapy in the management of advanced ovarian carcinoma – mechanistics, review of phase III randomized clinical trials, and regulatory implications. Gynecol Oncol., 2014, 132, p. 496–505.
5. Feng, QL., Shi, HR., Qiao, LJ., Zhao, J. Expression of hSef and FGF-2 in epithelial ovarian tumor. Zhonghua Zhong Liu Za Zhi, 2011, 33(10), p. 770–774.
6. Ferreras, C., Rushton, G., Cole, CL., et al. Endothelial heparan sulfate 6-O-sulfation levels regulate angiogenic responses of endothelial cells to fibroblast growth factor 2 and vascular endothelial growth factor. J Biol Chem, 2012, 287(43), p. 36132–36146.
7. Gacche, RN., Meshram, RJ. Angiogenic factors as potential drug target: Efficacy and limitations of anti-angiogenic therapy. Biochim Biophysic Acta, 2014, 1846(1), p. 161–179.
8. Gao, F., Vasquez, SX., Su, F., et al. L-5F, an apolipoprotein A-I mimetic, inhibits tumor angiogenesis by suppressing VEGF/basic FGF signaling pathways. Integr Biol (Camb), 2011, 3(4), p. 479–489.
9. Gao, JM., Yan, J., Li, R., et al. Improvement in the quality of heterotopic allotransplanted mouse ovarian tissues with basic fibroblast growth factor and fibrin hydrogel. Hum Reprod, 2013, 28(10), p. 2784–2793.
10. Garor, R., Abir, R., Erman, A., et al. Effects of basic fibroblast growth factor on in vitro development of human ovarian primordial follicles. Fertil Steril, 2009, 91(5), p. 1967–1975.
11. He, B., Lin, J., Li, J., et al. Basic fibroblast growth factor suppresses meiosis and promotes mitosis of ovarian germ cells in embryonic chickens. General Comparative Endocrinol, 2012, 176(2), p. 173–181.
12. He, G., Holcroft, CA., Beauchamp, MC., et al. Combination of serum biomarkers to differentiate malignant from benign ovarian tumours. J Obstet Gynaecol Can, 2012, 34(6), p. 567–574.
13. Hillegass, JM., Shukla, A., MacPherson, MB., et al. Utilization of gene profiling and proteomics to determine mineral pathogenicity in a human mesothelial cell line (LP9/TERT-1). J Toxicol Environ Health A, 2010, 73(5), p. 423–436.
14. Hsueh, SP., Hsu, WB., Wen, CC., et al. SV40 T/t-common polypeptide inhibits angiogenesis and growth of HER2-overexpressing human ovarian cancer. Cancer Gene Ther, 2011, 18, p. 859–870.
15. Kurman, RJ., Carcangiu, ML., Herrington, CS., Young, RH. WHO Classification of Tumours of Female Reproductive Organs. 4. ed. World Health Organisation, 2014, 6, 307 p.
16. Madsen, CV., Steffensen, KD., Olsen, DA., et al. Serum platelet-derived growth factor and fibroblast growth factor in patients with benign and malignant ovarian tumors. Anticancer Res, 2012, 32(9), p. 3817–3825.
17. Parte, S., Bhartiya, D., Manjramkar, DD., et al. Stimulation of ovarian stem cells by follicle stimulating hormone and basic fibroblast growth factor during cortical tissue culture. J Ovarian Res, 2013, 6. DOI: 10.1186/1757-2215-6-20.
18. Prat, J., FIGO Committee on Gynecologic Oncology. Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet, 2014, 124, 1, p. 1–5.
19. Robati, M., Ghaderi, A., Mehraban, M., et al. Vascular endothelial growth factor (VEGF) improves the sensitivity of CA125 for differentiation of epithelial ovarian cancers from ovarian cysts. Arch Gynecol Obstet, 2013, 288(4), p. 859–865.
20. Sadlecki, P., Walentowicz-Sadlecka, M., Szymanski, W., Grabiec, M. Comparison of VEGF, IL-8 and beta-FGF concentrations in the serum and ascites of patients with ovarian cancer. Ginekol Pol, 2011, 82(7), p. 498–502.
21. Saito, K., Khan, K., Sosnowski, B., et al. Cytotoxicity and antiangiogenesis by fibroblast growth factor 2-targeted Ad-TK cancer gene therapy. Laryngoscope, 2009, 119(4), p. 665–674.
22. Slaughter, KN., Thai, T., Penaroza, S., et al. Measurements of adiposity as clinical biomarkers for first-line bevacizumab-based chemotherapy in epithelial ovarian cancer. Gynecol Oncol, 2014, 133(1), p. 11–15.
23. Szubert, S., Szpurek, D., Moszynski, R., et al. Extracellular matrix metalloproteinase inducer (EMMPRIN) expression correlates positively with active angiogenesis and negatively with basic fibroblast growth factor expression in epithelial ovarian cancer. J Cancer Res Clin Oncol, 2014, 140(3), p. 361–369.
24. Wang, L., Ying, YF., Ouyang, YL., et al. VEGF and bFGF increase survival of xenografted human ovarian tissue in an experimental rabbit model. J Assist Reprod Genet, 2013, 30(10), p. 1301–1311.
25. Watanabe, T., Shibata, M., Nishiyama, H., et al. Elevated serum levels of vascular endothelial growth factor is effective as a marker for malnutrition and inflammation in patients with ovarian cancer. Biomed Rep, 2013, 1(2), p. 197–201.
26. Watanabe, T., Shibata, M., Nishiyama, H., et al. Serum levels of rapid turnover proteins are decreased and related to systemic inflammation in patients with ovarian cancer. Oncol Lett, 2014, 7(2), p. 373–377.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2018 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Jak dlouho přetrvává léčba mirabegronem u úspěšně léčených pacientů s hyperaktivním močovým měchýřem? Analýza multicentrické studie
- Význam hladin bazického fibroblastového růstového faktoru u pacientek s tumorem ovaria
- Ovlivňuje použití transferového média EmbryoGlue úspěšnost embryotransferu?
- Porovnání incizionální a epidurální analgezie v léčbě pooperační bolesti po císařském řezu
- Hodnocení sestupu a mobility uretrovezikální junkce u žen se stresovou inkontinencí moči – ultrazvuková studie
- Roboticky asistovaná laparoskopická abdominální cerkláž: dvě kazuistiky
- Primární maligní melanom pochvy, kazuistika a review z literatury
- Plánovaný domácí porod – Česká republika 2018
- Obezita a snížení plodnosti mužů
- Vakcinace proti HPV a výhled nových možností
- Potenciál survivínu pre liečbu gynekologických tumorových ochorení
- Prolaktin a poruchy reprodukce
- Zápis z jednání volební komise pro volby výboruSekce perinatologie a fetomaternální medicínyČeské gynekologické a porodnické společnosti ČLS JEP
- Zápis z jednání volební komise pro volby výboru Onkogynekologické sekce České gynekologické a porodnické společnosti ČLS JEP
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prolaktin a poruchy reprodukce
- Ovlivňuje použití transferového média EmbryoGlue úspěšnost embryotransferu?
- Vakcinace proti HPV a výhled nových možností
- Plánovaný domácí porod – Česká republika 2018
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



