-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Recidiva vzácného maligního Brennerova tumoru ovaria
Recurrence of rare malignant Brenner ovarian tumor
Objective: Description of the case of recurrence of a rare malignant Brenner ovarian tumour. Methods: Author observation and literature resources. Results: Occurrence of a rare malignant Brenner‘s tumor in a 66-year-old patient. After radical surgery (abdominal hysterectomy with bilateral adnexectomy, pelvic and paraaortic lymphadenectomy, omentectomy and appendectomy) and after adjuvant chemotherapy, recurrence of the disease was observed after 30 months. Conclusions: The case report describes rare occurrence of a malignant Brenner tumour and its relapse.
Keywords:
ovary – malignant Brenner tumour – relapse
Autori: Feckaninová B. 1; Pilka R. 2; Slobodová Z. 3
Pôsobisko autorov: Gynekologicko-porodnické oddělení, Nemocnice Šumperk 1; Porodnicko-gynekologická klinika LF UP a FN Olomouc 2; Ústav klinické a molekulární patologie, FN Olomouc 3
Vyšlo v časopise: Ceska Gynekol 2021; 86(4): 250-257
Kategória: Kazuistika
doi: https://doi.org/10.48095/cccg2021250Súhrn
Cíl: Popis případu recidivy vzácného maligního Brennerova tumoru ovaria. Metodika: Vlastní pozorování a literární rešerše. Výsledky: Výskyt vzácného maligního Brennerova tumoru u 66leté pacientky. Po radikální operaci (abdominální hysterektomie s oboustrannou adnexektomií, pelvickou a paraaortální lymfadenktomií, omentektomií a appendektomií) a po adjuvantní chemoterapii se objevuje recidiva onemocnění po 30 měsících. Závěr: Kazuistika popisuje raritní výskyt maligního Brennerova tumoru a jeho recidivu.
Klíčová slova:
ovarium – maligní Brennerův tumor – recidiva
Úvod
Zhoubné nádory ovaria jsou závažná onemocnění, která často probíhají dlouhou dobu bezpříznakově. Asi 75 % je diagnostikováno ve III. a IV. stadiu. Záchyt v I. stadiu je spíše náhodným nálezem při vyšetření nebo operaci z jiné indikace [1]. Maligní léze vaječníku zahrnují primární léze vyrůstající ze tkání vaječníku a sekundární léze původem z nádoru kdekoli v těle [2]. Maligní ovariální nádory jsou skupinou onemocnění, která se vzájemně liší morfologií a biologickým chováním. V 90 % se jedná o maligní epiteliální karcinomy. Mnohem méně se vyskytují nádory ze zárodečných buněk (dysgerminom, nádor ze žloutkového váčku, nezralý teratom, choriokarcinom, embryonální karcinom) a nádory z buněk stromatu a zárodečných pruhů (nádor z buněk granulózy, nádory ze Sertoliho buněk – arhenoblastom, nádory z Leydigových buněk – androblastom, thekomy) [1,3]. Vzácně se vyskytují malobuněčný karcinom a sarkom, mající velmi špatnou prognózu. Nejčastěji do ovaria metastazují zhoubné nádory děložního těla nebo trávicího ústrojí (Krukenbergův nádor) [2].
Maligní nádory ovaria jsou pátým nejčastějším nádorovým onemocněním žen ve vyspělých zemích. Incidence v ČR je 18,3/100 000 žen v roce 2017, což je přibližně 982 nových případu za rok. Pětileté přežití se bez ohledu na stadium nemoci pohybuje mezi 35 a 40 %. Průměrný věk v době diagnózy karcinomu ovaria je 57 let [3,4].
K rizikovým faktorům ovariálních nádorů obecně patří nulliparita, pozdní věk prvního porodu (> 35 let), vyšší socioekonomický status, kavkazské etnikum, endometrióza, hyperandrogenní syndrom, léky stimulující ovulaci při infertilitě, pozitivní rodinná anamnéza (riziko zvyšuje až 3×). Naopak k protektivním faktorům patří multiparita, kojení, užívání hormonální antikoncepce, nižší socioekonomický status, asijské etnikum, salpingektomie, hysterektomie a ligace vejcovodů [1].
Významným rizikovým faktorem je genetická predispozice. Jedná se o mutace genů BRCA a o mnohem vzácnější genové poruchy uvnitř komplexu Lynchova II. syndromu. Mutace těchto genů jsou autozomálně dědičné. BRCA 1, 2 najdeme u 14–18 % všech karcinomů ovarií (u zdravé populace je prevalence cca 1 : 750). Nositelky genů BRCA 1 mají celoživotní riziko karcinomu ovaria 40–60 % (v běžné populaci < 2 %) a mají 30× vyšší riziko karcinomu ovaria než běžná populace. Po odstranění adnex zůstává riziko primárního peritoneálního tumoru 3–4 %, po odstranění dělohy klesá na 0,5–1 % (zřejmě díky odstranění zdroje kmenových buněk v endometriu). Celoživotní riziko karcinomu prsu je až 87 %. U nosiček BRCA 2 je celoživotní riziko karcinomu ovaria 15–30 % a pro karcinom prsu stejné jako u BRCA 1 [5]. Lynchův syndrom představuje asociaci karcinomu endometria, vaječníku, prsu a tlustého střeva (zejména hereditární nepolypózní kolorektální karcinom). Častější jsou u těchto žen serózní papilární karcinomy ovaria mající lepší prognózu [1].
V etiopatogenezi ovariálních karcinomů se uvádí významná role počtu ovulací. Teorie nepřetržité ovulace (inces - sant ovulation) poukazuje na množství ovulačních cyklů a vliv ovulace na vznik karcinomu jako důsledek mikrotraumat povrchu ovaria, na něž působí vlivy peritoneálního prostředí za současného promitogenního působení estrogenů z folikulární tekutiny [1]. Gonadotropinová teorie uvádí, že perzistující stimulace ovarií gonadotropiny ve spojení s lokálními účinky endogenních hormonů zvyšuje proliferaci povrchového epitelu a následně mitotickou aktivitu [2]. V posledních letech došlo k zásadnější změně v pohledu na ovariální maligní nádory. Spektrum extrauterinních pánevních serózních karcinomů zahrnující ovariální karcinom, primární peritoneální karcinom a karcinom vejcovodu označujeme jako pánevní high-grade serózní karcinom (HGSC). V roce 2014 byla revidována původní FIGO (International Federation of Gynecology and Obstetrics) klasifikace ovariálních nádorů pro dvě zásadní změny. První změnou byl poznatek, že epiteliální ovariální karcinom není jednotné onemocnění a na základě histopatologických, imunohistochemických a molekulárně genetických analýz jej lze rozdělit do pěti hlavních typů:
- high-grade serózní karcinom (70 %);
- endometroidní (10 %);
- clear-cell (10 %);
- mucinózní (3 %);
- low-grade serózní karcinom (5 %).
Kurmanův dualistický model klasifikuje ovariální karcinomy do dvou odlišných skupin, které se liší biologickým chováním, odpovědí na léčbu a prognózu:
I. typ (low-grade malignity) zahrnuje:
- low-grade serózní karcinom;
- low-grade endometroidní karcinom;
- clear-cell karcinom;
- karcinom z přechodných buněk (Brennerův tumor);
- mucinózní karcinom.
II. typ (high-grade malignity) zahrnuje:
- high-grade serózní karcinom;
- high-grade endometroidní karcinom;
- karcinosarkom;
- nediferencovaný karcinom.
Druhým významným objevem ovlivňujícím současný přístup bylo poznání, že mnoho karcinomů II. typu se vyvíjí ze serózního tubárního intraepiteliálního karcinomu (STIC), dominantně v distální části vejcovodu, což je velmi pravděpodobné místo původu významné podskupiny HGSC.
Vzhledem ke společnému původu a identické chirurgické a farmakologické léčbě těchto karcinomů byl v nové revizi sjednocen staging pro zhoubné nádory ovaria, vejcovodů a peritonea. Histopatologická diagnóza je zásadně důležitá pro adekvátní staging, neboť různé histologické typy nádoru korespondují s různou odpovědí na léčbu. Nedávno byla obecně přijata teorie STIC vycházející z hodnocení vzorků z profylaktické salpingo-ooforektomie u žen s mutací BRCA. Podrobné imunohistochemické vyšetřování odhalilo u nositelek BRCA mutací vyšší incidenci okultního tubárního karcinomu než okultního ovariálního karcinomu. STIC byl také popsán u pokročilého stadia sporadických HGSC s ovariální nádorovou masou a ve vzácných případech primárního tubárního nebo peritoneálního HGCS bez zřejmého postižení ovarií. STIC není metastazováním ovariálního karcinomu, ale jeho tubární prekurzorovou lézí (rozdílné délky telomer mezi STIC a ovariálním karcinomem). Na druhé straně u low-grade ovariálních serózních karcinomů (LGSC) se předpokládá postupný vývoj z histologicky rozpoznatelných prekurzorů, zejména z benigních serózních cystadenomů/adenofibromů (vznikajících z epiteliálních inkluzních cyst ovariálního povrchu) přes stadium borderline tumorů. Dualistický model připisuje vzniku high-grade a low-grade karcinomů různé genetické charakteristiky. LGSC jsou spojeny s KRAS (Ki-ras2 Kirsten rat sarcoma viral oncogene homolog) a BRAF (B Raf proto-oncogene) mutacemi a nesouvisejí s abnormalitami TP53 a BRCA [3].
Dosud neexistuje efektivní metoda sledování prekanceróz nebo záchytu časných stadií onemocnění (vyšetření CA 125 je nespecifické, ultrazvuk je málo senzitivní) [1]. Kvůli omezené možnosti časné detekce a tomu, že karcinom ovaria je pro možnost volného růstu v břišní dutině pozdně symptomatický, je až 75 % všech karcinomů zachyceno v pozdních stadiích [5]. Klinický obraz je škálou vágních nespecifických příznaků, jako jsou poruchy trávení, nadýmání, zvětšování objemu břicha, pocit tlaku v břiše, tlak na močový měchýř a rektum, zácpa, poševní krvácení, dušnost, únavnost a úbytek hmotnosti [2]. Epitelové zhoubné nádory ovarií mají od samého začátku metastatický charakter [6].
Základní diagnostická vyšetření dělíme na obligatorní a fakultativní. Obligatorní vyšetření jsou nepodkročitelná: anamnéza, komplexní gynekologické vyšetření, základní hematologické a biochemické vyšetření, nádorový marker CA 125, RTG snímek plic, ultrasonografické vyšetření dutiny břišní, předoperační interní vyšetření a vyšetření anesteziologem. Diagnózu je možné při nejasnostech upřesnit fakultativními vyšetřeními: CT dutiny břišní, MR, PET/CT, cystoskopie, intravenózní urografie, rektoskopie, kolonoskopie, gastroskopie, nádorové markery CEA, CA 19-9, inhibin, HE 4 a jiná konziliární vyšetření dle přidružených onemocnění [1]. Kombinované vyšetření HE 4 a CA 125 se používá pro výpočet tzv. ROMA skóre (risk of ovarian malignancy algorithm). Jedná se o diagnostický test pro posouzení rizika ovariálního karcinomu. Hodnota ROMA skóre u premenopauzálních žen > 11,4 % znamená vysoké riziko zjištění karcinomu ovaria, naopak hodnota < 11,4 % udává nízké riziko. U žen po menopauze znamená hodnota ROMA skóre > 29,9 % vysoké riziko, < 29,9 % nízké riziko karcinomu ovaria. V roce 1999 byla založena výzkumná mezinárodní pracovní skupina IOTA (Internatiomal Ovarian Tumor Analysis).
Skupinou IOTA byla vybrána jednoduchá ultrazvuková pravidla (IOTA Simple Ultrasound Rules). Mezi ultrazvukové maligní znaky (M) patří nepravidelný solidní tumor, přítomnost ascitu, alespoň čtyři papilární prominence, nepravidelný multilokulární solidní tumor velikosti > 100 mm a bohatá perfuze léze. Benigní léze (B) charakterizuje unilokulární cysta, přítomnost solidní složky do 7 mm, přítomnost akustického stínu, hladký multilokulární tumor o max. rozměru do 100 mm a bez perfuze léze. Léze je hodnocena jako maligní, když je přítomen jeden a více M znaků a žádný B znak. Pokud je přítomen jeden a více B znaků a žádný M znak, léze je klasifikována jako benigní. Pokud je zároveň přítomen B a M znak a/nebo není žádný B nebo M znak zastoupen, nemohou jednoduchá pravidla klasifikovat lézi a je indikováno vyšetření ultrazvukovým expertem (second stage test). Přesná diagnóza se pak získá na základě histologického vyšetření tkání při operaci [6].
Předpokladem pro správnou léčbu pacientek je adekvátní provedení chirurgického a patologického stagingu včetně určení grade karcinomu. Tyto faktory jsou spolu s operací provedenou s nulovým pooperačním reziduem (R0) nejzásadnějšími prognostickými faktory pro pacientky s karcinomem ovaria, tuby a peritonea [3]. Léčba u většiny ovariálních karcinomů je komplexní, kombinuje chirurgickou léčbu s chemoterapií, event. i s cílenou léčbou [6]. Základem chemoterapie jsou kombinace taxan/platina. Pokud je zjištěn na začátku inoperabilní nádor nebo pacientka není schopna operace v době stanovení diagnózy a je zjištěna dobrá odpověď na tři a více cyklů chemoterapie, měla by se provést „interval debulking surgery“ – radikalizující operace, následovaná další chemoterapií [2]. V terapii recidiv využíváme chemoterapii (režim je dle senzitivity k platině) a případně biologickou léčbu. Salvage operace je vhodná u platina-senzitivních recidiv, kde došlo k recidivě onemocnění po více než 6 měsících od ukončení předchozí chemoterapie s platinovým derivátem. Po salvage operaci je standardem chemoterapie. U platina-senzitivních recidiv lze podat olaparib u BRCA-pozitívních žen. Podání bevacizumabu je indikováno u platina-rezistentních recidiv [1].
Vlastní pozorování
V kazuistice se popisuje případ 66leté pacientky, která byla odeslána obvodním gynekologem k došetření pro stopkatý děložní myom do 40 mm a elevaci onkomarkerů.
Vstupní hodnota CA 125 je 100 kU/l a HE 4 je 368. Při příjmu je pacientka afebrilní, kardiopulmonálně kompenzovaná, udává bolesti v podbřišku trvající přibližně 3 týdny. Léčí se s arteriální hypertenzí, hyperlipoproteinemií, překonala subarachnoidální krvácení, v minulosti provedena cholecystektomie. Měla dva spontánní porody, menopauza v 53 letech. Chodí pravidelně na gynekologické preventivní prohlídky, výsledky onkologické cytologie a mammografického screeningu v normě. Při vstupním gynekologickém vyšetření je popisován palpačně tuhý čípek, napřímená nezvětšená děloha, vpravo adnexa normálního nálezu, vlevo tuhá rezistence o průměru 7–8 cm. Vaginální ultrazvuk popisuje dělohu v AVF 60 × 45 mm, vpravo ovarium 28 x 20 mm, normálního vzhledu, vlevo od dělohy hyperechogenní útvar velikosti 74 x 91 mm, v CD depo volné tekutiny do 4 cm. Se závěrem tumor ovarii l. sin, neo vs. indikována k radikálnímu výkonu. Provedena laparotomia longitudinalis medialis, peroperačně vizualizováno – děloha volná, děložní tělo atrofické, čípek atrofický, parametria volná oboustranně, serózy hladké, bez ascitu. Adnexa vpravo atrofická, vlevo jsou zvětšena, nerovného povrchu, adherují k peritoneu, celkově o průměru 12 cm, makroskopicky suspektní nález. Malá pánev je volná, tenké kličky normálního vzhledu, appendix bledý, pelvický 6 cm, játra hladká, zčásti překryta adhezemi po cholecystoektomii, omentum volné, bez patologického nálezu, serózy hladké, bránice volná. Uzliny kolem aorty a velkých cév nehmatné. V malé pánvi je serózní tekutina cca 50–100 ml, odebrána na cytologii. Provedena levostranná adnexektomie a ze suspektních míst ovaria odeslán vzorek na vyšetření na zmrzlo, kde byl telefonicky potvrzen karcinom s vysokou mitotickou aktivitou, s levými adnexy resekována i část peritonea. Proveden radikální výkon – hysterektomie, adnexektomie bilaterální, omentektomie subtotálně, lymfadenektomie pelvina a paraaortalis, appendektomie. Při operaci bylo makroskopicky dosaženo nulového nádorového rezidua.
Pacientka byla čtvrtý pooperační den propuštěna domů, pozvána ambulantně k výsledkům histologie.
Histologie
Kryostatové vyšetření potvrzuje přítomnost struktury maligního tumoru, který je převážně papilárně či solidně utvářený, připomínající urotel. K primárnímu histologickému vyšetření byl dodán materiál z abdominální hysterektomie a adnexetomie se současnou subtotální resekcí omenta, appendektomií a s pánevní a paraaortální lymfadenektomií a současně výplachová cytologie.
Nejzávažnější nález byl zjištěn v oblasti levých adnex, celkové velikosti 85 x 85 x 50 mm, tvořen vícečetnými nádorovými uzly, bramborovitého vzhledu, povrch je převážně hladký, avšak v rozsahu 18 x 10 mm a 23 x 23 mm s drobnými bělavými prominencemi na povrchu.
Tuba je délky 110 mm, s dilatovaným luminem, v oblasti fimbrií je ztluštělá bělavým tumorem velikosti 55 x 45 x 40 mm. Na řezu je prakticky v celém rozsahu preparátu bělavý, lobulizovaný, ložiskově nekrotický tumor.
Histologicky je tumor solidně či papilárně utvářený, papily jsou tvořeny širokým fibrovaskulárním stromatem krytým epitelem vzhledu přechodného epitelu, povrch papil je hladce zaoblený. Nádorové buňky mají jádra větší velikosti s hrubým chromatinem, místy s prominujícími jadérky, cytoplazma je eozinofilní. Mitotická aktivita je vysoká, až 10 mitóz/1 HPF, přítomny jsou i atypické mitózy. Místy jsou v epitelu přítomny velmi drobné, opticky prázdné prostory, kde je ve speciálním barvení přítomna hlenotvorba. Ložiskově je tumor nekrotický. Tumor je přítomen i na povrchu ovaria, na seróze a přítomen je i v tubě převážně v oblasti fimbrií.
V imunohistochemickém vyšetření exprimují nádorové buňky p16, CK7, ER (50 %), PR (20 %). Bez přesvědčivé pozitivity WT-1, p53, p40, inhibin, vimentin. Proliferační aktivita v indexu Ki67 je asi 60 %. Struktury benigního či borderline Brennerova tumoru ani struktury jiného typu karcinomu přítomny nejsou.
Závěr
Morfologicky obraz svědčí pro karcinom z buněk přechodného epitelu (ne Brennerova typu) podle přechozí WHO klasifikace (2003). Tato jednotka v současně platné WHO (World Health Organization) klasifikaci (2014) již samostatně vyčleněna není, tento karcinom proto zařazujeme jako maligní Brennerův tumor TNM klasifikace pT1c, pN0 (0/21), Mx, FIGO IC (obr. 1–4).
Obr. 1. Okrajová oblast zachycující fibrózní okrsky (◀) nádorovou infiltrací, v tomto místě s nádorovými papilami (△) s patrným centrálním fibrovaskulárním stromatem (⇦).
Fig. 1. Peripheral area capturing fibrous areas (◀) by tumor infiltration, in this place with tumor papillae (△) with visible central fibrovascular stroma (⇦).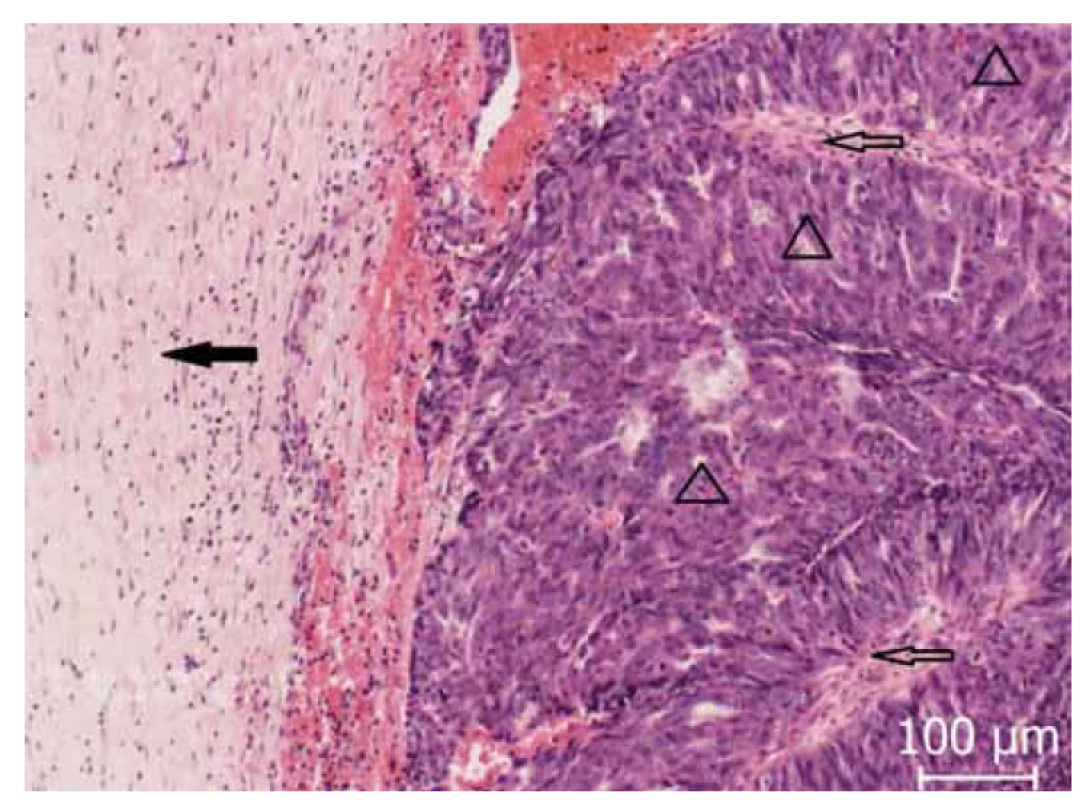
Obr. 2. Solidní oblasti (▲) nádorového epitelu ve vazivém stromatu (←). Viditelné jsou i oblasti nekrózy (✦).
Fig. 2. Solid regions (▲) of the tumor epithelium in the fibrous stroma (←). Areas of necrosis are also visible (✦).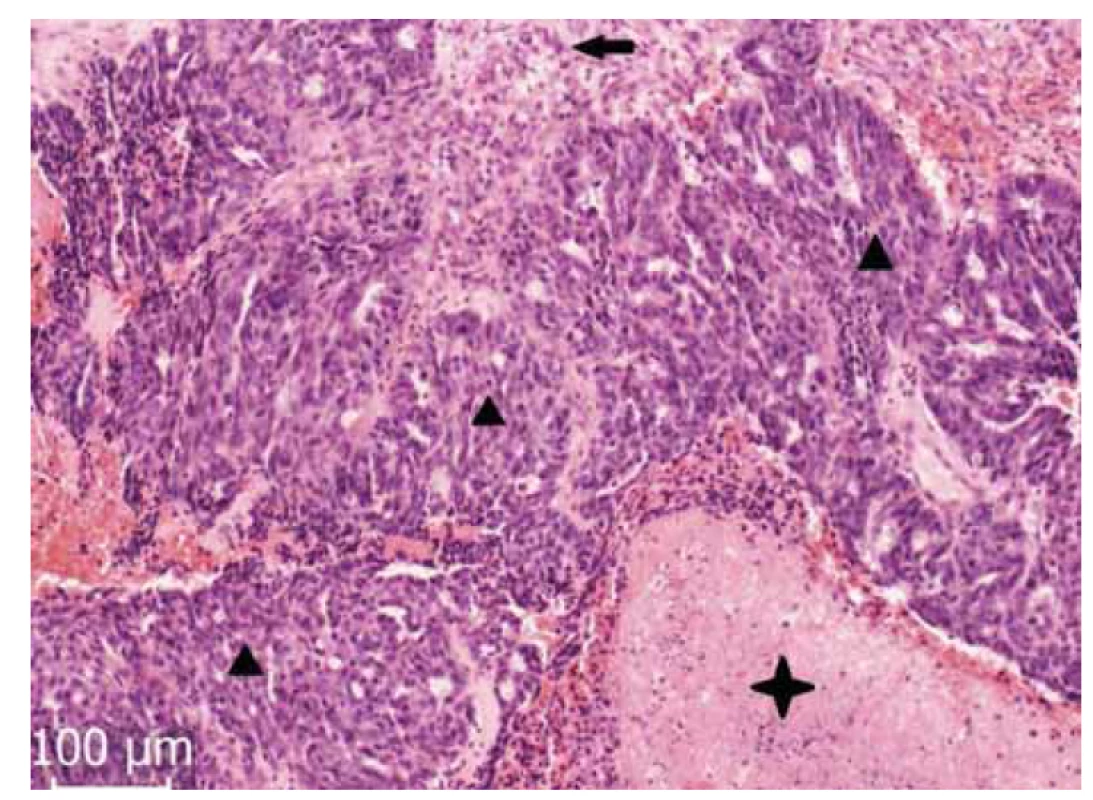
Obr. 3. Imunohistochemická exprese cytokeratinu 7 (CK7). Difuzní membránová a cytoplazmatická exprese CK7 v nádorovém epitelu.
Fig. 3. Immunohistochemical expression of cytokeratin 7 (CK7). Diffuse membrane and cytoplasmic expression of CK7 in tumor epithelium.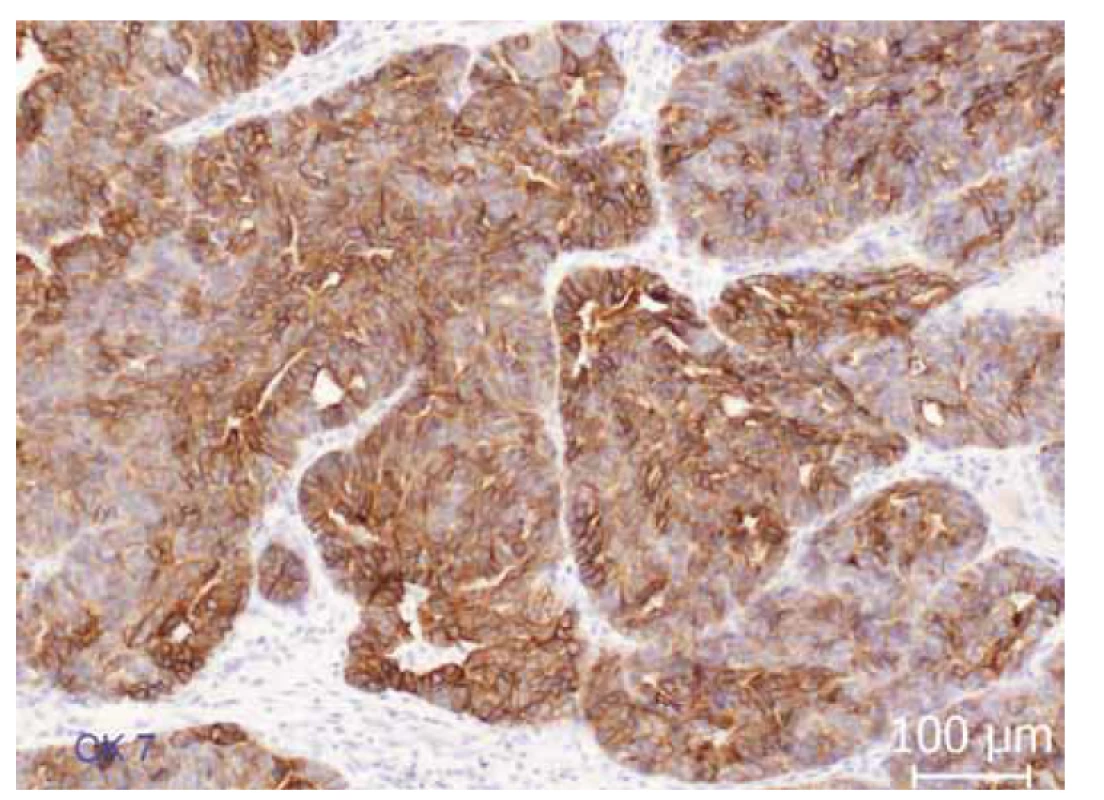
Obr. 4. Imunohistochemická exprese p16. Difuzní cytoplazmatická i nukleární exprese p16 (tzv. bloková pozitivita) v nádorovém epitelu.
Fig. 4. Immunohistochemical expression of p16. Diffuse cytoplasmic and nuclear expression of p16 (so-called block positivity) in tumor epithelium.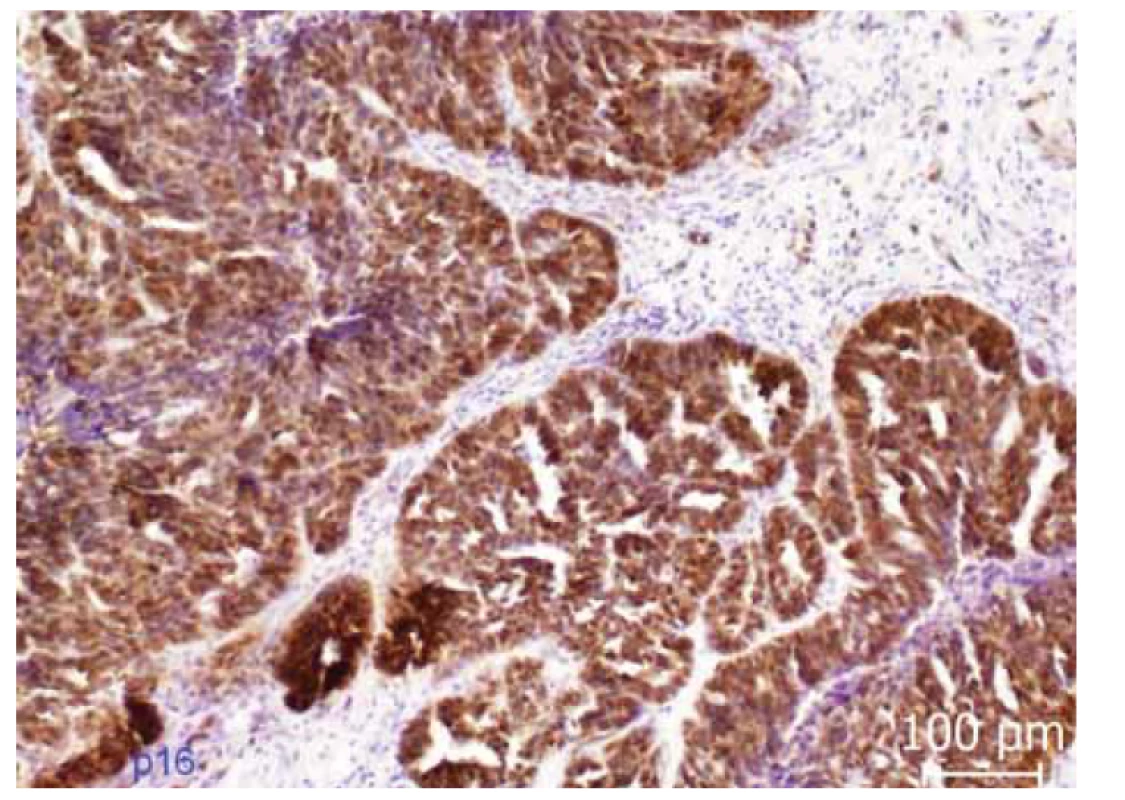
Následně je pacientka dispenzarizována na onkologické ambulanci. Pooperační chemoterapie v režimu paklitaxel + karboplatina, je dosažena remise. V pravidelných intervalech absolvuje kontrolní CT hrudníku, břicha a malé pánve, RTG srdce a plic a také UZ břišních orgánů. Výsledky jsou bez známek recidivy, bez generalizace. Absolvuje balneoterapii. Genetické vyšetření neprokazuje BRCA mutaci. Po 2 letech a 6 měsících od radikální operace byla pacientka odeslána obvodním gynekologem k vyšetření pro tumor v malé pánvi, hodnoty tumormarkerů CA 125 jsou 40 a HE 4 jsou 280. Pacientka je bez potíží, při vaginálním vyšetření pochva končí hladkou jizvou, vpravo bez nálezu, vlevo hmatný tuhý pohyblivý nebolestivý útvar do 5 cm. Na UZ zleva v malé pánvi hyperechogenní útvar 45 × 52 mm. Provedeno PET/CT, kde se na tomografických řezech zobrazuje zvýšená akumulace glukózy v poměrně ostře ohraničeném nehomogenním ložisku v pánvi vlevo vel. 60 x 39 x 59 mm. Nález svědčí pro recidivu Brennerova tumoru. V laboratorním vyšetření vzestup onkomarkerů HE 4 na 2017, CA 125 je 33, ROMA index 50,5. Indikována k LR debulkingu. Provedena dolní střední laparotomie, v operačním poli po uvolnění adhezí nalézáme tumor o průměru 6–7 cm, hladkého povrchu, široce nasedající na levou stěnu pánevní v úrovni ovarické fossy. Serózy malé pánve a dutiny břišní hladké, bez karcinomatózy, bez přítomnosti ascitu, kličky střevní a játra normálního nálezu. Postupně uvolnění široce nasedajícího tumoru od zevních a vnitřních ilických cév, ureter zcela zavzat do tumoru, postupně uvolněn. Operace komplikována větší krevní ztrátou, pooperačně hrazeno krevními deriváty.
Biopsie recidivy tumoru
V případě recidivy byla dodána částice velikosti 70 x 45 x 43 mm s výrazně potrhaným povrchem a pět menších částic v největších rozměrech 13–32 mm. Na řezu největší částicí je tumor bíložluté barvy, ložiskově prokrvácený, zasahující do okrajů této částice, obdobného vzhledu byly i menší vazivově-tukové částice. Histologicky jsou primární tumor i následná recidiva stejné morfologie. Materiál je tvořen vazivovou tkání, která je prostoupena solidně papilárně a zčásti kribriformně utvářeným tumorem tvořeným z buněk s výrazně nepravidelnými jádry s granulárním chromatinem a místy patrnými jadérky, zčásti prominujícími, s četnými mitózami včetně atypických, s apoptózami. Tumor je ložiskově nekrotický. V imunohistochemickém vyšetření exprimují nádorové buňky CK7, p16, ER, vykazují aberantní typ exprese p53 (zcela negativní). Negativní je WT-1, p63, CK20, Gata3.
Vzhledem k fragmentaci dodaného materiálu nelze posoudit resekční okraje ani kompletnost excize. Jde o metastázu/recidivu high-grade tumoru, který může odpovídat malignímu Brennerovu tumoru, který má pacientka v anamnéze, v diferenciální diagnóze je high-grade serózní karcinom tranzicionálního vzhledu a méně pravděpodobný je high-grade endometroidní karcinom. Jednoznačné rozlišení na základě morfologie ani imunohistochemie není s jistotou možné.
Pacientka byla indikována k pooperační chemoterapii karboplatina + paklitaxel. V plánu jsou další kontroly včetně CT hrudníku, břicha a malé pánve. Dle posledních informací je pacientka bez potíží, bez známek další recidivy onemocnění.
Diskuze
Brennerův tumor (BT) patří do skupiny epiteliálních ovariálních nádorů a vyskytuje se pouze u 1–2 % všech ovariálních novotvarů. Byl identifikován v roce 1907 Fritzem Brennerem. Je složen z uroteliálních buněk uspořádaných do solidních nebo cystických skupin ve vláknitém stromatu. Drtivá většina je benigních (95 %), hraničních (3–4 %) a velmi vzácně maligních (1 %). Poprvé popsal maligní Brennerův tumor von Numers v roce 1945 [7].
Maligní Brennerův tumor (MBT) se projevuje podobně jako jiné novotvary vaječníků, a to ve formě nespecifických vágních příznaků, břišních distenzí, bolestmi břicha a tlakovými příznaky tumorózní hmoty. Byly hlášeny MBT produkující estrogeny, které vedly k abnormálnímu děložnímu krvácení. Je popsán jeden případ MBT, kde se objevila intrakraniální hypertenze z duralních metastáz.
Brennerovy nádory byly také vzácně hlášeny v širokém vazu, v pochvě a ve varlatech [8].
Patogeneze BT není jednoznačně objasněna. BT vykazují diferenciaci přechodného typu, jak je vidět u močového měchýře a močovodů, ale nepochází z uroteliálniho traktu. První zprávy naznačovaly původ přímo z povrchového epitelu vaječníků, novější důkazy však naznačují, že tyto nádory pocházejí z míst přechodné buněčné metaplazie v adnexech, známých také jako hnízda Walthardových buněk v normálních vaječnících a vejcovodech [7].
Mikroskopicky jsou pro tento nádor typické oblasti benigního BT a zároveň oblasti ryzí malignity vykazující výraznou cytologickou atypii a infiltraci. Diferenciace přechodného typu nezbytná pro diagnostiku BT/MBT je charakterizována přítomností jader se zřetelnými jadernými rýhami (tvaru „kávových zrn“). Nádory exprimují několik imunohistochemických markerů uroteliální diferenciace, včetně uroplakinu III, trombomodulinu, GATA3, p63 a cytokeratinu 7 [9]. Právě exprese proteinu p63 je zjevně specifická pro buněčnou linii a v ovariálních nádorech je omezena na benigní a hraniční BT. Ztráta exprese u MBT naznačuje roli p63 v Brennerově karcinogenezi [9]. I přes nízkou citlivost a mírnou specificitu je CA 125 nejčastěji používaným sérologickým markerem a používá se k monitorování recidivy po léčbě.
Zajímavé výsledky poskytuje studie Matsutaniho et al v hodnocení MR a FDG/PET/CT u Brennerových nádorů. Průměrná hodnota SUVmax (standardized uptake value) u benigních BT (n = 4) prokázala mírné vychytávání FDG (2,3; rozmezí 1,9–2,6) na rozdíl od mírného vychytávání FDG (SUVmax 5,8) v případě borderline BT a vysokého vychytávání FDG (SUVmax 9,6) MBT.
I přes raritní výskyt MBT je popsáno několik studií s MBT. Gezginc et al popisují studie třinácti pacientů s MBT vaječníků, kteří byli léčeni na gynekologickém oddělení univerzity Selçuk (Turecko). Během 6 let od ledna 2004 do prosince 2010 byla retrospektivně analyzována data z nemocničních elektronických lékařských záznamů.
Výsledky: střední věk studované populace byl 55,69 ± 11,81 let (rozmezí 43–79 let). Většina pacientů měla bolesti břicha (6/13; 46,2 %). Průměrná velikost ovariálních nádorů byla 9,19 ± 1,34 cm (rozmezí 4–16,5 cm). Šest pacientů (46,2 %) bylo ve III. stadiu, pět (38,5 %) v I. stadiu a dva (15,4 %) ve IV. stadiu. Deset pacientů (76,9 %) dostávalo chemoterapii. Průměrné sledování bylo 38,38 ± 23,25 měsíce (rozmezí 5–84 měsíců). Během sledování byla recidiva detekována u sedmi pacientů (53,8 %). Průměrná doba recidivy byla 23,8 ± 14,46 měsíce (rozmezí 11–48 měsíců). Závěrem bylo zjištěno, že onemocnění bylo diagnostikováno většinou v pokročilém stadiu a míra recidivy byla vysoká [10]. Jiná studie popisuje míru recidivy MBT 28 %. Pětileté přežití MBT v I. stadiu je 94,5 %, zatímco u pacientů ve vyšším stadiu byla míra přežití 51,3 %. Podobně jako u jiných nádorů vykazují špatně diferencované tumory horší prognózu než ty, které jsou dobře diferencované [7].
V tab. 1 je popsáno deset případů s MBT. Jde o demografický a onkolgický souhrn těchto případů.
Tab. 1. Demografický a onkologický souhrn případů u pacientů s MBT.
Tab. 1. Demographic and oncological summary of cases in patients with MBT.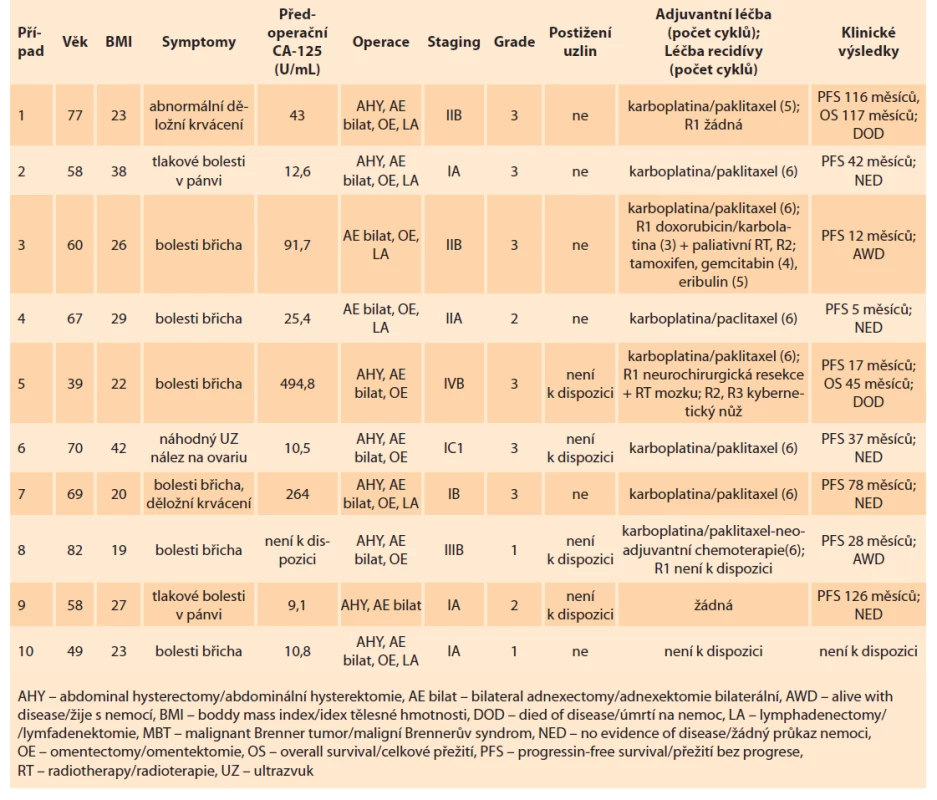
Závěr
Maligní Brennerův tumor (MBT) ovaria je raritní onemocnění, které i přes celosvětově nízký výskyt vykazuje poměrně vysokou recidivu onemocnění (53 %). Pětileté přežití je u vyšších stadií kolem 50 %. Primární modalitou léčby je chirurgická excize. Vzhledem k vzácnosti MBT nebyla stanovena přesná role a režim adjuvantní chemoterapie. V současnosti je většina pacientů léčena adjuvantní chemoterapií karboplatina + paklitaxel po primární operaci [7]. Výskyt recidivy byl nižší, než se očekávalo u vysoce závažného serózního ovariálního karcinomu, ale stále celkově vysoký.
V našem případě byla 66letá pacientka správně referována k vyšetření na vyšší pracoviště a byla provedena adekvátní operace. Histologicky potvrzen MBT levých adnex, staging FIGO IC. Následuje chemoterapie v režimu karboplatina + paklitaxel. Recidiva se objevuje 30 měsíců od první operace. Indikováno PET/CT se zvýšenou akumulací glukózy v poměrně ostře ohraničeném nehomogenním ložisku v pánvi vlevo. Provedena debulking operace pro recidivu MBT, které je potvrzeno histologicky. Následná chemoterapie s dobrým výsledkem, pacientka nyní bez potíží, bez známek recidivy.
Doručeno/Submitted: 20. 11. 2020
Přijato/Accepted: 29. 3. 2021
MUDr. Beáta Feckaninová
Gynekologicko-porodnické oddělení
Nemocnice Šumperk
Nerudova 40
787 01 Šumperk
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Zdroje
1. Kolařík D, Halaška M, Feyereisl J. Repetitorium gynekologie. Praha: Maxdorf 2008 : 794–815.
2. Pilka R a kol. Gynekologie. Praha: Maxdorf 2017 : 200–206.
3. Šišovská A, Minář L, Felsinger M et al. Novinky ve FIGO stagingu karcinomu ovaria, tuby a peritonea. Ceska Gynekol 2017; 82 (3): 230–236.
4. Epidemiologie zhoubných nádorů v České republice. 2021 [online]. Dostupné z: https: //www.svod.cz.
5. Dubová O, Zikán M. Praktické repetitorium gynekologie a porodnictví. Praha: Maxdorf 2019 : 356–365.
6. Špaček J, Kalousek I, Jílek P et al. Vybrané kapitoly z gynekologie. Praha: Mladá fronta 2018 : 114–116, 125, 483.
7. Lang SM, Mills AM,Cantrell LA. Malignant Brenner tumor of the ovary: review and case report. Gynecol Oncol Rep 2017; 22 : 26–31. doi: 10.1016/j.gore.2017.07.001.
8. Balasa RW, Adcock LL, Prem KA et al. The Brenner tumor: a clinicopathologic review. Obstet Gynecol 1977; 50 (1): 120–128.
9. Liao XY, Xue WC, Shen DH et al. P63 expression in ovarian tumours: a marker for Brenner tumours but not transitional cell carcinomas. Histopathology 2007; 51 (4): 477–483. doi: 10.1111/j.1365.2559.2007.02804.x.
10. Gezginç K, Karatayli R, Yazici F et al. Malignant Brenner tumor of the ovary: analysis of 13 cases. Int J Clin Oncol 2012; 17 (4): 324–329. doi: 10.1007/s10147-011-0290-7.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2021 Číslo 4- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Matrix metalloproteinases MMP-2 and MMP-9 as markers for the prediction of preeclampsia in the first trimester
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Kongenitální syfilis jako příčina úmrtí novorozence ve 31. týdnu gravidity – význam testování na syfilis v průběhu gravidity
- Možnosti léčby lokálně recidivujícího karcinomu vulvy
- Recidiva vzácného maligního Brennerova tumoru ovaria
- Molekulární klasifikace endometriálních karcinomů převedená do praxe
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Prevence tvorby de novo adhezí u pacientek s Ashermanovým syndromem
- Pánevní neuropatická bolest (diferenciální diagnostika)
- Historie a současné trendy v léčbě idiopatického hyperaktivního měchýře
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pánevní neuropatická bolest (diferenciální diagnostika)
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Recidiva vzácného maligního Brennerova tumoru ovaria
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



