-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunogenetické aspekty v etiopatogenezi revmatoidní artritidy: Role promotorového polymorfismu - 308 G/A genu pro tumor nekrotizující faktor α. Souhrn doktorské dizertační práce
Immunogenetic aspects of etiopathogenesis of rheumatoid arthritis: the role of - 308 G/A tumor necrosis factor α promoter polymorphism
Introduction.
Rheumatoid arthritis (RA) is a polygenic disorder and genetic determination can contribute to both susceptibility and severity of the disease. Tumor necrosis factor (TNF) α, a potent pro-inflammatory cytokine, plays a key role in the pathogenesis of RA. Several alleles from the HLA-DRB1 locus have been often found to be associated with RA. Thereby, the interest is focused on polymorphisms of the TNF α gene, which is located within the highly polymorphic MHC class III region next to HLA-DR locus on chromosome 6 (6p21.3). TNF α concentration is increased in plasma as well as in synovial fluid from patients with RA. Production of TNF α may be related to the polymorphisms in the TNF α gene. In patients with RA, cardiovascular diseases are responsible for death in 35 – 50 % cases, whereas in general adult population in about 20 - 25 % cases. This increased risk may be associated with RA-specific risk factors such as hyperhomocysteinemia, disease-related dyslipidemia, vascular inflammation, or increased levels of TNF α. It is well known that TNF α can play a role in the process of atherosclerosis. The -308 G/A TNF α promoter polymorphism was demonstrated to associate with obesity, dyslipidemia, insulin resistance, and hypertension - risk factors for coronary heart disease. The aim of the study was to analyze literature data, select a candidate gene for RA, and demonstrate possible association between its polymorphism and risk for onset and severity of RA with respect to several features of the disease.Methods.
A total of 130 patients with RA according to the American College of Rheumatology revised criteria were recruited into the study. The disease duration was at least 2 years. Patients were classified into four groups according to the grade of radiographic progression of the hand and wrist (Steinbrocker radiographic score: grade 1: non-erosive RA – 15 patients, grade II – IV: erosive RA – 114 patients). Control group consisted of 150 subjects with similar age and sex distribution.Results.
We observed no differences in genotype distributions and allelic frequencies of – 308 G/A TNF α promoter polymorphism between RA patients and control group. Significant difference was found for GG genotype in contrast to other genotypes (AA + AG) in – 308 G/A TNFα promotor polymorphism between patients with non-erosive and erosive diseases. In patients with erosive disease, GG genotype was more frequent (47.0 % vs. 74.6 %; OR = 3.35; 95% CI 0.99 – 11.45; P = 0.03). Statistically significant difference was also in allelic frequencies (Pa = 0.05). The difference between groups of patients with respect to genotype distribution was on the borderline of significance (Pg = 0.06). Comparing non-erosive patients and patients with the worst grade of radiographic involvement of the hand and wrist (grade IV), the prevalence of GG genotype was more than 6-fold higher in patients with erosive RA (40.0 % vs. 87.0 %; OR = 6.29; 95 % CI 1.19–36.43; P = 0,01). The difference in allelic frequencies of – 308 G/A TNF α polymorphism between groups of patients with different disabilities according to HAQ was found. Higher frequency of allele G was found in patients with more severe disability (HAQ > 1.00) (Pa = 0.035). Moreover, comparing genotype GG with other genotypes (AA + AG) of – 308 G/A TNF α polymorphism, we found increased presence of genotype GG in patients with increased (> 3.00 mmol/l) in contrast to patients with normal (1.00 – 3.00 mmol/l) plasma level of LDL cholesterol (OR = 2.29; 95% CI 0.94 – 5.63; P = 0.035). Statistically significant difference between those groups was also found for alellic frequencies (Pa = 0.047). Conclusion: The results of this work indicate an association of – 308 G/A TNF α polymorphism with more severe course of RA. Moreover, potential association of this polymorphism with plasma level of LDL cholesterol in RA patients was found.Key words:
gene, polymorphism, rheumatoid arthritis, TNF α
Autoři: P. Němec
Působiště autorů: Revmatologická ambulance II. interní kliniky FN u sv. Anny v Brně a LF MU Brno
Vyšlo v časopise: Čes. Revmatol., 15, 2007, No. 1, p. 25-33.
Kategorie: Souhrny doktorských dizertačních prací
Souhrn
Úvod.
Revmatoidní artritida (RA) je polygenně podmíněné onemocnění s vlivem genetické informace na riziko vzniku a závažnost jejího průběhu. Tumor nekrotizující faktor α (TNFα) je prozánětlivým cytokinem s klíčovou rolí v patogenezi RA. Opakovaně byla prokázána asociace některých alel HLA-DRB1 lokusu s RA. Z tohoto důvodu je věnována velká pozoronost polymorfismům TNFα genu, který je lokalizován ve vysoce variabilní oblasti genomu označované jako oblast HLA genů III. třídy, ležící na krátkém raménku 6 chromozomu (6p21.3) v těsné blízkosti HLA-DR lokusu. Zvýšená hladina TNFα je prokazována v plazmě a synoviální tekutině pacientů s RA. Produkce TNFα u RA může pravděpodobně souviset s některými polymorfismy genu pro TNFα. Onemocnění kardiovaskulárního systému jsou zodpovědná za 35–50 % úmrtí pacientů s RA, zatím co v běžné populaci jsou příčinou 20–25 % úmrtí. Toto zvýšené riziko může být spojeno s přítomností rizikových faktorů specifických pro RA jako je hyperhomocysteinemie, dyslipidemie asociovaná s onemocněním, zánět cévní stěny nebo zvýšená plazmatická hladina TNFα. Je známo, že se TNFα účastní procesu aterosklerózy. Byla prokázána asociace mezi promotorovým polymorfismem – 308 G/A v genu pro TNFα a obezitou, dyslipidemií, inzulinovou rezistencí a hypertenzí, tedy rizikovými faktory ischemické choroby srdeční. Cíl. Cílem studie bylo prostřednictvím analýzy literárních údajů vybrat vhodný kandidátní gen pro RA a prokázat možný vztah mezi vybraným polymorfismem tohoto genu a rizikem vzniku a závažností průběhu RA a některými fenotypovými znaky tohoto onemocnění.Metody.
Během tříletého období bylo do studie zařazeno celkem 130 pacientů, kteří splnili revidovaná diagnostická kritéria American College of Rheumatology pro RA s délkou trvání choroby minimálně 2 roky. Pacienti byli rozděleni do 4 skupin podle rentgenové progrese (klasifikace dle Steinbrockera: stadium I: neerozivní – 15 pacientů, stadium II–IV: erozivní – 114 pacientů). Kontrolní skupina zahrnovala 150 zdravých dobrovolníků obdobné distribuce věku a pohlaví.Výsledky.
Nebyl nalezen rozdíl v genotypových distribucích ani alelických frekvencích polymorfismu – 308 G/A TNFα mezi pacienty s RA a kontrolní skupinou. Statisticky významný rozdíl byl pozorován ve srovnání přítomnosti genotypu GG oproti ostatním genotypům (AA + AG) polymorfismu – 308 G/A TNFα mezi pacienty s neerozivní a erozivní formou onemocnění s vyšším zastoupením GG genotypu u erozivní formy RA (47,0 % vs. 74,6 %; OR = 3,35; 95% CI 0,99 – 11,45; P = 0,03). Statisticky významný byl rovněž rozdíl v alelických frekvencích (Pa = 0,05). V distribuci genotypů byl rozdíl mezi těmito skupinami pacientů na hranici signifikance (Pg = 0,06). Srovnání pacientů bez přítomných erozí a pacientů s nejtěžším stupněm rentgenového postižení (stadium IV) kloubů rukou a zápěstí prokázalo signifikantní více než 6násobné riziko vývoje nejtěžšího stupně rentgenového postižení kloubů pro nositele genotypu GG (40,0 % vs. 87,0 %; OR = 6,29; 95% CI 1,19 – 36,43; P = 0,01). Statisticky významný byl rovněž rozdíl v alelických frekvencích polymorfismu – 308 G/A TNFα mezi skupinami pacientů s odlišným stupněm funkčního postižení, hodnoceným dle HAQ, s vyšší frekvencí alely G u pacientů s vyšším stupněm funkčního postižení (HAQ > 1,00) (Pa = 0,035). Navíc se podařilo prokázat signifikantní rozdíl ve srovnání přítomnosti genotypu GG oproti ostatním genotypům (AA + AG) polymorfismu – 308 G/A TNFα mezi souborem pacientů s normální (1,00 – 3,00 mmol/l) a se zvýšenou (> 3,00 mmol/l) plazmatickou hladinou LDL-cholesterolu s vyšším zastoupením GG genotypu u pacientů se zvýšenou plazmatickou hladinou LDL-cholesterolu (OR = 2,29; 95% CI 0,94 – 5,63; P = 0,035). Statisticky významný rozdíl mezi těmito soubory byl rovněž nalezen v alelických frekvencích (Pa = 0,047). Závěr Výsledky této práce naznačují asociaci polymorfismu – 308 G/A genu pro TNFα se závažností průběhu RA. Navíc byla prokázána možná asociace tohoto polymorfismu s plazmatickou hladinou LDL-cholesterolu u RA pacientů.Klíčová slova:
gen, polymorfismus, revmatoidní artritida, polymorfismus, TNFαÚVOD
Revmatoidní artritida (RA) je chronické systémové autoimunitní onemocnění. Místem patologického zánětlivého děje je synoviální výstelka v kloubech, burzách a šlachách. Chronický zánět vede k tvorbě granulační zánětlivé tkáně (pannus) tvořené řadou imunokompetentních buněk. Důsledkem chronické synovitidy je destrukce kloubní chrupavky, vznik erozí subchondrální kosti a v konečné fázi vývoj deformit postižených kloubů. U svých nositelů vede RA dříve nebo později k disabilitě (1). RA se vyskytuje celosvětově s prevalencí 0,24–1 %. Etiologie RA není doposud známa. Předpokládá se však, že onemocnění vzniká u geneticky predisponovaných jedinců působením jistých, doposud neznámých faktorů (artritogenních agens), které vyvolají abnormální odpověď imunitního systému. RA je vzhledem k věku vzniku prvních obtíží, spektru klinických projevů, variabilitě stupně progrese onemocnění, ale rovněž s ohledem na nejednotnost prokazovaných abnormalit imunitního systému značně heterogenním onemocněním. Za tuto heterogenitu mohou být na jedné straně zodpovědny faktory zevního prostředí (infekce, stres nebo toxické látky) a na druhé straně je zřejmé, že klinická variabilita a některé laboratorní projevy RA mohou být podmíněny i faktory genetickými.
Genetickou predispozici potvrzují poznatky získané z epidemiologických studií sledujících výskyt RA u dvojčat, kde konkordance pro RA u jednovaječných dvojčat je 10–15 %, zatím co u dvojvaječných dvojčat 5–7 % (2). Výskyt RA u prvostupňových příbuzných pacientů s RA je odhadován na 2–4 %. Srovnání prevalencí RA v jednotlivých zkoumaných populacích může být použito k odhadu relativního genetického rizika vývoje RA (λ). Relativní genetické riziko pro jednovaječná dvojčata kolísá mezi 12 a 62 (λMZ ~ 12–62). Relativní genetické riziko vývoje RA pro prvostupňové příbuzné rovněž kolísá mezi 2–17 (λS ~ 2 – 17), zejména z důvodů odlišných výsledků epidemiologických studií. Tyto výsledky napovídají, že genetická predispozice je pravděpodobně polygenní, ale také že počet genů, které se na ní podílí, není pravděpodobně vysoký. Analýza dat získaných ze dvou celonárodních studií dvojčat s RA, provedených ve Finsku a Velké Británii, prokázala, že se dá předpokládat až 65% vliv genetické determinace na vznik a vývoj RA (2).
Významný podíl genetické predispozice k RA připadá na geny hlavního histokompatibilního komplexu (MHC) II. třídy (3). Lidský MHC je označován jako HLA (human leukocyte antigen). Velikost příspěvku HLA genů II. třídy k celkovému genetickému riziku RA je odhadována na 30–50 %. HLA lokus je lokalizován ve vysoce variabilní oblasti genomu na krátkém raménku 6. chromozomu (6p2). V sedmdesátých letech Stastný jako první popsal asociaci RA s přítomností alely HLA-DR4 u pacientů kavkazské populace (4). Následně byla prokázána asociace onemocnění s přítomností alel HLA-DR1, DR10 a DR6 u DR4 pozitivních, ale i negativních pacientů, zejména u jiných etnických skupin než u kavkazské populace. Bylo zjištěno, že genetická predispozice k RA je vázána na HLA alely kódující určitý sekvenční aminokyselinový motiv ve třetí hypervariabilní oblasti DRB1 (řetězec β) molekuly. Tato konzervovaná sekvence je označována jako tzv. sdílený epitop (shared epitope, SE). Alely kódující zmíněný motiv se vyskytují přibližně u 85–96 % pacientů s RA. Přítomnost alely HLA-DRB1*0401 u pacientů s RA může být faktorem určujícím závažnější průběh onemocnění s extraartikulárními projevy, zejména jsou-li pacienti homozygotní pro DRB1*0401 alelu. Zdá se tedy, že v míře rizika vývoje a závažnosti RA se uplatňuje efekt genové dávky asociovaných HLA alel. Některé práce naznačily, že alely kódující SE jsou asociovány s rizikem vývoje pouze anti-CCP pozitivní RA (5). Jiné práce naopak prokázaly, že alela HLA-DR3 je asociována s rizikem vývoje anti-CCP negativní RA (6). Tyto nálezy mohou poukazovat na odlišný patogenetický mechanismu anti-CCP pozitivní a anti-CCP negativní RA (7).
Předpokládá se však, že mimo HLA lokus II. třídy existuje řada kandidátních genů majících vztah k RA. Yamada a kol. analyzovali genom 48 pacientů s RA v rozsahu přibližně 104 Kb. Detekovali celkem 163 polymorfismů 41 kandidátních genů asociovaných s RA (8). U 142 těchto polymorfismů se jednalo o jednonukleotidové záměny (SNP), které se řadí k nejčastější formě variability genetické informace. Předpokládá se, že na každých 200–300 párů bazí připadá jedna SNP. Dalšími kandidátními geny pro RA mohou být geny pro některé cytokiny, jejich antagonisty a cytokinové receptory, geny jejichž produkty se podílí na apoptotických mechanismech, geny pro některé proteinázy (MMP-2, MMP-3), geny regulující T buněčnou odpověď (CTLA-4, PTPN22), gen pro inhibitor podobný IκB (NFKBIL1) (9), gen pro peptidil arginin deiminázu typ 4 (PADI4) (10), případně geny kódující složky komplementové kaskády. U některých polymorfismů těchto genů se předpokládá jejich funkční význam v ovlivnění genové exprese, neboť jsou lokalizovány v promotorové regulační oblasti jmenovaných genů.
TNFα je pleiotropní prozánětlivý cytokin produkovaný řadou buněk, zejména monocyty, makrofágy, T-lymfocyty, ale rovněž synoviálními fibroblasty, B-lymfocyty, neutrofily, mastocyty a epiteliálními buňkami. Efekt TNFα na cílové buňky je zprostředkován vazbou na specifické receptory pro TNF (TNFR) (11). TNFα hraje významnou roli v patogenezi RA, zejména v indukci T buněčné imunitní odpovědi, při stimulaci produkce proteolytických enzymů, prostaglandinů, expresi adhezivních molekul či HLA antigenů II. třídy (12).
TNFα lokus je lokalizován ve vysoce variabilní oblasti genů pro MHC na krátkém raménku 6. chromozomu (6p21.3), někdy označované jako HLA geny III. třídy. Gen pro TNFα leží mezi geny pro lymfotoxin-α (LTα) a genem pro LTß přibližně 250 kb centromericky od HLA-B lokusu a asi 850 kb telomericky od HLA-DR lokusu. Tato oblast je některým autory považována za druhý nejvýznamnější lokus ve vztahu k RA (13). Polymorfismy TNFα genu byly popsány v promotorové oblasti, v 5‘ nepřepisované oblasti a v prvním intronu. V kontrastu s těmito nálezy je 3‘ nepřepisovaná oblast genu relativně konstantní. Doposud popsané polymorfismy, většinou SNP, TNFα genu zahrnují – 1031 T/C, – 863 C/A, – 857 C/T, – 851 C/T, – 419 G/C, – 376 G/A, – 308 G/A, – 244 G/A, – 238 G/A, –163 G/A, – 49 G/A, + 489 G/A, + 851 A/G a + 1304 A/G, dále inzerci cytosinu na pozici + 70 a deleci guaninu na pozici + 691G (14).
Většina z těchto polymorfismů se vyskytuje v 5‘ promotorové oblasti genu, tedy v segmentu, který se podílí na regulaci genové transkripce. Největší pozornost je věnována SNP v promotorové oblasti genu pro TNFα záměně guaninu za adenin v pozicích – 308 a – 238. Polymorfismy v této lokalitě genu by mohly hrát významnou roli v patogenezi RA, jak v míře vnímavosti ke vzniku choroby, tak v určení závažností jejího průběhu.
CÍL PRÁCE
Cíle práce byly stanoveny s ohledem na nutnost komplexního přístupu k problematice imunogenetických podkladů etiopatogeneze RA takto:
- Z analýzy současných literárních údajů odvodit vhodné kandidátní geny pro studium asociace těchto genů s RA.
- Prokázat, zda se vybraný polymorfismus – 308 G/A v promotorové oblasti genu pro TNFα uplatňuje v predispozici ke vzniku RA (studie case - control).
- Prokázat, zda vybraný polymorfismus – 308 G/A v promotorové oblasti genu pro TNFα může být považován za faktor určující závažnost průběhu RA.
- Prokázat, zda vybraný polymorfismus – 308 G/A v promotorové oblasti genu pro TNFα může být asociován s některými vybranými fenotypovými znaky RA.
METODY
Soubory pacientů a kontrol
Do studie bylo zařazeno celkem 130 pacientů s RA, kteří byli vyšetření v průběhu roků 2004 až 2006 v revmatologické ambulanci II. interní kliniky Fakultní nemocnice u sv. Anny v Brně. Zařazení jedince do projektu bylo podmíněno podpisem informovaného souhlasu. Studie probíhala v souladu s Helsinskou deklarací schválenou na zasedání WMA v Edinburgu. Studie byla schválena Etickou komisí FN u sv. Anny v Brně a Lékařské fakulty Masarykovy univerzity v Brně.
Všichni pacienti zařazení do studie splnili revidovaná kritéria American College of Rheumatology (Arnett et al., 1987) pro RA. Soubor zahrnoval 98 žen a 32 mužů. Bližší charakteristiky souboru pacientů uvádí tabulka (tab. 1). Do studie byli zařazováni pouze pacienti s etablovanou RA, tedy pacienti kde interval mezi vznikem prvních symptomů choroby a dnem vyšetření byl delší než 24 měsíců. Vyšetření každého pacienta zahrnovalo historii onemocnění, klinické vyšetření a zhodnocení funkčního stavu pacienta (dotazník Health assessment questionnaire (HAQ)). Klinické vyšetření 28 periferních kloubů bylo použito k výpočtu skóre aktivity onemocnění DAS 28. Všem pacientům byla odebrána krev ke stanovení hodnot FW, CRP, celkového cholesterolu, HDL, LDL-cholesterolu a triglyceridů, dále hladiny revmatoidního faktoru ve třídě IgG, IgA a IgM, protilátek anti-CCP a antinukleárního faktoru. 129 pacientům byl proveden rentgenový snímek obou rukou a zápěstí ve dvou projekcích. Jeden pacient v období mezi klinickým a rentgenovým vyšetřením zemřel. Hodnocení rentgenové progrese choroby bylo provedeno na základě Steinbrockerovy klasifikace (Steinbrocker, 1949) Pacienti byli podle rentgenové progrese choroby následně rozděleni do 4 skupin: Stadium I – bez přítomnosti kloubních erozí – 15 pacientů, stadium II – 44 pacientů, stadium III – 44 a stadium IV – 26 pacientů. Kontrolní soubor zahrnoval 150 zdravých dobrovolníků obdobné distribuce věku a pohlaví (věkové rozpětí 27,2 až 86,5 roků, medián 51,7 roků) bez klinických a laboratorních známek RA.
Tab. 1. Charakteristika souboru pacientů s RA. 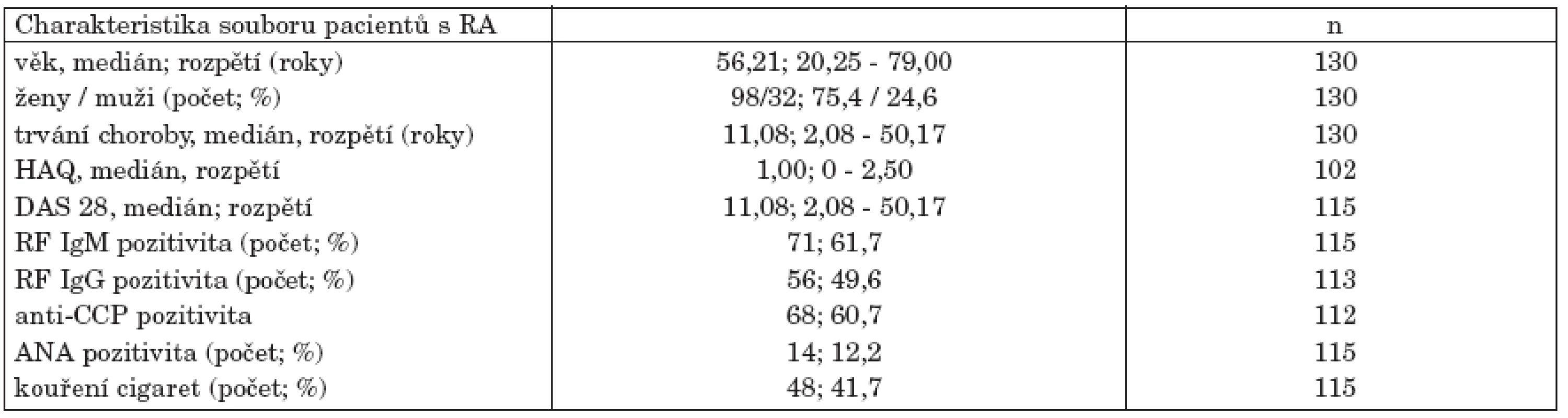
Detekce genotypu promotorového polymorfismu – 308 G/A v genu pro TNFα
Pacientům i kontrolám byla odebrána periferní krev a z ní izolována DNA z leukocytů pomocí metody s využitím proteinázy K. Izolace DNA spočívala v lýze buněk v roztoku, který obsahuje 10 mM Tris - HCl (pH=8,5), 0,1% SDS, 0,1 mg/ml proteinázy K. Proteináza K byla odtraněna extrakcí fenolem a po ethanolové precipitaci a vysušení byl vzorek DNA rozpuštěn v TE pufru.
Metodou PCR (polymerase chain reaction) byl amplifikován úsek promotoru genu pro TNFα v délce 328 pb. Po restrikční analýze (RFLP - restriction fragment length polymorphism) pomocí restrikční endonukleázy BsmFI (New England Biosystem, USA) při teplotě 65 °C po 3 hodiny ve 2% agarózovém gelu v UV světle byl identifikován genotyp GG (137 + 103 + 88 pb), GA (191+ 137 + 103 + 88 pb) nebo AA (191 + 137 pb) (obr. 1).
Obr. 1. Genotypy polymorfismu -308 G/A na elektroforetickém gelu v UV světle. 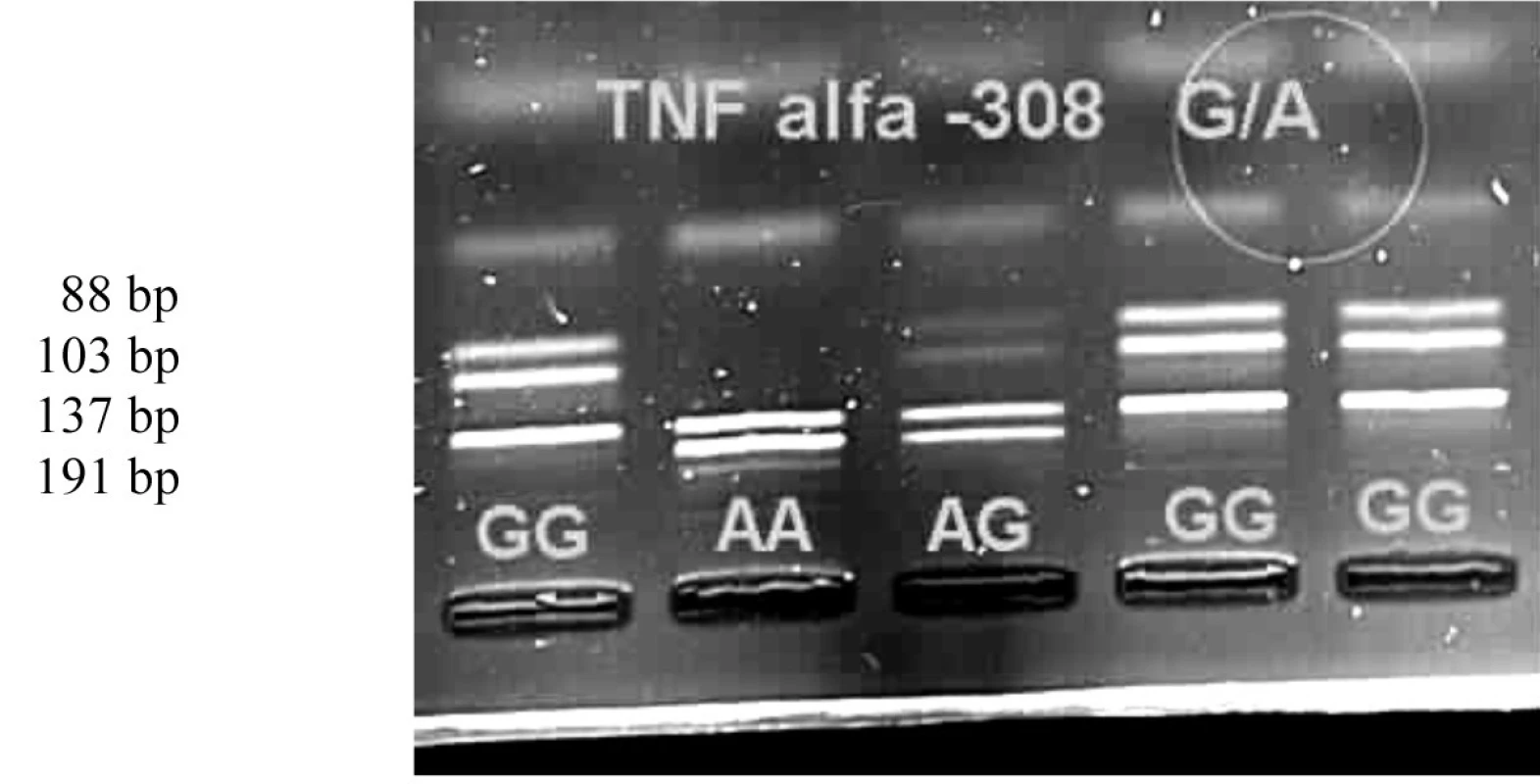
Statistická analýza
Rozdíly v distribuci genotypů a alelických frekvencích polymorfismu – 308 G/A TNFα mezi pacienty a kontrolními osobami a mezi skupinami pacientů byly kalkulovány pomocí chí-kvadrát testu a Fisher-exact testu. Shoda genotypových distribucí s Hardy-Weinbergovým equilibriem byla testována pomocí chí-kvadrát testu. Odds ratio (OR) a 95% konfidenční interval (CI) byl využit k výpočtu rizika polymorfismu – 308 G/A TNFα ve vztahu k onemocnění. K výpočtu signifikance OR byl použit Fisher-exact test. Za signifikantní byla považována hladina významnosti 5 %. Ke korekci mnohonásobného srovnání byl použit Holmův test. Po rozdělení souboru pacientů s RA podle některých klinických ukazatelů nebylo v zájmu statistické signifikance analýzy přistoupeno k dalšímu dělení souborů, protože jednotlivé skupiny by zahrnovaly příliš nízký počet jedinců.
Výsledky
Srovnání distribuce genotypů a alelických frekvencí promotorového polymorfismu – 308 G/A v genu pro TNFα v souboru pacientů s RA a v kontrolním souboru
Nebyly nalezeny žádné signifikantní rozdíly v distribuci genotypů a v alelických frekvencích polymorfismu – 308 G/A genu pro TNFα mezi souborem pacientů s RA a kontrolním souborem (Pg = 0,13) (tab. 2) (graf 1).
Tab. 2. Distribuce genotypů a alelické frekvcence polymorfismu - 308 G/A v genu pro TNFα v souboru pacientů s RA a v kontrolním souboru. 
Graf 1. Distribuce genotypů a alelické frekvence polymorfismu - 308 G/A v genu pro TNFα v souboru pacientů s RA a v kontrolním souboru. 
Srovnání distribuce genotypů a alelických frekvencí polymorfismu – 308 G/A v genu pro TNFα v souborech s odlišným stupněm rentgenové progrese RA
Soubor pacientů s RA byl rozdělen podle stupně rentgenové progrese, hodnocené na základě Steinbrockerovy klasifikace, na soubor RA pacientů bez přítomných kloubních erozí (stadium I) a na soubor RA pacientů s vytvořenými kloubními erozemi (stadium II – IV) na rentgenovém snímku rukou a zápěstí. Statisticky významný rozdíl byl pozorován ve srovnání přítomnosti genotypu GG oproti ostatním genotypům (AA +AG) polymorfismu – 308 G/A TNFα v rámci souboru pacientů s RA mezi neerozivní a erozivní formou onemocnění s vyšším zastoupením GG genotypu u erozivní formy RA (47,0 % vs. 74,6 %; OR = 3,35; 95% CI 0,99 – 11,45; P = 0,03) (tab. 3) (graf 2). V distribuci genotypů byl rozdíl mezi těmito skupinami RA pacientů na hranici signifikance (Pg = 0,06). Statisticky významný byl rovněž rozdíl v alelických frekvencích polymorfismu – 308 G/A TNFα v rámci souboru pacientů s RA mezi neerozivní a erozivní formou onemocnění (Pa = 0,05). Jestliže jsem proti sobě porovnal soubor pacientů s RA bez přítomných erozí a soubor pacientů s nejtěžším stupněm rentgenového postižení kloubů rukou a zápěstí (stadium IV), bylo patrné signifikantní více než 6násobné riziko vývoje nejtěžšího stupně rentgenového postižení kloubů (stadium IV) pro nositele GG genotypu polymorfismu – 308 G/A genu pro TNFα (40,0 % vs. 87,0 %; OR = 6,29; 95% CI 1,19 – 36,43; P = 0,01). (tab. 4) (graf 3). Statisticky významný byl rovněž rozdíl v alelických frekvencích polymorfismu – 308 G/A genu pro TNFα mezi těmito dvěma skupinami pacientů s RA s vyšší frekvencí alely G u pacientů s nejtěžším stupněm rentgenového postižení (stadium IV) (Pa = 0,02).
Tab. 3. Zastoupení GG genotypu proti ostatním genotypům (AA + AG) polymorfismu - 308 G/A v genu pro TNFα v souborech s neerozivní a erozivní RA. 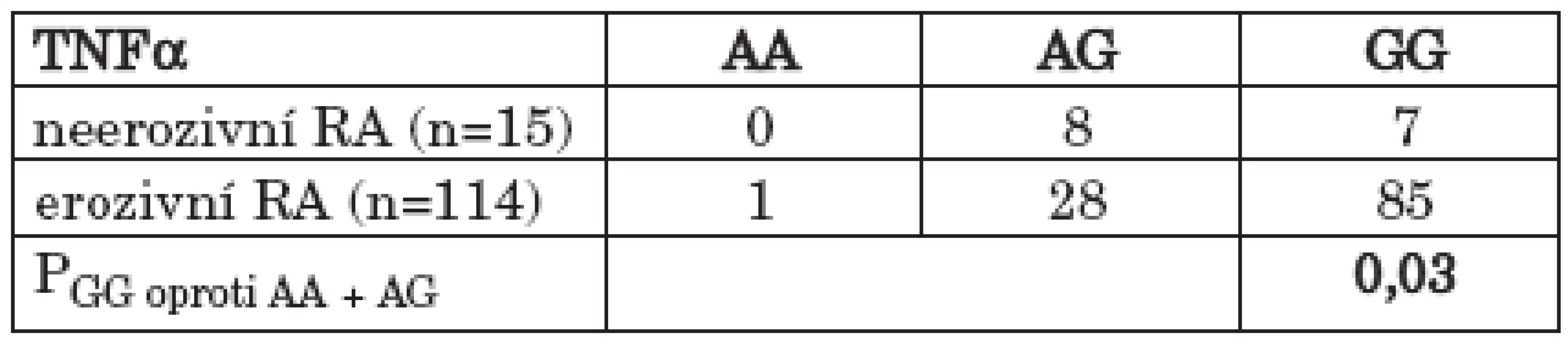
Graf 2. Zastoupení GG genotypu proti ostatním genotypům (AA + AG) polymorfismu - 308 G/A v genu pro TNFα v souborech s neerozivní a erozivní RA. 
Tab. 4. Zastoupení GG genotypu proti ostatním genotypům (AA + AG) polymorfismu - 308 G/A v genu pro TNFα u pacientů s neerozivní RA a s nejtěžším stupněm postižení (stadium IV) 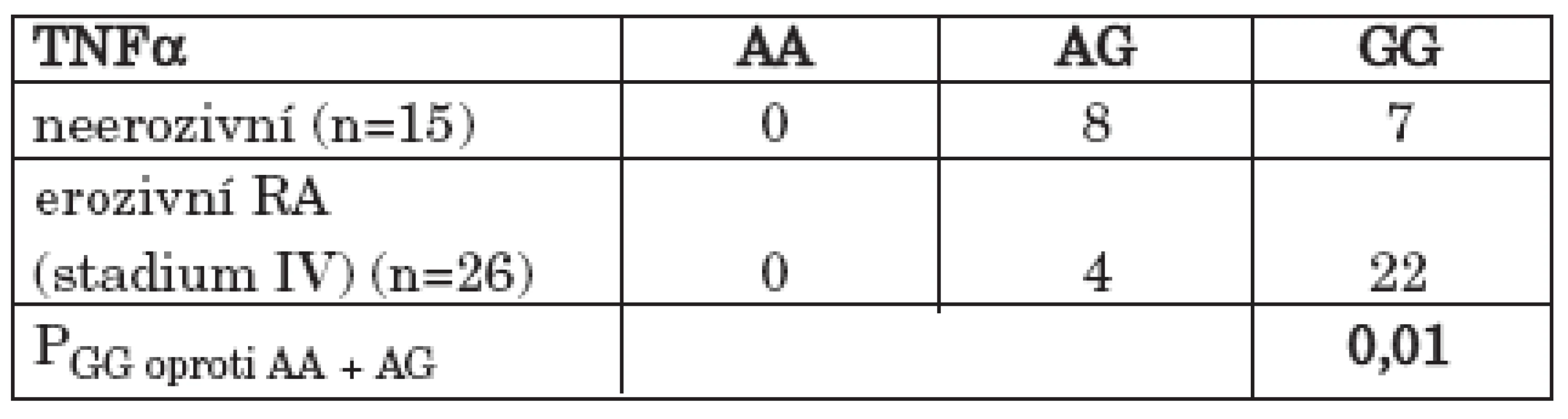
Graf 3. Zastoupení GG genotypu proti ostatním genotypům (AA + AG) polymorfismu - 308G/A v genu pro TNFα u pacientů s neerozivní RA a s nejtěžším stupněm postižení (stadium IV). 
Srovnání distribuce genotypů a alelických frekvencí polymorfismu – 308 G/A v genu pro TNFα v souborech pacientů s RA s odlišnými vybranými fenotypovými znaky
Dalším cílem mé práce bylo zjistit, zda polymorfismus – 308 G/A v genu pro TNFα koreluje s některými dalšími fenotypovými znaky v rámci souboru pacientů s RA. Soubor pacientů s RA byl rozdělen následujícím způsobem: Pacienti s odlišným stupněm funkčního postižení dle dotazníku HAQ; pacienti s RA se střední a vysokou aktivitou onemocnění a pacienti v remisi a nízkou aktivitou onemocnění dle skóre DAS 28; pacienti s pozitivitou a negativitou anti-CCP; s pozitivitou a negativitou RF IgM, RF IgG a ANA; pacienti s normální a zvýšenou plazmatickou hladinou LDL-cholesterolu a současní nebo minulí kuřáci cigaret a nekuřáci.
Soubor RA pacientů byl rozdělěn na dvě skupiny podle hodnoty dotazníku HAQ (pacienti s nižším stupněm funkčního postižení (HAQ ≥ 1,00) a pacienti vyšším stupněm funkčního postižení (HAQ > 1,00). Medián hodnoty HAQ ve sledovaném souboru byl 1,00 (0–2,50). Kompletně vyplněný hodnotitelný dotazník HAQ odevzdalo 102 pacientů. Statisticky významný rozdíl byl pozorován v rozdílu alelických frekvencí polymorfismu – 308 G/A TNFα mezi těmito dvěma skupinami s vyšší frekvencí alely G u pacientů s vyšším stupněm funkčního postižení (HAQ > 1,00) (Pa = 0,035) (tab. 5) (graf 4).
Tab. 5. Distribuce genotypů a alelické frekvence polymorfismu - 308 G/A v genu pro TNFα v souboru pacientů s RA s různým stupněm funkčního postižení (HAQ ≤ 1,00 vs. HAQ > 1,00). 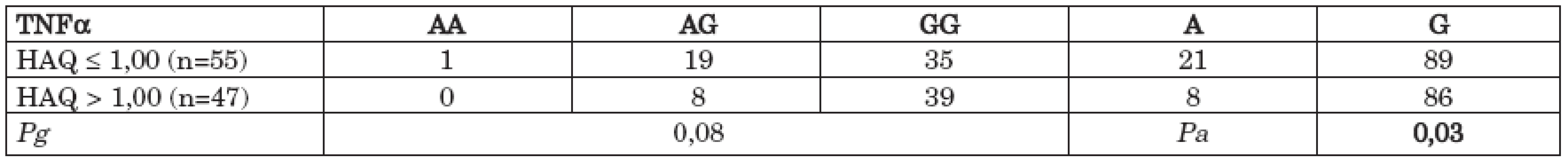
Graf 4. Alelické frekvence polymorfismu - 308 G/A v genu pro TNFα v souboru pacientů s RA s různým stupněm funkčního postižení (HAQ ≤ 1,00 vs. HAQ > 1,00). 
Statisticky významný rozdíl byl rovněž pozorován ve srovnání přítomnosti genotypu GG oproti ostatním genotypům (AA + AG) polymorfismu – – 308 G/A TNFα mezi souborem pacientů s normální (1,00 – 3,00 mmol/l) a se zvýšenou (> 3,00 mmol/l) plazmatickou hladinou LDL-cholesterolu s vyšším zastoupením GG genotypu u pacientů se zvýšenou plazmatickou hladinou LDL-cholesterolu (OR = 2,29; 95% CI 0,94 – 5,63; P = 0,035) (tab. 6) (graf 5). Statisticky významný rozdíl byl rovněž nalezen v alelických frekvencích polymorfismu – 308 G/A genu pro TNFα mezi těmito dvěma soubory pacientů s vyšší frekvencí alely G u pacientů se zvýšenou plazmatickou hladinou cholesterolu (Pa = 0,047).
Tab. 6. Zastoupení GG genotypu proti ostatním genotypům (AA + AG) polymorfismu - 308 G/A v genu pro TNFα mezi souborem pacientů s RA s normální a se zvýšenou plazmatickou hladinou LDL-cholesterolu. 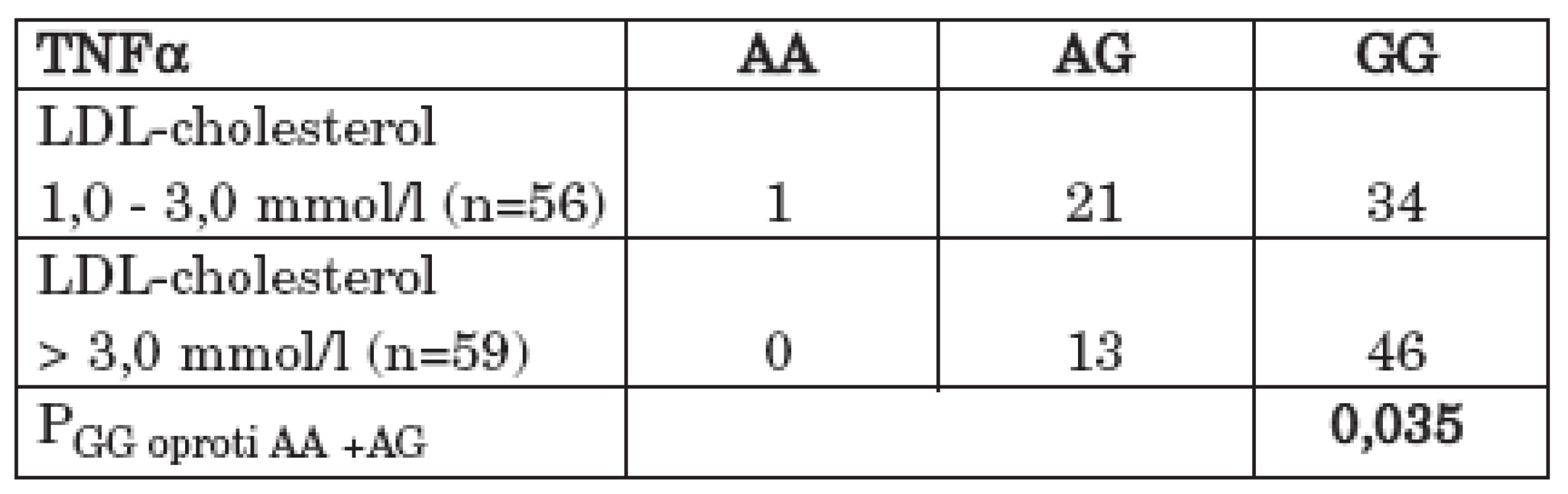
Graf 5. Zastoupení GG genotypu proti ostatním genotypům (AA + AG) polymorfismu - 308 G/A v genu pro TNFα mezi souborem pacientů s RA s normální a se zvýšenou plazmatickou hladinou LDL-cholesterolu. 
V ostatních sledovaných parametrech nebyl zaznamenán statisticky významný rozdíl v distribuci genotypů ani v alelických frekvencích polymorfismu – 308 G/A v genu pro TNFα mezi sledovanými podsoubory pacientů s RA.
Diskuse
Již déle než čtvrt století je známa asociace HLA-DRB1 alel s rizikem vývoje RA a jejím závažnějším průběhem. Velikost příspěvku HLA alel II. třídy k celkovému genetickému riziku RA je odhadována na 30–50 %. Výsledky mé práce naznačují existenci jiných kandidátních genů mimo HLA lokus II. třídy, které mohou ovlivňovat závažnost strukturálního postižení kloubů u RA pacientů. Studovaným polymorfismem byla jednonukleotidová záměna G/A na pozici – 308 v promotoru genu pro TNFα.
Některé z doposud publikovaných prací prokázaly asociaci promotorových polymorfismů genu pro TNFα se závažností průběhu RA. Závažnější průběh RA byl pozorován u heterozygotů GA polymorfismu – 308 TNFα (15). Rovněž Wilson a kol. ve své práci prokázali tendenci k nárůstu počtu kloubních erozí u pacientů s genotypem – 308 GA (16). Rozdíl v genotypových distribucích mezi subpopulacemi pacientů s RA však nebyl statisticky významný. Brinkman a kol., kteří provedli genetickou analýzu 283 pacientů s RA, neprokázali asociaci polymorfismu – 308 G/A TNFα se závažností průběhu RA (17). Autoři nepozorovali statisticky významný rozdíl v distribuci genotypů polymorfismu – 308 G/A mezi pacienty s odlišnou mírou tvorby kloubních erozí během 3 let. Nebyla rovněž zaznamenána asociace tohoto polymorfismu s přítomností revmatických uzlů a zvýšenou hladinou RF. Alela A tohoto polymorfismu, ve výše zmíněné práci, signifikantně korelovala s přítomností alely HLA-DR3. Autoři častěji pozorovali erozivní průběh RA u pacientů s genotypem GG v jiném promotorovém polymorfismu – 238 G/A v genu pro TNFα ve srovnání s heterozygoty GA tohoto polymorfismu. Tento trend byly pozorován nezávisle na HLA-DR4 pozitivitě či negativitě. Autoři se domnívají, že existuje jistý stupeň vazebné nerovnováhy mezi alelami – 238 G a - 308 A obou polymorfismů. Bartonová a kol. ve své rozsáhlé observační studii hodnotili asociaci devíti polymorfismů TNF lokusu u celkem 438 pacientů s nediferencovanou artritidou a RA (18). Cílem práce bylo asociovat na jedné straně jednotlivé polymorfismy TNFα genu a na druhé straně hodnotit rozdíl ve frekvencích jejich haplotypů v závislosti na rentgenové progresi artritidy po dobu 5 let od vstupu pacienta do registru. Autoři neprokázali rozdíl v alelických frekvencích ani v distribuci genotypů polymorfismů -1031 T/C, - 863 C/A, – 857 C/T, – 376 G/A, – 238 G/A, + 489 G/A, + 851 A/G a + 1304 A/G v závislosti na závažnosti průběhu artritidy. Pouze polymorfismu – 308 G/A byl asociován s erozivním fenotypem artritidy. Autoři zaznamenali tendenci k nárůstu frekvence alely G u pacientů s tvorbou kloubních erozí ve srovnání s pacienty bez jejich tvorby. Autoři rovněž neprokázali rozdíl ve frekvencích haplotypů výše zmíněných polymorfismů mezi pacienty s různým stupněm progrese choroby.
Předmětem studia byl rovněž vztah polymorfismu – 308 G/A TNFα k vnímavosti ke vzniku RA. V již citované práci pozoroval Brinkman a kol. tendenci k nárůstu frekvence alely – 308 G u pacientů s RA oproti zdravým kontrolám, ačkoliv tento rozdíl nebyl statisticky významný (17). V jiné práci, která ovšem zahrnovala menší počet pacientů s RA, byl zaznamenán nárůst frekvence alely – 308 A u pacientů s RA oproti kontrolním osobám (19). V práci Rodriguez-Carreona a kol. autoři také prokázali nárůst frekvence alely A u pacientů se závažnějším průběhem RA ve srovnání se zdravými kontrolami (20). Jiné práce však vztah mezi polymorfismem – 308 G/A a rizikem vývoje RA neprokázaly (16, 21, 22).
Výsledky mé práce potvrzují existenci asociace mezi polymorfismem – 308 G/A v genu pro TNFα a závažností průběhu RA. V souladu se závěry většiny z doposud publikovaných prací se mi nepodařilo prokázat asociaci promotorového polymorfismu – 308 G/A v genu pro TNFα s vnímavostí ke vzniku RA.
Jak je patrno, výše zmíněné studie poskytuji rozdílné výsledky. Tyto rozdílné výsledky mohou být na jedné stráně podmíněny etnickými rozdíly ve studovaných populacích pacientů s RA. Na druhé straně mnoho autorů připouští existenci jistých vazeb (vazebné nerovnováhy) ať už mezi jednotlivými polymorfismy uvnitř genu pro TNFα, nebo mezi různými skupinami genů. Vzhledem k blízkosti genu pro TNFα a HLA genů II. třídy na krátkém raménku 6. chromozomu se předpokládá existence vazebných nerovnováh právě mezi těmito skupinami genů.
Otázkou zůstává, jakým způsobem se může polymorfismus v TNFα lokusu podílet na určení závažnosti průběhu RA. Není doposud zcela jasné, zda polymorfismy v promotorové oblasti genu pro TNFα mají vliv na produkci TNFα. Některé práce, které se zabývaly studiem produkce TNFα in vitro, prokázaly vliv polymorfismu – 308 G/A v genu pro TNFα na produkci TNFα, jiné ne (23 – 26). Jak již bylo naznačeno, míra produkce TNFα však nemusí být pouze důsledkem samotného polymorfismu v promotorové regulační oblasti genu pro TNFα, ale může být ovlivněna existencí vazebných nerovnováh s jinými geny, zejména s geny HLA II. třídy. Navíc se na regulaci produkce TNFα, kromě transkripčních mechanismů, zřejmě podílí i jiné faktory. K nim patří postranskripční kontrola stability mRNA, uvolňování solubilní formy TNFα z vazby na buněčnou mebránu buněk či exprese TNFR.
Některé studie rovněž naznačily asociaci polymorfismů v promotorové oblasti genu pro TNFα s odpovědí na terapii anti-TNFα preparáty (27). Otázka vlivu polymorfismu – 308 G/A v promotorové oblasti genu pro TNFα na míru klinické odpovědí na terapii anti-TNFα preparáty nebyla v mé práci studována. Touto problematikou se však hodlám zabývat v budoucnu.
Zajímavým výsledkem mé práce je průkaz možné asociace promotorového polymorfismu – 308 G/A v genu pro TNFα s plazmatickou hladinou LDL-cholesterolu. U pacientů s RA se dyslipidemie, jako jeden z významných rizikových faktorů kardiovaskulárních onemocnění, vyskytuje často. Onemocnění kardiovaskulárního systému jsou zodpovědná za 35–50 % úmrtí pacientů s RA, zatím co v běžné populaci jsou příčinou 20–25 % úmrtí (28). Toto zvýšené riziko může být spojeno s přítomností rizikových faktorů specifických pro RA jako je hyperhomocysteinemie, dyslipidemie asociovaná s onemocněním, zánět cévní stěny nebo zvýšená plazmatická hladina TNFα. Je známo, že se TNFα účastní procesu aterosklerózy. Některé práce prokázaly, že existuje jistá asociace mezi promotorovým polymorfismem – 308 G/A v genu pro TNFα a metabolickým syndromem a některými jeho charakteristickými znaky např. plazmatickou hladinou celkového a HDL a LDL - cholesterolu, inzulinovou rezistencí nebo nadváhou (29 – 34). Tato problematika se tedy jistě zaslouží pozornost a hodlám se jí zabývat v dalším pokračování této práce.
Situace ve studiu asociací možných kandidátních genů s RA není jednoduchá. Mnoho autorů připouští existenci jistých vazebných nerovnováh existujících mezi jednotlivými kandidátními geny. Výsledný fenotyp je pak pravděpodobně výsledkem určité mozaiky variant jednotlivých genů asociovaných s RA. Je proto žádoucí, aby při studiu genetického podkladu RA nebyly studovány pouze asociace jednotlivých kandidátních genů s chorobou, ale aby byly studovány možné asociace více kandidátních genů současně. To je i cílem mých dalších výzkumných aktivit, kterými hodlám navázat na doposud získané výsledky. Současně si uvědomuji, že bude nutné potvrdit získané výsledky i na rozsáhlejším souboru pacientů s RA.
Poděkování
Děkuji svým spolupracovníkům RNDr. Monice Pávkové-Goldbergové, Ph.D., Daně Poláškové, Prof. MUDr. Anně Vašků, CSc. a Doc. MUDr. Miroslavu Součkovi, CSc., bez jejichž významné pomoci by tato práce nemohla vzniknout.
Studie byla prováděna v rámci výzkumného záměru NR7812-3/2004, IGA Ministerstva zdravotnictví České republiky.
MUDr. Petr Němec, Ph.D.
Revmatologická ambulance II. interní kliniky
FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
Zdroje
1. Lawrence RC, Helmick GG, Arnett FC, et al. Estimates of the prevalence of arthritis and selected musculosceletal disorders in the United States. Arthritis Rheum 1998;41 : 778–99.
2. MacGregor AJ, Snieder H, Rigby AS, et al. Characterizing the quantitative genetic contribution to rheumatoid arthritis using data from twins. Arthritis Rheum 2000; Jan; 43 : 30–7.
3. Winchester R. The molecular basis of susceptibility to rheumatoid arthritis. Adv Immunol 1994; 56 : 389–466.
4. Stastny P. Association of B cell alloantigen DRw4 with rheumatoid arthritis. N Engl J Med 1978; 298 : 869–71.
5. Klareskog L, Stolt P, Lundberg K, et al. A new model for an etiology of rheumatoid arthritis. Smoking may trigger HLA-DR (shared epitope)-restricted immune reactions to autoantigens modified by citrullination. Arthritis Rheum 2006; 54 : 38–46.
6. Verpoort KN, van Gaalen FA, van der Helm-van Mil AHM, et al. Association of HLA-DR3 with anti-cyclic citrullinated peptide antibody-negative rheumatoid arthritis. Arthritis Rheum 2005; 10 : 3058–62.
7. Zanelli E, Breedveld FC, de Vries RRP. HLA Class II association with rheumatoid arthritis. Facts and interpretations. Hum Immunol 2000; 61 : 1254–61.
8. Yamada R, Tanaka T, Ohnishi Y, et al. Identification of 142 single nucleotide polymorphisms in 41 candidate genes for rheumatoid arthritis in the Japanese population. Hum Genet 2000; 106 : 293–7.
9. Lin CH, Cho CL, Tsai WC, et al. Inhibitors of kB-like gene polymorphisms in rheumatoid arthritis.Immunol Lett 2006; 105 : 193–7.
10. Iwamoto T, Ikari K, Nakamura T, et al. Association between PADI4 and rheumatoid arthritis: a meta-analysis. Rheumatology (Oxford) 2006; 45 : 804–7.
11. Ruuls SR, Sedgwick JD. Unliking Tumor necrosis factor biology from the major histocompatibility complex: lessons from human genetics and animal models. Am J Hum Genet 1999; 65 : 294–30.
12. Vassalli P. The pathophysiology of tumor necrosis factors. Annu Rev Immunol 1992; 10 : 411–52.
13. Ota M, Katsuyama Y, Kimura A, et al. A second susceptibility gene for developing rheumatoid arthritis in the human MHC is localized within a 70-kb interval telomeric of the TNF genes in the HLA class III region. Genomics 2001; 71 : 263–70.
14. Hajeer AH, Hutchinson IV. Influence of TNFalpha gene polymorphisms on TNFalpha production and disease. Human Immunol 2001; 62 : 1191–9.
15. Cvetkovic JT, Wallberg-Jonsson S, Stegmayr B, et al. Susceptibility for and clinical manifestations of rheumatoid arthritis are associated with polymorphisms of the TNF-alpha, IL-1, and IL-1Ra genes. J Rheumatol 2002; 29 : 212–9.
16. Wilson AG, de Vries N, van de Putte LB, Duff GW. A tumor necrosis factor alpha polymorphism is not associated with rheumatoid arthritis. Ann Rheum Dis 1995; 54 : 601–3.
17. Brinkman BM, Huizinga TW, Kurban SS, et al. Tumor necrosis factor alpha gene polymorphisms in rheumatoid arthritis: association with susceptibility, or severity of disease? Br J Rheumatol 1997; 36 : 516–21.
18. Barton A, Platt H, Salway F, et al. Polymorphism in the tumor necrosis factor gene are not associated with severity of inflammatory polyarthritis. Ann Rheum Dis 2004; 63 : 280–4.
19. Danis VA, Millington M, Hyland V, et al. Increased frequency of the uncommon allele of a tumor necrosis factor alpha polymorphism in rheumatoid arthritis and systemic lupus erythematosus. Dis Markers 1995;12 : 127–33.
20. Rodriguez-Carreon AA, Zuniga J, Hernandez-Pachelo G, et al. Tumor necrosis factor-alpha promoter polymorphism contributes independently to HLA alleles in severity of rheumatoid arthritis in Maxicans. J Autoimmun 2005; 24 : 63–8.
21. Pawlik A, Florczak M, Ostanek L, et al. TNF–α – 308 promoter polymorphism in patients with rheumatoid arthritis. Scand J Rheumatol 2005; 34 : 22–6.
22. Vinasco J, Beraun Y, Nieto A, et al. Polymorphism at the TNF loci in rheumatoid arthritis. Tissue Antigens 1997; 49 : 74–8.
23. Bouma G, Xia B, Crusius JB, et al. Distribution of four polymorphisms in the tumor necrosis factor (TNF) genes in patients with inflammatory bowel disease (IBD). Clin Exp Immunol 1996; 103 : 391–6.
24. Louis E, Franchimont D, Piron A, et al. Tumor necrosis factor (TNF) gene polymorphism influences TNF-alpha production in lipopolysacharide (LPS)-stimulated whole blood cell culture in healthy humans. Clin Exp Immunol 1998; 113 : 401–6.
25. Mycko MP, Kowalski W, Kwinkowski M, et al. Multiple sclerosis: the frequency of allelic forms of tumor necrosis factor and lymfotoxin-alpha. J Neuroimmunol 1998; 84 : 198–206.
26. Cuenca J, Cuchacovich M, Perez C, et al. The – 308 polymorphism in the tumor necrosis factor (TNF) gene promoter region and ex vivo lipopolysacharide-induced TNF expression and cytotoxic activity in Chilean patients with rheumatoid arthritis. Rheumatology 2003; 42 : 308–13.
27. Mugnier B, Balandraud N, Darque A, et al. Polymorphism at position –308 of the tumor necrosis factor alpha gene influences outcome of infliximab therapy in rheumatoid arthritis. Arthritis Rheum 2003; 48 : 1849–52.
28. Sarzi-Puttini P, Atzeni F, Shoenfeld Y, et al. TNF-alpha, rheumatoid arthritis, and heart failure: a rheumatological dilemma. Autoimmun Rev 2005; 4 : 153–61.
29. Sookoian S, Garcia SI, Gianotti TF, et al. The G-308A promoter variant of the tumor necrosis factor-alpha gene is associated with hypertension in adolescents harboring the metabolic syndrome. Am J Hypertens 2005; 18 : 1271–5.
30. Sookoian SC, Gonzalez C, Pirola CJ. Meta-analysis on the G-308A tumor necrosis factor alpha gene variant and phenotypes associated with the metabolic syndrome. Obes Res 2005; 13 : 2122–31.
31. Um JY, Park JH, Kim HM. Gene polymorphisms in tumor necrosis factor locus and waist-hip ratio in obese Koreans. Clin Chim Acta 2003; 338 : 117–22.
32. Dalziel B, Gosby AK, Richman RM, et al. Association of the TNF-alpha -308 G/A promoter polymorphism with insulin resistance in obesity. Obes Res 2002; 10 : 401–7.
33. Ischii T, Hirose H, Saito I, et al. Tumor necrosis factor alpha gene G-308A polymorphism, insulin resistance, and fasting plasma glucose in young, older, and diabetic Japanese men. Metabolism 2000; 49 : 1616–8.
34. Lee SC, Pu YB, Tomas GN, et al. Tumor necrosis factor alpha gene G-308A polymorphism in the metabolic syndrome. Metabolism 2000; 49 : 1021–4.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2007 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Význam vybraných biomakerů v hodnocení a patogenezi osteoartrózy a revmatoidní artritidy. Souhrn doktorské dizertační práce
- Imunogenetické aspekty v etiopatogenezi revmatoidní artritidy: Role promotorového polymorfismu - 308 G/A genu pro tumor nekrotizující faktor α. Souhrn doktorské dizertační práce
- Imunochemické možnosti sledování degradace kolagenu typu II
- Mechanismy svalového zánětu a jejich klinické projevy u nemocných polymyozitidou a dermatomyozitidou. Souhrn doktorské dizertační práce
- Abstrakta přednášek z Třeboňských revmatologických dní, 3.–5. ledna 2007
- Abstrakta přednášek z Třeboňských revmatologických dní, 3.–5. ledna 2007 - pokračování
- Abstrakta přednášek z Třeboňských revmatologických dní, 3.–5. ledna 2007 - pokračování
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mechanismy svalového zánětu a jejich klinické projevy u nemocných polymyozitidou a dermatomyozitidou. Souhrn doktorské dizertační práce
- Imunochemické možnosti sledování degradace kolagenu typu II
- Význam vybraných biomakerů v hodnocení a patogenezi osteoartrózy a revmatoidní artritidy. Souhrn doktorské dizertační práce
- Imunogenetické aspekty v etiopatogenezi revmatoidní artritidy: Role promotorového polymorfismu - 308 G/A genu pro tumor nekrotizující faktor α. Souhrn doktorské dizertační práce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



