-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
Recommendations of Czech Rheumatological Society for the treatment of rheumatoid arthritis. Efficacy and treatment strategies
Rheumatoid arthritis (RA) is an autoimmune disease of unknown aetiology characterized by presence of chronic symmetric synovitis, which leads to the formation of joint erosions. Generally recommended method for activity assessment of RA is so called Disease Activity Score (DAS). In early RA when low disease activity is present with oligo - or monoarthritis antimalarials are drugs of choice, while sulfasalazine (SAS) is recommended in cases with medium activity without erosions. Initial treatment with methotrexate (MTX) or leflunomide (LEF) should be applied in a very active polyarthritis with a rapid development of erosions. MTX is often combined with other disease modifying drugs (DMARD) and the blockers of tumour necrosis factor alpha (TNF-alpha). LEF is to be administered to the patients in whom the other DMARD are contraindicated or not tolerated. In established RA with oligo - or monoarthritis with permanent low activity SAS is DMARD of choice. In cases with insufficient response and medium activity MTX is used and if it is inefficient LEF or combination of DMARD should be considered. In a very active disease with a rapid evolution of erosions high doses of MTX or LEF are recommended. When extraarticular symptoms of RA are present azathioprine is to be applied and in case of involvement of vital organs cyclophosphamide should be used. When DMARD are failing or contraindicated TNF-alpha blockers are to be applied. When one TNF-alpha blocker is inefficient it should by replaced by another one from the same group or another biological should be used. For indication of biologicals the activity limit is DAS28 5.1 and the decrease of DAS28 more than 1.2 is an efficacy criterion. Nonsteroidal antirheumatic drugs are an important part in the management of RA, and also corticosteroids are often of used in oral or parenteral form. To the complex therapy of RA nonpharmacological means are usually implemented – different physical procedures and various surgeries.
Key words:
rheumatoid arthritis, activity, disease modifying drugs, biological therapy
Autoři: R. Bečvář; J. Vencovský; P. Němec 1; D. Suchý 2; L. Procházková 1; K. Pavelka
Působiště autorů: Revmatologický ústav, Praha ; Interní klinika, Fakultní nemocnice U svaté Anny, Brno 1; Oddělení klinické farmakologie, Fakultní nemocnice, Plzeň 2
Vyšlo v časopise: Čes. Revmatol., 15, 2007, No. 2, p. 73-90.
Kategorie: Doporučení k léčbě
Souhrn
Revmatoidní artritida (RA) je autoimunitní onemocnění neznámé etiologie charakterizované přítomností chronické, symetrické synovitidy, která vede ke vzniku kloubních erozí. Doporučenou metodikou pro hodnocení aktivity RA je výpočet tzv. Disease Activity Score (DAS). U časné RA se při nižší aktivitě onemocnění s oligo - či monoartritidou podávají antimalarika, kdežto nasazení sulfasalazinu (SAS) je vhodné u středně aktivní RA bez erozí. Iniciální léčba metotrexátem (MTX) nebo leflunomidem (LEF) je doporučována u vysoce aktivní polyartritidy a s rychlým rozvojem erozí. MTX se často kombinuje s jinými chorobu modifikujícími léky (DMARD) a s léky blokujícími faktor nekrózy tumorů alfa (TNF alfa). LEF je vyhrazen pacientům s kontraindikací nebo intolerancí jiných DMARD. Při rozvinuté (etablované) RA se doporučuje SAS při trvale nízké aktivitě s oligo - či monoartritidou. Při nedostatečné odpovědi a střední aktivitě RA se podává MTX a při jeho neúčinnosti LEF, případně kombinace DMARD. Při vysoké aktivitě a rychlém rozvoji erozí se doporučují vyšší dávky MTX nebo LEF. Při extraartikulárních projevech RA je vhodné podání azathioprinu a při postižení vitálně důležitých orgánů cyklofosfamid. Při selhání nebo jasné kontraindikaci DMARD je na místě podávání preparátů blokujících TNF alfa. Při selhání léku blokujícího TNFalfa je vhodná změna za jiný lék z této skupiny nebo záměny za jiný biologický lék. Pro biologickou léčbu je stanovena hranice pro indikaci léčby DAS28 5,1 a za úspěch léčby se považuje pokles DAS28>1,2. Součástí farmakologické léčby je prakticky vždy podávání nesteroidních antirevmatik a často glukokortikoidů v perorální nebo parenterální formě. Ke komplexní terapii RA patří také nefarmakologická léčba – fyzikální procedury a různé revmatochirurgické zákroky.
Klíčová slova:
revmatoidní artritida, aktivita, chorobu modifikující léky, biologická léčba, kortikosteroidy, nesteroidní antirevmatikaÚvod
Revmatoidní artritida (RA) je autoimunitní onemocnění neznámé etiologie, které postihuje 0,5–1 % populace (1). RA je ve většině případů charakterizována přítomností chronické, symetrické synovitidy, která vyvolává vznik kloubních erozí. Část pacientů má i mimokloubní příznaky. Jde o heterogenní onemocnění, ale většina pacientů má onemocnění s kolísající aktivitou a různě rychlou progresí kloubních erozí, kloubních destrukcí, vzniku deformit a poklesu funkčních schopností (disability). RA navíc zkracuje život o 7–10 let (2). RA představuje pro společnost významný medicínský, ale i sociálně-ekonomický problém.
Terapie RA se v posledních 10 letech podstatně změnila. I proto se rozhodl výbor České revmatologické společnosti (ČRS) k přípravě nových Doporučení, protože původní dokument z roku 1999 je dnes již zastaralý (3). Od té doby byl udělán podstatný pokrok jak v zavádění některých zcela nových preparátů do algoritmu léčby RA, tak byly navrženy některé nové postupy a strategie.
Cíle léčby
Vyléčení RA není v současné době dostupné. Nicméně primárním cílem léčby RA musí být dnes navození remise (4). Přes různé definice remise je asi optimální užít buď kritéria remise dle Amerického sdružení revmatologů (ACR) (5), nebo jako DAS28 nižší než 2,6 (6). Pokud není remise možná, je nutné docílení alespoň stavu velmi nízké aktivity, „který může být definován jako DAS28 < 3,2“. Dalším cílem léčby je zastavení nebo zpomalení rentgenové progrese onemocnění. Toto se provádí zpravidla jedenkrát za rok a doporučovanou metodou v současnosti je modifikované, celkové Sharpovo skóre (7). Pacienti v remisi nebo ve stavu mírné aktivity mají zpravidla podstatně zpomalenou nebo zastavenou rentgenovou progresi, ale u individuálních pacientů nemusí klinická aktivita a rentgenová progrese korelovat (8), a proto se doporučuje provádět rentgenové kontroly i u pacientů v remisi. Zpomalení rentgenové progrese je důležité především proto, protože byla prokázána korelace mezi postupující rentgenovou progresí a funkčním poklesem pacienta. Protože pro pacienta nejdůležitějším cílem léčby je jednoznačně zábrana vzniku deformit, vzniku disability, invalidity a zhoršení kvality života.
Hlavními pilíři léčby RA jsou:
- přesné a časné stanovení diagnózy,
- vyhodnocení prognostických faktorů negativního vývoje,
- vyhodnocení aktivity onemocnění a stávajícího stupně strukturálního postižení,
- vzdělávání pacienta o jeho chorobě,
- pravidelné monitorování aktivity choroby a účinnosti léčby a ev. flexibilní změny terapeutické strategie,
- hodnocení funkčního stavu a rentgenové progrese jako důležitých momentů hodnocení účinnosti léčby.
Diagnóza revmatoidní artritidy
V klinické praxi se stále používají pro stanovené diagnózy RA kritéria Americké revmatologické společnosti (9) (tab. 1). Nicméně pro diagnózu časné RA nejsou tato kritéria příliš vhodná. Čekání na splnění kritérií RA může být příčinou oddáleného nasazení chorobu modifikujících léků (DMARD), přičemž časné nasazení DMARD bylo ve studiích prokazatelně účinnější (10).
Tab. 1. Klasifikační kritéria ACR pro diagnózu RA (podle Arnetta, et al., 1987 (9). 
Podstatná část pacientů s RA ve velmi časné fázi vývoje nesplňuje kritéria RA, ale odpovídá klasifikaci časné artritidy, či nediferencované artritidy. „Časná artritida“ se může vyvinout do RA, může spontánně odeznít, vyvinout se v jiné onemocnění – systémový lupus erythematodes (SLE) nebo spondylartritidu, nebo může zůstat nediferencovaná. Jako optimální postup v této fázi byl navržen následující algoritmus (4):
- a) stanovení diagnózy zánětlivé artritidy,
- b) vyloučení jiných jednotek,
- c) stanovení rizikových faktorů vývoje do perzistující, chronické destruktivní artritidy – tedy RA.
Faktory, které jsou rizikové pro vývoj do RA byly určeny: IgM a IgA revmatoidní faktory (RF) (11), protilátek proti cyklickému citrulinovanému peptidu (antiCCP) (12, 13), zvýšené hodnoty reaktantů akutní fáze (14, 15), časná přítomnost erozí (16) a počet oteklých a palpačně citlivých kloubů. Zkušenosti se studií u časných artritid potvrzují, že je výhodné pacienty s časnou, nediferencovanou artritidou s přítomnými rizikovými faktory vývoje RA, léčit včasně, dle stejných pravidel, jako pacienty s již jistou diagnózou RA.
Hodnocení aktivity a odpovědi na léčbu
Hodnocení aktivity RA je základem úspěchu cílené a individualizované léčby každého pacienta – hodnocení aktivity RA však vyžaduje určitou zkušenost, především při vyšetřování kloubů. Doporučenou metodikou pro hodnocení aktivity RA je tzv. DAS skóre (6) (tab. 2). Interpretace DAS28 skóre je na obrázku 1.
Tab. 2. Formulář pro zjištění DAS 28. 
sw – oteklé klouby, t – citlivé klouby, FW – rychlost sedimentace erytrocytů v mm/h, GH – globální hodnocení pacientem Kalkulace DAS: automaticky na: http://www.das-score.nl/www.das-score.nl/DAS28calc.htm ve formátu Excel: http://www.das-score.nl/www.das-score.nl/DAS28-ne.xls Obr. 1. Hodnocení DAS (28) skóre. 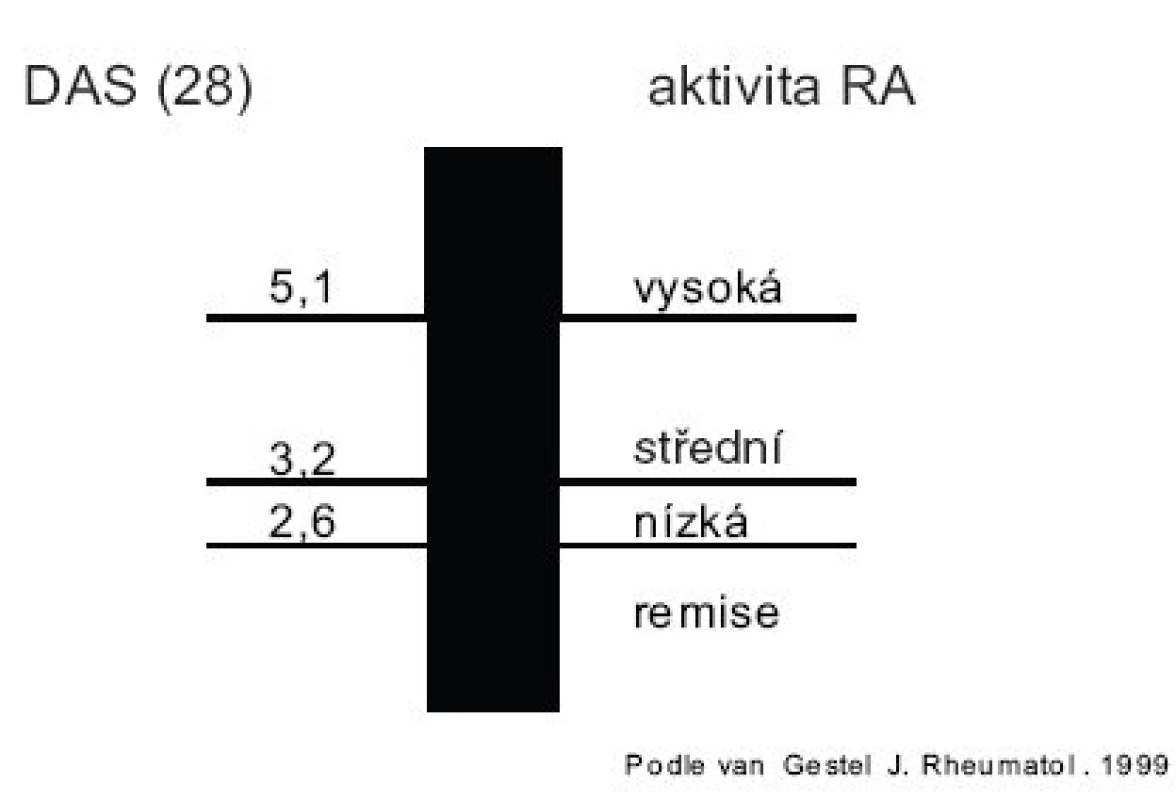
Pro biologickou léčbu je stanovena minimální hranice pro indikaci léčby 5,1. Jako úspěch léčby (response) se považuje pokles DAS28 > 1,2. Kromě poklesu DAS by však v našem klinickém rozhodování měla figurovat i absolutní hodnota DAS. Snaha ošetřujícího lékaře by měla být, aby pacient byl v remisi (DAS28 < 2,6) nebo alespoň ve stavu nízké aktivity (DAS28 < 3,2). V klinickém hodnocení TICORA se osvědčilo pravidelné hodnocení DAS44 ve 3měsíčních intervalech a adjustace terapie tak, aby byl DAS kontinuálně nízký. Tento postup byl účinnější, než při pouhém běžném hodnocení aktivity (17). Hodnocení aktivity se doporučuje provádět ve 3měsíčních intervalech.
K hodnocení odpovědi na léčbu se také používají kritéria ACR (18). Podle stupně redukce jednotlivých ukazatelů v procentech se označují jako ACR 20, ACR 50 a ACR 70. Často je zdůrazňováno, že kritéria ACR jsou nevhodná pro hodnocení individuálních pacientů.
Hodnocení rentgenové progrese je nedílnou součástí hodnocení RA. Zlatým standardem je dnes Sharpovo skóre modifikované van der Heij - de (19). Skóre hodnotí na vybraných kloubech skóre erozí a skóre zúžení kloubních štěrbin, dohromady pak jako celkové Sharpovo skóre. Doporučené intervaly jsou 6–12 měsíců. Rentgenová progrese je v principu lineární, i když některé zdroje uvádějí rychlejší progresi v prvních dvou letech onemocnění (4). Za klinicky významnou změnu se považuje změna TSS o 4 a více.
Jako doplnění hodnocení strukturální progrese a klinické aktivity se doporučuje monitorování funkčních schopností pacienta pomocí HAQ (20) a kvality života pomocí SF 36 nebo Euro-quol (21, 22).
Iniciální vyšetření
Iniciální vyšetření pacienta s RA by mělo obsahovat vyšetření aktivity (23). Jde o subjektivní symptomy pacienta (přítomnost kloubní bolesti, trvání ranní ztuhlosti, únavnost), funkční stav, objektivní známky aktivity (oteklé a palpačně citlivé klouby), mechanické kloubní problémy (omezení pohybu, deformity, instability), přítomnost mimokloubních příznaků, laboratorní ukazatele aktivity (CRP a FW) a stupeň rentgenové progrese.
Bazální laboratorní vyšetření by mělo obsahovat kompletní krevní obraz s diferenciálem, dále vyšetření bazálních biochemických parametrů včetně mineralogramu a glykémie, dále ledvinné a jaterní funkce i vzhledem k potenciálu léků vyvolávat v této oblasti nežádoucí účinky. U potenciálně hepatotoxických léků a imunosupresivních léků vylučujeme hepatitidu B a C. Důležité je i vyšetření moči. Při přítomnosti kloubního výpotku provádíme synovialogram.
Z imunologických testů provádíme vyšetření RF pomocí latex fixačního testu a vyšetření antiCCP. Při plánování biologické léčby provádíme skrínink na vyloučení latentní tuberkulózy (viz kapitola bezpečnost biologické léčby).
Při zavádění léčby kortikosteroidy v dávce 5 mg prednisonu nebo jeho ekvivalentu denně po předpokládanou dobu 3 měsíce a dále provádíme vyšetření DEXA a kostního metabolismu dle návodů ČRS a SMOS (24). Pacient s aktivní RA by měl být léčen a dispenzarizován u specialisty – revmatologa. Je-li pacient v remisi, lze připustit péči praktického lékaře, ale i v tomto případě periodické kontroly (6–12 měsíců) u specialisty.
Terapie RA chorobu modifikujícími léky (DMARD)
Charakteristika chorobu modifikujících léků
Všichni nemocní s aktivní RA jsou indikováni k léčbě DMARD. I když NSA a glukokortikoidy (GK) mohou zmírnit příznaky, může začít poškození kloubů a progredovat do nevratných změn. Cílem podávání DMARD je kontrola aktivity zánětlivého kloubního procesu a dosažení remise. Obecně je nutno zmínit, že léčba DMARD má svá omezení (25). Nemusí zabránit vzniku destrukcí i přes zmírnění klinických projevů, nemusí mít dlouhotrvající účinek a v některých případech nemusí být dlouhodobě tolerována pro jejich toxicitu. K běžně užívaným DMARD patří antimalarika chlorochin a hydroxychlorochin (HCQ), sulfasalazin (SAS), metotrexát (MTX) a leflunomid (LEF). Méně často se podávají soli zlata, azathioprin (AZA), cyklosporin A (CyA) a cyklofosfamid (CFA). Použití d-penicilaminu je dnes spíše výjimkou. Jejich základní charakteristika a běžně užívané dávky jsou uvedeny v tabulce 3 (26).
Tab. 3. Základní charakteristika běžných DMARD. 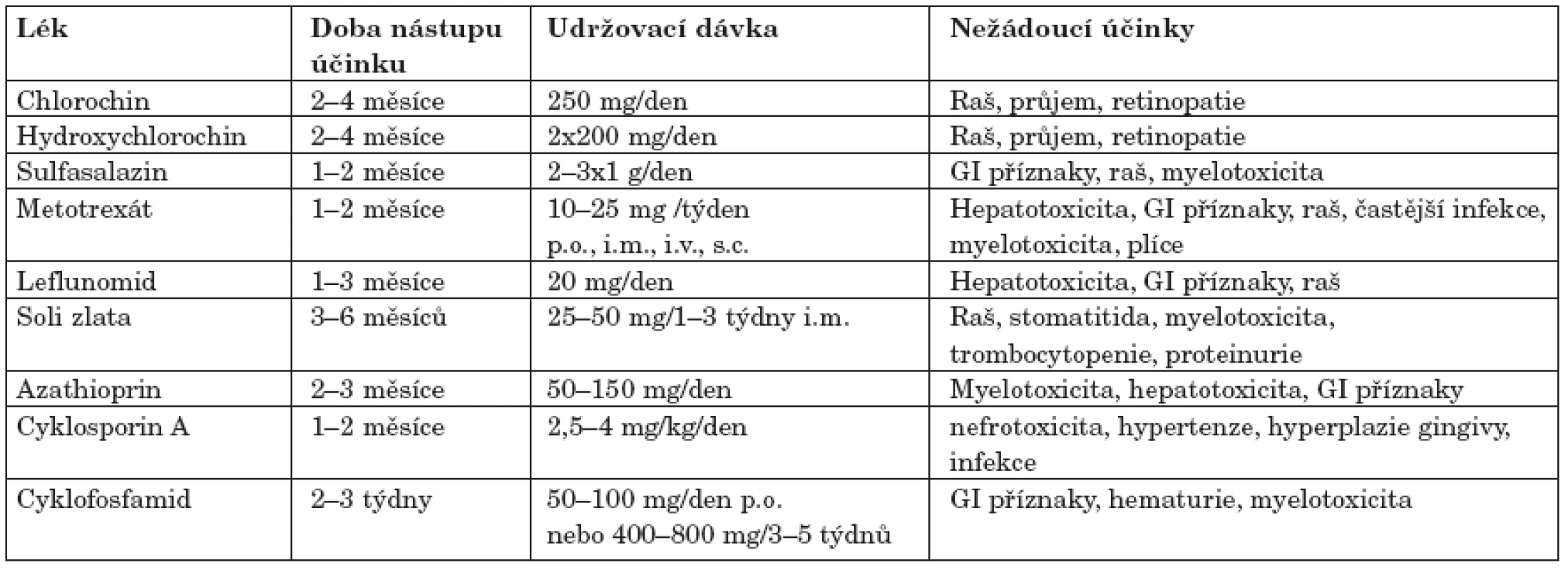
Antimalarika
Řada klinických hodnocení prokázala dobrý symptomatický efekt antimalarik u 60–80 % pacientů s RA. Efekt nastupuje opožděně, obvykle po 2–6 měsících. Antimalarika nezpomalují rentgenovou progresi choroby (23). Z výsledků metaanalýzy klinických hodnocení s DMARD u RA provedené Felsonem (27) vyplývá, že antimalarika jsou méně účinná než soli zlata, MTX, penicilamin a SAS, ale jsou však podstatně méně toxická. K nejčastějším nežádoucím účinkům antimalarik patří gastrointestinální příhody (nauzea, zvracení, bolesti břicha, průjem), kožní změny, neurologické příhody a myelotoxicita. K závažným nežádoucím účinkům antimalarik pak patří zejména okulotoxicita s rizikem vývoje ireverzibilní retinopatie.
Sulfasalazin
Účinnost SAS v terapii RA byla ověřena v mnoha kontrolovaných klinických hodnoceních. V jednom klinickém hodnocení byl SAS stejně účinný jako LEF ve smyslu snížení počtu oteklých a bolestivých kloubů a v odpovědi ACR 20 po 6 měsících léčby. Nastup účinku LEF byl poněkud rychlejší než u SAS. Efekt léčby přetrvával i po 24 měsících (28). V klinickém hodnocení COBRA byla srovnávána odpověď na agresivní kombinační léčbu (prednisolon 60 mg iniciálně s postupnou detrakcí během 6 měsíců a MTX a SAS) oproti monoterapii SAS u pacientů s časnou RA. I když byla klinická odpověď podstatně silnější v kombinované větvi, po 12 měsících léčby se obě skupiny nelišily. Kombinační léčba však měla výraznější vliv na zpomalení rentgenové progrese (29). Metaanalýza 66 klinických hodnocení ukázala, že SAS je stejně účinný jako MTX, injekční zlato a d-penicilamin a účinnější než AZA a antimalarika (27). SAS je lékem, který potenciálně zpomaluje rentgenovou progresi choroby (28, 30). Je ceněn zejména pro rychlý nástup účinku, který se dostavuje po 3–4 týdnech a dále pro nepřítomnost závažných pozdních nežádoucích účinků (např. vznik nádorů). Většina nežádoucích účinků se objevuje již během prvních tří měsíců léčby. K častým, ale nezávažným nežádoucím účinkům patří gastrointestinální příhody jako nauzea, zvracení, anorexie a bolesti břicha, dále neurologické příhody (cefalea a závratě) a kožní reakce. K závažným nežádoucím účinkům SAS řadíme myelotoxicitu, hepatotoxicitu, která se vyskytuje méně často než po MTX, a možnost indukce tvorby autoprotilátek a manifestace autoimunitního onemocnění.
Metotrexát
MTX je často nasazován jako DMARD první volby u časné RA. K jeho výhodám patří dobrý, na dávce závislý klinický efekt, přijatelný profil toxicity (po třech letech zůstává na terapii MTX více než 50 % pacientů), vhodnost použití do kombinace s jinými DMARD a biologickými léky a především schopnost definitivně zpomalovat rentgenovou progresi (31). Na druhé straně MTX není lékem, který navozuje trvalou remisi choroby, a proto je často kombinován s jinými DMARD. Velmi dobrá klinická účinnost MTX proti placebu byla dokumentována řadou klinických hodnocení i jejich metaanalýzou (32). Klinická účinnost MTX byla rovněž studována v řadě klinických hodnocení, kde komparátorem byl jiný DMARD. V klinických hodnoceních s injekčními solemi zlata byla prokázána srovnatelná klinická účinnost obou preparátů i podobný vliv na zpomalení rentgenové progrese (33). Obdobné výsledky byly rovněž zaznamenány ve klinických hodnoceních srovnávajících účinnost MTX a LEF (34). V klinickém hodnocení Emeryho byl MTX ve srovnání s LEF účinnější během prvního roku léčby, ale tyto rozdíly již nebyly patrné po dvou letech léčby (35). Tolerance léčby byla u obou léků srovnatelná. Některá klinická hodnocení u časných závažných forem RA u nemocných, kteří doposud nebyli léčení DMARD, potvrdila vynikající klinický účinek MTX a také určitý vliv na zpomalení rentgenové progrese. Klinický efekt MTX se v těchto studiích blížil efektu TNF alfa blokujících léků (36, 37).
Při terapii MTX je nutné počítat s možností jeho toxicity. Závažná je zejména hepatotoxicita a myelotoxicita, méně častá je plicní toxicita. Při perorálním podávání MTX se často vyskytují gastrointestinální nežádoucí příhody (nauzea, zvracení, anorexie, vzácně průjem). Nefrotoxicita MTX není příliš častá a více se vyskytuje při vysokých dávkách MTX. Přesto patří MTX spolu s antimalariky k nejlépe snášeným DMARD. Přes některé problémy (heterogenita hodnocení a malé počty pacientů ve skupinách s MTX a SAS) přinesla jisté srovnání toxicity DMARDs metaanalýza klinických hodnocení, která stanovila následující pořadí (od nejméně toxických): antimalarika, perorální preparát zlata, metotrexát, sulfasalazin, penicilamin, injekční zlato (27).
Leflunomid
LEF je novější DMARD schválený FDA v roce 1998. V prvních letech po zavedení do klinického užívání se doporučovalo zahájení terapie tzv. startovací dávkou 100 mg a pokračovat 20 mg denně, později se však výhodnost tohoto schématu nepotvrdila, tak se běžně podává od počátku pouze 20 mg v jedné denní dávce. Klinická účinnost a bezpečnost terapie LEF byla ověřena ve třech klinických hodnoceních III. fáze klinického výzkumu. Výsledky randomizovaných hodnocení prokázaly v prvním i v druhém roce léčby přinejmenším srovnatelnou klinickou účinnost LEF ve srovnání s MTX. LEF i MTX příznivě ovlivňovaly funkci a kvalitu života nemocných s RA, přičemž nástup účinku LEF byl rychlejší než u MTX. LEF i MTX zpomalovaly rentgenovou progresi po jednom i po dvou letech léčby LEF (34). Ve druhém hodnocení autoři srovnávali LEF se SAS a placebem a prokázali srovnatelnou klinickou účinnost LEF a SAS ve 24. týdnu léčby. LEF měl výraznější efekt na zlepšení funkčních schopností nemocných. Nástup účinku LEF byl také rychlejší než u SAS. Oba léky srovnatelným způsobem zpomalovaly rentgenovou progresi (38). Třetí klinické hodnocení srovnávalo klinickou účinnost LEF oproti MTX. Primární kritérium ACR 20 bylo dosaženo v prvním roce léčby u 50,5 % pacientů po LEF a 64,8 % po MTX, ale po dvou letech nebyl již rozdíl významný. V ovlivnění funkce a kvality života se oba přípravky nelišily (35). Byly rovněž publikovány výsledky pětiletého klinického hodnocení, které potvrzují přetrvávající efekt léčby LEF (39).
Výskyt nežádoucích účinků vyskytujících se při léčbě LEF je srovnatelný s počtem nežádoucích účinků po SAS a MTX (34, 35, 38). K nejčastějším nežádoucím účinkům patří hepatotoxicita, průjem, respirační infekce, cefalea, nauzea a dyspepsie, hypertenze a kožní projevy. Analýza rozsáhlé americké databáze AETNA ukázala nižší výskyt elevace jaterních enzymů po LEF než po MTX (40).
Cyklosporin A
CyA má výrazně imunosupresivní účinek, který spočívá v blokádě proliferace T-lymfocytů, produkci interleukinu-2 a dalších prozánětlivých cytokinů. CyAje účinný v monoterapii, ale má krátkodobý efekt. Proto se často aplikuje v kombinaci s MTX. Dlouhodobá klinická hodnocení ukázala, že CyA je schopen do určité míry zpomalovat rentgenovou progresi (41). Jeho užití je však výrazně omezeno nežádoucími účinky – vznikem hypertenze a poklesem renálních funkcí (42). Určení minimální účinné dávky je u CyA ze všech DMARDs nejobtížnější. U většiny nemocných je 20% pokles renálních funkcí obvykle reverzibilní.
Tab. 4. Významná klinická hodnocení s kombinací DMARD v léčbě RA (upraveno podle Pavelky (47). 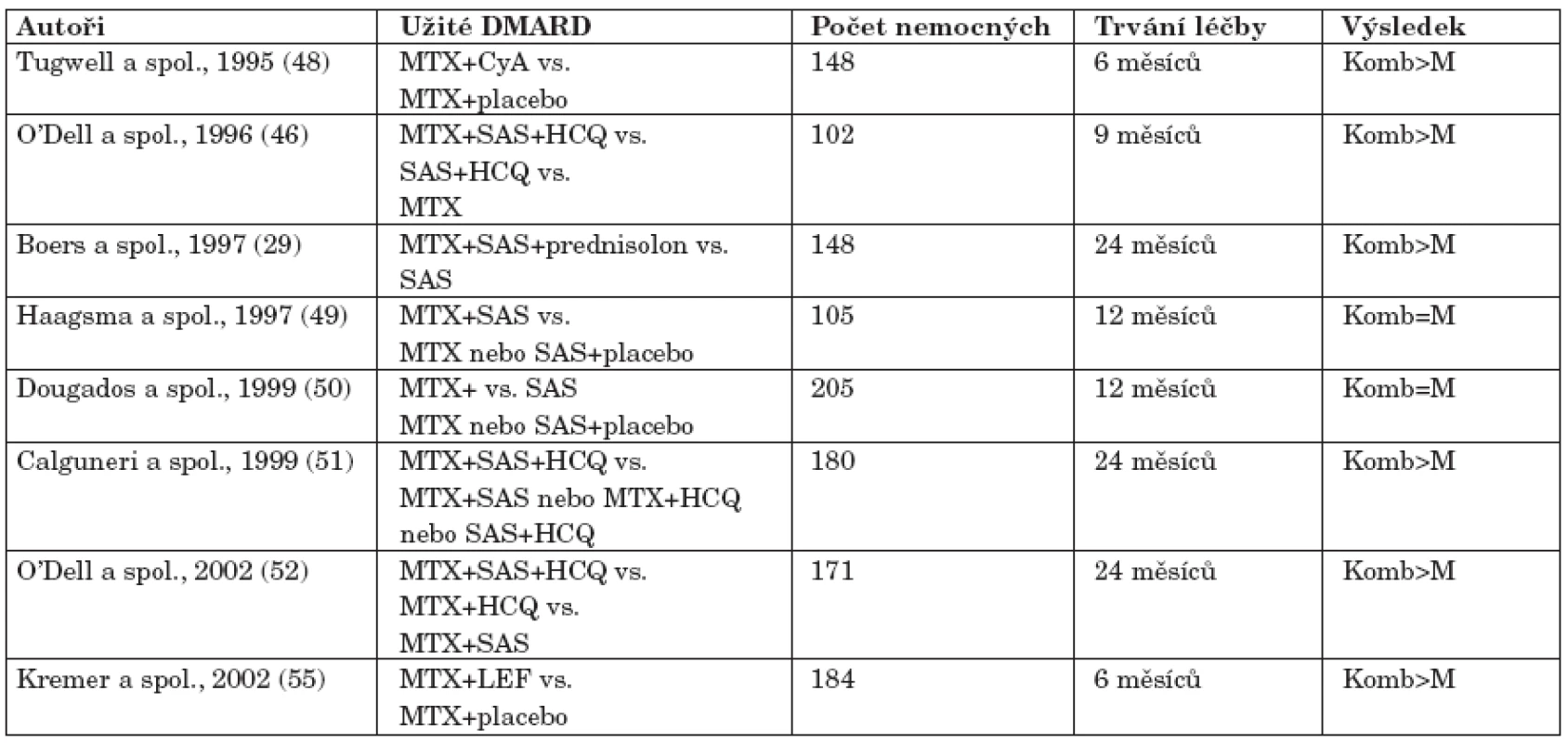
Komb-kombinace DMARD, M-monoterapie DMARD Méně často užívaná DMARD
Cyklofosfamid
Cyklofosfamid je silná alkylační látka. Je účinný v léčbě RA, ale v praxi se užívá velmi zřídka. Důvodem je především dlouhodobá toxicita a riziko indukce maligních nádorů. Při léčbě RA ho lze užít ve formě intravenózních pulzů při viscerálních manifestacích, jako je vaskulitida, nefritida nebo intersticiální plicní proces.
Soli zlata
Pro léčbu RA se užívají soli zlata vždy ve formě sloučenin síry – autothiomalát sodný pro parenterální aplikaci a triethylfosfin pro perorální aplikaci. Injekční forma se podává v týdenních intervalech a perorální v denních. Působení preparátů zlata nebylo nikdy detailně objasněno, nesporně stabilizují lyzosomální membrány, potlačují aktivitu makrofágů a blokují tvorbu imunitních komplexů a složek komplementu. Zlato v parenterální formě je účinné, ale injekce se musí aplikovat jednou týdně obvykle až půl roku (43) a pak je možné snížit frekvenci aplikací. V perorální formě mají soli zlata také pomalý nástup účinku (6 měsíců) a efekt bývá menší než u injekční formy (44). Nedoporučuje se podávat v kombinacích s jinými DMARD.
Azathioprin
Azathioprin je analog purinů s myelosupresivními účinky. Je účinný v léčbě RA, kdy potlačuje zánětlivou aktivitu, ale nebyl prokázán jeho vliv na radiologickou progresi nemoci. O jeho podávání lze uvažovat u refrakterních forem RA s mimokloubními projevy. Užívá se jen zřídka (45), protože nemá výhodný poměr účinnost riziko. Má vyšší toxicitu než jiná DMARD a vzhledem k častějším nežádoucím účinkům není vhodný do kombinací s jinými DMARD.
Kombinovaná léčba DMARD
V případě neúspěchu monoterapie může být v terapii RA použita kombinovaná léčba DMARD. Řada randomizovaných klinických hodnocení prokázala vyšší efektivitu kombinované terapie DMARDs ve srovnání s monoterapií při srovnatelném a v některých případech i lepším bezpečnostním profilu (tab. 4). Nejvhodnějšími DMARD pro kombinovanou léčbu jsou MTX, SAS, HCQ, částečně CyA a pravděpodobně LEF. Naopak pro kombinovanou léčbu se nedoporučují AZA, CFA a soli zlata.
Základním lékem do většiny kombinací je MTX. Jednoznačně nejvíce důkazů o účinnosti existuje pro kombinaci MTX a SAS a HCQ (26, 46). V klasickém O’Dellově klinickém hodnocení byla trojkombinace MTX a SAS a HCQ účinnější než kombinace SAS a HCQ a MTX samotný bez nárůstu toxicity. Kombinace MTX a SAS a HCQ se rovněž ukázala být účinnější než dvojkombinace MTX a SAS a MTX a HCQ u etablované RA. Kombinace MTX a SAS přinášela rozporné výsledky (29, 51). Účinná je i kombinace MTX a CyA, i když klinická hodnocení přinášejí rozdílné výsledky týkající se klinické účinnosti léčby a rentgenové progrese choroby (48, 53, 54). Další možností je kombinace LEF a MTX. V Kremerově klinickém hodnocení byl LEF nebo placebo přidán ke stávající minimálně 6měsíční terapii MTX (55). Ve 24 týdnu bylo kombinovanou léčbou dosaženo vyšší procento odpovědi podle kritérií ACR než monoterapií MTX. Tyto výsledky potvrzují i retrospektivní data získaná z rozsáhlé databáze AETNA zahrnující 40 594 tisíc pacientů s RA léčených LEF (56). Výskyt nežádoucích příhod při monoterapii LEF a kombinované terapii LEF a MTX byl nižší nebo srovnatelný s výskytem nežádoucích příhod při monoterapii MTX nebo jinými DMARD.
Principy strategie kombinované léčby DMARD
- Paralelní léčba – Pacient je kontinuálně léčen více DMARD.
- Step-down – Léčba sestupnými kroky. Pacientovi je nasazena kombinace DMARD a po dosažení klinického efektu jsou postupně jednotlivá DMARD vysazována.
- Step-up – Léčba vzestupnými kroky. Pacientovi je v úvodu nasazena monoterapie DMARD a v případě nedostatečného efektu je přidán další DMARD do kombinace.
V roce 2005 byla publikována metaanalýza 36 randomizovaných klinických hodnocení, kde byla použita kombinovaná léčba RA (57). Zahrnovala 16 paralelních,13 step-up a 7 step-down klinických hodnocení, z toho u 27 s etablovanou RA. V 7 klinických hodnoceních byly GK přidány k monoterapii DMARD a v jednom klinickém hodnocení ke kombinované terapii DMARD. Na druhé straně vedla kombinovaná léčba DMARD k častějšímu ukončení léčby z důvodu toxicity než monoterapie, avšak kombinace MTX a SAS a MTX + HCQ a kombinace MTX s oběma jmenovanými léky byla méně toxická než monoterapie.
Strategie podávání DMARD
Volba vhodného DMARD by měla být u každého nemocného RA přísně individuální a ovlivňuje ji řada faktorů. Hlavními kritérii pro výběr DMARD jsou odhad účinnosti u pacienta a prognózy onemocnění a způsob podávání. V této souvislosti by revmatolog měl posoudit schopnost spolupráce nemocného, komorbidity, u žen také otázku reprodukce. Vždy je nutno zhodnotit riziko nežádoucích účinků, jejich možnou frekvenci a závažnost, tedy zvážit poměr účinnost k riziku vedlejších účinků a v neposlední řadě poměr účinnosti k nákladům terapie. Jak v časné fázi, tak u rozvinuté formy RA se často používají spolu DMARD GK, jak je podrobně uvedeno ve zvláštní kapitole dále.
Léčba časné RA
Léčba RA v časném stadiu vyžaduje poněkud jinou strategii než u plně rozvinuté nemoci. Doporučovaný algoritmus pro časnou RA je uveden na obrázku 2, kde aktivita choroby je hodnocena pomocí DAS. Iniciální léčba antimalariky je vhodná u pacientů s nižší aktivitou onemocnění s oligo - či monoartritidou, s nepřítomností negativních prognostických faktorů, kdežto nasazení SAS je doporučováno u pacientů se středně aktivní RA, zejména u pacientů bez přítomných kloubních erozí, kde není stanovená definitivní diagnóza RA. SAS podáváme často v případě diferenciálně diagnostických rozpaků proti spondylartritidám, naopak nepodáváme jej v případě diferenciálně diagnostické pochybnosti vůči SLE.
Obr. 2. Terapeutická sekvence u časné RA (modifikováno podle: Smolen JS, et al. 2003 (58). 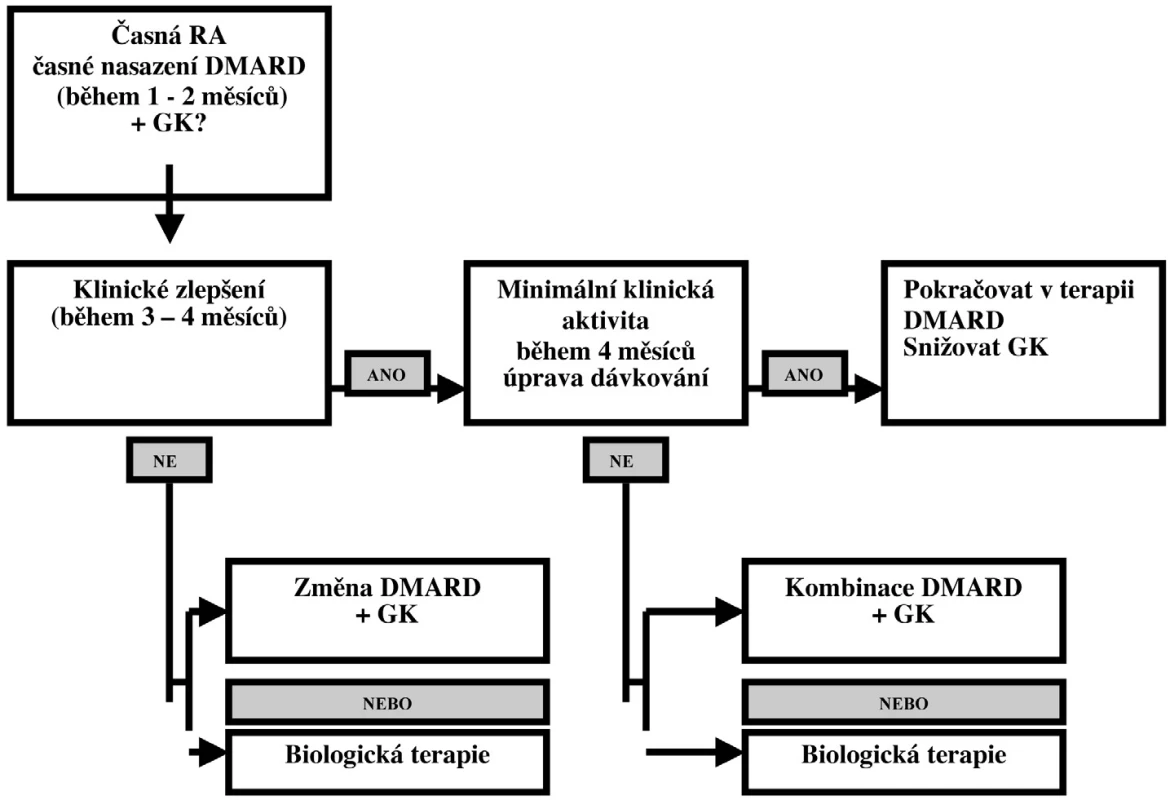
Iniciální léčba MTX je doporučována u pacientů s vysokou aktivitou onemocnění, s polyartritidou, s přítomností negativních prognostických faktorů a s rychlým rozvojem kloubních erozí, většinou u pacientů s definitivní diagnózou RA. U těchto nemocných je často využívána možnost kombinovat MTX s jinými DMARD a s TNF alfa blokujícími léky (viz kapitola Biologická léčba). Léčba LEF je doporučována u pacientů s vysokou aktivitou onemocnění, zejména v přítomnosti negativních prognostických faktorů a s rychlým rozvojem kloubních erozí. LEF je vyhrazen pacientům s kontraindikací nebo intolerancí jiných DMARD (MTX a SAS). Další vhodnou strate - gii ukázalo klinické ho - dnocení BeSt (59), ve kterém podávání kombinace DMARD s vysokou dávkou GK, která byla postupně snižována, nebo infliximabu vedla po roce k časnějšímu funkčnímu zlepšení a menšímu rentgenovému poškození než u skupin léčených postupným podáváním DMARD nebo strategií step-up.
Léčba etablované RA
Při etablované RA (diagnóza RA je jistá a jsou přítomny erozivní změny) doporučujeme vycházet z tohoto základního algoritmu, kdy aktivita nemoci je hodnocena pomocí DAS (obr. 3). Vycházíme z těchto principů:
Obr. 3. Farmakoterapeutická sekvence u etablované RA. 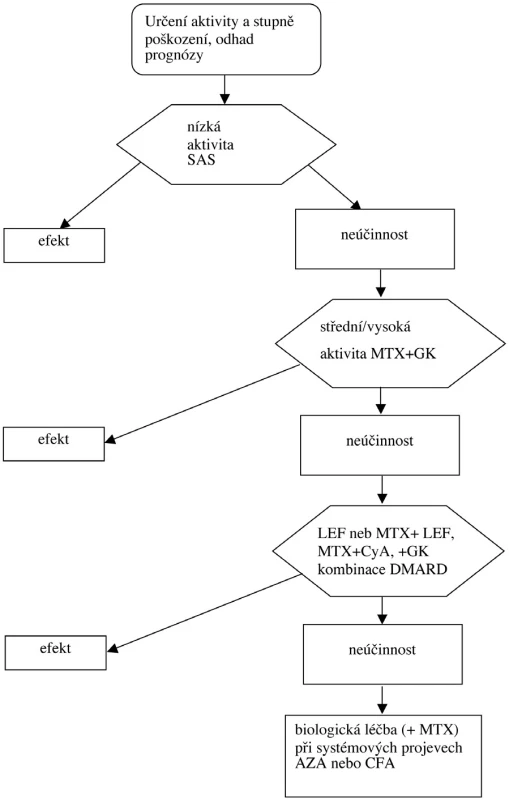
- Při přetrvávající nízké aktivitě s oligo - či monoartritidou a nepřítomnosti prognosticky negativních faktorů je lékem volby SAS (někdy pouze antimalarika). Při nedostatečné odpovědi se podává MTX (23).
- Při střední aktivitě je namístě již podávat MTX a při neúčinnosti LEF, případně kombinace DMARD – viz výše.
- U případů s vysokou aktivitou a rychlým rozvojem erozí se doporučuje MTX ve vyšších dávkách nebo parenterálně, případně LEF.
- Při extraartikulárních projevech je vhodné podání AZA a při závažných viscerálních manifestacích s postižením vitálně důležitých orgánů CFA v parenterální formě.
- Při selhání léčby DMARD je indikováno podávání preparátů blokujících TNF alfa (viz kapitola Biologická léčba).
- Při selhání léku blokujícího TNF alfa je vhodná změna za jiný lék z této skupiny nebo záměny za jiný biologický lék (viz kapitola Biologická léčba).
Biologická léčba RA
Cílem dnešního přístupu k pacientovi s RA by měla být snaha o co největší potlačení klinické a laboratorní aktivity nemoci spolu se zpomalením či zástavou rtg progrese. Měli bychom se tedy snažit přivést co nejvíce pacientů do remise, nebo do stavu, který se remisi blíží. Tradiční DMARD toto dokážou jen v menším počtu případů a jejich efekt je nedostatečný především v případech nemocných s trvalou vysokou aktivitou a prognosticky nepříznivými známkami, jako jsou přítomnost revmatoidních faktorů nebo protilátek proti citrulinovaným peptidům, či rychlý vývoj destruktivních změn na rtg.
Biologické léky znamenaly přelom v terapii RA. V řadě případů splňují požadavky, které na moderní léčbu RA klademe a umožňují zásadní změnu stavu pacienta. Jedná se však o léčbu nákladnou, která může být doprovázena vedlejšími nežádoucími účinky. Je proto zapotřebí pečlivě zvážit indikaci pro biologickou léčbu z hlediska možného prospěchu a rizika.
Nejvíce pokročilá je biologická léčba blokující TNF alfa. Využívá se monoklonálních protilátek (infliximab, adalimumab), či solubilního receptoru pro TNF alfa (etanercept) (tab. 5). Tyto léky ukázaly úspěšné ovlivnění průběhu RA či její juvenilní formu (JIA) (36, 37, 60–69). Vedou ke snížení aktivity nemoci a ke zpomalení či případně i zástavě rtg progrese (63, 68–71). Etanercept a adalimumab mohou být indikovány v léčbě RA samostatně, infliximab pouze v kombinaci s MTX. Klinická hodnocení provedená s těmito léky však jednoznačně ukazují, že kombinace kteréhokoliv TNF blokujícího léku s MTX je účinnější, než lék podaný samostatně (70, 72). To se týká především počtu nemocných dosahujících výborné klinické odpovědi a vlivu na radiologickou progresi. Anti-TNF léky byly použity také v kombinaci s dalšími bazálními léky, jako jsou SAS a LEF. Kratší zkušenosti jsou v současné době s dalšími biologickými léky rituximab a abatacept (tab. 5) (74–79). I u těchto léků byla popsána účinnost u nemocných nereagujících na bazální léky či na anti-TNF terapii. První klinické údaje hovoří také o zpomalení rtg progrese choroby při jejich aplikaci.
Tab. 5. Biologické prostředky určené k léčbě RA (případně juvenilní idopatické artritidy). 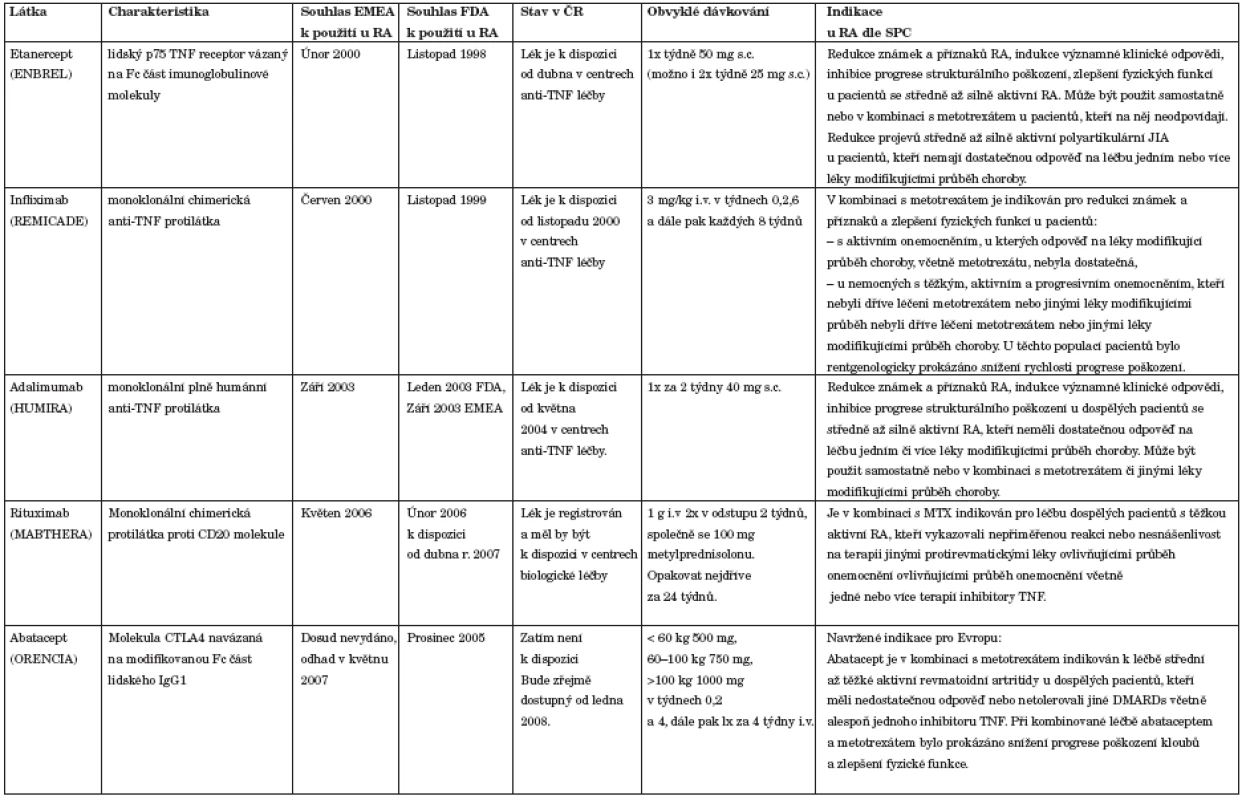
Standardní požadavky k podávání biologické léčby u RA
Mezinárodní doporučení týkající se biologických léků jsou každoročně publikována formou konsensuálního dokumentu (79). Doporučení ČRS pro podávání biologické léčby byla publikována v roce 2004 (80). Rychlý vývoj poznatků a objevení se nových preparátů si vynucuje vypracování nového textu.
RA je komplexní a heterogenní onemocnění, u kterého nelze postihnout úplně všechny situace, jež mohou nastat. Výjimečně proto mohou ovlivnit klinické rozhodování při výběru léčby i případné další okolnosti, které zde nejsou zmíněny. Tento text je především strategickým dokumentem postupu při indikacích a nemůže nahrazovat příbalové letáky a SPC platné pro tyto léky.
Použití léků blokujících TNF u RA
- Léky blokující TNF jsou indikovány u pacientů s RA, kteří nedostatečně odpovídají na léčbu MTX a v případě jeho intolerance či při kontraindikacích tak na terapii LEF nebo SAS. Tyto léky by měly být podávány v dostatečné dávce a po dostatečně dlouhou dobu (6 měsíců), pokud jsou tolerovány. Indikace se týká i polyartikulární JIA po 18. roce věku. U pacientů, u kterých jsou léky DMARD kontraindikovány, může být za výjimečných okolností uvažována terapie TNF blokující látkou jako první volba.
- Aktivita choroby musí být hodnocena jako vysoká (pomocí DAS28 skóre > 5,1) (81).
- Látky blokující TNF mohou být přidány k MTX, případně k jinému bazálnímu léku, či použity samostatně. Doporučená je kombinace s MTX ve všech případech, pokud je MTX tolerován. Infliximab by měl být podáván pouze současně s MTX.
- Pacienti s relapsem, u kterých byl v minulosti ukončen preparát, který vedl k remisi, by nejdříve měli být léčeni tímto lékem.
- Pokud je odpověď na léčbu jen částečná, je možné, že zvýšení dávky (infliximab) či zkrácení intervalu (infliximab, adalimumab) přinese další zlepšení (82).
- TNF blokující léčba vede ke zpomalení či zástavě rtg progrese. V klinických studiích se ukázalo, že je tomu tak i u některých pacientů, kteří nemají dostatečnou klinickou odpověď vyjádřenou kritériem zlepšení ACR20 nebo poklesem DAS28 (71). V běžné klinické praxi je zatím volen konzervativní přístup, při kterém by rtg změny samy o sobě neměly určovat klinické rozhodování o udržování léčby.
- Léčba preparáty blokujícími TNF by měla vést k významnému zlepšení. To by mělo být dokumentováno poklesem aktivity (pokles DAS28 alespoň o > 1,2) během 12 týdnů léčby a toto zlepšení by mělo být udržováno během následující terapie s kontrolami v intervalu 8 týdnů. Pokud pacient nesplní kritérium zlepšení ve dvou po sobě následujících návštěvách, léčba příslušným preparátem by měla být ukončena.
- V případě dosažení remise či dobré klinické odpovědi podle EULAR je doporučeno zvážit snížení nebo postupné vynechání dávky glukokortikoidů, pokud je pacient užívá. Lze také uvážit pokles v dávce bazálního léku či anti-TNF terapie, nicméně zde je potřeba přistupovat individuálně, protože pro tento postup ne-existují ověřená pravidla. Po vysazení anti-TNF terapie dochází většinou k relapsu onemocnění. Přetrvávání remise po vysazení anti-TNF lze očekávat jen u některých nemocných, kteří byli léčeni touto terapií velmi časně.
Použití rituximabu u RA
- Pokud má nemocný neadekvátní odpověď na léčbu pomocí blokády TNF (selhání léčby, nežádoucí účinky), je možná další biologická léčba rituximabem. Za výjimečných okolností může být zvážena terapie rituximabem před TNF blokádou, pokud jsou jasné kontraindikace anti-TNF léčby, a zejména tehdy, když má pacient v anamnéze B lymfocytární lymfom.
- Aktivita choroby by měla být hodnocena jako vysoká (pomocí DAS28 skóre > 5,1).
- Léčba je podávána v kombinaci s MTX.
- Efektivita léčby by měla být dokumentována poklesem DAS28 nejméně o 1,2 po 16 týdnech od první infuze. U takových pacientů, kde byla dokumentována účinnost a kteří opět vykáží zhoršení nemoci manifestované vzestupem DAS28 o 0,6 nad hodnotu dosaženou v 16. týdnu, může být zváženo opakování léčby. To je možné nejdříve po 24 týdnech od předchozí léčby rituximabem. Dávkovací schéma je stejné. Opakování připadá v úvahu i při reziduální vysoké aktivitě onemocnění (DAS28 > 5,1).
- K redukci frekvence a závažnosti infuzních reakcí se doporučuje podávat 100 mg i.v. metylprednisolonu 30 minut před infuzí rituximabu.
- Při podávání rituximabu musí být k dispozici základní resuscitační prostředky.
Výběr preparátu
Nebylo zatím prokázáno, že by některý z léků blokujících TNF byl účinnější než jiný preparát z této skupiny a neexistuje tedy důvod k doporučení látky, která by měla být používána prioritně. Byly však popsány individuální rozdíly mezi pacienty v reaktivitě na různé TNF inhibitory. V případě ztráty účinnosti může záměna jednoho preparátu za druhý vést k obnovení léčebného efektu (82, 83). Zachování účinnosti léčby lze očekávat i u vynucené záměny preparátů v důsledku vedlejší nežádoucí reakce. O účinnosti záměny za třetí anti-TNF preparát je málo údajů, nicméně zdá se, že zde je efekt podstatně menší (27). Rituximab je indikován u nemocných, kteří selhali anti - -TNF terapii. Rozhodnutí o tom, zda dalším biologickým preparátem bude záměna za jiný anti-TNF lék nebo za rituximab je individuální a závisí na několika okolnostech, mezi které patří např. charakteristika nemoci pacienta, komorbidita, preference nemocného, předcházející nežádoucí účinky a případně i ekonomické aspekty terapie.
Další sledování
Sledování krátkodobých i dlouhodobých účinků léčby a jejích případných toxických dopadů je jednoznačně doporučeno revmatologickými společnostmi v evropských zemích i v USA včetně ACR, EULAR, FDA i EMEA. Česká revmatologická společnost iniciovala vytvoření registru pacientů léčených TNF blokujícími léky (ATTRA = anti-TNF terapie revmatoidní artritidy). Registr je spravován Institutem biostatistiky a analýz Masarykovy univerzity v Brně, pod dohledem ČRS. Zařazení do registru a dlouhodobé sledování je povinnou administrativní součástí použití všech biologických léků.
Použití glukokortikoidů v léčbě časné RA
GK v léčbě časné RA (trvání onemocnění 1–3 roky) snižují účinně aktivitu choroby, počet oteklých a bolestivých kloubů, dávku NSA (84). Kromě klinického efektu se při časné terapii GK uplatňuje i chorobu modifikující efekt. Jak dokumentuje řada klinických hodnocení v rozsahu 28 týdnů až 2 let, vykazují GK v této fázi onemocnění chorobu modifikující efekt se signifikantním ovlivněním rtg progrese (84–88), ačkoliv existují i kontroverzní data (88, 89). Kromě ojedinělých případů nelze doporučit léčbu GK v monoterapii, předpokládá se vždy kombinace s jedním nebo více DMARD (29, 91, 92).
V léčbě dáváme přednost GK s kratším poločasem s ohledem na možný útlum osy hypothalamus – hypofýza (92). Dávka prednisonu se pohybuje mezi 5 a 15 mg nebo ekvivalentně metylprednisolonu v rozmezí 4–12 mg denně. Při vysoké aktivitě nemoci zahajujeme vyšší dávkou s postupnou detrakcí na minimální účinnou dávku (91). Předpokládaná délka podání se pohybuje okolo 6 měsíců, v literatuře jsou k dispozici dvouletá data (85, 86, 90, 91). Výskyt nežádoucích účinků je většinou přijatelný.
Při mimořádně vysoké počáteční aktivitě RA je vhodné zahájit vyšší dávkou prednisonu (do 60 mg) s postupnou detrakcí, jako ukázaly pozitivní výsledky výše uvedeného klinického hodnocení COBRA (29).
Glukokortikoidy u etablované RA
GK jsou indikovány k zvládnutí období zvýšené aktivity onemocnění, nebo v rámci tzv. bridging strategie před dosažením efektu terapie DMARD. Účinek léčby je krátkodobý, maximálně střednědobý, při čemž chorobu modifikující efekt je malý nebo žádný (93–95). GK podáváme v perorální nebo depotní formě, pulzní terapie je vyhrazena pro formy s vysokou aktivitou onemocnění (95–97). Dávkování GK řídíme podle aktivity onemocnění, kdy preferujeme podání nejnižší účinné dávky s cílem minimalizovat systémové nežádoucí účinky. Podání GK obden („alternativní“ podání) je limitováno častou exacerbací symptomů onemocnění ve dnech bez steroidní léčby.
Hlavní zásady léčby glukokortikoidy
Celodenní dávku GK je vhodné podávat v ranních hodinách. Při vyšší celodenní dávce je možné její menší část podat v poledne, ne však večer. Alternativní podávání dvojité dávky obden se doporučuje u nemocných s kontrolovanou aktivitou onemocnění. Podle poklesu aktivity RA jsou nutné úpravy dávkování. Při léčbě GK je také nutné monitorovat jejich vedlejší nežádoucí účinky. Je třeba se zejména zaměřit na nemocné s osteoporózou, chronickými infekcemi, tuberkulózou v anamnéze, hypertenzí a oběhovými onemocněními, peptickým vředem v anamnéze, gastritidou, ezofagitidou, diabetem mellitem a psychickým onemocněním. Z laboratorních vyšetření je třeba sledovat FW, krevní obraz s diferenciálním rozpočtem leukocytů, mineralogram, sérové hodnoty albuminu, vápníku, urey, kreatininu, ALT, AST, GMT a glykémie.
Pulzní léčba GK je indikována v případech, kdy je třeba potlačit vysokou aktivitu onemocnění na dobu do nástupu odpovědi na terapii DMARD nebo při zahájení léčby u nemocných s viscerálními manifestacemi RA (98). Podávají se infuze 1 g metylprednisolonu (resp. dávka 15 mg/kg) a opakuje obvykle třikrát denně nebo obden. Podáváme v 6hodinové infuzi v 300 ml 5% roztoku glukózy a před infuzí je vhodné podat antiulceróza (omeprazol 20 mg i.v.). V průběhu této léčby je zapotřebí dodržovat režim aktivní ošetřovatelské péče o pacienty (TK a P 3krát denně a po infuzi další 2 dny), provést EKG záznam vždy před a po ukončení pulzu, laboratorní vyšetření – mineralogram, amyláza před každým pulzem. Zvýšená opatrnost je nutná u hypertoniků (riziko akcelerace hypertenze), kardiaků (retence tekutin s možnou dekompenzací nebo arytmie), u diabetiků zvláště inzulin dependentních nebo dekompenzovaných a u aktivní infekce (99).
Intraartikulární podávání GK se užívá k ovlivnění nejvíce postižených kloubů buďto na začátku onemocnění, nebo při prudkých vzplanutí choroby v jednom nebo několika kloubech (flare). Další indikací je zánětlivý nález pouze na jednom nebo několika kloubech při jinak relativně nízké aktivitě onemocnění. Limitací je pouze lokální efekt a přechodné zlepšení, pokud není nemoc kontrolována další terapií. Doporučuje se opakovat po třech měsících. Kontraindikací této formy podání je infekce v místě vpichu, intraartikulární fraktura, septický kloub, bakteriémie, nestabilní klouby, špatně přístupné klouby a hemokoagulační poruchy. Při výběru léku volíme dlouhodobě se uvolňující preparát (depotní forma) s pomalým uvolňováním. Preferenčně aplikujeme přípravky s obsahem metylprednisolonu, méně často dexametazonu nebo betametazonu. Před aplikací je nutno odstranit výpotek, je-li přítomen.
Použití nesteroidních antirevmatik u revmatoidní artritidy
NSA jsou nedílnou součástí farmakoterapie RA. Jsou podávána od iniciálních fází nemoci a jejich účinkem je především zmírnění bolesti a otoku kloubů a tím zlepšení funkčnosti kloubního aparátu. Na rozdíl od DMARD však nejsou schopna ovlivnit zánětlivou aktivitu a průběh onemocnění ani rentgenovou progresi (100) a nelze je tedy užít jako monoterapii RA.
Hlavním mechanismem účinku NSA je inhibice syntézy prostaglandinů blokádou enzymu cyklo-oxygenázy. V roce 1991 byly popsány dvě izoformy cyklooxygenázy – COX-1 a COX-2, což vedlo v průběhu následujících let k vývoji nových selektivních inhibitorů COX-2. COX-1 je konstitutivní formou izoenzymu, exprimující se ve většině tkání, mimo jiné v žaludku, trombocytech, ledvinách. Je jedním z důležitých faktorů ochrany žaludeční sliznice, taktéž hraje důležitou roli v ovlivnění srážlivosti krevních destiček či homeostázy vody a sodíku v ledvinách. Právě blokáda COX-1 neselektivními NSA je považována za jeden z hlavních mechanismů gastrotoxicity těchto léků (101). Novější tzv. preferenčně selektivní COX-2 inhibitory a specifické COX-2 inhibitory (koxiby) blokují větší měrou cyklooxygenázu 2, což je inducibilní forma enzymu, jejíž exprese se zvyšuje zejména během zánětu.
Nebylo prokázáno, že by některá NSA byla účinnější v terapii RA, v případě neúčinnosti konkrétního preparátu lze po 4 týdnech terapie provést změnu NSA V rozhodování o volbě konkrétního preparátu hrají roli i plazmatické poločasy různých NSA (tab. 6) a tím i častost dávkování a dostupné galenické formy. Nejčastěji užívanou formou podání jsou perorální preparáty, méně častěji používanou alternativou – i vzhledem k relativní obtížnosti aplikace u pacientů s postižením ručních kloubů – jsou čípkové formy. V případech nutnosti rychlejšího účinku je možná aplikace intramuskulární či intravenózní. Četná NSA jsou používána v lokálních formách.
Tab. 6. Farmakokinetika vybraných NSA(16). 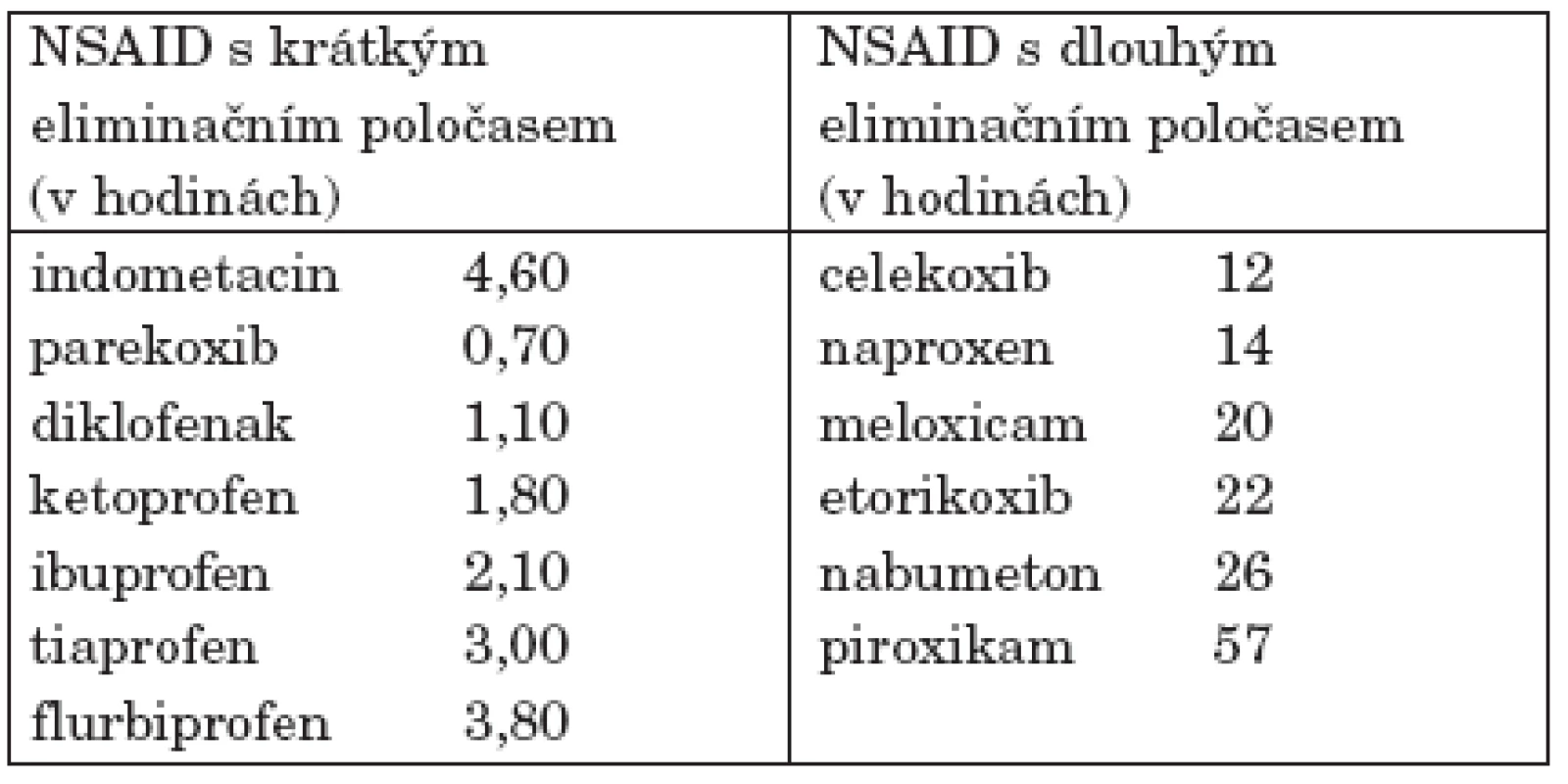
K hlavním nežádoucím účinkům NSA patří gastrointestinální toxicita, renální toxicita a kardiovaskulární toxicita. Většina těchto účinků se objevuje po delším podávání NSA a jsou podrobně popsány v druhé části Doporučení věnované bezpečnosti a monitorování terapie RA. Přes veškerá omezení plynoucí z recentních výsledků klinických hodnocení zůstávají NSA nedílnou součástí farmakoterapie RA. Nutností je dodržení zásad bezpečného podávání a použití on demand nikoliv plošně.
Analgetika
Bolest způsobená zánětem u pacientů s RA je ve většině případů uspokojivě tlumena prostřednictvím NSA. V některých případech, kdy jsou NSA kontraindikována nebo je jejich efekt nedostačující, lze použít k ovlivnění bolesti analgetika. Zejména je to paracetamol, který lze v případě nutnosti i kombinovat s NSA. Vzhledem k nulovému protizánětlivému účinku nejsou opioidy v terapii RA rutinně užívány, určitou situací, kdy může být jejich použití přínosné, je ovlivnění bolesti způsobené těžkými kloubními destrukcemi u pacientů, kde není možná chirurgická či ortopedická intervence.
Nefarmakologická léčba revmatoidní artritidy
Optimální terapie RA zahrnuje kromě farmakoterapie i nefarmakologické přístupy. Hlavním cílem fyzioterapie je redukce bolesti a zachování či zlepšení hybnosti. Široké spektrum nefarmakologických postupů zahrnuje rehabilitační pohybovou léčbu, elektroterapii, ultrazvuk, magnetoterapii, aplikaci laseru, transkutánní elektrostimulaci a další nefarmakologické přístupy. Nutný je individuální přístup při indikaci jednotlivých prostředků fyzioterapie pro konkrétního pacienta. Problémem hodnocení efektu a účinnosti těchto léčebných postupů je nedostatek seriózních klinických hodnocení.
Z dostupných hodnocení je prokázán efekt ultrazvuku, který je užíván k symptomatické léčbě RA pro svůj protizánětlivý a analgetický efekt. Ultrazvuk při aplikaci na ruce zlepšuje sílu stisku, dochází ke snížení počtu bolestivých a oteklých kloubů, zkrácení ranní ztuhlosti (102).
Transkutánní elektroneurostimulace (TENS) snižuje bolest a citlivost kloubů rukou ve srovnání s placebem (103). Termoterapie je často užívanou fyzikální terapií RA. Zahrnuje povrchovou aplikaci tepla, kryoterapii, parafínové zábaly, tepelné koupele. Termoterapie může být užívána jako paliativní či doplňující terapie v kombinaci s cvičením. Pozitivní efekt v ovlivnění rozsahu pohybů, svalové síly, bolesti a ztuhlosti byl prokázán při aplikaci parafinových zábalů na ruce postižené RA (104). Dynamické cvičení přiměřené intenzity po dobu 3 měsíců vedlo ke zlepšení svalové síly, kloubní mobility a aerobní kapacity, bez progrese bolesti, kloubního poškození a aktivity onemocnění. Další klinická hodnocení jsou nutná ke zhodnocení dlouhodobého efektu dynamického aerobního cvičení (105). Nutno však poznamenat, že všechny tyto závěry jsou limitovány malým počtem klinických hodnocení a jejich nízkou kvalitou, k reálnému zhodnocení efektu a účinnosti fyzioterapie jsou nutná další validní klinická sledování.
Chirurgická léčba revmatoidní artritidy
Operační léčba je nedílnou součástí komplexní terapie RA. Dle různých zdrojů 50–75 % pacientů s RA prodělá v průběhu onemocnění revmatoortopedickou operaci (106). Mezi nejdůležitější zákroky patří totální endoprotézy kyčelního kloubu a cervikální spondylodéza. Cílem revmato - chirurgických zákroků jsou korekce deformací či prevence vývoje nových deformací a z toho plynoucí zlepšení pohyblivosti, paliativní ovlivnění bolesti, prevence či snížení invalidity. Dle cíle (107) lze revmatochirurgické operace rozdělit na:
- uvolňující (parciální synovektomie, dekomprese nervů, excize revmatických uzlů),
- korekční (osteotomie, plastiky vazů a kloubního pouzdra),
- znehybňující (artrodézy),
- mobilizující (synovektomie, artrolýzy, resekce, interpoziční artroplastiky, totální endoprotézy) (tab. 7).
Tab. 7. Přehled nejčastějších postižení jednotlivých kloubů a revmatochirurgických operací (122) 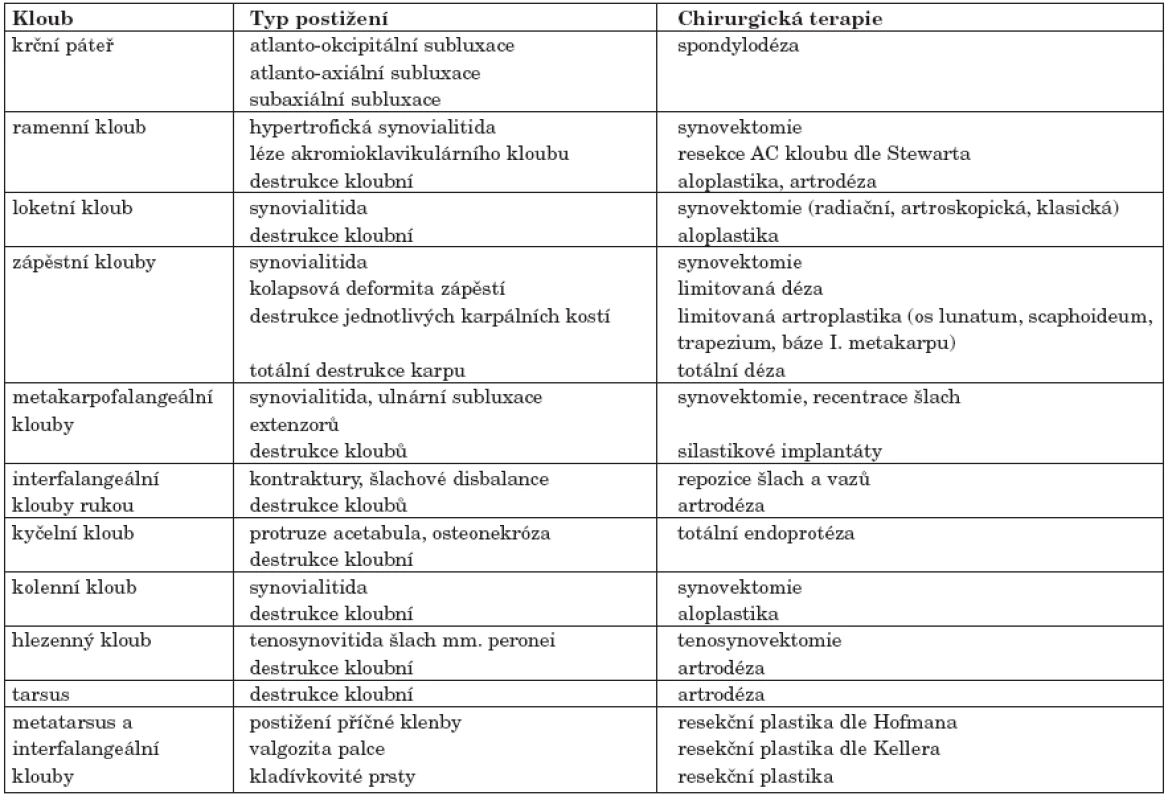
Při plánování revmatochirurgických zákroků je nutná kooperace revmatologa a chirurga s přihlédnutím ke specifickým problémům pacientů s RA, z nichž pro revmatochirurgické zákroky největší význam má zejména častější výskyt osteoporózy a fragilita kůže se zhoršenou hojivostí (v důsledku vlastního onemocnění a dlouhodobé kortikoterapie), dále doprovodná anémie, hepatopatie či postižení gastrointestinálního traktu (108).
Doc. MUDr. Radim Bečvář
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: becv@revma.cz
Zdroje
1. Hochberg MC. Adult and juvenile rheumatoid arthritis: current epidemiological concepts. Epidemiol Ref 1981; 3 : 27–44.
2. Harris ED jr. Rheumatoid arthritis: pathophysiology and implications for therapy. N Engl J Med 1990; 322 : 1277–84.
3. Pavelka K, Bečvář R, Olejárová M, Sainerová A. Revmatoidní artritida – Standardní postupy. Čes Revmatol 1999; 7(Suppl 1): 4–8.
4. Combe B, Landewe RB, Lukas C, et al. EULAR recommendations for management of early arthritis. Ann Rheum Dis 2006 Jan 5, [Epub ahead of print].
5. Pinals RS, Masi AT, Larsen RA, et al. Criteria of remission in rheumatoid arthritis of the American Rheumatism Association Diagnostic and therapeutic Criteria Committee. Preliminary criteria for clinical remission in rheumatoid arthritis. Arthritis Rheum 1981; 24 : 1308–15.
6. Prevoo ML, van’t Hof MA, Kupper HH, et al. Modified disease activity scores that include 28 joint counts: development and validation in a prospective longitudinal study in patients with rheumatoid arthritis. Arthritis Rheum 1995; 38 : 44–8.
7. Sharp JT, Young DY, Bluhm GB, et al. How many joints in the hands and wrists should be included in a score of radiologic abnormalities used to assess rheumatoid arthritis. Arthritis Rheum 1985; 28 : 1326–35.
8. Welsing PM, Landewe RB, van Riel PLCM, et al. The relationship between disease activity and radiological progression in patients with rheumatoid arthritis: a longitudinal analysis. Arthritis Rheum 2004; 50 : 2082–93.
9. Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31 : 315–24.
10. Anderson JJ, Wells G, Verhoeven AC, Felson DT. Factors predicting response to treatment in rheumatoid arthritis: the importance of disease duration. Arthritis Rheum 2000; 43 : 22–9.
11. Mottonen T, Paimela L, Leirisalo-Repo M, Kautiainen H, Ilonen J, Hannonen P. Only high disease activity and positive rheumatoid factor indicate poor prognosis in patients with early rheumatoid arthritis treated with „sawtooth“ strategy. Ann Rheum Dis 1998; 57 : 533–9.
12. Goronzy JJ, Matteson EL, Fulbright JW, et al. Prognostic markers of radiographic progression in early rheumatoid arthritis. Arthritis Rheum 2004; 50 : 43–54.
13. Vencovský J, Macháček S, Šedová L, Kafková J, Gatterová J, Pešáková V. Autoantibodies can be prognostic markers of an erosive disease in early rheumatoid arthritis. Ann Rheum Dis 2003; 62 : 427–30.
14. Combe B, Dougados M, Goupille P, et al. Prognostic factors for radiographic damage in early rheumatoid arthritis: a multiparameter prospective study. Arthritis Rheum 2001; 44 : 1736–43.
15. Dixey J, Solymossy C, Young A. Is it possible to predict radiological damage in early rheumatoid arthritis (RA)? A report on the occurrence, progression, and prognostic factors of radiological erosions over the first 3 years in 866 patients from the Early RA Study (ERAS). J Rheumatol Suppl 2004; 69 : 48–54.
16. McQueen FN, Benton A, Crabbe J, et al. What is the fate of erosions in early rheumatoid arthritis? Tracking individual lesions using x rays and magnetic resonance imaging over the first two years of disease. Ann Rheum Dis 2001; 60 : 859–68.
17. Grigor C, Capell H, Stirling A, et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single-blind randomised controlled trial. Lancet 2004; 364 : 263–9.
18. Felson DT, Anderson JJ, Boers M. The American College of Rheumatology preliminary core set of disease activity measures for rheumatoid arthritis clinical trials. Arthritis Rheum 1993; 36 : 729–40.
19. Van der Heijde DA, Dankert T, Nieman F, Rau R, Boers M. Reliability and sensitivity to change of a simplification of the Sharp/van der Heijde radiological assessment in rheumatoid arthritis. Rheumatology (Oxford). 1999; 38 : 941–7.
20. Fries JF, Spitz P, Kraines RG, et al. Measurement of patient outcome in arthritis. Arthritis Rheum 1980; 23 : 137–45.
21. Ware JE. SF-36 health survey manual and interpretation guide. The Medical Outcomes Trust. Boston, MA; Nimrod Press. 1997.
22. EuroQol Group. EuroQol: a new facility for the measurement of health – related quality of life. Health Moling 1990; 16 : 199–208.
23. American College of Rheumatology Subcommittee on Rheumatoid Arthritis Guidelines: Guidelines for the Management of Rheumatoid Arthritis. Arthritis Rheum 2002; 46 : 328–46.
24. Růžičková O, Bayer M, Pavelka K, Palička V. Doporučení pro prevenci a léčbu glukokortikoidy indukované osteoporózy u pacientů s revmatickým onemocněním. Čes Revmatol 2004; 4 : 163–74.
25. V ACR and EULAR improvement criteria have comparable validity in rheumatoid arthritis trials. American College of Rheumatology European League of Associations for Rheumatology. J Rheumatol. 1999; 26 : 705–11.
26. American College of Rheumatology ad hoc committee on clinical guidelines. Guidelines for management of rheumatoid arthritis. Arthritis Rheum 1996; 39 : 713–22.
27. Felson D, Anderson JJ, Meenan RF. The comparative efficacy and toxicity of second-line drugs in rheumatoid arthritis. Arthritis Rheum 1990; 33 : 1449–61.
28. Scott DL, Smolen JS, Kalden JR, et al. Treatment of active rheumatoid arthritis with leflunomide: two-year follow-up of a double blind, placebo controlled trial versus sulfasalazine. Ann Rheum Dis 2001; 60 : 913–23.
29. Boers M, Verhoeven AC, Markusse HM, et al. Randomised comparison of combined step-down prednisolone, methotrexate and sulfasalazine with sulfasalazine alone in early rheumatoid arthritis. Lancet 1997; 350 : 309–18.
30. Van der Heijde DM, van Riel PLCM, Nuver-Zwart IH, et al. Effects of hydroxychloroquine and sulfasalazine on progression of joint damage in rheumatoid arthritis. Lancet 1989; 333 : 1036–8.
31. Kremer JM, Phelps CT. Long-term prospective study of use of methotrexate in the treatment of rheumatoid arthritis – update after a mean of 90 months. Arthritis Rheum 1992; 35 : 138–45.
32. Tugwell P, Bennet K, Bell M, et al. Methotrexate in RA. Ann Intern Med 1989; 110 : 581–3.
33. Rau R, Hernom G, Kargen T, et al. A double blind, randomized parallel trial of intramuscular methotrexate and gold sodium thiomalate in early erosive rheumatoid arthritis. J Rheumatol 1991; 18 : 328–33.
34. Strand V, Cohen S, Sheriff M, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arch Intern Med 1999; 159 : 2542–50.
35. Emery P, Breedveld FC, Lemmell EM, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatol 2000; 39 : 655–65.
36. Bathon JM, Martin RW, Fleischmann RM, et al. A comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. N Engl J Med 2000; 343 : 1586–93.
37. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study. A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum 2006; 54 : 26–37.
38. Smolen JS, Kalden JR, Scott DL, et al. Efficacy and safety of leflunomide compared with placebo and sulfasalazine in active rheumatoid arthritis: a double blind, randomized, multicenter study. Lancet 1999; 353 : 259–66.
39. Kalden JR, Scott DL, Smolen JS, et al. European Leflunomide Study Group. Improved functional ability in patients with rheumatoid arthritis – longterm treatment with leflunomide versus sulfasalazine. European Leflunomide Study Group. J Rheumatol 2002; 29 : 1983–91.
40. Maddison P, Kiely P, Kirkham B, et al. Leflunomide in rheumatoid arthritis: recommendations through a process of consensus. 2005; 44 : 280–6.
41. Gerards AH, Landewe RB, Prins AP, et al. Cyclosporin A monotherapy versus cyclosporin A and methotrexate combination therapy in patiens with early rheumatoid arthritis: a double blind randomised placebo controlled trial. Ann Rheum Dis 2003; 62 : 291–6.
42. Tegzová D, Pavelka K, Šírová K, et al. Kontrolovaná studie methotrexátu a cyklosporinu u vysoce aktivní RA. Rheumatológia 1998; 12 : 123–7.
43. Cash JM, Klippel JH. Second-line drug therapy for rheumatoid arthritis. N Engl J Med 1994; 330 : 1368–75.
44. Ward JR, Williams HJ, Egger MJ, et al. Comparison of auranofin, gold sodium thiomalate, and placebo in the treatment of rheumatoid arthritis: a controlled clinical trial. Arthritis Rheum 1983; 26 : 1303–15.
45. Woodland J, Chapuit de Saintonge DM, Evans SJ, Sharman VL, Currey HL. Azathioprine in rheumatoid arthritis: double-blind study of full versus half doses versus placebo. Ann Rheum Dis 1981; 40 : 355–9.
46. O’Dell JR, Haire CE, Erikson N, et al. Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychloroquine or a combination of all three medications. N Engl J Med 1996; 334 : 1287–91.
47. Pavelka K. Terapie revmatoidní artritidy. In: Pavelka K, et al. eds. Farmakoterapie revmatických onemocnění. Praha: Grada Publishing, 2005; 224.
48. Tugwell P, Pincus T, Yocum D, et al. Combination therapy with cyclosporine and methotrexate in severe rheumatoid arthritis. N Engl J Med 1995; 333 : 137–41.
49. Haagsma CJ, van Riel PLCM, de Jong AJ, van de Putte LB. Combination of sulphasalazine and methotrexate versus the single components in early rheumatoid arthritis: a randomized, controlled, double-blind, 52 week clinical trial. Br J Rheumatol 1997; 36 : 1082–8.
50. Dougados M, Combe B, Cantagrel A. Combination therapy in early rheumatoid arthritis: a randomised, controlled, double blind 52 week clinical trial of sulphasalazine and methotrexate compared with the single components. Ann Rheum Dis 1999; 58 : 220–5.
51. Combination therapy versus monotherapy for the treatment of patients with rheumatoid arthritis. Clin Exp Rheumatol 1999; 17 : 699–704.
52. Treatment of rheumatoid arthritis with methotrexate and hydroxychloroquine, methotrexate and sulfasalazine, or a combination of the three medications: results of a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2002; 46 : 1164–70.
53. Marchesoni A, Battafarano N, Arreghini M, et al. Radiographic progression in early rheumatoid arthritis: a 12-month randomized controlled study comparing the combination of cyclosporin and methotrexate with methotrexate alone. Rheumatology (Oxford) 2003; 42 : 1545–9.
54. Gerards AH, Landewe RB, Prins AP, et al. Cyclosporin A monotherapy versus cyclosporin A and methotrexate combination therapy in patiens with early rheumatoid arthritis: a double blind randomised placebo controlled trial. Ann Rheum Dis 2003; 62 : 291–6.
55. Concomitant leflunomide therapy in patients with active rheumatoid arthritis despite stable doses of methotrexate. A randomized, double-blind, placebo-controlled trial. Ann Intern Med 2002; 137 : 726–33.
56. Cannon GW, Holden WL, Juhaeri J, et al. et al. Averse events with disease modifying antirheumatic drugs (DMARD): a cohort study of leflunomide compared with other DMARD. 2004 Oct; 31 : 1906–11.
57. Choy EHS, Smith C, Doré CJ, et al. A meta-analysis of the efficacy and toxicity of combining disease-modifying anti-rheumatic drugs in rheumatoid arthritis based on patient withdrawal. Rheumatology 2005; 44 : 1414–21.
58. Smolen JS, Sokka T, Pincus T, Breedveld FR. A proposed treatment algorithm for rheumatoid arthritis: aggressive therapy, methotrexate, and quantitative measures. Clin Exp Rheumatol 2003; 21(Suppl 31): S209–S210.
59. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial. Arthritis Rheum 2005; 52 : 3381–90.
60. Moreland LW, Schiff MH, Baumgartner SW, et al. Etanercept therapy in rheumatoid arthritis. A randomized controlled trial. Ann Intern Med 1999; 130 : 478–86.
61. Weinblatt ME, Kremer JM, Bankhurst AD, et al. A trial of etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein, in patients with rheumatoid arthritis receiving methotrexate. N Engl J Med 1999; 340 : 253–9.
62. Maini RN, Breedveld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumor necrosis factor monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998; 41 : 1552–63.
63. Maini R, StClair EW, Breedveld F, et al. Infliximab (chimeric anti-tumor necrosis factor alfa monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. Lancet 1999; 354 : 1932–9.
64. Lipsky PE, van der Heijde DM, St. Clair EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. New Engl J Med 2000; 22 : 1594–1602.
65. Lovell DJ, Giannini EH, Reiff A, et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis. New Engl J Med 2000; 11 : 763–9.
66. Genovese MC, Bathon JM, Martin RW, et al. Etanercept versus methotrexate in patients with early rheumatoid arthritis: two-year radiographic and clinical outcomes. Arthritis Rheum 2002; 46 : 1443–50.
67. Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti-tumor necrosis factor alpha monoclonal antibody,for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. Arthritis Rheum 2003; 48 : 35–45.
68. Klareskog L, Van der Heijde DM, De Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004; 363 : 675–81.
69. St. Clair EW, van der Heijde DM, Smolen JS, et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis. A randomized, controlled trial. Arthritis Rheum 2004; 50 : 3432–43.
70. Van der Heijde DM, Klareskog L, Rodriguez-Valverde V, et al. Comparison of etanercept and methotrexate, alone and combined, in the treatment of rheumatoid arthritis. Two-year clinical and radiographic results from the TEMPO study, a double-blind, randomized trial. Arthritis Rheum 2006; 54 : 1063–74.
71. Smolen JS, Han C, Bala M, et al. Evidence of radiographic benefit of treatment with infliximab plus methotrexate in rheumatoid arthritis patients who had no clinical improvement. A detailed subanalysis of data from Anti-tumor necrosis factor trial in rheumatoid arthritis with concomitant therapy study. Arthritis Rheum 2005; 52 : 1020–30.
72. Heiberg MS, Rodevand E, Mikkelsen K, et al. Adalimumab and methotrexate is more effective than adalimumab alone in patients with established rheumatoid arthritis: results from a 6-month longitudinal, observational, multicentre study. Ann Rheum Dis 2006; 65 : 1379–83.
73. Kremer JM, Westhovens R, Leon M, et al. Treatment of rheumatoid arthritis by selective inhibition of T-cell activation with fusion protein CTLA4Ig. N Engl J Med 2003; 349 : 1907–15.
74. Genovese MC, Becker J-C, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor in inhibition. N Engl J Med 2005; 353 : 1114–23.
75. Edwards JCW, Scepanski L, Szechinski J, et al. The efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350 : 2572–81.
76. Emery P, Fleischmann R, Filipowicz-Sosnowska A, et al. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment. Results of a phase IIb randomized, double-blind, placebo-controlled, dose-ranging trial. Arthritis Rheum 2006; 54 : 1390–1400.
77. Cohen SB, Emery P, Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum 2006; 54 : 2793–806.
78. Weinblatt M, Combe B, Covucci A, Aranda R, Becker JC, Keystone E. Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum 2006; 54 : 2807–16.
79. Furst DE, Breedveld FC, Kalden JR, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2006. Ann Rheum Dis 2006; 65(Suppl 3): iii2–iii15.
80. Vencovský J, Tegzová D, Krofta K, Pavelka K. Doporučení české revmatologické společnosti k biologické léčbě blokádou TNF – doplněk standardních léčebných postupů u revmatoidní artritidy. Čes Revmatol 2004; 12 : 20–9.
81. St. Clair EW, Wagner CL, Fasanmade AA, et al. The relationship of serum infliximab concentrations to clinical improvement in rheumatoid arthritis. Arthritis Rheum 2002; 46 : 1451–9.
82. Gomez-Reino JJ, Carmona L and the BIOBADASER Group. Switching TNF antagonists in patients with chronic arthritis: an observational study of 488 patients over a four-year period. Arthritis Res Ther 2006; 8: R29.
83. Solau-Gervais E, Laxenaire N, Cortet B, Dubucqoi S, Duquesnoy B, Flipo R-M. Lack of efficacy of a third tumour necrosis factor a antagonist after failure of a soluble receptor and a monoclonal antibody. Rheumatology 2006; 45 : 1121–4.
84. Doyt L, Bonn MD, Sam Lim S. New role for an old friend: prednisone is a disease modifying agent in early rheumatoid arthritis. Curr Opin Rheumatol 2003; 125 : 193–6.
85. Saag KG, Criswell LA, Sems KM, Nettleman MD, Kolluri S. Low-dose corticosteroids in rheumatoid arthritis: a meta-analysis of their moderate-term effectiveness. Arthritis Rheum 1996; 39 : 1818–25.
86. Svensson B, Boonen A, Albertsson K, van der Heijde, Kellar C, Hafström I. for the BARFOT Study Group. Low-dose prednisolone in addition to the initial disease-modifying antirheumatic drug in patients with early active rheumatoid arthritis reduces joint destruction and increases the remission rate. A two year randomised trial. Arthritis Rheum 2005; 52 : 3360–70.
87. Kirwan JR, ARC Low Dose Glucocorticoid Study Group. The effect of glucocorticoids on joint destruction in rheumatoid arthritis. N Engl J Med 1995; 333 : 142–6.
88. Wassenberg S, Rau R, Steinfeld P, Ziedler H. Very low-dose prednisolone in early rheumatoid arthritis retards radiographic progression over two years: a multicenter, double blind, placebo controlled trial. Arthritis Rheum 2005; 52 : 3371–80.
89. Hickling P, Jacoby RK, Kirwan JR. Joint destruction after glucocorticoids are withdrawn in early rheumatoid arthritis. Arthritis and Rheumatism Council Low Dose Glucocorticoid Study Group. Br J Rheumatol 1998; 37 : 930–6.
90. Capell HA, Madhok R, Hunter JA, et al. Lack of radiological and clinical benefit over two years of low dose prednisolone for rheumatoid arthritis: results of a randomised controlled trial. Ann Rheum Dis 2004; 63 : 797–803.
91. Van Everdingen AA, Jacobs JW, Siewertsz Van Reesema DR, Bijlsma JW. Low-dose prednisone therapy for patients with early active rheumatoid arthritis: clinical efficacy, disease-modifying properties, and side effects: a randomized, double-blind, placebo-controlled clinical trial. Ann Intern Med 2002; 136 : 1–12.
92. Quinn MA, Conaghan PG, Emery P. The therapeutic approach of early intervention for rheumatoid arthritis: what is the evidence? Rheumatology 2001; 40l: 1211–20.
93. Lin AE, Paget SA. Principles of corticosteroids therapy. London. Arnold, 2002.
94. Bijlsma JWJ, Boers M, Saag KG, Furst DE. Glucocorticoids in the treatment of early and late RA. Ann Rheum Dis 2003; 62 : 1033–7.
95. Gotzsche PC, Krogth Johansen H. Meta–analysis of short term low dose prednisolone versus placebo and non steroidal anti inflammatory drugs in rheumatoid arthritis. BMJ 1998; 316 : 811–8.
96. Morrison E, Capell HA. Corticosteroids in the management of early and established rheumatoid disease. Rheumatology 2006; 45 : 1058–61.
97. Pavelka K, et al. Farmakoterapie revmatických onemocnění. Grada. Praha, 2005.
98. Hrnčíř Z. Význam série minipulzů metylprednisolonu v léčbě aktivní revmatoidní artritidy. Čas Lék Čes 1994; 133 : 440–3.
99. Hrnčíř Z. Pulsní léčba u systémových onemocnění pojiva. In: Pavelka K. Pokroky v revmatologii. Alter Praha,1996
100. Brooks P, Emery P, Evans JF, et al. Interpreting the clinical significance of the differential inhibition of cyclooxygenase-1 and cyclooxygenase-2. Rheumatology 1999; 38 : 779–83.
101. Singh G, Triadafilopoulos G. Epidemiology of NSAID-induced gastrointestinal complications. J Rheumatol 1999; 26(Suppl 1): 18–24.
102. Casimiro L, Brosseau L, et al. Therapeutic ultrasound for the treatment of rheumatoid arthritis. Cochrane Database Syst Rev. 2006; Issue 4.
103. Brosseau L, Yonge KA, et al. Transcutaneous electrical nerve stimulation (TENS) for the treatment of rheumatoid arthritis in the hand Cochrane Database Syst Rev. 2006; Issue 4.
104. Robinson VA, Brosseau L, et al. Thermotherapy for treating rheumatoid arthritis. Cochrane Database Syst Rev 2006; Issue 4.
105. Van den Ende CHM, Vliet Vlieland TPM, et al. Dynamic exercise therapy for treating rheumatoid arthritis. Cochrane Database Syst Rev. 2006; Issue 4.
106. Gschwend, N. Modern surgical therapy of RA: chances, risks, results. Postgraduate lectures EFORT 1993. Masson, 1993, No.1; 4–9.
107. Miehlke, R. Operative Therapie. In Hetsenkofer, HJ. Rheumatologie Stuttgart: Thieme, 1989; 392–418.
108. Sculo, TP. Surgical Treatment of Rheumatoid Arthritis. Mosby Year Book, 1999.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2007 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Zobrazovací metody v hodnocení strukturální progrese u ankylozující spondylitidy
- Bezpečnost podání anti-TNF alfa léčby u revmatických pacientů s chronickou hepatitidou B nebo C
- Osteonekróza asociovaná se systémovou kortikoterapií
- Trombotická trombocytopenická purpura u nemocných se systémovým lupus erythematodes
- Stanovení pentosidinu v moči a tkáních kloubního kompartmentu pacientů s pokročilou osteoartrózou
- Výskyt echokardiograficky detekovatelných kardiovaskulárních manifestací systémového lupus erythematodes
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
- Monitorování léčby osteoporózy
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteonekróza asociovaná se systémovou kortikoterapií
- Trombotická trombocytopenická purpura u nemocných se systémovým lupus erythematodes
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
- Zobrazovací metody v hodnocení strukturální progrese u ankylozující spondylitidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



