-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení České revmatologické společnosti pro léčbu dnavé artritidy
Recommendations of the Czech Society for Rheumatology for the treatment of gouty arthritis
In the introduction, the author stresses the need for accurate diagnosis of gout. You can use ACR criteria or newly published EULAR diagnostic criteria. In both criteria, there is an absolute diagnosis based on the proof of sodium urate crystals. The need for a crystallographic analysis of all effusions of unknown etiology is emphasized as well. Cessation of a gout attack as soon as possible, normalization of serum levels of uric acid and removal of urate deposits in the body are the principal objectives in the treatment of gout. Furthermore, the associated diseases need to be addressed and the complications of gout prevented. Early anti-inflammatory treatment is of high importance in the treatment of acute inflammation. Non-steroidal anti-inflammatory drugs (NSAIDs) are the drug of choice in uncomplicated gout. Colchicine is used in patients with unclear diagnosis or contraindication to NSAIDs. Even lower dosages of colchicine (0.5 mg 3 times daily) are momentarily recommended, because conventional dosage often leads to adverse effects. A third alternative in the treatment of acute inflammation is the administration of corticosteroids. In cases with mono - or oligoarthritis, intra-articular administration of long-acting corticosteroids is highly recommended. Exclusion of septic arthritis is required. Systemic administration of corticosteroids at an initial dose of 20-50 mg with tapering within two to three weeks is a possible alternative, and is sometimes used especially in forms with polyarticular gout or in cases, where NSAIDs and colchicine cannot be used. However, new attacks occur more frequently after tapering of the dose. Thus, corticosteroids are considered a second-line treatment of gout. During acute inflammation we do not affect hyperuricemia. We initiate the reduction of uricaemia after resolution of acute attacks. Chronic tophaceous gout and radiographically progressive gout are another indication of the correction of hyperuricemia. Non-pharmacological and pharmacological treatment can be used in reducing uricaemia. Non-pharmacological methods should be applied for each patient and should include weight reduction, low-purine diet and alcohol abstinence. Uricosuric and uricostatic agents can be used for pharmacological reduction of uricaemia. Uricosuric agents are indicated only in patients without renal disease (lithiasis). Currently, there is no uricosuric agent available on the Czech market. The most used drug for the treatment of hyperuricaemia is the xanthine oxidase inhibitor allopurinol. It is administered at doses of 100-900 mg per day and an individual dose for each patient must be titered. In case of intolerance or lack of efficacy of allopurinol, a non-purine selective inhibitor of xanthine oxidase, febuxostat, is now available as a second-line treatment of hyperuricaemia. The recommended dose of febuxostat is 80 mg daily. Initiation of an effective hypouricaemic treatment can trigger new attacks, therefore a colchicine prophylaxis for 3-6 months is recommended. For patients with gout often have gout-associated diseases (hypertension, dyslipidemia, diabetes, metabolic syndrome), these should be monitored and treated in collaboration with a relevant specialist. Pegylated uricase (pegloticase) and monoclonal antibody against IL-1 (canakinumab) are promising new drugs for refractory gout that are currently in the final phase of testing and approval.
Key words:
gouty arthritis, therapy
Autori: K. Pavelka
Pôsobisko autorov: Revmatologický ústav a Klinika revmatologie 1. LF UK, Praha
Vyšlo v časopise: Čes. Revmatol., 20, 2012, No. 2, p. 82-92.
Kategória: Doporučení
Súhrn
V úvodu autor zdůrazňuje nutnost přesné diagnostiky dny. Lze použít kritéria ACR nebo nově publikovaná diagnostická kritéria EULAR. V obou těchto kritériích představuje absolutní diagnózu průkaz krystalů natrium urátu a je zdůrazněna nutnost provádění krystalografické analýzy u všech výpotků nejasné etiologie. Základními cíli při léčbě dny jsou ukončit co nejdříve dnavý záchvat, normalizovat hladinu kyseliny močové a odstranit depozita urátů v těle. Dále pak ovlivnit asociovaná onemocnění a předejít jejím komplikacím. Při léčbě akutního zánětu je velmi důležitá rychlost nasazení protizánětlivé léčby. Lékem volby u nekomplikované dny jsou nesteroidní antirevmatika (NSA). U pacientů s nejasnou diagnózou nebo kontraindikací NSA podáváme kolchicin. Nově je doporučováno i podání nižších dávek kolchicinu (3x 0,5 mg denně), protože klasické dávkování vede často k nežádoucím účinkům. Třetí alternativou léčby akutního zánětu je aplikace kortikosteroidů. Silně je doporučována především intraartikulární aplikace dlouho působícího kortikoidu u forem s mono - či oligoartritidou. Podmínkou je vyloučení septické artritidy. Systémové podání kortikosteroidů v dávce 20–50 mg iniciálně s detrakcí během dvou až tří týdnů je možnou alternativou a někdy se používá především u forem s polyartikulární dnou a nemožností podávat NSA a kolchicin. Jsou však častější nové ataky po detrakci kortikoidů a proto je to považováno za postup druhé volby. Během akutního zánětu neovlivňujeme hyperurikémii, ke snížení urikémie přistoupíme po odeznění akutního záchvatu. Další indikací korekce hyperurikémie je chronická tofózní dna a rentgenově progredující dna. Při snižování urikémie kombinujeme nefarmakologické a farmakologické postupy. Nefarmakologické postupy by měly být aplikovány u každého pacienta a měly by obsahovat redukci váhy, nízkopurinovou dietu a abstinenci. K medikamentóznímu ovlivnění urikémie se dají použít urikosurika nebo urikostatika. Urikosurika jsou indikována pouze u pacientů bez ledvinného onemocnění (litiázy). V současné době není žádné urikosurikum v České republice na trhu. Nejvíce používaným lékem na léčbu urikémie je inhibitor xantinoxidázy allopurinol. Podává se v dávkách 100–900 mg denně a je nutné vytitrovat individuální nutnou dávku pro každého pacienta. Při nesnášenlivosti nebo nedostatečné účinnosti allopurinolu je nyní dostupný jako lék druhé volby nepurinový inhibitor xantinoxidázy febuxostat, doporučovaná dávka je 80 mg denně. Při zahajování účinné hypourikemické léčby mohou vznikat nové záchvaty a proto se doporučuje profylaxe kolchicinem 3–6 měsíců. Protože dnavci mají často tzv. asociovaná onemocnění (hypertenze, dyslipidémie, diabetes, metabolický syndrom), je nutné toto sledovat a ev. ve spolupráci s příslušným odborníkem i léčit. Novými perspektivními léky refrakterní dny, které jsou v současné době ve finální fázi testování a schvalování, jsou pegylovaná urikáza (peglotikáza) a monoklonální protilátka proti IL-1 (canakinumab).
Klíčová slova:
dnavá artritida, terapie
Dna je zánětlivé revmatické onemocnění, které je vyvoláno usazováním krystalů natrium urátu v pojivových tkáních a následnou zánětlivou reakcí. V širším kontextu řadíme dnu mezi metabolická onemocnění, protože podmínkou vzniku dny je zvýšená hladina kyseliny močové v séru tzv. hyperurikémie.
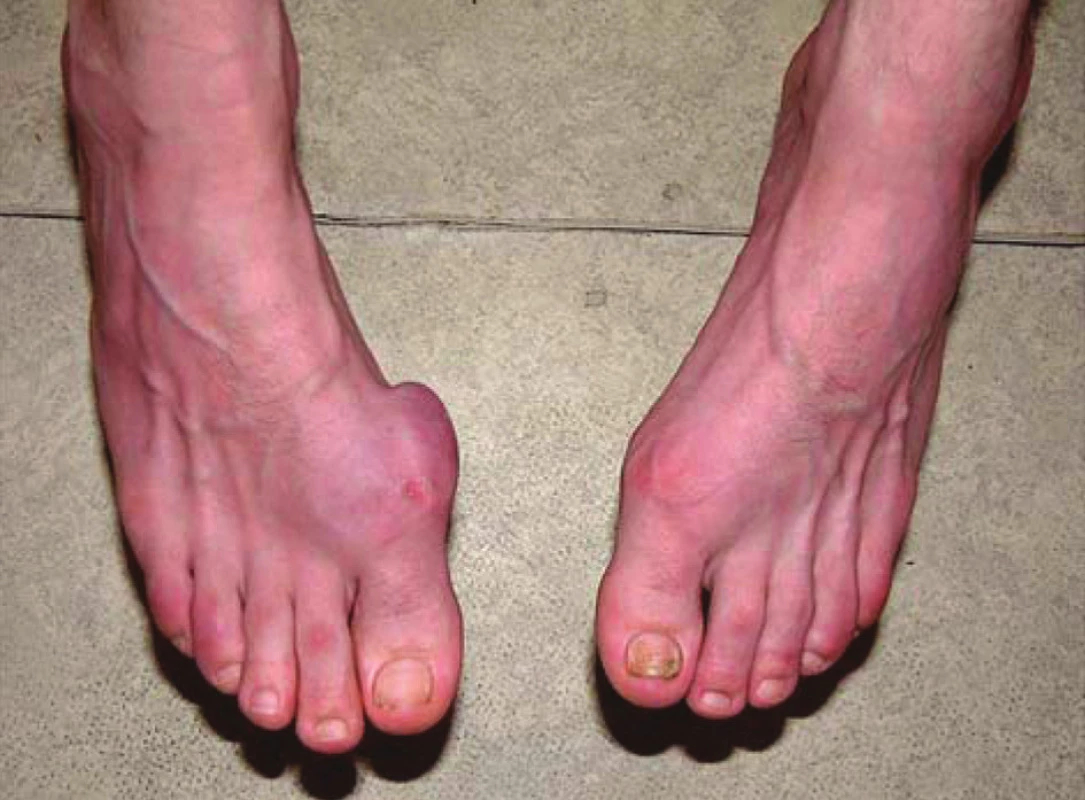
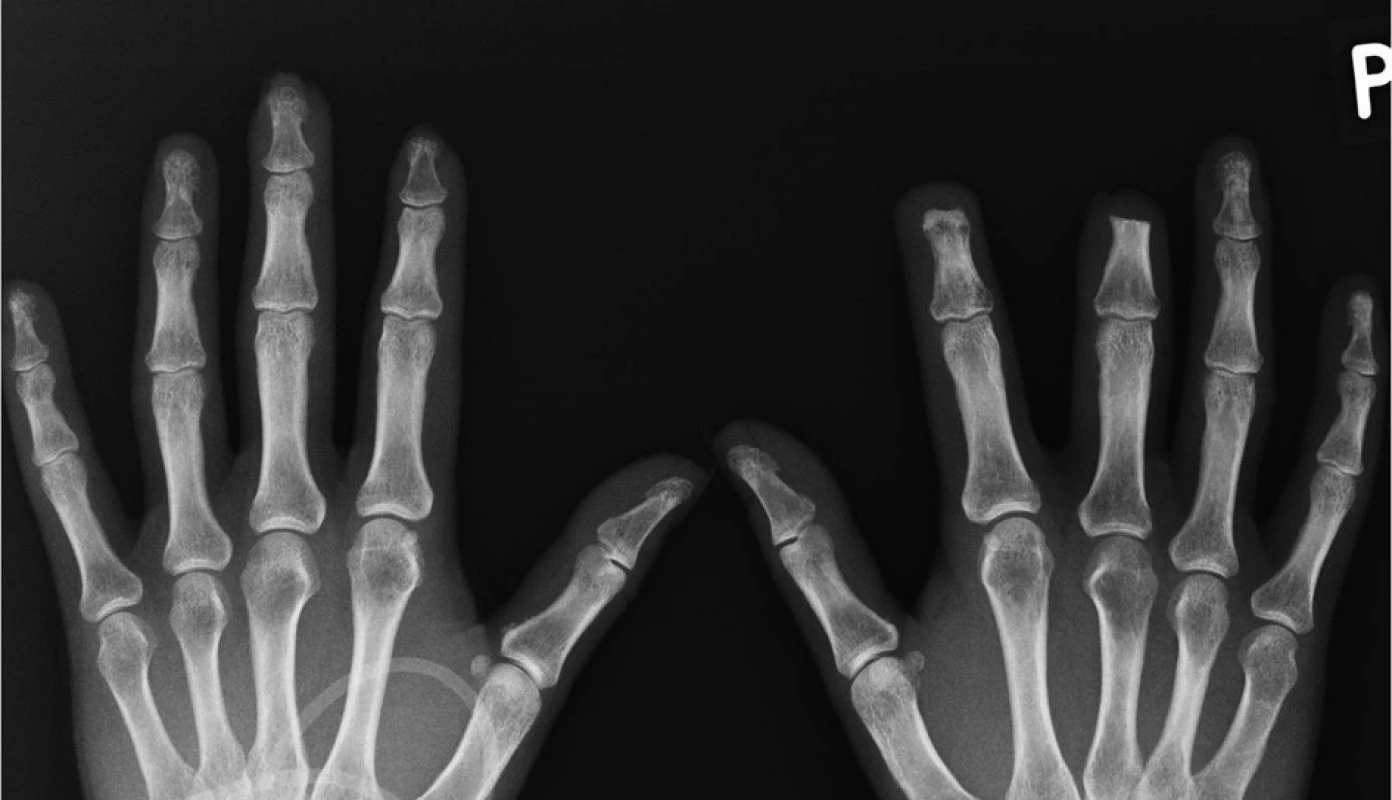
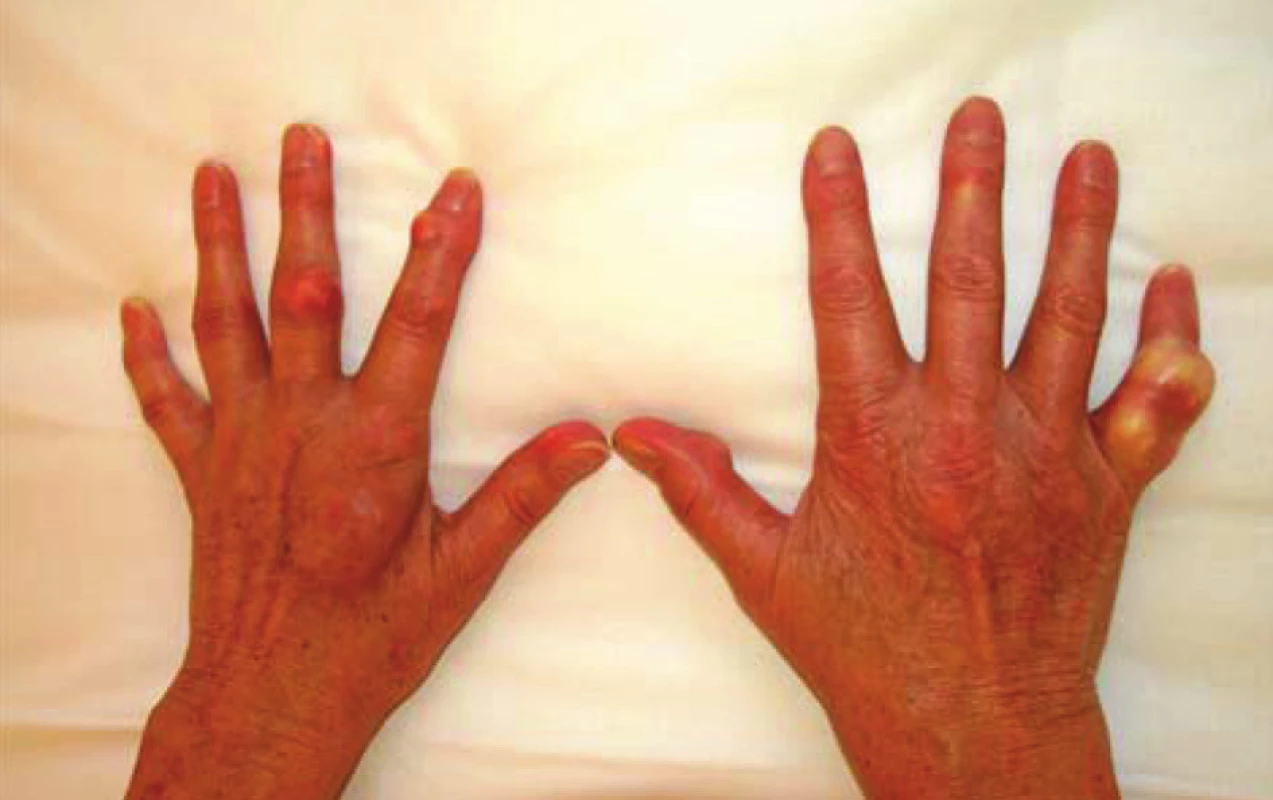
Dna je časté onemocnění a její prevalence se odhaduje na 1–2 % u dospělých a jde tedy o nejčastější artritidu v populaci (1). Prevalence dny se zvyšuje ve stáří a dosahuje 7 % u mužů nad 65 let a 3 % u žen nad 85 let. Některé epidemiologické studie také svědčí a zvyšování prevalence dny v populaci v posledních 40 letech (2), což může částečně souviset s dietními faktory, konkrétně se zvyšující se spotřebou masa a na puriny bohatou stravou a zvyšující se spotřebou alkoholu. Přestože se zdá být klinický obraz dny jasný a pokročilo i pochopení patogeneze dny, v klinické praxi je dna často špatně diagnostikována a rovněž léčba není optimální (obr. 1, obr. 2).
Mezi základní pilíře správné terapie dny patří: přesná a rychlá diagnostika dny, klasifikace dny (primární, sekundární), vyhodnocení příčin hyperurikémie, stadium nemoci (akutní dna, intermitentní stadium, chronická, tofózní dna), posouzení funkce ledvin, přítomnost asociovaných onemocnění, strukturální změny na skeletu, léčba akutního záchvatu, chronické artritidy, korekce hyperurikémie, prevence dalších atak.
Diagnostika dny
V 60. letech minulého století McCarty a spol. popsali metodiku identifikace krystalů natrium urátu v polarizačním mikroskopu. Krystaly se prokazují buď ve vzorku synoviální tekutiny získaného punkcí kloubní dutiny, nebo v dnavém tofu, kde se vzorek získá biopsií. Krystaly se získávají až u 95 % nemocných s dnou a někdy i u asymptomatických kloubů, což ale rovněž potvrzuje diagnózu dny. Alternativní metodou k průkazu krystalů může být vedle polarizačního mikroskopu elektronová mikroskopie. Při velkém množství krystalů v materiálu z tofu lze použít murexidovou zkoušku, která se ale v praxi používá velmi málo.
Pokud není dostupný materiál na krystalografickou analýzu, lze k diagnostice dny použít klasifikační kritéria ACR, tak jak je navrhl Wallace (3) (tab. 1). Senzitivita těchto kritérií je 87,6 % a specificita 97,2 %. Evropská liga proti revmatismu (EULAR) publikovala svoje Doporučení v roce 2006 (4). Tato kritéria vznikla na základě evidence a dále na základě konsensu při použití standardních metodik EULAR, např. delfské metodiky. Pracují s kritérii, jako je positivní prediktivní hodnota pro jednotlivý příznak či kombinaci příznaků. Tato Doporučení tvoří celkem 10 bodů, přičemž u každého je udávána i síla Doporučení (4) (tab. 2).
Tab. 1. ACR kritéria pro akutní dnavou artritidu. 
Tab. 2. EULAR Doporučení pro diagnózu dny 
Diferenciální diagnostika dny je poměrně široká. V běžné klinické praxi bychom měli na dnu myslet v případě každé nejasné především mono - či oligoartritidy, zvláště u mužů a při lokalizaci na dolních končetinách. Ve všech těchto případech by měla být vyšetřena na krystaly synoviální tekutina, pokud je dostupná.
Je nutné upozornit ještě na jeden problém. Většina uvedených kritérií se zabývá typickými dnavými projevy. Nicméně stále přibývá pacientů s atypickým průběhem. Přibývá pacientů, kteří mají první projevy dny až ve stáří, tzn. po 65 roce života. V této věkové kategorii se již vyrovnává poměr mužů a žen, výrazně častěji dna probíhá jako polyartritida s postižením drobných kloubů rukou. V anamnéze těchto pacientů častěji nacházíme používání diuretik či renální insuficienci. Naopak alkoholismus a přítomnost asociovaných onemocnění (obezita, hypertenze dyslipidémie) je méně častá (5) (tab. 3).
Tab. 3. Rozdíly mezi typickou dnou a dnou se začátkem ve stáří (Dle:Wise C. et al. Rheum Dis Clin N Am 2007;33:33-53 (5). 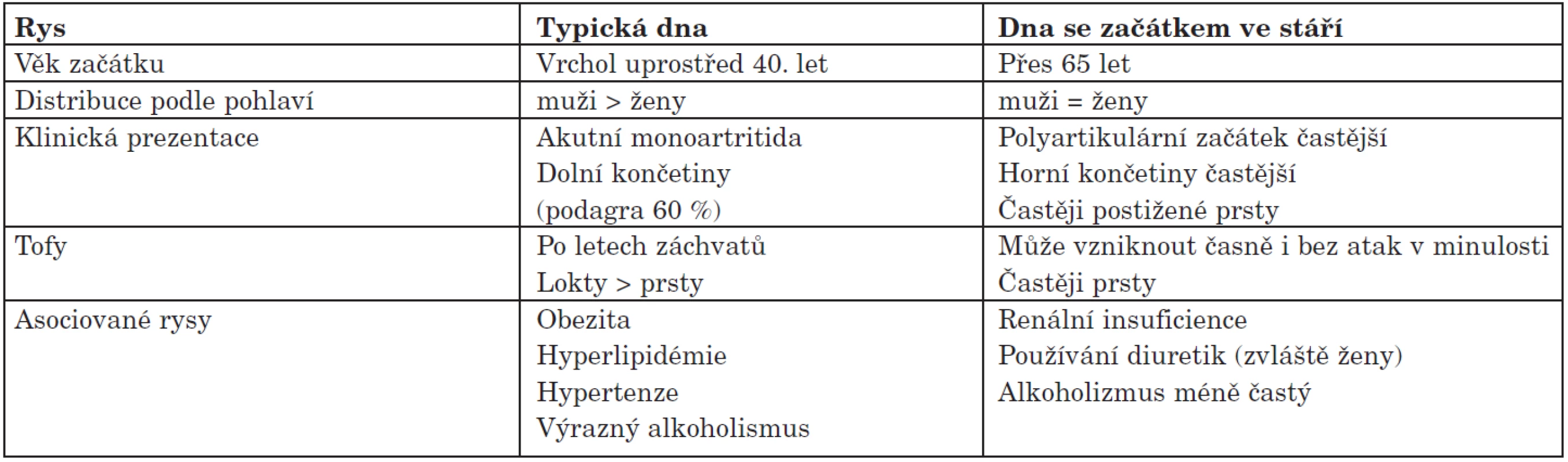
Terapie dny
Terapie dny se dá rozdělit podle stadia onemocnění: asymptomatická hyperurikémie, akutní dnavý záchvat, interkritické období a stadium chronické dny.
Základní cíle při léčbě dny jsou: ukončit co nejdříve dnavý záchvat a to nejlépe bez nežádoucích účinků léčby, normalizovat hladinu kyseliny močové, odstranit depozita urátů v těle, provádět prevenci dalších atak, ovlivnit asociovaná onemocnění a předejít jejich komplikacím.
Asymptomatická hyperurikémie
Hyperurikémie se vyskytuje v populaci až v 15 % populace, zatímco dna v 1 %, takže velká většina jedinců s hyperurikémii nikdy dnu nedostane a rovněž riziko nefrolitiázy je poměrně malé. Nicméně záleží na výšce urikémie, pokud je opakovaně vyšší než 540 μmol/l, jsou již rizika orgánových komplikací vyšší a je doporučeno nemocné léčit. V poslední době se objevily práce, které poukazují na možný toxický vliv kyseliny močové na endoteliální, cévní buňky (6). Přibývá názorů, že kyselina močová je významnou látkou působící negativně v patogenezi endoteliální dysfunkce a metabolického syndromu. Pravděpodobně je dnes vhodné snižovat urikémii medikamentózně u pacientů s vysokým kardiovaskulárním rizikem (7).
Akutní dnavý záchvat
Akutní dnavý záchvat je velmi bolestivý, přičemž největší obtíže nastávají hned na začátku onemocnění a tomu by měla odpovídat i terapeutická strategie. Základní principy léčby akutní dny jsou na tabulce 4.
Tab. 4. Terapie akutního záchvatu. 
Příznivý vliv chladu na akutně oteklý kloub byl znám již před staletími. Přesto se při opatřeních na tento způsob léčby často zapomíná. Moderní formou léčby je lokální kryoterapie při použití speciálních aplikátorů.
Protizánětlivou léčbu je nutné zahájit okamžitě, přičemž čas může být významnějším faktorem než výběr vhodného léku (8). K medikamentózní léčbě dny lze použít kolchicin, nesteroidní antirevmatika nebo kortikosteroidy a to buď intraartikulárně, nebo systémově.
Terapie kolchicinem
Kolchicin je mitotický jed, který se váže na tubulinové struktury polymorfonukleárů a který paralyzuje některé jejich funkce. Jde např. o schopnost fagocytovat krystaly natrium urátu a tím po jejich lýze vyvolávat zánětlivou reakci. Kolchicin je historický lék u dny, nicméně byl zkoušen i v moderní době a prokázal svoji účinnost oproti placebu (9). Kolchicin byl účinný u 2/3 pacientů během 24 hodin, zatímco placebo jen u 1/3 pacientů. Nicméně 80 % pacientů mělo při léčbě nežádoucí účinky, především gastrointestinální (nauzea, zvracení, průjmy, bolesti břicha) a to ještě před klinickým zlepšením. Kolchicin má nejnižší poměr účinnost/bezpečnost ze všech preparátů užívaných u dny. Špatná gastrointestinální tolerance je limitujícím faktorem použití kolchicinu.
Účinek kolchicinu je relativně specifický pro dnu, ale byl někdy pozorován i u psoriatické artritidy, artritidy při sarkoidóze a kalcifikující tendinitidě. Nicméně v případech nejasné diagnózy dny bývá pozitivní efekt kolchicinu považován za příznak podporující diagnózu dny.
Určitým problémem u kolchicinu je i dávkování. Tablety kolchicinu se vyrábějí ve velikosti 0,5 nebo 0,6 mg. Klasické doporučované dávkování bylo bolus 1 mg a pak ve 2 hodinových intervalech do maximální dávky 6 mg první den. Léčba se ukončovala při podstatném zmírnění bolestí nebo nástupu průjmů. Alternatívní, nižší dávkování kolchicinu navrhl Morris (10). V jeho publikaci navrhuje podávat 3x denně 0,5 mg a stejný postup je uveden i v Doporučeních EULAR (4). Nižší dávky kolchicinu testoval ve dvojslepé randomizované studii Terkeltaub (11). Srovnával účinnost léčby tzv. nízkou dávkou kolchicinu, což v praxi znamenalo 1,8 mg během jedné hodiny (1,2 mg bolus a 0,6 mg za hodinu) se skupinou s vysokou dávkou kolchicinu, což znamenalo 4,8 mg za 6 hodin (1,2 mg bolus a 0,6 mg každou hodinu do šesti hodin). Jako srovnávací sloužila jednorázová dávka kolchicinu 0,6 mg a placebo. Kolchicin v nízké dávce dosahoval stejných plazmatických koncentrací a stejné účinnosti jako vyšší dávky kolchicinu. Dávkovací schéma podání 1,8 mg v jedné hodině ve dvou dávkách je tedy možné doporučit (pozn. v České republice máme registrované tablety po 0,5 mg).
Další vlastností kolchicinu je, že má nejlepší účinnost, pokud je podán velmi časně tzn. do 24 hodin od začátku dnavého záchvatu. Tím se liší od NSA, kde je účinnost nezávislá od doby nasazení léčby.
V některých zemích se stále používá intravenózní kolchicin. V této formě má méně gastrointestinálních nežádoucích účinků, ale naopak některé závažné jiné nežádoucí účiny (dřeňové útlumy, nekrózy při paravenózní aplikaci) a proto i.v. aplikaci není možné doporučit. V současné době není kolchicin pro intravenózní aplikaci v ČR registrován.
Jaké je postavení kolchicinu v léčbě dnavého záchvatu? Rozhodně ho nelze považovat za lék první volby pro všechny pacienty, v tomto smyslu jsou výhodnější NSA. Indikováni jsou především pacienti s diagnostickou nejistotou, dále pacienti s kontraindikací aplikace NSA. Kolchicin musí být také nasazen velmi časně. Doba aplikace kolchicinu je většinou 1–3 dny. V současné době má kolchicin větší význam v prevenci dalších atak (viz dále) než v léčbě akutního zánětu.
Nesteroidní antirevmatika
Nesteroidní antirevmatika mají jiný mechanismus účinku než kolchicin, ale jejich účinnost je obdobná. Srovnávací studie NSA oproti kolchicinu nebyly nikdy provedeny. NSA jsou dnes nejvíce užívanou alternativou léčby akutní dny. Při časném nasazení jakéhokoliv NSA v adekvátní dávce je dosaženo kompletního odeznění záchvatu u 90 % pacientů do 5–8 dní. Byla provedena řada srovnávacích studií mezi různými NSA, která většinou ukazovala stejnou účinnost. Historicky se nejvíce užíval v léčbě dny indometacin, dále pak diclofenac, ale v podstatě lze užít jakékoliv NSA. Z novějších selektivních NSA (viz. dále) má u dny provedenou úspěšnou studii etorikoxib (10). Výhodné může být nasazení NSA s rychlým nástupem účinku nebo zahájit léčbu NSA parenterální aplikací. Léčba NSA u akutní dny se zahajuje vysokými, někdy i maximálně doporučovanými dávkami NSA, protože z klinického průběhu jasně vyplývá, že obtíže nemocného jsou nejvyšší na začátku onemocnění. Doporučované iniciální dávky NSA a jejich postupná detrakce jsou v tabulce 5. Toto samozřejmě musí být modifikováno u pacientů starších, s renální insuficiencí či rizikovými faktory kardiovaskulárními či gastrointestinálními (viz dále).
Tab. 5. NSA v léčbě akutní dnavé artritidy. 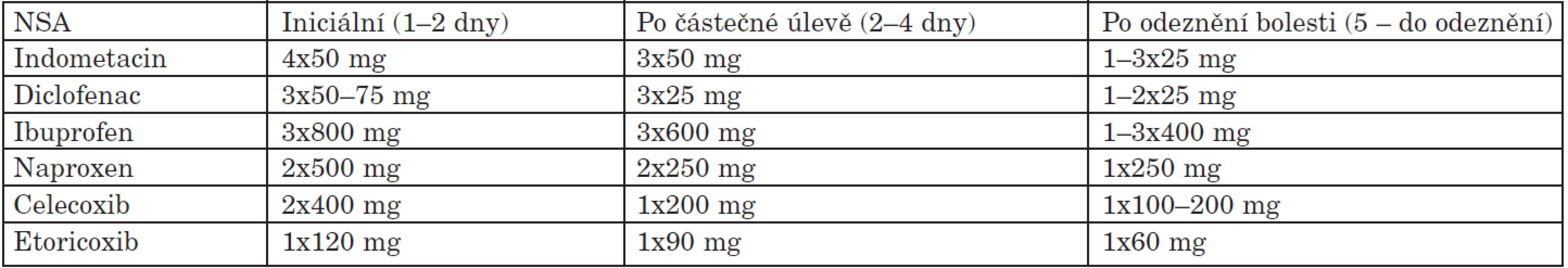
Aplikace NSA je limitována výskytem nežádoucích účinků (tab. 6). Mezi nejdůležitější nežádoucí účinky patří tzv. NSA indukovaná gastropatie a její komplikace, nefropatie, jaterní dysfunkce, CNS nežádoucí účinky, hypertenze, zhoršení kompensace městnavé srdeční slabosti a zvýšený výskyt kardiovaskulárních komplikací. Toxicita NSA je také vyšší u starších nemocných, což je většina pacientů s dnou. Největším rizikem u NSA je NSA indukovaná gastropatie. Strategií ke snížení gastrotoxicity může být aplikace COX-2 selektivních léků nebo současná aplikace blokátorů protonové pumpy. Oba postupy byly vyhodnoceny v metaanalýzách jako účinné (12, 13). Nicméně v poslední době byl o zdůrazněno potenciální kardiovaskulární riziko selektivních i neselektivních NSA (13). Při indikaci NSA léčby u dny je proto nutné zvážit komplexně všechny rizikové faktory toxicity u jednotlivého pacienta. Zda-li NSA přinášejí v této indikaci celkově více užitku než rizika není jednoznačně určeno.
Glukokortikoidy
Kortikosteroidy se mohou aplikovat u akutní dny intraartikulárně nebo systémově.
Intraartikulární aplikace kortikosteroidů
Punkce kloubní dutiny s aspirací synoviální tekutiny a následnou aplikací dlouhodobě působícího kortikosteroidu je často používanou metodou léčby a většina revmatologů s ní má pozitivní klinické zkušenosti. Aspirace synoviální tekutiny a její vyšetření má navíc význam pro diagnózu (viz výše). V klinických studiích však byla účinnost této léčby zkoumána velmi málo. Existuje jen jedna malá, otevřená studie. Do studie bylo zařazeno 19 pacientů. Průměrná bolest na škále 0–100 byla na začátku léčby 88 mm (82–93) a poklesla na úroveň 0 (0–12) po 48 hodinách (15).
Intraartikulární aplikaci kortikosteroidů lze doporučit u pacientů s monoartritidou či maximálně oligoartritidou. Pacienti s polyartikulární dnou, kteří mají jen částečný efekt NSA, nebo nežádoucí účinky po NSA mohou také profitovat při i.a. aplikaci kortikosteroidů. Podmínkou bezpečné aplikace intraartikulárních kortikosteroidů je ale vyloučení možné septické artritidy před aplikací.
Systémová aplikace kortikosteroidů
Systémově se dají podávat kortikosteroidy perorálně, intravenózně, intramuskulárně a v podobě ACTH. Prednison se obvykle podává v dávce 30 mg 1–3 dny a potom je dávka redukována v průběhu 1–2 týdnů. Při rychlejší detrakci mohou vznikat nové ataky (mechanismus tzv. rebound efektu). Parenterální aplikace nemá žádnou výhodu oproti perorální. V otevřené studii Grofa bylo zařazeno 12 pacientů a u 11 z nich bylo dosaženo kompletního potlačení symptomů do 7 dnů a u zbývajícího do 10 dnů. Pacienti s více než 5 postiženými klouby vyžadovali delší léčbu (v průměru 17 dní) (16). Iniciální dávka byla 20–50 mg prednisonu denně a vysazení trvalo v průměru 10,5 dne (4–20). Vyhodnocení vlivu iniciální dávky na výsledky nebylo možné. Je zajímavé, že byla jediná srovnávací studie účinnosti systémově podávaných kortikosteroidů a NSA. Efekt 150 mg indometacinu a 60 mg intramuskulárně podaného triamcinolonu byl obdobný.
Systémová aplikace kortikosteroidů je u akutní dnavé artritidy u pacientů s těžkou poly - nebo oligoartritidou a především v místech, které jsou obtížné na intraartikulární aplikaci (např. klouby střední nohy). Vhodní pro léčbu kortikosteroidy jsou také pacienti s kontraindikací NSA. Pro vyšší riziko opakovaných atak je systémová aplikace kortikosteroidů považována až za jako postup druhé volby.
Ovlivnění hladiny kyseliny močové během akutního zánětu
Během probíhajícího dnavého záchvatu je doporučeno neovlivňovat nově hladinu kyseliny močové, protože např. dramatický pokles může prodlužovat záchvat nebo vyvolávat záchvaty nové. V praxi to znamená, že u pacientů, kteří nebyli léčeni, nepodáváme léky snižující urikémii, ale počkáme s jejich aplikací až po odeznění záchvatu. U pacientů, kteří užívali tyto léky, pokračujeme v jejich aplikaci během záchvatu v dávce jako před záchvatem a eventuální úpravu dávky děláme opět až po skončení záchvatu.
Léčba hyperurikémie
Hyperurikémie je stav, kdy je kyselina močová v hypersaturovaném roztoku a má tendenci krystalizovat a usazovat se především v kloubních tkáních. Proto normalizace urikémie je v určitém smyslu slova kauzální léčba a prevence dalších atak. Cílová sérová koncentrace kyseliny močové byla na základě klinických studií stanovena na 360 μmol/l (6 mg/dl).
Otázkou zůstává, kdo by měl léky snižující hladinu kyseliny močové dostávat. Vcelku panuje shoda v tom, že asymptomatická hyperurikémie není až na výjimky indikací pro tuto léčbu (viz. výše). Jasnou indikací pro podávání léků jsou pacienti, kteří mají opakované, časté záchvaty. Dále pacienti, kteří mají tofózní dnu a pacienti s rentgenově průkaznou dnou a zvláště pak, u nichž rentgenové změny progredují. Určitá nejednotnost názorů je u pacientů, kteří mají velmi řídké záchvaty a jsou dokonce pacienti, kteří mají jeden záchvat za život. U těchto pacientů je nutné individuální rozhodnutí. U dny zatím bohužel nejsou známá data, která by definovala rizikové (prediktivní) faktory frekvence záchvatů či rizika vzniku chronicity. Jediným známým rizikovým faktorem je vlastní výška urikémie.
Léčba hyperurikémie by měla být komplexní a obsahovat jak způsoby léčby nefarmakologické, tak farmakologické (4) (tab. 7).
Hyperurikémie je v obecné rovině vyvolávána multifaktoriálně. Faktory k ní vedoucí lze rozdělit na korigovatelné a nekorigovatelné. Korigovatelné faktory u hyperurikémie jsou v tabulce 8.
Tab. 8. Korigovatelné faktory u hyperurikémie. 
Nefarmakologické způsoby léčby hyperurikémie
Nefarmakologické způsoby léčby hyperurikémie představují redukce váhy, abstinence a redukce množství purinů v potravě. Součástí léčby každého pacienta na začátku onemocnění by měla být informace o jeho onemocnění a edukace o vhodných režimových a dietních opatřeních. V epidemiologických studiích bylo prokázáno, že konsumpce alkoholu a centrální obesita jsou na hladině kyseliny močové nezávislé rizikové faktory vzniku dny (18). Mnoho pacientů s dnou má nadváhu a redukce váhy pomocí redukce příjmu kalorií a větším výdejem při cvičení může zvyšovat ledvinnou exkreci urátů. Observační studie v USA prokázala při dietní intervenci po 4 měsících pokles hladiny kyseliny močové o 18 % a frekvence dnavých záchvatů o 67 % (19). Podávání striktně bezpurinové diety snižovalo ve studii urikémii o 15–20 %. Dlouhodobě je však obtížné tuto bezpurinovou dietu dodržovat a proto je spíše možné uvažovat o dietě s nízkým obsahem purinů, kde dochází k poklesu urikémie asi o 10–15 %. Význam diety pro vznik dny prokázala i novější práce Choie (21). V této práci se prokázal významný efekt vysoké konsumpce masa, mořských plodů a alkoholu na vzniku dny. Z alkoholu byl významný vliv spotřeby piva a destilátů, naopak minimální byl vliv vína. Některé zdroje udávají, že až polovina dnavců je alkoholiků a proto edukace a výzva k abstinenci je plně na místě. Mechanismus vzniku alkoholem indukované hyperurikémie je složitý. U akutní alkoholový exces může vyvolávat laktátovou acidózu a pokles vylučování kyseliny močové ledvinami. Dlouhodobá konsumpce alkoholu zvyšuje produkci kyseliny močové de novo tím, že zrychluje degradaci adenosin trifosfosfátu na adenosin monofosfát.
Pohyb v kloubu může zvyšovat intenzitu zánětu v dnavém kloubu, jak prokázala experimentální studie, a proto se doporučuje uvést kloub do klidového režimu na 1–2 dny.
Farmakologické způsoby léčby hyperurikémie
UrikosurikaUrikosurické léky ovlivňují metabolismus aniontu kyseliny močové tím, že inhibují postsekreční, renální reabsorpci kyseliny močové, zvyšují ledvinou eliminaci kyseliny močové a tím redukují sérové koncentrace kyseliny močové. Zvýšená urikosurie může vést k depozicím urátů v ledvinných tubulech a ledvinným kamenům a tím zhoršovat funkci ledvin. Toto riziko může být sníženo zajištěním vysoké diurésy (více než 2 litry denně) a v případě kyselé moči její alkalizací. Urikosurika se mohou podávat pouze u pacientů bez ledvinného postižení. V klinickém použití jsou probenecid, sulfinpyrazon a benzbromaron. Poslední urikosurikum na trhu v Česku byl benzbromaron, který byl v některých státech včetně Česka stažen pro možnou hepatotoxicitu. V současné době není žádné urikosurikum na trhu v ČR. Je možné ho ev. získat formou mimořádného dovozu. A jací pacienti jsou indikováni pro léčbu urikosuriky? Jsou to nemocní bez ledvinného poškození a při nesnášenlivosti urikostatik (allopurinol, febuxostat). Indikovaní mohou být i pacienti s prokázaným sníženým vylučováním urátů. U pacientů s těžkou a na léčbu refrakterní hyperurikémií, lze i urikosurikum a allopurinol kombinovat.
Probenecid a sulfinpyrazon jsou méně účinné než allopurinol a neměly by být používány u nemocných s renálním poškozením. Benzbromaron je naopak účinnější než allopurinol i u pacientů s mírným renálním poškozením, jeho použití je však limitováno hepatotoxicitou.
Urikostatika
AllopurinolAllopurinol je strukturální analog hypoxantinu. Jako inhibitor xanthinoxidázy interferuje s konversí hypoxantinu na xantin a xantinu na kyselinu močovou. Snižuje hladiny kyseliny močové v séru a v moči a zvyšuje sérové hladiny hypoxantinu a xantinu. Většina allopurinolu je metabolizována na oxipurinol, který je aktivním metabolitem a který je principiálně zodpovědný za inhibici xanthinoxidázy.
Allopurinol je nejčastěji předepisovaným urikostatikem. Je tomu tak pro jeho dobrou účinnost a možnost podávat jedenkrát denně. Je dostupný v tabletách po 100 mg a 300 mg a může být podáván v jedné denní dávce. Efekt léčby allopurinolem je závislý na dávce léku. Výše nutné dávky však kolísá u jednotlivých pacientů od 100 až 900 mg allopurinolu denně. V praxi mnoho pacientů zůstává dlouhodobě na fixované dávce, což není správné, protože dávka by měla být adjustována podle aktuálních koncentrací kyseliny močové v séru. Obvykle se začíná s nižší dávkou 100–300 mg denně a k navýšení dávky se přistupuje později, pokud není dosaženo terapeutického cíle, kterým je 360 μmol/l a méně. Zvýšení dávky o 100 mg allopurinolu denně snižuje urikémii o 60 μmol/l. Doporučuje se redukovat hladinu kyseliny močové postupně ve smyslu – jděte nízko jděte pomalu (go low, go slow). Redukce hladiny kyseliny močové vede k dlouhodobému poklesu frekvence dnavých záchvatů (21). Nicméně krátce po zahájení léčby allopurinolem, když dochází k rychlému poklesu hladiny kyseliny močové, může docházet naopak k přechodnému zvýšení frekvence záchvatů. Proto je doporučováno u všech pacientů, u kterých je prováděna léčba snižující urikémii a zvláště u jedinců s vysokou frekvencí dnavých atak aplikovat 6 měsíců profylaxi malými dávkami kolchicinu (1–2 tabl. denně) (4). Dlouhodobé snížení resp. normalizace urikémie vede ke snížení výskytu tofů. Např. v kohortové studii v USA docházelo ve skupině s průměrnou urikémií 370 μmol/l k redukci tofů, zatímco ve skupině nad 490 μmol/l k žádné redukci nedocházelo (22). Allopurinol je možné podávat i u pacientů s renální insuficiencí. Dávky je však nutné redukovat. U pacientů s renální insuficiencí je doporučeno zahajovat dávkou 50–100 mg denně nebo ob den.
Podávání allopurinolu může vyvolávat až u 5 % pacientů nežádoucí účinky, které netolerují a přerušují léčbu. Mezi nežádoucí účinky patří také gastrointestinální iritace, útlum kostní dřeně, hepatotoxicita a hypersenzitivní syndrom. Tento syndrom může probíhat mírně jako kožní vyrážka, byly však popsány těžké formy s toxickou epidermální nekrolýzou, teplotou, eozinofilií, zhoršením renálních funkcí a dokonce úmrtím (DRESS syndrom). Mechanismus těchto reakcí není jasný, u některých pacientů bylo podezíráno současné podávání diuretik (23). U pacientů s rizikem alergických reakcí je možné preventivně začít podávat allopurinol ve smyslu tzv. desensitizace, což znamená zahájení léčby velmi malými dávkami (25–50 mg) denně na lůžkovém oddělení.
Je nutné také myslet na lékové interakce allopurinolu. Allopurinol může interferovat s hepatálním metabolismem perorálních antikoagulancií a teofylinu. Některé léky jako azathioprin nebo merkaptopurin jsou metabolizovány xantinoxidázou. U všech těchto léků je nutné redukovat dávky allopurinolu o 20–30 %.
Allopurinol je stále lékem první volby při léčbě hyperurikémie. V případě jeho nesnášenlivosti či nedostatečné účinnosti je jeho alternativou febuxostat nebo urikosurika.
Febuxostat
Febuxostat je nový, ne purinový selektivní inhibitor xanthinoxidázy, který neinterferuje s ostatními enzymy. Febuxostat je metabolizován v játrech a je jimi i vylučován, takže u pacientů se středním stupněm renální insuficience (clearance kreatininu vyšší než 30 ml/l) není nutná adjustace dávky a stejně tak u pacientů s mírným poškozením jaterních funkcí. V klinických studiích byly zkoušeny dávky 80 mg a 120 mg denně. Schválenou dávkou EMA a i v Česku je 80 mg denně. Protože jde o velmi účinný lék vedoucí k razantnímu snížení urikémie, doporučuje se podávat prvních 6 měsíců profylaktické dávky kolchicinu podobně jako u allopurinolu (24). Febuxostat byl testován v řadě studií především ve srovnání s allopurinolem. Do randomizované, kontrolované studie Beckera bylo zařazeno 762 pacientů s dnavou artritidou, kteří dostávali 80 mg nebo 120 mg febuxostatu nebo 300 mg allopurinolu. Primárním cílem bylo dosažení urikémie nižší než 360 μmol/l, sekundárními cíli pak snížení počtu dnavých záchvatů a zmenšení tofů. Všichni pacienti měli prevenci záchvatů kolchicinem nebo NSA. Primárního cíle bylo dosaženo ve skupině febuxostat 80 mg denně v 47–59 %, febuxostat 120 mg 44–74 % a ve skupině allopurinol 300 mg v 8–40 %: Febuxostat byl tedy signifikantně účinnější než allopurinol (p = 0,001) a to nejen v ukazateli proporce normálních urikémií, ale i ve snížení počtu dnavých záchvatů a regresi tofů (25). Ve studii Schumachera bylo zařazeno 1072 pacientů včetně pacientů s poškozenými renálními funkcemi. Pacienti dostávali 80 nebo 120 mg febuxostatu denně, nebo allopurinol 100 nebo 300 mg denně nebo placebo. Primárním cílem bylo opět dosažení urikémie méně než 360 μmol/l. Ve skupině febuxostat 80 mg bylo primárního cíle dosaženo v 48 %, febuxostat 120 mg v 69 %, ve skupině léčené allopurinolem v 22 % a ve skupině placebo pak v 0 % (26). Signifikantně více pacientů s poškozenou renální funkcí docílilo normální urikémie po febuxostatu než po allopurinolu (dávka 100 mg).
Tolerance febuxostatu je obvykle dobrá. Nicméně u 3–5 % se vyskytují elevace jaterních testů. Byl také pozorován nesignifikantně vyšší výskyt kardiovaskulárních příhod po febuxostatu, což vedlo EMA k restrikci používání febuxostatu u pacientů s ischemickou chorobou srdeční. Nicméně v tomto smyslu je nutné provést další studie včetně údajů z dlouhodobých observačních studií či registrů. Alergické reakce jsou poměrně vzácné po febuxostatu, nicméně není zatím jasné, zdali pacienti s anamnézou alergické reakce po allopurinolu mají vyšší riziko i po jiném inhibitoru xantinoxidázy jako je febuxostat.
Jaké jsou tedy indikace febuxostatu: 1. Febuxostat není v současné době indikován jako lék první volby při léčbě hyperurikémie. Je indikován u pacientů, kteří nesnášejí allopurinol, nebo kteří mají kontraindikace k jeho podávání. 2. Febuxostat je dále indikován u pacientů, kteří nedosáhnou terapeutického cíle ani při podávání maximálně doporučovaných dávek allopurinolu, nebo maximálních dávek, které pacient toleruje nebo dávek, které jsou individuálně možné (např. redukce při chronické renální insuficienci).
Kontraindikacemi jsou středně a silně vyjádřená alkoholická hepatopatie, závažná ICHS, pokles renálních funkcí pod 20 ml/min. clearance kreatininu a pacienti vyžadující léčbu plnými dávkami azathioprinu.
Léčba chronické, tofózní dny
V současné době se odhaduje proporce pacientů, kteří progredují ze stadia akutní, intermitentní dny do stadia chronické dny s tofy a rentgenovými známkami dny, na 5–10 % (obr. 3). Základním pilířem v léčbě chronické dny je dlouhodobá normalizace hladiny kyseliny močové. Tato normalizace vede jednak ke snížení počtu vzplanutí dnavých záchvatů, jednak ke zmenšení počtu a velikosti tofů. Např. ve studii FOCUS (27) s febuxostatem bylo dosaženo normourikémie u 93 % pacientů po 5 letech léčby. Zatímco na začátku léčby mělo akutní vzplanutí až 47 % pacientů, v pátém roce léčby klesl tento počet na nulu. Alespoň jeden tofus mělo na začátku 26 pacientů a u 18 došlo k jeho resoluci na konci studie (69 %).
Pacienti však mají při chronické dně chronickou synovitidu, bolestivé klouby a ztuhlost, takže obraz může připomínat revmatoidní artritidu. Tito pacienti vyžadují chronickou léčbu NSA, někdy i přechodně systémově kortikosteroidy. Lokální léčba při vzplanutí je také vhodná. Při chronickém průběhu, který je doplňován akutními záchvaty, je indikovaná i dlouhodobá profylaxe kolchicinem. Malá část pacientů je však na všechnu tuto léčbu refrakterní. Zde je možno uvažovat o některém experimentálním způsobu léčby, které ale již pomalu přicházejí do klinické praxe (viz dále).
Terapie asociovaných onemocnění
Dna je velmi asociována s obezitou, alkoholismem, hypertensí, hypertriglyceridémií nebo sumárně s metabolickým syndromem. Výskyt hypertense u dnavých pacientů se udává mezi 50–60 %. Až polovina dnavců konsumuje denně 60 g alkoholu a více a má z toho komplikace jako např. hepatopatii. Riziko akutního infarktu myokardu je u pacientů s dnou signifikantně vyšší než u stejně staré populace bez dny (7). Zdá se, že hyperurikémie může být i nezávislým rizikovým faktorem infarktu myokardu, protože zvýšené riziko není plně vysvětleno ani výskytem klasických rizikových faktorů u dny jako je renální dysfunkce, metabolický syndrom a další tradiční rizikové faktory ICHS. Každý pacient s dnou by měl být vyšetřen a monitorován na výskyt asociovaných onemocnění a tato by měla být adekvátně léčena a je přitom doporučována spolupráce s příslušnými odborníky.
Nové léčebné postupy
PEG urikáza
Přes pokroky v léčbě hyperurikémie a dny zůstává část pacientů, u kterých se nepodaří znormalizovat urikémii a následkem toho mají i klinické komplikace ve formě častých záchvatů nebo chronické dny. Jedním z nových postupů je aplikace urikázy. Na rozdíl od mnoha savců nemá člověk ve výbavě enzym urikázu, který rozkládá kyselinu močovou na více rozpustný alantoin, který je pak vylučován ledvinami. Již před 20 lety byla extrahována nativní ureáza z Aspergilus flavus. Později byla syntetizována rekombinantní urikáza tzv. rasburikáza. Tato je stále ještě v klinickém použití v indikaci hyperurikémie u dětí s lymfomem či leukemií nebo dospělých se solidními nádory. Aplikace rasburikázy však byla spojena s vysokým výskytem protilátek a nežádoucích účinků. Nově byla vyvinuta pegylovaná urikáza, která má sníženou antigenicitu a delší biologický poločas. Intravenózně podávaná, pegylovaná urikáza (PEG ureáza, peglotikáza) prošla fázemi 2 a 3 klinického zkoušení, kde prokázala vysokou potenci ve snížení urikémie a redukci tofózních depozit během poměrně krátké doby (27). V USA byla zaregistrována v roce 2010 pro léčbu dospělých pacientů s dnou, kteří jsou refrakterní na konvenční způsoby léčby. Podává se intravenózně v dávce 8 mg každé 2 týdny v pomalé infuzi. Po její aplikaci může být na začátku léčby exacerbace dnavých záchvatů a proto je profylaxe kolchicinem nutná. Mohou se vyskytovat alergické reakce. Problémem zůstává vysoká cena této léčby.
Inhibice interleukinu 1
Nové výzkumy prokázaly, že prozánětlivý cytokin interleukin 1ß hraje klíčovou úlohu při vzniku zánětu u dnavé artritidy, podobným způsobem jako u vrozených autoinflamatorních syndromů a kryopyrin asociovaných onemocnění a může také přispívat k destrukci u dnavé artritidy. Byla syntetizována monoklonální protilátka canakinumab, což je plně humánní anti interleukin 1ß monoklonální protilátka. V klinické studii prokazovala lepší profylaxi dnavých záchvatů ve srovnání s kolchicinem (28).
Chirurgická léčba dny
V případě, že má nemocný velké tofy, které způsobují mechanické problémy, např. na plosce nohy, je možné tofy chirurgicky odstranit. Klinická zkušenost nám ukazuje někdy problémy s hojením ran po těchto operacích.
Závěr
Výskyt dny a hyperurikémie se zvyšuje. Dna může být příčinnou zvýšené morbidity i mortality nemocných a může značně snižovat kvalitu života. Základem adekvátní léčby je správná diagnostika dny. V léčbě se musí uplatňovat kombinace nefarmakologických postupů, režimových opatření a farmakoterapie. Při akutním záchvatu je nutné zahájit léčbu okamžitě. Lékem první volby jsou NSA, u pacientů s diagnostickou nejistotou nebo kontraindikací NSA pak kolchicin. U pacientů s polyartritidou a kontraindikací NSA lze užít i systémové kortikosteroidy. U forem s monoartritidou se osvědčuje i.a. aplikace dlouho působícího kortikosteroidu. Léčba snižující urikémii se zahajuje až po odeznění záchvatu. Indikováni jsou pacienti s častou frekvencí záchvatů nebo rentgenovou progresí dny a pacienti s chronickou tofózní dnou. Lékem první volby je allopurinol, při jeho nesnášenlivosti nebo nedostatečném účinku pak febuxostat.
Prof. MUDr. Karel Pavelka
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Lawrence RC, Helmick CG, Arnett FC et al: Estimates of the prevalence of arthritis and selected musculosceletal disorders in the United States. Arthritis Rheum 1998;4(1):778-99.
2. Mikuls TR, Farrar JT, Bilker WB, et al: Gout epidemiology: results from the UK General Practise Research Database 1990-1999. Ann Rheum Dis 2005;64 : 267-72.
3. Wallace SL, Robinson H, Masi AT, et al: Preliminary criteria for the classification of the acute arthritis of primary gout. Arthritis Rheum 1977;20 : 895-900.
4. Zhang W, Doherty M, Pascual E, et al: EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of task force of the standing committee for international clinical studies including therapeutics. Ann Rheum Dis 2006;65 : 1301-1311.
5. Wise C: Crystal associated arthritis in the elderly. Rheum Dis Clin N Am 2007;33 : 33-75
6. Reyes A. Cardiovascular drugs and serum uric acid. Cardiovasc Drugs Ther 2003;17 : 397-414.
7. Krishnan E, Baker J, Furst D, et al: Gout and the risk of acute myocardial infarction. Arthritis Rheum 2006;54 : 2688-2696.
8. Wortmann RL. Recent advances in the management of gout and hyperuricemia. Curr Opin Rheumatol 2005;17 : 319-324.
9. Ahern MJ, Reid C, Gordon C, et al: Does colchicine work? The results of first study in acute gout. Aust NZ J Med 1987;17 : 301-304.
10. Terkeltaub RA, Furst DE, Bennett K, et al. High Versus Low Dosing of Oral Colchicine for Early Acute Gout Flare. Arthritis Rheum 2010;4 : 1060-1068.
11. Rubin BR, Burton R, Novarra S, et al.: Efficacy and safety profile of treatment with etoricoxib 120 mg once daily compared with indometacin 50 mg three times daily in acute gout: a randomized ,controlled trial. Arthritis Rheum 2004;50 : 598-606.
12. Ofmann JJ, Mac Lean CH, Strauss WL, et al.: A metaanalysis of severe upper gastrointestinal complications of nonsteroidal antirehumatic drugs. J Rheumatol 2002;29 : 169-182.
13. Hooper L, Brown TJ, Elliot R, et al: The effectiveness of five strategies for the prevention of gastrointestinal toxicity induced by non-steroidal anti-inflammatory drugs? Systematic review. BMJ 2004;329 : 948-52.
14. Solomon SD, Mc Murray JIV, Pfeiffer MA, et al: Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 2005;352 : 1071-80.
15. Fernandez C, Noguera R, Gonzales JA, et al: Treatment of acute atacts of gout with a small dose of triamcinolon acetonide. J Rheumatol 1999;26 : 2285-86.
16. Groff CD, Franck DA, Radtz DA: Systemic steroid therapy for acute gout: a clinical trial and review of the literature. Semin Arthritis Rheum 1990;19 : 329 - 36.
17. Alloway JA, Moriarty MJ, Hoogland YT a spol: Comparison of triamcinolone acetonide with indomethacin in the treatment of acute gouty arthritis. J Rheumatol 1993; 20 : 111-113.
18. Lin KC, Lin HY, Chou P. Community based epidemiological study on hyperuricemia and gout in Kin Hu. J Rheumatol 2000;27 : 1045-1050.
19. Dessein PH, Shipton AE, Stanwix AE, et al: Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction and increased proportional intake of protein and unsaturated fat on serum and lipoprotein levels in gout a pilot study. Ann Rheum Dis 2000;59 : 539-43.
20. Choi E, Atkinson K, Karlson EW, et al.: Alcohol intake and risk of incident gout in men: a prospective study. Lancet 2000;363 : 1277-81.
21. Perez –Ruiz F, Liote F.: Lowering serum uric acid levels: What is the optimal target for improving clinical outcomes in gout. Arthritis Rheum 2007;57 : 1324-1328.
22. Perez - Ruiz F, Calabozo M, Pijaan JI, et al: Effect of urate lowering therapy on the velocity of size of reduction of tophi in chronic gout. 2002;47 : 355-60.
23. Hande KR, Noone RM, Stone WJ, et al.: Severe allopurinol toxicity descrition and guidelines for preventive in patients with renal insuficency. Am J Med 1984;76 : 47-56.
24. Jansen TL, Richette P, Oerez Ruiz F, et al.: International position paper on febuxostat. Clin Rheumatol 2010;29 : 835-840.
25. Becker MA, Schumacher HR, Wortmann RL, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 298 week, phase III randomized trial. Arthritis Care Res 2008;59 : 1540-1548.
26. Schumacher HR, Becker MA, Lloyd E, et al: Febuxostat in the treatment of gout.5 year findings of the FOCUS efficacy and safety study. Rheumatology 2009;48 : 188-194.
27. Bomalski JS, Clarck M.: Serum uric acid-lowering therapies: where are we fading in management of hyperuricemia and potential role of uricase. Curr Rheum Rep 2004;6 : 240-247.
28. Schlesinger N, Mysler E, Hsiao-Yi Lin, et al. Cinazinumab reduces the risk of acute gouty arthritis flares during initiation of allopurinol treatment: results of a double-blind, randomised study. Ann Rheum Dis 2011;70 : 1264-1271.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2012 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Výhody subkutánně podávaného methotrexátu
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
-
Všetky články tohto čísla
- Obezita, tuková tkáň a kardiovaskulární riziko u revmatoidní artritidy
- Raynaudův fenomén a periferní ischemické syndromy
- Ultrazvukové skórovací indexy při hodnocení aktivity revmatoidní artritidy
- Účinnost bosentanu v prevenci vzniku nových digitálních ulcerací u nemocné se systémovou sklerodermií (kazuistika)
- Doporučení České revmatologické společnosti pro léčbu dnavé artritidy
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Raynaudův fenomén a periferní ischemické syndromy
- Doporučení České revmatologické společnosti pro léčbu dnavé artritidy
- Obezita, tuková tkáň a kardiovaskulární riziko u revmatoidní artritidy
- Ultrazvukové skórovací indexy při hodnocení aktivity revmatoidní artritidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy