Obezita, tuková tkáň a kardiovaskulární riziko u revmatoidní artritidy
Obesity, adipose tissue and cardiovascular risk in rheumatoid arthritis
Obesity is associated with low inflammatory activity and is a risk factor for severe cardiovascular and metabolic diseases. The occurrence of cardiovascular diseases in rheumatoid arthritis is two times higher than in the general population. Rheumatoid arthritis is associated with an unfavourable metabolic condition - chronic inflammation, and lack of exercise causes loss of muscle mass and increased accumulation of adipose tissue. This condition is referred to as rheumatoid cachexia or sarcopenic obesity and occurs in individuals with increased or mainly with normal body mass index. Obesity in rheumatoid arthritis affects many aspects. It can be a potential risk factor for seronegative subset of the disease. Obese patients with rheumatoid arthritis tend to have more active disease course and worse quality of life. On the other hand, there is some evidence that obese patients with rheumatoid arthritis have less joint erosions, and slower structural progression. The higher incidence of cardiovascular disease and increased mortality in rheumatoid arthritis are probably not directly dependent on the body mass index, but rather dependent on the inflammatory activity of the disease. On the contrary, very thin patients appear to be the more vulnerable group. The aim of this review is to summarize the relationship between obesity, the severity of rheumatoid arthritis and cardiovascular risk profile in the context of new knowledge on the role of adipokines in the pathogenesis of metabolic and inflammatory diseases.
Key words:
rheumatoid arthritis, obesity, adipose tissue, mortality, inflammation, adipokines
Autori:
L. Šenolt; M. Kuklová; H. Hulejová; L. Andres Cerezo
Pôsobisko autorov:
Revmatologický ústav, Klinika revmatologie 1. LF UK Praha
Vyšlo v časopise:
Čes. Revmatol., 20, 2012, No. 2, p. 43-52.
Kategória:
Přehledné referáty
Súhrn
Obezita je spojena s nízkou zánětlivou aktivitou a představuje rizikový faktor závažných kardiovaskulárních a metabolických onemocnění. U revmatoidní artritidy je výskyt kardiovaskulárních onemocnění dvakrát vyšší než v běžné populaci. Revmatoidní artritida bývá spojena s nepříznivým metabolickým stavem - chronický zánět a nedostatek pohybu způsobují úbytek svalové hmoty a zvýšenou akumulaci tukové tkáně. Tento stav se označuje jako revmatoidní kachexie nebo sarkopenická obezita a vyskytuje se u jedinců se zvýšeným, ale převážně také s normálním indexem tělesné hmotnosti. Obezita ovlivňuje u revmatoidní artritidy mnoho aspektů. Pravděpodobně může představovat rizikový faktor pro vznik séronegativní formy onemocnění. Obézní pacienti s revmatoidní artritidou mají obvykle aktivnější průběh onemocnění a horší kvalitu života. Na druhé straně ale existuje několik dokladů o tom, že obézní pacienti s revmatoidní artritidou mají méně kloubních erozí a pomalejší strukturální progresi. Vyšší výskyt kardiovaskulárních onemocnění a zvýšená mortalita u revmatoidní artritidy nejsou pravděpodobně přímo závislé na výši indexu tělesné hmotnosti, ale na zánětlivé aktivitě onemocnění. Ukazuje se naopak, že ohroženější skupinou jsou velmi hubení pacienti. Cílem této práce je shrnout vztah mezi obezitou, závažností revmatoidní artritidy a profilem kardiovaskulárního rizika v kontextu nových poznatků o roli adipokinů v patogenezi metabolických a zánětlivých onemocnění.
Klíčová slova:
revmatoidní artritida, obezita, tuková tkáň, mortalita, zánět, adipokiny
Úvod
Obezita je výsledkem chronické kvantitativní nerovnováhy mezi příjmem a výdejem energie, což přispívá k nadměrnému ukládání tukové tkáně v organismu. Tento stav představuje nejdůležitější rizikový faktor závažných kardiovaskulárních a metabolických onemocnění. Mezi další tradiční rizikové faktory kardiovaskulárních onemocnění patří arteriální hypertenze, porucha metabolismu lipidů, diabetes mellitus a kouření (1).
Revmatoidní artritida (RA) je chronické autoimunitní onemocnění charakterizované zánětem synoviální tkáně, destruktivním poškozením a vývojem ireverzibilních deformit postižených kloubů. V porovnání s běžnou populací je u pacientů s RA zvýšená kardiovaskulární morbidita a mortalita, což nelze vysvětlit pouze přítomností výše popsaných tradičně uznávaných kardiovaskulárních rizikových faktorů (2). Mezi akcelerovanou aterosklerózou a patologickými změnami při RA jsou určité podobnosti, navíc existuje přímý vztah mezi zánětem a mírou kardiovaskulárního rizika. RA není provázena pouze narušenou regulací buněk imunitního systému a zvýšenou tvorbou zánětlivých a „pro-destruktivně“ se chovajících molekul, ale dochází často k podstatným změnám v tělesné konstituci ve smyslu nárůstu tělesného tuku na úkor svalové hmoty. V této práci bude proto diskutován vztah mezi obezitou, závažností nemoci a profilem kardiovaskulárního rizika v kontextu nových poznatků o roli adipokinů v patogenezi metabolických onemocnění a RA.
Prevalence a definice obezity u revmatoidní artritidy
V současné době není mnoho pozornosti věnováno asociaci mezi metabolickým stavem, obezitou a RA. Většina studií používá klasickou WHO definici nadváhy a obezity pro běžnou populaci (3). Nicméně tato definice není vhodná pro jedince s odlišným složením tělesné hmoty. Například jedinec s větším množstvím tukové tkáně může mít stejný index tělesné hmotnosti (BMI) jako vypracovaný sportovec s větším množstvím svalové tkáně. Kardiovaskulární riziko je ale u obou jedinců odlišné. Podobně je tomu u pacientů s RA (4). Chronické zánětlivé onemocnění často navozuje degradaci svalové hmoty se vznikem kachexie. Klasická kachexie s nízkými BMI je ale v současné době u RA vzácná (~1 %). Vyskytuje se obvykle u aktivní systémové formy onemocnění a je charakterizována nízkým množstvím svalové i tukové tkáně. Častější je stav s normálním nebo naopak zvýšeným BMI při snížené svalové hmotě, ale naopak zvýšené akumulaci tukové tkáně. Tento nepříznivý metabolický stav je způsoben převážně chronickým zánětem v kombinaci se sníženou fyzickou aktivitou, označuje se jako revmatoidní kachexie a obvykle nebývá v běžné klinické praxi rozpoznán (5). Kompenzační akumulace tukové tkáně je charakterizována jako takzvaná sarkopenická obezita (obr. 1). Tyto metabolické změny vedly k úvahám o nastavení nižšího limitu BMI pro hodnocení nadváhy, případně obezity jako ukazatele kardiovaskulárního rizika u RA.
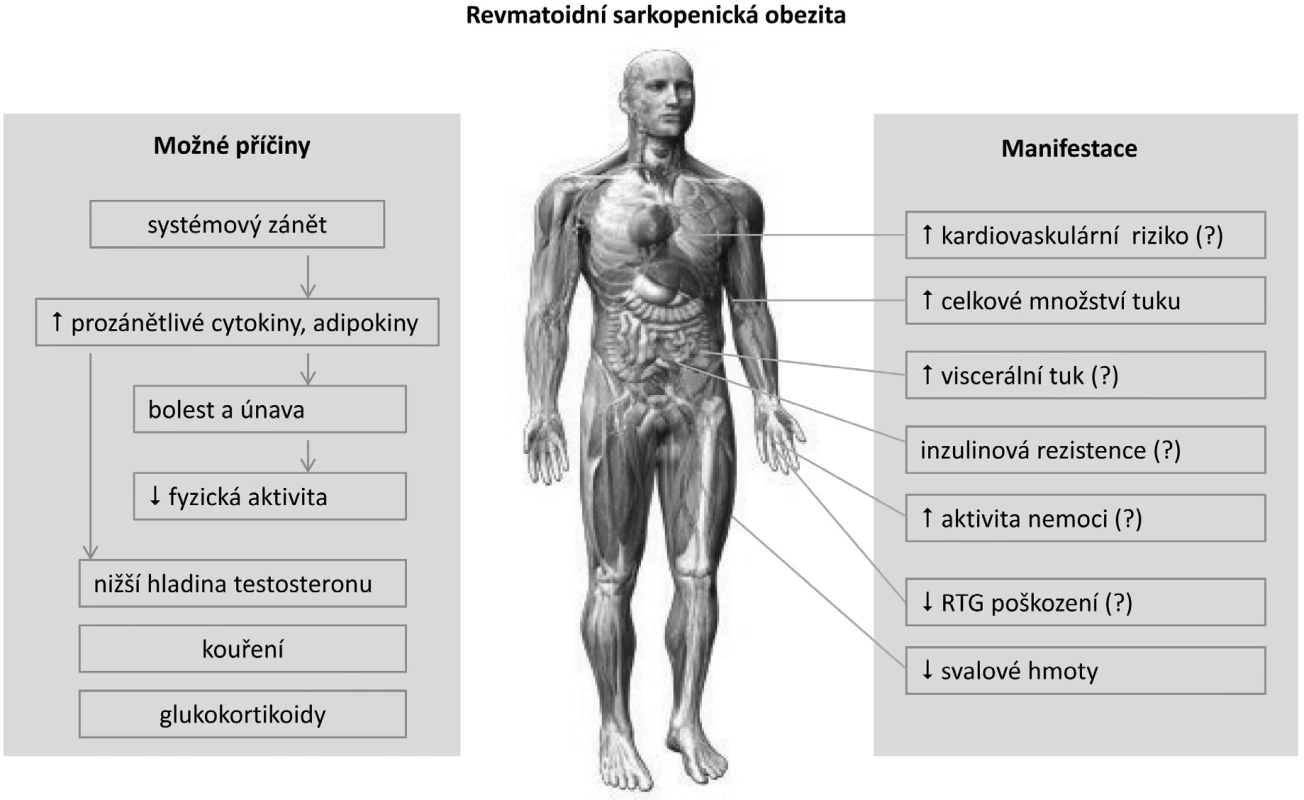
Při použití standardních limitů pro hodnocení obezity nebyla zjištěna vyšší prevalence obezity u pacientů s RA anebo naopak (6). Nicméně při srovnatelném množství tukové tkáně mají pacienti s RA přibližně o 2 kg/m2 nižší BMI v porovnání s běžnou populací (7). Proto bylo nedávno pro pacienty s RA navrženo používání nových limitů pro nadváhu a obezitu - 23 kg/m2, resp. 28 kg/m2. Klinický význam tohoto doporučení však zatím není zcela jasný. Celkově je průměrná hodnota BMI u pacientů s RA srovnatelná se zdravými jedinci – při použití standardních limitů má přibližně 60 % RA pacientů nadváhu nebo obezitu (8). Nicméně při aplikaci výše uvedených limitů BMI specificky upravených pro jedince s RA byla nedávno zjištěna prevalence nadváhy u 45 % a obezity u 37 % pacientů s RA, což je mnohem více v porovnání s běžnou populací (7). Revmatoidní sarkopenická (nebo kachektická) obezita tak přestavuje častý metabolický projev revmatoidní artritidy. Další část textu se bude zabývat několika otázkami, které nás mohou napadat. Jaká je příčina metabolických změn u RA? Jaká je role těchto změn v případném vznik RA? Jakou roli má obezita na aktivitu a progresi RA? Jaké z těchto změn vyplývá kardiovaskulární riziko a jak těmto změnám čelit?
Mechanismus změn tělesného složení u revmatoidní artritidy
Na první pohled nebývají metabolické změny charakteru revmatoidní sarkopenické obezity patrné – úbytek svalové hmoty je často provázen relativním nadbytkem tukové tkáně. K sarkopenické obezitě mají u RA větší sklon ženy než muži a patofyziologické mechanismy podílející se na těchto změnách nejsou dosud přesně známy (9). Příčina metabolicky nepříznivého stavu je velmi pravděpodobně multifaktoriální (obr. 1), může být způsobena chronickým zánětem s nadměrnou produkcí cytokinů, omezenou fyzickou aktivitou a sníženou účinností inzulinu (10).
V patogenezi sarkopenie se uplatňuje nadměrná produkce prozánětlivých cytokinů, takzvaných sarkoaktivních cytokinů. Jedná se převážně o tumor nekrotizující faktor-α (TNF-α), dále interleukin-1β (IL-1β), IL-6 nebo interferon-γ, které kromě klíčového postavení v patogenezi RA navozují degradaci svalů, podporují vystupňovaný katabolismus bílkovin a zvýšený bazální metabolismus (11). Uvedené cytokiny navíc snižují de novo syntézu proteinů ve svalech a navozují stav „anabolické rezistence“.
Bolest a ztuhlost v kloubech, úbytek svalové hmoty a svalové síly působí sníženou fyzickou aktivitu u nemocných s RA. Nadbytečné hromadění tukové tkáně u jedinců s RA může být jednoduše vysvětleno právě sníženou fyzickou aktivitou. Fyzická inaktivita je dále rizikovým faktorem řady onemocnění, včetně inzulinové rezistence. Na inzulinové rezistenci se u RA může podílet chronická kortikoterapie, prozánětlivé cytokiny, zejména TNF-α, a některé adipokiny (12). Insulin je znám jako anabolický hormon, který tlumí degradaci svalových proteinů. Snížené množství svalové tkáně a akumulaci tukové tkáně mohou podporovat i nižší hladiny testosteronu u pacientů s RA (13).
Obezita a vznik revmatoidní artritidy
Obezita představuje chronický stav nízké zánětlivé aktivity a předurčuje vznik různých onemocnění. Původní práce považovaly obezitu za významný rizikový faktor pro vznik RA. V jedné prospektivní kontrolované studii bylo například zjištěno, že obezita zvyšuje téměř čtyřnásobě riziko vzniku RA, a to zejména u žen (14). Novější a metodologicky přesněji vedené studie obezitu ale jako rizikový faktor vzniku RA nepotvrdily (6, 15). V rozsáhlé prospektivní studii na 570 pacientech s nediferencovanou artritidou byl hodnocen vztah mezi BMI a rizikem vývoje RA (15). V této práci nebyl zjištěn žádný vliv BMI na vývoj RA během prvního roku sledování. Na druhé straně bylo nedávno na souboru 515 nově diagnostikovaných pacientů s RA zjištěno, že obezita představuje více než trojnásobné riziko pro vznik RA s negativními protilátkami proti citrulinovaným peptidům (ACPA) (16). Velmi zajímavé zjištění podala také rozsáhlá epidemiologická studie hodnotící vliv nitroděložního prostřední na vnímavost ke vzniku RA v dospělém věku. Z celkového souboru 87 077 sledovaných porodů bylo studováno 619 jedinců, u kterých se vyvinula RA (17). Výsledkem bylo zjištění, že vyšší porodní hmotnost (> 4,54 kg) představuje dvojnásobné riziko pro vznik RA v dospělém věku v porovnání s normální porodní hmotností (17). Tento vztah byl nezávislý na autoprotilátkovém profilu onemocnění. Vliv nadváhy a obezity na vznik RA je stále zastřen mnoha nezodpovězenými otázkami. Závěrem lze s trochou nadsázky konstatovat, že obezita může představovat rizikový faktor pro vznik séronegativní formy RA.
Obezita, závažnost a progrese revmatoidní artritidy
Protože obezita je patologický stav spojený s aktivací prozánětlivých pochodů, tak by se dalo předpokládat, že obézní pacienti s RA mohou mít vyšší aktivitu onemocnění. V nedávné studii bylo na souboru 294 pacientů s etablovanou, dlouhotrvající RA prokázáno, že velké množství tukové tkáně a velmi vysoký BMI představují nezávislé faktory spojené s elevací CRP, vysokou aktivitou onemocnění a funkčním postižením (18). Podobný vztah byl překvapivě pozorován také u nemocných s velmi nízkým BMI nebo malým množstvím tukové tkáně. V tomto případě je nízká hmotnost velmi pravděpodobně důsledkem závažného a aktivně probíhajícího onemocnění. Obézní pacienti s RA mají navíc celkově sníženou kvalitu života (19). Nebylo ale pozorováno, že by obézní pacienti s dlouhotrvající RA měli větší tendenci k erozivnímu kloubnímu poškození nebo k častějšímu výskytu chirurgických kloubních zákroků oproti nemocným s normální hmotností (18).
Na druhé straně bylo v první pilotní studii provedené před 10 lety zjištěno, že vedle sdíleného epitopu a erozivního postižení kloubů na počátku onemocnění, může mít nízký BMI v časné fázi RA vliv na rychlejší strukturální kloubní poškození (20). Práce z poslední doby překvapivě potvrzují pozitivní vliv obezity a nadváhy na strukturální poškození a progresi RA v časné fázi nemoci. Bylo prokázáno, že obézní pacienti s RA mají již na počátku onemocnění méně kloubního poškození než srovnatelná skupina jedinců s normální hmotností (21). Navíc mají po 3 letech průběhu nemoci dvojnásobně pomalejší rentgenovou progresi než jedinci s normální hmotností (21). Zdá se tak, že obezita může mít paradoxně protektivní vliv na strukturální poškození ještě před klinickým vzplanutím onemocnění a tento efekt může přetrvávat několik prvních roků po manifestaci RA. Autoři další rozsáhlé práce potvrdili na dvou kohortách pacientů toto zjištění a prokázali negativní asociaci mezi BMI a rentgenovou progresí po 3 letech hodnocenou podle skóre Sharp-van der Heijde (15). Tento vztah byl nezávislý a platil pouze pro nemocné se séropozitivní RA (15, 21). V nedávné subanalýze dat z klinické studie GO-BEFORE byla hodnocena asociace mezi BMI a rentgenovými změnami. Bylo potvrzeno, že obézní pacienti s RA mají menší strukturální poškození kloubů (22). Tento vztah byl na rozdíl od předchozích prací (15, 21) prokázán i u séronegativní RA. Nicméně nebyl pozorován vztah mezi BMI nebo změnou váhy a roční rentgenovou progresí, což lze vysvětlit minimální strukturální progresí v průběhu biologické léčby golimumabem a krátkou dobou trvání studie.
Mechanismus, kterým je index BMI asociován s mírou kloubního poškození není v současné době přesně znám. Existuje několik možných vysvětlení. Větší mechanické zatížení u jedinců s vyšším BMI může přímo podporovat kostní syntézu a tak zabraňovat rychlejší progresi erozivních změn. Toto vysvětlení ale nemusí být zcela správné, a to zejména pokud se jedná o hodnocení drobných ručních kloubů. Na druhé straně nízká hmotnost bývá obvykle důsledkem aktivně probíhajícího onemocnění, které je spojené se závažnější strukturální progresí. Zajímavější vysvětlení na molekulární úrovni poskytuje vliv endokrinní funkce tukové tkáně na průběh onemocnění (23). V posledních letech je v této souvislosti studován význam adipokinů (24). Jak bude popsáno níže, některé adipokiny mají vztah k aktivitě nemoci a podílejí se na patogenezi kloubního poškození u RA. Obezita je obecně spojena s nižší expresí adiponectinu a v této souvislosti bylo nedávno prokázáno, že nízké hladiny adiponectinu u RA mají přímý vztah k menšímu rentgenovému poškození kloubů (25). Navíc bylo prokázáno, že jedinci s RA a velmi vysokými vstupními koncentracemi adiponectinu mají zvýšené riziko rentgenové progrese (26). Toto zjištění by mohlo vysvětlit molekulární podstatu asociace obezity s menší mírou rentgenových změn u RA. V další práci byl visfatin popsán jako faktor, který je asociován se zvýšeným a leptin se sníženým rizikem rentgenového poškození kloubů u RA (27). Závěrem lze konstatovat, že obezita může být u RA asociována s vyšší zánětlivou aktivitou nemoci, horší kvalitou života, ale paradoxně menší míru strukturálního poškození a rentgenové progrese.
Obezita a kardiovaskulární riziko u revmatoidní artritidy
Výskyt kardiovaskulárních onemocnění je u RA dvakrát vyšší v porovnání s běžnou populací (28, 29). Podle mnoha epidemiologických studií představuje RA stejné kardiovaskulární riziko jako například diabetes mellitus 2. typu. Již v časné fázi RA může být přítomna ateroskleróza nebo alespoň známky preklinické aterosklerózy v podobě zvětšené tloušťky intima media společných karotických arterií (30). Zvýšený výskyt kardiovaskulárních onemocnění nelze vysvětlit přítomností tradičních kardiovaskulárních rizikových faktorů, protože jejich zastoupení je u RA srovnatelné s běžnou populací. Dalo by se předpokládat, že větší počet kuřáků u pacientů s RA může vysvětlit nejen riziko vzniku RA, ale zároveň vyšší výskyt kardiovaskulárních onemocnění u těchto jedinců. Nicméně, kouření, ale také mužské pohlaví anebo osobní anamnéza kardiovaskulárního onemocnění představují menší kardiovaskulární riziko u RA než je tomu v běžné populaci (31). Ukazuje se, že na zvýšeném kardiovaskulárním riziku u RA se významně podílí zánětlivá aktivita onemocnění a jeho terapie (32).
Vzájemný vztah mezi obezitou, kardiovaskulárními chorobami a revmatoidní artritidou je složitý (obr. 2). Obezita je spojena se zvýšenou expresí prozánětlivých cytokinů, které se účastní průběhu kardiovaskulárních onemocnění. Dal by se tak předpokládat přímý vliv obezity na zvýšené incidence kardiovaskulárních onemocnění u RA. Nedávno bylo ale prokázáno, že na zvýšený výskyt infarktu myokardu u nemocných s RA nemá vliv obezita, ale klasické rizikové faktory, včetně aktivity onemocnění a léčby glukokortikoidy (33). V další longitudinální studii bylo paradoxně zjištěno, že obézní pacienti mají nižší mortalitu než hubení pacienti s RA (34). Toto ovšem neplatilo, pokud měli vyjádřenou systémovou zánětlivou aktivitu nebo přidružené komorbidity. U hubených pacientů (BMI <18,5 kg/m2) je dokonce vyšší riziko smrti z kardiovaskulárních příčin než u obézních jedinců s RA (4). Tento paradoxní jev je velmi pravděpodobně odrazem revmatoidní kachexie. Je nutné zdůraznit, že revmatoidní kachexie se vyskytuje zvláště u nemocných vyššího věku a je spojena se systémovým zánětem, zhoršením funkčního stavu a celkově zvýšenou mortalitou.
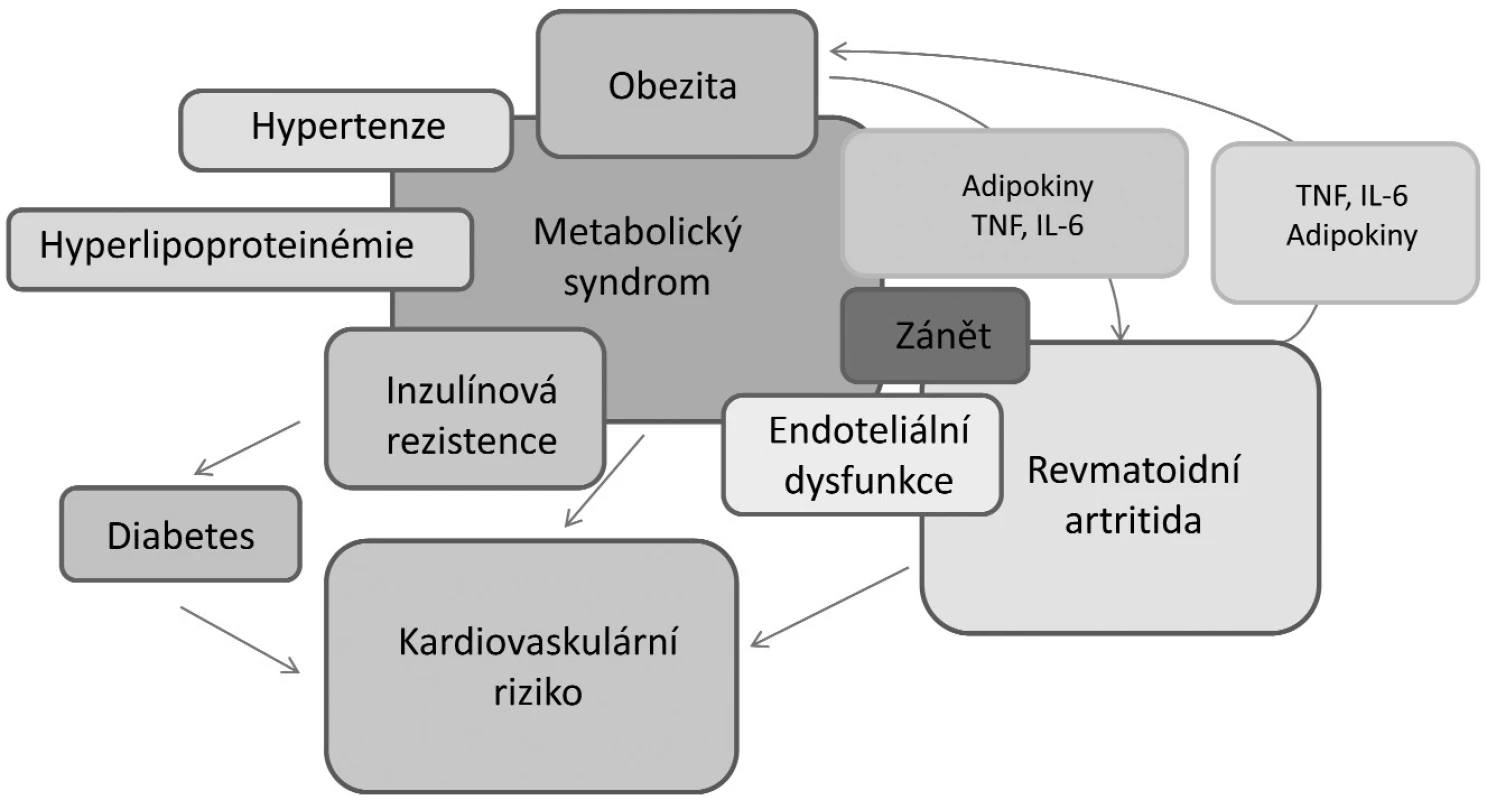
Antirevmatická léčba má na kardiovaskulární aparát protichůdné účinky. Kardiovaskulární profil je negativně ovlivněn užíváním nesteroidních antirevmatik, zejména COX-2 selektivních inhibitorů, a dlouhodobým užíváním vyšších dávek glukokortikoidů. Ty mohou negativně ovlivnit krevní tlak, lipidové spektrum, glykemii, tělesnou hmotnost a rozložení tuku. Na souboru 4 363 pacientů s RA bylo v rozsáhlé mezinárodní studii zjištěno, že dlouhodobá léčba glukokortikoidy, ale zejména konvenčními chorobu modifikujícími antirevmatickými léky a TNF-α inhibitory, snižuje výskyt kardiovaskulárních onemocnění (35). Nově používané biologické léky významně snižují nejen aktivitu RA, ale také kardiovaskulární morbiditu a mortalitu (35, 36). Na druhé straně mají některé kontroverzní účinky na lipidový profil a tělesné rozložení tukové tkáně. Inhibitory TNF-α a inhibitory IL-6 receptoru zvyšují celkové množství cholesterolu, včetně HDL cholesterolu, a triglyceridů (37). Při stejném BMI a obvodu pasu mají pacienti s RA oproti srovnatelné skupině zdravých jedinců větší množství tukové tkáně (38). Muži s RA mají více viscerálního tuku, kdežto ženy s RA mají větší množství podkožní tukové tkáně. Nárůst viscerálního tuku se podílí na patogenezi metabolického syndromu. Nedávno bylo zjištěno, že při obdobném zlepšení klinické aktivity onemocnění, zvyšují TNF-α inhibitory, na rozdíl od metotrexátu, celkové množství tukové tkáně (39). Tato metabolická změna ale není provázena zhoršením aterogenního lipidového profilu. Závěrem lze konstatovat, že přestože obezita představuje klíčový rizikový faktor kardiovaskulárních onemocnění, tak u RA existují některé paradoxní vztahy mezi obezitou, lipidovým profilem nebo úmrtím z kardiovaskulárních příčin.
Role adipokinů u revmatoidní artritidy
Tuková tkáň představuje dynamický endokrinní orgán produkující řadu prozánětlivých cytokinů, např. TNF-α, IL-1 nebo IL-6, které, jak je známo, hrají významnou roli v patogenezi RA, a množství další specifických bioaktivních molekul, takzvaných adipokinů (40). Termín adipokiny označuje jejich syntézu v adipocytech. Není tak divu, že byly původně studovány u komplikací obezity, kdy tento výzkum začal v roce 1994 objevením leptinu. V posledních 10 letech bylo zjištěno, že adipokiny jsou syntetizovány v jiných tkáních a účastní se funkcí, které nemají pouze vztah k tukové tkáni. Adipokiny mohou přispívat k celkovému zánětlivému stavu u metabolických a kardiovaskulárních onemocnění, a jsou doklady o jejich roli také u zánětlivých revmatických onemocnění (41). V současné době je známo více než 50 různých adipokinů, přehled nejdůležitějších je uveden v tabulce 1.
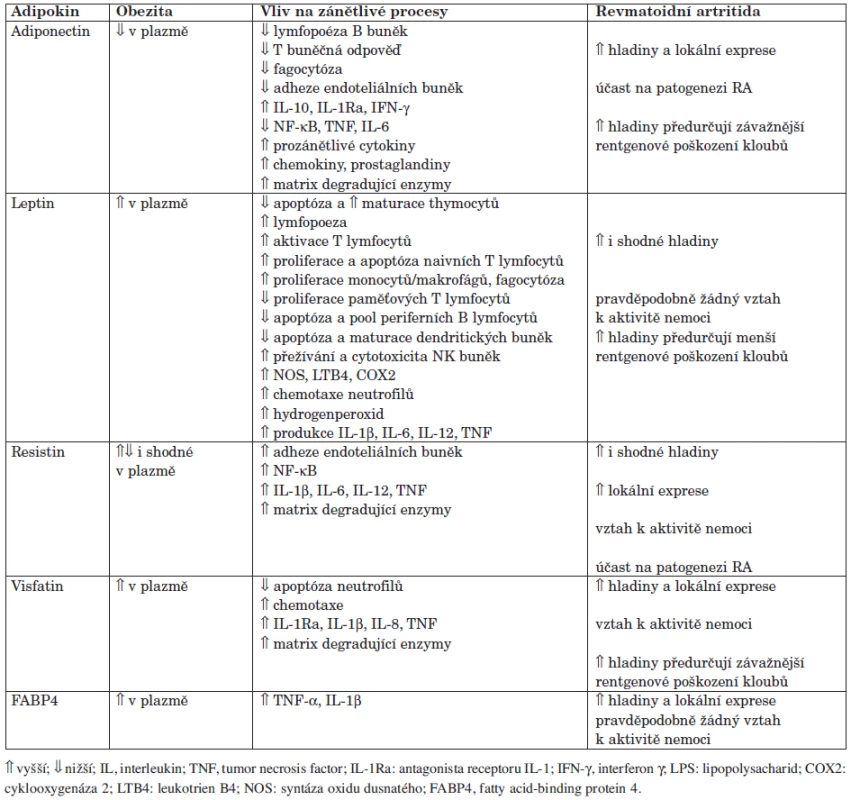
Leptin je malý peptidový hormon syntetizovaný převážně adipocyty. Je součástí regulace příjmu potravy a energetické bilance – přes hypotalamické receptory snižuje chuť k jídlu a zvyšuje energetický výdej. Cirkulující hladiny leptinu jsou vyšší u obézních pacientů a jsou přímo úměrné množství tukové tkáně, což ukazuje na rezistenci cílových buněk k účinkům leptinu (42). Exprese leptinu je stimulována při akutní infekci nebo zánětu, leptin navíc stimuluje syntézu prozánětlivých cytokinů a podílí se na polarizaci Th1 lymfocytů (43). U pacientů s RA byly prokázány jak zvýšené plazmatické i lokální koncentrace leptinu v synoviální tekutině (44, 45), tak srovnatelné systémové koncentrace s kontrolními jedinci (46). Leptin má přímý vztah k BMI, ale ne k aktivitě nemoci a není ovlivněn TNF-α blokující léčbou (46). Zvýšené hladiny leptinu reflektují menší rentgenové poškození kloubů u RA, přičemž tento vztah neplatí při korekci hladin leptinu k BMI (27). Naše práce prokázala zvýšení syntézy leptinu v podkožním tuku po TNF-α blokující léčbě u pacientů s RA, což bylo asociováno se zlepšením zánětlivé aktivity a mohlo by podporovat výše uvedené zjištění (47). Na druhé straně se ale v posledních letech ukazuje, že zvýšené množství leptinu může představovat molekulární vysvětlení vlivu obezity na závažnost a progresi osteoartrózy (48).
Adiponectin je protein produkovaný také převážně adipocyty, má protizánětlivé, insulin-senzitizující a antiaterogenní účinky. Přestože je produkován tukovou tkání, jeho systémové koncentrace významně klesají u obézních jedinců a po redukci hmotnosti se opět zvyšují (49). Na druhé straně u jedinců s RA jsou hladiny adiponectinu v cirkulaci i synoviální tekutině zvýšené (27, 45, 46, 50). Stejně tak je zvýšená exprese adiponectinu v synoviální tkáni RA pacientů (51). Působením na imunitní a rezidentní buňky synoviální membrány přispívá adiponectin k regulaci chemotaxe, aktivaci zánětu a destrukci kloubu (51). Mezi koncentracemi adiponectinu a rentgenovým poškozením kloubů byl u RA popsán negativní vztah (25). Pacienti s vysokými koncentracemi adiponectinu mají navíc zvýšené riziko rentgenové progrese onemocnění (26), což může vysvětlit molekulární podstatu asociace obezity s menší mírou strukturální progrese RA, jak je uvedeno výše.
Resistin byl poprvé identifikován v tukové tkáni experimentálních myší a byl dlouho považován za mediátor inzulinové rezistence u obezity. Evidence tohoto vztahu u lidí je již méně jasná, resistin je totiž u lidí syntetizován převážně buňkami imunitního systému a předpokládá se jeho hlavní role v zánětlivých procesech (52). My jsme poprvé popsali zvýšené množství resistinu v séru, synoviální membráně a synoviální tkáni pacientů s RA v porovnání s kontrolními jedinci (53). Resistin je tvořen makrofágy, dendritickými buňkami, B-lymfocyty a plazmatickými buňkami synoviální membrány. Pozorovali jsme také pozitivní korelaci mezi hladinami resistinu, zánětlivou a klinickou aktivitou nemoci. Tento vztah byl dále potvrzen a bylo navíc zjištěno, že hladiny resistinu klesají po TNF-α blokující léčbě (54). Exprese resistinu je indukována v zánětlivém prostředí, a resistin je pak zpětnovazebně schopen stimulovat produkci sebe samého a dalších klíčových prozánětlivých cytokinů, například TNF-α, IL-6, IL-1β. Resistin po přímé aplikaci do kloubu laboratorním myším navozuje leukocytární infiltraci a hyperplazii synoviální membrány s destruktivním postižením kloubu (55). Lze tak předpokládat, že resistin hraje důležitou roli v patogenezi RA.
Visfatin je nedávno popsaný adipokin s inzulino-mimetickými vlastnostmi, je tvořen tukovou tkání, ale i buňkami imunitního systému (56). U RA bylo popsáno zvýšené množství visfatinu v séru, synoviální tekutině a synoviální membráně (57). Byl popsán pozitivní vztah visfatinu k aktivitě nemoci (57), což nebylo potvrzeno všemi autory (58, 59). Nebyl pozorován pokles visfatinu po TNF-α blokující léčbě (58), nicméně v naší nedávné práci jsme pozorovali pozitivní korelaci zvýšených sérových hladin visfatinu s počtem periferních B-lymfocytů u pacientů s RA a jeho významný pokles po léčbě rituximabem (58). Visfatin stimuluje tvorbu prozánětlivých cytokinů a matrixových metaloproteináz, jinými slovy má schopnost indukovat patologické procesy vedoucí k zánětu a destrukci kloubů u RA (57). V souladu s těmito vlastnostmi byl u RA nedávno popsán přímý vztah vyšších hladin visfatinu k rentgenovému poškození kloubů (27 ). Visfatin je tak možné považovat za další kandidátní molekulu pro cílenou terapii RA, což bylo s pozitivním výsledkem vyzkoušeno na experimentálním modelu artritidy (59). Nicméně není stále jasné, jaké metabolické konsekvence by mohlo mít zablokování vybraných adipokinů u lidí.
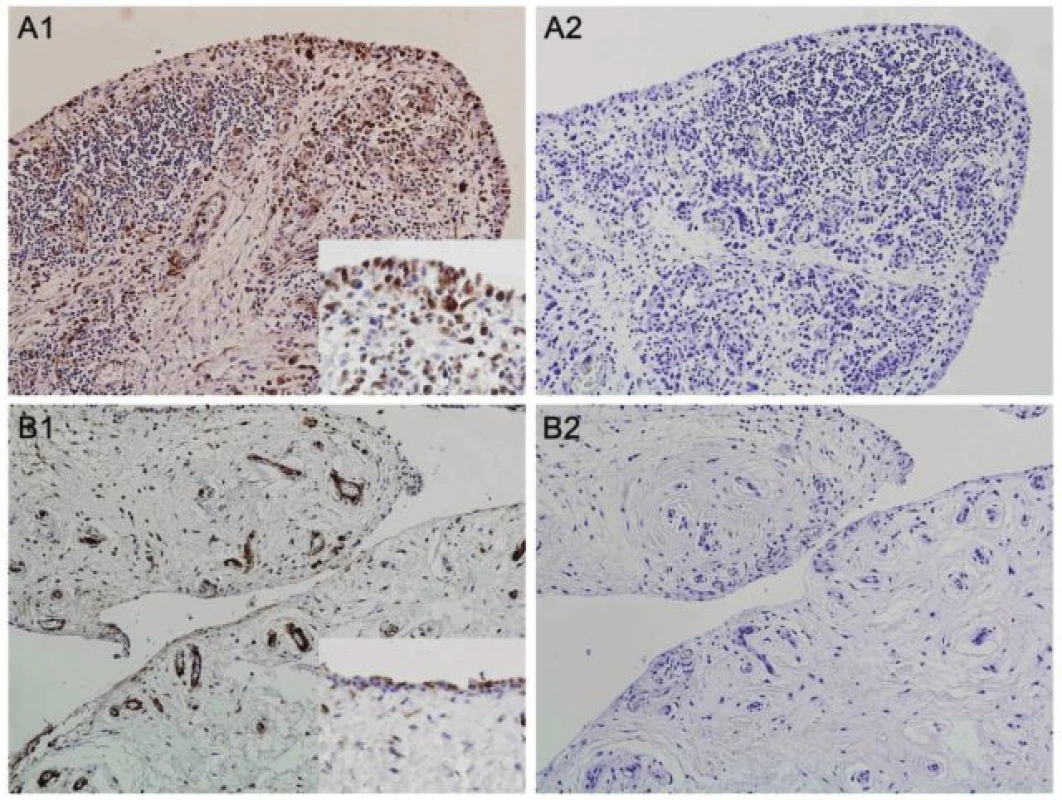
U revmatoidní artritidy byly studovány i některé další nově identifikované adipokiny, například naše pracovní skupina poprvé popsala vaspin a omentin u RA (60). Dále jsme prokázali významně zvýšené hladiny proteinu vázajícího mastné kyseliny-4 (FABP4) v séru a synoviální tekutině pacientů s RA v porovnání s kontrolními jedinci s osteoartrózou. FABP4 je asociován s inzulinovou rezistencí, diabetem mellitus a kardiovaskulárními chorobami (61). V naší pilotní práci jsme pozorovali zvýšenou expresi FABP4 v synoviální membráně pacientů s RA oproti kontrolní skupině s OA (obr. 3). Sérové hladiny FABP4 nekorelovaly s aktivitou nemoci, ale odrážely aterogenní profil pacientů s RA. Na podkladě této práce lze předpokládat, že zvýšené množství FABP4 může představovat molekulární mechanismus spojující zánět a zvýšené riziko kardiovaskulárních komplikací u RA. Nedávno bylo totiž prokázáno, že zvýšené množství FABP4 u nemocných s ischemickou chorobou představuje prognosticky nezávislý rizikový faktor zvýšeného výskytu kardiovaskulárních příhod (62).
Závěr
Revmatoidní artritida je chronické systémové zánětlivé onemocnění, které je provázeno úbytkem svalové hmoty a větším množstvím tukové tkáně. Tento stav se označuje jako sarkopenická obezita a je způsoben chronickým zánětem a nedostatkem pohybu při kloubním postižení. Shrnutí literatury z posledních let ukazuje několik protichůdných poznatků. Závěrem můžeme konstatovat, že obezita pravděpodobně nezvyšuje riziko vzniku RA, nicméně vyšší porodní hmotnost může predisponovat ke vzniku RA v dospělém věku a nelze ale vyloučit, že obezita představuje rizikový faktor pro vznik séronegativní RA. Obézní pacienti s RA mají obvykle vyšší aktivitu nemoci a horší kvalitu života, ale na druhé straně méně kloubního poškození a pomalejší strukturální progresi. U pacientů s RA je dvojnásobně zvýšené riziko výskytu kardiovaskulárních onemocnění v porovnání s běžnou populací. Podle dostupných epidemiologických studií se zdá, že kardiovaskulární riziko není u RA přímo závislé na výši indexu BMI, překvapivě více ohroženou skupinou jsou velmi hubení pacienti. U obézních pacientů lze ale očekávat horší léčebnou odpověď, jak bylo nedávno prokázáno u obézních pacientů s RA, kteří vykazovali nižší účinnost infliximabu, přestože tato léčba je upravována podle hmotnosti (63). Obezita tak ovlivňuje několik aspektů RA, jejichž patofyziologická podstata není přesně známa. Tuková tkáň a buňky imunitního systému produkují adipokiny, biologicky aktivní proteiny, které mohou na molekulární úrovni představovat spojení mezi patogenezí obezity, metabolických onemocnění a revmatoidní artritidy. Pro pacienty s RA je důležitá správná volba terapeutických opatření, která by měla být zaměřena na maximální potlačení zánětu a zároveň také zvýšení tělesné aktivity.
Poděkování: Tato práce vznikla za podpory grantového projektu IGA MZ ČR NR/10620-3
Doc. MUDr. Ladislav Šenolt, PhD
Revmatologický ústav
Na Slupi 4
12850 Praha 2
e-mail: seno@revma.cz
Zdroje
1. Ebrahim S, Taylor F, Ward K, Beswick A, Burke M, Davey Smith G. Multiple risk factor interventions for primary prevention of coronary heart disease. Cochrane Database Syst Rev 2011;(1):CD001561.
2. Gabriel SE. Heart disease and rheumatoid arthritis: understanding the risk. Ann Rheum Dis 2010;69(Suppl) :i61–4.
3. World Health Organisation. Obesity: preventing andmanaging the global epidemic. Report of a WHO Consultation. World Health Organ Tech Rep Ser 2000;894:i– xii:1–253.
4. Summers GD, Metsios GS, Stavropoulos-Kalinoglou A, Kitas GD. Rheumatoid cachexia and cardiovascular disease. Nat Rev Rheumatol 2010;6:445-51.
5. Summers GD, Deighton CM, Rennie MJ, Booth AH. Rheumatoid cachexia: a clinical perspective. Rheumatology (Oxford) 2008;47:1124-31.
6. Bartfai T, Waalen J, Buxbaum JN. Adipose tissue as a modulator of clinical inflammation: does obesity reduce the prevalence of rheumatoid arthritis? J Rheumatol 2007;34(3):488-92.
7. Stavropoulos-Kalinoglou A, Metsios GS, Koutedakis Y et al. Redefining overweight and obesity in rheumatoid arthritis patients. Ann Rheum Dis 2007;66:1316–21.
8. Armstrong DJ, McCausland EM, Quinn AD, Wright GD. Obesity and cardiovascular risk factors in rheumatoid arthritis. Rheumatology 2006;45:782.
9. Giles JT, Ling SM, Ferrucci L, Bartlett SJ, Andersen RE, Towns M, et al. Abnormal body composition phenotypes in older rheumatoid arthritis patients: association with disease characteristics and pharmacotherapies. Arthritis Rheum 2008;59:807-15.
10. Rajbhandary R, Khezri A, Panush RS. Rheumatoid cachexia: what is it and why is it important? J Rheumatol 2011;38:406-8.
11. Rall LC, Roubenoff R. Rheumatoid cachexia: metabolic abnormalities, mechanisms and interventions. Rheumatology (Oxford). 2004;43:1219-23.
12. Rho YH, Chung CP, Solus JF, Raggi P, Oeser A, Gebretsadik T, et al. Adipocytokines, insulin resistance, and coronary atherosclerosis in rheumatoid arthritis. Arthritis Rheum 2010;62:1259-64.
13. Cutolo M. Androgens in rheumatoid arthritis: when are they effectors? Arthritis Res Ther 2009;11:126.
14. Symmons DP, Bankhead CR, Harrison BJ et al. Blood transfusion, smoking, and obesity as risk factors for the development of rheumatoid arthritis: results from a primary care-based incident case-control study in Norfolk, England. Arthritis Rheum 1997;40:1955–61.
15. van der Helm-van Mil AH, van der Kooij SM, Allaart CF, Toes RE, Huizinga TW. A high body mass index has a protective effect on the amount of joint destruction in small joints in early rheumatoid arthritis. Ann Rheum Dis 2008;67:769-74.
16. Pedersen M, Jacobsen S, Klarlund M, Pedersen BV, Wiik A, Wohlfahrt J, et al. Environmental risk factors differ between rheumatoid arthritis with and without auto-antibodies against cyclic citrullinated peptides. Arthritis Res Ther 2006;8(4):R133.
17. Mandl LA, Costenbader KH, Simard JF, Karlson EW. Is birthweight associated with risk of rheumatoid arthritis? Data from a large cohort study. Ann Rheum Dis 2009;68:514-8.
18. Stavropoulos-Kalinoglou A, Metsios GS, Panoulas VF, Nevill AM, Jamurtas AZ, Koutedakis Y, et al. Underweight and obese states both associate with worse disease activity and physical function in patients with established rheumatoid arthritis. Clin Rheumatol 2009;28(4):439-44.
19. Garcia-Poma A, Segami MI, Mora CS, Ugarte MF, Terrazas HN, Rhor EA, et al. Obesity is independently associated with impaired quality of life in patients with rheumatoid arthritis. Clin Rheumatol 2007; 26:1831-5.
20. Kaufmann J, Kielstein V, Kilian S, Stein G, Hein G. Relation between body mass index and radiological progression in patients with rheumatoid arthritis. J Rheumatol 2003;30:2350-5.
21. Westhoff G, Rau R, Zink A. Radiographic joint damage in early rheumatoid arthritis is highly dependent on body mass index. Arthritis Rheum 2007;56:3575-82.
22. Baker JF, George M, Baker DG, Toedter G, Von Feldt JM, Leonard MB. Associations between body mass, radiographic joint damage, adipokines and risk factors for bone loss in rheumatoid arthritis. Rheumatology (Oxford) 2011;50:2100-7.
23. Stavropoulos-Kalinoglou A, Metsios GS, Koutedakis Y, Kitas GD. Obesity in rheumatoid arthritis. Rheumatology (Oxford). 2011;50:450-62
24. Gómez R, Conde J, Scotece M, Gómez-Reino JJ, Lago F, Gualillo O. What’s new in our understanding of the role of adipokines in rheumatic diseases? Nat Rev Rheumatol 2011;7:528-36.
25. Giles JT, Allison M, Bingham CO 3rd, Scott WM Jr, Bathon JM. Adiponectin is a mediator of the inverse association of adiposity with radiographic damage in rheumatoid arthritis. Arthritis Rheum 2009;61:1248-56.
26. Giles JT, van der Heijde DM, Bathon JM. Association of circulating adiponectin levels with progression of radiographic joint destruction in rheumatoid arthritis. Ann Rheum Dis 2011;7:1562-8.
27. Rho YH, Solus J, Sokka T, Oeser A, Chung CP, Gebretsadik T, et al. Adipocytokines are associated with radiographic joint damage in rheumatoid arthritis. Arthritis Rheum 2009;60:1906-14.
28. Kozera L, Andrews J, Morgan AW. Cardiovascular risk and rheumatoid arthritis—the next step: differentiating true soluble biomarkers of cardiovascular risk from surrogate measures of inflammation. Rheumatology (Oxford). 2011;50(11):1944-54.
29. Gremese E, Ferraccioli G. The metabolic syndrome: the crossroads between rheumatoid arthritis and cardiovascular risk. Autoimmun Rev 2011;10:582-9.
30. Gonzalez A, Maradit Kremers H, Crowson CS, Ballman KV, Roger VL, Jacobsen SJ, et al. Do cardiovascular risk factors confer the same risk for cardiovascular outcomes in rheumatoid arthritis patients as in non-rheumatoid arthritis patients? Ann Rheum Dis 2008;67(1):64-9.
31. John H, Toms TE, Kitas GD. Rheumatoid arthritis: is it a coronary heart disease equivalent? Curr Opin Cardiol 2011;26(4):327-33.
32. Wolfe F, Michaud K. The risk of myocardial infarction and pharmacologic and nonpharmacologic myocardial infarction predictors in rheumatoid arthritis: a cohort and nested case-control analysis. Arthritis Rheum 2008;58(9): 2612-21.
33. Escalante A, Haas RW, del Rincón I. Paradoxical effect of body mass index on survival in rheumatoid arthritis: role of comorbidity and systemic inflammation. Arch Intern Med 2005;165(14):1624-9.
34. Naranjo A, Sokka T, Descalzo MA, Calvo-Alén J, HŅrslev-Petersen K, Luukkainen RK, et al; QUEST-RA Group. Cardiovascular disease in patients with rheumatoid arthritis: results from the QUEST-RA study. Arthritis Res Ther 2008;10(2):R30.
35. Greenberg JD, Furer V, Farkouh ME. Cardiovascular safety of biologic therapies for the treatment of RA. Nat Rev Rheumatol. 2011;8:13-21.
36. Atzeni F, Turiel M, Caporali R, Cavagna L, Tomasoni L, Sitia S, et al. The effect of pharmacological therapy on the cardiovascular system of patients with systemic rheumatic diseases. Autoimmun Rev 2010;9:835-9.
37. Giles JT, Allison M, Blumenthal RS, Post W, Gelber AC, Petri M, et al. Abdominal adiposity in rheumatoid arthritis: association with cardiometabolic risk factors and disease characteristics. Arthritis Rheum 2010;62(11):3173-82.
38. Engvall IL, Tengstrand B, Brismar K, Hafström I. Infliximab therapy increases body fat mass in early rheumatoid arthritis independently of changes in disease activity and levels of leptin and adiponectin: a randomised study over 21 months. Arthritis Res Ther 2010;12(5):R197.
39. Fantuzzi G. Adipose tissue, adipokines, and inflammation. J Allergy Clin Immunol 2005;115:911-9.
40. Gómez R, Conde J, Scotece M, Gómez-Reino JJ, Lago F, Gualillo O. What’s new in our understanding of the role of adipokines in rheumatic diseases? Nat Rev Rheumatol 2011;7(9):528-36.
41. Stofkova A. Leptin and adiponectin: from energy and metabolic dysbalance to inflammation and autoimmunity. Endocr Regul 2009;43:157-68.
42. Batra A, Okur B, Glauben R, Erben U, Ihbe J, Stroh T, et al. Leptin: a critical regulator of CD4+ T-cell polarization in vitro and in vivo. Endocrinology. 2010;151:56-62.
43. Bokarewa M, Bokarew D, Hultgren O, Tarkowski A. Leptin consumption in the inflamed joints of patients with rheumatoid arthritis. Ann Rheum Dis 2003;62:952–6.
44. Otero M, Lago R, Gomez R, Lago F, Dieguez C, Gómez-Reino JJ, et al. Changes in plasma levels of fat-derived hormones adiponectin, leptin, resistin and visfatin in patients with rheumatoid arthritis. Ann Rheum Dis 2006;65:1198–201.
45. Popa C, Netea MG, de Graaf J, van den Hoogen FH, Radstake TR, Toenhake-Dijkstra H, et al. Circulating leptin and adiponectin concentrations during tumor necrosis factor blockade in patients with active rheumatoid arthritis. J Rheumatol. 2009;36:724-30.
46. Šenolt L, Kuklová M, Cerezo LA, Hulejová H, Filková M, Bošanská L, et al. Adipokine profile is modulated in subcutaneous adipose tissue by TNFαinhibitors in patients with rheumatoid arthritis. Ann Rheum Dis 2011;70:2054-6.
47. Stannus OP, Jones G, Quinn SJ, Cicuttini FM, Dore D, Ding C. The association between leptin, interleukin-6, and hip radiographic osteoarthritis in older people: a cross-sectional study. Arthritis Res Ther 2010;12(3):R95.
48. Haluzík M, Parízková J, Haluzík MM. Adiponectin and its role in the obesity-induced insulin resistance and related complications. Physiol Res 2004;53(2):123-9.
49. Senolt L, Pavelka K, Housa D, Haluzík M. Increased adiponectin is negatively linked to the local inflammatory process in patients with rheumatoid arthritis. Cytokine 2006;35:247-52.
50. Frommer KW, Zimmermann B, Meier FM, Schröder D, Heil M, Schäffler A, et al. Adiponectin-mediated changes in effector cells involved in the pathophysiology of rheumatoid arthritis. Arthritis Rheum 2010;62:2886-99.
51. Filková M, Haluzík M, Gay S, Senolt L. The role of resistin as a regulator of inflammation: Implications for various human pathologies. Clin Immunol 2009;133:157-70.
52. Senolt L, Housa D, Vernerová Z, Jirásek T, Svobodová R, Veigl D, Anderlová K, et al. Resistin in rheumatoid arthritis synovial tissue, synovial fluid and serum. Ann Rheum Dis 2007;66:458-63.
53. Gonzalez-Gay MA, Garcia-Unzueta MT, Gonzalez-Juanatey C, Miranda-Filloy JA, Vazquez-Rodriguez TR, De Matias JM, et al. Anti-TNF-alpha therapy modulates resistin in patients with rheumatoid arthritis. Clin Exp Rheumatol 2008;26:311-6.
54. Bokarewa M, Nagaev I, Dahlberg L, Smith U, Tarkowski A. Resistin, an adipokine with potent proinflammatory properties. J Immunol 2005;174:5789-95.
55. Moschen AR, Kaser A, Enrich B, Mosheimer B, Theurl M, Niederegger H, et al. Visfatin, an adipocytokine with proinflammatory and immunomodulating properties. J Immunol 2007;178:1748–58.
56. Brentano F, Schorr O, Ospelt C, Stanczyk J, Gay RE, Gay S, et al. Pre-B cell colonyenhancing factor/visfatin, a new marker of inflammation in rheumatoid arthritis with proinflammatory and matrix-degrading activities. Arthritis Rheum 2007;56:2829–39.
57. Gonzalez-Gay MA, Vazquez-Rodriguez TR, Garcia-Unzueta MT, Berja A, Miranda-Filloy JA, de Matias JM, et al. Visfatin is not associated with inflammation or metabolic syndrome in patients with severe rheumatoid arthritis undergoing anti-TNF-alpha therapy. Clin Exp Rheumatol 2010;28:56-62.
58. Senolt L, Kryštůfková O, Hulejová H, Kuklová M, Filková M, Cerezo LA, et al. The level of serum visfatin (PBEF) is associated with total number of B cells in patients with rheumatoid arthritis and decreases following B cell depletion therapy. Cytokine 2011;55:116-21.
59. Busso N, Karababa M, Nobile M, Rolaz A, Van Gool F, Galli M, et al. Pharmacological inhibition of nicotinamide phosphoribosyltransferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD. PLoS One 2008;3(5):e2267.
60. Senolt L, Polanská M, Filková M, Cerezo LA, Pavelka K, Gay S, et al. Vaspin and omentin: new adipokines differentially regulated at the site of inflammation in rheumatoid arthritis. Ann Rheum Dis 2010;69:1410-1.
61. Makowski L, Brittingham KC, Reynolds JM, Suttles J, Hotamisligil GS. The fatty acid-binding protein, aP2, coordinates macrophage cholesterol trafficking and inflammatory activity. Macrophage expression of aP2 impacts peroxisome proliferator-activated receptor χ and I@ kinase activities. J Biol Chem 2005; 280:12888-12895.
62. Peeters W, de Kleijn DP, Vink A, van de Weg S, Schoneveld AH, Sze SK, et al. Adipocyte fatty acid binding protein in atherosclerotic plaques is associated with local vulnerability and is predictive for the occurrence of adverse cardiovascular events. Eur Heart J 2011;32:1758-68.
63. Klaasen R, Wijbrandts CA, Gerlag DM, Tak PP. Body mass index and clinical response to infliximab in rheumatoid arthritis. Arthritis Rheum 2011;63:359-64.
Štítky
Dermatológia Detská reumatológia ReumatológiaČlánok vyšiel v časopise
Česká revmatologie

2012 Číslo 2
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Význam hydratace při hojení ran
- Výhody subkutánně podávaného methotrexátu
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
Najčítanejšie v tomto čísle
- Raynaudův fenomén a periferní ischemické syndromy
- Doporučení České revmatologické společnosti pro léčbu dnavé artritidy
- Obezita, tuková tkáň a kardiovaskulární riziko u revmatoidní artritidy
- Ultrazvukové skórovací indexy při hodnocení aktivity revmatoidní artritidy
