-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mykofenolát mofetil v léčbě systémového lupus erythematodes
Myocophenolate mofetil in the treatment of systemic lupus erythematosus
Systemic lupus erythematosus is a systemic autoimmune disease with multiple organ manifestations and serologic abnormalities. The spectrum of clinical manifestations is wide, varying from mild symptoms to potentially lethal conditions with irreversible organ damage. Organ involvement determines the morbidity and mortality of patients and the type of therapy. The most common involvement includes lupus nephritis, which occurs in 15–60% of patients, and leads to chronic renal failure in up to 47% of patients. Currently, a two-stage treatment of lupus nephritis is recommended: an intensive induction phase to induce remission followed by the maintenance phase to maintain remission.
In a case report of a female patient with systemic lupus erythematosus with multiple organ involvement – (lupus nephritis, vasculitis, ocular and hematologic involvement, pericarditis) and high antibody activity (positive antinuclear antibodies, anti-dsDNA, anti-C1q, ANCA and anti-nucleosome antibodies), the issues of therapy associated with intolerance and adverse effects of standard treatment are discussed. In recent years, mycophenolate mofetil has been demonstrated to play a significant role in the treatment of lupus nephritis in patients with systemic lupus erythematosus. In many cases mycophenolate mofetil can successfully replace the existing therapy.Key words:
Systemic lupus erythematosus, lupus nephritis, mycophenolate mofetil
Autoři: R. Svobodová; M. Sokalská Jurkiewicz; J. Hořínková
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 21, 2013, No. 3, p. 140-146.
Kategorie: Přehledný článek a kazuistika
Souhrn
Systémový lupus erythematodes je systémové autoimunitní onemocnění s četnými orgánovými manifestacemi a sérologickými abnormalitami. Spektrum klinických manifestací je široké, kolísající od jemných příznaků k potenciálně letálním stavům s ireverzibilním orgánovým postižením. Orgánové postižení určuje morbiditu a mortalitu pacientů a typ terapie. Mezi nejčastější patří lupusová nefritida, která se vyskytuje u 15–60 % nemocných a až ve 47 % vede k chronickému renálnímu selhání. V současné době je doporučována dvoufázová terapie lupusové nefritidy, nejprve intenzivní indukční fáze k navození remise, poté udržovací fáze k udržení dosažené remise.
Na případu pacientky se systémovým lupus erythematodes s mnohočetným orgánovým postižením – lupusová nefritida, vaskulitida, oční a hematologické postižení, perikarditida – a s vysokou protilátkovou aktivitou (pozitivita antinukleárních protilátek, anti-dsDNA, anti-C1q protilátek, antinukleosomálních a ANCA protilátek) je zpracována problematika terapie při netoleranci a nežádoucích účincích této standardní léčby. V posledních letech se ukazuje, že významnou roli v léčbě lupusové nefritidy u pacientů se systémovým lupusem hraje mykofenolát mofetil a v mnoha případech může stávající terapii s úspěchem nahradit.Klíčová slova:
Systémový lupus erythematodes, lupusová nefritida, mykofenolát mofetilÚvod
Systémový lupus erythematodes je systémové autoimunitní onemocnění, které postihuje především mladé ženy v reprodukčním věku. Jedná se o závažné onemocnění, které postihuje celou řadu orgánů – kůži, klouby, ledviny, srdce, plíce, CNS a další. Postižení ledvin je poměrně často zastoupené, lupusová nefritida (LN) je běžnou a závažnou komplikací SLE, vyskytuje se u 15–60 % nemocných v USA a Evropě a až ve 45–86% v Japonsku (1–3), u dětských nemocných se vyskytuje v 80 %. Těžké formy lupusové nefritidy (fokální proliferativní glomerulonefritida (GN) a difúzní proliferativní GN) a kombinace fokální proliferativní a membranózní GN jsou podstatně závažnější a zvyšují morbiditu a mortalitu pacientů se SLE a vyžadují použití účinných léčebných postupů imunosupresivními léky. Pacienti s těžkými formami LN mají až 47% pravděpodobnost vzniku chronického renálního selhání (4). V posledních 10 letech proběhla řada randomizovaných klinických studií s různými imunosupresivními léky, které výrazně zlepšily výsledky léčby pacientů se SLE s těžkou LN (5). Byl přijat návrh dvoufázové terapie – intenzivní indukční fáze (nověji vstupní) a méně intenzivní udržovací fáze (nověji následná) s léky užívanými v transplantologii a onkologii. Sekvenční dvoufázová terapie má za cíl dosažení remise LN v 1. fázi, ve 2. fázi pak tuto remisi upevnit, udržet nebo předejít relapsu LN vedoucímu k chronickému ledvinnému onemocnění (CHRI) a minimalizovat toxicitu ostatních podávaných léků. Hlavními prediktory relapsu LN jsou: vysoká aktivita SLE, zvýšená proteinurie, buněčné válce v močovém sedimentu, mužské pohlaví, mladší věk, hypertenze, prodleva v nasazení terapie, dlouhá doba do dosažení remise a pouze částečná odpověď na léčbu (tab. 1), (6–10).
Tab. 1. Prediktory relapsu LN (6–10) 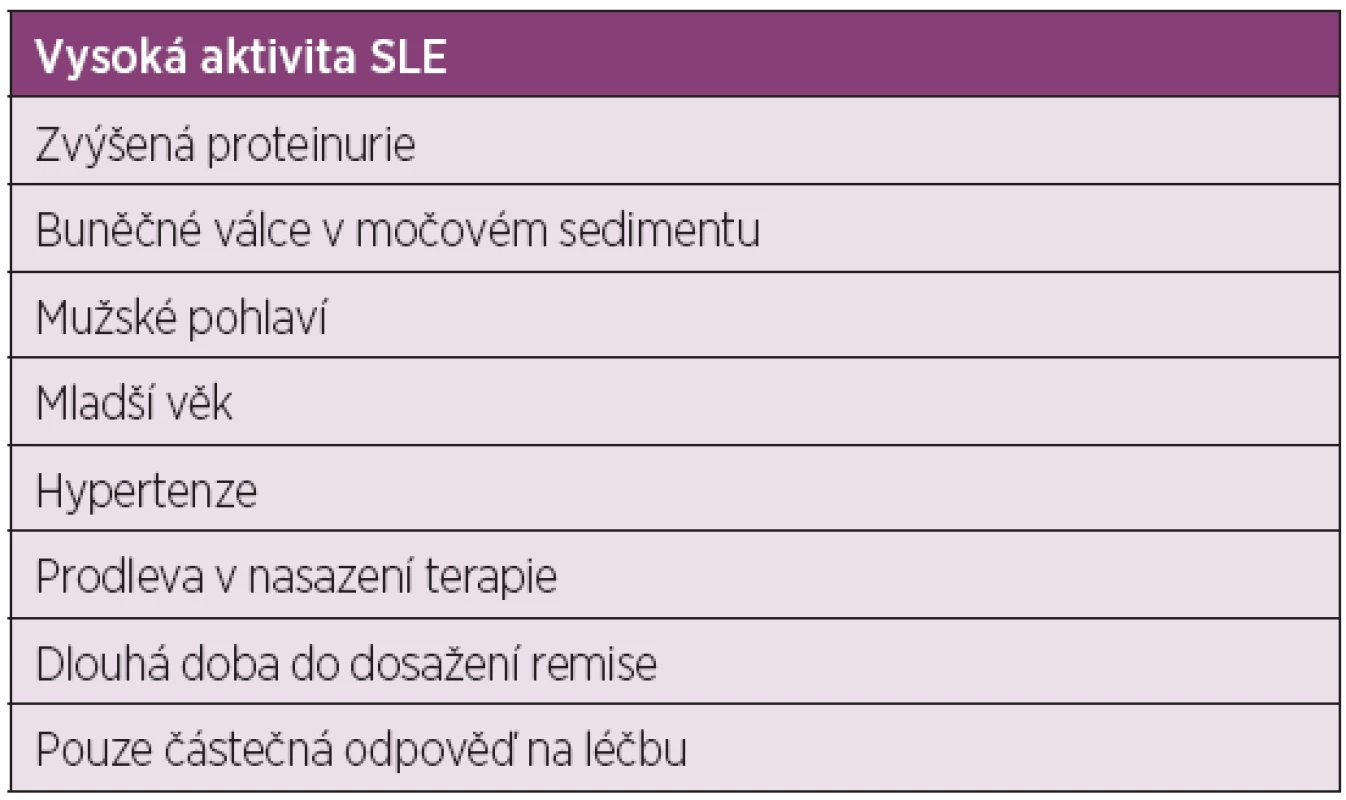
V 70.–90. letech byly porovnávány terapeutické režimy různých léčebných přípravků s glukokortikoidy (GK) oproti podávání samotných GK (11–15). Tyto studie dokázaly, že nejúčinnější je dlouhodobé podávání cyklofosfamidu, který snižuje vznik CHRI na 0–25 % a úmrtí na 11–15 % u pacientů se SLE a těžkou LN. Ale dlouhodobá léčba je zatížena výskytem nežádoucích účinků (tab. 2), mladé ženy měly vysoký výskyt trvalé amenorhey (29–71 %).
Tab. 2. Nežádoucí účinky cyklofosfamidu při i.v. podání 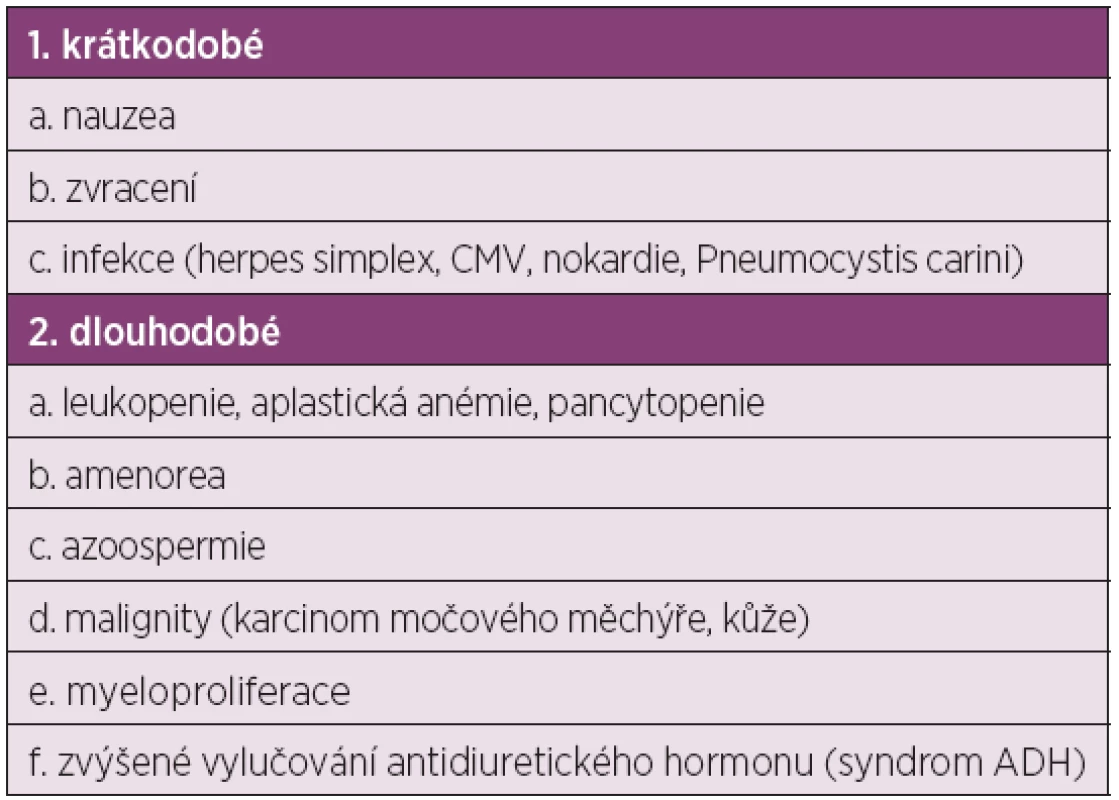
KAZUISTIKA
Padesátiletá pacientka měla v roce 2008 diagnostikovaný histologicky ověřený diskoidní kožní lupus. Současně trpěla anémií a leukopenií, ale nebyly přítomny žádné autoprotilátky. V červnu 2010 byla ambulantně vyšetřena v Revmatologickém ústavu pro celkové zhoršení stavu – astenii, dekompenzovanou hypertenzi, tachykardii a vaskulitické změny na horních i dolních končetinách. V imunologii byla již nalezena pozitivita antinukleárních protilátek, anti-dsDNA, anti-C1q protilátek, antinukleosomálních a ANCA protilátek. Pacientce byla doporučena hospitalizace, na kterou se ale dostavila až téměř za rok, v květnu 2011 z důvodu péče o svého postiženého syna. V té době si již stěžovala na vertigo, které ji znemožňovalo pohyb mimo domov, bolesti kloubů, hlavy, výraznou únavu a zhoršení zraku, bolest defektů na horních i dolních končetinách.
Objektivně byla astenická až kachektická, měla četné defekty na prstech rukou a nohou s tendencí k hnisání až k nekrotizaci (obr. 1, 2), těžce dekompenzovanou hypertenzi 240/120 mm Hg.
Obr. 1. Nekrotické změny na rukou, stav před léčbou 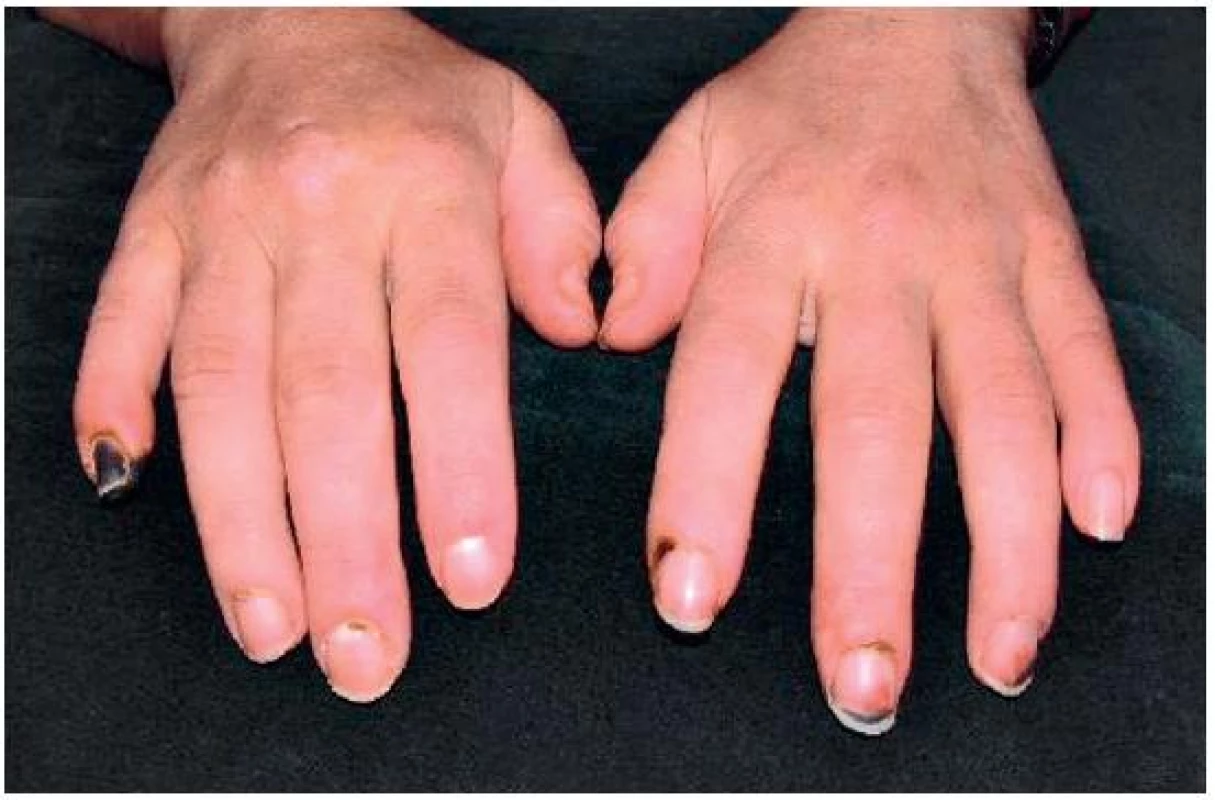
Obr. 2. Nekrotické změny na II. prstu PDK, stav před léčbou 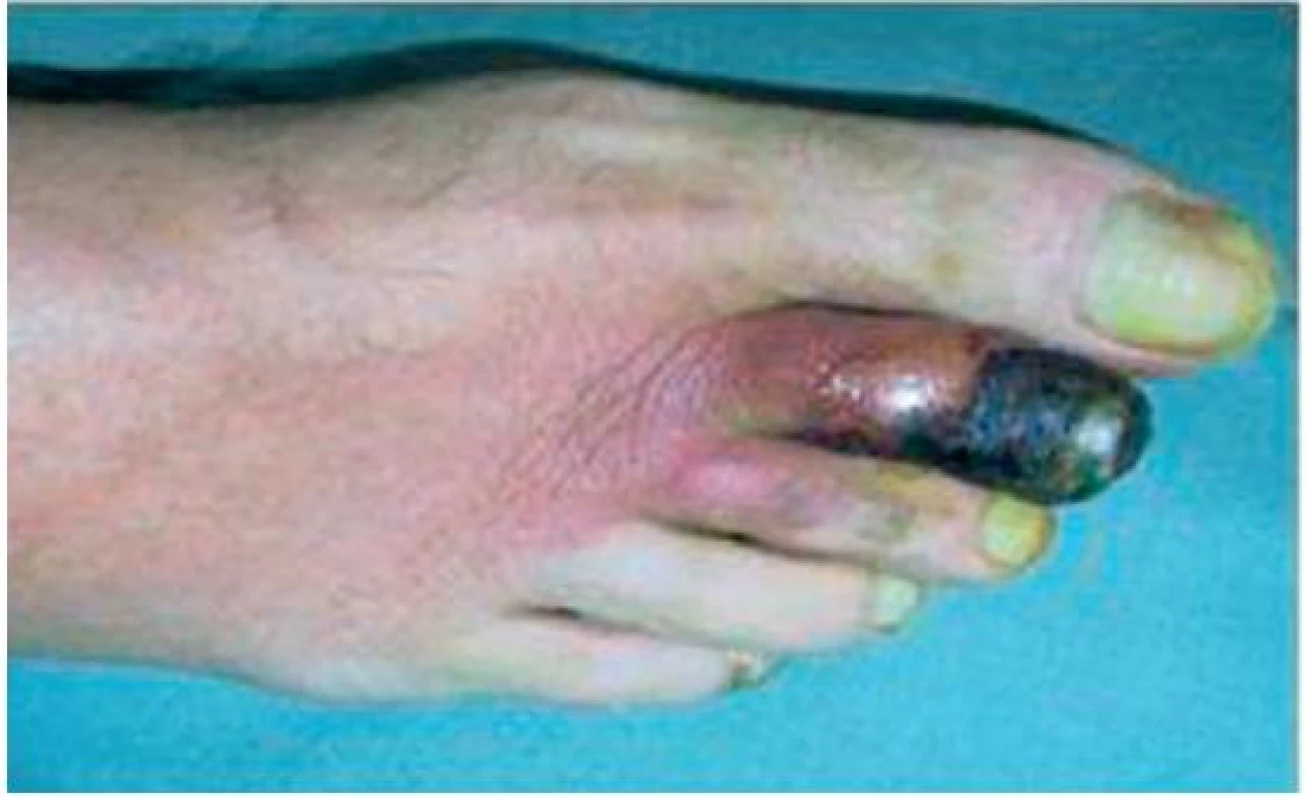
V laboratoři byla vysoká sedimentace erytrocytů 88/100, v krevním obraze anémie (Hb 96 g/l; Hct: (0,298), leukopenie (2,9 x 109l), trombocytopenie (121 x 109l) lymfocytopenie (0,4 x 109l). V biochemii byly nálezy svědčící pro katabolický stav – hyponatremie, snížená celková bílkovina, nízká hladina albuminu, urey, železa, vitaminu D. V imunologii byl nález pozitivity antinukleárních protilátek (ANA 1 : 640), anti-dsDNA (1 : 320), anti kardiolipinových protilátek IgG (12,6 U/ml), anti SmB, anti-histonů antinukleosomálních protilátek 357,5 UI/ml, anti C1q protilátek 298,2 U/ml anti La, pozitivity ANCA IF 1 : 320, ANCA ELISA – PR3 protilátek (12,4 U/ml). V moči byla přítomna velká proteinurie 2,18 g/24h.
Pacientka byla vyšetřena orgánově. Rentgenologické vyšetření plic prokázalo difuzní zmnožení plicního intersticia, ale vyšetření computerovou tomografií s vysokou rozlišovací schopností (HRCT) intersticiální plicní postižení nepotvrdilo, echokardiografie prokázala perikardiální výpotek. Při vyšetření gastrointestinálního traktu byla diagnostikována hepatosplenomegalie a počínající portální hypertenze. Velmi důležitý a závažný byl výsledek očního vyšetření, kde byl popsán výrazný edém na makule, v oblasti makuly a nazálně při papile četnější bělavá vatovitá ložiska a hemorhagie. Nález retinopatie tedy plně podporoval diagnózu systémového lupusu erythematodes (obr. 3). Vzhledem k proteinurii byla indikována renální biopsie s nálezem lupusové nefritidy, dle ISN/RPS class V. Současně byla nalezena i segmentární sklerotizace, která mohla být součástí pokročilé nebo opakovaných atak membranózní glomerulonefritidy (MGN), stejně jako reziduí po atace class III. Závěr byl tedy lupusová nefritida typu V a suspektní III. Pacientka tedy bohatě splnila kritéria pro diagnózu systémového lupusu erythematodes a vzhledem k renálnímu postižení byla indikována terapie cyklofosfamidem (CFA) dle protokolu Euro-Lupusu, ale bez počátečních aplikací pulsního metylprednisolonu pro dekompenzovanou hypertenzi. Kortikoidy byly podány perorálně v dávce 1 mg/kg denně. 1. puls cyklofosfamidu v dávce 500 mg proběhl bez komplikací, po 2. pulsu měla pacientka febrilie, infekci horních cest dýchacích, výraznou leukopenii, bylo tedy nutno podat profylakticky chemoterapeutikum Biseptol. Také jsme prodloužili podání dalšího pulsu CFA na 3 týdny, ale po jeho 3. aplikaci došlo k těžké hypersenzitivní reakci (hyperpyrexie, hypotenze, tachykardie, průjem, celková schvácenost), pro kterou musela být pacientka přeložena na jednotku intenzivní péče. Další podání cyklofosfamidu bylo tedy kontraindikováno a vyvstala otázka další terapie.
Obr. 3. Edém makuly, vatovitá ložiska 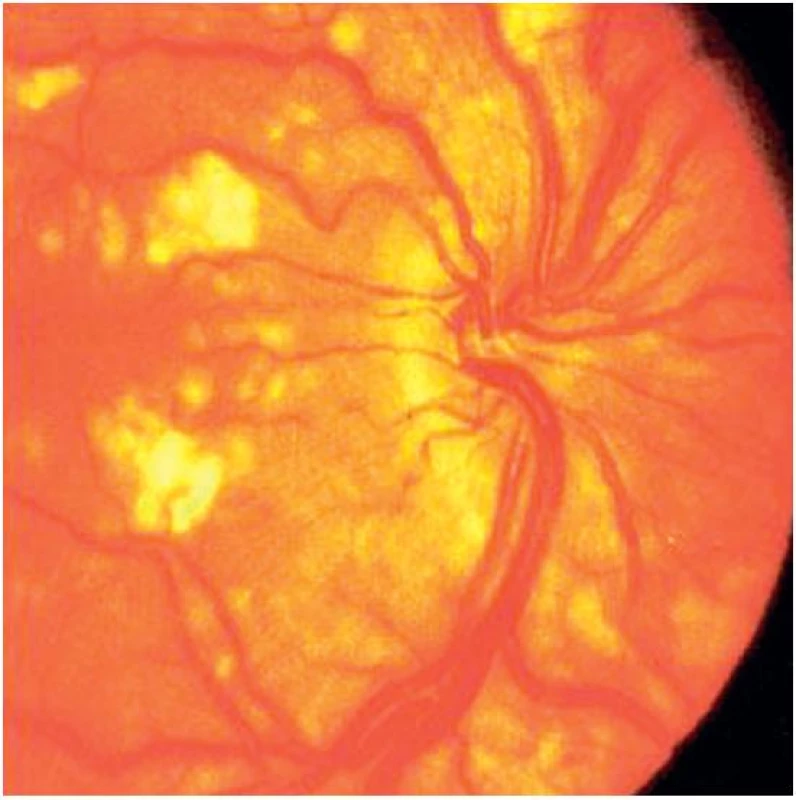
Vzhledem k dalším komplikacím (vaskulitida, oční postižení) jsme se rozhodli podávat mykofenolát mofetil (MMF), proto jsme zažádali zdravotní pojišťovnu o jeho zvláštní úhradu. Po jeho schválení jsme zahájili jeho podávání v dávce 1 000 mg denně s postupným navýšením do dávky 2 500 mg denně. Po 6 měsících bylo možno dávku snížit na 2 000 mg denně a současně jsme též postupně detrahovali dávku glukokortikoidů (GK). V současné době nemá pacientka žádné projevy kožní vaskulitidy (obr. 4), zlepšil se nález na očním pozadí, makuly jsou bez edému, došlo ke zlepšení vízu, poklesla proteinurie na 0,60g/24h. Došlo k úplné úpravě krevního obrazu, poklesu reaktantů akutní fáze, snížila se autoprotilátková aktivita (ANA 320; anti-dsDNA je negativní; Anti-C1q 190,3 U/ml; anti-nukleosomy 182,9 UI/ml, negativita ANCA protilátek IF i ELISA), zvýšila se hodnota komplementu C3 0,85 g/l. Pacientka mykofenolát mofetil velmi dobře toleruje a nemá po něm žádné komplikace. Je schopna se starat o svého postiženého syna.
Obr. 4. Stav po amputaci distálního článku II. prstu PDK 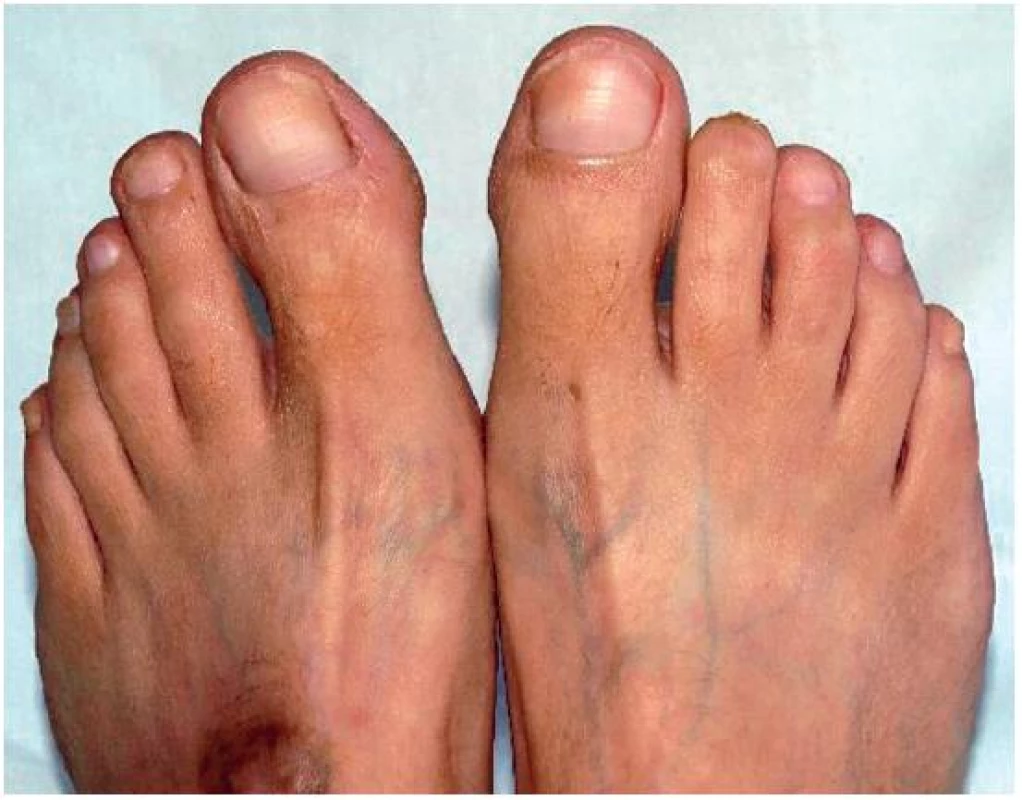
DISKUSE
Mykofenolát mofetil je inhibitor syntézy purinů inhibicí inosin-5'-monofosfát dehydrogenázy. Tím potlačuje syntézu purinových nukleosidů a má tedy cytostatický efekt na T a B lymfocyty. V roce 1995 byl schválen v USA pro prevenci akutní rejekce transplantátu u pacientů, kteří dostali allogenní transplantát ledvin, srdce nebo jater (16). U nás je v této indikaci v kombinaci s cyklosporinem a kortikosteroidy podáván od roku 1996.
V 70.–90. letech minulého století byl v léčbě lupusové nefritidy nejčastěji používán intravenózní cyklofosfamid v kombinaci s GK, který byl jednoznačně nejúčinnější (13). Snižoval výskyt chronické renální insuficience až na 0–25 %, úmrtnost na 11–15 %. Jeho nevýhodou je ale vysoký výskyt amenorhey u mladých nemocných – až 29–71 %. Proto v posledních 20 letech začala být zkoušena v této indikaci i jiná imunosupresiva a cytostatika včetně mykofenolátu mofetilu a byla porovnávána jejich bezpečnost a účinnost ať už k navození remise nebo jako udržovací terapie.
Od roku 2002, kdy byly publikovány výsledky studie Houssiau a kol., u pacientů s lupusovou nefritidou, která porovnávala vysoké a nízké dávky intravenózně podávaného CFA s následně podávaným azathioprinem (AZA), byla zahájena terapie lupusové nefritidy dle protokolu Euro-Lupus na základě závěrů této studie, která je používána dosud (17, 18). Tato léčba spočívá v tom, že pacienti jsou nejprve léčeni 3 pulsy metylprednisolonu v dávce 750 mg i.v., poté dostávají ve 14denních intervalech 500 mg cyklofosfamidu i.v. a současně jsou podávány glukokortikoidy perorálně v dávce 0,5 mg/kg/den s postupnou detrakcí po 4 týdnech. Po ukončení aplikace pulsů CFA následuje podávání azathioprinu v dávce 2 mg/kg/den do dosažení remise LN (tab. 3).
Tab. 3. Protokol Euro-Lupus terapie LN 
Ne všichni pacienti však mohou být léčeni tímto schématem, řada nemocných vykazuje nežádoucí účinky ať už po CFA, tak i po AZA nebo tyto léky netoleruje. Proto v posledních 10 letech se začal významnou měrou uplatňovat i mykofenolát mofetil.
V pětileté studii Contrerase a kol., publikované v roce 2004 u pacientů se SLE a s LN III. a IV. typu, byl k indukční terapii použit intravenózní CFA, v udržovací terapii pak porovnáván MMF proti azathioprinu a i.v. podávanému CFA á 3 měsíce. Bylo prokázáno, že indukční terapie i.v. CFA s následným podáváním perorálního MMF nebo AZA je účinnější a bezpečnější než dlouhodobá aplikace i.v. CFA. Pravděpodobnost relapsu byla nižší u skupiny MMF (15 %) než u AZA (32 %) a i.v. CFA (40 %). Výskyt amenorhey byl nejnižší po MMF (6 % vs. 8 % vs. 32 %) a závažné infekce byly pozorovány signifikantně méně po MMF a AZA (2 %) než po i.v. CFA (25 %). Tato studie jako první prokázala, že udržovací léčba za použití MMF nebo AZA po krátkodobé indukční léčbě i.v. CFA je účinnou a bezpečnou alternativou terapie u vysoce rizikových pacientů se SLE (19).
Ve studiích Chana a kol. u asijských pacientů s LN IV. typu byl k indukční terapii použit MMF ve srovnání s p.o. podáním CFA po dobu 6 měsíců, jako udržovací terapie pak MMF proti AZA. U MMF bylo dosaženo stejného počtu remisí a vzniku relapsu ve srovnání s CFA, ale byla u něj pozorována nižší mortalita, méně infekčních komplikací a nižší vznik amenorhey. V udržovací terapii byl po MMF ve srovnání s AZA pozorován signifikantně nižší výskyt leukopenie (0 % x 26 %) a infekcí (13 % x 40 %) (20, 21).
V roce 2009 byly publikovány výsledky indukční fáze randomizované kontrolované studie (ALMS) u pacientů s LN třídy III–V. K indukční léčbě byl použit MMF s cílovou dávkou 3 g denně (dosažená 2,6 g/den) nebo 6 pulsů CFA 0,5–1,0 g/m2 v měsíčních intervalech. Terapeutická odpověď byla dosažena u srovnatelného (56 % vs. 53 %) počtu pacientů, kompletní remise bylo dosaženo v obou větvích jen u 8 % pacientů. V obou skupinách byl stejný výskyt nežádoucích účinků včetně infekcí. Mykofenolát i cyklofosfamid byl srovnatelně účinný u bělošské a asijské populace, u Afroameričanů a Hispánců byl výrazně účinnější mykofenolát (22).
Další důležitou studií byla studie MAINTAIN Nephritis Trial, jejíž výsledky byly publikovány Houssiauem a kol. v roce 2010. Byly do ní zařazení pacienti s LN III., IV. i V. typu po dobu 4 let. Jako indukční terapie byl použit CFA v dávce 500 mg i.v. každých 14 dní, celkem 6 pulsů. V udržovací terapii byla srovnávána účinnost a bezpečnost MMF 2g/den a AZA 2 mg/kg/den. Při srovnání primárních a sekundárních cílů – udržení remise LN, zvýšení hladiny sérového kreatininu, výskytu mortality, těžkého systémového relapsu SLE – nebyly zjištěny statisticky významné rozdíly mezi oběma přípravky. Kromě signifikantního vyššího výskytu cytopenie po AZA (23 % x 3,8 %) nebyly ani rozdíly ve výskytu nežádoucích účinků. Rozdíl ve výskytu relapsu LN byl pouze 6 % ve prospěch MMF (23).
Tyto studie měly rozdílný design, ve studii ALMS byl více než dvojnásobný počet pacientů, ale obě potvrdily, že MMF je signifikantně lepší než AZA v prevenci selhání terapie a ve studii ALMS byl MMF také signifikantně lepší než AZA v prevenci renálního relapsu. V obou studiích byla incidence renálního relapsu při podávání udržovací terapie AZA podobná (23,9 % vs. 25 %), ačkoli míra renálních relapsů po MMF byla nižší v ALMS (12,9 %) než v MAINTAIN (19 %). Bylo to zřejmě tím, že pacienti ve studii MAINTAIN byli převážně bílé rasy, kdežto ve studii ALMS byly větší rasové rozdíly s velkým poměrem pacientů hispánského původu (29).
Nejnovější v loňském roce publikovanou prací s MMF byla studie (Dooley a spol., ALMS skupina) u pacientů s LN III., IV. a V. typu. Zde byl porovnáván v indukční terapii MMF proti i.v. CFA po dobu 6 měsíců, v udržovací terapii MMF a AZA po dobu 36 měsíců. Výsledky hovoří ve prospěch MMF proti AZA v selhání terapie (16,4 % vs. 32,4 %), vzniku renálního relapsu (12,9 % vs. 23,9 %) a nutnosti nasazení záchranné medikace (7,8 % vs. 17,1 %) u pacientů, kteří odpověděli na indukční terapii. Byl také zaznamenán nižší výskyt nežádoucích účinků ve skupině pacientů s MMF (23,5 %) než ve skupině s AZA (33,3 %). Došlo ale k nesignifikantnímu zvýšení selhání terapie u pacientů, kteří dostávali MMF jako indukční terapii proti CFA (24).
V poslední době je též snaha o léčbu systémového lupus erythematodes pomocí biologické terapie, která cíleně zasahuje do imunopatogeneze onemocnění. Účinnost a bezpečnost MMF u lupusové nefritidy byla porovnávána s rituximabem (RTX), což je chimérická monoklonální protilátka proti antigenu CD20 B-buněk, která způsobuje apoptózu a depleci B-buněk. Ve dvojitě slepé, placebem kontrolované studii LUNAR, jejíž výsledky byly publikované v letošním roce, byl RTX podáván současně s MMF a GK pacientům s LN III. nebo IV. typu. Rituximab signifikantně zvyšoval hladinu C3 a C4 složky komplementu a snižoval hladinu anti-ds-DNA protilátek. Závažné nežádoucí účinky včetně infekcí byly stejné v obou skupinách, ve skupině s rituximabem byl vyšší výskyt neutropenie, leukopenie a hypotenze. Nebyly zjištěny žádné významné rozdíly v navození remise LN (26).
Dále byla provedena systematická analýza 300 pacientů s LN III., IV. a V. typu, kteří dostávali rituximab společně s GK a MMF. Bylo zjištěno, že RTX efektivně navozuje remisi LN u pacientů, kteří nedosáhli remise po standardní terapii, u pacientů s LN III. typu v 87 %, IV. typu v 76 % a V. typu v 67 % (27).
Rituximab by tedy mohl být rezervou pro pacienty s refrakterní LN nebo s intolerancí CFA a MMF (28).
Na základě výsledků těchto studií se ukazuje, že MMF může být použit jako lék první volby v dlouhodobé udržovací terapii po dosažení remise CFA nebo MMF. Snižuje výskyt chronické renální insuficience na méně než 7 %, mortalitu na méně než 10 % a výskyt relapsu LN na 4–40 %. MMF je účinný i v indukční terapii, kompletní remise je dosahováno až u 62 % pacientů (29). Oproti AZA je po něm nižší výskyt cytopenie.
K dnešnímu dni nejsou údaje, jak dlouho podávat udržovací terapii, nicméně je doporučeno, že může být podávána neustále u pacientů, s rizikovými faktory pro vývoj chronické renální insuficience, tak jako je africký původ, hispánská příslušnost, mladý věk, biopsie se srpky v glomerulech, nedostatečná kompletní remise se stále zvýšenou hladinou sérového kreatininu nebo signifikantní proteinurií, přetrvávající elevace antifosfolipidových protilátek, trvale nízká hladina C3 složky komplementu a časté relapsy (tab. 4) (30). Je uznávané, že pacienti by měli být v době vysazení udržovací léčby léčeni minimálně pět let a v trvalé remisi dva roky, vysazení by mělo být prováděno velmi opatrně za častých klinických i laboratorních kontrol (31). Velkou nevýhodou MMF je jeho vysoká cena.
Tab. 4. Rizikové faktory pro vývoj chronické renální insuficience (25) 
Kromě léčby SLE a lupusové nefritidy je MMF v poslední dekádě a nejvíce v posledních dvou letech s úspěchem zkoušen k léčbě některých dalších systémových onemocnění pojiva, zvláště jejich komplikací a řady jiných onemocnění (tab. 5) (32–43).
Tab. 5. Další úspěšná léčba MMF (27 – 37) 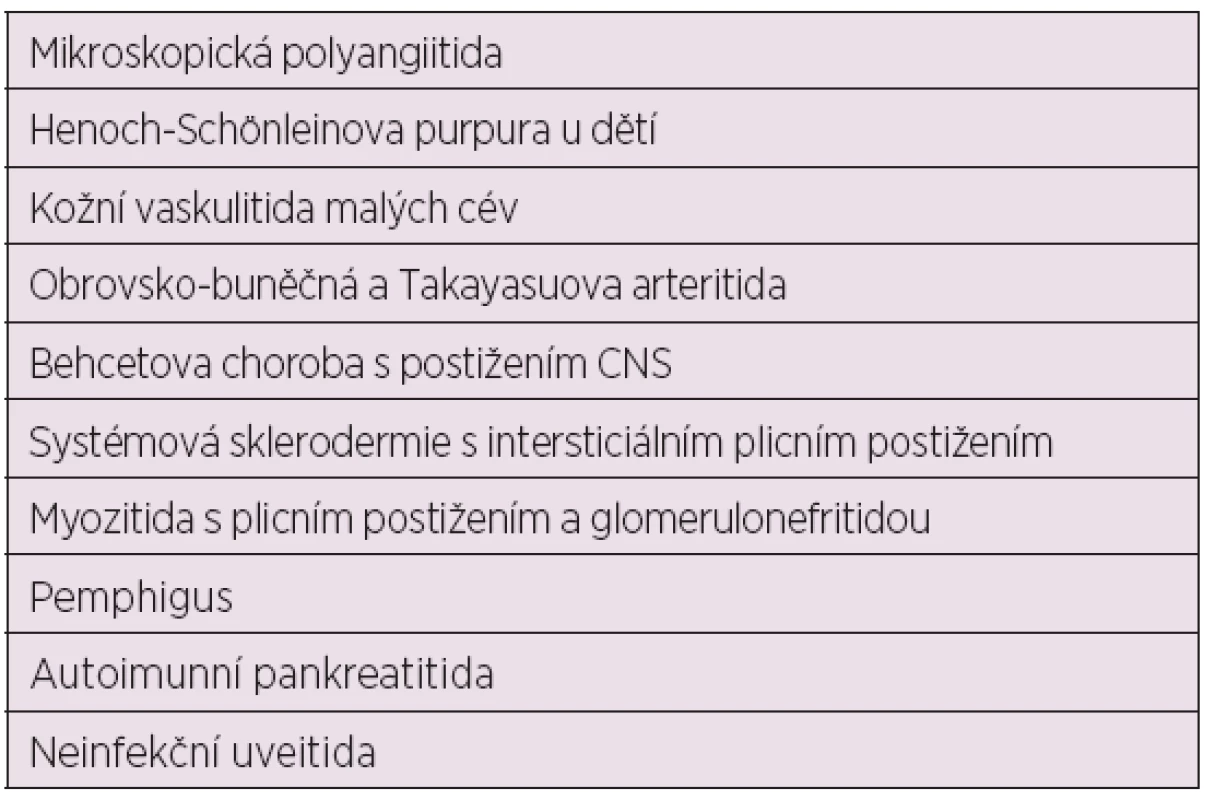
ZÁVĚR
Můžeme tedy používat mykofenolát mofetil jako lék první volby? V našich podmínkách jen s velkými obtížemi, protože léčba systémového lupusu a lupusové nefritidy není v indikačních kritériích tohoto léku a jedná se o velmi drahý lék. Proto musíme nejprve léčit jinými doporučenými imunosupresivy a teprve po selhání jejich účinku či při jejich netoleranci nebo vzniku nežádoucích účinků, musíme požádat zdravotní pojišťovnu o zvláštní úhradu pro mykofenolát mofetil. Je velkým přínosem pro pacienty se SLE s LN, je to velmi cenná alternativa jak v indukční, tak udržovací terapii.
Ale i ve světě je stále používán cyklofosfamid. Je to proto, že změny v praxi po zavedení nových terapií nebo technologií jsou obvykle postupné, dlouhodobá data pro pacienty léčených MMF (6 a 3 roky) jsou ve srovnání s CFA krátká (13–18 let) (11, 12)
Dále je stále málo dat na účinnost MMF ve srovnání s CFA pro nejtěžší formy LN (rychle progredující LN, srpkovité nekrotizující léze). Také přece jen došlo k nesignifikantnímu zvýšení selhání terapie u pacientů, kteří dostávali MMF jako indukční terapii oproti CFA (23). A konečně výsledky studií podporují geografické a rasové rozdíly v míře reakce na indukční terapii MMF oproti CFA pro LN, kdy MMF je účinnější u Hispánců a Afroameričanů než u bělošské populace (26).
Aby mohl být považován za standardní lék první volby pro těžkou LN pro svůj příznivý profil účinnosti i bezpečnosti nad i.v. podávaným cyklofosfamidem, zejména u žen v reprodukčním věku a u neasijských pacientů, je potřeba dalších klinických hodnocení v různých geografických podmínkách, na různých rasách po řadu měsíců. Tím by mohl MMF upevnit svoji roli jako preferovaného léku v první linii pro indukční a udržovací léčbu těžké LN.
Tato publikace vznikla za podpory výzkumných záměrů MZ ČR č. 000 000 23728
Adresa pro korespondenci:
MUDr. R. Svobodová, CSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Yokoyama H, Okuyama H, Yamaya H. Clinicopathological insights into lupus glomerulonephritis in Japanese and Asians. Clin Exp Nephrol 2011;15 : 321-30.
2. Seligman VA, Lum RF, Olson JL et al. Demographic differences in the development of lupus nephritis: A retrospective analysis. Am J Med 2002;112 : 726-9.
3. Bastian HM, Roseman JM, McGwin G Jr et al. LUMINA Study Group. LUpus in MInority populations: NAture vs nurture: Systemic lupus erythematosus in three ethnic groups. XII. Risk factors for lupus nephritis after diagnosis. Lupus 2002;11 : 152-60.
4. Contreras G, Pardo V, Cely C et al. Factors associated with poor outcomes in patients with lupus nephritis. Lupus 2005;14 : 890-5.
5. Dooley MA, Falk RJ. Human clinical trials in lupus nephritis. Semin Nephrol 2007;27 : 115-27.
6. Moroni G, Quaglini S, Maccario M et al. „Nephritis flares“ are predictors of bad long-term renal outcome in lupus nephritis. Kidney Int 1996;50 : 2047-53.
7. Pablos JL, Gutierrez-Millet V, Gomez-Reino JJ. Remission of lupus nephritis with cyclophosphamide and late relapses following therapy withdrawal. Scand J Rheumatol 1994;23 : 142-4.
8. Hebert LA, Dillon JJ, Middendorf DF et al. Relationship between appearance of urinary red blood cell/white blood cell casts and the onset of renal relapse in systemic lupus erythematosus. Am J Kidney Dis 1995;26 : 432-8.
9. Ciruelo E, de la Cruz J, López I et al. Cumulative rate of relapse of lupus nephritis after successful treatment with cyclophosphamide. Arthritis Rheum 1996;39 : 2028-34.
10. Illei GG, Takada K, Parkin D et al. renal flares are common in patients with severe proliferative lupus nephritis treated with pulse immunosuppressive therapy: Long-term follow up of a cohort of 145 patients participating in randomized controlled studies. Arthritis rheum 2002;46 : 995-1002.
11. Austin HA 3rd, Klippel JH, Balow JE et al. Therapy of lupus nephritis. Controlled trial of prednison and cytotoxic drugs. N Engl J Med 1986;314 : 614-9.
12. Steinberg AD, Steinberg SC. Long-term preservation of renal function in patients with lupus nephritis receiving treatment that includes cyclophosphamide versus those treated with prednisone only. Arthritis Rheum 1991;34 : 945-50.
13. Boumpas DT, Austin HA 3rd, Vaughan EM et al. Controlled trial of pulse methyl-prednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis. Lancet 1992;340 : 741-5.
14. Gourley MF, Austin HA 3rd, Scott D et al. Methylprednisolone and cyclophosphamide, alone or in combination, in patients with lupus nephritis. A randomized, controlled trial. Ann Intern Med 1996;125 : 549-57.
15. Boumpas DT, Austin 3rd, Vaughan EM et al. Risk for sustained amenorrhea in patients with systemic lupus erythematosus receiving intermittent pulse cyclophosphamide therapy. Ann Intern med 1993;119 : 366-9.
16. González-Rivera TC, McCune J. Mycophenolate mofetil for the induction and maintenance treatment of lupus nephritis. Immunotherapy 2011;3 : 1431-40.
17. Houssiau FA, Vasconcelos C, D´Cruz D et al. Immunosuppressive therapy in lupus nephritis: the Euro-Lupus Nephritis Trial, a randomized trial of low-dose versus high-dose intravenous cyclophosphamide. Arthritis Rheum 2002;46 : 2121-31.
18. Houssiau FA, Vasconcelos C, D´Cruz D et al. Early response to immunosuppressive therapy predicts good renal outcome in lupus nephritis: lessons from long-term followup of patients in the Euro-Lupus Nephritis Trial. Arthritis Rheum 2004;50 : 3934-40.
19. Contreras G, Pardo V, Leclercq B et al. Sequential therapies for proliferative lupus nephritis. N Engl J Med 2004;350 : 971-80.
20. Chan TM, Li FK, Tang CS et al. Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis. N Engl J Med 2000;343 : 1156-1162.
21. Chan TM, Tse KC, Tang CS et al. Long-term study of mycophenolate mofetil as continuous induction and maintenance treatment for diffuse proliferative lupus nephritis. J Am Soc Nephrol 2005;16 : 1076-84.
22. Appel GB, Contreras G, Dooley MA et al. Mycophenolate Mofetil versus Cyclophasphamide for Induction Treatment of Lupus Nephritis. J Am Soc Nephrol 2009;20 : 1103-12.
23. Houssiau FA, D´Cruz D, sangle S et al. MAINTAIN Nephritis Trial Group: Azathioprine versus mycophenolate mofetil for long-term immunosuppression in lupus nephritis: Result from the MAINTAIN Nephritis Trial. Ann Rheum Dis 2010;69 : 2083-9.
24. Dooley MA, Jayne D, Ginzler EM et al.; ALMS Group: Mycophenolate versus azathioprine as maintenance therapy for lupus nephritis. N Engl J Med 2011;365 : 1886-95.
25. Merrill J, Buyon J, Furie R et al. Assessment of flares in lupus patiens enrolled in a phase II/III study of rituximab (EXPLORER). Lupus 2011;20 : 709-16.
26. Rovin BH, Furie R, Latinis K, et al. LUNAR Investigator Group. Efficacy and safety of rituximab in patients with active proliferative lupus nephritis: the lupus nephritis assessment with rituximab study. Arthritis Rheum. 2012;64 : 1215-26.
27. Weidenbusch M, Römmele C, Schröttle A, Anders HJ. Beyond the LUNAR trial. Efficacy of rituximab in refraktory lupus nephritis. Nephrol Dial Transplant 2012;Jul 3. [Epub ahaed of print]
28. Tesar V, Hruskova Z. Recent news in the treatment of lupus nephritis. 2012 Aug;103 : 235-51.
29. Lenz O, Waheed AA, Baig A et al. Lupus Nephritis: Maintenance Therapy for Lupus Nephritis – Do We Now Have a Plan? Clin J Am Nephrol 8 : 2012 ePress.
30. Mok CC. Prognostic factors in lupus nephritis. Lupus 2005;14 : 39-44.
31. Tesař V. Novinky v léčbě proliferativní lupusové nefritidy. Novinky v nefrologii. Září 2010; Ročník VIII, číslo 4.
32. Hogan J, Schwenk M, Radhakrishanan J. Should mycophenolate mofetil replace cyclophosphamide as first-line therapy for severe lupus nephritis? Kidney International advance online publication, 30 May 2012)
33. Han F, Liu G, Zhang X et al. Effects of mycophenolate mofetil combined with corticosteroids for induction therapy of microscopic polyangiitis. Am J Nephrol 2011;33 : 185-92.
34. Du Y, Hou L, Zhao C et al. Treatment of children with Henoch-Schönlein purpura nephritis with mycophenolate mofetil. Pediatr Nephrol 2012;27 : 765-71.
35. Haeberle MT, Adams WB, Callen JP. Treatment of Severe Cutaneous Small-Vessel Vasculitis With Mycophenolate Mofetil. Arch dermatol 2012;148 : 887-8.
36. Kötter I, Henes JC, Wagner AD et al. Does glucocorticosteroid-resistant large-vessel vasculitis (giant cell arteritis and Takayasu arteritis) exist and how can remission be achieved? Critical review of the literature. Clin Exp Rheumatol 2012;30 : 114-29.
37. Shugaiv E, Tüzün E, Mutlu M et al. Mycophenolate mofetil as a novel immunosuppressant in the treatment of neuro-Behcet´s disease with parenchymal involvement: presentation of four cases. Clin Exp Rheumatol 2011;29 : 64-7.
38. Tzouvelekis A, Galanopoulos N, Bouros E et al. Effect and safety of Mycophenolate Mofetil or Sodium in Systemic Sclerosis-Associated Interstitial Lung Disease: A Meta-Analysis. Pulmonary medicine 2012
39. Aggarwal R, Oddis CV. Terapeutic advances in myositis. Curr Opin Rheumatol 2012;Epub
40. Owlia MB, Hemayati R, Zahir ST et al. Dermatomyositis Sine Myositis with Membranoproliferative Glomerulonephritis. Case Report Rheumatol 2012;Epub
41. Tsuruta D, Ishii N, hashimoto T. Diagnosis and treatment of pemphigus. Immunotherapy 2012;4 : 735-45.
42. Sodikoff JB, Keilin SA, Cai Q. Mycophenolate mofetil for maintenance of remission in steroid-dependent autoimmune pancreatitis. World J Gastroenterol 2012;18 : 2287-90.
43. Klisovic DD. Mycophenolate mofetil use in the treatment of noninfectious uveitis. Dev Ophthalmol 2012;51 : 57-62.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2013 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Prof. MUDr. Jiří Vencovský, DrSc., slaví 60 let
- Zemřel prof. MUDr. Ctibor Dostál, DrSc.
- Doporučení ČRS pro léčbu nemocných se SLE
- Zdravím podmíněná kvalita života u pacientů s revmatoidní artritidou v průběhu prvního roku anti-TNF léčby (hodnocení dotazníkem SF-36 a srovnání se vzorkem všeobecné populace České republiky) – výsledky z registru biologické léčby ATTRA
- Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
- Abstrakta přednášek z X. slapského sympozia o problémech revmatologie, rehabilitace a revmatochirurgie
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení ČRS pro léčbu nemocných se SLE
- Prof. MUDr. Jiří Vencovský, DrSc., slaví 60 let
- Zemřel prof. MUDr. Ctibor Dostál, DrSc.
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



