-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
18F-FDG PET and PET/CT examination in patients with giant cell arteritis – a practical view from a PET center
Giant cell arteritis (GCA) is a systemic vasculitis of large arteries, which affects older people, more frequently women. Febrile illness with elevation of nonspecific laboratory markers of inflammation (ESR, CRP) may be the first symptom of this disease. In such a condition an FDG PET (PET/CT) examination can be performed due to a wider differential diagnosis. Findings of high FDG uptake in the aorta and large arteries, especially those originating from the aortic arch, are relatively uniform and typical of GCA, even at a stage when structural changes of the arteries have not developed yet. Involvement of temporal artery can be visualized using hybrid PET/CT scanners, yet rather in isolated cases. FDG uptake in the walls of large arteries can be also used to assess the disease activity (both remission and possible relapse), furthermore, this finding correlates with laboratory evidence of disease activity (ESR, CRP). Although PET (PET/CT) examination is frequently used for primary diagnosis and monitoring of disease activity, these examinations are not considered standard. Herein, we present 4 patients using visual documentation. In these patients, PET (PET/CT) examination was used for primary diagnosis, and is compared with the CT angiography or MR angiography. In 2 patients, histological verification is presented. In 3 out of 4 patients, further course of the disease was monitored by PET examination as well.
Key words:
Giant cell arteritis, temporal arteritis, large vessel vasculitis, PET, PET/CT
Autori: Z. Řehák 1,2; Z. Fojtík 3; L. Fryšáková 4; J. Šimíková 5; I. Kielkowská 6; P. Němec 7; E. Eberová 8; Obrovská M Křivanová 3; J. Staníček 1; J. Eremiášová 1; J. Vašina 1; D. Řeháková 9; M. Šnelerová 10; T. Tichý 11; L. Křen 12
Pôsobisko autorov: Oddělení nukleární medicíny, centrum PET, Masarykův onkologický ústav Brno 1; Regionální centrum aplikované molekulární onkologie Masarykův onkologický ústav Brno, LF MU Brno 2; Interní hematologická a onkologická klinika FN a LF MU Brno 3; III. interní klinika FN a LF UP Olomouc 4; Interní oddělení, revmatologická ambulance, nemocnice Kyjov 5; Interní klinika FN Ostrava 6; II. interní klinika FN u sv. Anny v Brně a LF MU Brno 7; Revmatologická poradna, nemocnice s poliklinikou Karviná-Ráj 8; Klinika interní, geriatrie a praktického lékařství FN a LF MU Brno 9; Klinika infekčních chorob FN a LF MU Brno 10; Ústav patologie FN a LF UP Olomouc 11; Ústav patologie FN a LF MU Brno 12
Vyšlo v časopise: Čes. Revmatol., 22, 2014, No. 2, p. 91-98.
Kategória: Přehledový článek
Súhrn
Obrovskobuněčná arteritida (OBA) patří mezi systémové vaskulitidy velkých tepen, postihuje starší osoby, častěji ženy. Prvním příznakem tohoto onemocnění může být febrilní stav s elevací nespecifických laboratorních markerů zánětu (FW, CRP). A právě u takových stavů může být z důvodu širší diferenciální diagnostiky provedeno FDG PET (PET/CT) vyšetření. Nálezy vysoké akumulace radiofarmaka v aortě a velkých tepnách zejména odstupujících z aortálního oblouku jsou poměrně uniformní a typické pro OBA, a to ve fázi, kdy nejsou rozvinuty strukturální změny tepen. Postižení spánkové tepny se daří zobrazit až pomocí hybridních PET/CT skenerů, zatím spíše v ojedinělých případech. Pomocí akumulace FDG ve stěnách velkých tepen lze hodnotit i aktivitu nemoci (jak remisi, tak i případný relaps), a tento nález koreluje i s laboratorními známkami aktivity nemoci (FW, CRP). Přestože je PET (PET/CT) vyšetření hojně využíváno v primární diagnostice i monitoraci aktivity nemoci, nejsou tato vyšetření dosud považována za standardní.
Formou obrazové dokumentace prezentujeme 4 pacienty. U těchto pacientů bylo PET (PET/CT) vyšetření využito k primární diagnostice, srovnáváme s CT angiografickým nebo MR angiografickým vyšetřením. U 2 pacientů dokládáme i průkaz histologickým vyšetřením. U 3 ze 4 pacientů byl i další průběh onemocnění monitorován PET vyšetřením.
Klíčová slova:
Obrovskobuněčná arteritida, temporální arteritida, vaskulitidy velkých cév, PET, PET/CTÚvod
Obrovskobuněčná arteritida (OBA, angl. Giant Cell Arteritis, GCA) patří společně s Takayasuovou arteritidou mezi systémové vaskulitidy velkých cév postihující aortu a větší tepny. Tato vaskulitida je uváděna jako typické onemocnění starších osob, jejíž incidence s věkem stoupá a průměrný věk je udáván kolem 70 let. Onemocnění postihuje 2–3krát častěji ženy, část postižených má příznaky revmatické polymyalgie [1]. Nejužívanější diagnostická kritéria byla stanovena American College of Rheumatology v roce 1990 [2]. Prvním příznakem onemocnění mohou být relativně nespecifické symptomy provázené vzestupem laboratorních markerů zánětu a protrahovaný febrilní stav [3].
Standardním vyšetřením k diagnostice vaskulitid je histologické vyšetření. To je však v případě OBA, i obecně vaskulitid velkých cév, problematické. Nabízí se biopsie temporální (okcipitální) tepny nebo jejich větví. Ale pozornost se obrací i k využití méně invazivních, zobrazovacích vyšetření.
Z radiologických zobrazovacích metod lze k diagnostice OBA využít výpočetní tomografii (CT), magnetickou rezonanci (MR) nebo ultrasonografii (US). CT vyšetření je výhodné k odhalení změn ve stěně tepny, jako jsou zesílení stěny, kalcifikace, nástěnné tromby. CT angiografie (CTA) navíc odhaluje i intraluminální změny (stenózy, okluze, dilatace, aneuryzmatická rozšíření), prokazuje zejména patologie aorty a velkých tepen, ale nemůže dobře zobrazit relativně malé cévy [4, 5].
Vyšetření magnetickou rezonancí (MR) a MR angiografie (MRA) jsou pravděpodobně nejvýhodnější metody k odhalení cévních abnormalit, ale mohou selhávat v odhalení zánětu ve strukturálně normálních cévách. Použité cívky ovlivňují kvalitu vyšetření a lepších výsledků k průkazu temporální arteritidy je dosahováno na 1,5–3 T (Tesla) než na 1 T MR kamerách [6, 7]. MR a MRA vyšetření lze použít i pro monitoraci onemocnění.
Další metodou je US, resp. duplexní US jako kombinace dvourozměrného B-modu zobrazující stěnu tepny a okolí a dopplerovského mapování toku v ní. Ultrasonografií lze hodnotit jak anatomii cévní, stav lumen, časné alterace stěny. Hlavní výhodou je relativně nízká cena vyšetření, jeho dostupnost i absence ionizujícího záření. Nevýhodou je naopak subjektivní hodnocení, obtížné zobrazení některých tepenných segmentů (např. proximální část a. subclavia vlevo, hrudní aorty, břišních cév při překrytí plyny nebo tukem). Za pozitivní nález se považuje průkaz ztluštění komplexu intima-media (IMC), okluze, dilatace, v akutní fázi tzv. „halo sign“ (hypoechogenní halo díky edému) a zesílení cévní stěny. K monitoraci lze duplexní ultrasonografii použít i místo opakovaných angiografií [1, 8, 9]. Zesílení stěny a otok stěny tepny při CTA nebo MRA, „halo sign“ při US vyšetřeních lze považovat za známky aktivní časné fáze vaskulitidy. Zánětlivé změny mohou přetrvávat i při remisích, a tak je velmi problematické rozlišení zesílení stěny způsobeném aktivním zánětem a chronickou fibrotizací jen podle tloušťky cévní stěny [10].
PET a PET/CT
Pozitronová emisní tomografie (PET) je diagnostická metoda obecně zobrazující biodistribuci pozitronových radiofarmak. Základním a rutinně využívaným radiofarmakem pro PET je 2-[18F]fluoro-2-deoxy-D-glukóza (FDG). FDG je analog glukózy obsahující radionuklid fluoru 18F, a ten se rozpadá emisí pozitronů (β+) s poločasem rozpadu 109,7 minut. Diagnostika pomocí FDG PET (dále v textu i obecněji jen PET) kombinuje dobré vlastnosti snímání (zejména citlivost a rozlišení v porovnání s „konvenční scintigrafií“) a radiofarmaka s příznivou biodistribucí a relativně vysokou afinitou k nádorovým, ale i zánětlivým buňkám, a tak to, co je pro onkologické zobrazování nevýhodou, je naopak pro zobrazení zánětů výhodou. K zobrazení biodistribuce radiofarmaka byl PET skener dostačující, takto získaný obraz byl „funkčně-metabolický“. Nevýhodou byla ale absence anatomicko-morfologické informace. Současné hybridní zobrazovací systémy PET/CT představují spojení obou metod (PET i CT) a snímají vyšetřovaného ve stejném rozsahu v relativně blízkém časovém okamžiku. I doba snímání na současných PET/CT skenerech se zkracuje proti dřívějším PET skenerům asi o polovinu, dosahuje se i vyššího rozlišení. Vlastní CT lze provádět jak v režimu Low Dose (LD, nízké dávky), ale i High Dose (HD, vysoké dávky) s možností použití pozitivních i negativních kontrastů. Pro čtení a pochopení publikovaných kazuistik i souborů pacientů ve vztahu k PET (PET/CT) vyšetření je důležitá informace, zda bylo snímání na relativně starším PET nebo modernějším PET/CT skeneru, zda bylo snímání v HDCT režimu a byla použita intravenózní kontrastní látka (PET/CT skener v režimu HDCT s použitím kontrastu poskytne maximální diagnostickou informaci). V prosinci 2013 je v provozu v ČR jen jediný PET skener a 9 hybridních PET/CT skenerů (v MOÚ Brno je jak PET, tak i PET/CT skener). Vyšetření se stalo relativně dostupné.
Pacienti s OBA mohou být indikováni k PET (PET/CT) vyšetření jak ve fázi diagnostiky tohoto onemocnění nebo s již známou chorobou k ověření aktivity této choroby. V prvním případě jde spíše o širší diferenciálně diagnostické vyšetření v rámci došetření pacienta se systémovými příznaky zánětlivého onemocnění, s laboratorními známkami aktivního zánětu (vysokými hodnotami sedimentace erytrocytů, C-reaktivního proteinu). Takový pacient bývá (alespoň podle žádanek) indikován k vyšetření nejen k odhalení zánětlivého onemocnění, ale i k vyloučení případné skryté malignity [11]. V publikovaných souborech pacientů vyšetřených pro „horečku neznámého původu“ (fever of unknown origin, FUO) či obecněji z důvodu protrahovaných febrilií se pacienti s podezřením na vaskulitidu velkých tepen objevují cca v 10–28 % [12, 13, 14, 15, 16]. Velmi to záleží na skladbě i věku pacientů, jsou i významné rozdíly mezi jednotlivými zeměmi (např. v českých studiích relativně nižší zastoupení pacientů s TBC, AIDS). Právě z důvodu vyšetření nejasných febrilních stavů se jistě ve všech PET centrech v ČR objevují pacienti s podezřením na vaskulitidu velkých tepen. A takoví pacienti jsou k vyšetření indikováni častěji internisty (jen někdy na doporučení revmatologa). V současné době je dostatek literárních odkazů na jednotlivé pacienty i soubory pacientů a senzitivita u takto diagnostikovaných pacientů se udává mezi 77–92 %, specificita je relativně vysoká mezi 89–100 % [17].
Rozsah postižení a korelace s jinými zobrazovacími metodami
Výhodou PET vyšetření je možnost určení rozsahu postižení aorty a hlavních tepenných kmenů. Vlastní zkušenost ukázala, že nálezy relativně vysoké akumulace FDG ve stěnách velkých tepen jsou u pacientů s OBA poměrně uniformní (obr. 1–3) a odpovídají rovněž publikovaným případům – postihují prakticky celou aortu ve všech úsecích a relativně častěji postihují tepny odstupující z aort. oblouku – truncus brachiocephalicus, a. carotis communis, a. subclavia s přestupem na a. brachialis (zde i symetricky). Méně často se zobrazuje vysoká akumulace FDG v ilických a femorálních tepnách [18]. Při obvyklém zobrazení trupu v rozsahu od báze lební k proximálním stehnům (v celotělovém protokolu snímání) detekční schopnosti přístrojů PET (i PET/CT) končí na krku u a. carotis (přibližně v oblasti její bifurkace), na horních končetinách u a. brachialis (tato skutečnost je dobře patrná u všech iniciálních studií v obrázcích 1–4). Meller a kol. zkoumali časnou fázi aortitidy u 5 pacientů, u všech detekovali vysokou akumulaci FDG ve stěnách aorty a v dalších tepenných oblastech. Celkem u těchto pacientů popsali 28 cévních oblastí s vysokou akumulací FDG, jen 9 z těchto oblastí (32 %) mělo známky vaskulitidy i na MR vyšetření. Pak i v dalších souborech pacientů byla prokázána vysoká akumulace FDG v tepnách, které nejevily známky postižení dle CTA nebo MRA (obr. 2) [18, 19, 20]. Z vlastní zkušenosti (zejména na hybridním PET/CT zobrazování) známe zejména lehká ztluštění, zesílení stěny, měkkotkáňové lemy ve stěně aorty patrné i na CT u části pacientů, a tyto nálezy jsou někdy jen nevýrazné. Hlavní výhodou PET (PET/CT) vyšetření je, že může detekovat OBA v době, kdy nejsou rozvinuty strukturální změny podmiňující typicky angiografický (CTA, MRA) obraz. Otázkou je, zda u pacientů s podezřením na vaskulitidu typu OBA z PET vyšetření, vůbec doplňovat další diagnostická vyšetření (CT nebo MR angiografii a duplexní US) s vědomím, že tato vyšetření v časné fázi mohou být neprůkazná. Nebo ověřovat dalšími metodami jen v místech nejvýraznějších nálezů z PET vyšetření?
Obr. 1. Kazuistika – žena 66 let. 1A: PET MIP (maximum intensity projections, sumovaný pseudo 3D obraz) trupu s průkazem aktivní vaskulitidy. Vysoká akumulace FDG v aortě a velkých tepnách převyšující referenční jaterní akumulaci dokonce ve všech 7 oblastech, které hodnotíme. 1B: na trojici řezů v axiální, sagitální a koronální rovině je patrný tubulární charakter nálezu, lokalizační kříž umístěn do ascendentní aorty (metabolicky aktivní jsou jen stěny, ne lumen aorty). 1C: pro podezření na vaskulitidu bylo provedeno vyšetření CTA, jemný měkkotkáňový lem ve stěně aorty koreluje při fúzi obou vyšetření s metabolicky aktivní stěnou aorty (žlutý prstenec) 1D: Kontrolní PET vyšetření po 7 měsících terapie glukokortikoidy prokazuje pokles akumulace FDG ve velkých tepnách. 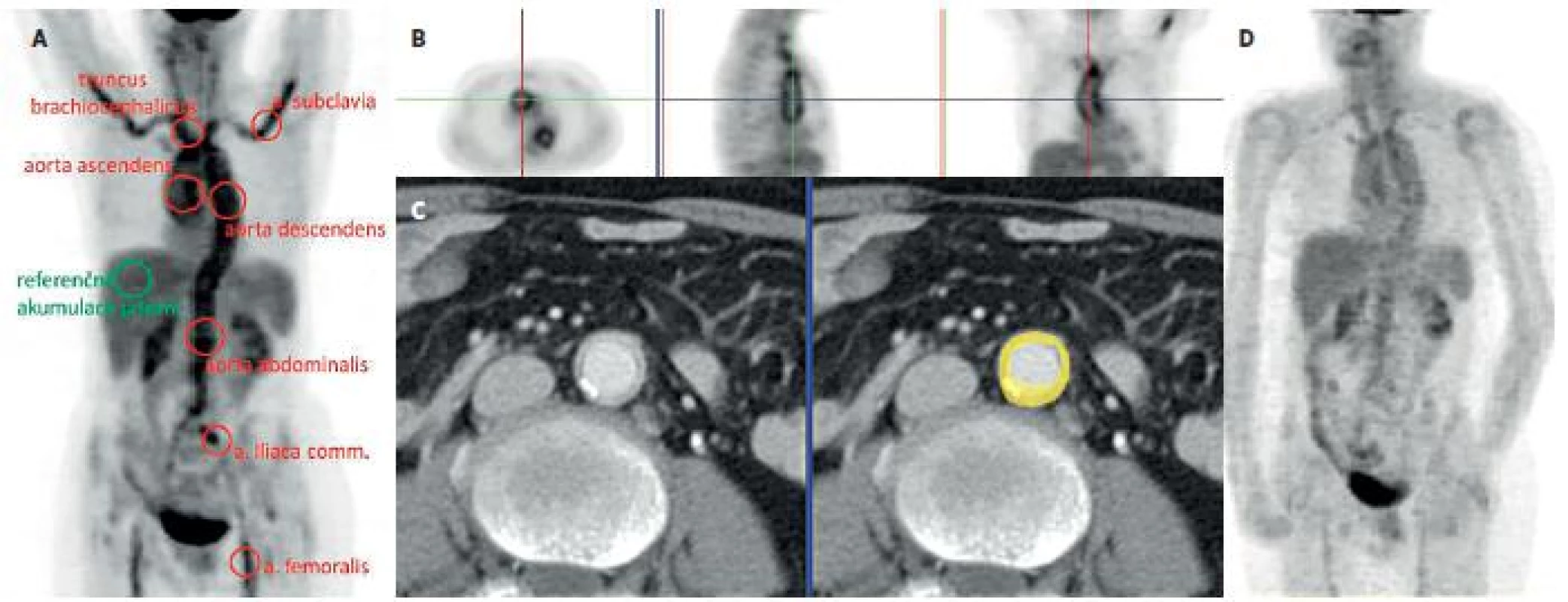
Obr. 2. Kazuistika – muž 65 let 2A: PET MIP trupu ve fázi metabolicky aktivní vaskulitidy provázené laboratorními i klinickými známkami zánětlivého onemocnění. Je patrna vysoká akumulace FDG v aortě a v některých velkých tepnách (truncus brachiocephalicus, a. carotis communis bilat., a. subclavia a a. brachialis bilat.). 2B a 2C: Při podezření na vaskulitidu bylo provedeno MRA vyšetření aortálního oblouku a krčních tepen – bez průkazu známek vaskulitidy. Excize temporální tepny ale potvrdila obrovskobuněčnou, temporální arteritis - 2D: barvení na elastická vlákna zv. 100x, průkaz rozpadu lamina elastica interna (označeno). 2E: HE, zv. 100x, průkaz vícejaderných buněk (označeno). 2F: Kontrolní PET vyšetření po 8 měsících terapie glukokortikoidy prokazuje pokles akumulace FDG ve velkých tepnách. 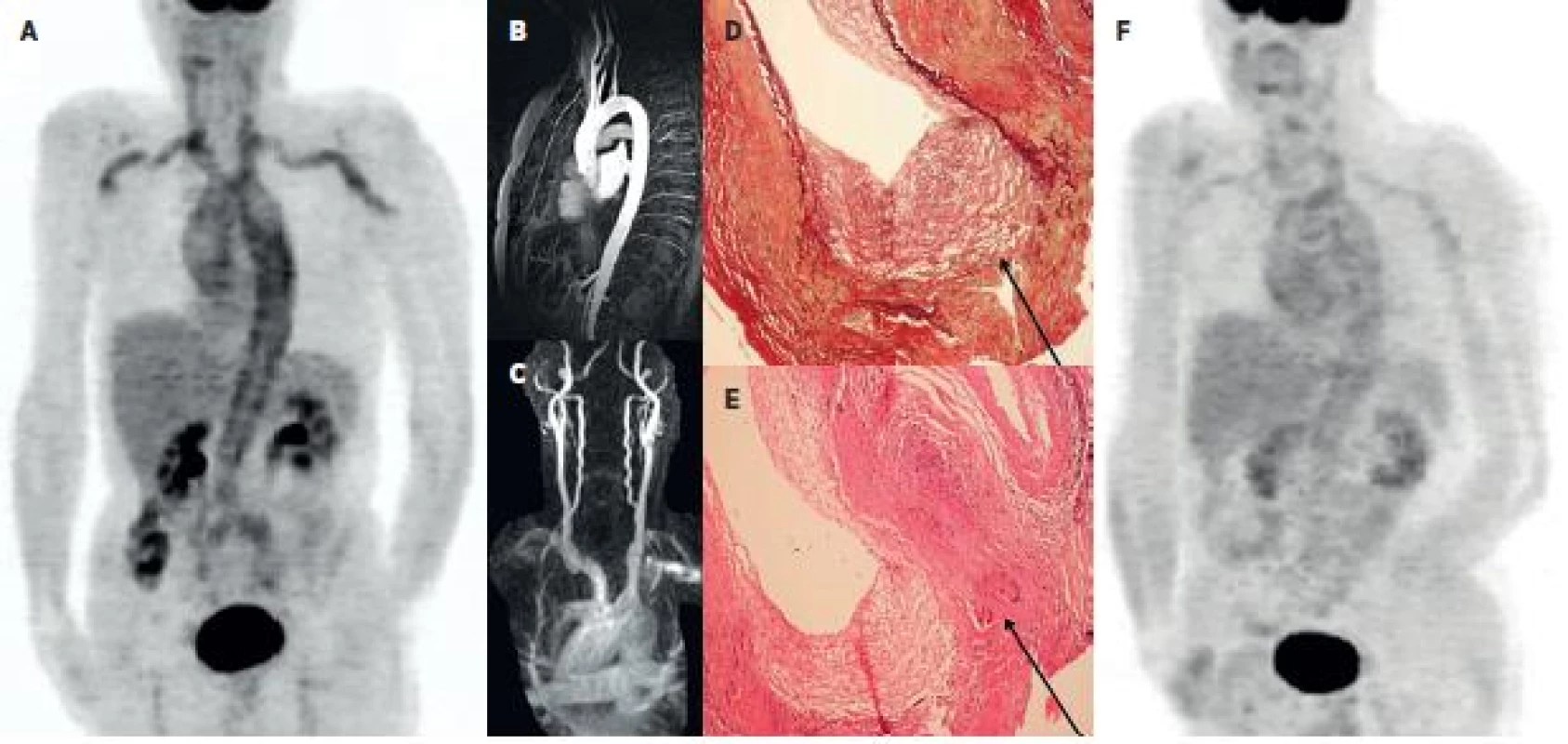
Obr. 3. Kazuistika – žena 63 let. 3A Hybridní PET/CT vyšetření trupu PET MIP prokazuje u pacientky s „horečkou neznámého původu“ vysokou akumulaci FDG v aortě a velkých tepnách. 3B: Doplněné speciální snímání mozku detekovalo vysokou akumulaci FDG i ve spánkových tepnách (červené šipky), jejich frontálních a parietálních větvích (žluté šipky) i okcipitálních tepnách (zelené šipky). Histologické vyšetření z excize větve levostranné spánkové tepny prokázalo obrovskobuněčnou arteritidu. (3C: HE, zv. 200x, označeny vícejaderné buňky, 3D: imunohistochemické vyšetření anti CD 68+, zv. 200x, označeny vícejaderné buňky, 3E: resorcin-fuchsin, zv. 100x, označen rozpad lamina elastica interna). 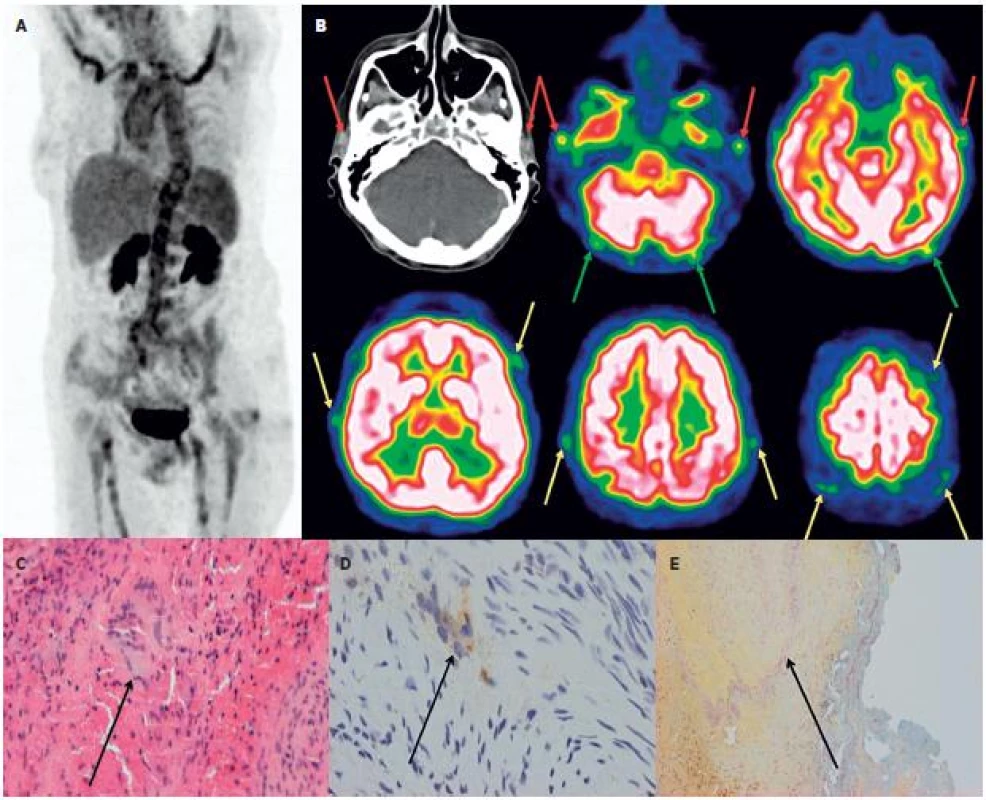
Obr. 4. Souhrnný obraz 7 PET studií (MIP projekce) u 53leté pacientky v průběhu 6,5 let. Vlevo iniciální sken v časné fázi provázené elevací FW a CRP. Další 2 studie byly hodnoceny jako fáze remise při terapii prednisonem a po jejím ukončení. Následující studie odpovídají relapsu nemoci (v břišní aortě – modrá šipka a a. iliaca comm. l. dx. – červená šipka) v korelaci s klinickým nálezem, i laboratorními parametry. Při imunosupresivní terapii přechodně pokles s následným vzestupem akumulace FDG v těchto tepnách. I přes kombinovanou imunosupresivní terapii (cyklosporin A, methotrexát, prednison) je na poslední studii patrná perzistující vysoká metabolická aktivita ve společné ilické tepně vpravo – nález pravděpodobně odpovídá chronické fázi onemocnění. 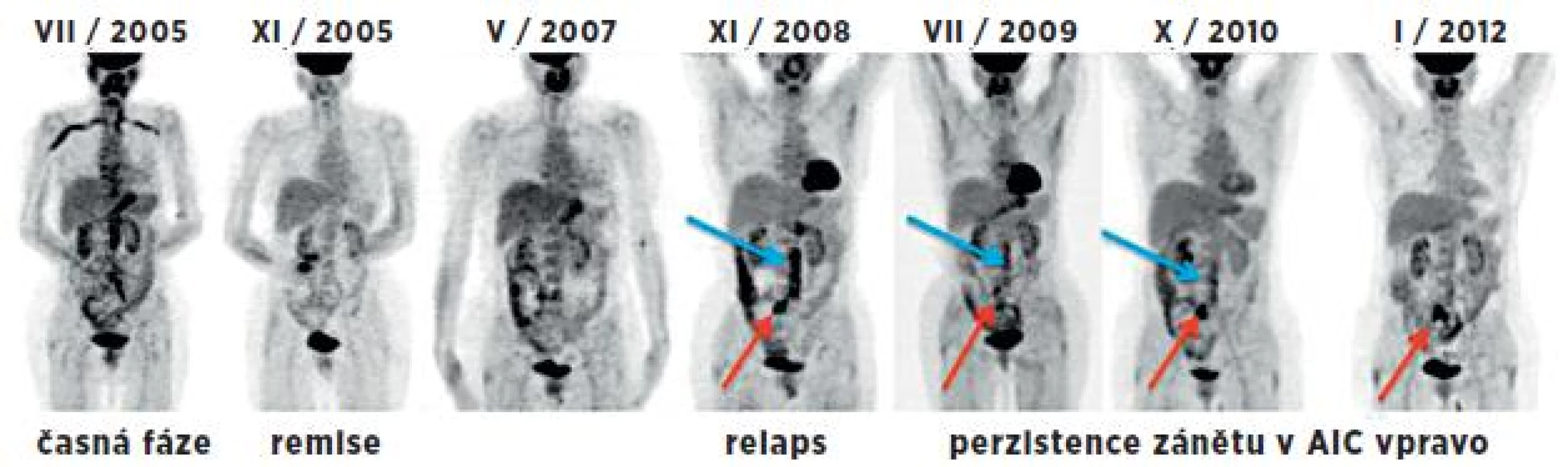
Funkční diagnostika obrovskobuněčné arteritidy
PET je metabolické, funkční zobrazení detekující aktivitu zánětu. Vyšetření tak proto bude mít smysl jen u nemocných před nasazením imunosupresiv nebo glukokortikoidů. Ve fázi diagnostiky horečky neznámého původu u starších pacientů je vyšetření relativně senzitivní. Ale sami jsme se přesvědčili, že u jednoho pacienta po nasazení glukokortikoidů (PET vyšetření 4. den při i.v. terapii metylprednisolonem) pro oční symptomatologii vyžadující neodkladnou terapii byla již míra akumulace FDG relativně nižší a PET nález byl spíše naznačen. U dalších 8 pacientů s klinickým podezřením na OBA, ale zaléčených glukokortikoidy v délce 1–3 týdny, jsme obraz vaskulitidy nedetekovali (připouštíme, že je možné, že pacienti toto onemocnění mít vůbec nemuseli). Rovněž jsme se setkali s úplným vymizením patologické akumulace FDG v tepnách po 28 dnech terapie prednisonem. Domníváme se, že lze předpokládat relativně rychlý pokles aktivity zánětu (tím i zobrazitelné akumulace FDG ve velkých tepnách) při terapii. I doporučení pro excizi spánkové tepny, k přímé diagnostice, je co nejdříve od zahájení, nejlépe ještě před zahájením terapie. I ústup klinických obtíží, laboratorních parametrů zánětu může být velmi rychlý [2]. Rovněž existují důkazy pro rychlé odeznívání známek zánětu při radiologických zobrazovacích vyšetřeních, a je doporučení tato vyšetření provádět ještě před zahájením imunosupresivní terapie, neboť senzitivita (ne specificita) US i MR vyšetření klesá již od prvního dne léčby [21]. Bohužel nejsou dosud informace jak rychlý je efekt terapie na odeznívání známek zobrazitelných PET (PET/CT) vyšetřením. U těch pacientů, kteří v rámci širší diferenciální diagnostiky neznámého zánětlivého onemocnění mají podstoupit PET (PET/CT) vyšetření, považujeme za rozumné vyčkat s nasazením imunosupresivní terapie až po provedení tohoto vyšetření, abychom nezkreslili zobrazení případné vaskulitidy. U pacientů s jasnými klinickými známkami temporální arteritidy bude diagnostika nasměrována spíše přímo k bioptickému průkazu (z temporální tepny nebo její větve). A zase u řady pacientů s rychlým a dramatickým průběhem (např. očním postižením, ischemickými komplikacemi) bude terapie imunosupresivními léky jistě zahájena neodkladně bez zvažování a čekání na PET (PET/CT) vyšetření.
Postižení arteria temporalis superficialis
Při vyšetřeních provedených na relativně starších PET skenerech se popisovalo, že nelze zobrazit akumulaci radiofarmaka v tepnách menších než 4 mm v průměru, tedy i v a. temporalis superficialis, a to jen z důvodu rozlišení PET skenerů [22, 23, 24]. Akumulace radiofarmak v této tepně se podařila zobrazit až na novější generaci PET/CT skenerů, s relativně lepším rozlišením. V současné době jsou publikovány 2 takové případy. První na experimentálním vyšetření s „non-FDG“ radiofarmakem na bázi uhlíku 11C, jako 11C–PK11195 PET/CT v kombinaci CT angiografií [25]. Druhé pak jako běžné vyšetření s radiofarmakem FDG na PET/CT kameře při použití doplňujícího snímání hlavy ve speciálním protokolu snímání pro mozek [26]. Rutinní vyšetření trupu se zpravidla provádí v celotělových protokolech, a v takových případech se zobrazení této tepny nedaří ani na PET/CT skenerech. Zda bylo zobrazení zánětu v temporální tepně spíše náhodné nebo bude časté a stane se alternativou k biopsii temporální tepny, to si netroufáme vůbec odhadnout.
Monitorace terapie
PET vyšetření lze využít i k monitoraci onemocnění, byl zdokumentován i pokles akumulace radiofarmaka v průběhu terapie glukokortikoidy v korelaci s nespecifickými markery zánětu (FW, CRP), počtem trombocytů a hladinou hemoglobinu (v případě hemoglobinu šlo o inverzní korelaci) [20, 27]. Již v roce 2006 Blockmans a kol. publikovali studii 35 pacientů s OBA, u kterých PET vyšetření prováděli jednak iniciálně, ale i 3. a 6. měsíc terapie glukokortikoidy. Již tato studie ukázala, že PET je senzitivní k odhalení OBA, a dokumentuje výrazný pokles metabolické aktivity po 3 měsících terapie, který lze i kvantifikovat. Co však studie ukázala také, že již nedochází k dalšímu poklesu akumulace ve velkých tepnách po 6 měsících terapie, a že rovněž nelze dopředu podle PET vyšetření (kvantifikací v iniciální studii) odhadnout, kteří pacienti zrelabují (18 pacientů z 35) [28]. Pomocí PET/CT vyšetření byl popsán i průkaz perzistující nemoci přes léčbu, v korelaci s klinickými i laboratorními známkami aktivity [29]. Rovněž byla hodnocena i léčebná odpověď ke glukokortikoidům rezistentních pacientů na léčbu cyklofosfamidem [30]. Zda k monitoraci ale stačí jen laboratorní a klinické parametry a ne relativně drahé a radiačně zatěžující vyšetření PET, je však otázkou.
Hodnocení akumulace FDG ve velkých tepnách
Zvýšenou akumulaci radiofarmaka ve stěnách velkých tepen lze hodnotit jako pozitivní již pouhým vizuálním hodnocením. Typickým obrazem je tubulární charakter akumulace radiofarmaka, tedy lumen tepny zůstává bez akumulace radiofarmaka (fotopenické) a „aktivní“ jsou jen stěny tepny (obr. 1B). V případě provedení vyšetření na hybridním PET/CT skeneru nacházíme někdy korelaci i se zesílením stěny tepny. Publikováno bylo např. vícestupňové hodnocení akumulace FDG v tepenné stěně. Třístupňové i čtyřstupňové škály se nám nezdají příliš praktické, obtížně se reprodukují (pozn.: třístupňová škála akumulací FDG: 1. stupeň – akumulace nižší než v játrech, 2. stupeň – „jako v játrech“, a 3. stupeň – vyšší než v játrech, čtyřstupňová škála: 0. – bez akumulace FDG, 1. stupeň – nízká akumulace, 2. stupeň – střední akumulace nebo jako v játrech a 3. stupeň – vysoká akumulace). Bohužel intervaly a přesné definice akumulace „jako v játrech“ jsme nenalezli, rovněž hranici mezi „žádnou“ a nízkou“ akumulací [19, 20, 27, 28]. Proto se zdá být praktičtější porovnávání jen s referenční jaterní akumulací, nejlépe vyjádřením přesné číselné hodnoty maximální standardizované akumulace radiofarmaka (SUVmax, standardized uptake value). Takto vzniklé hodnocení je jen dvoustupňové a snáze reprodukovatelné [18, 31, 32]. Neobvyklé bylo porovnání akumulace cévní s akumulací plicní jako pozadím, a takový postup již nebyl dále opakován [27]. Vzhledem k tomu, že vysoká akumulace FDG v cévách je generalizovaná, různé autorské kolektivy se i tuto skutečnost snaží zahrnout do hodnocení. Je proto měřeno více cévních oblastí (3–9), ale nejsou autorské kolektivy, které by volili stejnou metodiku hodnocení [18, 19, 28, 31]. Takto prováděnou kvantifikaci, tedy na několik stupňů a ve více oblastech lze pak použít ke srovnání mezi pacienty s vaskulitidou a kontrolami bez vaskulitid nebo v rámci srovnání pacientů s vaskulitidou při monitoraci terapie glukokortikoidy. Např. Meller et al. konstatovali, že u kontrolního souboru 66 vyšetřených osob bez známek vaskulitidy nezaznamenali 3. stupeň akumulace radiofarmaka ani v jednom případě, jen na úrovni 1. a 2. stupně, zatímco u osob s vaskulitidou právě často stupeň 3 [19]. Nebo Řehák a kol. shledali u 39 pacientů před terapií pozitivitu (akumulace FDG v tepně je vyšší než v játrech) nejméně 3 cévních oblastí ze 7 měřených (obr. 1A), na rozdíl od kontrolního souboru pacientů bez vaskulitidy [18]. Autorský kolektiv Blockmans a kol. zjistili pokles při terapii glukokortikoidy v hodnotě „total vascular score TVS“ (součet bodů v hodnotách 0–3 v sedmi cévních oblastech s maximálním počtem 21 bodů [28]. Vzhledem k tomu, že nebyla nalezena shoda v hodnocení a kvantifikaci akumulace FDG ve stěnách tepen, může pravděpodobně každé PET centrum hodnotit jiným způsobem. Obecně lze říci, že jako pozitivní bývá označován zpravidla nález přesahující akumulaci FDG v referenčním jaterním parenchymu. V případě pacientů s OBA před léčbou jsou nálezy na velkých tepnách poměrně uniformní, rozložené ve více cévních oblastech a akumulace FDG je zvýšená i při prostém vizuálním hodnocení (obr. 1–4). Při kontrolním vyšetření v remisi se tato akumulace FDG ve stěnách tepen výrazně snižuje jak rozsahem, tak i intenzitou (obr. 1, 2).
U části pacientů s OBA, tedy s vysokou akumulací FDG ve velkých tepnách, se objevují i další nálezy: zvýšená akumulace FDG v zachycených kloubech (při obvyklém snímání trupu v ramenních, kyčelních a sternoklavikulárních kloubech) a v extraartikulárních synoviálních strukturách. Takové nálezy se nově popisují u pacientů s revmatickou polymyalgií [33].
Závěr
Generalizovaný nález vysoké akumulace FDG ve velkých tepnách u starších pacientů se známkami aktivního zánětlivého onemocnění svědčí pro obrovskobuněčnou arteritidu (OBA) s relativně vysokou senzitivitou i specificitou. U těchto pacientů zobrazujeme časnou, metabolicky aktivní fázi onemocnění, a tento nález na PET (PET/CT) vyšetření může předcházet změnám tepen, které lze detekovat morfologickými zobrazovacími metodami. Přímé zobrazení postižení spánkových tepen se zdařilo až za použití novější generace PET/CT skenerů. U pacientů, kteří jsou léčeni imunosupresivní terapií (ať už glukokortikoidy v imunosupresivních dávkách nebo jinými léky) lze objektivizovat i fázi metabolické remise onemocnění, a tato koreluje s laboratorními parametry aktivity zánětu. U pacientů, kteří jsou léčeni nebo ve sledování po léčbě, lze PET (PET/CT) vyšetření využít i při podezření na progresi, perzistenci či relaps tohoto zánětlivého onemocnění. V primární diagnostice onemocnění jsou pacienti indikováni k PET (PET/CT) vyšetření častěji internisty než revmatology, a to kvůli širší diferenciální diagnostice horečnatých stavů. Do specializované revmatologické ambulance se takový pacient proto může dostat až po našem vyšetření, s již vysloveným podezřením na OBA. Pokud je klinický obraz OBA jasný nebo při postižení očí či závažné ischémii, je nutné zahájit imunosupresivní léčbu neodkladně, a rovněž biopsie spánkové nebo okcipitální tepny při klinickém podezření nutná není. Role PET (PET/CT) tak bude spíše u nemocných s celkovými příznaky.
Jsme si vědomi, že přestože důkazů o použití PET (PET/CT) i smyslu těchto vyšetření je relativně dostatek, dosud tyto metody nepatří ke standardním pro diagnostiku či monitoraci OBA.
Práce vznikla za podpory:
MZ ČR – RVO (MOÚ 00209805) a (FNB 65269705) a VaVpl RECAMO - CZ.1.05/2.1.00/03.010.
Adresa pro korespondenci:
Prim. MUDr. Zdeněk Řehák, Ph.D.,
Oddělení nukleární medicíny, centrum PET
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: rehak@mou.cz
Zdroje
1. Nesher G, Nesjet R. Giant cell arteritis and polymyalgia rheumatica, chapter 24 In Ball GV, Bridges SL. Vasculitis second edition. Oxford: University Press 2008 : 305–322.
2. Hunder GC, Bloch DA, Michel BA et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis and Rheumatism 1990;33(8):1122–1128.
3. Kalamia KT, Hunder GC. Giant cell arteritis (temporal arteritis) presenting as fever of undetermined origin. Arthritis Rheum 1981; 24(11): 1414–1418.
4. Giant cell arteritis. Am J Roentgenol 2003; 81(3): 742.
5. Ferda J. CT angiografie. Praha: Galen 2004: p. 114.
6. Bley TA, Wieben O, Uhl M et al. High-resolution MRI in giant cell arteritis: imaging of the wall of the superficial temporal artery. Am J Roentgenol 2005; 184(1): 283–287.
7. Bley TA, Uhl M, Carew J, Marki M, Schmidt E, Peter HH, et al. Diagnostic value of high-resolution MR imaging in giant cell arteritis. AJNR Am J Neuroradiol 2007; 28 : 1722–7.
8. Ciancio G, Brushi M, Govoni M. Ultrasonography in diagnosis and follow-up of temporal arteritis: an update. In: Challenges in Rheumatology (ed. M. Harjacek). Rijeka: InTech: 2009; 129–142.
9. Schmidt WA, Blockmans D. Use of ultrasonography and positron emission tomography in the diagnosis and assessment of large-vessel vasculitis. Curr Opin Rheumatol 2004; 17 : 9–15.
10. Pipitone N, Versari A, Salvarani C. Role of imaging studies in the diagnosis and follow-up of large vesel vasculitis: an update. Rheumatology 2008; 47 : 403–408.
11. Křivanová A, Adam Z, Mayer J et al. Teplota nejasné etiologie: příčiny a diagnostický postup. Vnitr Lek 2007; 53(2): 169–178.
12. Jarůšková M, Bělohlávek O. Role of FDG-PET and PET/CT in the diagnosis of prolonged fibrile states. Eur J Nucl Med Mol Imaging 2006; 33 : 913–918.
13. Bleeker-Rovers CP, de Kleijn EM, Corstens FH et al. Clinical value of FDG PET in patiens with fever of unknown origin and patiens suspected of focal infection or inflammation. Eur J Nucl Med Mol Imaging 2004; 31 : 29–37.
14. Blockmans D, Knockaert D, Maes A et al. Clinical value of (18F)fluoro-deoxyglucose positron emission tomography for patients with fever of unknown origin. Clin Infect Dis 2001; 32 : 191–196.
15. Ferdová E, Záhlava J, Ferda J. Horečky nejasného původu, význam hybridního zobrazeni 18F-FDG-PET/CT. Ces Radiol 2008; 62(1): 23–33.
16. Řehák Z, Fojtík Z, Hofírek I. Přínos 18F-FDG PET vyšetření v diagnostice vaskulitid velkých cév u nemocných s horečkami neznámého původu. In O. Eliška, J. Spáčil, V. Štvrtinová. Angiologie 2008, trendy soudobé angiologie, Galen 2008, p. 23–30.
17. Zerizer I, Tan K, Khan S et al. Role of FDG-PET and PET/CT in the diagnosis and management of vasculitis Eur J Radiol 2010; 73(3): 504–509.
18. Řehák Z, Fojtík Z, Szturz P et al. 18F-FDG PET a PET/CT vyšetření v časné diagnostice obrovskobuněčné arteritidy – soubor 39 pacientů. Ces Radiol 2013; 67(1): 62–72.
19. Meller J, Strutz F, Siefker U et al. Early diagnosis and followup of aortitis with [18F]FDG PET and MRI. Eur J Nucl Med Mol Imaging 2003; 30(5): 730–736.
20. Walter MA, Melzer RA, Schindler C et al. The value of [18F]FDG-PET in the diagnosis of large-vessel vasculitis and the assessment of activity and extent of disease Eur J Nucl Med Mol Imaging 2005; 32(6): 674–681.
21. Hauenstein C, Reinhard M, Geiger J et al. Effects of early corticosteroid treatment on magnetic resonance imaging and ultrasonography findings in giant cell arteritis. Rheumatology 2012 51 : 1999–2003.
22. Brodmann M, Lipp RW, Passath A et al. The role of 2-18F-fluoro-2-deoxy-D-glucose positron emission tomography in the diagnosis of giant cell arteritis of the temporal arteries. Rheumatology (Oxford) 2004; 43(2): 241–242.
23. Belhocine T. The right place of 18FDG PET for the diagnosis of giant cell arteritis – a response to the article of Brodmann et al. Rheumatology (Oxford) 2004; 43(5): 675–676.
24. Belhocine T, Blockmans D, Hustinx R et al. L. Imaging of large vessel vasculitis with 18FDG PET illlusion or reality? A critical revuve of literature data. Eur J Nucl Med Mol Imaging 2003; 30 : 1305–1315.
25. Gaemperli O, Boyle JJ, Rimoldi OE et al. Molecular Imaging of vascular Inflammation. Eur J Nucl Med Mol Imaging 2010; 37 : 1236.
26. Řehák Z, Szturz P, Křen L et al. Upsampling From Aorta and Aortic Branches. PET/CT Hybrid Imaging Identified 18F-FDG Hypermetabolism in Inflamed Temporal and Occipital Arteries. Clin Nucl Med 2013 doi: 10.1097/RLU.0b013e3182868aae
27. Moosig F, Czech N, Mehl C et al. Correlation between 18-fluorodeoxyglucose accumulation in large vessels and serological markers of inflammation in polymyalgia rheumatica: a quantitative PET study. Ann Rheum Dis 2004; 63 : 870–873.
28. Blockmans D, De Ceuninck L, Vanderschueren S et al. Repetitive 18F-Fluorodeoxyglucose positron emission tomography in giant cell arteritis: a prospective study in 35 patients. Arthritis Rheum 2006; 55(1): 131–137.
29. Bertagna F, Bosio G, Caobelli F et al. Role of 18F-fluorodeoxyglucose positron emission tomography/computed tomography for therapy evaluation of patients with large-vessel vasculitis. Jpn J Radiol 2010; 28(3): 199–204.
30. Henes, JC Müller M, Pfannenberg C et al. Cyclophosphamide for large-vessel vasculitis: assessment of response by PET/CT. Clin Exp Rheumatol 2011; 29, supplement 64: S43–S48.
31. Scheel AK, Meller R, Vosshenrich R et al. Diagnosis and follow up of aortitis in the elderly. Ann Rheum Dis 2004; 63 : 1507–1510.
32. Hautzel H, Sander O, Heinzel A et al. Assessmentn of large-vessel involvement in giant cell arteritis with 18F-FDG PET: introducing an ROC-analysis-based cutoff ratio. J Nucl Med 2008; 49(7): 1107–1113.
33. Adams H, Raijmakers P, Smulders Y. Polymyalgia Rheumatica and Interspinous FDG Uptake on PET/CT. Clin Nucl Med 2012; 37 : 502–505.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2014 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Myozitida s inkluzními tělísky asociovaná s revmatoidní artritidou – kazuistika
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- Doporučení EULAR pro léčbu revmatoidní artritidy - rozdíly mezi verzí 2013 a 2010
- Metatarzalgie u pacientů s revmatoidní artritidou
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metatarzalgie u pacientů s revmatoidní artritidou
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



