-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Myozitida s inkluzními tělísky asociovaná s revmatoidní artritidou – kazuistika
Inclusion body myositis in association with rheumatoid arthritis – case report
Inclusion body myositis is a disease belonging to the group of idiopathic inflammatory myopathies. It is known for its resistance to treatment and poor prognosis. To date, treatment with corticosteroids, immunosuppressants or intravenous immunoglobulins has not proved to be of beneficial effect. We describe a case of a male patient, who was simultaneously diagnosed with inclusion body myositis and rheumatoid arthritis. In this case, treatment with corticosteroids had a favorable laboratory and clinical effect. Association of these two diseases is rare. To date, only four cases of such patients have been described in the literature. An association with other inflammatory rheumatic diseases, especially Sjögren's syndrome, as well as systemic lupus erythematosus and systemic sclerosis, is described more frequently. In these cases, a favorable response to treatment with corticosteroids was reported as well.
Key words:
Inclusion body myositis, rheumatoid arthritis, corticosteroids
Autoři: M. Tošovský 1; J. Zámečník 2
Působiště autorů: II. interní gastroenterologická klinika, FN LF UK Hradec Králové 1; Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes. Revmatol., 22, 2014, No. 2, p. 108-112.
Kategorie: Kazuistika
Souhrn
Myozitida s inkluzními tělísky je onemocnění patřící do skupiny idiopatických zánětlivých myopatií. Je známé svou rezistencí k léčbě a nepříznivou prognozou. Dosud nebyl prokázán příznivý efekt léčby kortikosteroidy, imunosupresivy ani intravenozními imunoglobuliny. Popisujeme případ muže, u něhož byla současně diagnostikována myozitida s inkluzními tělísky a revmatoidní artritida. Léčba kortikosteroidy měla v tomto případě příznivý laboratorní i klinický efekt. Asociace těchto dvou onemocnění je vzácná, v literatuře byly dosud popsány pouze čtyři případy takových pacientů. Častěji je popisována asociace s jinými zánětlivými revmatickými onemocněními, zejména Sjögrenovým syndromem, dále pak systémovým lupus erythematodes a systémovou sklerodermií. V těchto případech byla rovněž zaznamenána příznivá odpověď na léčbu kortikosteroidy.
Klíčová slova:
Myozitida s inkluzními tělísky, revmatoidní artritda, kortikosteroidyÚvod
Myozitidu s inkluzními tělísky (inclusion body myozitis, IBM) řadíme mezi idiopatické zánětlivé myopatie. Onemocnění je známé svou rezistencí k léčbě a nepříznivou prognózou. Popisujeme případ muže, u kterého se vyskytla myozitida s inkluzními tělísky společně s revmatoidní artritidou a u kterého došlo k dobré odpovědi na léčbu. V diskuzi se stručně ohlížíme za publikovanými případy pacientů, u kterých se myozitida s inkluzními tělísky vyskytla společně s dalšími zánětlivými revmatickými nemocemi a zmiňujeme prognózu těchto pacientů.
Popis případu
57letý pacient byl odeslán praktickým lékařem do revmatologické ambulance pro bolest drobných ručních kloubů a zápěstí. Jednalo se o pacienta s arteriální hypertenzí a dávnou anamnézou vředové choroby (před 27 lety), kouřil 15 cigaret denně, pil 4–5 piv týdně. Užíval quinapril 5 mg denně. Uváděl několik let zvýšené jaterní testy.
Pacient si stěžoval na více než rok trvající bolest a otoky metakarpofalangeálních (MCP) kloubů a zápěstí oboustranně, objektivně byla přítomna artritida těchto kloubů (palpační bolestivost i otoky), byla naznačena ulnární deviace v MCP kloubech. Zánětlivé parametry byly zvýšené (CRP 7,3 mg/l, FW 96 mm/hod).
Kromě kloubních obtíží si pacient dále stěžoval na slabost a ztrátu síly svalů horních i dolních končetin, úbytek svalové hmoty, váhový úbytek (26 kg/12–18 měsíců, t.č. již nepokračující). Pacient nesvedl dřep a ruce nad hlavu zvedl pouze s obtížemi, polykací obtíže neudával. Kožní projevy nebyly přítomny, dechové obtíže pacient neuváděl, dýchání bylo čisté, bez vedlejších fenomenů. Pro pokles svalové síly byl již pacient recentně vyšetřován v neurologické ambulanci a absolvoval již některá vyšetření. Laboratorně byla přítomna zvýšená aktivita kreatinfosfokinázy (CK 11,59 µkat/l) a hladina myoglobinu (575,8 µg/l), současně byly zvýšeny sérové aktivity transamináz (ALT 0,94 µkat/l, AST 1,68 µkat/l) při normální sérové aktivitě GMT (0,28 µkat/l). Thyreopatie byla vyloučena. Elekromyografické vyšetření prokázalo myopatické změny proximálních svalových skupin, dále počínající sy. kubitálního kanálu oboustranně a známky symetrické axonální senzitivní polyneuropatie. Při vyšetření stehen magnetickou rezonancí byl přítomen rozsáhlý symetrický edém svalů s mírnou tukovou degenerací podél sept (obr. 1) a bylo označeno vhodné místo k biopsii, která byla následně provedena. V době našeho ambulantního vyšetření zatím nebyl výsledek znám.
Obr. 1. Magnetická rezonance (STIR) svalů stehen. 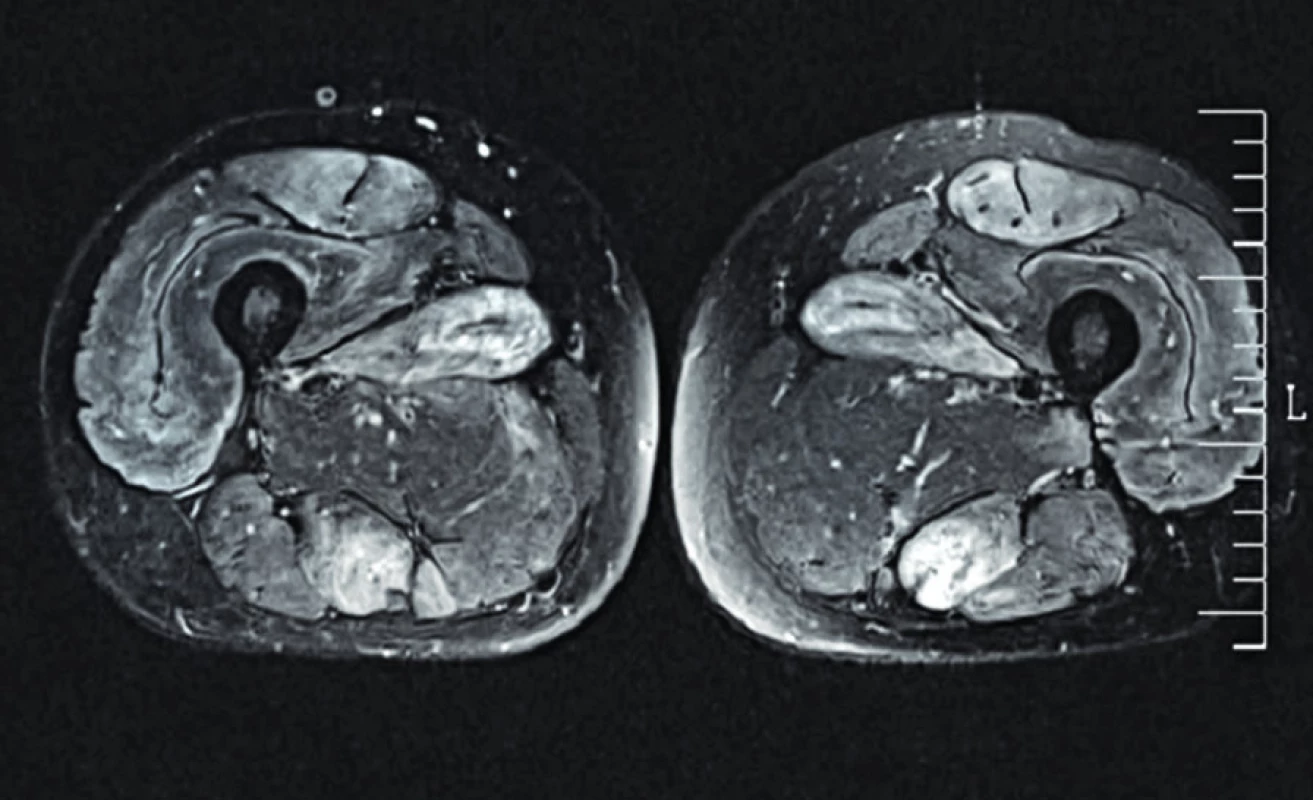
Pracovní diagnóza zněla: suspektní idiopatická zánětlivá myopatie, polyartritida (pravděpodobně při idiopatické zánětlivé myopatii), váhový úbytek – nepokračující. Pacient byl objednán k hospitalizaci k zahájení terapie a dovyšetření.
Během hospitalizace byla (po vyloučení vředové choroby) podána série intravenózních pulzů glukokortikoidů (5x1 g methylprednisolonu) s velmi dobrým efektem na kloubní obtíže – došlo ke kompletnímu vymizení otoků i bolestivosti kloubů. Současně došlo k úplné normalizaci svalových testů (CK 1,35 µkat/l, myoglobin 76,2 µg/l).
Myozitidám specifické či asociované protilátky byly negativní (anti Jo1, anti Ku, anti Mi, anti Pl7, anti Pl12, anti SRP, PM-Scl), prokázali jsme však přítomnost revmatoidního faktoru latexfixační reakcí (1 : 20480) a metodou ELISA ve všech třídách (více než 500 IU/ml), dále přítomnost protilátek proti citrulinovaným peptidům (aCCP 520,3 U/ml). Současně byla zaznamenána výrazná pozitivita ANA/IF (+++) a antidsDNA/IF (+++). Na rentgenovém snímku rukou byla přítomna periartikulární osteoporóza, zúžení kloubních štěrbin a erozivní změny na zápěstních kůstkách (obr. 2). Klinické projevy systémového lupus erythematodes jsme neprokázali.
Obr. 2. RTG rukou – periartikulární osteoporóza, zúžení kloubních štěrbin a erozivní změny na zápěstních kůstkách. 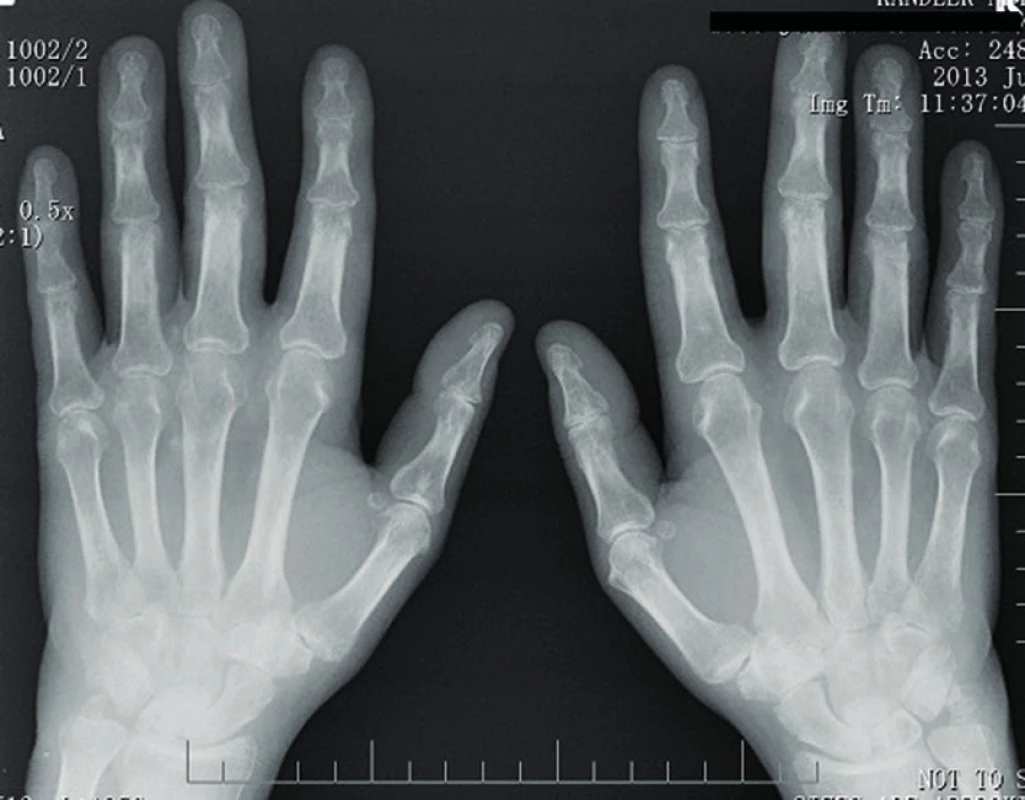
Histologicky byl ve svalovině přítomen výrazný endomyziální CD8+ lymfocytární infiltrát (obr. 3) podobný polymyozitidě. V cytoplazmě svalových vláken byla ale pozorována přítomnost početných lemovaných vakuol (obr. 4) a eozinofilních inluzí (obr. 5), které na úrovni elektronového mikroskopu odpovídaly typickým filamentózním IBM-inkluzím. Nález tak byl uzavřen jako myozitida s inkluzními tělísky.
Obr. 3. Endomyziální infiltrace lymfocyty, částečně podobná intersticiální infiltraci při polymyozitidě. Barvení izopentanem zmraženého řezu hematoxylinem a eozinem, originální zvětšení 200x. 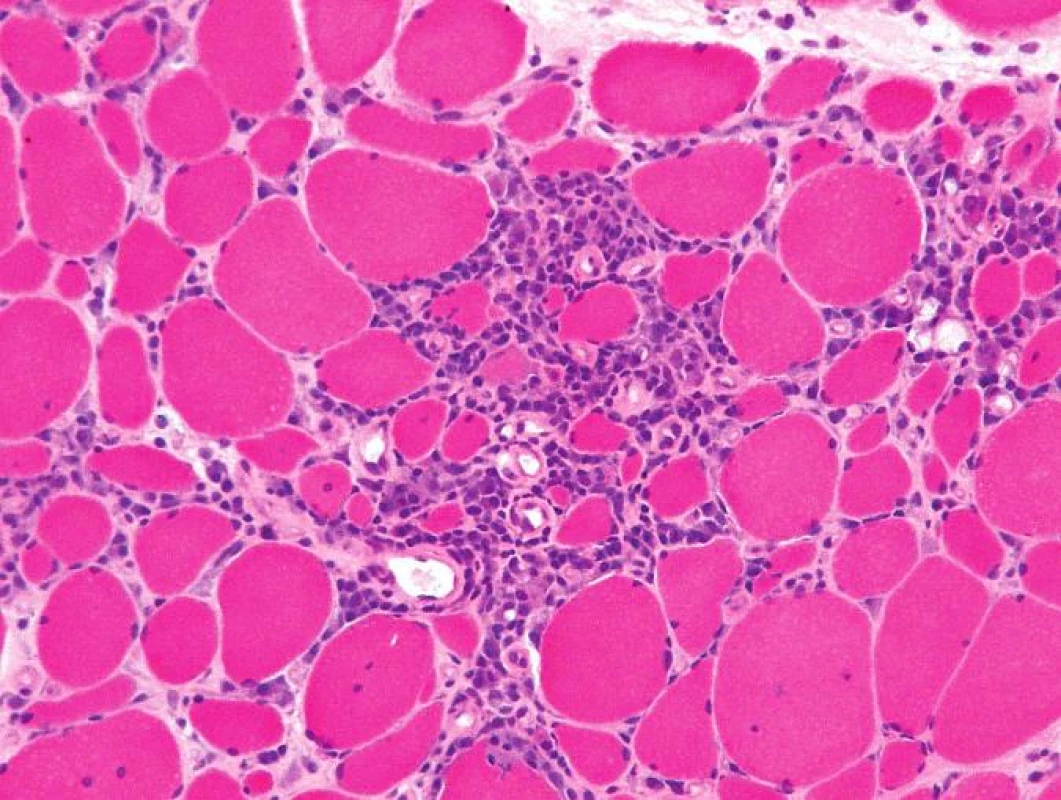
Obr. 4. Imunohistochemické vyšetření prokázalo složení intersticiální zánětlivé infiltrace převážně z CD8+ T-lymfocytů. Originální zvětšení 200x. 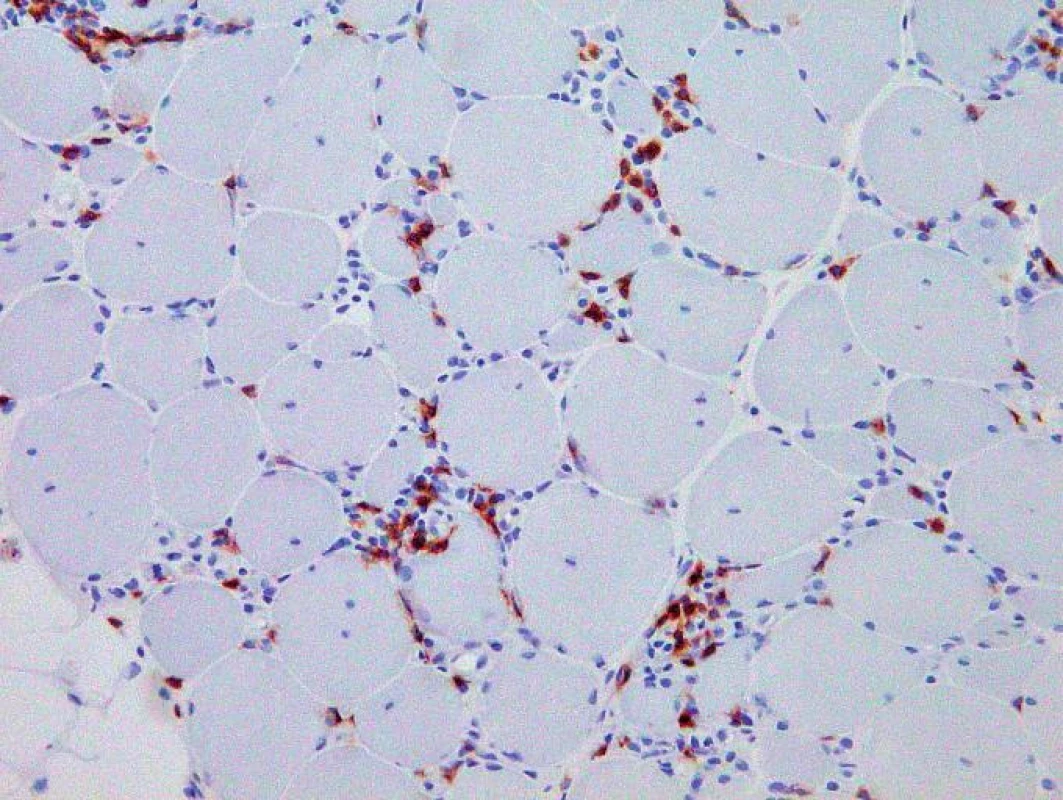
Obr. 5. Lemované vakuoly s bazofilním lemem a granulárním materiálem v cytoplazmě vláken. Barvení Izopentanem zmraženého řezu hematoxylinem a eozinem, originální zvětšení 600x. 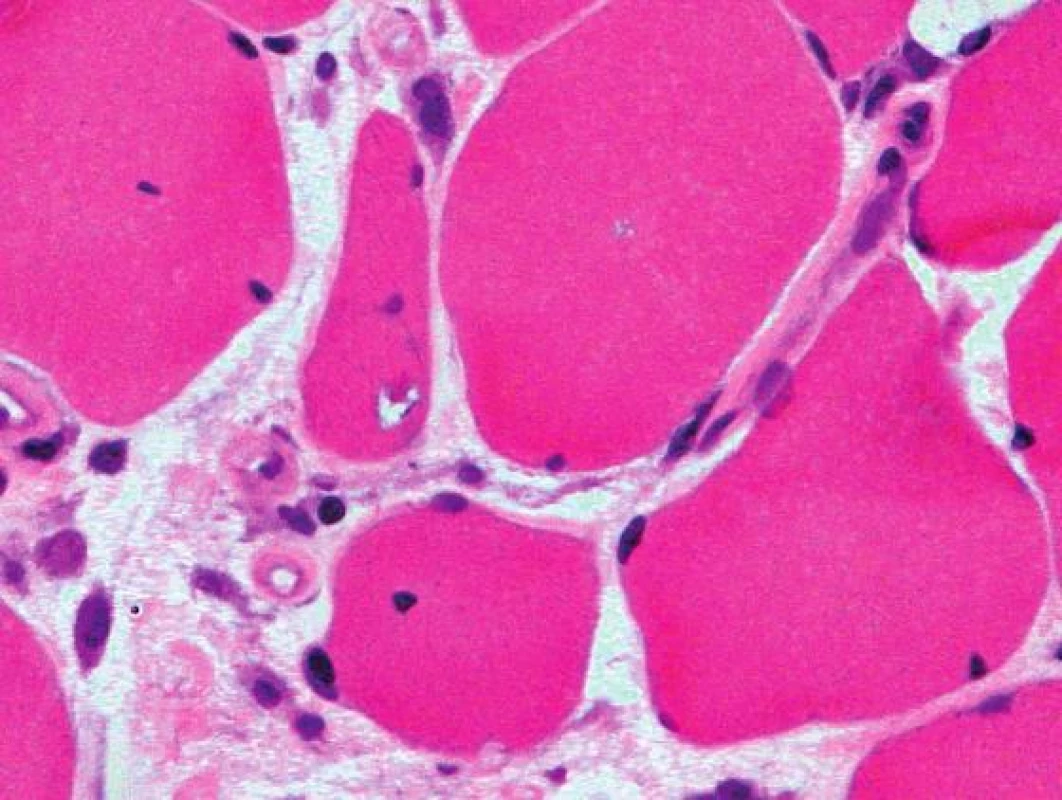
Obr. 6. Objemné intracytoplazmatické eozinofilní inkluze byly zřetelné v mnoha vláknech už na úrovni světelného mikroskopu. Barvení izopentanem zmraženého řezu hematoxylinem a eozinem, originální zvětšení 400x. 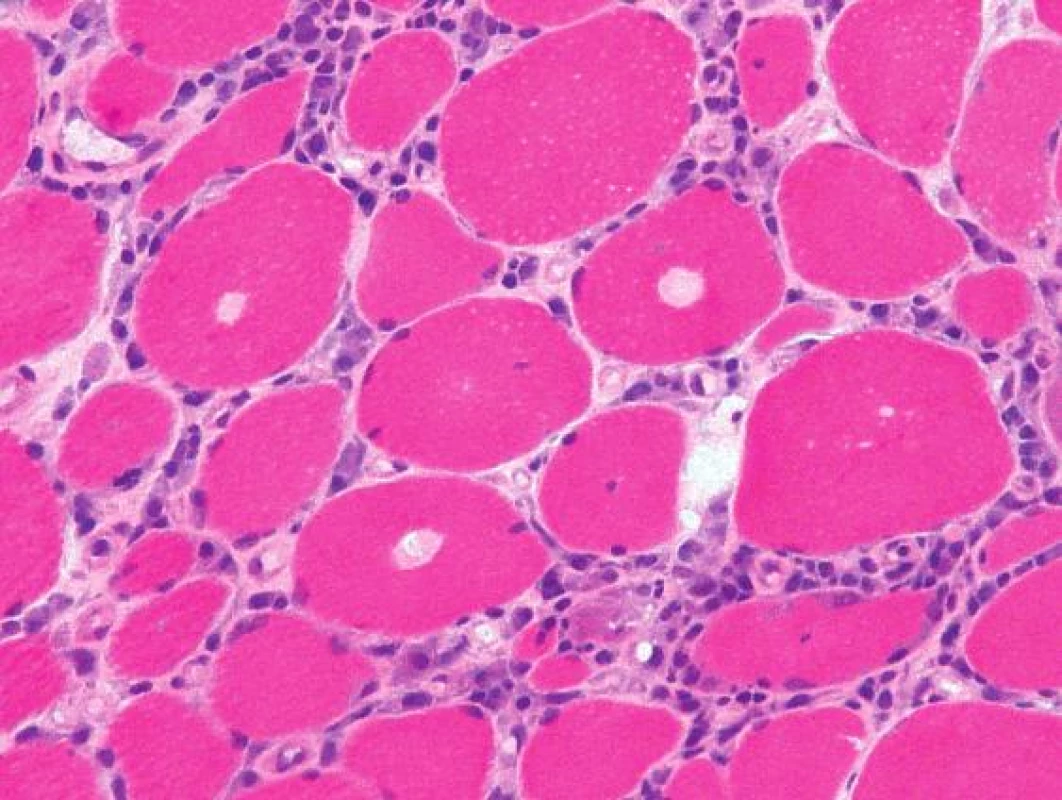
Stav jsme proto uzavřeli jako kombinaci myozitidy s inkluzními tělísky společně s IgM RF pozitivní revmatoidní artritidou a pozitivitou anti-dsDNA protilátek bez projevů systémového lupus erythematodes.
Pokračovali jsme v perorální léčbě kortikosteroidy (methylprednisolon 24 mg denně) v kombinaci s methotrexátem 15 mg týdně, pacient byl propuštěn do domácí péče. Při první ambulantní kontrole byl pacient zcela bez bolestí kloubů (klinicky bez známek artritidy), došlo ke zlepšení svalové síly – zvládl dřep, přibral na hmotnosti. Došlo k normalizaci zánětlivých parametrů (CRP 1,7 mg/l) a markerů svalového postižení (CK 1,35 µkat/l, myoglobin 58,6 µg/l), došlo k vymizení anti-dsDNA protilátek. Dávka kortikosteroidů byla snížena (16 mg methylprednisolonu denně). I další vývoj stavu pacienta byl příznivý.
Diskuse
Prokázali jsme současný výskyt revmatoidní artritidy a myozitidy s inkluzními tělísky. Pacient splňoval jak klasifikační kriteria EULAR/ACR 2010 pro revmatoidní artritidu (1), tak ACR kritéria z roku 1987 (2). Diagnóza myozitidy byla stanovena na základě klinického obrazu a typického histologického nálezu.
Myozitidy s inkluzními tělísky řadíme mezi idiopatické zánětlivé myopatie, které tvoří 15–28 % těchto myopatií (3, 4). Postihuje častěji muže, průměrný věk začátku onemocnění je přibližně 60 let. K rozvoji svalové slabosti dochází často velmi plíživě. Postižení bývá v 85–90 % symetrické. Nejčastěji jsou postiženy proximální svaly dolních končetin, později postihuje i horní končetiny. Mohou být postiženy i distální svalové skupiny a toto postižení v některých případech dominuje (5, 6, 7, 8, 9). U našeho pacienta byly horní končetiny a distální partie dolních končetin rovněž postiženy. Naopak dysfagické obtíže (popisovány v 35–50 % případů) (9, 10, 11) a myalgie postižených svalů (popisovány v 40 % případů) (8) pacient neudával.
Elevace kreatinfosfokinázy nebývá extrémní (do desetinásobku normy) (6), stejně tomu bylo i v našem případě. Při EMG vyšetření bývají kromě klasických myopatických změn v některých případech rovněž zachyceny i změny neuropatické (6, 7, 8).
Také u vyšetření magnetickou rezonancí byla popsána některá specifika onemocnění. Změny jsou častěji lokalizovány na předních svalových skupinách, častěji je přítomno i postižení distálních skupin a častější je rovněž asymetrie postižení (12).
V histologickém nálezu bývá literárně přítomna infiltrace endomysia zánětlivými buňkami (CD8+ T-lymfocyty), lemované vakuoly v sarkoplazmě (je nutné vyšetřovat vzorek šokově zmražený v izopentanu), eozinofilní inkluze, atrofická a hypertrofická vlákna, v elektronovém mikroskopu pak vláknité inkluze (13, 14, 15). Histologický nález našeho pacienta odpovídal těmto popisovaným změnám.
Myozitida s inkluzními tělísky je známá svou rezistencí na standardní léčbu. Kortikosteroidy buď neměly žádný efekt na svalovou sílu (n = 25) (6), nebo vykazovaly pouze částečný efekt ve smyslu mírného zlepšení nebo stabilizace stavu (7). V jiném sledování došlo při léčbě k poklesu kreatinfosfokinázy, avšak bez klinického efektu na svalovou sílu (16) Naopak pacienti s myozitidou asociovanou s jinými systémovými onemocněními (Sjögrenův syndrom, systémový lupus erythematodes) vykazovali lepší odpověď na léčbu (8, 17, 18, 19, 20, 21). U imunosupresiv (methotrexát, azathioprin) nebylo dle literatury dosaženo významného efektu (7, 8, 16, 22), stejně tak léčba intravenózními polyvalentními imunoglobuliny se ukázala neefektivní (3 dvojitě slepé, placebem kontrolované studie) (23, 24, 25). První pozitivní výsledky naopak přináší použití alemtuzumabu (anti CD52) (26).
U našeho pacienta se myozitida s inkluzními tělísky vyskytla společně s revmatoidní artritidou. Toto spojení je celkem vzácné, dosud byly publikovány pouze čtyři případy této asociace. U dvou pacientů se navíc myozitida s inkluzními tělísky objevila v průběhu terapie anti-TNFα (27, 28, 29).
Častěji naopak bývá popisována asociace s jinými systémovými revmatickými nemocemi, zejména Sjögrenovým syndromem (30), dále pak systémovým lupus erythematodes a systémovou sklerodermií. V těchto případech byla zaznamenána lepší odpověď na léčbu (8, 17, 18, 19, 20, 21).
Závěr
Myozitida s inkluzními tělísky je idiopatickou zánětlivou myopatií, která má svá specifika zejména v klinickém obraze a v odpovědi na léčbu. V literatuře byl popsán výskyt společně s některými dalšími systémovými revmatickými nemocemi a v těchto případech pacienti vykazovali lepší odpověď na léčbu a měli příznivější prognózu.
Poděkování
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Adresa pro korespondenci:
MUDr. Marian Tošovský
II. interní gastroenterologická klinika, Fakultní nemocnice v HK
Sokolská 581
500 05 Hradec Králové
email: marian.tosovsky@fnhk.cz
Zdroje
1. Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010; 69 : 1580–1588.
2. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31 : 315–24.
3. Kula RW, Sawchak JA, Sher JH. Inclusion body myositis. Curr Opin Rheumatol 1989; 1 : 460.
4. Mhiri C, Gherardi R. Inclusion body myositis in French patients. A clinicopathological evaluation. Neuropathol Appl Neurobiol 1990; 16 : 333.
5. Ringel SP, Kenny CE, Neville HE, et al. Spectrum of inclusion body myositis. Arch Neurol 1987; 44 : 1154.
6. Lotz BP, Engel AG, Nishino H et al. Inclusion body myositis. Observation in 40 patients. Brain 1989; 112(Pt3): 727.
7. Sayers ME, Chou SM, Calabrese LH. Inclusion body myositi: analysis of 32 cases. J Rheumatol 1992; 19 : 1385.
8. Beyenburg S, Zierz S, Jerusalem F. Inclusion body myositis: clinical and histopathological features of 36 patients. Clin Investig 1993; 71 : 351.
9. Felice KJ, North WA. Inclusion body myositis in Connecticut: observation in 35 patients during an 8-year period. Medicine 2001; 80 : 320.
10. Wintzen AR, Bots GT, de Bakker HM, et al. Dysphagia in inclusion body myositis. J Neurol Neurosurg Psychiatry 1988; 51 : 1542.
11. Riminton DS, Chambers ST, Parkin PJ, et al. Inclusion body myositis presenting solely as dysphagia. Neurology 1993; 43 : 1241.
12. Dion E, Cherin P, Payan C, et al. Magnetic resonance imaging criteria for distinguishing between inclusion body myositis and polymyositis. J Rheumatol 2002; 29 : 1897.
13. Mikol J, Engel AG. Inclusion body myositis. In: Engel AG, Franzini-Armstrong C (Eds). Myology, 2nd Ed. New York: McGraw-Hill; 1994. p. 1385
14. Engel WK, Askanas V. Inclusion-body myositis: clinical, diagnostic, and pathologic aspects. Neurology 2006; 66: S20.
15. Engel AG, Arahata K. Monoclonal antibody analysis of mononuclear cells in myopathies. II: Phenotypes of autoinvasive cells in polymyositsi and inclusion body myositis. Ann Neurol 1984; 16 : 209.
16. Leff RL, Miller FW, Hicks J, et al. The treatment of inclusion body myositis: a retrospective review and a randomized, prospective trial of immunosupressive therapy. Medicene (Baltimore) 1993; 72 : 225.
17. Yood RA, Smith TW. Inclusion body myositis and systemic lupus erythemathosus. J Rheumatol 1985; 12 : 568.
18. Cohen MR, Sulaiman AR, Garancis JC, Wortman RL. Clinical heterogeneity and treatment responce in inclusion body myositis. Arthritis Rheum 1989; 32 : 734.
19. Derk CT, Vivino FB, Kenyon L, Mandel S. Inclusion body myositis in connective tissue disorders: case report and review of the literature. Clin Rheumatol 2003; 22 : 324–3258.
20. Massawi G, Hickling P, Hilton D, Patterson C. Inclusion body myositis evolving in systemic lupus erytematosus? A case report. Rheumatology 2003; 42 : 1012–1014.
21. Quartuccio L, De Marci G, Scott CA, et al. Treatment of inclusion body myositis with cyclosporin-A or tacrolimus: successful long-term management in patients with earlier active disease and concomitant autoimmune features. Clin Exp Rheumatol 2007; 25 : 246–251.
22. Badrising UA, Maat. Schieman ML, Ferrari MD, et al. Comparison of weakness progresion in inclusion body myositis during treatment with methotrexate or placebo. Ann Neurol 2002; 51 : 369.
23. Dalakas MC, Koffman B, Fujii M, et al. A controlled study of intravenous immunoglobulin combined with prednisone in treatment of IBM. Neurology 2001; 56 : 323.
24. Dalakas MC, Sonies B, Dambrosia, J et al. Treatment of inclusion-body myositis with IVIg: a double-blind, placebo controlled study. Neurology 1997; 48 : 721.
25. Walter MC, Lochmüller H, Toepfer M, et al. High-dose immunoglobulin therapy in sporadic inclusion body myositis: a double-blind, pacebo-controlled study. J Neurol 2000; 247 : 22.
26. Dalakas MC, Rakocevis G, Schidt J, et al. Brain 2009; 132 : 1536–44.
27. Soden M, Boundy K, Burrow D, et al. Inclusion body myositis in association with rheumatoid arthritis. J Rheumatol 1994; 21 : 344–346.
28. Kalla R, Soumakiyan M, Tuck S. A case of inclusion body myositis responsive to prednisolone therapy. Clin Rheumatol 2009; 28 (Suppl 1): 21–22.
29. Vordebäumen S, Neuen-Jacob E, Richter J, et al. Inclusion body myositis in a patient with long standing rheumatoin arthritis treated with anti-TNFα and rituximab. Clin Rheumatol 2010; 29 : 555–558.
30. Kanellopulos P, Baltoyiannis C, Tzioufas AG. Primary Sjögren´s syndrome associated with inclusion body myositis. Rheumatology 2002; 41 : 440–444.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2014 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Myozitida s inkluzními tělísky asociovaná s revmatoidní artritidou – kazuistika
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- Doporučení EULAR pro léčbu revmatoidní artritidy - rozdíly mezi verzí 2013 a 2010
- Metatarzalgie u pacientů s revmatoidní artritidou
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metatarzalgie u pacientů s revmatoidní artritidou
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



