-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
58. výroční sjezd českých a slovenských revmatologů
Vyšlo v časopise: Čes. Revmatol., 22, 2014, No. 4, p. 133-174.
Kategorie: Abstrakta
Hradec Králové, 17.-20. 9. 2014
58. výroční sjezd českých a slovenských revmatologů se konal ve dnech 17. – 20. 9. 2014 v Kongresovém centru ALDIS v Hradci Králové. Registrováno bylo 550 účastníků. Odborný program probíhal v 11 blocích, zazněly přednášky v satelitních sympoziích a edukačních blocích. Součástí akce byla i prezentace formou posterových sdělení, ale i konference zdravotnických pracovníků nelékařských profesí. V přilehlých prostorách kongresového centra se nacházelo 32 výstavních stánků, převážně farmaceutických společností
PŘEDNÁŠKY
Alkaptonúria a ochronóza
Rovenský J
Národný ústav reumatických chorôb, Piešťany
Alkaptonúria (AKU) je dedičná porucha metabolismu aminokyselín fenylalanínu a tyrozínu, pri ktorej sa následkom defektnej aktivity enzýmu oxidázy kyseliny homogentisovej táto kyselina nerozštiepi, hromadí sa v organizme a vylučuje sa močom. Jej polymér (ochronotický pigment) impregnuje slabšie vyživované orgány, ako je napr. chrupka. Ide o zriedkavé ochorenie, ktoré u nás postihuje 1 z 19 000 pacientov.
Prvé príznaky alkaptonúrie sa objavujú už u novorodencov. Tí majú tmavý ušný maz, ich moč na vzduchu tmavne a na plienkach zanecháva hnedočierne škvrny. Usadzovanie ochronotického pigmentu sa môže zistiť pri náhodnom odbornom vyšetrení v prednom segmente oka. Pigmentové škvrny sú najnápadnejšie na očnom bielku. Neskôr sú dobre viditeľné aj voľným okom. Keďže pacienti fungujú dlhý čas bez ťažkostí, pre poruchy zraku lekársku pomoc obvykle nevyhľadávajú.
Po 10. až 15. roku života sa súbežne s očnými prejavmi postupne objavujú aj viditeľné ochronotické zmeny na ušniciach. Na chrupke sú vidieť nebolestivé, tvrdé, drsné hrbolčeky, pevne spojené so spodinou, ktorá tmavomodro a fialovo presvitá cez jemnú pokožku. V pokročilom štádiu môžu vznikať deformácie ušnice. Vonkajší zvukovod je bez zmien, ušný maz je tmavohnedý, bubienok tmavší, s modrastým odtieňom. Pacienti môžu trpieť aj výraznejším postihnutím percepčného aparátu. Prejavy na sluchovom orgáne sú charakteristické, a práve preto často vedú k diagnostikovaniu ochorenia.
Typickým prejavom ochorenia sú i zmeny na koži, a to najmä hnedastá alebo modrastá pigmentácia kože pod pazuchou, na tvári, krku, rukách a zriedkavo aj na nechtoch. Ochronotický pigment sa však usádza aj na vnútorných orgánoch, napr. na srdcovom svale či v cievach.
Z klinického hľadiska sa najzávažnejší proces odohráva na kĺboch. Hovoríme o ochronotickej artropatii. Ide o degeneratívny proces, ktorého rozvoj je dobre známy: má tendenciu k invalidizácii. Od začiatku ochorenia je ťažiskom týchto klinických prejavov chrbtica.
Alkaptonúria sa diagnostikuje dôkazom kyseliny homogentisovej v moči, ktorá sa u zdravého človeka nevyskytuje. Zakladá sa tiež na náleze pigmentových škvŕn na očných štruktúrach, v podpazuší a na röntgenovom náleze kalcifikovaných medzistavcových platničiek.
Liečba alkaptonúrie bola doteraz iba symptomatická. Ochorenie sa liečilo najmä dávkami vitamínu C, nesteroidnými antireumatikami a rehabilitačnými postupmi.
V súčasnosti prebieha v Národnom ústave reumatických chorôb v Piešťanoch klinická štúdia s liekom, ktorý pre pacientov predstavuje nádej na zastavenie chorobného procesu a zlepšenie zdravotného stavu.
Klinická úskalí u vaskulitid v revmatologii
Hrnčíř Zb
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Problematika vaskulitid zasahuje nestejným způsobem do všech oborů klinické medicíny. V revmatologii jde zpravidla o akutní/subakutní stavy, které mohou svojí variabilitou překvapit i zkušeného. Normativním východiskem je revize nomenklatury podle mezinárodního konsenzu z Chapel Hill 2012: zahrnuje i vaskulitidy s nepřímým vztahem k infektům jako mediátorům imunitní reakce, ale ne přímé infekty cévní stěny. Primární rovinou kategorizace je predominance podle typu postižených cév. U velkých cév, tj. aorty a jejich větví, jde o obrovskobuněčnou arteritidu (OBA); její varianta u mladých žen (Takayasuova choroba) může být asymptomatická i při zániku části aorty. U osob > 50 let je aktuální vztah OBA a polymyalgia rheumatica (PMR). Komplex OBA-PMR má dvě úskalí: závažnou arteritidu bez zřejmých změn na extrakraniálních (spánkových) tepnách a riziko rychlé ztráty zraku při přední ischemické neuropatii optiku. Fundoskopie sítnice je indikována u každého podezření na OBA a stejně tak Dopplerova US magistrálních a spánkových tepen (hypoechogenní „halo“ spíše u typické OBA); aortitidu odhalí pozitronová emisní tomografie (PET), popř. PET/CT. OBA je nejčastější vaskulitidou v dospělosti a v Evropě i nejčastější revmatologickou příčinou horečky nejasného původu (FUO). U vaskulitid středně velkých cév jde hlavně o polyarteritis nodosa (PAN), bez autoprotilátek (vyjma antifosfolipidových) a s infarzacemi ledvin, ale ne s glomerulonefritidou. Diskriminátorem vaskulitid malých cév je přítomnost nebo chybění imunokomplexových depozit (ID). Absence/téměř absence ID signuje ANCA asociované vaskulitidy bez granulomatózy (mikroskopická polyangiitida) nebo s granulomatózou, tj. granulomatózní polyangiitidu (GPA, Wegenerovu) a eozinofilní (alergickou) granulomatózu s polyangitidou (EGPA, syndrom Churga a Straussové). Chybění ANCA v séru neznamená lepší prognózu, a např. u EGPA je spojeno s větším rizikem i fatální kardiomyopatie. U GPA může postižení drobných ručních kloubů předstírat RFs a ACPA negativní RA; proto pozor na nález v moči. Při limitaci GPA na hlavu a krk může být komorbiditou choroba IgG4. U vaskulitid jednoho orgánového systému jde v revmatologii obvykle o leukocytoklastickou kožní vaskulitidu (LKV); je to nejčastější vaskulitický syndrom po OBA. Hlavním klinickým projevem LKV je hmatná purpura a bioptickou konfirmací „jaderný prach“ z rozpadlých PMN. LKV může být konkomitancí RA, SLE aj. imunopatologických chorob, vč. systémových vaskulitid, ale také infektu a neoplazie. Z asociovaných vaskulitid je revmatologicky aktuální zvl. vaskulitida u RA: vedle digitálních změn s infarzacemi/hemoragiemi může jít o variabilně rozsáhlé postižení, až po obraz typu PAN. RA s rizikem vaskulitidy má tuto charakteristiku: muž > žena, nikotinismus, trvání >10 let, destrukce kloubů, revmatoidní uzly, autoprotilátky (RFs, ACPA) a sdílený epitop (SE genotypy *0401/*0401, *0401/*0404, *0101/*0401). Klinická úskalí zmiňovaných vaskulitid jsou doložena buď jako stručná případová studie nebo vesměs autentickou multioborovou obrazovou dokumentací.
S vaskulitidami se setkává každý revmatolog: smyslem sdělení je usnadnit orientaci ve variabilitě jejich klinických projevů a v asociačním kontextu evokovat osobní zkušenost posluchačů/čtenářů.
Enteropatie z nesteroidních antiflogistik v klinické praxi a experimentu
Kopáčová M
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Léčba nesteroidními antiflogistiky (NSAID) je spojena s rizikem vedlejších účinků na gastrointestinální trakt. NSAID jsou nejčastěji předepisovanými a užívanými medikamenty prakticky ve všech věkových skupinách nemocných a v řadě medicínských oborů. Přispívají k tomu nepochybně i četné reklamy v médiích a volný prodej NSAID. Vedlejší účinky na gastrointestinální trakt se projevují i při podávání nízkých dávek a aplikaci jinou než orální cestou. NSAID mohou způsobit závažné morfologické postižení kterékoli části trávicího traktu spojené s významným vzestupem morbidity a mortality. Postižení tenkého střeva mnohdy uniká pozornosti, nejen proto, že na tuto možnost není pomýšleno, ale také proto, že diagnostika tenkého střeva je obtížnější. Velká část pacientů má zcela bezpříznakový průběh, často je prvním projevem postižení střeva anémie či zjevné krvácení do trávicího traktu.Poškození sliznice trávicího traktu nesteroidními antiflogistiky (označované jako gastropatie, enteropatie či kolopatie z nesteroidních antirevmatik) může mít řadu podob – od erozí přes ulcerace až k jejich komplikacím (krvácení, anémie, perforace, diafragmatické stenózy, dysfunkce tenkého střeva, malasimilace, subileózní až ileózní stavy). Etiopatogeneze poškození sliznice NSAID je multifaktoriální. Riziko krvácení je vyšší u žen a stoupá s věkem (nad 60 let), s kombinací různých NSAID, se současnou medikací antiagregancii a/nebo antikoagulancii.
Prevalence tenkostřevní enteropatie je odhadována na 8–20 % u osob dlouhodobě léčených NSAID. Patofyziologicky se pravděpodobně jedná o dvoustupňový proces. V první fázi dochází k poškození mitochondrií buněk sliznice tenkého střeva (s neschopností udržet energetický metabolismus) a narušení mezibuněčných těsných spojení (tight junctions). Druhotné mechanismy jsou důsledkem narušené bariérové funkce tenkého střeva (leukocytární infiltrace, poškození cytokiny, solemi žlučových kyselin, indukce fibroprodukce atd.). Klinicky se projevuje nejčastěji chronickou hypochromní sideropenickou anémií z vleklých okultních krevních ztrát do trávicího ústrojí, může se projevit také nejasnými bolestmi břicha, hubnutím, průjmy nebo fibrózními stenózami se subileózními stavy. Život ohrožující může být masivní krvácení nebo perforace tenkého střeva. Obdobné projevy nacházíme i v oblasti tračníku.Pro diagnostiku je rozhodující enteroskopie (balonová enteroskopie a kapslová enteroskopie) a koloskopie. Endoskopicky nacházíme erytém sliznice, afty, eroze, ulcerace, fibrózní stenózy či striktury. Postižení je mnohdy vícečetné. Akutní krvácení je možno ošetřit endoskopicky (nejčastěji termickou koagulací). Diafragmatické stenózy řešíme endoskopickou balonovou dilatací. Farmakologická léčba je často svízelná, zejména není-li možno NSAID vysadit. Nadějné je širší používání selektivních COX-II inhibitorů. Podáváme inhibitory protonové pumpy. Perforační příhody je třeba řešit chirurgicky.
Podpořeno programem Prvouk P37/08.
Whippleova choroba – systémové onemocnění s revmatickými a gastrointestinálními projevy
Bureš J
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Whippleova choroba je chronické infekční systémové onemocnění způsobené bakterií Tropheryma whipplei (patřící mezi Actinomycetales). Jedná se o vzácnou chorobu, poprvé byla popsána v roce 1907, dosud bylo celosvětově publikováno necelých 1000 případů. Častěji jsou postiženi muži běloši, 2/3 pacientů mají v anamnéze profesionální kontakt s půdou (zemědělci) nebo s odpadními vodami. Chronická nedeformující polyartritida je charakteristickým časným příznakem. Kloubní obtíže předcházejí v průměru 6 let gastrointestinální symptomatologií (průjmy s hubnutím a malnutricí). Dalšími příznaky jsou polyserozitida, lymfadenopatie a subfebrilie. Diagnostika může být obtížná při absenci gastrointestinálních příznaků (15 %), zavádějící mohou být projevy psychiatrické a neurologické (až ve 20 %). Pro správné rozpoznání choroby je rozhodující duodenoskopie s odběrem biopsií k histologickému vyšetření (charakteristické jsou PAS-pozitivní makrofágy v lamina propria mucosae). V léčbě se doporučuje i.v. penicilin + i.v. gentamycin nebo i.v. ceftriaxon na 2–4 týdny a dále pak p.o. trimethoprim-sulfamethoxazol nebo p.o. doxycyklin + p.o. hydroxychlorochin na jeden rok. U našich pěti nemocných, diagnostikovaných za 20 let, se osvědčilo úvodní podání i.v. amoxicilinu (s kyselinou klavulanovou) + i.v. gentamycinu a poté jednoroční podávání p.o. salazopyrinu s p.o. doxycyklinem. Prognóza Whippleovy choroby je nejistá, až ve 40 % případů může dojít k relapsu onemocnění (především pokud je léčba antibiotiky předčasně ukončena). Horší prognózu mají pacienti s neurologickou symptomatologií. Relaps choroby zpravidla hůře reaguje na opětovnou farmakologickou terapii. Onemocnění je potenciálně fatální.Závěrem, na Whippleovu chorobu je třeba pomýšlet, pokud jsou u pacienta současně přítomny RF-séronegativní artritida, malasimilační syndrom (s průjmy, hubnutím a malnutricí) a subfebrilie. Antibiotická terapie musí být dlouhodobá.
Gastrointestinálne komplikácie pri vrodených chorobách spojiva
Rybár I1/, Vavrečka A2/
1/Klinika reumatológie LF SZU a NÚRCH Piešťany, 2/Klinika gastroenterológie LF SZU a UNB Bratislava
Vrodené choroby spojiva predstavujú chorobné jednotky, ktorých príznaky a znaky sú spôsobené génovou mutáciou, ktorá zapríčiňuje kvalitatívnu, alebo kvantitatívnu poruchu sekrécie kolagénu, alebo elastínu ako najdôležitejších štrukturálnych elementov podporného a pohybového systému. Do tejto skupiny patrí Marfanov syndróm, Ehler-Danlosov syndróm, osteogenesis imperfecta, Sticklerov syndróm i benígny konštitučný hypermobilný syndróm. Každá z týchto chorôb má určité charakteristické artikulárne aj extraartikulárne príznaky a znaky. Pre Marfanov syndróm je to vysoký vzrast, arachnodaktýlia, gotické podnebie, kĺbová hypermobilita, ektopia šošovky či aneuryzma aorty. Ehlers-Danlosov syndróm charakterizuje popri kĺbovej hypermobilite a kožnej hyperelasticite aj sklon k ruptúram ciev a vnútorných orgánov, ktorý je rôznym spôsobom vyznačený u rôznych variantov tejto choroby. Chorí s osteogenesis imperfecta majú popri zvýšenej lomivosti kostí, poruchám dentície a deformitám končatín a trupu po neadekvátne zhojených zlomeninách intenzívne modré očné skléry. Chorí s benígnym konštitučným hypermobilným syndrómom nejavia na prvý pohľad odchýlky od normy v stavbe tela, ale disponujú značnou kĺbovou hypermobilitou, polyartralgiami, recidivujúci luxáciami kĺbov, ruptúrami väzov a predčasnou osteoartrózou. Gastrointestinálne (GI) príznaky spojené s vrodenými chorobami spojiva zahrňujú spontánne GI krvácanie, spontánnu GI perforáciu, ale aj hiatovú herniu, prolaps rekta, visceroptózu, divertikulózu, pričom tieto komplikácie sa najčastejšie vyskytujú pri určitých formách Ehlers-Danlosovho syndrómu.
Gastrointestinální manifestaceBehcetovy nemoci
Tomš J, Soukup T, Bradna P, Tachecí I, Douda T
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Behcetův syndrom (BS) je multisystémové zánětlivé onemocnění neznámé etiologie, jež se vyznačuje relabujícím průběhem. Přes jistou nejednotnost v klasifikaci je toto onemocnění řazeno k systémovým vaskulitidám. Dominující klinickou manifestací je postižení sliznice dutiny ústní, genitálu, kůže, artritida a postižení očí. U části pacientů přispěje k diagnostice tzv. patergní kožní test. BS je příkladem onemocnění se specifickou geografickou distribucí (země podél tzv. hedvábné stezky), kdy právě v těchto regionech je pozorována silná asociace s antigen HLA B-51.Postižení gastrointestinálního traktu (GIT) se popisuje daleko méně často (0–25 %) než typické kožní a slizniční projevy. Hlavním symptomem bývají bolesti břicha a známky krvácení do GIT (meléna). Při endoskopickém vyšetření je možno prokázat solitární nebo vícečetné ulcerace, zejména v distálním ileu a céku. Závažnými komplikaci se vzácně mohou stát perforace trávicí trubice nebo hemodynamicky významné až život ohrožující krvácení do GIT. Postižení GIT u BS není vždy snadné odlišit od Crohnovy nemoci nebo enteropatie z nesteroidních antirevmatik (obdobný klinický ale i endoskopický obraz). V rámci postižení GIT je u BS potřebné vzít v úvahu i významně zvýšené riziko venózní a arteriální trombózy (portální trombóza, Budd-Chiariho syndrom, trombóza mesenterických nebo lineálních cév).Základem léčby BS s gastrointestinální manifestací jsou glukokortikoidy a imunosupresivní léky. Ovšem doporučení EULAR pro léčbu BS (Ann Rheum Dis 2008) uvádějí, že pro léčbu GIT postižení nejsou k dispozici žádná data vycházející z principů medicíny založené na důkazech. V klinické praxi proto využíváme podobné léčebné postupy jako u idiopatických střevních zánětů (sulfasalazin, azathioprin), u rezistentních případů připadá v úvahu anti TNF alfa terapie event. thalidomid. Při trombotickém postižení je indikována antikoagulační a/nebo antiagregační léčba. Na našem pracovišti jsme v uplynulých 20 letech (1995–2014) zaznamenali celkem 9 pacientů s BS (6 mužů a 3 ženy; věk manifestace 29–41 let; geograficky pacienti z celé České republiky, 1 pacient vietnamské národnosti). Gastrointestinální postižení bylo prokázáno u 3 pacientů (pacient A – terminální ileitida, B – obraz obdobný Crohnově nemoci, C – drobné ulcerace duodena a jejuna). Ve všech třech případech vedla léčba glukokortikoidy v kombinaci s imunosupresivy (azathioprin, methotrexát, kolcichin) ke klinické remisi.
Využití kapslové endoskopie v diagnostice enteropatie z nesteroidních antiflogistik
Tachecí I, Douda T, Bradna P, Kopáčová M, Bureš J
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Poškození tenkého střeva účinkem nesteroidních antiflogistik (NSA) představuje významnou komplikaci jejich podávání. Ačkoliv je toto onemocnění známo již více než čtyřicet let, v jeho diagnostice a léčbě zůstávají dosud zásadní nejasnosti. S nástupem kapslové endoskopie se objevuje možnost enteropatii včas a neinvazivně prokázat a zabránit tím rozvoji závažných komplikací. Cílem naší studie bylo stanovit prevalenci onemocnění u pacientů dlouhodobě užívajících NSA a identifikovat klinické a laboratorní prediktory enteropatie. Do studie bylo zařazeno celkem 51 nemocných léčených NSA dlouhodobě (> 1 měsíc) pro revmatoidní artritidu či osteoartrózu. V souboru bylo 40 žen a 11 mužů (průměrný věk 62 let). Kontrolní skupinu tvořilo 13 zdravých dobrovolníků (5 mužů, 8 žen – průměrný věk 52 let). Všichni podstoupili vstupní vyšetření kapslovou endoskopií, klinické vyšetření, laboratorní testy (zaměřené na základní možné laboratorní prediktory) a vyplnili dotazník (zaměřený na klinické prediktory poškození tenkého střeva). Endoskopicky identifikovaná enteropatie byla klasifikována do 3 stupňů (mírná, středně těžká a těžká). Endoskopická, klinická a laboratorní data byla následně statisticky srovnávána s cílem odhalit prediktor tíže či přítomnosti enteropatie.
Souhrnná prevalence enteropatie ve skupině pacientů dlouhodobě užívajících NSA byla 61 %. Lehká, střední a těžká enteropatie byly zjištěny u 45,1 %, 7,8 %, respektive u 7,8 %. Nejčastější patologické nálezy byly vícečetná ložiska zarudnutí sliznice (rudé skvrny) a eroze tenkého střeva (v celkovém počtu do 10). Klinický význam těchto nálezů je sporný. Závažné poškození tenkého střeva (vícečetné eroze a vředy) jsme potvrdili u 16 % nemocných. Dále jsme se zaměřili na identifikaci klinického či laboratorního prediktoru enteropatie z NSA. Přes některé nadějné výsledky (sedimentace, CRP) nelze ani markery anémie (hemoglobin, erytrocyty, střední objem krvinky, hladina sérového železa), nutrice (albumin, prealbumin) a zánětu (CRP, trombocytóza, sedimentace) doporučit jako jednoznačný ukazatel přítomnosti/tíže enteropatie u pacientů dlouhodobě léčených NSA. Také klinické ukazatele (věk, pohlaví, dyspepsie) se ukázaly jako nespolehlivé.
V kontrolní skupině zdravých dobrovolníků byla zjištěna prevalence lézí kompatibilních s enteropatií u 15 %. Lehká, střední a těžká enteropatie byly zjištěny u 15,4 %, 0 %, respektive u 0 % zdravých dobrovolníků.
Kapslová endoskopie je vysoce přesné, neinvazivní vyšetření využitelné v diagnostice všech forem enteropatie z NSA. Poškození tenkého střeva související s léčbou NSA bylo prokázáno u většiny nemocných, závažné (klinicky významné) poškození u 16 % pacientů. Nebyl identifikován jednoznačný klinický nebo laboratorní marker přítomnosti/tíže enteropatie.
Práce byla podpořena grantem IGA NT 13532-4/2012.
Reaktivní artritida v novém konceptu spondyloartritid
Pavelka K
Revmatologický ústav, Praha
Reaktivní artritida (ReA) je dle definice spondyloartritida (SpA), která je vyvolávána určitým typem infekcí. ReA má společné rysy se SpA, mezi které patří určitý typ artritidy, entezitida a extraskeletální projevy, mezi které patří postižení očí, kůže, sliznic, gastrointestinálního traktu a jasné asociace s HLA B27. Nejčastějšími bakteriálními původci jsou chlamydie, salmonelly, shigelly, Campylobacter, yersinie a Ureaplasma urealyticum. Při detekci infekce se používají moderní metody kultivační, PLR a LCR a dále metody sérologické k průkazu protilátek. Antigen HLA B27 je pozitivní u 80 % u závažných případů a méně častý u přechodných, lehčích případů. Algoritmus používání zobrazovacích technik je u ReA podobný jako u SpA, včetně detekce sakroiliitidy na MR a možného použití sonografie při detekci artritidy a synovitidy. Prognóza ReA je nejistá, až u 50 % artritida odezní během 6 měsíců, 15–20 % pacientů má protrahovaný průběh > 1 rok. Výskyt sakroiliitidy ve studiích kolísá od 14–49 % pacientů, definitivní ankylozující spondylitida se vyvine 12–26 %. Význam nových kritérií ASAS pro SpA je pro časnou diagnostiku u ReA nejasný. Při terapii akutních ReA se používají glukokortikoidy a nesteroidní antirevmatika. U klinických forem ReA byl zkoušen sulfasalazin a v menší míře methotrexát. Anti-TNF byly použity ve výjimečných případech a není dost evidence o jejich účinnosti. Na druhé straně nebyl v těchto případech zaznamenán větší počet infekcí. Je uvažováno o použití inhibitorů IL-23 nebo IL-17. Role antibiotik není jasná. Dlouhodobé aplikace antibiotik (3 měsíce a dále) přinesly rozporuplné výsledky. Novější studie prokázala účinnost kombinované léčby rifampicinem, doxycyklinem a azithromycinem u post-chlamydiové ReA.
Jsme schopni ovlivnit rentgenovou progresi u pacientů s ankylozující spondylitidou?
Tošovský M
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Ankylozující spondylitida je zánětlivé revmatické onemocnění postihující převážně osový skelet. Typickými projevy je specifická bolest zad (zánětlivá bolest zad) a vznik osteoproduktivních změn v oblasti páteře, které mohou vést až k její ankylóze. Léčba inhibitory TNFα přinesla významný pokrok v léčbě tohoto onemocnění, nicméně první dvouletá data neprokázala příznivý vliv na ovlivnění rentgenové progrese. To vedlo k názoru, že zánět a osteoproduktivní změny probíhají nezávisle na sobě. Na druhé straně však existují důkazy o propojení zánětu a vzniku osteoproduktivních změn. Jedním z nich je například prediktivní vliv hladiny C-reaktivního proteinu na rentgenovou progresi. Stejně tak byl prokázán prediktivní vliv přítomnosti zánětlivých změn v oblasti obratlového rohu dle magnetické rezonance (MR) na vznik nových syndesmofytů. V současnosti existují nové hypotézy, které jsou v souladu s dosud publikovanými daty. Jednou z nich je hypotéza časných a pokročilých zánětlivých lézí obratlových rohů. Časné zánětlivé léze se mohou zhojit ad integrum (ať už spontánně nebo vlivem léčby) nebo postupně vyvinout v tzv. pokročilou zánětlivou lézi. U pokročilých zánětlivých lézí (přítomnost eroze, kostní sklerózy či tukové metaplazie) pak dochází ke vzniku reparačních osteoproduktivních změn, které probíhají již nezávisle na přítomnosti zánětu. Naopak perzistující zánět může v pokročilých lézích do určité míry vznik osteoproduktivních změn brzdit (TNF brake theory). Prediktivní vliv přítomnosti pokročilých zánětlivých lézí (v porovnání s časnými lézemi) na vznik nových syndesmofytů byl prokázán. Přínosem anti-TNFα léčby by pak byla především prevence vzniku a léčba časných zánětlivých lézí a tím zabránění vývoje pokročilých lézí. Tento vliv se pak na ovlivnění rentgenové progrese samozřejmě projeví až po delším časovém období. V souladu s tím jsou nová víceletá data, která ukazují příznivý vliv anti-TNFα léčby na rentgenovou progresi. Úkolem do budoucna bude vytipovat pacienty s rizikem významné rentgenové progrese a u těchto pacientů zahájit léčbu co nejdříve. Tato problematika vyžaduje další intenzivní výzkum.
Účinnost anti-TNFα léčby u pacientů s neradiografickoua radiografickou axiální spondyloartritidou. Výsledky z registru ATTRA
Forejtová Š1, Závada J,1 Uher M,2 Hejduk K2, Pavelka K1
1Revmatologický ústav Praha 2IBA - Masarykova univerzita Brno
Ankylozující spondylitida je poměrně časté chronické zánětlivé revmatické onemocnění ze skupiny spondylartritid, které je příčinou časté disability a invalidity svých nositelů a vede k významnému snížení jejich kvality života. Relativně pozdní výskyt radiografických známek sakroiliitidy vedl ke zpoždění v diagnostice ankylozující spondylitidy. Proto byla vyvinuta nová kritéria pro tzv. axiální spondyloartritidu, při jejíž diagnostice využíváme mimo jiné i magnetickou rezonanci. Biologická léčba je tak velkým pokrokem v terapii ankylozující spondylitidy, neboť je první účinnou léčbou, která kromě symptomatického efektu snižuje také rychle a efektně reaktanty akutní fáze a současně má vliv na intenzitu zánětu na magnetické rezonanci i na výskyt extraartikulárních manifestací, současně vede ke zlepšení funkčních schopnosti a zlepšení kvality života i práceschopnosti nemocných. V randomizovaných studiích byla prokázána účin-nost anti-TNFα terapie u neradiografické i radiografické formy axiální spondylartritidy. Práce sleduje účinnost biologické léčby u pacientů s axiální spondylartritidou léčených v Revmatologickém ústavu a porovnává efekt terapie u pacientů s neradiografickou i radiografickou formou.
Remodelace kosti a periostální novotvorba kostní hmoty u pacientů léčených pro osteoporózu
Štěpán J
Revmatologický ústav, Praha
Prvním projevem onemocnění osteoporózou může být až zlomenina po nepřiměřeně mírném traumatu. Za hlavní osteoporotické zlomeniny se považují fraktury obratlů, distálního předloktí, paže, pánve a zlomeniny oblasti kyčle. Většina úbytku kostní hmoty a nárůst rizika neobratlových zlomenin u žen mezi padesátým a osmdesátým rokem života jde na vrub intrakortikální remodelace a trabekularizace kortikální hmoty skeletu, jejichž rozsah narůstá exponenciálně s věkem. Antiresorpční terapie zpomaluje remodelaci kosti, úbytek kostní hmoty a zhoršování mikroarchitektury kosti, tlumí však i novotvorbu kosti. Riziko zlomenin narůstá s věkem i při účinné antiresorpční léčbě, byť pomaleji, než bez léčby. Stále nezodpovězenou otázkou zůstává, zda lze změny novotvorby (obnovování organické kostní matrix a kostní hmoty) při léčbě různými antiresorpčními léky vysvětlit jen jako důsledek spřažení funkce osteoblastů a osteoklastů. Je totiž třeba posuzovat také modelaci kosti na klidových površích kosti, kde podmínkou novotvorby není předchozí osteoklastická resorpce. Na klinický význam modelace skeletu upozornily studie remodelačních i modelačních účinků intermitentního podávání teriparatidu (lidský rekombinantní PTH1-34). Zhruba třetina nárůstu hmoty na trabekulárních a endokortikálních površích při léčbě teriparatidem se vysvětluje novotvorbou nezávislou na předchozí osteoresorpci, zatímco dvě třetiny nárůstu kostní hmoty jsou důsledkem zvýšeného vyplňování resorpčních kavit při remodelaci kosti. K hodnocení samotné modelace kosti nelze užít sérových biochemických markerů, protože vyjadřují celotělovou úroveň kostního obratu. Při histomorfometrii nemáme k dispozici dynamický test osteoresorpce, který by umožnil odlišit místa remodelace a modelace, a lze hodnotit jen morfologii resorpční kavity, kdy hladkost nebo zvrásněnost cementové linie je interpretována jako výraz modelace nebo remodelace kostní jednotky. Osvědčilo se ale hodnocení periostální apozice, která je výhradně projevem modelace kosti. U žen s těžkou postmenopauzální osteoporózou léčených teriparatidem je novotvorba kostní hmoty na periostálních površích 4krát zvýšená v porovnání s bazálními hodnotami už po jednom měsíci. Podle výsledků dynamické histomorfometrie párových kostních biopsiích u žen s postmenopauzální osteoporózou se periostální modelace kosti se po celou dobu léčby teriparatidem postupně zvyšuje. Významný mechanismus zlepšení kvality kortikální kostní hmoty představuje také intrakortikální novotvorba, iniciovaná osteoresorpcí. Kortikální BMD sice při léčbě teriparatidem přibývá pomalu, protože nově vytvořená kostní hmoty teprve postupně mineralizuje, ale zlepšená kvalita a elasticita kosti je vysvětlením vyšší mechanické pevnosti radiu, obratlů i proximálního femuru. V souhlase s tím se u žen s postmenopauzální osteoporózou léčených teriparatidem snížilo riziko obratlových zlomenin (o 84 % až 96 %) a neobratlových zlomenin (o 68 %) jako projev významného zlepšení kvality a pevnosti trámčité i kortikální kostní hmoty.
Význam hodnotenia kvality kosti u sekundárnej osteoporózy
Killinger Z, Jackuliak P, Kužma M, Payer J
V. interná klinika LF UK a UN, Bratislava
Vplyv kostnej denzity na riziko fraktúr u primárnej postmenopauzálnej osteoporózy je všeobecne známy a dobre zdokumentovaný. U pacientov so sekundárnou osteoporózou sa na vyššom riziku fraktúry podieľa viacero, na kostnej denzite nezávislých, faktorov. Ich vplyv na riziko zlomeniny je determinovaný predovšetkým základným ochorením, jeho liečbou, ale aj ďalšími menej objasnenými faktormi. Tie znižujú pevnosť kosti hlavne prostredníctvom zmeny jej kvality nezriedka aj bez zmeny samotnej denzity. Podiel akým sa jednotlivé faktory podieľajú na zhoršení kvality kosti u rôznych foriem sekundárnej osteoporózy je však stále nedostatočne objasnený. Rozvoj novších zobrazovacích metód s vysokým rozlíšením posúva v posledných rokoch hodnotenie pevnosti kosti smerom od denzity ku kvalite. Kým mnohé zobrazovacie techniky sú vďaka ich náročnosti, cene a nedostupnosti využívané len v oblasti výskumu (hrCT a hlavne µCT, resp. hrMR a µMR) niektoré z nich, ako napr. trabekulárne kostné skóre (TBS) alebo štrukturálna analýza krčku femuru (HSA), sú dnes vďaka rozšíreniu DXA denzitometrov dostupné už aj v klinickej praxi. Hlavným problémom pri využití týchto metód zostáva správna interpretácia nameraných parametrov. Predovšetkým bude potrebné zadefinovať nielen ich koreláciu s rizikom zlomeniny, ale aj prahové hodnoty pre indikáciu antiporotickej liečby. Dôležité bude v najbližšej budúcnosti aj stanovenie, aká metóda a u ktorej formy sekundárnej osteoporózy bude schopná predikovať riziko zlomeniny lepšie, ako to dokáže meranie samotnej kostnej denzity. V súčasnosti máme k dispozícii kalkulátor 10-ročného (absolútneho) rizika fraktúry (FRAX), ktorý síce nezahŕňa zložité zobrazovacie metódy, ale zohľadňuje rizikový profil pacienta, v ktorom prekonaná fraktúra (koreluje s kvalitou kosti), sekundárna osteoporóza, ale aj anamnéza reumatoídnej artritídy výrazne ovplyvňujú hodnotu rizika zlomeniny. Dá sa preto predpokladať, že význam FRAXu bude vyšší u pacientov so sekundárnou osteoporózou a zmenou kvality kosti. Aj tu však bude potrebné rozhodnúť aká hodnota rizika (intervenčný prah) by bola v danej krajine akceptovaná nielen z medicínskeho, ale aj ekonomického hľadiska. Na našom pracovisku sme hodnotili zmeny TBS u viacerých foriem sekundárnej osteoporózy, ako aj jeho zmeny pri rôznych terapeutických modalitách. Taktiež sme hodnotili možnosť využitia rizikového profilu (FRAX) u pacientov so sekundárnou osteoporózou včítane RA. Naše výsledky poukazujú na možný prínos týchto postupov pri hodnotení rizika zlomeniny u pacientov so sekundárnou osteoporózou.
Osteoporóza u chronických plicních chorob
Žurek M, Horák P
III. interní klinika NRE, FN a LF UP, Olomouc
Dlouholetý průběh chronických plicních onemocnění může vést k vzniku mimoplicních komplikací akcelerované aterosklerózy, hypertenze i osteoporózy se zlomeninami. Osteoporotické zlomeniny zhoršují kvalitu života a jsou spojeny se zvýšenou mortalitou. Osteoporóza se u chronických plicních onemocnění vyskytuje častěji než ve zdravé populaci a na její patogeneze se podílí zejména léčba glukokortikoidů a také vliv systémového zánětu na kost. Včasná identifikace rizikových nemocných je předpokladem cílené léčebné intervence. V současné době nejsou dostupná specifická doporučení léčby osteoporózy u nemocných s chronickými plicními chorobami, v praxi jsou využívány léčebné postupy z doporučení léčby glukokortikoidy indukované nebo postmenopauzální osteoporózy.
Hladina vitamínu D u pacientov pred a po osteoanabolickej liečbe
Brázdilová K1, Čierny D1, Killinger Z1, Vaňuga P2, Tomková S 3, Masaryk P4, Letkovská A4, Kmečová Z5, Payer J1
1V. interná klinika LF UK a UN Bratislava, 2NEDÚ, Ľubochňa, 3Interná klinika nemocnice Košice – Šaca a.s., Košice, 4NÚRCH, Piešťany, 5II. interná klinika FNsP F.D. Roosevelta, Banská Bystrica
Osteoanabolická liečba je v Slovenskej republike rezervovaná pre postmenopauzálne ženy a mužov s ťažkou osteoporózou a pacientov s glukokortikoidmi indukovanou osteoporózou s T-skóre < -2,9 (v oblasti lumbálnej chrbtice, krčku femuru alebo total femur) alebo prítomnou osteoporotickou fraktúrou. Osteoanabolickú liečbu predstavuje teriparatid alebo rekombinantný parathormón (od decembra 2012 neprítomný na slovenskom trhu). Jedná sa o prospektívnu, otvorenú, nerandomizovanú, 18-mesačnú štúdiu prebiehajúcu v piatich centrách. Register zahŕňa 1070 pacientov (727 liečených preparátom Forsteo a 343 preparátom Preotact, celkovo 971 žien a 99 mužov). Všetci pacienti boli liečení subkutánne teriparatidom v dávke 20 ug (Forsteo®, Eli Lilly) alebo parathormónom v dávke 100 ug (Preotact®, Nycomed). Pred začatím osteoanabolickej liečby užívali odporúčanú dennú dávku vápnika 500 až 1000 mg a vitamínu D 400 až 800 IU a v priebehu liečby 1000 až 1500 mg vápnika a 800 IU vitamínu D denne na základe odporúčaní z jednotlivých centier. Cieľom našej štúdie bolo zistiť prevalenciu hypovitaminózy D pred nasadením a po ukončení osteoformačnej liečby (analýza do septembra 2013). V rámci bezpečnostného profilu sme sledovali hladiny kalcia v sére a moči. Na hodnotenie zmien koncentrácií vitamínu D a vápnika sme použili t-test. Zistili sme vysoký výskyt hypovitaminózy D pred i po ukončení liečby napriek adekvátnej suplementácii. Pred zahájením liečby malo koncentráciu vitamínu D pod 30 ng/ml 74,8 % pacientov, po 6 mesiacoch to bolo 75 %, po 12 mesiacoch 80,5 % a po 18 mesiacoch liečby 71,8 % pacientov. Asymptomatická hyperkalciémia nad 2,6 mmol/l bola pozorovaná pred zahájením liečby u 2,8 % pacientov, po 6 mesiacoch až u 16 %, po 12 mesiacoch to bolo 12,4 % a po 18 mesiacoch 6,3 %. Pacienti s osteoformačnou liečbou majú nízke koncentrácie vitamínu D pred aj po ukončení liečby bez ohľadu na jej indikáciu. Hlavným dôvodom pretrvávania hypovitaminózy D i po osteoformačnej liečbe je strach z hyperkalciemizujúceho efektu medikácie. Vzhľadom k efektivite D hormónu je potrebné tento postup prehodnotiť a forsírovať suplementáciu D hormónu podávaného v štandardne odporúčaných dávkach (800 IU denne).
Doporučení ČRS k diagnostice systémové sklerodermie
Bečvář R, Soukup T, Štork J, Suchý D, Němec P, Fojtík Z, Jansa P, Horák P, Němcová D
Revmatologický ústav, Revmatologická klinika 1. LF UK, Praha
Systémová sklerodermie (SSc) je generalizované onemocnění pojivové tkáně projevující se ztluštěním a fibrózou kůže různého rozsahu a typickým postižením řady orgánů. Současně dochází k fibrotickým změnám ve stěně arteriální části řečiště.K vyšetření periferních cév slouží chladový provokační test a laser Doppler. Hlavním nástrojem k odlišení primárního a sekundárního Raynaudova fenoménu je kapilaroskopie nehtových valů. Nezbytné je vyšetření lipidového spektra. Vhodnou zobrazovací metodou je ultrasonografie, někdy i angiografie. Nejdůležitějším kožním příznakem je ztuhnutí kůže, které se projeví ztíženou zřasitelností (modifikované kožní skóre dle Rodnana). K hodnocení hloubky indurace kůže slouží vysokofrekvenční sonografie a durometrie. Biopsie kůže není k diagnóze vždy nutná, provádí se u atypických obrazů. Vyšetření: muskuloskeletálního aparátu zaměřujeme na odhalení kloubních kontraktur, rozsah kloubní pohyblivosti a detekci třecích šelestů šlachových pouzder palpačně nebo pomocí stetoskopu. RTG diagnostika může ukázat ztenčení distálních falang prstů rukou a akrální osteolýzy. Vyšetření trávicího traktu zahrnuje všechny metody užívané v gastroenterologii. U jícnu se navíc provádí scintigrafie, manometrie, případně pH-metrie. Vyšetření žaludku kromě běžných rtg metod zahrnuje enteroklýzu a CT. Vyšetření tenkého spočívá v testech na malabsorpci, enterobiopsii a sekrečních dechových testech. Vyšetření tlustého střeva zahrnuje endoskopii a kontrastní rentgenové vyšetření. Postižení plicního parenchymu zahrnuje vyšetření plicních funkcí – spirometrie a DLCO. Důležité je zaměření na pokles FVC %. Ze zobrazovacích metod je kromě skiagramu nezbytné HRCT. Bronchoskopické vyšetření s cytologií lavážní tekutiny může přispět k diagnostice aktivní alveolitidy. Postižení myokardu lze prokázat pomocí ekg záznamu a echokardiografickým vyšetření. Perfúzní scintigrafie myokardu pomocí dovoluje posouzení relativního prokrvení jednotlivých oblastí myokardu. Při podezření na plicní hypertenzi je klíčovou vyšetřovací metodou dopplerovská echokardiografie. Slouží k posouzení velikosti, tvaru, hypertrofie, funkce pravé komory a k odhadu tlaku v plicnici. Echokardiografický screening je indikován u všech nemocných v intervalu jednoho roku. Podezření na přetlak v plicnici je nutno ověřit pravostrannou katetrizací.Při podezření na renální manifestaci SSc se doporučují pravidelné kontroly krevního tlaku dvakrát týdně či každodenně formou automonitorace, pravidelně stanovovat sérovou hladinu kreatininu a močový sediment. Při trvalé hypertenzi a proteinurii je nutné vyšetření glomerulární filtrace a případně renální biopsie. U juvenilní formy SSc se spektrum vyšetřovacích metod a algoritmy vyšetření zásadně neliší od dospělé formy. Jelikož se v tomto věku jedná o dosti vzácné onemocnění je vždy diferenciálně diagnosticky je nutno vyloučit jiné autoimunitní systémové onemocnění.
Liečba systémovej sklerózy: súčasnosť a perspektívy
Lukáč J
Národný ústav reumatických chorôb, Piešťany
Liečba systémovej sklerózy (SSc) vyžaduje: včasnú diagnostiku, vyhodnotenie klinického nálezu – vrátane postihnutia vnútorných orgánov, posúdenie dynamiky chorobných zmien a prognostických faktorov. Liečba systémovej sklerózy musí byť komplexná: medikamentózna i nemedikamentózna.
Medikamentózna terapia pozostáva z podávania liekov na liečbu vaskulárneho poškodenia – vrátane pľúcnej artériovej hypertenzie, imunosupresívnych preparátov, liekov s antifibrotickým účinkom a biologickej liečby, ktorá už preukázala terapeutický efekt v dvojito zaslepených liekových štúdiách, alebo v pilotných štúdiách mimo schválenú indikáciu. Nevyhnuté sú i lieky, ktoré sa podávajú pri poškodení kardiovaskulárneho, respiračného systému, gastrointestinálneho traktu a obličiek.
Nemedikamentózne liečebné postupy pozostávajú z režimových opatrení, rehabilitačnej liečby, ošetrovania ulcerácií a chirurgickej liečby.
Liečba Raynaudovho fenoménu (Rf) a digitálnych ulcerácií (DU) pri SSc. Blokátory kalciových kanálov (nifedipin, amlodipin, diltiazem) sú liekom prvej voľby pri primárnom Rf, nemajú terapeutický efekt na liečbu difitálnych ulcerácií pri SSc. Inhibítory fosfodiesterázy 5 (sildenafil) podporujú hojenie DU. Prostaglandíny – prostacyklín – PGI2 (iloprost) je analóg prostacyklínu a alprostadil (PGE2) znižujú raynaudovské krízy a zlepšujú hojenie DU v porovnaní s placebom. Statíny – atorvastatín 40 mg znižuje počet DU a zlepšuje kvalitu života pacientov. Bosentan – antagonista receptorov pre endotelín 1 predchádza vzniku nových DU, nemá významný vplyv na hojenie už existujúcich DU. Vhodná je kombinácia alprostadilu a bosentanu.
Podporná liečba: antikoagulanciá (pri pozitivite antifosfolipidových protilátok, pri gangrénach), antiagreganciá (aspirin 100 mg, klopidogrel), reologiká (pentoxyfilín).Imunosupresívna liečba. Cyklofosfamid sa podáva vo forme pulzov alebo perorálne pri prognosticky závažných formách SSc s progredujúcou závažnou pľúcnou fibrózou, difúznou formou SSc. Nesmie sa podávať dlhšie ako 2 roky ani pri súčasnom výskyte DU. Azatioprin je indikovaný u stredne závažných foriem SSc s postihnutím viscerálnych orgánov ako následná liečba po liečbe cyklofosfamidom. Glukokortikoidy sú indikovane iba pri včasných aktívnych formách pľúcnej fibrózy (alveolitída), myozitíde pri SSc. Dávka nemá presiahnuť 15 mg prednisonu denne. Methotrexát znižuje skóre kožného postihnutia, nemal by sa podávať pri závažnom a progredujúcom postihnutí pľúc. Cyklosporín A znižuje kožné skóre pri SSc. Podávanie cyklosporinu A pri SSc dvojnásobne zvyšuje riziko renálnych kríz pretože zhoršuje perfúziu obličkami. Mykofenolát mofetil má priaznivý vplyv na dermosklerózu a pľúcnu fibrózu pri SSc.
Autológna transplantácia kmeňových buniek (prospektívna štúdia ASTIS). U 156 pacientov so závažnou formou SSc sa dosiahlo významné zlepšenie mRSS, zlepšenie funkčnej schopnosti (SHAQ) a vitálnej kapacity. Zhoršenie renálnych funkcií, mortalita 10 %.
Cielená terapia SSc. Rituximab významne spomaľuje až zastavuje progresiu funkčných pľúcnych zmien podľa merania funkčnej pľúcnej kapacity v porovnaní s kontrolnou skupinou, taktiež spomaľuje progresiu dermosklerózy hodnotenú modifikovaným Rodnanovým kožným skóre (mRSS). Tocilizumab (anti-IL-6 R) podávaný u dvoch pacientov so SSc zlepšoval kožné skóre merané mRSS. Basiliximab (anti-CD25) sa s úspešne využil v liečbe SSc. Nintedanib – inhibítor tyrozín kinázy, (štúdia IMPULS pri IPF). Spomaľuje pokles FVC v porovnaní s placebom. Pirfenidon má antifibrotický účinok (štúdia ASCEND 555 pac. s IPF). Spomaľuje pokles FVC, zlepšuje prežívanie. Aimspro® – hyperimúnne kozie sérum je purifikovaný proteínový koplex. Účinkuje cez kortikotropín uvoľnujúci hormón. Cieľom je využitie tohto lieku v liečbe sclerodermie, AmLS a sekundárnej SM. V II. fáze dvojito zaslepenej placebom kontrolovanej štúdie sa preukázala dobrá tolerancia liečby a tendencia k poklesu modifikovaného Rodnanovho skóre v malom súbore 20 pacientov s SSc.
Chirurgická liečba. Sympatektómia digitálna cervikálna transtorakálna (torakoskopicky) arteriálna adventektómia, odstránenie kalcifikácií, amputácie, autológna transplantácia progenitorových buniek, hyperbarická komora. Ošetrovanie DU: neinvazívny debridement s antiseptickým ošetrením, pokrytie rán hydrokoloidnými náplasťami, atb. lokálne prípadne i celkove). Liečba SSc má byť individuálna so zameraním na formu SSc, prognostické faktory, štádium, orgánové postihnutie. Vyžaduje si interdisciplinárny prístup a trvalé monitorovanie pacientov.
Aplikace DETECT algoritmu v detekci rizika plicní arteriální hypertenze u pacientů se systémovousklerodermií (data screeningu PAH Východočeského regionu)
Soukup T1, Pudil R2, Hromadková L3, Tomš J1, Tošovský M1, Bradna P1, Hrnčíř Z1
1 II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové 2 I. interní kardioangiologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Plicní arteriální hypertenze (PAH) je závažným projevem systémové sklerodermie (SSc) u 7–12 % nemocných. Publikovaná data ukazují na vysokou mortalitu u těchto nemocných. Studie DETECT představuje nový algoritmus pro časnou detekci PAH u SSc v běžné klinické praxi. Algoritmus obsahuje devět proměnných ve dvoukrokovém schématu.Cílem retrospektivní, monocentrické, cross-sectional studie bylo aplikovat modifikovaný DETECT kalkulátor u pacientů s SSc z Východočeského regionu k odhalení rizika PAH a porovnání těchto výsledků se stávajícím PAH screeningem podle doporučení ESC/ERS 2009 (European society for cardiology/European respiratory society). Sekundárním cílem bylo zjistit modifikované DETECT skóre dva roky před stanovením PAH diagnózy. Do studie bylo zařazeno 60 pacientů s diagnózou SSc podle American College of Rheumatology. Pacienti byli věkového rozmezí 27–78 let a průměru 61,1 (±12,1) roku. U všech nemocných byly zjištěny demografické a klinické parametry, subtyp SSc, sérové testy/hladiny (NT-proBNP, kyselina močová, antinukleární protilátky), elektrokardiografický nález pravostranné deviace osy, plicní funkční testy (FVC % /DLCO % náležitých hodnot) a echokardiografické parametry za použití standardizovaného postupu. Dopplerovská echokardiografie stanovila odhad vrcholového tlaku v plicní arterii za použití vrcholové rychlosti regurgitačního jetu. Během probíhajícího screeningu nebylo prováděno měření plochy pravé síně, proto byl zástupně zvolen parametr vycházející z rozměru pravé komory (PK) = (1,4 x rozměr PK)2. Parametr byl vytvořen empiricky. Modifikovaným DETECT kalkulátorem bylo doporučeno 24/58 (41,4 %) pacientů k pravostranné srdeční katetrizaci (PSK). Při použití ESC/ERS 2009 doporučení bylo k PSK doporučeno 14/58 (24,1 %) pacientů. Všichni pacienti s pozitivním ECS/ERS screeningem byli katetrizováni a PAH byla prokázána u 7/58 (12,1 %) pacientů. Dva pacienti měli postkapilární plicní hypertenzi (PH) a dva PH při intersticiálním plicním postižení. Nebyli zjištěni pacienti s pozitivním ESC/ERS screeningem a negativním DETECT screeningem. Skupina s pozitivním DETECT screeningem a negativním ESC/ERS screeningem zahrnovala devět pacientů. Všichni tito pacienti byli NYHA funkční třídy I-II. Poměr FVC/DLCO a sérová hladina kyseliny močové byly abnormální dva roky před stanovením dg. PAH. Hladina NT-proBNP a modifikovaný parametr PK jeden rok před touto diagnózou. V naší práci zachytil modifikovaný DETECT kalkulátor všechny pacienty s diagnostikovanou PAH za použití ESC/ERS screening a PSK. Na druhou stranu DETECT kalkulátor je složen z klinických parametrů, které pomohou identifikovat populaci SSc s velmi nízkým rizikem PAH. Data dvouletého sledování ukazují na možnou prediktivní roli modifikovaného DETECT kalkulátoru. Naše práce potvrzuje klinický význam modifikovaného DETECT skórovacího algoritmu v detekci pacientů s rizikem PAH.
Využití kapilaroskopie v diagnostice časné systémové sklerodermie
Štilcová H, Bláhová A, Soukup T
LF UK v Hradci Králové a FN, Hradec Králové
Kapilaroskopie je neinvazivní metoda zobrazující kapiláry nehtového valu v tenké vrstvě epidermis. Umožňuje tímto studovat nemoci spojené s miktroangiopatií. Praktické využití našla při diagnostice vaskulopatie nemocných se systémovou sklerodermií (SSc). Přispívá k časné diagnostice nemoci, patologický kapilaroskopický obraz je zařazen mezi nová EULAR/ACR 2013 klasifikační kritéria pro SSc. Indikací ke kapilaroskopickému vyšetření je přítomnost častých atak Raynaudova fenoménu při teplotě nad 10 °C ve více lokalizacích, zároveň přítomnost autoprotilátek asociovaných s SSc nebo difúzní otoky prstů. Podstatou kapilaroskopie je zobrazení kapilár ve světelném mikroskopu pomocí zvětšení 75x–200x. Zobrazuje aferentní raménko, apex a eferentní raménko kapiláry. Základním parametrem je hodnocení počtu kapilár – norma 9 kapilár na 1mm. Dále se hodnotí pravidelnost uspořádání kapilár, rozšíření kapilár až gigantické kapiláry, hemoragie, keříčkování kapilár.Na našem pracovišti používáme semikvantitativní model hodnocení, který umožňuje rozlišit normální/abnormální nález: časný, aktivní, pozdní. V našem souboru máme provedeno 30 kapilaroskopických vyšetření. Významně větší výskyt časných patologických nálezů byl zjištěn u lokalizované formy, pozdějších u difúzní formy systémové sklerodermie. Kapilaroskopie může být nástrojem k odhalení nejčasnějších fází SSc, umožňuje zahájit terapii co nejdříve.
Podpořeno výzkumným projektem PRVOUK P37/08.
Syndrom bakteriálního přerůstání detekovaný vodíkovým a metanovým dechovým testem u nemocných se systémovou sklerodermií
Cyrany J, Soukup T, Kopáčová M, Bureš J
II. interní gastroenterologická klinika, LF UK v Hradci Králové a FN, Hradec Králové
Gastrointestinální komplikace se objevují u většiny pacientů se systémovou sklerodermií (SSc). Postižení tenkého střeva vede k poruše peristaltiky, která je hlavním faktorem rozvoje bakteriálního přerůstání (small intestinal bacterial overgrowth – SIBO). Vodíkovým a metanovým dechovým testem je možné SIBO neinvazivně diagnostikovat.
Cíl: zjistit incidenci SIBO u pacientů se systémovou sklerodermií ve vztahu k demografickým, klinickým a laboratorním parametrům.
Pacienti: Do studie bylo zařazeno 30 pacientů se systémovou sklerodermií dle kritérií ACR (American College of Rheumatology), průměrného věku 60 let (27–83 let), z toho 8 mužů, a to bez ohledu na přítomnost gastrointestinálních příznaků.Metody: U pacientů byly sledovány následující parametry demografické: věk, pohlaví; klinické: subtyp a trvání SSc, BMI (body mass index), Raynaudův fenomén, digitální ulcerace, postižení plicního intersticia, difúzní plicní kapacita pro CO, usilovná vitální kapacita, přítomnost plicní hypertenze, SHAQ (Scleroderma Health Assessment Questionnaire); laboratorní: albumin, prealbumin, beta-karoten, anti-centromerové a anti-topoisomerázové protilátky.
Všichni pacienti podstoupili vodíkový a metanový dechový test: po lačnění 12 h byl proveden odběr vzduchu na konci výdechu pomocí systému QUINTRON GaSampler. Po odběru bazálního vzorku byl perorálně podán testovací substrát (roztok 75 g glukózy) a odběry byly opakovány ve dvacetiminutových intervalech po celkovou dobu 4 hodin. Vzorky vydechovaného vzduchu byly analyzovány plynovým chromatografem QUINTRON Microlyzer DP Plus (Quintron Instrument Company, Milwaukee, WI, USA), hodnoty výdeje vodíku a metanu vyjádřené v jednotkách ppm (parts per million) byly vyneseny do grafu proti času a křivka byla hodnocena dle recentních kritérií: pro bakteriální přerůstání svědčil vzestup hodnoty vodíku nebo metanu o více než 12 ppm v prvních 120 minutách testu.
Výsledky: Vodíkový a metanový dechový test svědčil pro SIBO u 13/30 pacientů (43 %). Nemocní se SIBO byly starší (67 ± 10 let) než pacienti s negativním testem (56 ± 12 let), p = 0,015. Doba od manifestace dalšího příznaku kromě Raynaudova fenoménu byla ale kratší pacientů se SIBO (2,0 ± 1,1) než u pacientů bez SIBO (7,2 ± 4,4), p = 0,07. Pacienti s prokázaným SIBO měli častěji postižené plicní intersticium (11/13) než pacienti bez SIBO (5/17), p = 0,003. V ostatních sledovaných parametrech mezi skupinami nebyl statisticky významný rozdíl.
Závěry: Incidence SIBO určená vodíkovým a metanovým dechovým testem u neselektované populace pacientů se systémovou sklerodermií je v naší studii 43 %. SIBO se objevuje častěji u starších nemocných, ale projeví se časně v průběhu trvání nemoci. Nemocní se SIBO měli v našem souboru postižení plicního intersticia téměř třikrát častěji. V ostatních sledovaných parametrech nebyl mezi skupinami se SIBO a bez tohoto syndromu shledán rozdíl, a to ani v parametrech nutričních.Podpořeno výzkumným projektem PRVOUK P37/08.
Plazmatické koncentrace HSP90 u pacientů se systémovou sklerodermií korelují s aktivitou nemoci, plicním postižením a kožním skóre
Tomčík M1/, Štorkánová H1/, Hulejová H1/, Prajzlerová K1/, Skácelová S1/, Bečvář R1/, Distler J H W 2/, Šenolt L1/
1/ Revmatologický ústav, Revmatologická klinika 1. LF UK, Praha, 2/ Department of Internal Medicine III and Institute for Clinical Immunology, University of Erlangen-Nuremberg, Erlangen
Naše předchozí práce prokázala, že exprese Heat Shock Protein (HSP) 90 je zvýšená v kůži a dermálních fibroblastech pacientů se systémovou sklerodermií (SSc) i v preklinických modelech SSc v závislosti na transformujícím růstovém faktoru (TGF)-β. Dále jsme demonstrovali, že inhibice HSP90 pomocí 17-Dimethylaminoethylamino-17-demethoxy-geldanamycinu (17-DMAG) efektivně tlumí signální dráhu TGF-β a signifikantně redukuje stimulační účinky TGF-β na syntézu kolagenu in vitro. In vivo jsme prokázali potentní antifibrotické účinky inhibice HSP90 pomocí 17-DMAG u tří různých myších modelů SSc, které napodobují odlišné patogenetické mechanismy této nemoci.
Cílem této práce bylo změřit plazmatické koncentrace HSP90 u pacientů se SSc a zhodnotit jejich potenciální asociaci s orgánovým postižením a aktivitou nemoci.
Celkově jsme analyzovali plazmy 40 pacientů (36 žen; průměrný věk 53,9; trvání nemoci 5,0 let; dcSSc/lcSSc = 9/31), kteří splnili klasifikační kritéria pro SSc podle EULAR/ACR-2013, a 39 zdravých kontrol se srovnatelným věkem a pohlavím. Plazmatické koncentrace HSP90 byly měřeny pomocí ELISA (Enzo Life Sciences). Dále bylo změřeno CRP, ANA protilátky a ENA komplex. Klinické údaje o orgánových manifestacích spojených se SSc byly získány z českého registru pacientů se SSc – hodnotili jsme plicní postižení, plicní arteriální hypertenzi, poruchu motility jícnu, srdeční a renální postižení, kapilaroskopický nález, Raynaudův fenomén a digitální ulcerace. Kožní změny byly zhodnoceny podle modifikovaného kožního Rodnanova skóre (mRSS) a bylo stanoveno skóre aktivity SSc podle EUSTAR. Výsledky jsou prezentovány jako průměr ± SEM.
Plazmatické koncentrace HSP90 se statisticky signifikantně nelišily u pacientů se SSc a u zdravých kontrol (9,5 ± 1,1 vs. 16.9 ± 2.4 ng/ml, p = 0,058). Rovněž jsme nenalezli statisticky signifikantní rozdíl mezi pacienty s difúzní kožní (dc)SSc a limitovanou kožní (lc)SSc (8,5 ± 0,9 vs. 9,8 ± 1,4 ng/ml, p = 0,709). Plazmatické koncentrace HSP90 však pozitivně korelovaly s hodnotami skóre aktivity SSc podle EUSTAR (r = 0,418, p = 0,007) a negativně korelovaly s parametry plicních funkcí, konkrétně forsírovaná vitální kapacita (FVC), forsírovaný expirační objem za jednu sekundu (FEV1) a difúzní kapacita pro oxid uhelnatý (DLCO) (r = - 0,457, p = 0,004; r = -0,346, p = 0,033; r = -0,450, p = 0,004, v uvedeném pořadí). Navíc u podskupiny pacientů s dcSSc korelovaly koncentrace HSP90 pozitivně s hodnotami kožního skóre (mRSS) (r = 0,728, p = 0,031). Po přísné Bonferroniho korekci zůstaly statisticky signifikantní jen korelace koncentrací HSP90 s hodnotami skóre aktivity SSc podle EUSTAR, FVC a DLCO (p < 0,01). Plazmatické koncentrace HSP90 nebyly významně ovlivněny přítomností autoprotilátek (antinukleárních, anticentromérových, anti-Scl70), patologickým kapilaroskopickým nálezem (časný, aktivní, pozdní), užíváním nízkých dávek glukokortikoidů (nebo jiných imunosupresiv) v anamnéze, ani přítomností jednotlivých klinických příznaků SSc.
Naše práce demonstruje, že na rozdíl od exprese HSP90 v kůži se plazmatické koncentrace HSP90 signifikantně neliší u pacientů se SSc a u zdravých kontrol, anebo mezi jednotlivými podtypy SSc. Avšak vyšší plazmatické koncentrace HSP90 jsou asociovány s vyšší aktivitou nemoci, zhoršenými funkčními parametry při plicním postižení a navíc u difúzní kožní formy (dc)SSc i s výraznějším kožním postižením. Tyto výsledky podporují závěry naší předchozí práce, ve které jsme demonstrovali, že HSP90 představuje důležitou regulační molekulu kožní fibrózy u SSc a její inhibice má potentní antifibrotické účinky u preklinických modelů SSc. V případě potvrzení našich výsledků na větší kohortě pacientů by se mohl HSP90 stát novým potenciálním biomarkerem aktivity nemoci a plicního a kožního postižení u SSc.
Tato studie byla podpořena projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00023728 (Revmatologický ústav).
Echokardiografické parametry u pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva ve screeningu plicní hypertenze
Vymětal J, Hutyra M, Smržová A, Zadražil J, Horák P
FN Olomouc, III. interní klinika – nefrologická, revmatologická a endokrinologická, Olomouc
Sklerodermie je systémové onemocnění, které má v případě orgánových komplikací velmi vážnou prognózu. Život limitující jsou zejména postižení plic nebo rozvoj těžké plicní hypertenze vedoucí k selhání pravé komory. Echokardiografie je na naší klinice rutinně prováděna u všech pacientů se systémovým onemocněním pojiva, přičemž podezření na plicní hypertenzi je v rámci echokardiografického screeningu zjištěno jen u menšího procenta pacientů.
Cílem naší práce zhodnotit význam deformační analýzy volné stěny pravé komory s využitím 2D speckle tracking a dalších parametrů systolické a diastolické funkce pravé komory z pohledu jejich predikce plicní hypertenze u pacientů se sklerodermií a příbuznými jednotkami. Ve sdělení prezentujeme výsledky a jejich možný přínos pro detekci plicní hypertenze ve skupině 45 pacientů našeho centra.
V období 04/2013 až 1/2014 jsme echokardiograficky vyšetřili celkem 45 pacientů se sklerodermií a smíšeným onemocněním pojiva. Rutinní parametry byly doplněny o frakční změnu plochy pravé komory (FAC) a 2D strain volné stěny pravé komory, současně byly stanovovány hodnoty NT-proBNP a Troponinu T. Parametry byly korelovány s echokardiograficky predikovanou hodnotou systolického tlaku v plícnici (PASP).
Možná plicní hypertenze (PASP 37–50 mmHg) byla zjištěna u 9 (20 %) a pravděpodobná plicní hypertenze (PASP > 50 mmHg) u 3 (6,7 %) pacientů. Statisticky významné korelace s hodnotami PASP byly nalezeny pro NT-proBNP (r = 0,354, p = 0,0342), 2D strain středního segmentu volné stěny pravé komory (r = 0,351, p = 0,0356) a pro FAC. Všichni pacienti měli prakticky normální ejekční frakci levé komory (EF LK 65,0 ± 5,67 %) a v souboru nebyla zjištěna korelace plicní hypertenze s parametry systolické či diastolické funkce levé komory.
Hodnocení FAC a 2D strainu pravé komory může být užitečným doplňkem k rutinnímu měření a odhadu plicní hypertenze, metodika však činí vyšetření v klinické praxi časově náročnějším s nutností postprocessingu.
Paraneoplastické prejavy v reumatológii
Macejová Ž
I. interná klinika LF UPJŠ, Košice
Paraneoplastické syndrómy sú zriedkavé prejavy spúšťané alterovaným imunitným systémom ako dôsledok prítomnosti malígneho ochorenia. Sú definované ako klinické nemetastatické prejavy onkologického ochorenia. Mechanismus vzniku paraneoplastického syndrómu je rôzny. Najčastejšie vznikajú týmito spôsobmi: 1. rast tumoru navodí tvorbu protilátok proti nádorovým bunkám, ktoré následne skrížene reagujú s vlastným tkanivom, 2. tumory môžu produkovať biologicky aktívne substancie-enzýmy, cytokíny, hormóny, 3. tumory môžu produkovať proteíny, ktoré sa fyziologicky produkujú embryonálnymi a fetálnymi bunkami (CEA, AFP, Ca19-9). Klinická prezentácia paraneoplastického syndrómu najčastejšie zahŕňa prejavy nešpecifické, hematologické, neurologické, muskuloskeletálne, gastrointestinálne, nefrogénne a kožné prejavy. Medzi muskuloskeletálne prejavy patrí aj dermatomyozitída/polymyozitída, pričom častejšia je dermatomyozitída. Paraneoplastická príčinu u tohto syndrómu je dokázaná približne v 20 % prípadov. Medzi ostatné paraneoplastické syndrómy muskuloskeletálneho systému patrí: polymyalgia rheumatica, hypertrofická osteoartropátia, sclerodermia, SLE-like syndróm, algodystrofický syndróm, polyartritída, vaskulitída, Raynodov syndróm a iné. Kazuistika: 77-ročný muž s prejavmi myopatie, dyspepsie, úbytkom hmotnosti bol prijatý na internú kliniku. V anamnéze bola prítomná ischemická choroba srdca, kardiálne zlyhávanie NYHA III, trojcievne koronárne postihnutie. Pri prijatí bol prítomný vzostup kardio-špecifických enzýmov: CK, CK-MB, troponínu. Začatá duálna antidoštičková liečba a liečba atorvastatínom. Pretrvávala dyspepsia, hnačky, myalgie, výrazná svalová slabosť a vzostup CK. Stav bol hodnotený ako myopatia pri liečbe statínmi a tieto boli z liečby vysadené. Napriek tomu sa klinický stav nezlepšil, dominovalo postihnutie svalov, chudnutie, striedanie hnačky a zápchy, objavila sa krv na stolici. Bolo realizované gastroenterologické vyšetrenie, následne USG, CT, ktoré odhalilo tumorózne zmeny. Stav sme prehodnotili na paraneoplastickú myozitídu. Realizované EMG vyšetrenie suponovanú diagnózu potvrdilo. Pacient podstúpil chirurgické riešenie s definitívnym záverom: kolorektálny karcinóm. Po úspešnej chirurgickej intervencii došlo k ústupom klinických prejavov a poklesu svalových enzýmov. Muskuloskeletálne príznaky môžu byť pomerne často paraneoplastické, preto najmä u starších jedincov je potrebné na ne myslieť. Niekedy môžu byť prvým a jediným prejavom malignity a môžu prispieť k jej skorej diagnóze a dobrej prognóze pacienta.
Autoprotilátky u paraneoplastické myozitidy
Mann H, Pleštilová L, Chinoy H, Cooper R, Dani L, Lundberg I, Betteridge Z, Vencovský J
Revmatologický ústav, Praha ČR, The University of Manchester, Manchester, VB, Karolinska Institutet, Stockholm, Švédsko, Royal National Hospital, Bath, VB
U nemocných s idiopatickými zánětlivými myopatiemi je zvýšené riziko maligních onemocnění a především dermatomyozitida (DM) u dospělých nemocných je často onemocněním paraneoplastickým. V klinické praxi má proto odhalení nemocných se zatím nediagnostikovaným nádorem velký praktický význam. V minulosti byla za jeden z rizikových faktorů možného maligního onemocnění považována negativita autoprotilátek. Nyní je známo, že především dva typy protilátek specifických pro myozitidu (protilátky proti transkripčními intermediárnímu faktoru 1 gama: TIF 1 gama a proti nukleárnímu matrixovému proteinu: NXP-2) jsou spojené se zvýšeným rizikem malignit. Autoři představují výsledky průřezové studie vztahu autoprotilátek s malignitou u nemocných idiopatickou zánětlivou myopatií ze 3 evropských zemí (Česká republika, Švédsko, Velká Británie). Nejvyšší riziko maligního onemocnění je spojené s pozitivitou anti-TIF1 gama protilátek, které se vyskytují především u nemocných s dermatomyozitidou.
Polyserositida jako paraneoplastický syndrom
Olejárová M 1,2/, Henyšová V 2/, Večeřová A 3/, Lubanda H 3/, Kodetová D 4/
1 Revmatologický ústav, Praha; 2 1.lékařská fakulta UK Praha; 3 IV. interní klinika VFN a 1. LF UK, Praha; 4 Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha
Polyserositida (souběžné postižení perikarditidou, pleuritidou, případně i peritonitidou) může být projevem zánětlivých revmatických onemocnění (systémový lupus erythematodes – SLE, Stillova choroba aj.), autoinflamatorních onemocnění (familiární středomořská horečka aj.), ale i chorob infekčního (tuberkulóza, syfilis, virové infekce) či maligního původu. Autoři popisují případ 28leté mladé ženy s relabující polyserositidou, provázenou zvýšením reaktantů akutní fáze, leukocytózou s neutrofilií a několikanásobným zvýšením jaterních aminotransferáz. Z důvodu hrozící tamponády byla pacientka po vyloučení infekčního původu obtíží léčena empiricky glukokortikoidy – nejprve i.v. pulzy metylprednisolonu (MP) s následnou perorální terapií středními dávkami s velmi dobrým efektem a kompletní regresí obtíží, nicméně při detrakci denní dávky pod 24 mg MP došlo vždy k relapsu choroby. Po celou dobu onemocnění neměla pacientka horečku, exantém ani artritidu, byl punktován i výpotek z kolenního kloubu, který byl čirý a neobsahoval prakticky žádné buněčné elementy. Diferenciálně diagnosticky byl zvažován SLE a Stillova choroba, avšak klinické projevy nebyly typické ani pro jedno z nich. Tyto diagnózy potvrzeny nebyly, stejně jako autoinflamatorní choroba. Zkusmo byl podán kolchicin, ale bez efektu. I přes tuto terapii po snížení dávky MP stav relaboval. V rámci kompletního vyšetření byl u pacientky zjištěn sonograficky uzel na štítné žláze, který byl biopticky zhodnocen jako papilární karcinom. Pacientka podstoupila totální tyreoidektomii, při níž byla zjištěna ještě metastáza karcinomu v přilehlé uzlině, a následnou radioterapii. Po operaci byla kortikoterapie znovu pozvolna redukována, tantokrát již úspěšně bez relapsu onemocnění. Nyní je pacientka na dávce 12mg MP denně a cítí se velmi dobře. Polyserositida tedy může být i paraneoplastickým syndromem, např. u Ca prsu. U papilárního karcinomu štítné žlázy její výskyt dosud popsán nebyl.
T-regulační lymfocyty u revmatoidní artritidy
Šenolt L
Revmatologický ústav, Praha
Revmatoidní artritida (RA) je prototypem chronického zánětlivého autoimunitního onemocnění, které vzniká na podkladě prolomení imunitní tolerance vůči vlastním antigenům. Důležitou úlohu v tomto procesu hraje kromě jiného posttranslační modifikace a selhání účinku CD4+ T regulačních (Treg) lymfocytů, které za normálních okolností tlumí aktivaci a proliferaci autoreaktivních imunitních buněk. U autoimunitních onemocnění může být defekt i v samotných efektorových T lymfocytech, které nedostatečně odpovídají na supresivní působení Treg lymfocytů. Nejčastěji používané rozlišovací znaky Treg lymfocytů jsou regulační transkripční faktor „Forkhead box protein 3“ (Foxp3), receptor pro interleukin-2 (IL-2Rα / CD25) nebo antigen asociovaný s cytotoxickými T-lymfocyty (CTLA-4). U autoimunitních onemocnění zastávají Treg lymfocyty protektivní úlohu, která je zprostředkována jak buněčným kontaktem, např. pomocí CLTA-4, tak působením regulačních cytokinů IL-10 a transformujícího růstového faktoru (TGF-β). V tomto sdělení bude autor diskutovat interakce mezi Treg lymfocyty, ostatními buňkami imunitního systému a rezidentními buňkami kloubního aparátu. Přestože neexistuje jednoznačná shoda, většina dat poukazuje na snížené množství a narušenou supresivní funkci Treg lymfocytů u RA a to převážně lokálně v místech probíhajícího zánětu. Některé imunitní buňky, převážně však změna poměru Th17/Treg lymfocytů, mohou mít prognostický význam dalšího vývoje autoimunitních onemocnění. Na závěr se bude autor věnovat novým léčebným směrům, které se zaměřují na oživení funkce Treg lymfocytů s cílem obnovit imunitní toleranci.
Úloha neutrofilov v patogenéze SLE
Blažíčková S
Laboratória, s.r.o., Piešťany a FZaSP TU, Trnava
Tak ako i pri iných autoimunitných ochoreniach, i pri SLE je etiológia predmetom rôznych hypotéz. Jednou z teórii je porucha apoptózy, kedy dochádza k odkrytiu a štrukturálnym zmenám jadra buniek a následnej tvorbe autoprotilátok proti apoptotickým produktom (najmä dsDNA a nukleozómom). Posledné desaťročie prinieslo dôkazy o úlohe neutrofilov v indukcii SLE a i pri výslednom poškodení orgánov. Granulocyty s nízkou hustotou (LDG) popísané pri SLE vyvolávajú poškodenie ciev a sú schopné syntetizovať väčšie množstvo interferónov (IFN) I. typu. Fenotypovo sú charakterizované ako nezrelé neutrofily s nesegmentovaným jadrom a vyššou expresiou myeloperoxidázy, neutrofilnej elastázy a defenzínu-3. Okrem samotnej zvýšenej produkcie IFN bolo popísané spojenie medzi autoprotilátkami a produkciou IFN I u pacientov so SLE. Imunokomplexy tvorené autoprotilátkami proti chromatínu môžu okrem vyvolania lokálneho zápalu stimulovať plazmatoidné dendritické bunky (pDC) k tvorbe IFN-alfa. Neutrofily pacientov s SLE sú následne aktivované IFN-alfa a v prítomnosti autoprotilátok proti ribonukleoproteínom odumierajú. Dôsledkom ich rozpadu je vypustenie tzv. neutrofilových extracelulárnych pastí (NETs). NETs u pacientov so SLE obsahujú DNA, históny ako aj veľké množstvo neutrofilových antimikrobiálnych peptidov (najmä LL37 a HMGB1) a tvoria sa voči nim príslušné autoprotilátky. Vznikajúce imunokomplexy môžu slúžiť ako autoantigény aktivujúce B lymfocyty, ale i pDC. Kým vysoké hladiny prozápalových cytokínov pacientov so SLE môžu zvyšovať senzitivitu k NETóze, autoprotilátky môžu vyvolávať prechod z apoptózy do NETózy. Zvýšená schopnosť tvoriť NETs ako aj zvýšená cytotoxicita neutrofilov voči endotelovým bunkám naznačujú zatiaľ nepoznanú úlohu neutrofilov v patogenéze SLE.
Dendritické buňky a jejich role u revmatoidní artritidy
Heřmanová Z, Horák P, Smržová A, Skácelová M
Fakultní nemocnice, Olomouc
Dendritické buňky (DC) jsou nejvýznamnějšími antigen prezentujícími buňkami lidského organismu. DC výrazně zasahují do regulace T a B lymfocytů, a tím propojují vrozenou a adaptivní imunitu. Jsou schopné pohltit, zpracovat a předkládat v kontextu s HLA molekulami různé antigenní fragmenty T lymfocytům v sekundárních lymfatických orgánech. Podílí se tak na ochraně organismu proti infekčním onemocněním. Při pohlcování vlastních rozpadlých buněk zůstávají DC v nezralém stavu, exprimují málo kostimulačních, adhezivních a HLA molekul. V tomto případě DC nezpůsobí aktivaci T a B lymfocytů, ale naopak jejich anergii či tvorbu tlumících T regulačních lymfocytů. Výsledkem je vytvoření tolerance k vlastním buňkám. Porušení uvedeného mechanismu přispívá ke vzniku autoimunitních chorob. DC polarizují T lymfocyty ve směru Th1, což je typicky pozorováno u značné části autoimunitních onemocnění, jako je např. revmatoidní artritida, roztroušená skleróza, psoriáza či diabetes mellitus 1. typu.
U revmatoidní artritidy je synoviální tkáň terčem zánětlivého procesu, který způsobuje erozi kloubní chrupavky a subchondrální kosti s následnou destrukcí kloubů. Synovium je charakteristické expanzí buněk intimy a výraznou infiltrací imunokompetentními buňkami, včetně dendritických buněk. DC jsou přítomny v synoviální tekutině i v synoviální tkáni, a to v nezralém i zralém stádiu. Kromě produkce chemokinů a jejich receptorů jsou DC zdrojem řady cytokinů, které modulují imunitní odpověď včetně ovlivnění funkce T lymfocytů. DC přispívají také k tvorbě terciální ektopické lymfoidní struktury v synovii, což je popisováno až u 40 % pacientů. Dendritické buňky představují díky svým schopnostem slibný budoucí cíl imunoterapie nejen autoimunitních, ale také nádorových a alergických onemocnění. Terapie se zaměří na patologickou autoimunitní odpověď, zatímco protektivní antiinfekční imunitní odpověď zůstane nedotčena.
Problematika liečby nediferencovaných artritíd
Mičeková D, Mlynáriková V
Národný ústav reumatických chorôb, Piešťany
Pod pojem nediferencované artritídy (NA) sú zahrnuté zápalové oligoartritídy alebo polyartritídy, u ktorých nemožno spraviť definitívnu diagnózu, ale časom sa môžu rozvinúť do chronického zápalového reumatického ochorenia alebo môžu prejsť do remisie. Viaceré observačné kohorty pacientov so včasnou artritídou ukázali, v závislosti na inklúznych kritériách, že u 17–32 % pacientov prechádza ochorenie v reumatoidnú artritídu (RA), a na druhej strane u 40–55 % dochádza k spontánnej remisii. Mnohé štúdie demonštrovali, že včasná liečba RA zlepšuje klinické, funkčné a rádiologické výsledky. Otázkou je, či aj včasná liečba NA môže byť ešte väčším prínosom pre pacienta? Existuje tzv. „Teória okna možností“, ktorá je hypotézou, že včasný stupeň RA, možno v štádiu nediferencovanej artritídy, v ktorej môže byť priebeh ochorenia alterovaný príslušnou liečbou, viesť k prevencii rozvoja chronického a invalidizujúceho ochorenia. V roku 2010 boli publikované nové klasifikačné kritériá reumatoidnej artritídy, ktoré umožňujú včasnejšiu diagnózu a liečbu pacientov s RA. Novšie údaje ukazujú, že zavedenie kritérií vedie k včasnejšej diagnóze RA, aj keď benefit z dlhodobého hľadiska bude jasný až časom. Wevers-deBoer a spol. uskutočnili analýzu publikácií, zameraných na liečbu nediferencovaných artritíd alebo včasných artritíd (nespĺňajúcich ACR kritéria 1987 alebo ACR/EULAR kritériá 2010). Študovaná bola liečba i.m. zlatom, i.a. glukokortikoidmi (GK), i.m. glukokortikoidmi, DMARDs a/alebo bez GK, biologické lieky. Štúdie ukázali, že syntetické DMARDs potláčajú aktivitu u pacientov s NA, liečba MTX môže pozdržať, ale nie zabrániť rozvoju RA a môže spomaliť rtg progresiu. Zdá sa, že počiatočná kombinácia MTX a viacerých DMARDs alebo GK vedie k lepšiemu krátkodobému klinickému úspechu. Dlhodobé údaje nie sú k dispozícii. Saalen a spol. sledovali efekt 14-týždňového kurzu aplikácie infliximabu v porovnaní s placebom u pacientov s NA, ktorí neodpovedanie na jednorázovú injekciu GK. Ak po 14 týždňoch pretrvával klinický zápal, zahájila sa liečba MTX. Zaradených bolo 17 pacientov – 10 na infliximab a 7 na placebo. Remisia v 26. týždni sa dosiahla u 1 pacienta na placebe a 2 na infliximabe. Emery a spol. porovnávali 6 mesačnú liečbu abataceptom a placebom. Po 1 roku 12 (46 %) na abatacepte a 16 (67 %) na placebe progredovalo v RA (ACR 1987). Radiologická progresia po 1 roku bola signifikantne nižšia v skupine s abataceptom. Remisia (DAS28) po 1 roku sa dosiahla u 9 (47 %) na abatacepte a 5 (39 %) na placebe. Viaceré štúdie sledovali efekt i.a. alebo i.m. aplikovaných GK. Jednorázová injekcia glukortikoidov pravdepodobne nemá dlhodobejší efekt. Opakovaná i.m. aplikácia GK môže oneskoriť začiatok aplikácie DMARDs, ale nevedie k prevencii rozvoja RA, aj keď v jednej štúdií podporovali vznik remisie. Neexistujú údaje z dlhodobých sledovaní. Závery observačných kohortných štúdií môžu indikovať, že outcome ochorenia je lepší, ak je liečba zahájená do 6 mesiacov.
Fyzická disabilita a kvalita životachorých s hypermobilnýmsyndrómom
Magyar R1,2, Rybár I1
1Klinika reumatológie Lekárskej fakulty Slovenskej zdravotníckej univerzity a Národného ústavu reumatických chorôb, Piešťany, 2IV. interná klinika, Univerzitná nemocnica L. Pasteura, Košice
Hypermobilný syndróm (HS) je klinická jednotka zo skupiny vrodených chorôb spojiva, ktorá je spojená s rôznymi kĺbovými (polyartralgie, epizodické artritídy, ruptúry šliach, distorzie, predčasná osteoartróza) aj mimokĺbovými prejavmi (varixy, hernie, prolaps mitrálnej chlopne). Hlavným príznakom choroby je kĺbová hypermobilita (KH), ktorá sa pri vyšetrení môže často prehliadnuť a ťažkosti podhodnotiť.
Cieľ: Posúdiť fyzickú disabilitu a kvalitu života chorých s hypermobilným syndrómom. Metóda: Prospektívna štúdia s vyšetrením po sebe nasledujúcich pacientov reumatologickej ambulancie. Skríning KH Hakimovým – Grahamovým dotazníkom. Overenie KH podľa Beightonových kritérií. Diagnostika HS podľa Brightonských kritérií. Kontrolná skupina 57 zdravých osôb odpovedajúceho pohlavia a veku. Hodnotenie intenzity bolesti a únavy pomocou VAS, fyzickej disability dotazníkom HAQ a kvalita života podľa SF-36. Pearsonova korelácia.
Vyšetrených 1087 pacientov reumatologickej ambulancie (886 žien, 201 mužov) s priemerným vekom 53,27 ± 14,44 rokov (18–89). Hypermobil-ný syndróm potvrdený u 55 pacientov (54 žien a 1 muža) s priemerným vekom 39,00 ± 1,00 rokov (19–69). Priemerná hodnota intenzity kĺbových bolestí na VAS: 29,67 ± 25,82 mm a únavyna VAS: 46,16 ± 29,32. Mimokĺbové príznaky potvrdené u 16 % pacientov (9/55). Kontrolná skupina 57 zdravých osôb (51 žien, 6 mužov) s priemerným vekom 39,31 ± 2,03 rokov (18–68). Hodnoty priemerného skóre fyzickej disability sa u pacientov s hypermobilným syndrómom aj u osôb kontrolnej skupiny nachádzali v pásme normy, tj. Pod 0,500 (0,288 ± 0,742 vs. 0,101 ± 0,204, NS). Fyzická komponenta kvality života bola u chorých s HS preukazne nižšia oproti zdravým kontrolám (66,56 ± 18,32 vs. 79,04 ± 11,57, p < 0,001). Preukazne nižšie hodnoty sa u chorých s HS zaznamenali v položkách Physical functioning (fyzická aktivita, p < 0,001), Role Physical (obmedzenie fyzickej aktivity, p < 0,01) a Bodily Pain (bolesť, p < 0,05), ale nie v General Health (všeobecné hodnotenie zdravia). Mentálna komponenta kvality života bola u chorých s HS preukazne nižšia oproti zdravým kontrolám (64,87 ± 16,02 vs. 71,11 ± 13,43, p < 0,05). Preukazne nižšie hodnoty sa u chorých s HS zaznamenali v položkách Vitality (vitalita, p < 0,05) a Social Functioning (spoločenská aktivita, p < 0,01), ale nie v Role Emotional (obmedzenie emočnými problémami) ani v Mental Health (mentálne zdravie). Vyššia intenzita bolesti a únavy korelovali s poklesom fyzickej aj mentálnej komponenty kvality života.
Chorí s hypermobilným syndrómom mali fyzickú disabilitu porovnateľnú so zdravými kontrolami, ale preukazne nižšiu fyzickú aj mentálnu komponentu kvality života korelujúcu s bolesťou a únavou.
Prognóza nemocných s časnou a velmi časnou artritidou. Zkušenosti ambulance pro časnou artritidu
Bradna P, Baštecká D, Soukup T, Tošovský M, Tomš J, Kodeda M, Brtková J
Subkatedra revmatologie, II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Ambulance pro časnou artritidu jsou poměrně novým fenoménem, vyvolaným nutností co nejrychlejšího zahájení chorobu modifikující terapie u nemocných s pravděpodobným vývojem destruktivní artritidy. Do ambulance jsou, zpravidla praktickými lékaři, odesíláni pacienti, u nichž byly objektivně pozorovány otoky více než jednoho kloubu. Práce popisuje spektrum, diagnostické vyústění, krátkodobou a dlouhodobou prognózu nemocných z poradny pro časnou artritidu II. interní gastroenterologické kliniky FN Hradec Králové.
Sestavu pacientů tvoří 183 poprvé revmatologicky vyšetřených nemocných s krátkodobou anamnézou artritidy. Muži tvoří 30,6 % sestavy, ženy 69,4 %. Průměrný věk varíroval od 18 do 86 let, v průměru 55,3 roku. Nemocní jsou sledováni 12–60 měsíců. Byla aplikována klasifikační kritéria pro revmatoidní artritidu ACR/EULAR 2010. U těch byla po ověření nálezu byla použita terapie methotrexatem, sulfasalazinem a antimalarikem, jednorázově byl podán metylprednisolon i.m. Kontrolní rtg rukou a nohou u nemocných s revmatoidní artritidou byly zhotoveny lx ročně. Medián oteklých kloubů při vstupním vyšetření byl 5, z toho 4 byly malé klouby. Hladina CRP byla v průměru 22 mg/l, medián však 9 mg/l. Průměrná hodnota sedimentace erytrocytů byla 32 mm/hodinu. Revmatoidní faktor byl přítomen u 31 % všech nemocných, protilátky proti citrulinovanému proteinu v 37 % odeslaných pacientů.Stanovit diagnózu revmatoidní artritidy podle kritérií ACR/EULAR 2010 bylo možno stanovit v 56 % sestavy. U zbývajících nemocných byla stanovena škála dalších revmatologických diagnóz včetně dvou nově diagnostikovaných tumorů s paraneoplastickými projevy.
Remise (DAS28) bylo možno dosáhnout do jednoho roku v 46,8 % nemocných s RA, nízké aktivity choroby v dalších 17,6 %, celkem tedy dosaženo léčebného cíle v 64,4 % nemocných s časnou revmatickou artritidou. Diskutujeme dlouhodobé výsledky léčby po 3–5 letech sledování. K biologické terapii bylo nutno přistoupit u necelých 3 % nemocných. Ve většině případů je dlouhodobě udržována remise nebo nízká aktivita při použití chemických DMARDs režimů.
Ambulance pro časnou artritidu osvědčily svou užitečnost. Zahájení chorobu modifikující terapie ideálně v době velmi časné artritidy (do 3 měsíců od vzniku otoku) nebo co nejdříve poté rezultuje v procento úspěšné léčby blížící se výsledkům studií s biologickou léčbou a ve většině případů je možno remisi dlouhodobě udržovat. Biologická léčba je nutná jen ve výjimečných případech (3 % naší sestavy). Smysluplná existence ambulance pro časnou artritidu však závisí na poučené obci praktických lékařů, kteří odesílají nemocné bez zbytečné prodlevy a na organizaci práce, maximálně urychlující rozhodovací procesy o zahájení terapie.
Neobvyklý případ panikulitidy
Bělobrádková M, Bureš J, Soukup T, Tomš J
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Předkládáme kazuistiku 38leté ženy se souběhem několika autoimunitních onemocnění. Pacientka je od 18 let léčena pro Crohnovu chorobu. Ve 24 letech začala trpět silnými bolestmi hlavy, klaudikacemi levé horní končetiny. Byla prokázána Takayasuova arteritis.Na naši kliniku byla nyní přijata pro výsev bolestivých kožních induraci na břiše a stehnech, váhový úbytek, teploty a koloskopicky prokázaný relaps Crohnovy choroby. Byla provedena biopsie kožních lézí, která prokázala nodulární vaskulitidu.Nodulární vaskulitida je typ lobulární panikulitidy s vaskulitidou, který se vyskytuje u pacientů s Crohnovou chorobou.
V literatuře je tento typ zmiňován v souvislosti s erythema induratum Bazin. Tyto jednotky jsou histologicky identické, liší se etiologií. Erythema induratum Bazin je spojena s tuberkulózou. Na tuto jednotku jsme mysleli, protože pacientka v rámci terapie podstoupila i biologickou léčbu, která až osmkrát zvyšuje riziko infekce TBC. Provedli jsme příslušná vyšetření, kterými jsme mykobakteriální infekci vyloučili. Pacientce jsme tedy mohli navýšit imunosupresivní léčbu Crohnovy choroby, což je zároveň i kauzální léčba nodulární vaskulitidy.
Idiopatická granulomatózní mastitis – má se revmatolog zajímat o prsa?
Bradna P1, Jandík P2, Hadži Nikolov D3, Laco J3, Urminská H4, Žižka J4 1
1Subkatedra revmatologie, II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové; 2Chirurgická klinika LF a FN, Hradec Králové; 3 Fingerlandův ústav patologie, Hradec Králové; 4Radiologická klinika LF a FN, Hradec Králové
Revmatologie svou systémovou podstatou zasahuje do patologie většiny orgánů lidského těla. Recentně se k autoimunitním procesům, léčeným imunomodulační léčbou řadí rovněž onemocnění, postihující převážně, avšak nikoliv výhradně prs – idiopatická granulomatózní mastitida. Nad kazuistikou jednoho z případů se zamýšlíme nad diagnostikou, symptomatologií a léčebnými možnostmi této pro revmatologa vzácné chorobné jednotky s nutností interdisciplinárního přístupu. Popisujeme kazuistiku 35leté ženy na mateřské dovolené, u níž se objevila tuhá rezistence v levém prsu. Byla ošetřena chirurgicky s nálezem tekutinové kolekce. Ta byla drénována, kultivačně však nebyla prokázána infekce. Proto byla provedena excize útvaru a v něm histologicky prokázán obraz odpovídající granulomatózní mastitidě. Lokální nález se pozvolna zlepšoval. Když se asi po dvou měsících od začátku onemocnění objevila červená bolestivá kožní ložiska na předloktí a na dolních končetinách, byla nemocná odeslána k revmatologickému vyšetření podezření na vaskulitidu. Biopsie kůže a podkoží však prokázala obraz granulomatózního zánětlivého procesu obdobný nálezu z prsu. Idiopatická granulomatózní mastitida je rekurující onemocnění, u nějž se předpokládá podíl autoimunitních patogenetických mechanismů. Etiologie není jasná, zvažují se spouštěcí vlivy mikrobiální infekce (Corynebakteria), u významné části nemocných je v blízké anamnese laktace. Nebyly popsány specifické autoprotilátky. Je nutno odlišit tuberkulózní zánět vzhledem k podobnosti histologického obrazu (granulomatózní nekaseózní zánět). Ze systémových projevů se objevuje kožní postižení, typické je špatné hojení ran a jizvení. V posledních letech se prokázal příznivý efekt imunomodulační terapie, nejčastěji kortikosteroidy a cytotoxickými imunosupresivy (MTX, azathioprin, kolchicin). Zdá se, že imunomodulační léčba vede k omezení recidiv, zatímco chirurgické ošetření recidivám nebrání.
Idiopatická granulomatózní mastitida je vzácné onemocnění s pravděpodobnou autoimunitní složkou, kde imunomodulační terapie je jednou z možností léčby. Revmatolog je angažován jako konsiliář, může však převzít a vést imunomodulační terapii. Pro diagnózu a léčbu je důležitá součinnost řady medicínských oborů, zejména onkologie (neoplazma je zásadní diferenciální diagnózou), chirurgie, zobrazovacích technik, poučeného patologického anatoma a revmatologa.
Dobré vzdělání v muskuloskeletální sonografii, klíč ke správné diagnóze
Hánová P
Revmatologický ústav, Praha
Zjistit závislost shody sonografického nálezu na délce a způsobu edukace sonografistů. Srovnání se zahraničními zkušenostmi.
V rámci různých klinických hodnocení byla testována spolehlivost UZ nálezů skórovacího systému US7. Hodnotilo se celkem 7 kloubů na dominantní či více postižené horní a dolní končetině. Hodnocení se účastnilo pokaždé 8 stejných vyšetřujících s různou úrovní zkušenosti po 6 měsících a 2 letech. Hodnocena byla spolehlivost výsledku uvnitř skupiny i u jednotlivých vyšetřujících.
Interobserver reliability (IeOR) testování po 6 měsících byla nízká (kappa ≤ 0,2), intraobserver reliability v intervalu 0–1. Po 18 měsících průměrná IeOR: kappa = 0,6; IaOR v intervalu kappa 0,6–1.
Závěr: Shoda na sonografickém nálezu je úměrná úrovni vzdělání sonografisty. Ve valné většině evropských států i USA existuje ucelený systém edukace v muskuloskeletální sonografii na národní i mezinárodní ůrovni. Jeho absolvování v předepsaném rozsahu a pod dohledem zkušených sonografistů je k sonografické specializaci nezbytné. V ČR tento systém doposud chybí, jeho vytvoření v budoucnu se s přístupností UZ metodiky jeví jako nezbytné.
Kardiovaskulární příhody u SLE
Smržová A, Horák P
III. interní klinika – nefrologická, revmatologická a endokrinologická, Fakultní nemocnice a LF UP, Olomouc
Systémový lupus erythematodes (SLE) je autoimunitní onemocnění s multiorgánovým postižením. Kardiovaskulární postižení zaujímá přední místo v mortalitě pacientů s SLE. Velmi důležitým jevem je akcelerace aterosklerózy a její následné kardiocerebrální příhody. Nejčastěji se jedná o infarkt myokardu (IM) a cévní mozkovou příhodu (CMP). Žilní trombóza v přímé souvislosti se SLE se objevuje asi v 10 %. Prezentovaná práce sleduje výskyt kardiovaskulárních příhod a je-jich vztah k vybraným rizikovým faktorům v kohortě pacientů se SLE sledovaných v jednom klinickém centru (III. interní klinika, FN a LF UP Olomouc).
Soubor obsahuje 63 pacientů se SLE (ženy/ muži – 53 : 10, průměrný věk 38,4 ± 12,7 let, průměrná doba trvání choroby 143 ± 173,5 měsíců, BMI 24,74 ± 5,06, obvod pasu 83,38 cm ± 16,58), 25 pacientů má lupusovou nefrididu. Hodnota intima media thickness (IMT) byla měřena standardně ultrasonograficky, 10 mm proximálně od bifurkace a. carotis communis na obou stranách. Z laboratorních metod byly měřeny sérové hladiny celkového cholesterolu (CH), triglyceridů (TG), lowdensity lipoproteinu (LDL), high-density lipoproteinu (HDL), anti-ds DNA, antinukleozomální protilátky (ANUC), C3 a C4 složky komplementu a ENA protilátek. Klinická aktivita choroby byla hodnocena pomocí indexů aktivity a kumulativního poškození SLEDAI a SLICC. Dále bylo využito dotazníkové metody ke zmapování tradičních rizikových faktorů kardiovaskulárních onemocnění. Podrobnou analýzou byly spočítány kumulativní dávky glukokortikoidů a dalších imunosupresiv, užívání antikoagulační, antiagregační terapie, medikace statiny a ACE inhibitory.
Anamnézu kardiovaskulární příhody v průběhu SLE mělo 21 pacientů (33 %) – 3 infarkty myokardu (4,7 % z celého souboru, 14 % ze všech KVP), 8 cévních mozkových (12,7 % z celého souboru, 38 % ze všech KVP) a 12 tromboembolických příhod (19 % z celého souboru, 57 % ze všech KVP). Dva pacienti měli kombinaci dvou manifestací – CMP a IM, CMP a EAP. S přítomností KVP korelovala obezita, obvod pasu a boků, kouření, celkový cholesterol, LDL, poměr CH/HDL, hladiny apo lipoproteinu A – 1 a B. Hraniční statistickou významnost byla zaznamenána u aktivity choroby (SLEDAI), hsCRP, pozitivitě RNP protilátek, antikardiolipinových protilátek a lupus antikoagulant (p = 0,06). V hodnotě šířky intima media se obě skupiny lišily jen hraničně (p = 0,07). Dále byly podrobněji analyzovány podskupiny pacientů i IM, CMP, TEN a arteriální hypertenzí.
Práce poukazuje na vysoký výskyt KVP u SLE. Potvrzuje nutnost věnovat kardiovaskulární problematice v revmatologii pozornost.
Úskalí implantace totální endoprotézy kolenního kloubu u revmatiků
Šponer P, Kučera T
Ortopedická klinika LF UK v Hradci Králové a FN, Hradec Králové
Implantace náhrady kolenního kloubu u revmatiků představuje účinnou léčebnou metodu, při níž však musí být respektována řada pro úspěch léčby nezbytných předoperačních, peroperačních a pooperačních opatření. Implantaci kloubní náhrady u revmatiků pak provázejí též specifická technická úskalí, která souvisejí s horší kvalitou kosti i měkkých tkání. Cílem předkládaného sdělení je prezentace zásad aloplastiky kolenního kloubu u revmatiků na základě retrospektivního zhodnocení vlastního pětiletého souboru pacientů.
Při retrospektivním hodnocení souboru pacientů operovaných na Ortopedické klinice LF UK a FN v Hradci Králové pro revmatickou valgózní deformitu kolenního kloubu budou porovnány výsledky předoperačního a pooperačního klinického a rentgenologického vyšetření se zaměřením na skupinu pacientů, u nichž byl vzhledem ke stupni valgózní deformity kolenního kloubu použit laterální parapatelární přístup. Při klinickém hodnocení budou porovnány výsledky s využitím Knee Society Score. Při rentgenologickém hodnocení bude zhodnocena míra dosažené korekce na základě zhodnocení femorotibiálního úhlu, zhodnocena též bude přítomnost radiolucentních linií v okolí implantátu. Samostatnou problematikou je zhodnocení výskytu komplikací u našeho souboru operovaných revmatiků.
Implantace kloubní náhrady v oblasti kolenního kloubu vyžaduje koordinaci péče revmatologické a ortopedické s respektováním důležitých opatření před, během a po provedeném operačním výkonu. Laterální parapatelární přístup umožňuje díky dózovanému uvolnění zkrácených měkkých tkání adekvátní korekci mechanické osy dolní končetiny, která je předpokladem dobré funkce kloubní náhrady.
Antifosfolipidový syndrom – klinické manifestace, diagnostika a léčba
Horák P
III. interní klinika nefrologická, revmatologická, endokrinologická, FN a LF UP, Olomouc
Antifosfolipidový syndrom (APS) je soubor příznaků spojený s přítomností protilátek proti fosfolipidům (lupus antikoagulans, antikardiolipinové protilátky, protilátky proti beta2glykoproteinu). Bývá přítomen u systémových chorob pojiva, zejména u SLE, kde se hovoří o sekundárním antifosfolipidovém syndromu, nebo se vyskytuje samostatně jako tzv. primární antifosfolipidový syndrom.
Projevuje se poruchami krevního srážení spojenými s laboratorními odchylkami při vyšetření koagulace (prodloužení aPTT, falešně pozitivní BWR), klinicky pak častými trombózami arteriálního či venózního řečiště spojenými s poškozením postižených orgánů (pneumologické, neurologické, ledvinné manifestace) a specifickou patologií spojenou s graviditou (úmrtí plodu, časté spontánní aborty). Často se vyskytuje rovněž trombocytopenie, jakožto i další asociované příznaky. Antifosfolipidový syndrom (APS) je charakterizovaný přítomností venózní či arteriální trombózy či specifické komplikace gravidity při současném laboratorním průkazu přítomnosti antifosfolipidových protilátek. Přítomnost antifosfolipidových protilátek by měla být prokázána při dvou odběrech v intervalu nejméně 12 týdnů. Přítomnost protilátek namířených proti plazmatickým proteinům vázajícím fosfolipidy může být prokázána přímo buď ELISA metodou v případě antikardiolipinových protilátek či protilátek proti β2 glykoproteinu I, nebo koagulačním vyšetření prokazujícím účinek protilátky na faktory koagulační kaskády závislé na fosfolipidech (test lupus antikoagulans). Klasifikační kritéria byla vyvinuta zejména pro potřeby výzkumu, jejich užití v klinické praxi je problematičtější a ne vždy se o ně klinická diagnóza APS může plně opřít. Definitivní diagnóza APS se opírá o přítomnost nejméně jednoho klinického a jednoho laboratorního kritéria. Primární a sekundární APS – většina dostupných pramenů naznačuje, že průběh primárního či sekundárního antifosfolipidového syndromu je podobný. Některé údaje však popisují závažnější průběh APS asociovaného se systémovým lupusem. U určité části primárních antifosfolipidových syndromů se může SLE vyvinou v průběhu let.
Antifosfolipidový syndrom je spojený se zvýšenou mortalitou, ať již v souvislosti s vlastními manifestacemi či v důsledku akcelerované aterosklerózy či ischemické choroby srdce.
Terapie primárního či sekundárního APS zásadně neliší. U sekundární formy je často nezbytná i imunosuprese k potlačení aktivity základního patologického procesu. Nejčastěji se v léčbě užívá heparin (nízkomolekulární LMWH či nefrakcionovaný), warfarin a kyselina acetylsalicylová. Pacienti se systémovým lupusem užívají velmi často hydroxychorochin, který má prospěšný efekt i v rámci antifosfolipidového syndromu.
Katastrofický antifosfolipidový syndróm
Tuchyňová A
Národný ústav reumatických chorôb, Piešťany
Katastrofický antifosfolipidový syndróm (CAPS) je síce zriedkavou, ale najzávažnejšou formou antifosfolipidového syndrómu. Spúšťače tohto stavu môžu byť rôzne. Medzi predpokladané patogenetické mechanizmy patrí aktivácia endotelových buniek, trombocytov, inhibícia antikoagulačných faktorov a fibrinolýzy, aktivácia komplementu. CAPS sa klinicky manifestuje multiorgánovým postihnutím, ktoré sa vyvíja v priebehu niekoľkých dní a je podmienený vznikom mnohopočetných cievnych oklúzií. Medzi najčastejšie postihnuté orgány patria obličky, pľúca, centrálny nervový systém, srdce, pečeň, gastrointestinálny trakt a koža, s histologickým obrazom trombotickej mikroangiopatie. V laboratórnom obraze nachádzame predovšetkým prítomnosť protilátok proti kardiolipínu, beta-2-glykoproteínu, lupus antikoagulans, antinukleárnych protilátok, trombocytopénie a anémie. Diferenciálne diagnosticky je potrebné odlíšiť iné ochorenia s podobným obrazom, ako napríklad imunitnú trombocytopéniu, hemolyticko-uremický syndróm, heparínom indukovanú trombocytopéniu a ďalšie. K včasnej diagnostike CAPS by mali napomôcť aktualizované diagnostické algoritmy. Kritickým bodom pre prognózu pacienta s CAPS je okrem skorej diagnostiky aj včas zahájená agresívna terapia, ktorej základonm je kombinovaná antikoagulačná liečba s glukokortikoidmi, intravenóznymi imunoglobulínmi a plazmaferéza. Napriek súčasným možnostiam liečby zostáva mortalita týchto pacientov stále vysoká.
Cieľom tejto práce je prezentácia súčasných poznatkov o patogenéze, klinickom obraze, diagnóze a liečbe tohto syndrómu.
Antifosfolipidový syndrom a gravidita
Tegzová D, Andělová K1/
Revmatologický ústav, Praha, 1/Ústav péče o matku a dítě v Praze
Mezi významné rizikové faktory pro ztrátu plodu patří přítomnost antifosfolipidových protilátek, která je typická pro antifosfolipidový syndrom. Takto nemocné ženy totiž nejsou často schopny plod donosit a ztrácí jej opakovaným potrácením nejčastěji ve druhém nebo na začátku třetího trimestru. Jako příčina tohoto jevu je pokládána přítomnost a působení antifosfolipidových autoprotilátek, a to jak lupusového antikoagulans, tak antikardiolipinových protilátek. Předpokládá se, že tyto protilátky vyvolávají trombózu cév placenty a tím negativně ovlivňují přívod kyslíku a výživy k plodu, což vede k jeho předčasnému zániku. Tomu lze předcházet včasným nasazením antiagregační a antikoagulační léčby, která je u rizikových žen podávána téměř po celou dobu gravidity. Při antiagregační terapii je užíván aspirin, jehož nízké dávky je možno podávat po celou dobu gravidity i laktace a jsou vhodnou a bezpečnou možností antiagregační léčby v graviditě u žen s vyšším rizikem trombomebolické příhody. Vyšší dávky aspirinu by neměly být gravidním ženám podávány posledních 4–8 týdnů před porodem a v průběhu laktace. Warfarin může u plodu způsobit fetální warfarinový syndrom, který je charakterizován embryopatií, poškozením CNS, spontánními aborty, porody mrtvého plodu, hemoragiemi a předčasnou zralostí plodu. V graviditě je nutno jej vysadit a změnit léčbu za heparinem nebo nízkomolekulární heparinem. Antikoagulační léčba heparinem nebo nízkomolekulárním heparinem je bezpečná pro matku i plod a jeho aplikace v graviditě i v laktaci je možná. Vyšší molekulární váha má mít pozitivní význam v tom, že lék neproniká ani přes placentu ani do mléka. Významným nežádoucím projevem terapie heparinem a jeho deriváty je zvýšená ztráta kostní hmoty, a proto je u takto léčených gravidních žen nutná důsledná prevence rozvoje osteoporózy kalciem a vitaminem D.
Podporováno Výzkumnými záměry ministerstva zdravotnictví ČR číslo: 000 000 23728
Současné možnosti léčby revmatické polymyalgie
Němec P1, Řehák Z2
1Revmatologická ambulance, II. interní klinika, FN u sv. Anny v Brně a Lékařská fakulta Masarykovy univerzity, Brno, 2Oddělení nukleární medicíny, Masarykův onkologický ústav, Brno
Revmatická polymyalgie (PMR) patří mezi nejčastější zánětlivá revmatická onemocnění osob ve vyšším věku s převahou postižení žen. Etiologie PMR není doposud známá. Incidence tohoto onemocnění se pohybuje mezi 13–113 případy na 100.000 obyvatel s častějším výskytem v Evropě a Severní Americe. 5–30 % případů PMR bývá provázeno příznaky obrovskobuněnčné arteriitidy. K typickým projevům onemocnění patří symetrická pletencová bolest v oblasti ramenních kloubů, šíje a pánve. K diagnostice PMR je možné použít nová klasifikační kritéria EULAR z roku 2012. V poslední době se k potvrzení diagnózy PMR začínají využívat i moderních zobrazovací metody, např. ultrasonografie, magnetická rezonance a zejména 18F-FDG pozitronová emisní tomografie (PET). Vyšetření pomocí PET, případně PET/CT, může současně poskytnout informaci o postižení velkých tepen vaskulitidou nebo o přítomnosti maligního onemocnění. Lékem první volby jsou glukokortikoidy. Jejích podávání vede k vymizení příznaků onemocnění a k poklesu reaktantů akutní fáze, ale jejich dlouhodobé použití může být provázeno výskytem nežádoucích projevů léčby. Sdělení pojednává o současných možnostech léčby PMR s využitím alternativních léčebných režimů, které zahrnují použití imunosupresiv a biologických léků.
Malé molekuly v liečbe reumatických chorôb
Lukáčová O, Lukáč J, Rovenský J
Národný ústav reumatických chorôb, Piešťany
Desiatky rokov sa v liečbe reumatoidnej artritídy (RA) používajú malé molekuly DMARDs, ktoré môžu spôsobiť prerušenie intracelulárnej alebo extracelulárnej signalizačnej cesty. Biologická liečba, ktorú máme k dispozícii od r. 1990, prerušuje extracelulárnu komunikáciu. Najnovšie sa študujú malé molekuly, ktoré dokážu prerušiť intracelulárnu signalizáciu založenú na inhibícii kináz. V skupine nereceptorových proteínových kináz je zatiaľ známych 10 podtypov. Prerušením jednej alebo viacerých kináz môže dôjsť k modulovaniu funkcií bunkových štruktúr ako napr. povrchových receptov, signálnych proteínov, transkripcie jadrových proteínov a môže vplývať na cieľové bunkové typy. JAK-STAT (Janus-asociovaná kináza). Ide o rodinu nereceptorových proteínových tyrozínkináz, ktoré vplývajú na vnútrobunkovú signalizáciu pomocou transkripcie JAK-STAT cesta. Poznáme 4 typy JAK 1, 2, 3 a tyrozín kináza Tyk 2. SYK (Spleen tyrozín kináza).
Cytoplazmatická tyrozínkináza je exprimovaná na hemopoetických bunkách, B lymfocytoch, nezrelých T lymfocytoch, makrofágoch, hrá úlohu pri imunitnej odpovedi, vplýva na bunkové prežívanie, uvoľnenie cytokínov, ovplyvňuje aj signalizáciu osteoklastov, synoviálnych fibrocytov, trombocytov, lymfatických ciev. BTK (Bruton – tyrozín kináza). Intracelulárna kináza exprimovaná na hemopoetických bunkách, B lymfocytoch, makrofágoch. Mohla by mať dôležitú úlohu v liečbe artritíd aj iných autoimunitných chorobách. PI3K (Fosfatidylinositol-3 kináza). Skupina signálnych molekúl, ktoré fosforilujú 3 - hydroxylovú skupinu inozinolového kruhu fosfatidylinositolu lipidových substrátov. Ovplyvňuje rast buniek, prežívanie buniek, proliferáciu, metabolizmus viacerých bunkových typov. Nové cesty liečby autoimunitných chorôb sú založené na prerušení intracelulárnej signalizácii cestou kináz. Takto je možné modulovať funkciu bunkových štruktúr ako sú povrchové receptory, signálne proteíny, transkriptné jadrové proteíny. Majú signifikantný potenciál na vývoj vysokoefektívnej perorálnej liečby. Liečba RA inhibíciou kináz je selektívne cielená. Prebiehajú viaceré štúdie, ktoré by mali pomôcť pri pochopení risku a benefitu pri tejto liečbe u pacientov s RA.
Úloha kolchicínu v súčasnej farmakoterapií dnavej artritídy
Rybár I, Ursínyová U, Čaničová A
Klinika reumatológie LF SZU a NÚRCH Piešťany
Cieľom liečby dny v jednotlivých štádiách choroby je znížiť sérovú koncentráciu urátov pod 360 µmol/l (6,7 mg/dl) a pri akútnom dnovom záchvate potlačenie klinických prejavov. Prehľad farmakoterapie jednotlivých foriem dny poukazuje na pevné postavenie jednotlivých účinných látok. Kolchicín: liečba akútneho dnového záchvatu a prevencia akútneho záchvatu v úvode hypourikemickej liečby. Urikozuriká: inhibujú organický aniónový transportný systém v obličkách, ktorý vychytáva kyselinu močovú v primárnom moči a vracia ju do krvi. Urikostatiká: liečba hyperurikémie bez ohľadu na funkciu obličiek. Urikázy: peglotikáza a rasburikáza. Peglotikáza je liek určený na liečbu závažných prípadov chronickej dnovej artritidy, ktoré zaberajú na liečbu bežnými antiuratikami. Rasburikázu povolila EMEA v roku 2009 na liečbu akútnej hyperurikémie pri prevencii akútneho zlyhania obličiek u pacientov s hematologickými malignitami. Cieľom urikostatickej liečby je znížiť a stabilizovať hladiny kyseliny močovej v sére. Rizikovým obdobím na vznik akútných dnových záchvatov je niekoľko prvých týždňov hypourikemickej liečby. Vtedy môže kolísanie hladiny kyseliny močovej spôsobiť ich vzplanutie. Príčinou vzniku dnových záchvatov v uvedenom období je zníženie sérových urátov, ktoré spôsobuje prechodné, lokalizované precipitácie kryštálikov nátriumurátu v chrupkách a mäkkých tkanivách.V súčasnosti sa na prevenciu akútnych dnových záchvatov používajú nesteroidové antiflogistiká alebo nízko dávkovaný kolchicín. Výsledky klinických štúdií potvrdili, že nízko dávkovaný kolchicín (0,5 mg – 1 mg denne po dobu 3 až 6 mesiacov) štatisticky významne znižuje incidenciu akútnych dnových záchvatov v prvých 3 mesiacov od začatia urikostatickej liečby, ako aj v ďalších 3 mesiacov urikosurickej liečby. Súčasne sa potvrdilo, že ak napriek liečbe kolchicínom akútne dnové záchvaty vzniknú, majú ľahší priebeh a menej často sa opakujú. Navyše kolchicín aplikovaný prechodne po dobu do 6 mesiacov, má pri porovnaní s nesteroidovými antiflogistikami priaznivejší bezpečnostný profil, predovšetkým u chorých s rizikom gastrointestinálnych a kardiovaskulárnych nežiadúcich účinkov.
Prospektivní, randomizované, jednoduše zaslepené, multicentrické klinické hodnocení účinnosti a bezpečnosti léčby methotrexátem a kortikoidy oproti léčbě pouze kortikoidy u nemocných s polymyozitidou a dermatomyozitidou (studie PROMETHEUS)
Tomasová Studynková J1, Mann H1, Jarošová K1, Blumhardt S2, Maurer B2, Dastmalchi M2, Danko K3, Świerkocka K5, Olesinska M5, Distler O2, Lundberg IE3, Vencovský J1
1RÚ, Praha, Česká republika, 2Fakultní nemocnice Zurich, Švýcarsko, 3Rheumatology Karolinska Institutet, Stockholm, Švédsko, 4University of Debrecen, 5Revmatologický ústav, Varšava, Polsko
V terapii polymyozitidy (PM) a dermatomyozitidy (DM) se obvykle používají glukokortikoidy (GK) nebo GK s přidanými imunosupresivy. Vzhledem k malému počtu pacientů s PM/DM jsou kontrolovaná klinická hodnocení účinnosti těchto dvou postupů vzácná. V klinické praxi se často ke GK přidává methotrexát (MTX); důkazy podporující tuto strategii zatím chybí.
Cílem studie bylo hodnocení účinnosti a bezpečnosti léčebných postupů GK vs. GK s přidaným MTX u nemocných s PM/DM. Primárním cílem bylo stanovení celkové dávky kortikoidů (v mg/kg váhy) v průběhu studie. Sekundární cíle byly hodnocení aktivity onemocnění, svalové vytrvalosti, funkčního postižení a bezpečnosti léčby.
Pacienti naivní na MTX byli randomizováni do 2 skupin léčených GK (skupina A) nebo GK s MTX (skupina B). Studie byla otevřená, ale aktivita onemocnění byla hodnocena zkoušejícím neobeznámeným s léčbou. Délka léčby byla 48 týdnů. Dávka GK na počátku hodnocení byla 1 mg/kg a byla snižována každé 4 týdny, pokud bylo dosaženo definice zlepšení (DOI). Maximální dávka MTX byla 20 mg/t.
V 5 centrech bylo celkem zařazeno 31 pacientů (17 PM, 14 DM). Šestnáct pacientů bylo randomizováno do skupiny A, 15 do skupiny B. Skupiny A i B vykazovaly stejné základní charakteristiky. Čtyři pacienti (3 v A , 1 v B) byli během hodnocení vyřazeni. Kritéria DOI ve 48. týdnu splnilo 85 % pacientů (skupina A) a 86 % pacientů (skupina B). Nebyl významný rozdíl v celkové podané dávce Prednisonu (124 ± 16 mg / kg ve skupině A vs 135 ± 14 mg / kg ve skupině B, p = 0,6). Rovněž nebyl mezi skupinami A a B zjištěn žádný významný rozdíl v parametrech hodnocení účinnosti terapie. Celkem bylo hlášeno 92 případů nežádoucích účinků (AE). Počet AE v obou skupinách byl podobný. Nežádoucí účinky v souvislosti s léčbou GK byly častější ve skupině A (5 případů) než ve skupině B (2 případy).
U pacientů s polymyozitidou nebo dermatomyozitidou v časném stadiu onemocnění nebyla prokázána větší účinnost léčby GK s přidaným MTX v porovnání s léčbou pouze GK po dobu jednoho roku sledování.
Podpořeno grantem EULAR a projektem RÚ č. 00023728.
Aktuální trendy v léčbě neuropatické bolesti v revmatologii
Šléglová O
Revmatologický ústav, Praha
Neuropatická bolest patří mezi obtížně ovlivnitelná onemocnění. Její léčba by měla být komplexní, nicméně nejúčinnější možnost představuje farmakoterapie. Výzkum této oblasti je zaměřen na plné objasnění patologických procesů, které ovlivňují rozvoj a trvání neuropatické bolestí se snahou najít možné mechanismy jejího ovlivnění. Na základě nových poznatků jsou upravována mezinárodní i česká doporučení pro diagnostiku a léčbu neuropatické bolesti, kterými se řídíme i v případě neuropatických bolestí vznikajících u revmatických onemocnění.Neuropatická bolest bývá rezistentní na klasická analgetika a v její léčbě se používají adjuvantní analgetika. K nejvýznamnějším změnám zde bezesporu patří potvrzení účinnosti gabapentin a pregabalin, které významně tlumí neuropatickou bolest a staly lékem 1. linie v její léčbě. Širšímu uplatnění této léčby u revmatologických pacientů bránilo původní omezení preskripce těchto léků jen na neurology. Od roku 2011 má však revmatolog možnost předepisovat pregabalin a od roku 2012 i gabapentin.V současnosti je pozornost zaměřena na důležitost sestupných mozkových drah, v kterých jsou nejdůležitější neurotransmitery noradrenalin a serotonin. Proto je velká naděje vkládána do vývoje léků umožňujících modulaci bolesti na podkladě monoaminergních substancí. Do této skupiny patří duloxetin a venlafaxin. Duloxetin, který má potvrzený efekt u periferní bolestivé diabetické neuropatie, byl zkoumán ve dvojitě slepých randomizovaných studií u osteoartrózy kolene (3 studie) a u bolestí zad (3 studie), kde potvrdil účinnost. Na základě těchto studií americká FDA schválila jeho použití i k léčbě chronické muskuloskeletální bolesti.
Novým preparátem k léčbě bolesti je i vysoce koncentrovaný kapsaicin ve formě náplasti, který je indikován k léčbě periferní neuropatické bolesti nediabetologické etiologie u dospělých pacientů. Kapsaicin je selektivní agonista vaniloidní receptoru TRPV1. Vysoké dávky kapsaicinu vedou nejprve k nadměrné stimulaci kožních nociceptorů exprimujících TRPV1 a poté k následné desenzitizaci těchto receptorů a k inhibici bolesti. Kapsaicin v lokální formě se vyznačuje odlišným mechanismem účinku než ostatní léky a je vhodný do kombinace prakticky se všemi antineuropatickými léky. V rámci sdělení bude prezentována studie s kapsaicinem provedena v Revmatologickém ústavu u pacientů se syndromem karpálního tunelu u revmatických onemocnění.
Methotrexát v terapii revmatoidní artritidy
Svobodová R
Revmatologický ústav, Praha
Methotrexát (MTX) je v současné době nejužívanějším chorobu modifikujícím lékem a lékem první volby u pacientů s revmatoidní artritidou (RA). Má příznivý poměr účinku a rizika. Po třech letech zůstává na léčbě MTX více než 50 % nemocných, což je dvojnásobek oproti jiným DMARDs.
Účinek nastává během 6–8 týdnů u 60–75 % pacientů. Je prokázáno, že zpomaluje rentgenovou progresi, snižuje počet aktivních kloubů až o 75 %, snižuje spotřebu nesteroidních antirevmatik a glukokortikoidů, má pozitivní účinek na klinickou aktivitu onemocnění, snižuje CRP, zlepšuje funkční schopnosti pacientů a zlepšuje mortalitu nemocných. Pokud není v monoterapii dostatečně účinný, je kotevním lékem pro kombinace s jinými DMARDs nebo s různými biologickými přípravky, kde zvyšuje jejich účinnost.
Některé nové studie u časných forem revmatoidní artritidy u pacientů, kteří nebyli dosud léčeni chorobu modifikujícími léky (DMARDs), potvrdily vynikající účinek MTX na klinické symptomy a také určité zpomalení rentgenové progrese. Efekt MTX se v těchto studiích blížil účinku TNF-α blokujících léků.
Parenterální způsob podání MTX ve srovnání s perorálním nabízí rychlejší nástup účinku při vyšší biologické dostupnosti, nižším výskytu nežádoucích účinků na GIT a možnosti podávání vyšších dávek MTX dle individuální potřeby. Řada klinických hodnocení, zaměřených na hodnocení prediktivních faktorů odpovědi na MTX, prokázala větší účinnost MTX u mužů, nekuřáků, časné RA a při současném podávání kortikoidů. Naopak nižší účinnost byla pozorována po nasazení MTX až po jiných DMARDs a při vyšší počáteční aktivitě onemocnění. Vzhledem k jeho účinnosti a tomu, že je používán jako komparátor v klinických hodnoceních s novými biologickými léky (anti-CD4, IL-1r, anti-TNF, IL-10, anti-IL6, atd.) zůstane s jistotou na dalších 5–10 let lékem volby u pacientů s revmatoidní artritidou.
Polymorfismy C677T a A1298C genu pro methylentetrahydrofolát reduktázu jsou spojeny se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
Soukup T1/, Doseděl M2/, Pávek P3/, Nekvindová J4/, Tošovský M1/, Vlček J2/, Bradna P1/,
1/ II. interní gastroenterologická klinika, LF UK v Hradci Králové a FN, Hradec Králové; 2/ Katedra sociální a klinické farmacie, FaF v Hradci Králové, UK Praha; 3/ Katedra farmakologie a toxikologie FaF v Hradci Králové, UK Praha; 4/ Ústav klinické biochemie a diagnostiky, LF v Hradci Králové a FN, Hradec Králové
Methotrexát (MTX) patří k základním lékům používaným při léčbě revmatoidní artritidy (RA). Efektivita léčby MTX u RA se pohybuje mezi 46 % – 65 % (hodnoceno podle kritéria ACR 20). Farmakogenetika se zabývá genetickou predispozicí pacienta pro odpověď na danou léčbu.
Cílem práce bylo zjistit, zda jednonukleotidové polymorfismy (SNPs) C677T a A1298C pro MTHFR gen predikují odpověď na léčbu MTX u pacientů s RA z Východočeského regionu. Hodnocení účinnosti bylo provedeno na základě sledování změny DAS 28 (∆DAS 28) během prvních šesti měsíců léčby MTX.
Do studie bylo zařazeno 120 pacientů, všichni splnili klasifikační kritéria pro RA (American College of Rheumatology – ACR 1987) a v minulosti nebo v současnosti byli léčeni perorálním MTX. Část nemocných byla léčena monoterapií MTX s glukokortikoidy nebo bez nich (n = 65), ostatní (n = 55) pacienti užívali MTX a zároveň konvenční syntetický DMARD nebo biologikum. Genotypizace byla provedena použitím (LifeTechnologies) TaqMan (allele-specific) PCR alelické diskriminace.
Při hodnocení za pomocí tzv. dominantního modelu jsme nenalezli asociaci C677T a A1298C SNPs a EULAR odpovědi na léčbu MTX. Porovnáním genotypů (všech homozygotů a heterozygotů) za použití ∆DAS 28 během šesti měsíců MTX léčby jsme nalezli signifikantně zhoršenou odpověď na léčbu u genotypu 677CT (p = 0,01) a 1298AC (p = 0,043) u pacientů na MTX monoterapii. Byl také ukázán synergický efekt 677CT a 1298AC genotypů na signifikantní snížení léčebné odpovědi charakterizované ∆DAS 28 po šesti měsících monoterapie MTX (p = 0,013, ῃ2 = 0,160 – large effect size).
Naše data svědčí pro možnou spojitost C677T a A1298C SNPs se zhoršenou odpovědí na léčbu MTX u RA.
Podpořeno MZ ČR – RVO (FNHK, 00179906).
Vztah kalprotektinu (S100A8/9) s klinickými, laboratorními a ultrazvukovými parametry aktivity revmatoidní artritidy
Hurňáková J1,2/, Závada J1,2/, Hánová P1,2/, Hulejová H1,2/, Klein M1,2/, Mann H1,2, Šléglová O1,2/, Olejárová M1,2/, Forejtová Š 1,2/, Růžičková O 1,2/, Komarc M 2,3/, Pavelka K 1,2/, Šenolt L 1,2/
1/Revmatologický ústav, 2/1. lékařská fakulta Univerzity Karlovy v Praze, 3/Ústav biofyziky a informatiky 1. LF UK, Praha
Kalprotektin (heterodimer S100A8/9, MRP8/14, calgranulin A a B) je novým, slibným markerem aktivity revmatoidní artritidy (RA). Na rozdíl od jiných sérových proteinů akutní fáze, které jsou většinou hepatálního původu, je kalprotektin uvolňován z aktivovaných synoviálních makrofágů během zánětlivých procesů, a tak přímo odráží lokální zánětlivou aktivitu v kloubech. Jeho zvýšené hladiny byly pozorovány nejen v synoviální tekutině, ale i v periferní krvi pacientů s RA a řada autorů popisuje asociaci hladin kalprotektinu s jinými konvenčními parametry aktivity nemoci. Málo se ví o vztahu hladin kalprotektinu k ultrazvukem verifikované aktivitě RA, který je považován za citlivější metodu v průkazu synovitidy než klinické vyšetření. Cíl: Cílem naší studie bylo zjistit, jestli hladiny kalprotektinu korelují s tradičními parametry aktivity pacientů s RA a navíc, jestli korelují také s ultrazvukovými parametry aktivity nemoci. Dále jsme se pokusili definovat prediktivní hodnotu jednotlivých sledovaných parametrů ve vztahu k ultrazvukem definované aktivitě revmatoidní artritidy.
Metody: Celkově bylo vyšetřeno 37 pacientů s RA (24 žen, 13 mužů, medián trvání nemoci 18 měsíců). Hodnocený byl počet oteklých kloubů, index DAS28 a ultrazvukový sedmikloubní index na klinicky více postižené ruce a noze (zápěstí, druhý a třetí metakarpofalangeální a proximální interfalangeální, a druhý a pátý metakarpofalangeální kloub) metodou GS a PD. V den klinického a ultrazvukového vyšetření byli pacientům odebrány vzorky krve a byla stanovena hladina C-reaktivního proteinu a kalprotektinu. Ke statistické analýze byl použit Spearmanův korelační koeficient a multivariační regresní analýza.
Výsledky: Kompozitní index DAS 28 (r = 0,605, p < 0,001; r = 0,605, p < 0,001, resp.) a hladiny C-reaktivního proteinu (r = 0,451, p = 0,006; r = 0,463, p = 0,004, resp.) signifikantně korelovali s ultrazvukovou synovitidou dle GS i PD. Dále jsme prokázali signifikantní korelaci hladin sérového kalprotektinu a PD synovitidy (r = 0,497, p < 0,005). Sérový kalprotektin také koreloval s hladinou C-reaktivního proteinu (r = 0,629, p < 0,001) a indexem DAS 28 (r = 0,385, p < 0,019). V multivariantní analýze s nezávislými proměnnými DAS28 a kalprotektinem byli kalprotektin (p < 0,001) i DAS28 (p = 0,001) oba statisticky významnými prediktory PD synovitidy (adjustovaný R2 = 0,811). Závěr: Naše výsledky potvrzují těsnou korelaci sledovaných klinických, laboratorních a ultrazvukových parametrů aktivity RA. Kalprotektin jako nový perspektivní marker má potenciál stát se důležitým, laboratorním markerem v monitoraci aktivity revmatoidní artritidy.
Tato práce vznikla za podpory grantu IGA MZ ČR č. NT/12437-5, GAUK č. 1010213 a Výzkumných záměrů MZ ČR č. MZO 00023728.
Asociační studie polymorfismu genu pro BAFF ve dvou nezávislých kohortách nemocných s idiopatickou zánětlivou myopatií
Kryštůfková O1,2/, 1,2/Svitálková T1,2/, Světlá M1/, Hulejová H1/, Pleštilová L1,2/, 3/Pecha O3/, Mann H1,2/, Notarnicola A4/, Venalis P4/, Padyukov L4/, Novota P1/, 4/Lundberg I. E4/, Vencovský J1,2
1/Revmatologický ústav a 2/Revmatologická klinika 1. LF UK Praha, 3/Ústav biofyziky a informatiky, 1. LF UK Praha, 4/Rheumatology Unit, Department of Medicine, Karolinska University Hospital in Solna, Karolinska Institutet, Stockholm, Sweden
Cytokin BAFF (B-cell activating factor of the TNF family) hraje důležitou úlohu ve tvorbě (auto)protilátek. Nemocní s idiopatickými zánětlivými myopatiemi (IIM, myozitida) mají zvýšené hladiny BAFF v séru (sBAFF) v korelaci s aktivitou onemocnění. Byla prokázána asociace mezi jednonukleotidovým polymorfismem (SNP) rs9514828 (-871 C/T) v promotorové oblasti genu pro BAFF a idiopatickou trombocytopenickou purpurou. U dalších autoimunních revmatických onemocnění byly vazby nekonzistentní. V české kohortě (CZE) jsme zjistili vazbu haplotypu čtyř polymorfismů na diagnózu myozitidy.
Cílem práce bylo ověřit náš nález na nezávislé skupině švédských pacientů s myozitidou (SWE) a posoudit případnou korelaci jednotlivých SNP a hladin proteinu BAFF v séru.
Do studie byly zahrnuty dvě kohorty nemocných (CZE: n = 311, věk (roky) 54.6, ženy 74 % a SWE: n = 307, věk 54,1, ženy 64 %) a zdravých kontrol (CZE: n = 103, věk 42, ženy 69 % a SWE: n = 325, věk 52,0, ženy 74 %). SNP (rs9514827, rs3759467, rs1041569 a rs9514828) byly analyzovány metodou přímého sekvenování. Hladiny sBAFF byly měřeny metodou ELISA. Asociace alel, genotypů a haplotypů byly statisticky hodnoceny Chí-kvadrát a Fisherovým testem s Bonferoniho korekcí. Porovnání skupin bylo provedeno neparametrickými testy.
Čtyři testované polymorfismy byly v silné genetické vazbě a tvořily nejčastější haplotypy (TTAC, CTAT, TCAC, TTTT) u pacientů i kontrol, srovnatelně s nálezy publikovanými na jiných populacích. Haplotyp TTTT měl u CZE pacientů signifikantně vyšší frekvenci (16 %) ve srovnání se zdravými kontrolami (10 %; OR = 1,73, 95% CI = 1,05–2,85, p < 0,02), ale nikoliv u SWE kohort (pacienti 13 %; kontroly 17 %, p = 0,07). CZE a SWE skupiny nemocných se nelišily frekvencí alel, genotypů ani haplotypů, avšak byl zaznamenán rozdíl mezi kontrolními skupinami. Zjistili jsme vyšší frekvenci TTTT haplotypu u SWE (17 %) nežli u CZE kontrol (10% p < 0,02). SWE kontroly měly vyšší frekvence T-allely rs1041569 (19 %) a TC-genotypu rs3759467 (33 %) ve srovnání s CZE kontrolami (12 % a 19 %; p < 0,05)
Nebyla přítomna žádná vazba alel nebo genotypů na hladiny sBAFF pro žádný ze studovaných polymorfismů.
Nalezli jsme rozdílnou asociaci mezi polymorfismy genu pro BAFF a myozitidou ve dvou Evropských populacích. Naše původní pozorování asociace TTTT haplotypu a myozitidy u české populace nebylo potvrzeno na nezávislé skupině švédských pacientů. Nicméně obě skupiny nemocných se vzájemně nelišily a rozdíl byl zaznamenán na úrovni zdravých kontrol. V porovnání s literaturou lze rozdíly ve frekvenci alel, genoypů nebo haplotypů vysvětlit genetickou diverzitou mezi populacemi.
Poděkování: IGA-MZ ČR NT/12438-4, European Science Foundation (ESF), in the framework of the Research Networking Programme European Myositis Network (EuMyoNet)
Revmatologie a personalizovaná medicína
Tomš J
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Léčba zánětlivých revmatických nemocí prošla v uplynulých dvou desetiletích značným vývojem. Detailnější pohled na patogenezi revmatoidní artritidy (RA), spondyloartritid a dalších onemocnění umožnil nástup biologické léčby. Terapeutický zásah na cytokinové úrovni (např. TNF alfa, interleukin 6, B-lymfocytární antigen CD20) je obvykle spojen s dramatickými změnami s pozitivním vlivem na klinické, laboratorní, radiografické a funkční parametry zmíněných nemocí. Přes pokroky v léčbě RA (nemalá) část pacientů nedosáhne optimálních terapeutických výsledků. Dalšími diskutovanými tématy jsou „cost-efektivita“ finančně náročné biologické léčby a riziko toxicity (infekční komplikace, malignity aj.). Je nutné si také uvědomit, že klinické studie v revmatologii se zaměřují na „skupinový efekt“. Např. respektované studie využívají léčebnou odpověď celého souboru pacientů (ACR 20, ACR 50, ACR 70), ale tato data často překryjí velkou variabilitu mezi jedinci.
V současné době se ukazuje, že rozdílné patogenetické podskupiny RA a vysoký stupeň klinické heterogenity by mohly být vhodnou oblastí pro implementaci principů „personalizované medicíny“ (PM). Přístup a nástroje PM budou užitečné pro zlepšení výběru vhodného léku, určení optimálního dávkování, maximalizaci léčebného účinku a minimalizaci rizika toxicity.
Revmatologové si možná neuvědomují, že některá pravidla PM praktikují už delší dobu. Používáme autoprotilátky a reaktanty akutní fáze ke zhodnocení závažnosti a aktivity nemoci u pacientů s RA a následně zahajujeme nebo modifikujeme léčbu na základě výsledků těchto testů. Na druhé straně si dosud revmatologové plně neuvědomili slibné možnosti, které PM může přinést. Skepticismus ohledně užitečnosti a aplikace specifických biomarkerů a genetických testů do denní praxe je poměrně hluboce zakořeněný.
Výzkum a vzdělávací aktivity revmatologických iniciativ (EULAR, OMERACT apod.) vedou revmatology k tomu, aby se více sblížily s principy PM. S rychle narůstajícím množstvím biomarkerů v revmatologii (autoprotilátky, genetické polymorfismy, parametry kostní a kloubní destrukce, lékové metabolity atd.) budou lékaři schopni přizpůsobit terapii přesně na míru individuálního pacienta a zlepšit tak komplexní klinickou péči.
Kmenové buňky v terapii osteoartrózy
Kubínová K
II. interní gastroenterologická klinika, LF UK v Hradci Králové, FN Hradec Králové
Osteoartróza patří k onemocněním, která v souvislosti se stárnoucí populací stále nabývají na významu. Přesto, že je z hlediska prevalence, sociálních a následně i ekonomických důsledků nutné věnovat osteoartróze dostatečnou pozornost, dosud neexistuje účinná a nenákladná terapie tohoto onemocnění. V patogenezi tohoto degenerativního procesu hraje vedle zánětlivé složky klíčovou roli převážně dysfunkce či úbytek chondrocytů, jejichž úlohou je zabezpečit dostatečnou produkci stavebních elementů chrupavky. Chronickým mechanickým namáháním, traumaty či asymetrickým zatěžováním kloubních povrchů dochází ke změnám exprese chondrocytárních proteinů, syntézy kolagenu, proteoglykanů a ostatních anabolických dějů, dále ke zvýšené produkci metaloproteináz a dalších enzymů, které se podílejí na odbourávání extracelulární matrix. To vede k neschopnosti obnovy chrupavky, rozvoje lokálního zánětlivého procesu a dalšímu úbytku kloubního povrchu.
Vedle klasických farmakologických způsobů podpory kloubní regenerace existují nové terapeutické možnosti, které mohou ovlivnit progresi osteoartrózy. Jedná se o metody buněčných terapií. Zejména v posledních letech, v souvislosti s úspěšnou izolací kmenových buněk a jejich in vitro diferenciací do progenitorových buněk chondrocytů, se moderní medicíně otevřela cesta k transplantacím buněk do degenerovaných kloubů. Pro takové výkony se zdají být obzvláště vhodné mezenchymové kmenové buňky, které se dají izolovat z mnoha tkání a ani po izolaci a manipulaci neztrácejí svůj charakteristický fenotyp a potenciál chondrogenní diferenciace. Jako místo odběru je z hlediska přístupnosti a šetrnosti nejvíce využívána tuková tkáň.
Do postiženého kloubu lze mezenchymové kmenové buňky dopravit různými cestami. Nejjednodušší způsob představuje intraartikulární injekční podání. Na modelu koz s mechanicky narušenými kloubními chrupavkami byly implantované buňky v roztoku hyaluronové kyseliny detekovány v nově regenerované tkáni společně s redukcí osteofytické degenerace a další progrese osteoartrózy (Murphy et al., 2007). U pacientů po těžkých kloubních traumatech došlo ke klinickému zlepšení bez vzniku neoplazií či jiných komplikací (Wakitani, 2011). Implantace na scaffoldech různé povahy vyžaduje sice invazivnější přístup, za to však nabízí lepší kontrolu nad vlastnostmi tkáňového mikroprostředí, implantací buněk transplantátu a formací extracelulární matrix. Některé syntetické i přírodní nosiče navíc svou konstrukcí podporují proliferační aktivitu transplantovaných chondrocytů (Raghunath, 2007). Pokrok v tkáňovém inženýrství tedy podle prvních klinických studií přestavuje jistě jednu z možných cest terapeutického ovlivnění osteoartrózy.
Riziko vzniku Non – Hodgkinova lymfomu u Sjögrenova syndromu – kazuistika
Bělobrádková M, Soukup T, Belada D, Bradna P, Kopáčová M
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Sjögrenův syndrom (SS) je chronické autoimunitní onemocnění charakterizované lymfocytárním infiltrátem exokrinních žláz, zejména slzných a slinných, který vyvolává poškození žlázového parenchymu a poruchu sekreční funkce. Nejvíce obávanou komplikací u Sjögrenova syndrom (SS) je non-Hodgkinův lymfom (NHL), který se vyskytuje u 5–10 % pacientů s SS.
Popis pozorování: Předkládáme kazuistiku muže, který trpěl primárním Sjögrenovým syndromem od 46 let, projevujícím se keratoconjunctivitis sicca, přítomností protilátek anti SS-A, anti SS-B, pozitivní biopsií slinných žláz, splňoval diagnostická kritéria pro Sjögrenův syndrom. Po 5 letech bezproblémového průběhu nemoci přichází pro rezistenci v tříslech. Byla diagnostikována periferní a centrální lymfadenopatie. Histologické vyšetření exstirpované tříselné uzliny prokázalo folikulární B – NHL. Pacient podstoupil šestkrát kúru CHOP a 4 cykly rituximabem, což vedlo k dosažení kompletní remise. V následujícím roce došlo ke zhoršování očního nálezu, což postupně vyústilo v perforaci rohovkového vředu a endoftalmitidu s nutností eviscerace bulbu levého oka. V rámci extraglandulárních projevů základního onemocnění se u pacienta rozvinula polyneuropatie dolních končetin, chronická renální insuficience, oligoartritida, pankreatitida. Nemocný byl opakovaně léčen pro pneumonie, sepsi. Sedm let od diagnózy lymfomu byl hospitalizován pro městnavé srdeční selhání s obrazem dilatační kardiomyopatie, což bylo hodnoceno jako pozdní antracyklinová kardiotoxicita v rámci terapie CHOP. Postupné zhoršování celkového stavu v průběhu následujícího roku vedlo k fatální pneumonii, septickému šoku s multiorgánovým selháním a smrtí.
Medián času od stanovení diagnózy SS ke vzniku lymfomu je zhruba 10 let. Nejčastěji se jedná o lymfom z B buněk či MALTom. Náš pacient zemřel 8 let od zjištění lymfomu, který byl diagnostikován 5 let po rozpoznání Sjögrenova syndromu. Lymfom byl v remisi a nestal se tedy primární příčinou jeho smrti, ta byla pravděpodobně způsobena pozdním následkem jeho léčby. Pacienti se SS mají 15–20x vyšší riziko vzniku NHL než zdravá populace. Některé práce uvádějí, že mají zároveň vyšší riziko další malignity, jako je myelom, karcinom prsu, ledviny, kůže atd. Včasné vyhledání pacientů s vyšší pravděpodobností vzniku lymfomu je proto velmi důležité. K tomu napomáhají prediktivní faktory (klinické, laboratorní i histologické). Nejvýznamnější klinické příznaky jsou lymfadenopatie, splenomegalie, purpura. Mezi nejsilnější laboratorní prediktory patří CD 4+ T-lymfocytopenie, nízký CD4+/CD8+ T cell ratio, hypokomplementémie, neutropenie, kryoglobulinémie. Detekce germinal center-like struktur v biopsii slinné žlázy, podle recentních studií, rovněž predikuje vyšší riziko vzniku NHL.
Porozumění a nalezení dalších markerů v rámci moderních molekulárně-biologických metod povede k zlepšení péče a prognózy pro tyto pacienty.
Podpořeno výzkumným projektem PRVOUK P37/08
Kompozitní indexy aktivity (DAS-28, CDAI, SDAI) u pacientů s revmatoidní artrititidou a konkomitující fibromyalgií
Tomš J, Daňková M, Bláhová A, Bradna P, Hrnčíř Zb
II. interní gastroenterologická klinika LF UK v Hradci Králové a FN, Hradec Králové
Kompozitní indexy DAS-28 (Disease Activity Score), SDAI (Simplified Disease Activity Index) a CDAI (Clinical Disease Activity Index) jsou nástroje frekventně používané k hodnocení aktivity onemocnění pacientů s revmatoidní artritidou (RA). Nemusí být ovšem dostatečné při hodnocení aktivity u případů RA asociované s chronickými bolestivými stavy jako např. fibromyalgie (FM).
Cíl: Zhodnotit vliv konkomitující FM na kompozitní indexy aktivity u pacientů s RA.
Metodika: 120 pacientů (29 mužů, 91 žen) s revmatoidní artritidou bylo vyšetřeno na přítomnost FM podle ACR kritérií (1990). Všichni pacienti byli vyšetřeni jedním revmatologem, který posoudil počet bolestivých kloubů (TJC), počet oteklých kloubů (SJC) a počet citlivých bodů (TPC). Laboratorní parametry zahrnovaly sedimentaci erytrocytů (FW), C-reaktivní protein (CRP), revmatoidní faktor (RF) a protilátky proti citrulinovaným peptidům (ACPA). Aktivita RA byla hodnocena pomocí 3 kompozitních indexů (DAS-28, CDAI, SDAI) a funkční disabilita pomocí dotazníku HAQ (Health Assessment Questionnaire).
Diagnóza FM byla stanovena u 25 (20,8 %) pacientů s RA (4 muži, 21 žen). Soubory pacientů s RA a RAF (RA s konkomitující FM) se významně nelišily v sociodemografických parametrech (věk, vzdělání, rodinný stav, trvání RA), zánětlivých laboratorních markerech, seropozitivitě RF a ACPA. Pacienti s RAF při srovnání s RA dosáhli statisticky významně vyššího skóre všech tří kompozitních indexů (DAS-28 5,35 ± 1,1 vs. 3,67 ± 1,4, p < 0,0001; SDAI 31,8 ± 10,9 vs. 13,5 ± 10,8, p < 0,0001; CDAI 29,6 ± 10,7 vs. 11,8 ± 9,4, p < 0,0001) a úrovně disablity (HAQ 1,83 ± 0,64 vs. 0,87 ± 0,76, p < 0,0001). Detailnější analýza ukázala, že TJC a VAS-GH (celkové hodnocení nemoci pacientem na 100 mm vizuální analogové škále) nejvíce přispěly k rozdílům aktivity nemoci u RA a RAF. Celkové hodnocení nemoci lékařem (s využitím VAS) bylo signifikantně zvýšené u pacientů s RAF oproti RA.
Revmatologové, využívající kompozitní indexy aktivity v běžné klinické praxi i v klinických studiích, by si měli být vědomi limitů v případech, kdy tyto indexy nereflektují skutečnou zánětlivou aktivitu, ale jejich výsledek je ovlivněn především parametry závislými na pacientově individuální percepci bolesti.
Familiárna stredomorská horúčka v ambulancii reumatológa – kazuistika
Čierny D, Hrubišková K, Killinger Z, Payer J
V. interná klinika LFUK a UN, Bratislava
Familiárna stredomorská horúčka (FMF) je geneticky podmienené autozomálne-recesívne ochorenie. Výskyt závisí od etnického pôvodu, predilekčne sú postihnuté etnické skupiny žijúce okolo Stredozemného mora (Turci, Arabi, sefardickí Židia, ev. Arméni). Prevalencia sa pohybuje od 1 : 250–1000 obyvateľov. Mierne prevažujú muži v pomere cca 1 : 1,5–2. K najzávažnejším formám patrí postihnutie obličiek sekundárnou amyloidózou. Liekom voľby je kolchicín. Perspektívne sa zvažuje i biologická liečba, najmä anti-Il 1.
Prezentujeme prípad 42-ročnej pacientky s dlhodobou anamnézou epizodických atakov teplôt, artralgií, bolestí brucha spojených s vysokou laboratórnou zápalovou odpoveďou (CRP, leu, FW), pričom po odoznení atakov sa laboratórne hodnoty spontánne normalizovali. Dôkladné dif dg vyšetrenia neobjasnili príčinu ťažkostí. Genetickým vyšetrením sme zistili mutácie p.Met694Val a p.Arg202Gln v compound heterozygocii. Po nasadení liečby kolchicinom došlo prakticky k vymiznutiu atakov.V našej kazuistike ide o diferenciálne diagnostický problém v prípade výskytu raritnejšieho ochorenia. K uľahčeniu stanovenia diagnózy prispel i dôkladný anamnestický rozbor (podobné prejavy zistené aj u sesternice a detí pacientky, u dcéry potvrdený identický genetický defekt). Liečba kolchicinom u pacientky komplikovaná zhoršením koincidujúcej ulceróznej kolitídy, preto do budúcna zvažovaná biologická liečba anakinrou.
FMF je ochorenie, ktoré sa v našom zemepisnom priestore zatiaľ vyskytuje zriedkavo. Pri typických epizodických prejavoch a vylúčení inej príčiny je však vhodné myslieť na toto ochorenie a zrealizovať genetické vyšetrenie. K diagnóze môže prispieť aj dôkladná anamnéza. Pri potvrdenej diagnóze je nutné monitorovať najmä eventuálne obličkové postihnutie, ktoré predstavuje najzávažnejšiu komplikáciu pre pacienta.
CMV infekcia u pacientky liečenej anti-TNF
Miklošková E, Kmečová Z, Škamlová M, Dlhopolček P, Mazal J
2. interná klinika SZU, FNSP FDR, Banská Bystrica
69-ročná pacientka s reumatoidnou artritídou IV št. od roku 1974, rezistentná na konvenčnú liečbu, bola od roku 2009 liečená anti TNF. Vo februári 2014 hospitalizovaná pre poruchu vedomia s dezorientáciou, ťažkú obojstrannú pneumonitídu, prechodne na umelej pľúcnej ventilácii pre akútne respiračné zlyhanie, kardiálne zlyhanie a hepatitídu. Bronchoalveolárnou lavážou-BAL zaznamenaná pozitivita CMV DNA PCR. Preliečená gancyklovírom v dĺžke 21 dní, po ktorom došlo postupne k stabilizácii klinického stavu a normalizácii laboratórnych výsledkov.Cytomegalovírus – CMV – je vírus DNA patriaci do čeľade Herpesviridae, ktorý je schopný dlhý čas po primoinfekcii pretrvávať v organizme v latentnej forme. Reaktivácia CMV infekcie vzniká pri poklese imunity spôsobenej rôznymi príčinami, napr. imunosupresiou. Môže vyvolať celý rad klinických príznakov a syndrómov. CMV vyvoláva nekrózu buniek parenchymatóznych orgánov s bunkovou intersticiálnou reakciou a nasledujúcou prestavbou tkaniva týchto orgánov. Najviac postihnuté bývajú: obličky, pečeň, pľúca, CNS, slinné žľazy, srdce a oko. CMV infekcia u pacientov liečených biologikami môže byť nepríjemnou komplikáciou a môže končiť fatálne. Hlavnú úlohu tu má imunodeficitnosť, vyvolaná intenzívnou imunosupresívnou liečbou. Imunosupresiou klesá počet CD8 a cytotoxických T lymfocytov, ktoré sú zodpovedné za ochranu proti CMV infekcii. Laboratórna diagnostika sa opiera o zachytenie CMV, ktorý sa nachádza vo všetkých exkrétoch. Dôležité je vyšetrenie CMV DNA pomocou PCR, ktoré stanoví virémiu. Gancyklovír má anticytomegalovírusový účinok a podáva sa 21 dní.
Revmatická polymyalgie paraneoplastické příčiny – kazuistika
1/Franeková L, 2/Makešová M
1/Interní klinika ÚVN – Vojenská fakultní nemocnice, Praha, 2/Interní klinika – odd. všeobecných interních lůžek, ÚVN – Vojenská fakultní nemocnice, Praha
Revmatická polymyalgie (PMR) je klinický syndrom projevující se myalgiemi šíje, ramenních a pánevních pletenců a ranní ztuhlostí delší než 45 minut. Postihuje především osoby nad 50 let věku. Diagnóza PMR je postavena na kombinaci klinických příznaků a elevace zánětlivých parametrů, pokud jsou vyloučeny polékové (statiny) a infekční příčiny, dále thyreopatická, onkologická či jiná zánětlivá revmatická onemocnění. V rámci onkologického screeningu se doporučují provádět tato vyšetření: laboratorní (KO+dif., hladiny minerálů, JT, elfo bílk., ev.imunofixace, moč chem.+sed., u mužů PSA), rtg plic, sono břicha, stolice na OK, u žen gynekologická prohlídka a mammografie. Malignitami, které nejčastěji imitují PMR, je mnohočetný myelom a adenokarcinomy (plic, prostaty, ledviny, kolorekta). Dále může jít o ca prsu. Tumorové markery jsou považovány za málo senzitivní a nedoporučují se (vyjma PSA) pro vyhledávání tumorů v běžné praxi. Prezentace obsahuje přehled tumor markerů, jejich senzitivitu pro diagnózu tumorů, které se nejčastěji projevují myalgiemi, a také jejich finanční náročnost.
Kazuistika: 68letý pacient s dvouměsíční anamnézou myalgií šíje, pletenců ramenních a pánevních, dále svalstva paží, předloktí a zadní strany stehen a lýtek, ovšem bez pocitu ranní ztuhlosti, s výraznou elevací zánětlivých parametrů (FW 120/hod, CRP 47), normocytární anémií a mírnou elevací obstrukčních enzymů, byl odeslán praktickým lékařem k revmatologickému vyšetření 29. 1. 2014. Výsledky onkologického screeningu byly negativní (PSA, RTG plic, sono břicha, imunofixace, rtg lebky a dlouhých kostí). NSA a poté třítýdenní terapie metylprednisolonem v dávce 12 mg a ani navýšení na 16 mg nepřineslo žádnou úlevu obtíží. Pacient byl přijat k revizi diagnózy na interní lůžko. Přestože byla zjištěna extrémní elevace CEA a CA 19–9, následné endoskopické vyšetření horní části zažívacího traktu a koloskopické vyšetření neprokázaly tumor. CT břicha přineslo 19. 3. překvapivý nález rozsáhlého, drobně ložiskového metastatického procesu plic, jater, peritonea, retroperitonea a skeletu. Primární tumor z tohoto vyšetření nebyl patrný. Pacient zemřel 22. 3., pitva rovněž neodhalila primární tumor.
V případě paraneoplastické příčiny revmatické polymyalgie chybí ranní ztuhlost svalů, čtyřtýdenní terapie prednisolonu v dávce 20 mg nevede k úlevě nebo je odpověď chudá (úleva je menší než 50 %). Každý pacient s příznaky PMR by měl absolvovat v rámci dif. diagnostiky onkologický screening. Kazuistika dokladuje, že i pacient s negativním screeningem může mít tumor ve stadiu generalizace. Ze solidních tumorů imitujících PMR jde nejčastěji o adenokarcinomy, pro které je nejvíce senzitivním markerem CA 19–9 a CEA.
Proteomika a jej využitie v diagnostike reumatologických ochorení
Brúsiková K, Macejová Ž
I. interná klinika LF UPJŠ a UNLP, Košice
Základnou úlohou biomedicínskeho výskumu v súčasnosti je pochopenie pôvodu ochorení a ich vplyvu na dôležité orgány a orgánové sústavy. Dôležitou oblasťou výskumu je proteomika, ktorú je možné v medicíne využívať v základnom aj aplikovanom výskume na objasnenie podstaty chorobných procesov, štúdium biomarkerov a cieľov terapie. V súčasnosti je cennou metódou aj v oblasti reumatológie. Táto prehľadná práca sumarizuje doterajšie proteomické štúdie, v ktorých boli použité vzorky pacientov s reumatoidnou artritídou, osteoartrózou, ankylozujúcou spondylitídou, Sjögrenovým syndrómom a systémovým lupus erythematodes. Popisuje proteíny, ktoré sú charakteristicky prítomné vo vzorkách pacientov s týmito ochoreniami. Na identifikáciu proteínových vzoriek pochádzajúcich z krvnej plazmy a synoviálnej tekutiny pacientov bola v štúdiách použitá dvojdimenzionálna polyakrylamidová elektroforéza v kombinácii s hmotnostnou spektrometriou. U pacientov s reumatoidnou artritídou bolo v sére identifikovaných 12 proteínov a v synoviálnej tekutine 9 proteínov. Medzi najvýznamnejšie patrí α1-antitrypsín, kyslý α1-glykoproteín, α2-glykoproteín, α1-antichymotrypsín, haptoglobín, ceruloplazmín a sérový amyloid A. U pacientov s osteoartrózou bolo v sére a v tkanive kĺbu popísaných 12 proteínov, medzi ktorými boli kalgranulín, fibrinogén, kolagén a vimentín. Vo vzorkách séra pacientov s ankylozujúcou spondylitídou sa zistilo 7 charakteristických proteínov, u pacientov so systémovým lupus erythematodes 11 proteínov. Skúmaným materiálom pacientov so Sjögrenovým syndrómom boli sliny a tkanivo slinnej žľazy, kde bolo charakterizovaných spolu 14 proteínov, medzi nimi α defenzín, β aktín, kalgranulín A a B, prekurzor cystatínu. Biomarkery popísané v týchto štúdiách budú v budúcnosti aplikovateľné v diagnostike, určení prognózy a terapie reumatologických ochorení.
Morfologické zmeny n. medianus u pacientov s novodiagnostikovanou,autoimunitne podmienenou hypotyreózou
Holováčová D, Kužma M, Killinger Z, Payer J
V. interná klinika LFUK a UN, Bratislava
Syndróm karpálneho tunela je najčastejšie diagnostikovanou kompresívnou neuropatiou pri tyreoidálnej dysfunkcii. Pri ultrazvukovom vyšetrení pomocou vysokofrekvenčnej sondy možno zaznamenať charakteristické rysy kompresie n. medianus.Preukázať morfologické zmeny n. medianus u pacientov s hypotyreózou pomocou ultrazvuku. Korelovať hladiny TSH, fT4, autoprotilátok s ultrasonografickým nálezom. Prierezová kontrolovaná štúdia, v ktorej sme u pacientov s novodiagnostikovanou, autoimunitne podmienenou hypotyreózou (kritéria S–TSH > 4,78 mIU/l, S-fT4 < 11,5 pmol/l, S-aTG > 115 kIU/l, S-aTPO > 34 kIU/l) vyšetrili plochu priečneho rezu n. medianus v mieste jeho vstupu do karpálneho tunela (Cross Sectional Area, CSA), čo sme porovnali so súborom zdravých jedincov. Do štúdie sme nezaradili pacientov s pridruženými ochoreniami, ktoré by mohli byť príčinou kompresívnej neuropatie – diabetes mellitus, akromegalia, paraneoplastické, zápalové, toxické, systémové ochorenia, ako aj mechanické preťaženie. U pacientov boli hodnotené senzitívne a motorické príznaky, provokačné manévre a biochemické údaje v rámci diferenciálnej diagnostiky inej príčiny neuropatie. Kategoriálne dáta boli vyjadrené ako priemer ± strednej chyby priemeru (SEM). Rozdiel medzi skupinami bol štatisticky vyhodnotený pomocou nepárového T-testu. Korelácia medzi TSH, fT4, protilátkami proti tkanivu ŠŽ a CSA n. medianus bola hodnotená pomocou Pearsonovho korelačného testu. Do štúdie bolo zaradených 44 pacientov (priemerného veku 52,8r., BMI 24,5kg/m2, S-TSH 22,815 ± 4,617 mIU/l, S-fT4 11,756 ± 0,519 pmol/l z toho 30 žien,14 mužov). Pacienti boli porovnávaní so súborom 44 zdravých (pr. veku 52,57 r., BMI 24,52 kg/m2, S-TSH 2,313 ± 0,153 mIU/l, S-fT4 16,397 ± 0,359 pmol/l z toho 30 žien, 14 mužov) na základe veku, pohlavia a BMI. Medzi skupinami nebol štatisticky signifikantný rozdiel. Plocha priečneho rezu n. medianus u pacientov s hypotyreózou bola 0,0984 ± 0,0056 cm2, a v kontrolnej skupine 0,0720 ± 0,0016 cm2. Rozdiel bol štatisticky signifikantný (p < 0,0001). Korelačnou analýzou sme nepotvrdili vzťah medzi aktivitou TSH, fT4, autoprotilátok a hodnotou CSA n. medianus. Distálne lokalizované senzorické ťažkosti sa vyskytli iba u 8 % pacientov.Záver: U novodiagnostikovaných pacientov s autoimunitnou hypotyreózou sme pomocou ultrasonografie preukázali vyšší výskyt morfologických zmien n. medianus charakteristických pre syndróm karpálneho tunela v porovnaní so zdravými. Tieto zmeny boli prítomné aj u asymptomatických pacientov s hypotyreózou (34 %). Meranie priečneho prierezu n. medianus pomocou vysokofrekvenčného ultrasonografu by mohlo byť považované za alternatívnu modalitu pre včasný záchyt tejto neuropatie u pacientov s hypotyreózou.
Vliv anti-TNF terapie na únavu u pacientů s ankylozující spondylitidou – výsledky z českého národního registru ATTRA
Forejtová Š, Jarošová K1, Uher M1, Hejduk K, Pavelka K
Revmatologický ústav, Praha, 1/Institut biostatistiky a analýz, Masarykova univerzita, Brno
Cílem studie bylo zjistit vliv anti-TNF terapie na únavu u pacientů s ankylozující spondylitidou (AS) a porovnat výsledky s vlivem léčby na aktivitu onemocnění.
Pro posouzení únavy jsme použili skóre vitality (podškála ze SF 36) a BASDAI pro hodnocení aktivity onemocnění. Hodnoty vitality skóre, BASDAI a jejich zlepšení jsou popsány pomocí mediánu a rozmezí mezi kvartily (IQR). Statistická významnost rozdílů mezi hodnotami při zahájení léčby a hodnotami po 3 a 12 měsících léčby byla hodnocena pomocí Wilcoxonova testu. Kruskal-Wallisův H test byl použit k posouzení rozdílů mezi pohlavími a věkovými kategoriemi (při hladině významnosti α = 0,05).
Celkem bylo do analýzy zahrnuto 588 pacientů s AS [v průměrném věku 37,6 let (standardní odchylka 10,5) a průměrným trváním nemoci 8 let (standardní odchylka 7,4) na začátku anti-TNF léčby]. Vitalita u mužů byla na začátku léčby lepší než u žen (p = 0,003), ale nebyl žádný rozdíl ve zlepšení vitality mezi oběma pohlavími. Po 3 měsících léčby měli v porovnání s pacienty ve věku > 50 lety větší zlepšení v hodnocení BASDAI pacienti ve věku < 30 let (p = 0,002) a dále ve skupině ve věku 30–39 let (p = 0,020), ale nebyl žádný statistický rozdíly mezi různými věkovými skupinami ve zlepšení vitality skóre mezi 3. a 12. měsícem léčby.
Dle subanalýzy věkových skupin došlo k významnému zlepšení únavy i aktivity onemocnění aktivity po 3 měsících a také k významnému zlepšení aktivity onemocnění mezi 3. a 12. měsícem ve všech věkových skupinách. Překvapivě nedošlo k žádnému významnému zlepšení únavy mezi 3. a 12. měsícem, a to ve všech věkových skupinách kromě skupiny pacientů ve věku od 30 do 39 let.
Podpořeno výzkumným projektem 00023728 Ministerstva zdravotnictví České republiky.
Tab. 1. Vitalita (podškála z SF-36) a zlepšení BASDAI po jednom roce anti-TNF léčby: subanalýza se stratifikací dle věku a pohlaví na začátku onemocnění. 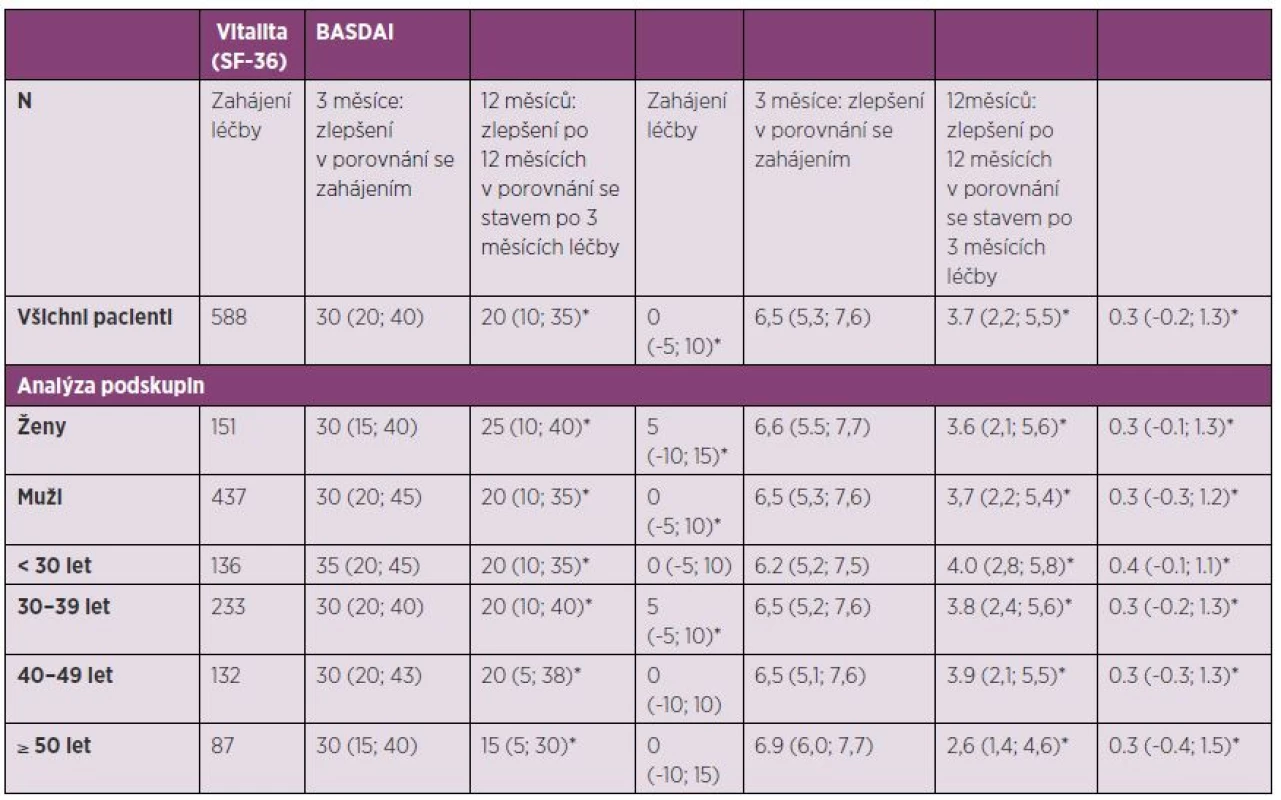
Hodnoty mediánu a IQR * indikují signifikantní zlepšení (Wilcoxonův Rank Test; α = 0,05). Charakteristika a výsledky sledování nemocných s ANCA asociovanou vaskulitidou (AAV) v České republice, data z celorepublikového registru
Jančová E, Hrušková Z, Lánská V, Šedová L, Kodeda M, Šrámková S, Němec P, Jelinek D, Menšíková R, Svojanovský J, Klaboch J, Hanzal V, Žamboch K, Palásek I, Bohm M, Milota T, Krátká K, Petránová K, Tesař V
Klinika nefrologie 1. LF UK a VFN, Praha
Studie popisuje charakteristiky a výsledky nemocných s AAV, jejichž klinická a laboratorní data jsou shromažďována v rámci celorepublikového registru.Do činnosti registru (od roku 2009) je zapojeno v České republice 16 center (9x nefrologických, 4x revmatologická, 2x imunologická, 1x pediatrická). Sběr dat je uskutečňován přes webovou aplikaci. Kromě vstupních retrospektivních dat jsou vkládána prospektivní data a laboratorní údaje v intervalu 3–6 měsíců. Statistická analýza zahrnovala metodu Kaplan-Meiera a log-rank test pro analýzu přežití.Celkově je sledováno 682 pacientů (M/Ž 327/355), medián věku při stanovení diagnózy 58 let (11–89), 169 nemocných je nově diagnostikováno. V době diagnózy bylo 339 (50 %) c/PR3 ANCA pozitivní, 236 p/MPO ANCA (35 %), 24 (4 %) ANCA negativní a u 72 (11 %) není tento údaj k dispozici. GPA je nejčastější diagnózou (58 %), následuje MPA (35 %) – včetně renálně limitované formy a EGPA ve 4 %. Kumulativně je nejčastěji zastoupeno renální postižení u 83 % (renální biopsie u 72 %), dále plicní 55 %, kloubní 35 % a ORL 34 %. Většina nemocných (88 %) byla léčena cyklofosfamidem, azathioprin byl použit v 60 %, mykofenolat mofetil nebo kyselina v 24 %, methotrexát v 2 % a 35 % pacientů podstoupilo PF. Pro relabující nebo trvalou aktivitu bylo 35 pacientů (4 %) léčeno biologickou terapií, většina z nich (27) rituximabem.
V současné době je sledováno 508 žijících pacientů, 73 % z nich je v kompletní remisi, 12 % v parciální remisi, 6 % má perzistující aktivitu, 6 % je relabujících a 3 % jsou nově diagnostikováni. Většina nemocných (98 %) má hypertenzi, 14 (2 %) podstoupilo Tx ledviny a 14 % je trvale dialyzováno. Poslední dostupné VDI (Vasculitis Damage Index) se pohybovalo mezi 0 a 16 (medián 4). U nemocných zemřelých do 1 roku od doby diagnózy jsou nejčastější příčinou úmrtí infekce (48 %). Jejich podíl na příčině úmrtí v delším sledování klesá, přesto zůstává vysoký 35 %. Nejčastější příčinou pozdního úmrtí bývají kardiovaskulární onemocnění (39 %).Pětileté přežití je vyšší u pacientů ve věku ≤ 65 let než u starších (85,3 % vs 67,2 %; p < 0,001), u c/PR3-ANCA pozitivních pacientů v porovnání s p/MPO – ANCA (85,7 % vs. 72,5 %, p = 0,002) a u pacientů s méně závažnou renální vaskulitidou při diagnóze ve srovnání s těmi, jejichž sérová hladina kreatininu byla ≥ 500 umol/l (86,5 % vs. 66,8 %, p < 0,001). Zaznamenali jsme trend lepšího přežívání nemocných, kteří byli diagnostikováni po roce 2000 (p = 0,01).
V české populaci je GPA nejčastější AAV. Infekce je nejčastější příčinou úmrtí v prvním roce po stanovení diagnózy, zatímco kardiovaskulární příčiny smrti převažují v následujících letech. Starší věk a závažné postižení ledvin jsou spojeny s vyšší mortalitou.
S podporou: České nadace pro onemocnění ledvin a Českého registru AAV
Proč monoterapie revmatoidní artritidy biologickým DMARD?
Pavelka K
Revmatologický ústav, Praha
Biologické léky (b DMARDs) je doporučeno používat při léčbě revmatoidní artritidy (RA) v kombinaci s methotrexátem (MTX) nebo jiným konvenčním DMARD. Nicméně jak ukazují registry, v běžné klinické praxi je 25–35 % pacientů na monoterapii biologickým lékem. Hlavními důvody pro použití monoterapie biologickými DMARDs v praxi je nesnášenlivost DMARDs, kontraindikace DMARDs nebo komorbidity. Otázkou zůstává jaký biologický DMARDs v případě nutnosti monoterapie zvolit. V jediné přímé srovnávací head to head studii srovnávající monoterapii dvou b DMARDs nazvané ADACTA byl tocilizumab účinnější než adalimumab (rozdíl v DAS po 24 týdnech -3,3 vs. -1,8; p < 0,0001). Remise bylo docíleno po tocilizumabu v 39 % vs. 10,5 % po adalimumabu (p < 0,001). Výsledky této studie byly replikovány v běžné klinické praxi ve velké kohortové otevřené studii Kaufmanna v Německu. V této studii srovnával výsledky po 3 a 6 měsících monoterapie tocilizumabem proti TNF inhibitorům. Ve všech měřených ukazatelích (kloubní indexy, pacientovo a lékařovo globální hodnocení, přetrvávání na léčbě) byl tocilizumab úspěšnější než adalimumab. Výsledky těchto studií pak byly podkladem pro Doporučení EULAR, ve kterých je v situaci vynucené monoterapie doporučován na prvním místě tocilizumab.
V současné době byla vyhodnocena data skupiny TOCERRA, která provádí analýzu léčby tocilizumabem v celkem 10 evropských zemích. Bylo analyzováno celkem 2 614 pacientů, z toho 266 z České republiky. V České republice bylo na monoterapii tocilizumabem 23 % pacientů a 77 % bylo na kombinaci tocilizumab + methotrexát nebo další DMARDs. Tato studie ukázala, že tocilizumab zahajovaný v monoterapii je stejně účinný jako tocilizumab podávaný v kombinaci s DMARDs (HR 0,95; 0,81; 1,11).
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Certolizumab pegol v léčbě SpA
Pavelka K
Revmatologický ústav, Praha
Cílem studie RAPID-axSpA bylo prokázat účinnost certolizumab pegolu (CZP) u axiální spondyloartritidy (ax SpA). Šlo o první studii, která zahrnula široké spektrum ax SpA, tzn. jak AS, tak nr ax SpA (1).
Pacienti s aktivní ax SpA podle ASAS kritérií s více než 3 měsíce trvající diagnózou, aktivita definována jako BASDAI > 4, bolest páteře > 4, CRP vyšší než horní limit a současnou evidenci sakroileiitidy (v posledních 3 měsících na MRI, jak je definováno podle ASAS kritérií). Primárním ukazatelem ASAS 20 v týdnu 12, sekundární ukazatele ASAS 20 v týdnu 24, ASAS 40, ASAS parciální remise, ASDAS = > 2, BASFI, BASMI, MRI, sociální ukazatele.
Do studie bylo zařazeno celkem 325 pacientů s průměrnou délkou trvání nemoci kolem 7 let a průměrným věkem 40 let. Procento mužů bylo kolem 61 %. Primární cíl byl splněn, když odpověď ve skupinách s CZP byla 57,7 % a 63,6 % oproti 38,3 % po placebu (p < 0,001). Účinnost byla prokázána i ve všech ukazatelích sekundární odpovědi. Dále byla srovnána účinnost CZP u AS a nr ax SpA. Na začátku léčby měly obě skupiny stejnou aktivitu, co se týče BASDAI (6,4 vs. 6,5), skupina s AS měla vyšší CRP (14,3 mg vs. 11,9 mg). Odpověď u obou skupin pacientů byla identická. Dále byla prokázána pozitivní odpověď po léčbě CZP na úrovni magnetické rezonance, kde došlo ke snížení intenzity zánětu a to v obou skupinách pacientů. Bezpečnostní profil léčby byl dobrý a studie nepřinesla žádné nové varovné signály.
CZP je účinným a bezpečným lékem axiálních spondyloartritid, jeho účinek je rychlý a mohutný a nastupuje často již v prvním týdnu. Účinek byl stejný ve skupině již vyvinutých AS, jako ve skupině nr ax SpA. Na základě této studie byla CZP udělena licence a úhrada v indikaci nr ax SpA.
Extraartikulární manifestace u spondyloartritid – možnosti jejich ovlivnění
Pavelka K
Revmatologický ústav, Praha
Extraartikulární manifestace a komorbidity jsou velice časté u spondyloartritid, přičemž výskyt je prakticky stejný u již vyvinuté ankylozující spondylitidy a non-radiografické spondyloartritidy. Mezi nejdůležitější patří: akutní přední uveitida (výskyt 20–40 %), idiopatický střevní zánět (5–10 %), psoriáza (10–20 %), kardiální abnormality (poruchy vedení 1–33 %), aortální insuficience (1–10 %). Dle Doporučení EULAR by měli být tito pacienti léčeni ve spolupráci s příslušnými specialisty. Revmatologové by si měli být vědomi zvýšeného rizika kardiovaskulárního onemocnění a osteoporózy. Adjustované riziko pro kardiovaskulární příhodu pro mladé pacienty s ankylozující spondylitidou (AS) je 1,47 (95% CI 1,13–1,92, p = 0,0043). Celková mortalita u AS vs. běžná populace 1,6–1,9 zvýšená.
Při léčbě pacientů se spondyloartritidou (SpA) by se měla zohlednit léčba extraartikulárních manifestací. Nejúčinnější léčbou, která ovlivňuje jak axiální, tak i periferní projevy SpA, je anti TNF léčba, která je účinná i při léčbě a prevenci extraartikulárních komplikací. V této indikaci existuje rozdíl mezi mononukleárními protilátkami a etanerceptem. Pouze anti TNF protilátky (infliximab, adalimumab) jsou účinné u idiopatických střevních zánětů, zatímco etanercept v této indikaci nemá prokázanou účinnost. Při léčbě monoklonálními protilátkami je průkazně nižší výskyt akutní přední uveitidy než při léčbě etanerceptem (1). Novější studie ukázala účinnost golimumabu u pacientů se závažnou uveitidou nereagující na ostatní anti TNF léky.
Extraartikulární manifestace jsou u ax SpA velmi časté a je nutné po nich aktivně pátrat a v rámci týmové interdisciplinární spolupráce je léčit. Optimálním terapeutickým postupem je nasazení monoklonálních protilátek proti anti TNF, které ovlivňují komplexně celé spektrum onemocnění.
Epidemiologie digitálních ulcerací u systémové sklerodermie v České republice. Vlastní zkušenosti s léčbou bosentanem
Bečvář R a DUO centra v České republice
Revmatologický ústav, Praha
Digitální ulcerace (DU) jsou recidivující a invalidizující manifestace systémové sklerodermie (SSc), které se vyskytují až u 50 % pacientů. Při DU u SSc může dojít k závažným komplikacím, jako je infekce, nekróza nebo gangréna vyžadující amputaci. Registr DUO je evropská, multicentrická, prospektivní, observační kohortová studie pacientů s DU při SSc (SSc/DU).
Cílem této studie bylo popsat základní charakteristiku pacientů SSc/DU a jejich léčbu v České republice (ČR) v době zařazení do registru DUO.
Ve vybraných centrech byli zařazeni všichni nemocní se současnými DU nebo s anamnézou DU. Všichni pacienti podepsali informovaný souhlas podle platné české legislativy. Pacienti byli klinicky vyšetřeni a dostali standardní léčbu podle rozhodnutí ošetřujícího lékaře. Data jsou zaznamenávána v internetové databázi s on line přístupem. Dále jsou prezentována demografická data a terapeutické přístupy u nemocných v ČR. Statistická analýza je deskriptivní.
Čeští pacienti (n = 81) zařazení do registru DUO od dubna 2008 do března 2013 byli převážně ženy (n = 71, 87,7 %). Klasifikace nemoci byla tato: limitovaná forma 56,8 %, difúzní forma 28,4 % a overlap SSc/smíšené onemocnění pojiva 13,6%. Podíl pacientů s alespoň jedním aktivním DU při zařazení byl 67,9 %.
Léčebné intervence na DU prováděné v minulosti zahrnovaly horní hrudní sympatektomii (21 %), debridement (23,5 %) a chirurgickou amputaci (13,6 %). Nejčastější komplikace prodělané v minulosti byly gangréna (29,6 %) infekce měkkých tkání vyžadující celkovou léčbu antibiotiky (19,8 %), a vzácně osteomyelitida (6,2 %). V době zařazení do registru byla podávána analgetika a protizánětlivé léky až u 84 % nemocných, kdežto prostanoidy jen u 16 % a antagonisté receptorů pro endotelin pouze u 6,2 %. Topická léčba při zařazení byla užita u 24,7 % nemocných, z toho nejčastěji lokálně antibiotika (17,3 %), následováno neadhezivním krytím (8,6 %). Suché krytí bylo použito pouze u 3,7% případů a hydrokoloidy u 2,5 %. Dále jsou popsány případy nemocných s DU/SSc léčení úspěšně antagonistou receptorů pro endotelin bosentanem. U všech nemocných již nevznikaly nové DU a u 2 nemocných došlo k urychlení hojení stávajících DU.
Stroncium ranelát – současné možnosti léčby
Horák P
III. interní klinika NRE, LF UP a FN, Olomouc
Protelos je indikován k léčbě závažné osteoporózy u žen po menopauze a dospělých mužů, s vysokým rizikem fraktur, u nichž léčba jinými léčivými přípravky schválenými pro léčbu osteoporózy není možná, z důvodu například kontraindikace nebo intolerance. U žen po menopauze Protelos snižuje riziko vertebrálních a kyčelních fraktur. Stávající kontraindikace jsou dostatečné k minimalizaci kardiovaskulárního rizika a dostupné údaje nevykazují žádné důkazy zvýšeného rizika u pacientů, kteří neměli v anamnéze srdeční nebo oběhové problémy. Příznivý účinek přípravku Protelos v prevenci zlomenin, včetně pacientů s vysokým rizikem fraktur, byl potvrzen. Za těchto podmínek je poměr přínosů a rizik přípravku Protelos pozitivní a Protelos představuje nezbytnou alternativu v léčbě osteoporózy.
Nový způsob, jak zlepšit mikrocirkulaci – možnosti BEMER terapie u starších pacientů
Klopp R C, Horváth I
Bemer East Europe, Budapest
Po zavedení magnetické rezonance, jako klinického diagnostického přístroje začali zkoumat účinky silného magnetického pole (reverzibilní EEG a EKG změny). Slabé magnetické pole má slabou hustotu, takže na rozdíl od silného magnetického pole je prakticky zanedbatelný tepelný účinek. Dnes víme, že magnetické pole, podrážděné a kontraktilní struktury – ovlivňuje především hladké svalové buňky cévní stěny. Japonská výzkumná skupina (Chiyoji et al) v roce 1997 na zvířecím modelu popsala účinek magnetického pole, změny v arteriol žilky cévní stěny jako spontánní kontrakce pohybu. Berlínský institut mikrocirkulace dostal podobné výsledky ve studiích u člověka téměř ve stejnou dobu (použití přístroje BEMER 3000), a další experimenty naznačují, že aplikace magnetického pole poskytuje příležitost pro stimulaci toku krve do různých orgánů.
Z experimentálních výsledků lze vyvodit následující závěry:
- Porovnání opakované léčby BEMER s mnohou dlouho používanou a uznávanou mikrocirkulací v lékařské terapii, při opakované léčbě BEMER se také ukázalo, že mikrocirkulace a rozsah vlivu provozních podmínek je terapeuticky relevantní.
- Vliv dočasného charakteru léčby BEMER pro nalezení správného léku a léčbu.
- Vhodné ošetření BEMER opět prokázal účinek ve prospěch profylaktické a ochranné účinnosti, k léčbě různých chronických onemocnění, hojení ran a zlomenin, doplňková terapie BEMER se zdá být slibná, protože v klinickém průběhu těchto nemocí jsou rozhodující nedostatky tkáňového metabolismu a imunitní obrany.
Podle evropských studií, s výsledkem léčby BEMER se zlepšují revmatologické, neurologické a další zdravotní problémy atd.
Tyto poruchy lze vysledovat k narušení mikrocirkulace. Mikrocirkulace a optimální fungování imunitního systému mají obrovský význam, protože s udržováním vytvoříme příležitost ke zlepšení fungování imunitního systému.
From pharmacology to clinical practice: Evidence of the structure-modifying effects of pharmaceutical-grade chondroitin sulphate
Chevalier X
Hôpital Henri MONDOR, CRETEIL – UPEC
Chondroitin sulphate (CS) is a glycosaminoglycan as a part of the proteoglycans of the cartilage extra-cellular matrix. It plays a key role in the hydrophilic properties of proteoglycans.
There are numerous in vitro studies showing that at a concentration of around 200 µg/ml, CS can induce several beneficial effects. Actually, CS can counteract the negative effects of IL-1ß on chondrocytes, exert an anti-apoptotic effect, decrease inflammation and the activity of osteoblasts in OA lesions. The exact mechanism of action still needs to be better understood.
Clinical efficacy of CS has been challenged and data have been reported as conflicting. The effect size on pain in meta-analyses ranges from 0.13 (0,00 – 0,27) to 0,75 (0,50 – 0,99). It usually works after 3 to 4 weeks from the first administration and shows a carry-over effect of several weeks (4 weeks) after stopping. A recent well performed trial in hand OA showed that 800 mg of purified CS is superior to placebo.
Some recent guidelines do not recommend CS as well as other slow acting drugs as a part of the medical management of knee OA. However, a recent task force does recommend these drugs in patients not responding to paracetamol. Even if the chondroprotective effect of CS is not approved, recent papers suggest a real chondroprotective role of CS.
In a large and randomized, double-blind, placebo-controlled study in more than 600 patients, the results showed that pharmaceutical-grade CS 800 mg/day halted structural changes in knee OA as assessed by radiographic follow-up over 2 years.
This structure-modifying property is not yet included in the labelling of the drug.
So how to conclude and what should we recommend in our daily practice?
CS is a well-tolerated drug with a mild clinical effect. Its place should be weighted when compared with other drugs in OA. CS appears to be more efficient than paracetamol and less risky than NSAIDs. Thus, it is still logical to propose it as a long term analgesic drug in symptomatic OA and to stop the treatment if after 3–6 months no improvement is noted. In severe flare of the disease, CS is not appropriated due to its latency of efficacy.
Systémový lupus erythematodes z pohledu různých specializací – liší se pohled nefrologa a revmatologa na management diagnostiky a léčby SLE?
Horák P
III. interní klinika NRE, LF UP a FN, Olomouc
Systémový lupus erythematodes (SLE) je autoimunitní zánětlivé onemocnění postihující zejména ženy v reprodukčním věku. Je charakterizované hyperaktivitou B buněk a nadprodukcí orgánově nespecifických autoprotilátek, z nichž mnohé se podílejí na tvorbě imunokomplexů. Jejich tkáňové či cévní depozita pak vedou k zánětlivému orgánovému postižení. Klinický obraz SLE je velmi pestrý. Jedná se o vysoce heterogenní chorobu, kterou lze dělit do řady klinicky a laboratorně definovaných podtypů a které se může s řadou dalších jednotek překrývat (smíšená choroba pojiva, Sjögrenův syndrom, antifosfolipidový syndrom). Průběh choroby je charakterizován střídáním remisí a exacerbací. Laboratorně je pro SLE typická tvorba orgánově nespecifických protilátek, které jsou namířeny proti nukleárním, cytoplazmatickým i povrchovým antigenům vlastního těla. Akutního vzplanutí je zpravidla doprovázeno systémovými příznaky, jako je horečka, únava, váhový úbytek. K nejčastějším projevům patří postižení kůže, kloubů, kardiovaskulárního systému, plic, glomerulů ledvin, centrálního nervového systému či krvetvorby. SLE může vyústit do selhání postiženého orgánu a závažná forma choroby je spojena s významnou mortalitou. Problematika SLE je mezioborová, zasahuje řadu specializací nejen v rámci vnitřního lékařství, zahrnuje rovněž problematiku pediatrickou, neuropsychiatrickou či porodnicko-gynekologickou. Přednáška se zabývá pohledem revmatologa. Vychází k doporučení Česká revmatologická společnosti pro diagnostiku léčbu nemocných se SLE. Na kazuistickém materiálu se pokusí představit základní klinické scénáře, se kterými se revmatolog v případě SLE setkává či potýká.
Systémový lupus erythematodes z pohledu různých specializací – liší se pohled nefrologa a revmatologa na management diagnostiky a léčby?
Ryšavá R
Klinika nefrologie, Karlova Univerzita v Praze, 1. LF a VFN, Praha
Systémový lupus erythematodes (SLE) je chronické zánětlivé autoimunitní onemocnění nejasné etiologie, projevující se řadou imunologických abnormalit a potenciálem k postižení řady orgánů. Postižením ledvin se prezentuje asi čtvrtina nemocných v době stanovení diagnózy, nicméně až dvě třetiny pacientů renální poškození vyvinou během svého života.
Ke stanovení diagnózy SLE je nutné, aby nemocný splňoval jak klinická, tak i laboratorní (imunologická) kritéria. Postižení ledvin má pro nemocného zásadní význam, proto ke stanovení diagnózy SLE stačí jen dvě kritéria (dle SLICC klasifikace), zatímco pacienti bez renálního postižení musí splňovat celkem 4. Nemocný ale musí mít diagnózu lupusové nefritidy prokázanou biopticky a současně musí mít pozitivní alespoň jednu z protilátek ANAb či anti-dsDNA. Terapie nefritidy bývá zejména ve fázi indukční léčby dosti agresivní, takže je schopna zvládnout i ostatní, extrarenální, projevy onemocnění.
Pro racionální léčbu SLE, která je dlouhodobá (někdy i doživotní), je nutné pravidelné sledování a neustálé posuzování dostupných indikátorů aktivity onemocnění a pátrání po známkách orgánového postižení. K tomu nám slouží některé jak laboratorní, tak imunologické testy (krevní obraz, močový sediment, proteinurie, hladina sérového kreatininu, složky komplementu C3 a C4; s postižením ledvin bývají v úzké korelaci anti-dsDNA, anti C1q a případně anti-CRP protilátky), klinická a zobrazovací vyšetření i skórovací indexy (např. SELENA-SLEDAI nebo BILAG). Je třeba ale říci, že používání těchto indexů v nefrologii (na rozdíl od revmatologie) nenašlo větší uplatnění. Částeč-ně to může být i tím, že poškození ledvin je dle těchto indexů charakterizováno jen proteinurií ≥ 500 mg/24 hod (či uPCR ≥ 50 mg/mmol) či přítomností močových válců. Nikterak nezohledňují úroveň renální funkce či případné morfologické změny ledvin. V běžné praxi mají ale často nemocní s aktivní nefritidou proteinurii menší, než je uvedená mez, válce jim chybí (většina laboratoří je navíc ani není schopna stanovit), ale mají aktivní močový sediment s erytrocyturií či leukocyturií.
U takto komplikovaného onemocnění by diagnostiku i léčbu měl vést specialista, většinou revmatolog. Je-li ale přítomno poškození ledvin, pak lékařem určujícím léčebnou strategii by měl být nefrolog. Multidisciplinární přístup k pacientům je často nezbytný, ale za léčbu by vždy měl nést zodpovědnost jen jeden odborník a její případnou změnu komunikovat s ostatními. V současné době máme v léčbě k dispozici kromě standardních léků i nové monoklonální protilátky (belimumab, rituximab a další), které nám umožňují léčit i nemocné s opakovanými relapsy či těžkým průběhem SLE.
Diagnostika a léčba SLE pacientů je velkou výzvou a vyžaduje interdisciplinární přístup. Cílem plánovaného mini-sympozia je ukázat případné rozdíly v pohledu revmatologa a nefrologa na management diagnostiky a léčby SLE.
Biosimilární léčiva v léčbě zánětlivých revmatických onemocnění – současný stav problematiky
Pavelka K
Revmatologický ústav, Praha
Biosimilární léčiva jsou bílkovinové produkty, které jsou vyrobeny pomocí biotechnologie nebo z přírodních zdrojů a které jsou prokazatelně „dostatečně podobné“ (sufficiently similar) biologickému léku, který je již schválen regulační agenturou (EMA – comparable, FDA highly similar). Biosimilarita je definována zákonem v jednotlivých státech a lze jí rozdělit na fázi preklinickou, která má deklarovat analytickou a funkční biosimilaritu a fázi klinickou, která má prokázat identickou účinnost a bezpečnost. Biosimilární léky nejsou zcela identické originálním biologickým lékům, protože mohou nastat různé posttranslační modifikace. Klíčovým problémem může tedy být imunogenicita a bezpečnost léčby.
Ve studii PLANETRA prokázal biosimilární produkt CT-P13 v kombinaci s MTX identickou účinnost, jako originální infliximab. Po jednom roce léčby byli pacienti s CT-P13 switchováni na originální infliximab a v průběhu druhého roku léčby nebyl zaznamenán větší výskyt nežádoucích účinů u switchované skupiny než u skupiny od počátku na biosimilárním léku. Ve studii PLANETAS byl zkoušen preparát CT-P13 oproti originálnímu infliximabu v monoterapii u pacientů s ankylozující spondylitidou. Bezpečnost i účinnost obou léků byla identická. Po jednom roce léčby byli pacienti na originálním infliximabu switchováni na preparát CT-P13. Ve skupině switchované bylo mírné zvýšení nežádoucích účinků oproti skupině na dlouhodobé léčbě CT-P13, ale nebyl zaznamenán větší výskyt závažných nežádoucích účinků.
V současné době EMA uznala pro preparát CT-P13 indikaci revmatoidní artritidy, ankylozující spondylitidy, psoriatické artritidy, psoriázy a idiopatických střevních zánětů. Pacienti s revmatickými diagnózami jsou zavedeni v národním registru ATTRA. Výsledky budou sloužit především k potvrzení bezpečnosti léčby těmito léky.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Update léčby revmatoidní artritidy abataceptem
Němec P
Revmatologická ambulance, II. interní klinika, FN u sv. Anny v Brně a Lékařská fakulta Masarykovy univerzity, Brno
Sdělení se věnuje nejnovějším poznatkům souvisejícím s terapii revmatoidní artritidy abataceptem (Orencia®). Dlouhodobá terapie subkutánní formou abataceptu je spojena s nízkým výskytem závažných infekcí, malignit i autoimunních projevů. Rovněž celková snášenlivost léčby je příznivá, s malým počtem reakcí v místě vpichu. Data dlouhodobé účinnosti potvrzují stejný trend setrvalé účinnosti srovnatelný s intravenózní formou přípravku. Předpokládá se, že abatacept působí v „horních patrech“ zánětlivé kaskády, a tudíž by mohl významně modulovat průběh onemocnění u pacientů s časnou revmatoidní artritidou. Tudíž časná léčebná intervence u těchto pacientů by mohla, alespoň v některých případech, umožnit trvalé nebo alespoň dočasné přerušení léčby. Tuto hypotézu hodnotila studie AVERT. Jedná se o první studii, která u pacientů, kteří dosáhli remise nebo nízké aktivity onemocnění, testovala možnost vysazení veškeré terapie, tedy biologické léčby, methotrexátu a glukokortikoidů. Uspořádání studie, její výsledky i závěry jsou diskutovány v rámci sdělení.
Jak racionální je switch v rámci skupiny TNF-alfa blokátorů v léčbě pacientů s RA?
Suchý D, 1/Uhlíř J
FN, Plzeň; BMS, s.r.o., Praha
První biologické preparáty, které se začaly používat v terapii revmatoidní artritidy, patřily do skupiny blokátorů TNFα. Teprve později se objevily léky s odlišným mechanismem účinku; léky, které zasahují na jiných úrovních a ovlivňují pravděpodobně jiné cytokiny či signální dráhy, než látky cílící na TNFα. I přes tuto skutečnost zůstává častým zvykem střídat jednotlivé léky blokující TNFα i v případě, že terapie jedním z nich je primárně neúčinná, dojde k sekundárnímu selhání účinnosti či pacient nedosáhne očekávaný cíl léčby (podle „treat to target“ konceptu). Zdůvodněním pro záměnu jednoho TNFα blokátoru za jiný (tzv. „TNF cycling“) bývá často osobní zkušenost, že tato strategie je/může být úspěšná, představa, že jednotlivé TNFα blokátory se od sebe odlišují v různých vlastnostech (jako např. struktura, stimulace tvorba protilátek) a rovněž skutečnost, že nejsou k dispozici randomizované klinické studie vyvracející tuto strategii.
Argumenty pro/proti záměně jednoho TNFα blokátoru za jiný jsou diskutovány v prezentaci, v rámci které autoři analyzují možné diference v MoA různých TNFα blokátorů a porovnávají dostupné literární údaje svědčící pro/proti této léčebné strategii.
Kontrola hyperurikémie šetří funkci ledvin
Pavelka K
Revmatologický ústav, Praha
Výskyt dny vzrůstá a dosahuje 1 % v populaci. Hyperurikémie a dna jsou často provázeny výskytem komorbidit, mezi které patří hypertenze, diabetes mellitus, obezita a chronické onemocnění ledvin. Mezi onemocnění ledvin řadíme nefrolitiázu, akutní selhání ledvin při léčbě nádorů a rozvoj chronické renální insuficience při intersticiální dnavé nefritidě. V epidemiologické studii v průběhu 14 let došlo ke zvýšení proporce pacientů s chronickou renální insuficiencí z 6 na 14 %. Novější studie také prokázaly, že hyperurikémie je samostatný rizikový faktor kardiovaskulárních onemocnění.
Při léčbě hyperurikémie se kombinují režimová opatření s farmakoterapií, konkrétně se používá allopurinol a febuxostat. Febuxostat je non-purinový selektivní inhibitor xanthinoxidázy. V klinických studiích se ukázaly dávky s 80 a 120 mg febuxostatu účinnější než 300 mg allopurinolu. Ve studii APEX byl febuxostat podáván pacientům se středním stupněm renální insuficience s velmi dobrými výsledky. Nově byla dokončena studie EXCEL, do které bylo zařazeno 551 pacientů z originálních tří dvojslepých studií, kteří byli zařazeni do otevřené dlouhodobé extenze (trvání 48 měsíců). U pacientů, u kterých bylo docíleno trvalého snížení hladiny kyseliny močové, docházelo k menšímu poklesu renální funkce (p < 0,0001). Tato data predikují, že každý pokles urikémie o 1 mg/dcl zachová funkci ledvin 1,15 ml/min GFR.
Trvalé dlouhodobé snížení hladiny kyseliny močové při léčbě febuxostatem zachovává funkci ledvin. Studie vyhodnocující redukci kardiovaskulárního rizika při úspěšném snížení kyseliny močové v současné době probíhají.
Dlouhodobá účinnost denosumabu (osmiletá data)
Horák P
III. interní klinika, LF UP, Olomouc
Denosumab je plně humánní monoklonální protilátka IgG2, která specificky a s vysokou afinitou cílí RANKL (Receptor activator of nuclear factor NF-kappa-B ligand), esenciální mediátor formace, funkce a přežívání osteoklastů. RANKL se v rámci procesu aktivace osteoklastů váže na svůj receptor RANK, patřící do rodiny TNF receptorů a exprimovaný osteoklasty a jejich progenitory. Denosumab napodobuje fyziologickou funkci osteoprotegerinu, cytokinu neutralizujícího RANKL a bránícího osteoresorpci. Vyvázání RANKL, ať už osteoprotegerinem či denosumabem, zabraňuje formaci osteoklastů, inhibuje jejich funkci a zkracuje jejich přežívání. Studie III. fáze hodnotily efekt podávání denosumabu v dávce 60 mg v subkutánní formě každých 6 měsíců.
FREEDOM je původně tříletá studie kontrolovaná placebem zahrnující 7 868 postmenopauzálních žen s osteoporózou, která byla koncipována k průkazu efektu denosumabu na snížení rizika osteoporotických fraktur. Tříleté podávání denosumabu vedlo ve srovnání s placebem k 68% poklesu rizika zlomenin obratlů a 20% poklesu rizika ne-vertebrálních zlomenin, riziko zlomenin proximálního femuru bylo sníženo o 40 %. BMD bederní páteře se při léčbě denosumabem zvýšilo za 3 roky o 9,2 %, u proximálního femuru o 6 %. Na základní tříletou studii FREEDOM navazuje extenze, dlouhodobá data prokazují konzistentní efekt na snížení rizika fraktur i dobrý bezpečnostní profil léku. Rovněž recentně prezentovaná osmiletá data prokazují, že léčba denosumabem u postmenopauzální osteoporózy je spojena s perzistující redukcí kostního obratu, kontinuálním nárůstem BMD a nízkou incidencí fraktur. Bezpečnostní profil léku zůstává i po osmi letech příznivý.
Update léčby axiálních spondyloartritid
Pavelka K
Revmatologický ústav, Praha
Axiální spondyloartritidy se podle nové klasifikace ASAS dělí na ankylozující spondylitidu (AS) a non radiografickou axiální spondyloartritidu (nr ax SpA). Evidence o účinnosti léčby AS je dostupná pro následující modality: pravidelné cvičení a rehabilitace, edukace pacientů, analgetika, nesteroidní antirevmatika, lokální aplikace glukokortikoidů, u periferních forem sulfasalazin a u všech forem onemocnění anti TNF blokující léky. Dle kritérií České revmatologické společnosti je pro léčbu anti TNF preparáty indikován pacient, který: selhává na dosavadní léčbě (NSA, sulfasalazin u periferních forem, lokální léčba u monoartritid) a zároveň má vysokou aktivitu onemocnění, která je definována takto: BASDAI > 4, CRP > 10 mg/l, pozitivní názor experta. Nr ax SpA je dle výzkumu onemocnění se stejnou aktivitou a stejnou klinickou závažností jako již etablovaná AS. Bylo provedeno několik studií v indikaci nr ax SpA, které potvrzují dobrou účinnost anti TNF preparátů v této indikaci. Šlo o studie s infliximabem (INFAST), etanerceptem (ESTHER), certolizumabem (RAPIDax-SpA) a adalimumab (ABILITY I). Metaanalýza těchto studií prokázala dobrou účinnost v této indikaci, i když o trochu menší než u AS.
Do studie ABILITY byli zařazeni pacienti s axiální spondyloartritidou dle kritérií ASAS (vyloučeni pacienti s již definovanou sakroiliitidou a psoriázou). Do studie bylo zařazeno 192 pacientů, kteří byli randomizováni do větve s aplikací adalimumabu 40 mg každý druhý týden nebo placebem. Primární cíl byla odpověď ASAS 40 po 12 týdnech a cíle bylo dosaženo (36 vs. 15 %, p < 0,001). Pozitivních výsledků bylo dosaženo i ve všech sekundárních ukazatelích účinnosti. Protizánětlivý účinek byl prokázán i na úrovni redukce zánětu pomocí MRI. Výsledky otevřeného prodloužení studie ukazují přetrvávání účinnosti do týdne 68. Léčba byla relativně bezpečná a nepřinesla žádné nové bezpečnostní signály.
KONFERENCE ZDRAVOTNICKÝCH PRACOVNÍKŮ NELÉKAŘSKÝCH PROFESÍ CAZR – aktivity zdravotníků nelékařů
Vránová H
Revmatologický ústav, Praha
Toto sdělení je snahou seznámit širokou veřejnost se sdružením, založeným na podporu všech, kteří jsou zapojeni do rozsáhlé problematiky revmatických chorob.
Občanské sdružení založené v roce 2010 – Česká asociace zdravotníků v revmatologii (CAZR) nabízí všem zdravotníkům pracujícím nebo pomáhajícím v revmatologii možnost realizace při zapojení se do tohoto uskupení.
Jedná se dobrovolné profesní nepolitické sdružení všech nelékařských pracovníků, a to zdravotních sester, fyzioterapeutů, ergoterapeutů, radiologických asistentů, pracovníků v laboratoři, sociálních pracovníků, psychologů a všech ostatních pracovníků pomáhajících v oblasti revmatologie a dalších iniciativ, které se zabývají ošetřováním, péčí a edukací při managementu revmatických chorob.
Ve stanovených cílech je snaha zapojit tyto pracovníky a za pomoci jejich činnosti snižovat dopad revmatologických a muskuloskeletálních onemocnění na jednotlivce i společnost, a tak zlepšovat sociální postavení revmatiků.
CAZR nabízí podporování profesního rozvoje a vzdělávání zdravotníků v oboru revmatologie a jiných souvisejících oblastech – prevence, ošetřovatelský výzkum, laboratorní diagnostika, rehabilitace, ergoterapie, sociálně právní. Dále pořádání vzdělávacích akcí pro odbornou i laickou veřejnost a zlepšování kvality v oblastech edukace.
V neposlední řadě navazovat spolupráci s podobně zaměřenými organizacemi a stále podporovat kooperaci s Českou revmatologickou společností J. E. Purkyně a být nadále členem EULAR – Evropské ligy proti revmatismu.
Spoznávajme reumatické ochorenia – Pagetova choroba
Nováková M
Národný ústav reumatických chorôb, Piešťany
Pagetova choroba patrí medzi menej známe ochorenia z oboru reumatológia, preto je našou snahou pripomenúť si toto ochorenie. V odbornej prednáške si rozoberieme možnú príčinu ochorenia, rizikové faktory a incidenciu. Zameriame sa na klinický obraz pacienta, nakoľko je dôležité, aby reumatologická sestra vedela spoznať tieto príznaky. Ďalšou časťou prednášky je liečba ochorenia medikamentami, chirurgickou cestou či využívanie ortopedických pomôcok. Keďže prednáška je venovaná sestrám dôležitou časťou je ošetrovateľská starostlivosť o pacienta s Pagetovou chorobou. V závere prednášky sa venujeme aj odporúčaniam pre prax rozdeleným pre pacientov a pre sestry.
Osteoporóza – aplikace Prolia
Kráslová E, Kvítková J
Revmatologický ústav, Praha
Osteoporóza je onemocnění látkové výměny kostní tkáně, které má za následek ubývání množství kostní hmoty a celkové snížení kvality kostí. Postižené kosti se stávají málo odolné vůči mechanickým vlivům a klesá jejich pružnost a pevnost. Toto řídnutí kostí se sebou přináší nebezpečí zlomenin i při minimální vyvinuté síle. Díky pohodlnému a nezdravému životnímu stylu se počet postižených prudce zvyšuje, v České republice se odhaduje až na 850 000. Nemoc tak získala nechvalně známou přezdívku „tichá epidemie 21. století“.
Řídnutí kostní tkáně je přirozený proces spojený se stárnutím těla. Existují tak faktory, které ovlivnit lze a ty, na které nemůžeme mít žádný vliv. Ty, které můžeme ovlivnit je správně podaná informace a edukace pacienta: v jídle, v pohybu, v psychice, v celkové podpoře psychosomatiky. Správná a včasná léčba a zapojení pacienta může progresi onemocnění zpomalit.
Přípravek Prolia se používá k léčbě osteoporózy u žen po menopauze, u kterých existuje zvýšené riziko výskytu fraktur. Přípravek Prolia snižuje riziko zlomenin páteře a jiných kostí, včetně zlomenin kyčle. Přípravek Prolia se používá také k léčbě úbytku kostní tkáně u mužů podstupujících léčbu rakoviny prostaty, která zvyšuje riziko zlomenin. Léčivá látka v přípravku Prolia, denosumab, je monoklonální protilátka. Monoklonální protilátka je typ bílkoviny, která byla vyvinuta tak, aby rozpoznala konkrétní antigen a navázal se na ni. Denosumab byl vyvinut tak, aby se navázal na antigen nazývaný RANKL, který se podílí na aktivaci osteoklastů, tj. buněk lidského těla, které se účastní odbourávání kostní tkáně. Tím, že se denosumab váže na RANKL a blokuje jej, snižuje tvorbu a aktivitu osteoklastů. V důsledku toho dochází ke snížení úbytku kostní tkáně a kost je pevná, snižuje se pravděpodobnost vzniku zlomenin.
Funkční metody v diagnostice gastrointestinálních manifestací systémové sklerodermie
Staníčková D, Tachecí I, Cyrany J, Zimandlová D, Soukup T, Kopáčová M, Bureš J
II. interní gastroenterologická klinika, Lékařská fakulta UK a Fakultní nemocnice v Hradci Králové
Gastrointestinální komplikace se objevují u většiny pacientů se systémovou sklerodermií (SSc).
Porucha motility postiženého jícnu se manifestuje jako ezofageální dysfunkce – a to jak typickými potížemi (pyróza, regurgitace, dysfagie), tak i mimojícnovými projevy (kašel, chrapot). Mikroaspirace mohou navíc negativně ovlivňovat postižení plic. Postižení žaludku se může projevit gastroparézou a postižení anorektální oblasti zácpou. Jícnová impedance zlepšuje a rozšiřuje diagnostické možnosti klasické pHmetrie, jak v určování charakteru refluxátu (umožňuje detekovat i slabě kyselý a alkalický reflux; rozlišit vzduch, tekutinu či aerosol), tak i výšky jeho propagace (do oblasti nad horní jícnový svěrač). Na našem pracovišti používáme kombinované sondy vybavené 6 impedančními snímači a 1 antimonovým pH senzorem. Při klasické jícnové pH metrii/impedanci zavádíme sondu transnazálně do jícnu, k průkazu extraezofageálního refluxu umisťujeme sondu pod laryngoskopickou kontrolou tak, aby byl proximální impedanční senzor nad horním jícnovým svěračem. Sonda je připojena k datarekordéru a poučený pacient odchází domů. Zásadní je správná spolupráce pacienta založená na co nejpřesnější dokumentaci denního režimu (jídlo, poloha) a potíží. Po 24 hodinách jsou data stažena do počítače, upravena softwarem a hodnocena lékařem.
K diferenciální diagnostice poruch motility jícnu a anorektální oblasti můžeme použít vysokorozlišovací manometrii (high resolution manometry, HRM) – lze jí detekovat i některé poruchy motility jícnu typické pro systémové nemoci pojiva. K identifikaci poruch motility žaludku využíváme elektrogastrografii (EGG).
Postižení tenkého střeva vede k poruše peristaltiky, která je hlavním faktorem rozvoje bakteriálního přerůstání (small intestinal bacterial overgrowth – SIBO). SIBO lze neinvazivně diagnostikovat vodíkovým a metanovým dechovým testem. Vodík a metan jsou v lidském organismu produkovány pouze střevními bakteriemi. Podíl takto vyprodukovaných plynů se vstřebá do krevního oběhu a je ve stopovém množství vylučován plícemi. Obsah těchto plynů v alveolárním vzduchu tak koreluje s jejich střevní produkcí.
Na našem pracovišti používáme k odběru vzduchu na konci výdechu a k analýze výdeje vodíku a metanu zařízení Quintron – odběrový systém GaSampler a plynový chromatograf Microlyzer DP Plus. Pro správnost měření je klíčová příprava pacienta před vyšetřením (dieta, vyloučení antibiotik), správný odběr alveolárního vzduchu, nakládání s odebraným vzorkem a technika měření.
Podpořeno výzkumným projektem PRVOUK P37/08.
Postřehy z kongresu EULAR 2014 Paris, France 11.–14. June 2014
Korandová J
Revmatologický ústav, Praha
Kongres EULAR 2014 se letos tentokrát uskuteční v Paříži a zúčastní se ho posluchači z více než 120 zemí Evropy. Stejně jako v případě kongresů již uskutečněných, hlavním cílem pořadatelů je poskytnout posluchačům co nejvyšší úroveň informací týkajících se klinického i bazálního výzkumu v oblasti revmatologie. EULAR kongres však návštěvníkům nenabízí „pouze“ kvalitní odborný program. Neméně důležitou je i jeho role „společenská“ – EULAR kongres svým návštěvníkům poskytuje prostor pro vzájemná setkání, výměnu zkušeností a názorů, ale i prostor pro přípravu nových výzkumných projektů mezi zdravotníky a pacienty. Cílem zmíněných setkání a pracovních jednání je dosažení dalšího pokroku v oblasti klinické péče o pacienty s revmatickými chorobami.
EULAR kongresů jsem se zúčastňovala od roku 1995, nejprve v roli reprezentanta pacientů, členů Revma Ligy v ČR, posléze jsem se stala reprezentantkou českých nelékařů pracujících v oboru revmatologie (od roku 2001). Moje mise kongresem EULAR 2014 skončí. Téměř po 20 rocích aktivního působení v ČR i v EULAR mě vystřídá Bc. Hana Šmucrová, která bude dozajista vynikající nástupkyní.
Kvalita života u pacientů na biologické léčbě – dotazníky versus realita
Vondřičková K
Revmatologický ústav, Praha
Kvalita života je dána úrovní tělesné a duševní činnosti a pracovní výkonnosti a úrovní tělesné, duševní a sociální pohody. Přesto definovat kvalitu života je velmi nesnadné protože každý jedinec ji vnímá individuálně. Mezi revmatickými chorobami existují rozdíly v dopadu na život pacientů, všechny ale přinášejí bolesti, útrapy a existuje možnost funkčních poruch až invalidita. Přijetí těchto změn je psychicky náročné a může vyvolat deprese. Biologické léky rozhodným způsobem změnily osud pacientů, protože dokážou u větší části z nich zmírnit symptomy choroby a zpomalit či zastavit vývoj onemocnění. Předpokladem k dobré adaptaci na nemoc je informovanost a aktivní spolupráce pacienta. Pokud se to podaří, nemusí nemocný vnímat kvalitu svého života jako nedostatečnou.
Nástrojem k měření kvality života jsou dotazníky. Sdělení bude doplněno kazuistikou
Pohybová aktivita jako součást fyzioterapie u revmatických onemocnění
Zinková I
Revmatologický ústav, Praha
Pohybová aktivita (PA), v angl. physical activity, zahrnuje základní a plánovanou (stukturovanou) pohybovou aktivitu. Podle objemu vykonávaných pohybových aktivit v čase rozlišujeme účastníky pohybových aktivit na čtyři skupiny. Pacienti s revmatickým onemocněním se řadí do skupiny s minimální až nízkou úrovní pohybové aktivity. Poslední práce ukazují, že pohybové aktivity mohou mít pozitivní vliv na pacienty s revmatickým onemocněním. Zdravotní benefity pohybových aktivit (vliv na kardiovaskulární systém, na respirační systém, na muskuloskeletální systém) jsou základním předpokladem pro využití ve fyzioterapii (jako funkčně kondičního tréninku) pacientů s revmatickým onemocněním. Pohybové aktivity vhodné k doplnění terapie (např. u osteoporózy, systémové sklerodermie, ankylozující spondylitidy, event. sloužícími jako prevence např. u revmatoidní artritidy) se dělí na aerobní PA, rezistenční PA a balanční PA. Základním nesouladem v chápání doporučení pohybové aktivity, resp. funkčně kondičního tréninku, spočívá v názoru, že pohybová aktivita má mít za následek především snížení bolesti, event. zánětlivého procesu. Z pohledu pacienta i fyzioterapeuta jsou ale důležité i další cíle: zlepšení celkové fyzické kondice pacienta, zlepšení kognitivních funkcí, zlepšení funkčních schopností k vykonávání ADL, zlepšení rovnovážných schopností, zvýšení svalové síly, zlepšení flexibility a v neposlední řadě i prevence pádů. To vše za předpokladu, že funkčně kondiční trénink u daného pacienta nezvyšuje trvale bolest ani zánětlivý proces. V dostupných studiích, které se zabývají pohybovými aktivitami u revmatických pacientů, jsou využívány při vstupním a výstupním vyšetření např. tyto hodnotící parametry: svalová síla, funkce svalů (FI 2), rozsah pohybu, energetický výdej, hustota kostních minerálů, svalové enzymy, test chůze 6 min., dotazníky kvality života (HAQ, SF 36), Barthel Index (BI), Berg Balance Scale (BBS), Timed Up and Go (TUG), VAS stupnice bolesti nebo zánětlivé markery.
Spolupráce ruku v ruce
Šmucrová H, Vincová G
Revmatologický ústav, Praha
Vzájemná spolupráce fyzioterapeuta a ergoterapeuta je velmi důležitá pro zajištění komplexní léčebné rehabilitace pacientů s onemocněním drobných ručních kloubů. Ergoterapeutická a fyzioterapeutická intervence se v praxi osvědčila jako ideální kombinace nefarmakologické léčby těchto pacientů. Nefarmakologická léčba zaujímá vedle farmakologické léčby nezastupitelné místo ve smyslu prevence vzniku deformit, úlevy od bolesti a zlepšení nebo obnovy kvality života pacientů s revmatickým onemocněním.Onemocnění drobných ručních kloubů se častěji vyskytuje u žen. Vzniká následkem artrotických změn nebo na podkladě revmatických chorob. V důsledku onemocnění dochází k omezení hybnosti kloubů a vzniku deformit. To vede ke snížení až úplnému omezení funkční schopnosti rukou, zejména úchopové funkce. Proto zde je nutný zcela individuální přístup fyzioterapeuta i ergoterapeuta ke konkrétnímu pacientovi, kde je nutné respektovat jeho aktuální zdravotní stav. Cílem fyzioterapeutické i ergoterapeutické intervence je snížení projevů daného onemocnění. Snížení bolesti a udržení funkčního rozsahu postižených kloubů, zachování nebo zlepšení svalové síly horních končetin. Dále trénink jemné a hrubé motoriky. Toto vše je prováděno s dalším cílem umožnit pacientovi být v maximální možné míře soběstačným a nezávislým ve vykonávání všedních denních činností, pracovních i zájmových činností. Pacientovi jsou doporučeny vhodné kompenzační pomůcky, které mu usnadní provádění těchto úkonů. Je edukován v technikách zaměřených na ochranu kloubů a management únavy. Samotné cvičení s fyzioterapeutem a ergoterapeutem při rehabilitaci však nestačí. Proto je pacient následně edukován ve cvičeních, která může provádět v domácím prostředí. V praxi je tento fakt mnohdy opomíjen. Pacienti absolvují rehabilitaci, avšak doma nepokračují v dalším cvičení. Cílem tohoto sdělení je proto představit cvičení rukou, která lze pacientům nabídnout pro domácí využití.
Funkce ruky u systémové sklerodermie
Špiritović M, Stejskalová M
Revmatologický ústav, Praha
Kontraktury a deformity rukou jsou jedním z faktoru zdravotního postižení a snížené kvality zdraví související s životem u systémové sklerózy. Fyzioterapeutické postupy, ošetření rukou a různé pomůcky usnadňují práci a zvyšují kvalitu života pacientům trpícím systémovou sklerózou. Cílem přednášky je poukázat na možnosti, kterými si pacient může usnadnit práci pomocí různých pomůcek, též ochránit se při každodenní činnosti. Dále také ukázat na způsoby jak zvládat bolest a zvýšit rozsah pohybu, nezávisle na někom a s menšími obtížemi.
Skupinové cvičení a další vhodné pohybové aktivity pro pacienty s osteoporózou
Rathouská A
Revmatologický ústav, Praha
Osteoporóza je chronické metabolické onemocnění charakterizované sníženým množstvím a kvalitou kostní hmoty a v důsledku toho dochází ke zvýšenému riziku zlomenin. V důsledku těchto zlomenin pociťuje pacient bolest nejčastěji lokalizovanou v hrudní nebo bederní páteři. Svalová dysbalance zhoršuje stabilitu a zvětšuje sklon k pádům. Riziko pádu je podle nizozemské studie u lidí žijících doma nad 65 let až 40 % za rok, u lidí v ústavní péči je to až 70 %. Prevalence osteoporózy v posledních letech stoupá, může to být způsobeno zvyšováním průměrného věku obyvatelstva, ale i životním stylem, medikamentózní léčbou a v neposlední řadě také nedostatkem pohybu. Právě pravidelná pohybová aktivita a vliv gravitace jsou důležitými faktory pro růst kostní hmoty a remodelaci kostí, přispívá také k lepší účinnosti farmakoterapie. Doporučuje se spíše každodenní fyzická aktivita trvající alespoň 30 minut, než nepravidelné intenzivní cvičení. Mezi nejvhodnější pohybové aktivity se dá zařadit chůze (např. nordic walking), jízda na kole, různé formy aerobního cvičení nebo i tai-chi. Chanův výzkum z roku 2003 dokazuje, že u starších osob provozujících tai-chi, se snižuje riziko pádu o 47,5 %. Vzhledem k těmto velmi dobrým výsledkům by bylo vhodné zvážit možnost zavedení podobných typů cvičení i do rehabilitační praxe i u nás.
Kromě individuální terapie si velkou oblibu mezi pacienty získalo skupinové cvičení. Skupinové cvičení má pro pacienta význam somatický i psychologický, protože skupina osob se stejnou diagnózou může pacienta pozitivně naladit a vede i k většímu zájmu o cvičení a k soutěživosti. V Revmatologickém ústavu cvičení probíhá pod vedením zkušeného fyzioterapeuta v malých skupinkách dvakrát týdně. Cvičební jednotka trvá 55 minut a bude podrobněji popsána v přednášce. Skládá se ze čtyřicetiminutového cvičení v tělocvičně a z mechanoterapie. Při cvičení využíváme zejména strategii cvičení proti odporu, která je podle mnohých výzkumů označována za nejvhodnější a zvyšuje BMD (Kerr a kol.) Bě-hem cvičení se snažíme zmírnit nebo odstranit svalové dysbalance a zlepšit rovnováhu pacienta, posilujeme svalový korzet z důvodu prevence dalších kontraktur a upravujeme pohybové stereotypy.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2014 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
Najčítanejšie v tomto čísle- Belimumab v terapii systémového lupus erythematodes a v dalších indikacích
- 58. výroční sjezd českých a slovenských revmatologů
- Faktory ovlivňující účinnost anti-TNF terapie v klinické praxi: zkušenosti z národního registru ATTRA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



